Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Funktionelle Beurteilung der intestinalen Tight-Junction-Barriere und der Ionenpermeabilität im heimischen Gewebe durch Ussing-Chamber-Technik
In diesem Artikel
Zusammenfassung
Das Darmepithel verleiht nicht nur Nährstoffaufnahme, sondern auch Schutz vor schädlichen Substanzen. Die apikal-epithelste interzelluläre Verbindung, d. h. die Tight Junction, reguliert die parazelluläre Durchlässigkeit von gelösten Stoffen und Ionen. Hier wird ein Protokoll zur Herstellung von Schleimhautblättern und zur Beurteilung der Ionenselektivität von Tight Junctions mittels Ussing-Kammertechnik beschrieben.
Zusammenfassung
Die Ussing-Kammertechnik wurde erstmals 1951 vom dänischen Wissenschaftler Hans Ussing erfunden, um den transzellulären Transport von Natrium über die Froschhaut zu untersuchen. Seitdem wurde diese Technik auf viele verschiedene Gewebe angewendet, um die physiologischen Parameter des Transports über Membranen hinweg zu untersuchen. Die Ussing-Kammermethode ist anderen Methoden vorzuziehen, da natives Gewebe verwendet werden kann, wodurch es besser auf das anwendbar ist, was in vivo geschieht. Da jedoch natives Gewebe verwendet wird, ist der Durchsatz gering, die Zeit ist begrenzt und die Gewebevorbereitung erfordert Geschick und Training. Diese Kammern wurden verwendet, um spezifische Transporterproteine in verschiedenen Geweben zu untersuchen, Krankheitspathophysiologie wie bei Mukoviszidose zu verstehen, den Transport und die Aufnahme von Medikamenten zu untersuchen und insbesondere zum Verständnis des Nährstofftransports im Darm beizutragen. Angesichts des gesamten epithelialen Transportprozesses eines Gewebes sind nicht nur transepitheliale Bahnen, sondern auch parazelluläre Wege wichtig. Tight Junctions sind eine Schlüsseldeterminante der gewebespezifischen parazellulären Permeabilität im Darm. In diesem Artikel wird die Ussing-Kammertechnik verwendet, um die parazelluläre Permselektivität von Ionen durch Messung der transepithelialen Leitfähigkeit und der Verdünnungspotentiale zu bewerten.
Einleitung
Die Ussing-Kammermethode wurde erstmals von dem dänischen Wissenschaftler Hans Ussing entwickelt. Ussing verwendete es zunächst, um den Kurzschlussstrom des Natriumtransports über die Froschhaut zu messen, nachdem beobachtet wurde, dass NaCl gegen einen steilen Konzentrationsgradienten über die Haut transportiert werden konnte1. Sein System bestand aus der Froschhaut, die zwischen zwei Kammern mit Zugang zu beiden Seiten der Haut montiert war. Jede Kammer enthielt Ringer-Lösung, die zirkuliert und belüftet wurde. Zwei schmale Agar-Ringer-Brücken, die sich in der Nähe der Haut befinden und mit gesättigten KCl-Kalomel-Elektroden verbunden sind, messen die Potentialdifferenz, wie sie von einem Potentiator abgelesen wird. Ein zweites Paar Agarringerbrücken befand sich am gegenüberliegenden Ende jeder Kammer, die mit Bechergläsern mit gesättigtem KCl verbunden waren, das mit AgCl gesättigt war, um eine elektromotorische Kraft auszuüben, die von einer Batterie bereitgestellt wurde. Ein Potentialteiler wurde verwendet, um die Spannung so einzustellen, dass die Potentialdifferenz über die Haut Null blieb, wodurch Kurzschlussbedingungen erzeugt wurden. Ein Mikroamperemeter wurde ebenfalls angeschlossen, um den Strom abzulesen, der durch die Haut fließt (siehe die Abbildung in Ref.1 für das ursprüngliche Kammerdesign).
In den letzten 70 Jahren wurde diese Technik auf viele verschiedene Gewebe, insbesondere auf Darmgewebe, angewendet, um den Nährstoff- und Ionentransport zu untersuchen. Zum Beispiel wurde der Mechanismus des Cholera-induzierten Durchfalls untersucht, indem Kaninchenileum in diesen Kammern montiert wurde, und es wurde festgestellt, dass Choleratoxin-induzierter Durchfall durch cAMP2 vermittelt wird. Darüber hinaus wurden diese Kammern auch verwendet, um den Mechanismus zu untersuchen, der dem Glukosetransport über Na+-Glukose-Cotransporter 1 (SGLT1)3 zugrunde liegt. Unser Labor konzentriert sich auf den transzellulären und parazellulären Transport in Darmepithelzellen. Mit der Ussing-Kammermethode wurde der Peptidtransport in Claudin-15-Knockout-Mäusen untersucht, die den parazellulären Natriumtransport beeinträchtigt haben, wobei Ussing-Kammern verwendet wurden, um die Absorption des nicht hydrolysierbaren Dipeptids Glycylsarcosin zu messen. Es wurde festgestellt, dass die luminale Na+ -Homöostase für den Protonen-gekoppelten Peptidtransport wichtig ist4. Darüber hinaus wurden diese Kammern auch verwendet, um die Anionensekretion im murinen Blinddarm als Reaktion auf die submuköse Aktivierung des Proteinase-aktivierten Rezeptors 1 durch die Serinprotease Trypsin5 zu untersuchen.
Ussing-Kammern wurden kürzlich auch verwendet, um die parazellulären Bahnen im Epithelgewebe zu beurteilen. Parazelluläre Signalwege werden durch Tight Junctions reguliert, bei denen es sich um Proteinkomplexe handelt, die sich an dem Punkt bilden, an dem sich zwei oder mehr Zellen treffen6. Die Barrierefunktion und die Ionenselektivität (ob Anionen oder Kationen selektiv in der Lage sind, die Tight Junction zu passieren) wird durch das Vorhandensein von Proteinen der Claudin-Familie bestimmt; Einige davon wirken als Barrieren (Claudin 3 und 7), Anionenporen (Claudin 10A) oder Kationenporen (Claudin 2, 10B und 15)7. Andere Methoden wurden verwendet, um den parazellulären Signalweg zu beurteilen, wie z. B. die orale Gavage von FITC, begleitet von einer FITC-Konzentration im Blutplasma8 oder EDTA-Cr9; Diese Techniken sind jedoch von geringerer Auflösung und können die Ionenselektivität oder einen bestimmten Abschnitt der Abschnitte des Darmtraktes nicht beurteilen. Ussingkammern können jedoch verwendet werden, um das Verdünnungspotential von Zielionen zu bewerten und somit die Ionenselektivität der Dichtstellen zu bestimmen. Zum Beispiel kann mit NaCl die Selektivität der Engstellen für Na+ und Cl- berechnet werden, indem eine Seite der Membran (normalerweise die Schleimhautseite) verdünnt und die Änderung der transepithelialen Potentialdifferenz gemessen wird. Die relativen Permeabilitäten von Na+ und Cl- können durch die Goldman-Hodgkin-Katz-Gleichung10 und die Selektivität der Tight Junction mit der Kimizuka-Koketsu-Gleichung11 geschätzt werden. Diese Kammern haben daher den Vorteil, die elektrophysiologischen Parameter des Gewebes zu messen und liefern dadurch mehr Informationen über den Durchgang von Ionen durch die Engstellen als andere Methoden mit niedrigerer Auflösung.
Die Ussing-Kammer-Methode ist nicht nur auf den Darmtrakt beschränkt, obwohl sie in Studien über den Darm weit verbreitet ist, hat sie auch viele andere Anwendungen. Zum Beispiel wurden diese Kammern verwendet, um Mukoviszidose und insbesondere den Chloridkanal-Mukoviszidose-Transmembran-Leitwertregulator (CFTR) zu untersuchen12. Mukoviszidose wird durch eine Mutation in CFTR13 verursacht, die zu einer gestörten Chloridsekretion und einem gestörten Flüssigkeitstransport durch respiratorische Epithelzellen und einer daraus resultierenden dickeren, trockeneren Schleimschicht führt14. Die Untersuchung der epithelischen CFTR der Atemwege wurde mit diesen Kammern durchgeführt, um nicht nur die Krankheit zu verstehen, sondern auch Wege zur Behandlung der Krankheit zu finden. Zum Beispiel wurde bei Patienten mit seltenen Mutationen, die Mukoviszidose verursachen, die Analyse von respiratorischen Epithelzellen von Patienten verwendet, um Therapien wie Orkambi und eine Verstärker-Kotherapie zu testen15.
Ussing-Kammern wurden auch verwendet, um die Wege der Arzneimittelabgabe zu untersuchen, z. B. mit menschlichem Biopsiegewebe, um die Arzneimittelaufnahme und Pharmakokinetik zu untersuchen16. Die Darmaufnahme ist nicht der einzige Weg der Medikamentenabgabe. Diese Kammern wurden auch verwendet, um nasale Arzneimittelabgabesysteme zu untersuchen17. Studien zur Arzneimittelabgabe mit Ussing-Kammern wurden auch für das Auge durchgeführt. In der Hornhaut des Kaninchens wurden Permeabilitäts- und Aufnahmestudien mit Labrasol durchgeführt, einem Medikament, das die Absorption von Medikamenten über Gewebe hinweg erhöhen soll18. Eine weitere Studie untersuchte die Wirkung von Benzylalkoniumchlorid auf die transsklerale Arzneimittelabgabe im Kaninchen Sklera19.
Die Ussing-Kammermethode ist nützlich, da natives Gewebe verwendet werden kann. Als solches ist es gegenüber In-vitro-Modellen wie Caco-2-Zelllinien vorzuziehen. Die Technik erfordert jedoch Geschick und Zeit, um Proben vorzubereiten, so dass sie nicht für Anwendungen mit hohem Durchsatz geeignet ist. Die elektrophysiologischen Eigenschaften von Zellmonoschichten können mit Hilfe von Zellkultureinsätzen in diesen Kammern untersucht werden. Jüngste Entdeckungen haben die Kultur von Organoiden ermöglicht, bei denen es sich um Mini-Organe handelt, die in Kultur aus der Ernte epithelialer oder endothelialer Stammzellen gezüchtet wurden20. Organoidkulturen können manipuliert werden, um in einer Monoschicht gezüchtet zu werden, wodurch es möglich wird, Organoide in einer Ussing-Kammer zu montieren21. Organoide verschiedener Epithel- und Endothelgewebe können untersucht werden, wodurch die Anzahl der benötigten Tiere verringert wird, da die Organoidkultur langfristig aufrechterhalten werden kann. Dies erhöht auch den Durchsatz, da zeitaufwendige und mühsame Gewebedissektions- und Präparationsschritte nicht erforderlich sind. Auch in Zukunft werden die Ussing-Kammerstudien für die Untersuchung des Gewebetransports sehr nützlich sein und im Bereich der personalisierten Medizin besonders wichtig sein.
Das folgende Protokoll demonstriert die Anwendung der Ussing-Kammermethode zur Beurteilung der Permselektivität und Barrierefunktion der Tight-Junctions im Dünndarm von Claudin-15-Knockout-Mäusen (Cldn15-/-) und Wildtyp-Kontrollen (WT) durch Messung des Verdünnungspotenzials von NaCl. Tight Junctions (TJ) werden an der Stelle gebildet, an der sich zwei oder mehr Zellen im Epithel- und Endothelgewebe treffen. Es wird angenommen, dass bizelluläre Tight Junctions (bTJ), insbesondere die Proteine der Claudin-Familie, die im bTJ vorkommen, die Barrierefunktion und Permselektivität von TJ7 bestimmen. Cldn15-/- Mäuse haben einen Mega-Dünndarm22 und eine reduzierte Nährstoffaufnahmefähigkeit aufgrund des Verlustes des intestinalen Na + -Recyclings, der über Claudin 154,23,24 auftritt. Cldn15-/- Mäuse haben eine beeinträchtigte Na+-Homöostase, was sie zu einem interessanten Modell für die Untersuchung der Permselektivität des TJ macht. Das folgende Protokoll bewertet die Permeabilität des TJ gegenüber NaCl durch Messung des Verdünnungspotentials von NaCl (PNa/PCl) im mittleren Dünndarm. Kurz gesagt, die Änderung der Membranpotentialdifferenz, die durch Verdünnung einer Seite der Membran (M-Seite oder S-Seite, beide werden im folgenden Protokoll gemessen) auftritt, kann verwendet werden, um die Permeabilität von Na + (PNa) und Cl- (PCl) zu berechnen, und das Verdünnungspotential (PNa / PCl) wird zeigen, ob die Tight Junction eine kationische oder anionische Selektivität aufweist.
Die Experimente in diesem Protokoll wurden mit einer kundenspezifischen Ussing-Kammer (Abbildung 1A) durchgeführt, die aus zwei Hälften besteht, zwischen denen die Darmvorbereitung vertikal montiert ist, Spannungsklemmverstärker, elektrischer Rekorder, Elektroden, Salzbrücken, Ringer-Lösung, HEPES-Puffer (150 mM NaCl), verdünnter HEPES-Puffer (75 mM NaCl), Darmvorbereitung (für Details über die Ausrüstung siehe die Tabelle der Materialien).
Protokoll
Alle Tiere, die in diesen Experimenten verwendet wurden, wurden in der Tierpflegeeinrichtung der Universität von Shizuoka untergebracht und die Experimente wurden gemäß den Richtlinien für Tierversuche der Universität Shizuoka durchgeführt. Alle Experimente wurden mit Genehmigung des Animal Care and Use Committee an der University of Shizuoka (Genehmigungen # 205272 und # 656-2303) durchgeführt.
1. Herstellung von NaCl-Elektroden
HINWEIS: Die in diesen Experimenten verwendeten Elektroden bestehen aus konzentriertem NaCl oder KCl. Die KCl/Calomel-Elektroden werden kommerziell eingekauft. Stellen Sie vor Beginn des Experiments sicher, dass alle Elektroden bis oben mit konzentrierter NaCl- oder KCl-Lösung gefüllt sind.
- Bereiten Sie kleine Gläser mit Kunststoffdeckeln (Volumen 20 ml) vor.
- Bohren Sie zwei Löcher in die Kunststoffdeckel, eines für die NaCl-Salzbrücke (2,5 mm Durchmesser) und das andere für Silberdraht (1 mm Durchmesser; Abbildung 1C, NaCl-Elektrode).
- Füllen Sie das Glas mit gesättigter NaCl-Lösung (ca. 15 ml, bis voll).
- Führen Sie Silberdraht (0,8 mm Durchmesser, 7 cm lang) in das Glas ein, stellen Sie jedoch sicher, dass der Drahtabschnitt außerhalb des Glases über Kroktorclips (kleine Größe) mit dem Verstärkersystem verbunden werden kann.
- Wenn Sie nicht in Gebrauch sind, wickeln Sie die Elektroden ein und stellen Sie sicher, dass die Löcher mit Parafilm bedeckt sind, um ein Austrocknen zu verhindern.
2. Vorbereitung von Salzbrücken
HINWEIS: Bereiten Sie Salzbrücken mindestens einen Tag vor dem Experiment vor, um ausreichend Zeit zum Verfestigen zu haben. Salzbrücken können wiederholt verwendet werden, aber die Verwendung nach 2 Monaten wird nicht empfohlen.
- NaCl Salzbrücken
- Bereiten Sie #7 Polyethylschläuche (Außendurchmesser 2,3 mm, Innendurchmesser 1,3 mm), 19 G Nadel- und Schlossspritze, 200 ml 1 M NaCl-Lösung, 2 g Agar, verschließbarer Kunststoffbehälter für die Salzbrückenlagerung vor.
- Bereiten Sie eine angemessene Anzahl von Salzbrücken vor, indem Sie die Schläuche auf die für die Einrichtung der Ussing-Kammer erforderliche Größe schneiden (jede Kammer benötigt zwei Salzbrücken).
- Machen Sie vor dem Einspritzen von Agar eine U-Form mit den Röhrchen und legen Sie sie in ein Becherglas mit warmem Wasser (um eine einfache Form für die Einrichtung von Salzbrücken zu schaffen).
- Machen Sie 200 ml 1 M NaCl, indem Sie 11,688 g NaCl in 200 ml in entionisiertem Wasser auflösen.
- 1 M NaCl in 100 mL Portionen aufteilen: 100 ml 2% Agar in 1 M NaCl herstellen (2 g Agar in NaCl mischen, in der Mikrowelle erhitzen, um sich aufzulösen).
- Füllen Sie die Spritze mit einer 19 G NaCl/Agar-Lösung mit einer 19 G NaCl/Agar-Lösung. Beginnen Sie vorsichtig, die Lösung tropfenweise auszustoßen, und führen Sie dabei die Nadel in ein Ende des Röhrchens ein und füllen Sie, bis die Mischung von der anderen Seite austritt.
- Ziehen Sie die Nadel langsam zurück, während Sie die Lösung noch ausdrücken, und wiederholen Sie den Vorgang, bis alle erforderlichen Salzbrücken hergestellt sind. (Wenn die Lösung in der Spritze oder Nadel erstarrt, erwärmen Sie sie kurz in heißem Wasser, bis die Lösung wieder ausgedrückt werden kann.)
- Überprüfen Sie die Salzbrücken, um sicherzustellen, dass keine Blasen vorhanden sind, und lagern Sie sie in der verbleibenden 1 M NaCl-Lösung in einem verschließbaren Behälter.
- KCl Salzbrücken
HINWEIS: Für die KCl-Agarbrücken werden dünnere Schläuche verwendet, um den Anstieg der K + - Konzentration im Puffer zu vermeiden, da sich die Salzbrückenspitzen auflösen können und K + in den Puffer austreten kann.- Bereiten Sie #3 Polyethylschläuche (Außendurchmesser 1,0 mm, Innendurchmesser 0,5 mm), 23 G Nadel- und Schlossspritze, 200 ml 1 M KCl-Lösung, 2 g Agar, verschließbarer Kunststoffbehälter für die Salzbrückenlagerung vor.
- Bereiten Sie eine angemessene Anzahl von Salzbrücken vor, indem Sie den Schlauch auf die Größe schneiden, die für die Einrichtung der Ussing-Kammer erforderlich ist (jede Kammer benötigt zwei Salzbrücken).
- Machen Sie 200 ml von 1 M KCl, indem Sie 14,91 g KCl in 200 ml deionisiertem Wasser auflösen.
- In zwei 100-ml-Portionen aufteilen: Machen Sie 100 ml 2% Agar in 1 M KCl (mischen Sie 2 g Agar in KCl, erhitzen Sie in einer Mikrowelle, um sich aufzulösen).
- Injizieren Sie mit einer 23 G Nadel und einer Verriegelungsspritze Schlauch mit 2% Agar 1 M KCl-Mischung (stellen Sie sicher, dass die Röhrchen vollständig gefüllt sind und keine Blasen vorhanden sind) auf die gleiche Weise wie bei den NaCl-Salzbrücken.
- Überprüfen Sie die Salzbrücken, um sicherzustellen, dass keine Blasen vorhanden sind, und lagern Sie sie in der verbleibenden 1 M KCl-Lösung in einem verschließbaren Behälter.
3. Vorbereitung der Ringer-Lösung und des HEPES-Puffers
HINWEIS: Abhängig von dem in der Ussing-Kammer montierten Gewebe können sich die Komponenten der Ringer-Lösung unterscheiden. Die hier vorgestellten Rezepte sind spezifisch für den Dünn- und Dickdarm.
- Machen Sie die Lösung von Ringer am Tag der Versuche frisch, wie in Tabelle 1 beschrieben.
- Blasen Sie die Lösung mit 95% O2/5% CO2, um dem Gewebe O2 und eine Pufferkapazität zuzuführen.
| Ringer-Lösung (Dünndarm) | Ringerlösung (Dickdarm) |
| NaHCO3 – 21,0 mM | NaHCO3 – 21,0 mM |
| K2HPO4 – 2,4 mM | K2HPO4 – 2,4 mM |
| KH2PO4 – 0,6 mM | KH2PO4 – 0,6 mM |
| NaCl – 119,0 mM | NaCl – 119,0 mM |
| MgCl2 – 1,2 mM | MgCl2 – 1,2 mM |
| CaCl2 – 1,2 mM | CaCl2 – 1,2 mM |
| Indomethacin – 10 μM (1 mM Vorrat in 21 mM NaHCO3 herstellen, 10 mL Stamm für 1 L Ringer-Lösung hinzufügen) | Indomethacin – 10 μM (1 mM Vorrat in 21 mM NaHCO3 herstellen, 10 mL Stamm für 1 L Ringer-Lösung hinzufügen) |
| 1 mM Glutamin (0,146 g/L) | 10 mM Glukose |
Tabelle 1: Rezept für Ringer's Solution Um die Lösung von Ringer herzustellen, mischen Sie alle Komponenten zusammen mit deionisiertem Wasser. Die Lösung von Ringer wird am besten vor Experimenten frisch hergestellt. Bis zum Gebrauch im Kühlschrank oder auf Eis aufbewahren. Vor der Verwendung Gas mit 95% O2/5% CO2.
- Machen Sie HEPES am Tag des Experiments frisch, wie in Tabelle 2 beschrieben, indem Sie die Zutaten in deionisiertem Wasser mischen.
- Stellen Sie sich erst nach der pH-Einstellung auf das endgültige Puffervolumen ein.
- Erwärmen Sie den HEPES-Puffer auf 37 °C und stellen Sie den pH-Wert auf 7,4 ein, indem Sie unter Rühren langsam Tropfen von 1 M Tris-Lösung hinzufügen.
- Passen Sie sich dem endgültigen Volumen an, indem Sie die entsprechende Menge an deionisiertem Wasser hinzufügen.
| HEPES-Puffer | Verdünnungs-HEPES-Puffer |
| HEPES – 10 mM | HEPES – 10 mM |
| Glukose – 10 mM (Dickdarm) | Glukose – 10 mM (Dickdarm) |
| 1 mM Glutamin (0,146 g/L) (Dünndarm) | 1 mM Glutamin (0,146 g/L) (Dünndarm) |
| NaCl – 150 mM | NaCl – 75 mM + 150 mM Mannitol (zur Anpassung an Osmolalitätsunterschiede) |
| MgCl2 – 1 mM | MgCl2 – 1 mM |
| CaCl2 – 2 mM | CaCl2 – 2 mM |
| Indomethacin – 10 μM (1 mM Vorrat in 21 mM NaHCO3 herstellen, 10 mL Vorrat für 1 L Ringer's Solution hinzufügen) | Indomethacin – 10 μM (1 mM Vorrat in 21 mM NaHCO3 herstellen, 10 mL Vorrat für 1 L Ringer's Solution hinzufügen) |
| Stellen Sie den pH-Wert von 7,40 (37 ° C) mit 1 Mio. Tris ein | |
Tabelle 2: HEPES-Pufferrezept Um HEPES-Puffer und Verdünnungs-HEPES-Puffer herzustellen, lösen Sie alle Inhaltsstoffe in deionisiertem Wasser auf. Lösungen müssen mit 1 M Tris-Lösung pH-eingestellt werden, fügen Sie daher nicht das volle Volumen Wasser hinzu (z. B. lösen Sie bei der Herstellung von 1 L alle Zutaten in etwa 800 ml Wasser auf). Dann erhitzen Sie die Lösung auf 37 ° C, stellen Sie den pH-Wert auf 7,4 und stellen Sie dann das endgültige Volumen ein.
4. Einrichtung der Ussing-Kammer
HINWEIS: Die in diesem Protokoll verwendeten Ussing-Kammern sind maßgeschneiderte kontinuierliche Perfusionskammern. Zur Beurteilung der Darmbarrierefunktion der Maus oder der Nährstoffaufnahme werden Kammern mit einer Öffnung von 4 oder 5 mm Durchmesser empfohlen25 (Abbildung 1A-C).
- Um den Kanteneffekt26 zu reduzieren und die Kammern besser abzudichten, befestigen Sie vor dem Aufstellen 4 oder 5 mm gestanzte Paraffinfolie (ca. 4 cm2) (Abbildung 1B).
- Aufgestellt im offenen Kreislauf zur Verdünnungspotentialmessung. Im aktuellen Klemmmodus eingestellt. Stellen Sie den Ausgang als Strom ein und stellen Sie den Stromimpuls auf ±20 μA ein.
- Beim Einstellen unter Kurzschlussbedingungen zur Messung von Kurzschlussstrom und Transmukosalwiderstand in den Spannungsklemmmodus eingestellt. Stellen Sie den Ausgang als Spannung ein und stellen Sie den Spannungsimpuls auf ±5 mV ein.
- Stellen Sie sicher, dass 37 °C Wasser im Wassermantel zirkuliert.
- Füllen Sie jede Kammer mit Ringer-Lösung oder HEPES-Puffer (Menge hängt vom verwendeten System ab, die hier verwendeten Kammern benötigen 5 ml für jede Seite) und stellen Sie sicher, dass keine Lecks vorhanden sind.
- Verbinden Sie Salzbrücken und Elektroden.
- Stellen Sie sicher, dass die Spannung 0 und stabil ist, Impulsstrom, um sicherzustellen, dass Salzbrücken und Elektroden ordnungsgemäß eingerichtet sind.
- Lassen Sie die Temperatur der System- und Ringerlösung für mindestens 20 min ausgleichen.
- Korrigieren Sie nach dem Ausgleich die asymmetrische Spannungsdifferenz zwischen den KCl-Elektroden und kompensieren Sie den Flüssigkeitswiderstand, indem Sie ihn auf Null ändern (siehe Handbuch für das Ussing-Kammersystem, das zur Bestimmung des richtigen Weges verwendet wird).
5. Dissektion von Darmgewebe
HINWEIS: Alle Tierversuche müssen innerhalb der vom Land und der Universität festgelegten Vorschriften durchgeführt werden.
- Vor der Einnahme des Darmgewebes frische, eiskalte Ringer-Lösung zubereiten und mit 95% O2 und 5% CO2 für 15 min blasen (Schritt 3).
- Anästhesien von Mäusen gemäß den Richtlinien für den Einsatz von Tieren in der Forschung. Für dieses Experiment wurden Mäuse mit 2% -3% Isofluran betäubt, das von einem Anästhesisten verabreicht wurde. Überprüfen Sie die richtige Anästhesie, indem Sie die Zehen kneifen und sicherstellen, dass keine Schmerzreaktion auftritt.
- Machen Sie einen Schnitt in den Bauch mit einer Schere vom Becken bis zum Zwerchfell; Suchen Sie den Magen und schneiden Sie das Pylorusende des Magens ab.
- Greifen Sie den am Dünndarm befestigten Magenteil mit einer Pinzette und ziehen Sie vorsichtig den Dünndarm, während Sie die mesenterialen Anhänge abschneiden. Achten Sie darauf, das Darmgewebe in keiner Weise zu schneiden oder zu schädigen.
- Fahren Sie fort, den Darm bis zum Anus zu sezieren. Für die vollständige Entfernung des Dickdarms schneiden Sie die Beckenknochen ab, um den distalen Teil des Dickdarms freizulegen, und entfernen Sie vorsichtig den Rest des Darms, indem Sie die Anhaftungen abschneiden.
- Messen Sie die Länge des Darms und teilen Sie in gewünschte Segmente. Teilen Sie für dieses Experiment den Dünndarm in drei Segmente auf und verwenden Sie das mittlere Segment.
- Legen Sie die gewünschten Segmente in eiskalte, sprudelnde Ringer-Lösung; Öffnen Sie dann jedes Segment in Längsrichtung, indem Sie entlang der mesenterialen Anhänge schneiden. Fett und Bindegewebe abschneiden.
- Geben Sie die Segmente in die eiskalte Ringerlösung zurück und waschen Sie sie gründlich (selbst in der eiskalten Lösung ist die Sauerstoffversorgung des luminalen Epithels wichtig, um die Epithelfunktion aufrechtzuerhalten).
6. Abbau der Muskelschicht und Vorbereitung des Darmblattes
HINWEIS: Die Entfernung der Serosa (Muskelschicht) ist wichtig für Transportstudien mit dem Darm. Wenn die Serosa verbleibt, kann das Darmgewebe zufälligen Muskelkontraktionen ausgesetzt sein, die die elektrophysiologischen Daten verzerren, und der Transport kann gehemmt werden. Ungestreiftes Gewebe verschlechtert sich schnell, wenn es in Ussing-Kammern montiert wird, da die Serosa eine signifikante Diffusionsbarriere für Substrat und Sauerstoff darstellt. In einigen besonderen Fällen kann es notwendig sein, die Muskelschicht beizubehalten, so dass die Entscheidung beim Forscher und dem experimentellen Design liegt. Die Darmschichten können auf zwei Arten vorbereitet werden, je nachdem, welche Schicht entfernt wird (Abbildung 2). Für dieses Experiment werden Schleimhaut- und submuköse Präparate benötigt (Abbildung 2, 2. Panel).
- Bereiten Sie Dissektionsplatten (10 cm Durchmesser) vor, die mit Silikonkautschuk, Stiften (kleine Akupunkturnadeln), 5 mm gestanztem Filterpapier und Parafilmquadraten (2 cm x 2 cm; für andere Systeme möglicherweise nicht erforderlich) bedeckt sind.
- Gießen Sie frische, eiskalte, gesprudelte Ringer-Lösung in die Dissektionsplatte (genug, um das Gewebe zu bedecken, ca. 2-3 ml).
- Heften Sie unter einem Stereomikroskop die Enden des Darmgewebes (Schleimhautseite nach unten) ab.
- Mit einer feinen Pinzette die Muskelschicht von der darunter liegenden Schleimhaut stumpf sezieren.
- Achten Sie darauf, keine Löcher in das Gewebe zu reißen oder einzuführen.
- Sobald die Muskelschicht entfernt ist, schneiden Sie ein Stück groß genug für eine Öffnung mit einem Durchmesser von 5 mm. Bei der Vorbereitung des Dünndarms sollte die Entfernung der Serosa-Muskelschicht innerhalb von 10 Minuten erfolgen, da die luminale Sauerstoffversorgung unter diesen Bedingungen schwierig ist.
- Nasses 5 mm gestanztes Filterpapier quadratisch in Ringer-Lösung und das Darmgewebe mit Schleimhautseite nach unten darauf legen, da sich submuköse Präparate spontan mit der Schleimhautseite außen umwickeln.
- Stellen Sie sicher, dass die Öffnung vollständig vom Darmgewebe bedeckt ist und keine Falten vorhanden sind. Verwenden Sie eine schwarze Tafel unter der Vorbereitung, um zu prüfen, ob die Öffnung vollständig bedeckt ist.
- Wiederholen Sie diesen Vorgang für die erforderliche Anzahl von Schleimhautpräparaten (in diesem Experiment sind zwei Präparate erforderlich: Ein Präparat wird verwendet, um das Verdünnungspotenzial zu messen, und das andere wird verwendet, um elektrische Basisparameter zu messen).
7. Montage von Darmpräparaten in Ussing-Kammern
HINWEIS: Die Einrichtung hängt von der Art des verwendeten Ussing-Kammersystems und des verwendeten Aufzeichnungssystems ab.
- Saugen Sie Ringer's Solution/HEPES-Puffer aus der Ussing-Kammer ab.
- Zerlegen Sie die Ussing-Kammer und legen Sie das Filterpapier mit der Darmpräparationsschleimhautseite nach unten auf die Schleimhautseitenkammer und stellen Sie sie so ein, dass das Fenster der Kammer mit dem Loch des Filterpapiers übereinstimmt (Abbildung 1A, schwarze Markierung um das Kammerfenster ist nützlich für die Ausrichtung der Präparate).
- Legen Sie die Serosa-Seitenkammer vorsichtig auf die Schleimhaut-Seitenkammer und schließen Sie sie fest, aber stellen Sie sicher, dass sich die Darmschicht während der Verbindung nicht bewegt hat.
- Füllen Sie beide Kammern schnell mit Ringer-Lösung oder HEPES-Puffer auf und platzieren Sie sprudelnde Stäbe (Ringer-Lösung: 95% O2/5% CO2; HEPES-Puffer: 100% O2) am gegenüberliegenden Ende der Kammern, weg von der Membran (zu nahe an der Zubereitung zu sprudeln, könnte sich auf die Messungen auswirken).
- Schließen Sie die Salzbrücken wieder an und überprüfen Sie, ob die Spannung stabil und der Impulsstrom stabil sind, um sicherzustellen, dass die Verbindungen in Ordnung sind (Abbildung 1C).
- Wiederholen Sie dies für jede Darmvorbereitung.
- Lassen Sie das System für ca. 15 min ausgleichen. Wenn Sie ein Aufzeichnungssystem verwenden, lassen Sie den Leitwert und die Isc / Membran-Potentialdifferenz stabilisieren, bevor Sie mit den Experimenten beginnen.
8. Verdünnungspotentialexperiment (Öffnerbedingungen)
- Waschen Sie beide Seiten der Kammer, indem Sie den HEPES-Puffer absaugen und jeder Seite 5 ml frischen, vorerwärmten HEPES-Puffer hinzufügen.
- Schalten Sie das Aufnahmesystem ein. Stellen Sie den Bereich auf 250 mV ein (das hier verwendete System verstärkt die Ausgangsspannung um 10x), setzen Sie die Markerpositionen ein und stellen Sie das Aufnahmesystem auf Maß ein.
- Schalten Sie die Ussing-Kammersysteme in den Klemmmodus und beginnen Sie mit der Messung. Sobald sich das Membranpotential stabilisiert hat (~15-20 min), kann die Bewertung beginnen.
- Saugen Sie den HEPES-Puffer von der Schleimhautseite ab und ersetzen Sie ihn schnell durch 5 ml erwärmten Verdünnungs-HEPES-Puffer mit 75 mM NaCl.
- Sobald das Membranpotential seinen Höhepunkt erreicht hat (5-10 min), entfernen Sie den Verdünnungspuffer von der "Mucosal" -Seite und ersetzen Sie ihn durch HEPES-Puffer.
- Falls erforderlich, wiederholen Sie Schritt 3 für die Serosalseite und fügen Sie der Serosalseite einen Verdünnungs-HEPES-Puffer hinzu.
- Um sicherzustellen, dass das Gewebe lebensfähig ist, fügen Sie den Adenylatcyclase-Aktivator Forskolin (Endkonzentration 10 μM) auf der Serosa-Seite hinzu.
- Sobald die Membranpotentialdifferenz einen Höhepunkt erreicht hat und zu sinken begonnen hat, ist das Experiment vorbei.
9. Messung der transepithelialen elektrischen Leitfähigkeit und des Basis-Isc (Kurzschlussbedingungen)
- Waschen Sie beide Seiten der Kammer, indem Sie die Lösung des Ringers absaugen und 5 ml frische geblasene Ringerlösung auf jede Seite geben.
- Schalten Sie das Aufnahmesystem ein. Stellen Sie den Bereich auf 2,5 V ein (das hier verwendete System verstärkt die Ausgangsspannung um das 10-fache), stellen Sie die Markerpositionen ein und stellen Sie das Aufnahmesystem auf Maß ein.
- Schalten Sie die Ussing-Kammersysteme in den Klemmmodus und beginnen Sie mit der Messung. Sobald sich Isc und Leitwert stabilisiert haben (~15-20 min), können Baseline-Messungen erhalten werden.
- Um sicherzustellen, dass das Gewebe lebensfähig ist, fügen Sie den Adenylatcyclase-Aktivator Forskolin (Endkonzentration 10 μM) auf der Serosaseite hinzu.
- Sobald die Membranpotentialdifferenz einen Höhepunkt erreicht hat und zu sinken begonnen hat, ist das Experiment abgeschlossen.
10. Ergebnisse analysieren
- Berechnen Sie unter Offenkreisbedingungen den transmukösen Leitwert aus der Spannungsänderung als Reaktion auf Stromimpulse nach dem Ohmschen Gesetz. Bestimmen Sie den äquivalenten Kurzschlussstrom (Isc) aus transmuköser Spannung und Leitwert unter Anwendung des Ohmschen Gesetzes.
- Verwenden Sie das Verdünnungspotential von NaCl zur Berechnung der relativen ionischen Selektivität (PNa/PCl) mit der Goldman-Hodgkin-Katz-Gleichung10.
- Schätzen Sie die absolute Selektivität der Tight Junction für jedes Ion unter Verwendung der Kimizuka-Koketsu-Gleichung11.
- Berechnen Sie PNa/PCl unter Verwendung der Goldman-Hodgkin-Katz-Gleichung aus Verdünnungspotentialen und bestimmen Sie die absoluten Permeabilitäten PNa und PCl aus der Kimizuka-Koketsu-Gleichung, wie von Yu et al.10 wie folgt beschrieben:
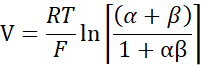

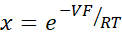

wobei V: Verdünnungspotential (mV); α: Aktivitätsverhältnis. Die berechnete Aktivität von NaCl im HEPES-Puffer dividiert durch die berechnete Aktivität von NaCl im Verdünnungs-HEPES-Puffer (Für dieses Experiment wurde sie als 1,8966 berechnet); e: Mathematische Konstante, 2,71828; GM: Transmuköse Leitfähigkeit (mS/cm2); F: Faraday-Konstante (96.485,3329 C/mol); R: Gaskonstante (8,314 J/mol K); T: Temperatur (310.15 K)
Ergebnisse
Die in diesem Papier gezeigten Ergebnisse sind Ergebnisse, die Teil eines größeren Projekts waren, das abgeschlossen wurde (siehe Referenz 4,23,24).
Die transepitheliale elektrische Leitfähigkeit des Dünndarms ist bei Cldn15-/- Mäusen erniedrigt.
Der transmuköse Ausgangsleitwert (unter Kurzschlussbedingung...
Diskussion
In diesem Experiment wurden Ussing-Kammern verwendet, um die elektrischen Basisparameter und das Verdünnungspotential von NaCl im Dünndarm von Cldn15-/- und WT-Mäusen zu messen. Bei der Durchführung von Ussing-Kammerexperimenten ist es sehr wichtig, zu überprüfen, ob die in den Experimenten verwendete Membranvorbereitung praktikabel ist. Dies geschieht in der Regel durch Zugabe von Glukose oder dem Adenylatcyclase-Aktivator Forskolin und durch Sehen, ob ein angemessener Anstieg des
Offenlegungen
Die Autoren haben keine potenziellen Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wird von 17K00860 (zu HH) und 19K20152 (zu NI) unterstützt. WH möchte der Otsuka Toshimi Scholarship Foundation für ihre finanzielle Unterstützung von 2018-2021 danken.
Materialien
| Name | Company | Catalog Number | Comments |
| #3 polyethyl tubing | Hibiki | outer diameter 1.0 mm; inner diameter 0.5 mm | |
| #7 polyethyl tubing | Hibiki | outer diameter 2.3 mm; inner diameter 1.3 mm | |
| 10 mL locking syringe | Terumo | SS-10LZ | Locking syringes are necessary to prevent the needle from dislodging during filling |
| 19 g needle | Terumo | NN-1938R | Please use caution when working with needles and dispose of in sharps container |
| 23 g needle | Terumo | NN-2332R | Please use caution when working with needles and dispose of in sharps container |
| 5 mm punch | NA | NA | Use to punch holes in filter paper and parafilm |
| acupuncture needles | Seirin | NS | Used as dissection pins to pin tissue to dissection plate |
| Agar | Fujifilm Wako | 010-15815 | |
| Alligator clips | NA | NA | Connects the electrode to the amplifier |
| CaCl2 | Fujifilm Wako | 038-00445 | |
| D(-)-Mannitol | Fujifilm Wako | 133-00845 | This is used to correct for the osmolality difference in dilution HEPES buffer |
| D(+)-Glucose | Fujifilm Wako | 049-31165 | |
| Dissection kit | You will need, scissors and curved forceps | ||
| Dissection plates | We used 10 cm cell culture plates and covered with silicon rubber | ||
| DMSO | Sigma | 472301-500ML | For making forskolin stock |
| Electrical recorder | TOA Electronics | PRR-5041 | Other equivalent electrical recorders are available commercially |
| Epithelial voltage clamp amplifier | Nihon Kohden | CEZ9100 | Other equivalent amplifiers are available commerically |
| filter paper, cut into squares | NA | NA | Punched with a 5 mm punch, used to hold intestinal preparation |
| fine forceps | Fast Gene | FG-B50476 | For blunt dissection of the muscle layer |
| Forskolin | Alomone Labs | F-500 | Make 10 mM stock in DMSO, final concentration will be 10 µM |
| HEPES | Sigma | H4034-1KG | |
| Indomethacin | Sigma | I7338-5G | Make a 1 mM stock in 21 mM NaHCO3, final concentration is 10 µM |
| K2HPO4 | Fujifilm Wako | 164-04295 | |
| KCl | Fujifilm Wako | 163-03545 | |
| KCl/calomel electrode | Asch Japan Co. | SCE-100 | |
| KH2PO4 | Kanto chemical | 32379-00 | |
| L(+)-Glutamine | Fujifilm Wako | 074-00522 | |
| MgCl2 | Fujifilm Wako | 135-00165 | |
| Mixed Gas (95% O2/5% CO2) | Shizuoka Oxygen Company | Used for bubbling Ringer solution and chambers when using Ringer solution | |
| NaCl | Fujifilm Wako | 191-01665 | |
| NaCl electrode | NA | NA | Handmade electrodes which require concentrated NaCl and Silver wire |
| NaHCO3 | Fujifilm Wako | 191-01305 | |
| O2 Gas | Shizuoka Oxygen Company | Used for bubbling chambers when using HEPES buffer | |
| parafilm | Bemis | PM-996 | Used to help seal Ussing chambers |
| pH meter | DKK-TOA Corp | HM-305 | HEPES buffer needs to be adjusted to pH 7.4 at 37 °C |
| pH meter electrode | DKK-TOA Corp | GST-5311C | |
| silicone rubber | Shinetsu Chemical | KE-12 | Used to fill dissection plates |
| silver wire | Used for making NaCl electrodes | ||
| Small jars w/ plastic lids | NA | NA | Use for NaCl electrodes |
| stereomicroscope | Zeiss | Stemi 305 | A stereomicroscope allows you to see depth, so you can dissect the tissue more easily |
| Tris (Trizma base) | Sigma | T1503-1KG | Make a 1M solution to adjust pH of HEPES buffers |
| Ussing chambers | Sanki Kagaku Kougei | These chambers are custom made continuous perfusion Ussing chambers with a window diameter of 5 mm | |
| Water pump and heating system | Tokyo Rikakikai Co. Ltd. | NTT-110 |
Referenzen
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23, 110-127 (1951).
- Field, M. Ion transport in rabbit ileal mucosa. II. Effects of cyclic 3', 5'-AMP. American Journal of Physiology - Legacy Content. 221, 992-997 (1971).
- Herrmann, J. R., Turner, J. R. Beyond Ussing's chambers: contemporary thoughts on integration of transepithelial transport. American Journal of Physiology - Cell Physiology. 310, 423-431 (2015).
- Ishizuka, N., et al. Luminal Na + homeostasis has an important role in intestinal peptide absorption in vivo. American Journal of Physiology - Gastorintestinal and Liver Physiology. 315, 799-809 (2018).
- Ikehara, O., et al. Subepithelial trypsin induces enteric nerve-mediated anion secretion by activating proteinase-activated receptor 1 in the mouse cecum. Journal of Physiological Sciences. 62, 211-219 (2012).
- Furuse, M. Molecular basis of the core structure of tight junctions. Cold Spring Harbor Perspectives in Biology. 2, 002907 (2010).
- Tsukita, S., Tanaka, H., Tamura, A. The claudins: From tight junctions to biological systems. Trends in Biochemical Sciences. 44, 141-152 (2019).
- Li, B. R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visual Experiments: JoVE. , e57032 (2018).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. V. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9, (2020).
- Yu, A. S. L., et al. Molecular basis for cation selectivity in claudin-2-based paracellular pores: Identifi cation of an electrostatic interaction site. Journal of General Physiology. 133, 111-127 (2009).
- Kimizuka, H., Koketsu, K. Ion transport through cell membrane. Journal of Theoretical Biology. 6, 290-305 (1964).
- Li, H., Sheppard, D. N., Hug, M. J. Transepithelial electrical measurements with the Ussing chamber. Journal of Cystic Fibrosis. 3, 123-126 (2004).
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245, 1066-1073 (1989).
- Smith, J. J., Karp, P. H., Welsh, M. J. Defective fluid transport by cystic fibrosis airway epithelia. Journal of Clinical Investigation. 93, 1307-1311 (1994).
- Molinski, S. V., et al. Orkambi and amplifier co-therapy improves function from a rare CFTR mutation in gene-edited cells and patient tissue. EMBO Molecular Medicine. 9, 1224-1243 (2017).
- Kisser, B., et al. The Ussing chamber assay to study drug metabolism and transport in the human intestine. Current Protocols in Pharmacology. 77, 1-19 (2017).
- Östh, K. . The horizontal Ussing chamber method in studies of nasal drug delivery - Method Delopment and Applications Using Different Formulations. , (2002).
- Guo, P., et al. Study of penetration mechanism of labrasol on rabbit cornea by Ussing chamber, RT-PCR assay, Western blot and immunohistochemistry. Asian Journal of Pharmaceutical Sciences. 14, 329-339 (2019).
- Okabe, K., et al. Effect of Benzalkonium Chloride on transscleral drug delivery. Investigative Opthalmology & Visual Science. 46, 703 (2005).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Kozuka, K., et al. Development and characterization of a human and mouse intestinal epithelial cell monolayer platform. Stem Cell Reports. 9, 1976-1990 (2017).
- Tamura, A., et al. Megaintestine in claudin-15-deficient mice. Gastroenterology. 134, 523-534 (2008).
- Nakayama, M., Ishizuka, N., Hempstock, W., Ikari, A., Hayashi, H. Na+-coupled nutrient cotransport induced luminal negative potential and Claudin-15 play an important role in paracellular Na+ recycling in mouse small intestine. International Journal of Molecular Sciences. 21, 376 (2020).
- Tamura, A., et al. Loss of claudin-15, but not claudin-2, causes Na+ deficiency and glucose malabsorption in mouse small intestine. Gastroenterology. 140, 913-923 (2011).
- Clarke, L. L. A guide to Ussing chamber studies of mouse intestine. American Journal of Physiology - Gastrointestinal and Liver Physiology. 296, (2009).
- Dobson, J. G., Kidder, G. W. Edge damage effect in in vitro frog skin preparations. American Journal of Physiology. 214, 719-724 (1968).
- Corman, B. Streaming potentials and diffusion potentials across rabbit proximal convoluted tubule. Pflügers Archiv: European Journal of Physiology. 403, 156-163 (1985).
- Shen, L., Weber, C. R., Raleigh, D. R., Yu, D., Turner, J. R. Tight junction pore and leak pathways: A dynamic duo. Annual Review of Physiology. 73, 283-309 (2011).
- Frizzell, R. A., Schultz, S. G. Ionic conductances of extracellular shunt pathway in rabbit ileum. Journal of General Physiology. 59, 318-346 (1972).
- Otani, T., et al. Claudins and JAM-A coordinately regulate tight junction formation and epithelial polarity. Journal of Cell Biology. 218, 3372-3396 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten