Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein Modell der experimentellen Steatose in vitro: Hepatozytenzellkultur in lipidüberlastetem Medium
In diesem Artikel
Zusammenfassung
Dieses Protokoll soll ein Werkzeug sein, um Steatose und die molekularen, biochemischen, zellulären Veränderungen zu untersuchen, die durch die übermäßige Exposition von Hepatozyten gegenüber Lipiden in vitroverursacht werden.
Zusammenfassung
Die metabolische Dysfunktion-assoziierte Fettlebererkrankung (MAFLD), früher bekannt als nichtalkoholische Fettlebererkrankung (NAFLD), ist aufgrund ihrer Beziehung zu Fettleibigkeit, Diabetes Typ 2 und Dyslipidämie die weltweit häufigste Lebererkrankung. Lebersteatose, die Ansammlung von Lipidtröpfchen im Leberparenchym, ist ein Schlüsselmerkmal der Krankheit, die der Entzündung vorausgeht, die bei Steatohepatitis, Fibrose und Lebererkrankungen im Endstadium beobachtet wird. Die Ansammlung von Lipiden in Hepatozyten könnte den ordnungsgemäßen Stoffwechsel von Xenobiotika und endogenen Molekülen stören und zelluläre Prozesse induzieren, die zum Fortbekommen der Krankheit führen. Obwohl die experimentelle Untersuchung der Steatose in vivodurchgeführt werden kann, sind In-vitro-Ansätze zur Untersuchung der Steatose komplementäre Werkzeuge mit unterschiedlichen Vorteilen. Die Hepatozytenkultur in lipidüberladenem Medium ist eine ausgezeichnete reproduzierbare Option für die Untersuchung der Lebersteatose, die die Identifizierung zellulärer Prozesse im Zusammenhang mit der Lipidakkumulation wie oxidative und retikuläre Belastungen, Autophagie, Proliferation, Zelltod usw. sowie andere Tests einschließlich Arzneimittelwirksamkeit und toxikologische Tests unter vielen anderen möglichen Anwendungen ermöglicht. Hier sollte die Methodik der Hepatozytenzellkultur in lipidüberladenem Medium beschrieben werden. HepG2-Zellen wurden in RMPI 1640-Medium kultiviert, das mit Natriumpalmitat und Natriumoleat konditioniert war. Wichtig ist, dass das Verhältnis dieser beiden Lipide entscheidend ist, um die Ansammlung von Lipidtröpfchen zu begünstigen, während die Zellproliferation und eine moderate Sterblichkeitsrate, wie sie während der Krankheit in der Leber auftritt, aufrechterhalten werden. Die Methodik, von der Herstellung der Lipidlösungsvorräte, Mischung, Zugabe zum Medium und Hepatozytenkultur wird gezeigt. Mit diesem Ansatz ist es möglich, Lipidtröpfchen in den Hepatozyten zu identifizieren, die durch Ölrot-O-Färbung leicht beobachtbar sind, sowie Kurven der Proliferations- / Mortalitätsraten.
Einleitung
Fettleber im Zusammenhang mit metabolischen Dysfunktion ist weltweit weit verbreitet1,2; Es wird geschätzt, dass bis zu 25% der Bevölkerung betroffen sind3. Diese Krankheit, die früher als nichtalkoholische Fettlebererkrankung (NAFLD) bekannt war, hat ihre Nomenklatur für metabolische Dysfunktion assoziierte Fettlebererkrankung (MAFLD) aktualisiert, um die Pathogenese im Zusammenhang mit Fettleibigkeit, Insulinresistenz, Diabetes Typ 2 und Dyslipidämie sowie die möglichen Behandlungen der Krankheit3,4 genau widerzuspiegeln.
Unabhängig vom Namen umfasst die Krankheit ein breites Spektrum histopathologischer Veränderungen, die durch eine ungewöhnlich hohe Ansammlung von Lipiden in der Leber gekennzeichnet sind (>5% des Fettes in den Hepatozyten5)und kann durch die Lipidakkumulation fortschreiten, die typischerweise bei einfacher Steatose bis Steatohepatitis vorkommt, was wiederum zur Entwicklung von Fibrose, Zirrhose führen kann. hepatozelluläres Karzinom und Leberversagen5,6,7,8. Aufgrund seiner zunehmenden Prävalenz wird erwartet, dass MAFLD der erste Hinweis auf eine Lebertransplantation und die Hauptursache für das hepatozelluläre Karzinom wird9.
Obwohl es als eine gutartige oder milde Form der Fettlebererkrankung angesehen wurde, ist die Lebersteatose tatsächlich der metabolische Schlüssel in MAFLD10. Verschiedene Stoffwechselwege werden durch die Lipidakkumulation in der Leber beeinflusst, einschließlich, aber nicht beschränkt auf Lipidsynthese, Export und Stoffwechsel10. Insulinresistenz, oxidativer Stress, retikulärer Stress und zelluläre Dysfunktion sind stark mit der hepatischen Lipotoxizität verbunden11,12. Auf der anderen Seite sind Fetthepatozyten das Ziel reaktiver Sauerstoffspezies, die Metaboliten wie Lipidperoxide, Proteincarbonyle und Addukte von Nukleinsäuren13abgeben. Auf zellulärer Ebene können Fetthepatozyten unter anderem mitochondriale Schäden14, zelluläre Seneszenz15, Apoptose16, Pyroptose12und Autophagie17erleiden.
Hepatozyten sind in hohem Maße für den Stoffwechsel, die Entgiftung und die Synthese einer Vielzahl von Molekülen verantwortlich. Viele dieser Funktionen könnten durch die bei der Steatose beobachtete Lipidakkumulation beeinträchtigt werden. Daher ist es von großer Bedeutung, über reproduzierbare Werkzeuge zu verfügen, die eine genaue Beurteilung der Steatose ermöglichen. In diesem Sinne sind In-vitro-Modelle leicht anwendbar und hochgradig reproduzierbar. Steatose in vitro wurde mit verschiedenen Zielen16,18,19verwendet. Die HepG2-Zellen sind als Hepatozytenzelllinie weit verbreitet. Es hat Vorteile wie einfach zu kulturieren und gut charakterisiert. Vielleicht ist der einzige Nachteil von HepG2-Zellen die Tatsache, dass es sich um eine krebserregende Zelllinie handelt, so dass dies bei der Analyse der Ergebnisse berücksichtigt werden muss. Hier wird die Anwendung einer mischung von Fettsäuren gezeigt, die in der Zellkultur weit verbreitet sind: Palmitinsäure (PA) und Ölsäure (OA). Sowohl PA als auch OA bieten unterschiedliche Ergebnisse in Kultur20. PA (C 16:0) ist die häufigste gesättigte Fettsäure, die aus der Nahrung gewonnen wird16. PA gilt als Biomarker der De-novo-Lipogenese, einem entscheidenden Schritt in der Entwicklung von NAFLD21. PA erweist sich als hochgiftig22; Daher wird es möglicherweise nicht empfohlen, Eine Steatose in vitro zu induzieren. OA (C 18:1) ist eine einfach ungesättigte Fettsäure. Im Gegensatz zu PA wurde vermutet, dass OA entzündungshemmende und antioxidative Eigenschaften besitzt, die PA12entgegenwirken können. Sowohl PA als auch OA sind die Hauptfettsäuren, die in den Triglyceriden vorhanden sind, unabhängig vom Gesundheitszustand oder der Krankheit16. Tabelle 1 enthält Beispiele für die Hepatozytenkultur mit PA, OA und deren Mischung sowie die berichteten Endpunkte12,23,24,25,26,27. Andere Fettsäuren wurden auch in der Hepatozytenkultur verwendet, einschließlich Stearinsäure (C 18:0)28,29,30, Linolsäure (C 18: 1)28,30,31 und ihre Konjugate (CLA)28,32, Palmitoleinsäure (C 16: 1)29. Ihre Verwendung wird jedoch in der Literatur am seltensten berichtet, vielleicht weil ihre Leberhäufigkeit niedriger ist als PA und OA16.
In Verbindung damit ähneln beide Fettsäuren der Steatose in vitround bieten proliferierende Zellen mit erhöhtem Zelltod und geringerer Lebensfähigkeit im Vergleich zu Kontrollbedingungen. Erwähnenswert ist, dass die jeweiligen Salze dieser Fettsäuren vorhanden sind und ebenfalls verwendet werden können. Eines der Hauptprobleme bei der Beurteilung der Lipidüberlastung in hepatozytenzelliger Zellkultur liegt in der Unterscheidung zwischen toxikologischen Modellen und einem Modell, das die Steatose am besten darstellt. Viele Modelle können im ersten Fall berücksichtigt werden. In der Tat könnte die Verwendung von PA allein unter ihnen in Betracht gezogen werden, und die hohe Mortalität ist das offensichtlichste Ergebnis12,16,23,24,25,26,27. Die Verwendung hoher Dosen auch bei OA kann auch als toxikologisches Modell betrachtet werden. Das hier gezeigte Protokoll entspricht höher der Steatoseentwicklung, da es im Vergleich zu anderen Modellen eine niedrige Mortalität aufweist und es ermöglicht, es über mehrere Tage mit progressiver Lipidakkumulation zu befolgen, wie es bei NAFLD auftritt. Die Möglichkeit, eine leichte und schwere Steatose unter experimentellen Bedingungen zu beurteilen, gilt als weiterer Vorteil.
| Fettsäure | Bedingungen | Ergebnisse | Referenz | ||
| PAPA | Konzentration: 200 μM | Lipidakkumulation | Yan et al, 201925. | ||
| Belichtungszeit: 24 h | Hepatozytenschäden | ||||
| Erhöhung der Transaminasen | |||||
| PAPA | Konzentration: 50, 100 und 200 μM | Lipidakkumulation | Xing et al,201924. | ||
| Belichtungszeit: 24 h | |||||
| PAPA | Konzentration: 250 μM, 500 μM, 750 μM und 1.000 μM | Lipidakkumulation | Wang et al, 202026. | ||
| Belichtungszeit: 24 h | Progressive Verringerung der Zelllebensfähigkeit | ||||
| Mix aus OA/PA | Konzentration: 1 mM | Lipidakkumulation | Xiao et al, 202027. | ||
| Belichtungszeit: 24 h | Meldet keine Lipotoxizität | ||||
| Preis: 2OA:1PA | |||||
| Mix aus OA/PA | Erste Stimulation mit 200 μM und 400 μM PA und dann zweite Stimulation mit 200 μM OA | Lipidakkumulation. | Zeng et al,202012. | ||
| Konzentration:400 μM PA: 200 μM OA | Der Nachweis einer durch PA induzierten Lipotoxizität wurde durch Stimulation von OA reduziert. | ||||
| Preis: 2PA:1OA | |||||
| Belichtungszeit: 24 h | |||||
| Mix aus OA/PA | Konzentration: 400 μM PA: 200 μM OA | Lipidakkumulation | Chen et al, 201823. | ||
| Preis: 2PA:1OA | |||||
| Belichtungszeit: 24 h | |||||
| Mix aus OA/PA | Konzentration:50 und 500 μM | Erzeugung von zwei Arten von Steatose: leichte Steatose und schwere Steatose. | Campos und Guzmán 2021 | ||
| Preis: 2PA:1OA | Simuliert chronische Exposition von Lipidüberlastung | ||||
| Zeit Exposition: 24 h, 2 Tage, 3 Tage und 4 Tage. | |||||
Tabelle 1. Hepatozytenkultur unter steatogenen Bedingungen. Die Tabelle zeigt die Art der verwendeten Fettsäure, die Bedingungen und die beobachteten Ergebnisse in der Hepatozytenkultur. PA: Palmitinsäure. OA: Ölsäure.
Schließlich ist dieses Modell nicht nur auf die Untersuchung von Steatose und Fettleber anwendbar, sondern auch auf die hepatischen Stoffwechsel-, Synthese- und Entgiftungswege im Zusammenhang mit Steatose. Auch die in vitro induzierte Steatose könnte Hinweise auf die Identifizierung potenzieller Marker der Krankheit sowie therapeutischer Ziele liefern.
Protokoll
1. Standard- und Konditionsmedienvorbereitung
- Um Standard-RPMI 1640 herzustellen, ergänzen Sie RPMI 1640-Kulturmedium mit 10% (v / v) fetalem Rinderserum (FBS, zuvor hitzeinaktiviert) und 1% (v / v) Penicillin-Streptomycin-Lösung. Lagern Sie das Medium bei 4 °C.Sterilisieren Sie es mit 0,22 μm Filtern.
- Um Palmitat-Stammlösung herzustellen, bereiten Sie eine 50 mM Palmitatlösung im Standard RPMI 1640 vor, die zuvor mit 1% Rinderserumalbumin (lipidfrei) ergänzt wurde. Ein Volumen von 5-10 ml dieses Bestandes ist ausreichend. Sterilisieren Sie die Stammlösung mit 0,22 μm Filtern. Bei 4 °C lichtgeschützt bis zu 1 Monat lagern.
- Zur Herstellung einer Oleat-Stammlösung bereiten Sie eine 50 mM-Oleatlösung im Standard RPMI 1640 vor, die zuvor mit 1% Rinderserumalbumin (lipidfrei) ergänzt wurde. Ein Volumen von 10 ml ist ausreichend. Sterilisieren Sie die Stammlösung mit 0,22 μm Filtern. Bei -20 °C lichtgeschützt bis zu 1 Monat lagern.
- Um steatogenes Medium aus den zuvor vorbereiteten Beständen vorzubereiten, bereiten Sie ein 1-teiliges Palmitat vor: 2-teiliges oleatsteatogenes Medium in zwei möglichen Konzentrationen: milde und schwere Steatose.
- Leichte Steatose: 100 ml eines 1-teiligen Palmitats: 2-teilige Oleatmischung (50 μM) in Standard-RPMI 1640 vorbereiten. Sterilisieren Sie mit 0,22 μm Filtern. Bei 4 °C bis zu 1 Woche lagern.
- Schwere Steatose: 100 ml eines 1-teiligen Palmitats: 2-teiliges Oleat (500 μM) in Standard-RPMI 1640 vorbereiten. Sterilisieren Sie mit 0,22 μm Filtern. Bei 4 °C bis zu 1 Woche lagern.
- Alternative Vorbereitung für die Lagerlösungen.
- Bereiten Sie beide Stammlösungen mit den jeweiligen Fettsäuren vor, indem Sie freies Lipidalbumin wie oben angegeben verwenden.
- Wenn freies Lipidalbumin fehlt, verwenden Sie Palmitat- und Oleatsalze.
- Entweder Palmitat oder Oleat in 2 ml absolutem Ethanol auflösen und dann im Endvolumen von Standard-RPMI 1640 (5-10 ml) mischen. Oleat direkt durch Rühren im Standard-RPMI 1640-Kulturmedium auflösen.
- Verdampfung von Ethanol durch Inkubation in einem Wasserbad bei 70 °C; gründlich mischen.
- Sterilisieren Sie in jedem Fall beide Stammlösungen mit 0,22 μm Filtern. Lagern Sie Palmitat-Stammlösung bei 4 °C und Oleat-Stammlösung bei - 20 °C. Schützen Sie beide Lösungen vor Licht. Diese Lösungen sind 1 Monat lang stabil.
2. Vorkultur
- Säen Sie 100.000 HepG2-Zellen pro Vertiefung in einer 24-Well-Platte. Fügen Sie 1 ml Standard-RPMI 1640 hinzu.
- Vorinkubieren bei 37 °C und 5% CO2 für 24 h, was eine Zellanhaftung ermöglicht.
3. Steatogene Kultur
- Nach der Vorkultur das Standardmedium RPMI 1640 verwerfen und das steatogene Medium entsprechend hinzufügen.
- Entsorgen Sie den Überstand und fügen Sie alle 24 Stunden frisches steatogenes Medium hinzu.
4. Beurteilung der Lebensfähigkeit und Mortalität
- Säen Sie 100.000 HepG2-Zellen pro Vertiefung in einer 24-Well-Platte. Fügen Sie 1 ml Standard-RPMI 1640 hinzu.
- 24 h bei 37 °C und 5%CO2 vorbebrüten.
- Ändern Sie das Standardmedium RPMI 1640 für das steatogene Medium.
- Inkubieren Sie für 24 h, 2 Tage, 3 Tage und 4 Tage und erfrischen Sie das steatogene Medium alle 24 h.
- Verwerfen Sie nach entsprechender Zeit den Überstand.
- Lösen Sie die Zellen aus dem Brunnen, indem Sie 500 μL 0,05% Trypsin-EDTA hinzufügen. 5 min bei 37 °C und 5% CO2 inkubieren.
- Sammeln Sie die resuspendierten Zellen in einem Mikroröhrchen.
- Zentrifuge bei 300 x g und verwerfen Sie den Überstand.
- Fügen Sie 200 μL Standard-RPMI 1640 hinzu und resuspendieren Sie die Zellen.
- 15 μL 0,4% Trypanblaue Lösung in eine frische Mikroröhrchen geben. Mit 15 μL der vorherigen Zellsuspension mischen.
- Zählen Sie die gefärbten und nicht gefärbten Zellen in einem Hämozytometer.
- Berechnen Sie die Lebensfähigkeit und die Sterblichkeitsraten entsprechend.
Lebensfähigkeit =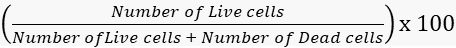
Mortalität =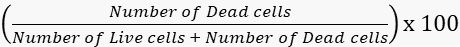
5. Lipidfärbung mit Öl-Rot O
- Legen Sie in jedem Brunnen einen Zellkulturdeckel in eine 24-Well-Platte.
- Säen Sie 100.000 HepG2-Zellen pro Vertiefung. Fügen Sie 1 ml Standard-RPMI 1640 hinzu.
- Vorinkubieren bei 37 °C und 5% CO2 für 24 h.
- Ändern Sie das Standardmedium RPMI 1640 für das steatogene Medium.
- Inkubieren Sie für 24 h, 2 Tage, 3 Tage und 4 Tage und erfrischen Sie das steatogene Medium alle 24 h.
- Verwerfen Sie nach entsprechender Zeit den Überstand.
- Mit 1 ml phosphatgepufferter Kochsalzlösung (PBS) waschen. Verwerfen Sie den Überstand.
- Fixieren Sie mit 1 ml 4% Paraformaldehyd in PBS.
- 1 h bei Raumtemperatur inkubieren.
- Entsorgen Sie den Überschuss an Paraformaldehyd.
- Spülen Sie die Zellen mit 1 ml destilliertem Wasser ab.
- Fügen Sie 1 ml 70% Isopropanol hinzu und inkubieren Sie für 5 min.
- Verwerfen Sie den Überschuss an Isopropanol. Eine PBS-Wäsche ist an dieser Stelle nicht erforderlich.
- Fügen Sie 1 ml ölrote O-Lösung hinzu und inkubieren Sie sie für 30 minuten.
- Entsorgen Sie den Überschuss der ölroten O-Lösung.
- Mit 1 ml destilliertem Wasser abspülen.
- Fügen Sie 500 μL Hämatoxylinlösung hinzu. 3 Min. inkubieren.
- Entsorgen Sie den Überschuss an Hämatoxylinlösung.
- Mit 1 ml destilliertem Wasser abspülen.
- Unter dem Mikroskop bei einer Vergrößerung von 400x beobachten (Objektiv 40x, Okular 10x).
6. Morphometrische Beurteilung des Lipidgehalts
- Wählen Sie zufällig Fotos von 10 optischen Feldern aus dem gesamten Bereich des Brunnens aus und nehmen Sie sie auf. Wiederholen Sie für jeden Brunnen.
- Beurteilen Sie den Prozentsatz der rot gefärbten Fläche mit dem Farbschwellenwert-Tool in der ImageJ-Software gemäß Ferreira und Rasband33.
- Vergleichen Sie den gefärbten Bereich mit dem gesamten Bereich des optischen Feldes mit dem Werkzeug Partikel analysieren in der ImageJ-Software nach Ferreira und Rasband33.
- Berechnen Sie den durchschnittlichen Prozentsatz jeder Bohrung.
Ergebnisse
Hepatozyten, die im steatogenen Medium kultiviert werden, zeigen Wachstum auf der gesamten Oberfläche des Brunnens; Fetthepatozyten zeigen jedoch eine geringere Wachstumsrate im Vergleich zu Zellen, die im Kontrollmedium kultiviert werden. Das vorgeschlagene Verhältnis und die Konzentration von OA und PA garantieren das Überleben der Zellen während der Kultur. Die Aussaat von 1 x10 5 Zellen pro Vertiefung in 24-Well-Platten sorgt für eine optimale Konfluenz, wie in Abbildung 1
Diskussion
Dieses Protokoll soll eine Strategie zur Untersuchung der Steatose in vitroliefern. Zellkultur ist ein leistungsfähiges Werkzeug, um zelluläre, molekulare, biochemische und toxikologische Aspekte der Zellen zu untersuchen, die verschiedenen Bedingungen ausgesetzt sind. Mit diesem Ansatz kann die Steatose nicht nur als ein Stadium der komplexen Krankheit, die MAFLD ist, visualisiert werden, sondern auch als die Überexposition der Hepatozyten gegenüber Lipiden und die möglichen Ergebnisse, die sich aus einer ...
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Diese Arbeit wurde von Consejo Nacional de Ciencia y Tecnología (Conacyt, CB-221137) finanziert. Adriana Campos ist Doktorandin am Programa de Doctorado en Ciencias Biomédicas, Universidad Nacional Autónoma de México, und wurde von Conacyt (CVU: 1002502) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Biosafety cabinet | ESCO Airstream | AC2-452+C2:C26 | Class II Type A2 Biological Safety Cabinet |
| Bottle top filter | Corning, US | 430513 | Non-pyrogenic, polystyrene, sterile. 1 filter/Bag. 0.22 μm, 500 mL. |
| Bovine serum albimun (BSA) | Gold Biotechnology, US | A-421-10 | BSA Fatty Acid Free for cell culture |
| Culture media RPMI 1640 | ThermoFisher-Gibco, US | 31800-022 | - |
| Fetal Bovine Serum (FBS) | ThermoFisher-Gibco, US | A4766801 | - |
| Hemocytometer | Marienfeld, DE | 640010 | - |
| HepG2 cell line | ATCC, US | HB-8065 | Hepatocellular carcinoma human cells. |
| Humidified incubator | Thermo Electronic Corporation,US | Model: 3110 | Temperature (37 °C ± 1 °C), humidity (90% ± 5%) , CO2 (5% ± 1%) |
| Inverted microscope Eclipse | NIKON, JPN | Model: TE2000-S | - |
| Isopropanol | Sigma-Aldrich, US | I9030-4L | - |
| Oil Red O Kit | Abcam, US | ab150678 | Kit for histological visualization of neutral fat. |
| Paraformaldehyde | Sigma-Aldrich, US | P6148-500G | - |
| Penicillin/streptomycin | ThermoFisher-Gibco, US | 15140-122 | Antibiotics 10,000 U/mL Penicillin, 10,000 μg/mL Streptomycin |
| pH meter | Beckman, US | Model: 360 PH/Temp/MV Meter | - |
| Phosphate buffered saline | ThermoFisher-Gibco, US | 10010-023 | - |
| Serological Pipettes | Sarstedt, AUS | 86.1253.001 | Non-pyrogenic, sterile, 5 mL |
| Serological Pipettes | Sarstedt, AUS | 86.1254.001 | Non-pyrogenic, sterile, 10 mL |
| Sodium bicarbonate | Sigma-Aldrich, US | S5761-1KG | Preparation of culture media |
| Sodium oleate | Santa Cruz Biotechnology, US | sc-215879A | - |
| Sodium palmitate | Santa Cruz Biotechnology, US | sc-215881 | - |
| Syring filter | Corning, US | 431219 | Non-pyrogenic, sterile, 28 mm, 0.2 μm. |
| Trypan Blue | Sigma-Aldrich, US | T6146-25G | - |
| Trypsin 0.05% /EDTA 0.53 mM | Corning, US | 25-052-Cl | - |
| 24 well cell culture cluster | Corning, US | 3524 | Flat bottom with lid. Tissue culture treated. Nonpyrogenic, polystyrene, sterile. 1/Pack. |
| 96 well cell culture cluster | Corning, US | 3599 | Flat bottom with lid. Tissue culture treated. Nonpyrogenic, polystyrene, sterile. 1/Pack. |
Referenzen
- Younossi, Z. M. Non-alcoholic fatty liver disease - a global public health perspective. Journal of Hepatology. 70 (3), 531-544 (2019).
- Younossi, Z., et al. Global perspectives on nonalcoholic fatty liver disease and nonalcoholic steatohepatitis. Hepatology. 69 (6), 2672-2682 (2019).
- Eslam, M., et al. A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement. Journal of Hepatology. 73 (1), 202-209 (2020).
- Eslam, M., Sanyal, A. J., George, J. MAFLD: A consensus-driven proposed nomenclature for metabolic associated fatty liver disease. Gastroenterology. 158 (7), 1999-2014 (2020).
- Chalasani, N., et al. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American association for the study of liver diseases. Hepatology. 67 (1), 328-357 (2018).
- Calzadilla Bertot, L., Adams, L. A. The natural course of non-alcoholic fatty liver disease. International Journal of Molecular Science. 17 (5), 774 (2016).
- Reccia, I., et al. Non-alcoholic fatty liver disease: A sign of systemic disease. Metabolism. 72, 94-108 (2017).
- Tomita, K., et al. Free cholesterol accumulation in hepatic stellate cells: Mechanism of liver fibrosis aggravation in nonalcoholic steatohepatitis in mice. Hepatology. 59 (1), 154-169 (2014).
- Byrne, C. D., Targher, G. Nafld: A multisystem disease. Journal of Hepatology. 62, 47-64 (2015).
- Ipsen, D. H., Lykkesfeldt, J., Tveden-Nyborg, P. Molecular mechanisms of hepatic lipid accumulation in non-alcoholic fatty liver disease. Cellular and Molecular Life Sciences. 75 (18), 3313-3327 (2018).
- Diehl, A. M., Day, C. Cause, pathogenesis, and treatment of nonalcoholic steatohepatitis. New England Journal of Medicine. 377 (21), 2063-2072 (2017).
- Zeng, X., et al. Oleic acid ameliorates palmitic acid induced hepatocellular lipotoxicity by inhibition of ER stress and pyroptosis. Nutrition and Metabolism. 17, 11 (2020).
- Ore, A., Akinloye, O. A. Oxidative stress and antioxidant biomarkers in clinical and experimental models of non-alcoholic fatty liver disease. Medicina (Kaunas). 55 (2), 26 (2019).
- Paradies, G., Paradies, V., Ruggiero, F. M., Petrosillo, G. Oxidative stress, cardiolipin and mitochondrial dysfunction in nonalcoholic fatty liver disease. World Journal of Gastroenterology. 20 (39), 14205-14218 (2014).
- Aravinthan, A., et al. Hepatocyte senescence predicts progression in non-alcohol-related fatty liver disease. Journal of Hepatology. 58 (3), 549-556 (2013).
- Gomez, M. J., et al. A human hepatocellular in vitro model to investigate steatosis. Chemico Biological Interactions. 165 (2), 106-116 (2007).
- Wu, W. K. K., Zhang, L., Chan, M. T. V. Autophagy, NAFLD and NAFLD-related HCC. Advances in Experimental Medicine and Biology. 1061, 127-138 (2018).
- Levy, G., Cohen, M., Nahmias, Y. In vitro cell culture models of hepatic steatosis. Methods in Molecular Biology. 1250, 377-390 (2015).
- Kanuri, G., Bergheim, I. In vitro and in vivo models of non-alcoholic fatty liver disease (NAFLD). International Journal of Molecular Science. 14 (6), 11963-11980 (2013).
- Ricchi, M., et al. Differential effect of oleic and palmitic acid on lipid accumulation and apoptosis in cultured hepatocytes. Journal of Gastroenterology and Hepatology. 24 (5), 830-840 (2009).
- Lee, Y., et al. Serial biomarkers of de novo lipogenesis fatty acids and incident heart failure in older adults: The cardiovascular health study. Journal of the American Heart Association. 9 (4), 014119 (2020).
- Alnahdi, A., John, A., Raza, H. Augmentation of glucotoxicity, oxidative stress, apoptosis and mitochondrial dysfunction in Hepg2 cells by palmitic acid. Nutrients. 11 (9), 1979 (2019).
- Chen, X., et al. Oleic acid protects saturated fatty acid mediated lipotoxicity in hepatocytes and rat of non-alcoholic steatohepatitis. Life Sciences. 203, 291-304 (2018).
- Xing, J. H., et al. NLRP3 inflammasome mediate palmitate-induced endothelial dysfunction. Life Sciences. 239, 116882 (2019).
- Yan, H., et al. Insulin-like Growth Factor Binding Protein 7 accelerates hepatic steatosis and insulin resistance in non-alcoholic fatty liver disease. Clinical and Experimental Pharmacology and Physiology. 46 (12), 1101-1110 (2019).
- Wang, J., Hu, R., Yin, C., Xiao, Y. Tanshinone IIA reduces palmitate-induced apoptosis via inhibition of endoplasmic reticulum stress in Hepg2 liver cells. Fundamental and Clinical Pharmacology. 34 (2), 249-262 (2020).
- Xiao, Z., Chu, Y., Qin, W. IGFBP5 modulates lipid metabolism and insulin sensitivity through activating ampk pathway in non-alcoholic fatty liver disease. Life Sciences. 256, 117997 (2020).
- Avila, G., et al. In vitro effects of conjugated linoleic acid (CLA) on inflammatory functions of bovine monocytes. Journal of Dairy Science. 103 (9), 8554-8563 (2020).
- Malhi, H., Bronk, S. F., Werneburg, N. W., Gores, G. J. Free fatty acids induce JNK-dependent hepatocyte lipoapoptosis. The Journal of Biological Chemistry. 281 (17), 12093-12101 (2006).
- Oh, J. M., et al. Effects of palmitic acid on TNF-alpha-induced cytotoxicity in SK-Hep-1 cells. Toxicology In Vitro: An International Journal Published in Association with BIBRA. 26 (6), 783-790 (2012).
- Stellavato, A., et al. In vitro assessment of nutraceutical compounds and novel nutraceutical formulations in a liver-steatosis-based model. Lipids in Health and Disease. 17 (1), 24 (2018).
- Pachikian, B. D., et al. Implication of trans-11, trans-13 conjugated linoleic acid in the development of hepatic steatosis. PLoS One. 13 (2), 0192447 (2018).
- Ferreira, T., Rasband, W. Analyze. ImageJ User Guide. , 132-135 (2012).
- Geng, Y., Wu, Z., Buist-Homan, M., Blokzijl, H., Moshage, H. Hesperetin protects against palmitate-induced cellular toxicity via induction of GRP78 in hepatocytes. Toxicology and Applied Pharmacology. , 404 (2020).
- Geng, Y., et al. Protective effect of metformin against palmitate-induced hepatic cell death. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1866 (3), 165621 (2020).
- Sarnyai, F., et al. Effect of cis- and trans-monounsaturated fatty acids on palmitate toxicity and on palmitate-induced accumulation of ceramides and diglycerides. International Journal of Molecular Science. 21 (7), 2626 (2020).
- Chen, J. W., et al. Tetrahydrocurcumin ameliorates free fatty acid-induced hepatic steatosis and improves insulin resistance in HepG2 cells. Journal of Food and Drug Analysis. 26 (3), 1075-1085 (2018).
- Burhans, M. S., et al. Hepatic oleate regulates adipose tissue lipogenesis and fatty acid oxidation. Journal of Lipid Research. 56 (2), 304-318 (2015).
- Abenavoli, L., Milanovic, M., Milic, N., Luzza, F., Giuffre, A. M. Olive oil antioxidants and non-alcoholic fatty liver disease. Expert Reviews in Gastroenterology and Hepatology. 13 (8), 739-749 (2019).
- Nagarajan, S. R., et al. Lipid and glucose metabolism in hepatocyte cell lines and primary mouse hepatocytes: A comprehensive resource for in vitro studies of hepatic metabolism. American Journal of Physiology - Endocrinology and Metabolism. 316 (4), 578-589 (2019).
- Hodson, L., Skeaff, C. M., Fielding, B. A. Fatty acid composition of adipose tissue and blood in humans and its use as a biomarker of dietary intake. Progress in Lipid Research. 47 (5), 348-380 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten