Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Partielles heterotopes Hinterbeinein Transplantationsmodell bei Ratten
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieser Artikel stellt ein partielles heterotopes osteomyokutanes Lappentransplantationsprotokoll bei Ratten und seine möglichen Ergebnisse in der mittelfristigen Nachbeobachtung vor.
Zusammenfassung
Vaskularisierte kompositative Allotransplantationen (VCA) stellen die fortschrittlichste Rekonstruktionsoption für Patienten ohne autologe Operationsmöglichkeiten nach einem komplexen Gewebedefekt dar. Gesichts- und Handtransplantationen haben das Leben entstellter Patienten verändert und ihnen ein neues ästhetisches und funktionelles soziales Organ gegeben. Trotz vielversprechender Ergebnisse ist VCA aufgrund lebenslanger Immunsuppressionskomorbiditäten und infektiöser Komplikationen immer noch unterdurchschnittlich. Die Ratte ist ein ideales Tiermodell für In-vivo-Studien, die immunologische Wege und Transplantatabstoßungsmechanismen untersuchen. Ratten werden auch häufig in neuartigen Techniken zur Konservierung von Kompositgewebetransplantaten eingesetzt, einschließlich Perfusions- und Kryokonservierungsstudien. Modelle, die für VCA bei Ratten verwendet werden, müssen reproduzierbar, zuverlässig und effizient mit geringer postoperativer Morbidität und Mortalität sein. Heterotope Gliedmaßentransplantationsverfahren erfüllen diese Kriterien und sind einfacher durchzuführen als orthotope Gliedmaßentransplantationen. Die Beherrschung mikrochirurgischer Nagetiermodelle erfordert solide Erfahrung in der Mikrochirurgie und Tierpflege. Hierin wird ein zuverlässiges und reproduzierbares Modell der partiellen heterotopen osteomyokutanen Lappentransplantation bei Ratten, die postoperativen Ergebnisse und die Mittel zur Vorbeugung potenzieller Komplikationen berichtet.
Einleitung
In den letzten zwei Jahrzehnten hat sich VCA zu einer revolutionären Behandlung für Patienten entwickelt, die schwere Entstellungen erleiden, einschließlichGesichts-1-und Oberschenkelamputationen2,Penis3und anderer komplexer Gewebedefekte4,5. Die Folgen einer lebenslangen Immunsuppression behindern jedoch immer noch eine breitere Anwendung dieser komplexen rekonstruktiven Operationen. Grundlagenforschung ist entscheidend, um Anti-Ablehnungsstrategien zu verbessern. Die Erhöhung der VCA-Konservierungszeit ist auch wichtig, um die Transplantationslogistik zu verbessern und den Spenderpool zu vergrößern (da VCA-Spender mehr Kriterien erfüllen müssen als feste Organspender, einschließlich Hautton, anatomische Größe, Geschlecht). In diesem Zusammenhang werden Gliedmaßentransplantationen bei Ratten häufig in Studien zur Immunabstoßung von Allotransplantaten6,7, neuartigen Toleranzinduktionsprotokollen8und Konservierungsstudien9,10,11verwendet. Daher sind diese VCA-Modelle ein Schlüsselelement, das es für die translationale VCA-Forschung zu beherrschen gilt.
Osteomyokutane Klappen wurden in der Literatur als zuverlässige Modelle zur Untersuchung von VCA bei Ratten8,12,13,14beschrieben. Obwohl orthotope Ganzgliedmaßentransplantationen eine langfristige Beurteilung der Transplantatfunktion ermöglichen, ist dies ein zeitaufwendiges Verfahren, das mit höheren postoperativen Morbiditäts- und Mortalitätsraten verbunden ist14. Im Gegensatz dazu sind heterotope Gliedmaßentransplantationsmodelle nicht funktionsfähig, ermöglichen aber reproduzierbare Studien zu VCA. Postoperative Ergebnisse können vor Beginn einer VCA-Transplantationsstudie an Ratten zuverlässig antizipiert werden. Diese Studie berichtet über ein partielles heterotopes osteomykutanes Lappentransplantationsmodell bei der Ratte, das häufige mögliche Ergebnisse und Komplikationen beinhaltet, die intraoperativ und postoperativ während einer Nachbeobachtungszeit von drei Wochen auftreten können.
Protokoll
Alle Tiere erhielten eine humane Pflege gemäß dem NIH-Leitfaden für die Pflege und Verwendung von Labortieren. Das Institutional Animal Care and Use Committee (IACUC-Protokoll 2017N000184) und das Animal Care and Use Review Office (ACURO) genehmigten alle Tierprotokolle. Inzucht männliche Lewis-Ratten (250-400 g) wurden für alle Experimente verwendet.
1. Chirurgie
- Betäuben Sie die Lewis-Ratten mit Isofluran-Inhalation. Induzieren Sie die Anästhesie mit 5% Isofluran in der Induktionskammer und halten Sie die Anästhesie mit 1,5-3% Isofluran-Inhalation durch einen Atemkegel aufrecht.
- Tragen Sie Augengleitmittel vor der Operation bei Überlebensverfahren auf. Rasieren Sie die Operationsstelle, behandeln Sie mit Enthaarungscreme, Peeling und drapieren Sie mit sterilen Vorhängen.
- Bestätigen Sie die Totalanästhesie mit einem Zehenquetschtest vor dem Schnitt und regelmäßig während des Eingriffs. Überwachen Sie die Herz- und Atemraten während des gesamten Eingriffs. Halten Sie bei allen Operationen sterile Bedingungen aufrecht, indem Sie sterile Instrumente, Vorräte, Vorhänge und Handschuhe verwenden. Die Liste der für die Verfahren verwendeten Instrumente finden Sie in der Materialtabelle.
2. Spenderrecht Teilbeschaffung
- Machen Sie einen umlaufenden Schnitt der Haut über dem Knöchel am distalen Drittel des Beines.
- Skelettieren und kauterisieren Sie die Arteria saphenöses arterie und den terminalen Ast der Arteria poplitea mit einer bipolaren Pinzette. Kauterisieren und schneiden Sie die Muskeln Gastrocnemius, Soleus, Tibialis anterior und Bizeps femoris ab, bis der Tibiaknochen freigelegt ist.
- Machen Sie einen 2,5 cm großen Schnitt an der rechten Leistenfalte. Sezieren Sie das Leistenfettpolster und ziehen Sie es distal zurück, um die Oberschenkelgefäße freizulegen. Verwenden Sie einen Angelhakenretraktor, um das Leistenband zu greifen, und klemmen Sie eine Zange, um das Leistenfettpolster distaell zu halten.
HINWEIS: Das Leistenfettpolster ist in der Ernte der Teilgliedmaße enthalten. - Sezieren Sie die Oberschenkelgefäße, individualisieren Sie Murphy-Äste (tiefe muskuläre Kollateraläste, die sich normalerweise auf halbem Weg zwischen dem Leistenband und dem Epigastriezweig befinden) und ligatieren Sie mit 8-0 Nylon krawatten.
- Heparinisieren Sie die Spenderratte mit 100 IE/ kg Heparin, das mit einer 27,5 G-Nadel in die Penisvene injiziert wird.
- Vervollständigen Sie den Hautschnitt um die Hüfte.
- Kauterisieren Sie die Muskeln Bizeps femoris und Gluteus superficialis mit einer bipolaren Pinzette. Kauterisieren und schneiden Sie den Ischiasnerv bei mittlerer Femurlänge. Legen Sie den Femur proximal auf Höhe des hinteren Oberschenkelkamms frei.
HINWEIS: Adduktor- und Quadrizepsmuskeln bleiben bei der Beschaffung außen vor. Der innominate Pedikel bleibt erhalten. - Ligaten Sie Femurgefäße mit 8/0 Nylonbindern auf Höhe des Leistenbandes. Führen Sie eine Arteriotomie an der Oberschenkelarterie direkt unterhalb der Ligatur durch und erweitern Sie sich, um das Einsetzen eines 24-G-Angiokatheters zu ermöglichen.
- Kauterisieren und schneiden Sie den verbleibenden Muskel unter dem Pedikel und setzen Sie die vordere Seite des Femurs frei.
- Schneiden Sie Tibia und Femur mit einem Knochenschneider so proximal und distal wie möglich (mittellang).
- Spülen Sie die partielle Hinterbeine mit 2 ml Heparinsalzlösung (100 IE / ml), um einen klaren venösen Abfluss zu erhalten. Auf Eis in einer sterilen Gaze bis zum mikrovaskulären Transfer lagern (Abbildung 1).
- Während das Tier unter Vollnarkose steht, führen Sie die Euthanasie durch Exsanguination durch, bis das Tier kein Lebenszeichen zeigt (keine Atembewegung und kein Herzschlag).

Abbildung 1: Ernte der partiellen Hinterbeine der Ratte. Ein 24 G Angiokath wird in die Oberschenkelarterie eingeführt, bereit für den heterotopen mikrovaskulären Transfer. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Empfängeroperation
- Rasieren Sie vor dem Schnitt den Nacken und verabreichen Sie Buprenorphin 0,01-0,05 mg/kg subkutan. Legen Sie die Ratte in Rückenlage auf ein Heizkissen.
- Machen Sie einen 2,5 cm großen Schnitt in der rechten Leistenfalte. Sezieren Sie das Leistenfettpolster und lehnen Sie es distal zurück, um die Femurgefäße freizulegen. Verwenden Sie einen Haken, um das Leistenband und eine Klemmzange zurückzuziehen, um das Leistenfettpolster distal zu halten.
- Sezieren Sie die Oberschenkelgefäße, individualisieren Sie die Murphy-Äste und ligatieren Sie mit 8/0 Nylonbindern.
- Ligatieren Sie beide Gefäße über den Epigastrischen Gefäßen mit 8/0 Nylonbindern. Platzieren Sie Approximatorklemmen proximal und erweitern Sie die Gefäßenden; mit Heparin-Kochsalzlösung abspülen.
- Machen Sie einen Schnitt an der linken Flanke über der Hüfte und erstellen Sie eine subkutane Tasche mit einem subkutanen Tunnel zur Leistenfalte.
HINWEIS: Der Einschnitt erfolgt oberhalb des Bewegungsbereichs der Hüfte, um sicherzustellen, dass das Tier eine normale Hinterbeinebebewegung beibehält. Darüber hinaus ermöglicht die Aufrechterhaltung einer Kutanbrücke zwischen dem Transplantateinschub und der mikrovaskulären Transferstelle eine bessere Fixierung des Transplantats (Abbildung 2). - Legen Sie den proximalen Teil der partiellen Extremität und das Leistenfettpolster durch den subkutanen Tunnel für den mikrovaskulären Transfer. Führen Sie venöse und arterielle Anastomosen mit 10/0 Nylonnähten durch. Entfernen Sie beide Approximatorklemmen und beobachten Sie die Revaskularisation der Extremität. Führen Sie einen "Melktest" an beiden Gefäßen durch, um die Durchgängigkeit jeder Anastomose zu beurteilen.
HINWEIS: Acht bis neun Nähte sind in der Regel für venöse Anastomose notwendig, 6 Nähte im Durchschnitt für arterielle Anastomose. - Machen Sie einen Längsschnitt auf der medialen Seite der transplantierten Extremität und führen Sie das Transplantat ein. Entfernen Sie überschüssige Haut des Transplantats und schließen Sie die Wunde mit separaten Nähten und einer laufenden Naht mit resorbierbaren 4/0-Nähten.
- Nähen Sie die Leistenfettpolster der transplantierten Extremität und des Empfängers mit zwei separaten resorbierbaren Nähten zusammen und schließen Sie die Leistenfalte ganz am Ende nach einer letzten Untersuchung der mikrovaskulären Anastomosen.
HINWEIS: Leistenfettpolster werden fest vernäht, um eine Schützenschicht aus Fett über den Anastomosen hinzuzufügen und eine gesicherte Position des Transplantats und seines Pedikels zu gewährleisten. Ein sorgfältiger Verschluss ist besser für die Wundheilung; Es verhindert auch Restblutungen aus der Wunde und verringert das Risiko einer Selbstverstümmelung. - Kompensieren Sie den Flüssigkeitsverlust subkutan mit 1-3 ml Kochsalzlösung entsprechend der Menge der perioperativen Blutungen.
- Legen Sie ein elisabethanisches Halsband um den Hals des Tieres und tragen Sie 2 lose Nähte auf die Haut auf, um sie in der richtigen Position zu halten.
- Stoppen Sie die Isofluran-Inhalation und überwachen Sie das Tier kontinuierlich auf einem Wärmekissen, bis es vollständig bei Bewusstsein und ambulant ist.
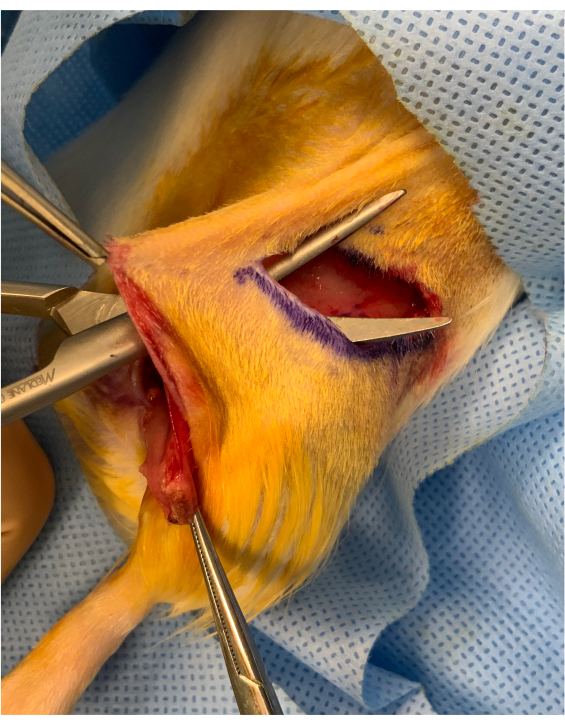
Abbildung 2: Perioperatives Bild vor dem Einsetzen der osteomyoktanen Extremität. Zwischen dem Leistenschnitt und dem Einsetzen des Transplantats über der Hüfte bleibt eine Hautbrücke von ca. 1 cm erhalten. Das Transplantat wird unter die Brücke gelegt und hält es für den mikrovaskulären Transfer stabil. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Nachsorge
- Überwachen Sie das Tier zweimal täglich für 72 Stunden, dann einmal täglich bis zum postoperativen Tag (POD) 7 und dann zweimal pro Woche.
HINWEIS: Die Überwachung muss an den Zustand des Tieres und des Transplantats angepasst werden (blasse Augen benötigen möglicherweise zusätzliche Flüssigkeiten, Porphyrinfärbung als Indikator für Tierschmerzen, abnormale Transplantatfarbe / -temperatur), und weitere Pflege sollte mit dem Tierarzt besprochen werden. Für die Empfängerratten ist während des gesamten Untersuchungszeitraums eine Einzelunterkunft erforderlich, um Schäden am Transplantat zu vermeiden. - Führen Sie eine Analgesie mit subkutaner Injektion von Buprenorphin und / oder nichtsteroidalem entzündungshemmendem Medikament gemäß den IACUC-Richtlinien durch.
- Bewerten Sie das Transplantat und führen Sie täglich eine körperliche Untersuchung mit Bildern mit demselben Gerät durch.
HINWEIS: Die Verwendung von Haarentfernungscreme auf der Haut des Transplantats ist hilfreich, um die Hautfarbe der Transplantation besser beurteilen zu können.
Ergebnisse
In dieser Einzeloperatorenstudie wurden 30 syngene heterotope partielle Gliedmaßentransplantationen durchgeführt. Erfolg wurde am postoperativen Tag 21 als das Fehlen von VCA-Versagen oder Komplikationen, die Eine Euthanasie erfordern, definiert. Die normale Entwicklung des Transplantats ist in Abbildung 3 dargestellt. Die mittlere Dauer für die partielle Gliedmaßenbeschaffung und den Transplantateintritt beim Empfänger beträgt 35 bzw. 105 Minuten; die mittlere Ischämiezeit betrug 105...
Diskussion
Orthotopische Gliedmaßentransplantationsmodelle bei Nagetieren wurden in der Literatur15,16,17beschrieben ; Sie erfordern jedoch eine Nervenreparatur, Muskelanhaftung und eine perfekte Osteosynthese des Femurs, was ein sehr schwieriger Schritt sein kann. Diese Modelle sind auch mit einer höheren Morbiditäts- und Mortalitätsrate bei Nagetierenverbunden 14,insbesondere in der kurzfristigen Nachbeobachtu...
Offenlegungen
Die Autoren haben keine Angaben.
Danksagungen
Diese Arbeit wurde vom Büro des stellvertretenden Verteidigungsministers für Gesundheitsangelegenheiten durch das Congressionally Directed Medical Research Program unter der Award-Nr. W81XWH-17-1-0680. Meinungen, Interpretationen, Schlussfolgerungen und Empfehlungen sind die der Autoren und werden nicht unbedingt vom Verteidigungsministerium unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 24 GA angiocatheter | BD Insyte Autoguard | 381412 | |
| 4-0 suture Black monofilament non absorbable suture | Ethicon | 1667 | Used to suture the E-collar to the back of the neck |
| 4-0 suture Coated Vicryl Plus Antibacterial | Ethicon | VCP496 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Bipolar cords | ASSI | 228000C | |
| Black Polyamide Monofilament USP 10-0, 4 mm 3/8c | AROSurgical | T04A10N07-13 | Used to perform the microvascular anastomoses |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Dissecting Scissors 15 cm, Round Handle 8 mm diameter, Straight Slender Tapered Blade 7 mm, Lipshultz Pattern | ASSI | ASSI.SAS15RVL | |
| Double Micro Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 18040-22 | |
| Elizabethan collar | Braintree Scientific | EC-R1 | |
| Forceps 13.5 cm long, Flat Handle, 9 mm wide Straight Tips 0.1 mm diameter (x2) | ASSI | ASSI.JFL31 | |
| Halsey Micro Needle Holder | Fine science tools (FST) | 12500-12 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star Elastic Stays | CooperSurgical | 3314-8G | Used to retract the inguinal ligament for femoral vessels dissection |
| Lone Star Self-Retaining Retractors | CooperSurgical | 3301G | |
| Micro-Mosquito Hemostats | Fine science tools (FST) | 13010-12 | Used to retract the inguinal fat pad distally |
| Needle Holder, 15 cm Round Handle, 8 mm diameter, Superfine Curved Jaw 0.2 mm tip diameter, without lock | ASSI | ASSI.B1582 | |
| Nylon Suture Black Monolfilament 8-0, 6.5 mm 3/8c | Ethilon | 2808G | Used to ligate collateral branches on the femoral vessels |
| Offset Bone Nippers | Fine science tools (FST) | 16101-10 | |
| S&T Vascular Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 00398-02 | |
| Walton scissors | Fine science tools (FST) | 14077-09 |
Referenzen
- Lanteiri, L., et al. Feasibility, reproducibility, risks and benefits of face transplantation: a prospective study of outcomes. American Journal of Transplantation. 11 (2), 367-378 (2011).
- Park, S. H., Eun, S. C., Kwon, S. T. Hand transplantation: current status and immunologic obstacles. Experimental and Clinical Transplantation. 17 (1), 97-104 (2019).
- Cetrulo, C. L., et al. Penis transplantation: first US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Grajek, M., et al. First complex allotransplantation of neck organs: larynx, trachea, pharynx, esophagus, thyroid, parathyroid glands, and anterior cervical wall: a case report. Annals of Surgery. 266 (2), 19-24 (2017).
- Pribaz, J. J., Caterson, E. J. Evolution and limitations of conventional autologous reconstruction of the head and neck. Journal of Craniofacial Surgery. 24 (1), 99-107 (2013).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. I. Results with syngeneic grafts. Transplantation. 35 (4), 293-299 (1983).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. II. Results with allogeneic grafts. Transplantation. 35 (4), 300-304 (1983).
- Adamson, L. A., et al. A modified model of hindlimb osteomyocutaneous flap for the study of tolerance to composite tissue allografts. Microsurgery. 27 (7), 630-636 (2007).
- Arav, A., Friedman, O., Natan, Y., Gur, E., Shani, N. Rat hindlimb cryopreservation and transplantation: a step toward "organ banking". American Journal of Transplantation. 17 (11), 2820-2828 (2017).
- Gok, E., et al. Development of an ex-situ limb perfusion system for a rodent model. ASAIO Journal. 65 (2), 167-172 (2019).
- Gok, E., Rojas-Pena, A., Bartlett, R. H., Ozer, K. Rodent skeletal muscle metabolomic changes associated with static cold storage. Transplantation Proceedings. 51 (3), 979-986 (2019).
- Brandacher, G., Grahammer, J., Sucher, R., Lee, W. P. Animal models for basic and translational research in reconstructive transplantation. Birth Defects Research. Part C, Embryo Today. 96 (1), 39-50 (2012).
- Fleissig, Y., et al. Modified heterotopic hindlimb osteomyocutaneous flap model in the rat for translational vascularized composite allotransplantation research. Journal of Visualized Experiments: JoVE. (146), e59458 (2019).
- Ulusal, A. E., Ulusal, B. G., Hung, L. M., Wei, F. C. Heterotopic hindlimb allotransplantation in rats: an alternative model for immunological research in composite-tissue allotransplantation. Microsurgery. 25 (5), 410-414 (2005).
- Jang, Y., Park, Y. E., Yun, C. W., Kim, D. H., Chung, H. The vest-collar as a rodent collar to prevent licking and scratching during experiments. Lab Anim. 50 (4), 296-304 (2016).
- Kern, B., et al. A novel rodent orthotopic forelimb transplantation model that allows for reliable assessment of functional recovery resulting from nerve regeneration. American Journal of Transplantation. 17 (3), 622-634 (2017).
- Perez-Abadia, G., et al. Low-dose immunosuppression in a rat hind-limb transplantation model. Transplant International. 16 (12), 835-842 (2003).
- Sucher, R., et al. Orthotopic hind-limb transplantation in rats. Journal of Visualized Experiments. (41), e2022 (2010).
- Fleissig, Y. Y., Beare, J. E., LeBlanc, A. J., Kaufman, C. L. Evolution of the rat hind limb transplant as an experimental model of vascularized composite allotransplantation: Approaches and advantages. SAGE Open Medicine. 8, 2050312120968721 (2020).
- Lindboe, C. F., Presthus, J. Effects of denervation, immobilization and cachexia on fibre size in the anterior tibial muscle of the rat. Acta Neuropathologica. 66 (1), 42-51 (1985).
- Nazzal, J. A., Johnson, T. S., Gordon, C. R., Randolph, M. A., Lee, W. P. Heterotopic limb allotransplantation model to study skin rejection in the rat. Microsurgery. 24 (6), 448-453 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten