Method Article
Lichtblattmikroskopie der schnellen Herzdynamik in Zebrafischembryonen
In diesem Artikel
Zusammenfassung
Wir beschreiben optimierte Werkzeuge zur Untersuchung des Zebrafischherzens in vivo mit Lichtblattfluoreszenzmikroskopie. Insbesondere schlagen wir helle kardiale transgene Linien vor und präsentieren neue sanfte Einbettungs- und Immobilisierungstechniken, die Entwicklungs- und Herzfehler vermeiden. Eine mögliche Datenerfassungs- und Analysepipeline, die an die kardiale Bildgebung angepasst ist, ist ebenfalls vorhanden.
Zusammenfassung
Die embryonale Herzforschung hat stark von den Fortschritten in der schnellen In-vivo-Lichtblattfluoreszenzmikroskopie (LSFM) profitiert. In Kombination mit der schnellen äußeren Entwicklung, der handhabbaren Genetik und der Transluzenz des Zebrafisches Danio rerio hat LSFM Einblicke in die Form und Funktion des Herzens mit hoher räumlicher und zeitlicher Auflösung ohne signifikante Phototoxizität oder Photobleichen geliefert. Die Bildgebung von schlagenden Herzen stellt bestehende Probenvorbereitungs- und Mikroskopietechniken in Frage. Man muss eine gesunde Probe in einem verengten Sichtfeld halten und ultraschnelle Bilder aufnehmen, um den Herzschlag aufzulösen. Hier beschreiben wir optimierte Werkzeuge und Lösungen, um das Zebrafischherz in vivo zu untersuchen. Wir demonstrieren die Anwendungen heller transgener Linien zur Markierung der Herzbestandteile und stellen neuartige sanfte Einbettungs- und Immobilisierungstechniken vor, die Entwicklungsdefekte und Veränderungen der Herzfrequenz vermeiden. Wir schlagen auch eine Datenerfassungs- und Analysepipeline vor, die an die kardiale Bildgebung angepasst ist. Der gesamte hier vorgestellte Workflow konzentriert sich auf die Bildgebung des embryonalen Herzens von Zebrafischen, kann aber auch auf verschiedene andere Proben und Experimente angewendet werden.
Einleitung
Um die komplexen Ereignisse und Wechselwirkungen im früh schlagenden Herzen aufzudecken, ist eine In-vivo-Bildgebung des gesamten Organs erforderlich. Mit ihrer minimalen Phototoxizität1,2,3, ihrer geringen Photobleichung4 und ihrer hohen Geschwindigkeit hat sich die Lichtblattmikroskopie zum primären Bildgebungsinstrument für die embryonale und kardiale Entwicklung entwickelt5,6. Es hat Einblicke in die Form und Funktion des Herzens mit einer hohen räumlichen und zeitlichen Auflösung geliefert7,8,9 und es den Forschern ermöglicht, fluoreszierend markierte Teile des Herzens mit hoher Geschwindigkeit abzubilden und zu verfolgen, hämodynamische Kräfte zu untersuchen und die Herzentwicklung direkt im Körper der sich entwickelnden Embryonen zu verfolgen6,10,11,12.
Um Zebrafische im Sichtfeld präzise und reproduzierbar einzuschränken, gibt es eine Vielzahl von Einbettungsprotokollen für Lichtbleche, kurz- und langfristig, sowie Einzel- oder Mehrfachproben13,14,15,16,17,18,19. Das gebräuchlichste Protokoll beinhaltet die Tricain-Ruhigstellung und die Agarosemontage in einem Glas- oder Kunststoffrohr. Da sich die Herzfrequenz jedoch aufgrund der verwendeten Temperatur, Anästhetika und des verwendeten Einbettungsmaterials ändern kann20,21,22 erfordert die Bildgebung des Zebrafisch-Herzs spezifische, schonende Protokolle, um die Gesundheit der Proben zu gewährleisten6,8,11,12,20,21,22,23 . Für die Kurzzeitbildgebung (bis zu einer Stunde) kann man den Fisch in 130 mg/L Tricain betäuben und in fluoriertes Ethylenpropylen (FEP) Röhrchen mit 0,1% iger Agaroselösung und einem Pfropfen einbetten, wie in Weber et al. 201416 beschrieben. Da Tricain jedoch zu Entwicklungsdefekten führen kann20,22 müssen für die Langzeitbildgebung unterschiedliche Protokolle verwendet werden.
Hier beschreiben wir eine neue Strategie für die langfristige kardiale Bildgebung. Während es viele Lichtblattimplementierungen gibt24, empfehlen wir die Verwendung einer hängenden Probe in einem T-SPIM-Mikroskop (eine Detektions- und zwei Beleuchtungslinsen in einer horizontalen Ebene, wobei die Probe vertikal im gemeinsamen Fokus hängt). Dies gibt die notwendige Bewegungs- und Rotationsfreiheit für die präzise Probenpositionierung. Die Fische werden immobilisiert, indem 30 pg α-Bungarotoxin-mRNA im ein- oder zweizelligen Stadium injiziert werden. α-Bungarotoxin ist ein Schlangengift, das die Muskeln lähmt, ohne die kardiovaskuläre Entwicklung oder Physiologie zu beeinträchtigen22. Für eine präzise, verzerrungsfreie Bildgebung empfehlen wir, Fische in Röhrchen aus FEP zu montieren, einem Polymer mit einem Brechungsindex, der fast identisch mit Wasser ist. Wir besprechen, wie die FEP-Röhrchen am besten vorbereitet werden können, indem sie vor der Bildgebung begradigt und gereinigt werden. Die Fische werden dann in diesen Röhren mit dem Kopf nach unten in Medien montiert, und der Boden des Rohres wird mit einem 2% igen Agarosepfropfen versiegelt, auf dem fischige Köpfe ruhen. Das Schneiden von Löchern in das FEP-Rohr erleichtert den Gasaustausch und sorgt für das Fischwachstum. Die eingebetteten Fische können in Medien aufbewahrt werden, bis sie direkt vor der Bildgebung auf einem Probenhalter montiert werden. Wir schlagen auch eine Datenerfassungs- und Analysepipeline für reproduzierbare Hochgeschwindigkeitsbildgebung vor. Darüber hinaus diskutieren wir die Verwendung von zytoplasmatischen versus Membranmarker-transgenen Linien für eine robuste Herzzellmarkierung sowie verschiedene Optionen, um das Herz zu stoppen. Diese Montagetechniken gewährleisten die Probengesundheit und ermöglichen es, das Herz präzise und reproduzierbar im Sichtfeld einzuschränken.
Protokoll
Alle Erwachsenen und Embryonen von Zebrafischen (Danio rerio) wurden gemäß den vom UW-Madison Institutional Animal Care and Use Committee (IACUC) genehmigten Protokollen behandelt.
1. Zubereitung von Zebrafischen
- Behandeln Sie Zebrafische gemäß den festgelegten Protokollen25,26 und institutionellen Richtlinien. Züchten Sie erwachsene Fische der gewünschten transgenen Linie (siehe Diskussion). Sammeln Sie die Embryonen und bewahren Sie sie bei 28 °C in einer Petrischale auf, die mit Fischmedium, z. B. E327, gefüllt ist.
- Wählen Sie eine Methode der Immobilisierung (siehe Diskussion).
- Wenn Sie α-Bungarotoxin-mRNA zur Immobilisierung des Fisches verwenden, injizieren Sie 30 pg mRNA22 in das Eigelb von Embryonen im Ein- oder Zweizellstadium mit einer Bohrungsglasnadel, die auf einem Mikromanipulator montiert und mit einem Picoinjektor verbunden ist28.
- Bei Verwendung von Tricain 0,4% ige Stammlösung auf pH 7,0-7,4 mit 1 M Tris-Base gepuffert und bei -20 °C bis zur Bildgebung lagern.
- Bewahren Sie die Eier in einer mit E3 gefüllten Petrischale bei 28 °C auf und geben Sie die Eier alle 24 h in eine neue Schale mit frischem E3 bis zur Bildgebung.
- Um die Pigmentbildung zu verhindern, wenn der Zebrafischhintergrund kein Albino ist, übertragen Sie fische 24 Stunden nach der Befruchtung (hpf) in eine neue E3-Schale mit 0,2 mM Tyrosinase-Inhibitor 1-Phenyl-2-Thioharnstoff (siehe Diskussion).
2. Vorbereitung von FEP-Röhrchen
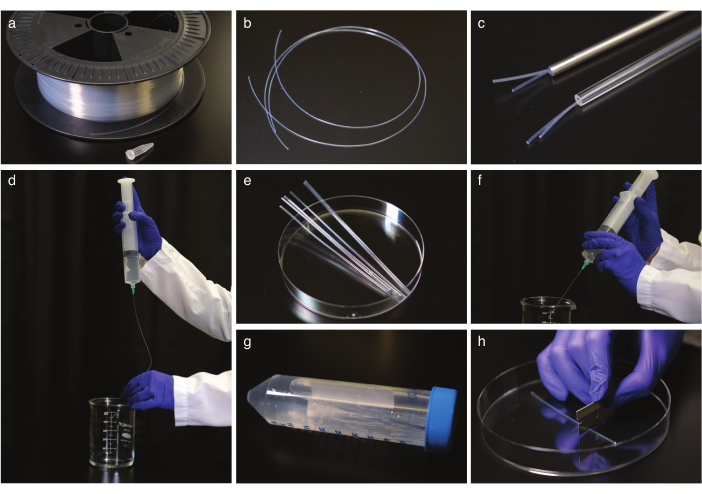
Abbildung 1: FEP-Rohrreinigung und -begradigung. (a) FEP-Rohre auf einer Kabeltrommel. b) FEP-Rohre vor dem Richten. c) FEP-Rohre aus autoklavsicheren Schläuchen aus Glas und Stahl. d) Spülen der FEP-Rohre nach dem Richten und Abkühlen. e) FEP-Rohr, das zur Beschallung auf die Größe eines Zentrifugenrohrs zugeschnitten ist. f) Spülen der FEP-Röhren nach der Beschallung. g) Lagerung der gereinigten und begradigten FEP-Röhrchen in einem Zentrifugenröhrchen. (h) Schneiden des FEP-Röhrchens vor der Bildgebung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Richten Sie die FEP-Rohre (Abbildung 1a,b) aus, indem Sie sie in ein autoklavsicheres Glas- oder Stahlrohr (Abbildung 1c) mit dem richtigen Innendurchmesser für FEP-Rohre, normalerweise 1,6 oder 2,4 mm, und Autoklaven bis 180 °C für 2 h legen. Lassen Sie die Schläuche bei Raumtemperatur mindestens 5 h abkühlen. Dann aus den Richtrohren entfernen.
HINWEIS: Verwenden Sie Handschuhe, wenn Sie die Schläuche manipulieren, und arbeiten Sie mit einem 50-cm-Schlauch auf einmal. - Reinigen Sie die FEP-Schläuche.
HINWEIS: Spritzen mit stumpfer Nadelspitze der inneren FEP-Röhrchengröße werden aus Sicherheitsgründen empfohlen, aber eine normale Nadel funktioniert.- Spülen Sie die Röhrchen zweimal mit 1 M NaOH mit einer 50 ml Spritze (Abbildung 1d).
- Schneiden Sie die FEP-Röhrchen mit einer Rasierklinge auf die Größe eines 50-ml-Zentrifugenröhrchens (Abbildung 1e), legen Sie die geschnittenen Röhrchen in 0,5 M NaOH-gefüllte Zentrifugenröhrchen und ultraschallisieren Sie sie 10 Minuten lang.
- Spülen Sie die FEP-Röhrchen mit doppelt destilliertem H2O und wiederholen Sie dann die Spülung mit 70% Ethanol (Abbildung 1f).
- Transferröhrchen zu 70% Ethanol und Ultraschall für 10 min.
- Spülen Sie die Röhrchen mit doppelt destilliertem H2O und lagern Sie sie in Zentrifugenröhrchen in doppelt destilliertem H2O (Abbildung 1g).
3. Zubereitung von 2% Agarosegericht
- In einem Glaskolben Agarosepulver mit niedrigem Schmelzpunkt in E3 lösen. Erhitzen Sie die Lösung in einer Mikrowelle und rühren Sie sie alle 20 Sekunden um, bis sich das gesamte Pulver aufgelöst hat.
- Gießen Sie Agarose in eine Glas- oder Kunststoff-Petrischale, um eine 1-2 mm dicke Schicht zu machen. Warten Sie, bis Agarose verfestigt ist.
- Um es aufzubewahren, gießen Sie E3 vorsichtig auf die Oberseite des Agars, um ein Austrocknen zu verhindern. In Paraffinfolie einwickeln und bei 4 °C aufbewahren.
4. Vorbereitung von Einbettungsmedien
- Bereiten Sie genügend E3 vor, um die Probenkammer zu füllen.
HINWEIS: Vermeiden Sie die Verwendung von Methylblau, wenn Medien mit Objektivlinsen in Berührung kommen. - Wenn Sie Tricain verwenden, tauen Sie die Stammlösung auf und geben Sie 0,02% Tricain zu E3 hinzu.
5. Probenmontage
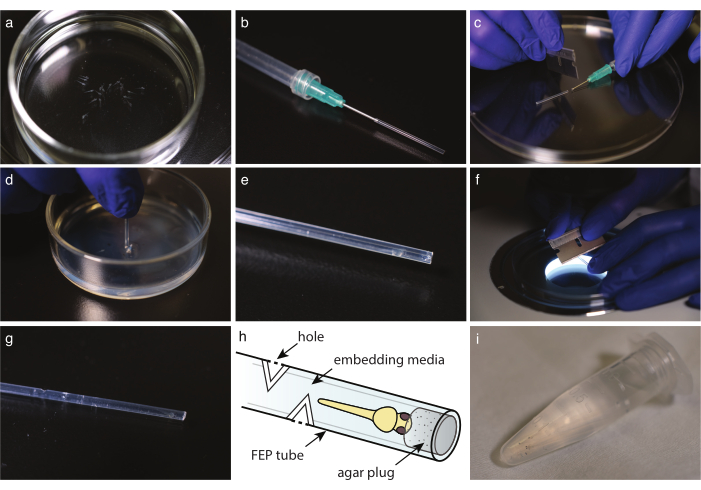
Abbildung 2: Embryonenmontage im FEP-Röhrchen. (a) Anästhesiepräsenter pigmentfreier Fisch in Befestigungsmedien. b) Eine Spritze mit stumpfer Endnadel und FEP-Schlauch. c) Sobald Medien und Fische im FEP-Röhrchen aufgenommen wurden, schneiden Sie das Röhrchen am Rand der Nadel auf. d) Eintauchen des geschnittenen Rohrs in eine mit 2 % Agarose beschichtete Schale, um das Ende zu verstopfen. e) Ein Zebrafisch in einem verstopften FEP-Röhrchen. f) Schneiden Sie das FEP-Rohr vorsichtig um 30°, um Gasaustauschlöcher zu erzeugen. g) FEP-Rohr mit vier Löchern über einem eingebetteten Zebrafisch. h) Schema eines Zebrafisches, der in eine FEP-Röhre eingebettet ist. Löcher und Agarstopfen sind angegeben. (i) Mehrere eingebettete Zebrafische, die für die Bildgebung bereit sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Mit einer Einweg-Glaspipette die Fische in einbettende Medien überführen (Abbildung 2a). Wenn Sie Tricain verwenden, geben Sie den Fisch 10 Minuten vor der Bildgebung in eine mit tricainhaltigem E3 gefüllte Petrischale. In beiden Fällen können Sie unter ein Stereomikroskop schauen, um zu überprüfen, ob sich der Fisch nicht mehr bewegt und dass das Herz im Vergleich zur Steuerung mit der gleichen Geschwindigkeit schlägt.
- Schneiden Sie das FEP-Rohr mit einer Rasierklinge auf die ideale Länge (Abbildung 1h).
HINWEIS: Die Länge sollte an den Probenhalter des Mikroskops angepasst werden. die typische Länge beträgt ca. 3 cm. - Bereiten Sie eine Spritze mit einer stumpfen Endkanüle vor. Füllen Sie die Spritze mit Luft, montieren Sie dann das FEP-Röhrchen auf die Nadel und spülen Sie das verbleibende Wasser vorsichtig aus, indem Sie die Spritze entleeren (Abbildung 2b).
HINWEIS: Vermeiden Sie es, Blasen zu machen, indem Sie die Luft langsam ausspülen. - Nehmen Sie mit dem an der Spritze montierten FEP-Röhrchen zuerst Medien auf, um das FEP-Röhrchen zu füllen, und nehmen Sie dann einen Embryo mit dem Kopf nach unten auf. Halten Sie den Fischkopf so nah wie möglich am Röhrenende. Vermeiden Sie es, Blasen zu machen; Wenn eine Blase vorhanden ist, verwerfen Sie die Probe.
- Schneiden Sie mit einer Rasierklinge das FEP-Röhrchen vorsichtig am Rand der stumpfen Endkanüle oder -nadel ab (Abbildung 2c).
- Entsorgen Sie alle Flüssigkeiten auf der Oberseite der mit Agar überzogenen Schüssel. Tauchen Sie das FEP-Rohr direkt in das Agar (Abbildung 2d). Drehen Sie das Rohr und nehmen Sie es heraus, um den Stecker aus dem Agarosebett zu lösen.
- Überprüfen Sie unter einem Stereoskop das Vorhandensein des Agarstopfens am Ende der Röhre (Abbildung 2e).
- Für die Langzeitbildgebung schneiden Sie 3-5 Löcher in das FEP-Rohr in jeder Himmelsrichtung, mindestens 5 mm über dem Ende des Fisches.
- Verwenden Sie unter einem Stereoskop eine Rasierklinge senkrecht zur Röhrenachse, um einen 30°-Schnitt in das FEP-Rohr zu machen, bis das Montagemedium erreicht ist (Abbildung 2f).
- Machen Sie einen zweiten Schnitt bei 180°, um ein Loch zu erzeugen (Abbildung 2g,h).
- Transfer des montierten Embryokopfes nach unten in ein 1,5 ml Mikrozentrifugenröhrchen mit Einbettungsmedien, bis er bildbereit ist (Abbildung 2i).
6. Probenpositionierung

Abbildung 3: Probenkammer. (a) FEP-Röhrchen, das auf einem Probenhalter montiert ist. b) Die Stichprobenkammer mit Stufen und Zielen. (c) Draufsicht auf die mit Medien gefüllte Probenkammer mit Beleuchtung und Detektionsobjektiv in einer T-SPIM-Konfiguration. d) Am Mikroskop montierter Probenhalter mit der Probe in der Kammer. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
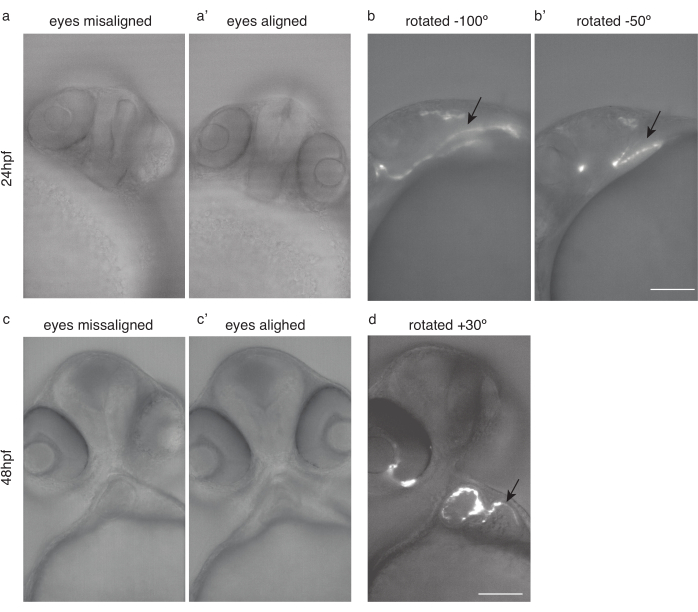
Abbildung 4: Embryonenpositionierung für die Herzbildgebung. (a) 24 hpf Tg(kdrl:Hsa.HRAS-mCherry) Zebrafisch mit falsch ausgerichteten Augen. a') Derselbe Fisch, mit ausgerichteten Augen. (b) Derselbe Fisch gedreht -100 ° und (b') -50 ° für eine optimale Herzbildgebung. c) 48 hpf Zebrafisch mit falsch ausgerichteten Augen. c') Derselbe Fisch, mit ausgerichteten Augen. (d) Derselbe Fisch wurde für eine optimale Herzbildgebung um 30° gedreht. Schwarze Pfeile zeigen auf das Herz. Maßstabsleiste 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Montieren Sie am Mikroskop das FEP-Röhrchen in den Probenhalter (Abbildung 3a) und füllen Sie die Bildgebungskammer mit Einbettungsmedien (Abbildung 3b,c). Als nächstes legen Sie den Probenhalter auf die Bühne, wobei die Probe in die Kammer eintaucht (Abbildung 3d).
- Überprüfen Sie den Zustand der Probe. Beurteilen Sie die Herzfrequenz visuell, um das allgemeine Wohlbefinden der Fische zu bewerten, da die spezifische Herzfrequenz von Stufe und Temperatur abhängt, indem Sie sie mit nicht montierten Kontrollfischen vergleichen. Wenn der Herzschlag zu langsam ist, entsorgen Sie den Fisch.
HINWEIS: Sorgen Sie für eine schonende Behandlung der Embryonen, einen sorgfältigen Transfer auf einbettende Medien, eine Bildgebung unmittelbar nach der Einbettung, die Vermeidung schneller Temperaturänderungen, die Vermeidung von Tricain und eine Verringerung der Expositionszeit gegenüber Tricain. - Für eine reproduzierbare Bildgebung immer die gleiche Probenposition verwenden. Es wird empfohlen, die Augen auszurichten und in einem Winkel abzubilden.
- Drehen Sie den Fisch so, dass sich beide Augen (Abbildung 4a,c) in der Fokusebene befinden (Abbildung 4a',c')
- Drehen Sie den Fisch von dieser Position aus weiter um etwa 50 ° -100 ° im Uhrzeigersinn für eine 24 hpf-Bildgebung (Abbildung 4b, b') und ungefähr 20 ° -30 ° gegen den Uhrzeigersinn für eine 48 hpf-Bildgebung (Abbildung 4d).
HINWEIS: Das frühe Herz vor 30 hpf kann aufgrund seiner versteckten Position schwer abzubilden sein (Abbildung 4b).
7. Bilderfassung
- Wählen Sie die Beleuchtungsseite, die die beste Bildqualität bietet und passen Sie die Laserleistung an jeden Fisch an.
HINWEIS: Zeichnen Sie die für die nachfolgende Bildanalyse verwendete Laserleistung auf. - Zeichnen Sie an jeder Z-Ebene 4-5 Herzschläge mit 300 Bildern pro Sekunde (fps) oder mehr auf.
HINWEIS: Das Sichtfeld kann zugeschnitten werden, um die Erfassungsgeschwindigkeit zu erhöhen. Zum Beispiel schlägt das Zebrafischherz bei 48 hpf zwei- bis dreimal pro Sekunde, daher sind bei 300 fps zwischen 300 und 600 Frames erforderlich, um vier bis sechs Herzschläge zu erfassen. - Um das schlagende Herz aufzunehmen, bewegen Sie die Probe schrittweise durch das Lichtblatt. Verwenden Sie einen z-Abstand von 1-2 μm, der die gesamte Tiefe des Herzens abdeckt.
8. Bildverarbeitung
- Synchronisieren Sie den aufgenommenen Film, um ein 4D-Herz (x, y, z, Zeit) mit einem Fiji-Plugin (Bild J229,30) zu rekonstruieren, wie zuvor beschrieben6.
- Um Daten zu untersuchen und Filme des gerenderten Zebrafischherzens zu generieren, laden Sie die 4D-Datei (x, y, z, Zeit) in eine 3D-Rendering-Software.
Ergebnisse
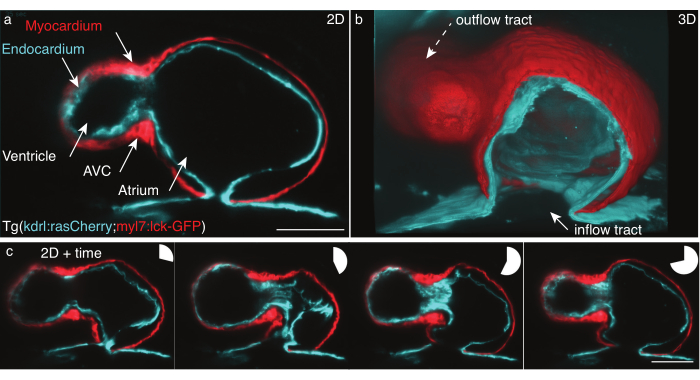
Abbildung 5: Das 48 hpf Zebrafischherz. (a) Standbild eines Z-Frames, anterior-ventrale Ansicht von 48 hpf Tg(kdrl:Hsa.HRAS-mCherry; myl7:lck-EGFP) Zebrafisch, abgebildet mit LSFM, (b) 3D-Rekonstruktion von Filmstapeln, Schnittansicht durch das Atrium. (c) Montage von vier Frames über einen vollen Herzschlag auf einer Z-Ebene. Kreisdiagramme zeigen die Zeit während des Herzschlags an. Maßstabsleiste 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Wir haben das 48 hpf schlagende Herz von Tg(kdrl:Hsa.HRAS-mCherry; myl7:lck-EGFP) Zebrafisch gemäß dem oben beschriebenen Protokoll aufgezeichnet (Abbildung 5). Eine 488 nm und eine 561 nm Laserlichtplatte beleuchteten die Probe gleichzeitig. Die emittierte Fluoreszenz wurde senkrecht mit einer 16x/0,8 W Objektivlinse und einer wissenschaftlichen Metalloxid-Halbleiterkamera (sCMOS) detektiert.
Bei 48 hpf hat das Herz gerade eine Schleife durchlaufen und hat zwei Kammern, den Ventrikel und den Vorhof, muss aber noch Klappen entwickeln. In unseren Filmen sind die verschiedenen Herzstrukturen wie Zuflusstrakt, Ventrikel, atrioventrikulärer Kanal (AVC), Atrium und Abflussspur leicht unterscheidbar (Abbildung 5a,b). Diese Daten zeigen das genaue Schlagen und zeigen komplexe Wechselwirkungen zwischen den beiden Zellschichten des Herzens: dem Myokard, einer einzelligen Muskelschicht, die sich zusammenzieht und Kraft erzeugt (Abbildung 5c, rot), und dem Endokard, einer einzelnen Zellschicht, die das Herz mit dem Gefäßsystem verbindet (Abbildung 5c, Cyan).
Die Herzschlagrekonstruktion in x,y,z (3D) + Zeit (4D) + Farbe (5D) wurde nach Mickoleit et al.6 durchgeführt. Die Rekonstruktion basiert auf zwei Hypothesen: Die Bewegung des Herzens wiederholt sich, und die Daten sollten mit einem kleinen z-Schritt erfasst werden. Die Ausgabe ist ein rekonstruierter Einzeltakt in 5D, der 30 GB bis 80 GB pro Heartbeat misst. Zum Rendern der Daten haben wir das kostenlose Open-Source-Tool FluoRender für das Tiefenrendering31 verwendet, da es für die Verarbeitung mehrdimensionaler Datensätze und das einfache Rendern von 5D-Filmen sowohl von Zellebenen als auch von einzelnen Schichten entwickelt wurde (Abbildung 5b).
Diskussion
Transgene Linien zur Abbildung des Herzens
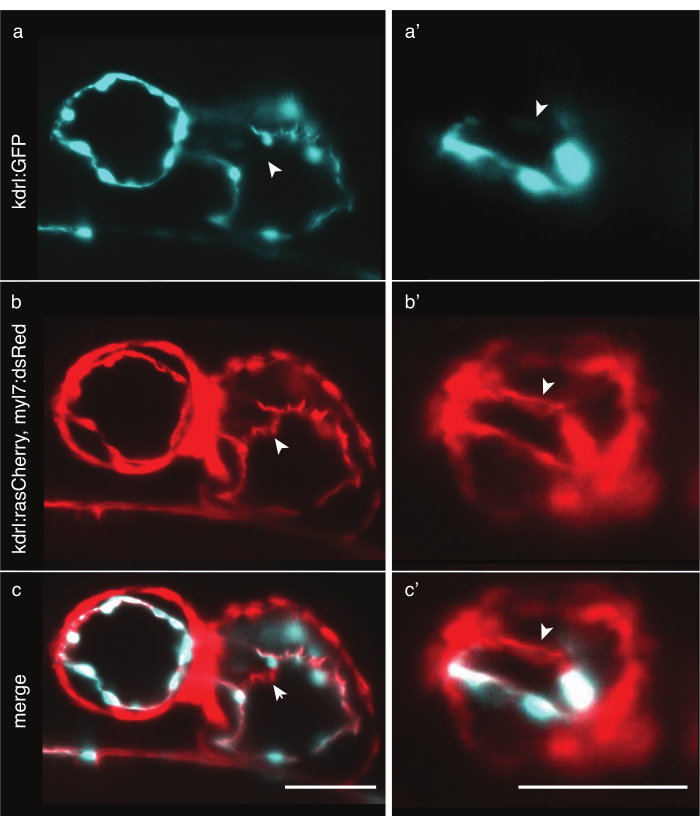
Abbildung 6: Vergleich von zytoplasmatischen und Membranmarker-Zebrafisch-transgenen Linien. Anterior-ventrale Ansicht von 48 hpf Zebrafischherzen, aufgenommen mit LSFM. Weiße Pfeile zeigen Strukturen an, die nur mit einer transgenen Membranmarkerlinie sichtbar sind. (a) Tg(kdrl:EGFP)32 Signal in Cyan im Herzen und (a') im Ventrikel. (b) Tg(kdrl:Hsa.HRAS-mCherry; myl7:dsRed)33 Signal in rot im Herzen und (b') im Ventrikel. ( c,c') Verschmelzung von Tg(kdrl:Hsa.HRAS-mCherry; myl7:dsRed) und Tg(kdrl:EGFP) Signal. Maßstabsleiste 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Abbildung des Zebrafischherzens erfordert eine präzise Herzzellmarkierung. Während die Myokarddicke in den Zellen relativ konstant ist, sind Endokardzellen dick um den Kern herum, haben aber dünne Membranvorsprünge, in einigen Regionen dünner als 2 μm. Zytoplasmatische transgene Linien wie Tg(kdrl:EGFP)32 markieren effektiv die Regionen um Endokardkerne, aber weiter entfernt emittiert das dünne Zytoplasma möglicherweise nicht genügend Photonen, um mit so kurzen Expositionszeiten nachgewiesen zu werden, was zu künstlichen Löchern in den Daten führt (Abbildung 6a). Im Gegensatz dazu können transgene Membranmarkerlinien wie Tg(kdrl:Hsa.HRAS-mCherry)33 das Endokard effektiv markieren und mehr Details offenbaren (Abbildung 6b,c). Wählen Sie für jedes Experiment sorgfältig die am besten geeignete transgene Linie aus.
Immobilisierung von Zebrafischen
Die Wahl der Immobilisierungstechnik hängt von der Länge des Experiments und dem Alter des Fisches ab. Tricain wurde häufig für die Immobilisierung von Zebrafischen verwendet, hauptsächlich aufgrund seiner Benutzerfreundlichkeit. In der Tat führt die einfache Zugabe von 130 mg / L Tricain zu den Fischmedien zu ihrer Betäubung in 10 Minuten. Da es zu Entwicklungsstörungen führen und die Herzphysiologie beeinflussen kann20,22 empfehlen wir, Tricain nur für kurze Experimente (weniger als 30 min) zu verwenden. Bei längerer Bildgebung lähmen α-Bungarotoxin-mRNA-Injektionen im ein- oder zweizelligen Stadium fische bis zu 3 Tage nach der Befruchtung (dpf), ohne die kardiovaskuläre Entwicklung oder Physiologie zu beeinträchtigen22.
Auswahl der richtigen FEP-Röhren
FEP-Rohre sind in verschiedenen Durchmessern und Stärken erhältlich. Um 0-5 dpf Fische abzubilden, sind 0,8 mm ein guter Innendurchmesser; Wählen Sie entweder dickwandige 0,8 x 1,6 mm Rohre oder dünnwandige 0,8 x 1,2 mm Rohre. Wir empfehlen dünnwandige Rohre; Dickere Wände bieten jedoch eine erhöhte Stabilität und Steifigkeit, was wichtig sein kann, wenn die Probenkammer über fließende Medien verfügt, die ein dünnes Rohr stören und bewegen könnten. Für größere Proben können 1,6 x 2,4 mm und 2 x 3 mm verwendet werden.
Temperatur- und Gasaustausch
Ein wesentlicher Aspekt des Wohlbefindens des Zebrafisch-Embryos ist die Temperatur. Idealerweise halten Sie den Fisch während der Bildgebung bei 28,5 ° C, da die Umgebungstemperatur die Entwicklung und die Herzfrequenz beeinflusst34.
Nach unserer Erfahrung hält der Sauerstoffaustausch durch den 2% igen Agarosepfropfen nur eine stabile Herzfrequenz bis 3-4 dpf aufrecht. Daher sorgt das Schneiden von Löchern in der Röhre für sauerstoffdiffusion. Es kann auch für die Arzneimittelabgabe an die Probe erforderlich sein, falls gewünscht.
Aussetzung des Herzschlags.
Die schnellen Erfassungsgeschwindigkeiten entsprechend ausgestatteter Lichtblattmikroskope ermöglichen die Aufnahme des schlagenden Herzens in vivo. Um jedoch einen ungestörten Z-Stack zu erwerben, kann man das Herz verlangsamen oder stoppen. Das Anhalten des Herzens führt jedoch zu einer Entspannung des Herzmuskels und kann zum Zusammenbruch des Herzens führen6. Die Herzschlagsuspension kann unter Verwendung von Morpholinos, niedrigen Temperaturen, einem Inhibitor der Muskelkontraktion oder Optogenetik erfolgen. Diese Methoden haben jeweils ihre Nachteile und müssen für jedes Experiment sorgfältig evaluiert werden.
Die Injektion von 4 ng Silent Heart (sih) Morpholino im Einzelzellstadium kann den Herzschlag stoppen, indem sie auf das Gen tnnt2a abzielt, das für die Sarkomerbildung entscheidend ist35. sih Zebrafische haben keinen Herzschlag und überleben nur bis 7 dpf, wenn die Embryonen beginnen, sich auf zirkulierendes Blut für die Sauerstoffversorgung zu verlassen. Da die Herzmorphogenese sowohl von genetischen als auch von biomechanischen Kräften angetrieben wird36, weisen diese Fische Herzfehlbildungen um 3 dpf auf.
Da der Fluss von Ca2+ temperaturempfindlich ist, beeinflusst die Temperatur die Herzfrequenz bei embryonalen Zebrafischen21. Folglich verlangsamt das Absenken der Temperatur in der Bildgebungskammer den Herzschlag. Um den Herzschlag zu stoppen, sind Temperaturen unter 15 °C erforderlich. Da Zebrafische in der Regel bei 28,5 °C gehalten werden, können solche niedrigen Temperaturen nur für kurze Zeiträume (weniger als 10 min) gehalten werden.
Medikamente wie chemische Inhibitoren von Muskelkontraktionen, 2,3-Bu-Tanedion-2-Monoxim (BDM), können dem Zebrafischmedium (50 nM37,38) zugesetzt werden, um den Herzschlag vorübergehend auszusetzen. BDM ist bequem zu verwenden, da es die Herzkontraktion in weniger als 15 Minuten stoppt und weggewaschen werden kann, um die Herzfunktion wiederherzustellen. Da BDM jedoch das Herzaktionspotential verändert, muss es mit Vorsicht angewendet werden37.
Schließlich kann das Herz transgener Zebrafische, die lichtgesteuerte Ionenkanäle oder Pumpen wie Channelrhodopsin oder Halorhodopsin in ihrem Myokard exprimieren, manipuliert und gestoppt werden, indem der Schrittmacher am Zuflusstrakt mit Licht beleuchtet wird39,7,40,41,9.
Aussicht
Die vorgestellten optimierten Werkzeuge und Lösungen zur Untersuchung des Zebrafischherzens in vivo ermöglichen eine langfristige, schonende Bildgebung der ultraschnellen Herzdynamik. Die Probeneinbettung kann an verschiedene Bildgebungsmodalitäten wie konfokale Mikroskopie, Zwei-Photonen-Mikroskopie oder optische Projektionstomographie (OPT) angepasst werden. Die Lichtblattmikroskopie ist jedoch wahrscheinlich die bevorzugte Technik, die eine optische Schnittgeschwindigkeit mit einer Geschwindigkeit bietet, die ausreicht, um die Dynamik des Herzens zu erfassen. Während sich dieses Protokoll auf die Bildgebung des embryonalen Herzens von Zebrafischen konzentriert, glauben wir, dass es auch auf verschiedene andere Proben und Experimente angewendet werden könnte. Es wird interessant sein, in Zukunft zu sehen, ob ähnliche Einbettungs- und Bildgebungsverfahren auch in späteren Stadien während der Entwicklung eingesetzt werden können, wenn das Herz verborgener und die Larve weniger durchscheinend ist.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Wir danken Madelyn Neufeld für die Illustration in Abbildung 2h. Diese Arbeit wurde von der Max-Planck-Gesellschaft, dem Morgridge Institute for Research, der Chan Zuckerberg Initiative und dem Human Frontier Science Program (HFSP) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5mL Eppendorf | Eppendorf | 22364111 | To carry embedded samples |
| 15mL Falcon tubes | Falcon | 352095 | To carry embedded samples |
| 50mL centrifuge tubes | Falcon | 352070 | 50ml tubes for sonication step, and storing cleaned, straightened FEP tubes |
| 50mL syringe | BD | 309654 | 50ml syringe for FEP cleaning |
| Agarose, low gelling temperature | Sigma Aldrich | 39346-81-1 | To make plug |
| Blunt Tip Needles, 21 gauge | VWR | 89500-304 | Blunt end needle for 0.8 inner diameter FEP tube |
| Borosilicate glass tube | McMaster-Carr | 8729K33 | Tubing for FEP tube straightening 9.5mm outer diameter, 5.6 inner diameter, 30cm long, other sizes available |
| Borosilicate glass tube | McMaster-Carr | 8729K31 | Tubing for FEP tube straightening 6.35mm outer diameter, 4mm inner diameter, 30cm long, other sizes available |
| Conventional needles, 21 Gauge | BD | 305165 | Conventional needle for 0.8 inner diameter FEP tube |
| Disposable glass pipette | Grainger | 52NK56 | To transfer fish, use with pipette pump |
| E3 medium for zebrafish embryos | |||
| Ethanol | Sigma Aldrich | 64-17-5 | Ethanol for FEP cleaning |
| FEP tube, 0.8 / 1.2 mm | ProLiquid | 2001048 | FEP tube with thin wall, other sizes available |
| FEP tube, 0.8 / 1.6 mm | Bola | S1815-04 | FEP tube with thick wall, other sizes available |
| FEP tube, 2/3mm | BGB | 211581 | Large FEP tube with thick wall, other sizes available |
| Hot Hand Rubber Mitt | Cole-Parmer | 691000 | To carry hot equipment after autoclaving |
| Omnifix 1mL Syringes | B Braun | 9161406V | 1ml syringe for embedding |
| Petri dish, small | Dot Scientific | PD-94050 | To make agarose plug |
| Pipette pumps | Argos Technologies | 04395-05 | To transfer fish, use with disposable glass pipette |
| PTU | Sigma Aldrich | 103-85-5 | Also known as: N-Phenylthiourea, 1-Phenyl-2-thiourea, Phenylthiocarbamide |
| Razor blades | Azpack | 11904325 | To cut FEP tubes |
| Sodium Hydroxide | Dot Scientific | DSS24000 | NaOH for FEP cleaning |
| Tricaine | Sigma Aldrich | E10521 | Also known as: MS-222, Ethyl 3-aminobenzoate methanesulfonate, Tricaine |
Referenzen
- Hoebe, R. A., et al. Controlled light-exposure microscopy reduces photobleaching and phototoxicity in fluorescence live-cell imaging. Nature Biotechnology. 25 (2), 249-253 (2007).
- Jenielita, M., Taormina, M. J., Delaurier, A., Kimmel, C. B., Parthasarathy, R. Comparing phototoxicity during the development of a zebrafish craniofacial bone using confocal and light sheet fluorescence microscopy techniques. Journal of Biophotonics. 6 (11-12), 920-928 (2013).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (8), 1700003 (2017).
- Reynaud, E. G., Kržič, U., Greger, K., Stelzer, E. H. K. Light sheet-based fluorescence microscopy: more dimensions, more photons, and less photodamage. Human Frontier Science Program Journal. 2 (5), 266-275 (2008).
- Weber, M., Huisken, J. Light sheet microscopy for real-time developmental biology. Current Opinion in Genetics & Development. 21 (5), 566-572 (2011).
- Mickoleit, M., et al. High-resolution reconstruction of the beating zebrafish heart. Nat Methods. 11 (9), 919-922 (2014).
- Arrenberg, A. B., Stainier, D. Y., Baier, H., Huisken, J. Optogenetic control of cardiac function. Science. 330 (6006), 971-974 (2010).
- Trivedi, V., et al. Dynamic structure and protein expression of the live embryonic heart captured by 2-photon light sheet microscopy and retrospective registration. Biomed Optics Express. 6 (6), 2056-2066 (2015).
- Weber, M., Yelon, D., et al. Cell-accurate optical mapping across the entire developing heart. eLife. 6, 28307 (2017).
- Weber, M., Huisken, J. In vivo imaging of cardiac development and function in zebrafish using light sheet microscopy. Swiss Medical Weekly. 145, 14227 (2015).
- Fei, P., et al. Cardiac light-sheet fluorescent microscopy for multi-scale and rapid imaging of architecture and function. Science Reports. 6 (1), 1-12 (2016).
- Felker, A., et al. Continuous addition of progenitors forms the cardiac ventricle in zebrafish. Nature Communication. 9 (1), 1-14 (2018).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Keller, P. J., Pampaloni, F., Stelzer, E. H. Life sciences require the third dimension. Current Opinion in Cell Biology. 18 (1), 117-124 (2006).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. K. Reconstruction of zebrafish early embryonic development by scanned light sheet microscopy. Science. 322 (5904), 1065-1069 (2008).
- Weber, M., Mickoleit, M., Huisken, J. Multilayer mounting for long-term light sheet microscopy of zebrafish. Journal of Visualized Experiments. (84), e51119 (2014).
- Berndt, F., Shah, G., Power, R. M., Brugués, J., Huisken, J. Dynamic and non-contact 3D sample rotation for microscopy. Nature Communications. 9 (1), 1-7 (2018).
- Daetwyler, S., Günther, U., Modes, C. D., Harrington, K., Huisken, J. Multi-sample SPIM image acquisition, processing. and analysis of vascular growth in zebrafish. Development. , 173757 (2019).
- Keomanee-Dizon, K., Fraser, S. E., Truong, T. V. A versatile, multi-laser twin-microscope system for light-sheet imaging. Review of Scientific Instruments. 91 (5), 053703 (2020).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139 (17), 3242-3247 (2012).
- Gierten, J., et al. Automated high-throughput heartbeat quantification in medaka and zebrafish embryos under physiological conditions. Science Reports. 10 (1), 1-12 (2020).
- Swinburne, I. A., Mosaliganti, K. R., Green, A. A., Megason, S. G. Improved long-term imaging of embryos with genetically encoded α-bungarotoxin. PLOS ONE. 10 (8), 0134005-0134015 (2015).
- Taylor, J. M., et al. Adaptive prospective optical gating enables day-long 3D time-lapse imaging of the beating embryonic zebrafish heart. Nature Communication. 10 (1), 1-15 (2019).
- Power, R. M., Huisken, J. A guide to light-sheet fluorescence microscopy for multiscale imaging. Nature Methods. 14 (4), 360-373 (2017).
- Nüsslein-Volhard, C., Dahm, R. . Zebrafish: A Practical Approach. , (2002).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Cold Spring Harbor. E3 medium (for zebrafish embryos). Cold Spring Harbor Protocols. 2011, 66449 (2011).
- Yuan, S., Sun, Z. Microinjection of mRNA and morpholino antisense oligonucleotides in zebrafish embryos. Journal of Visualized Experiments. (27), e1113 (2009).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Jin, S. -. W., Beis, D., Mitchell, T., Chen, J. -. N., Stainier, D. Y. Cellular and molecular analyses of vascular tube and lumen formation in zebrafish. Development. 132 (23), 5199-5209 (2005).
- Chi, N. C., et al. Foxn4 directly regulates tbx2b expression and atrioventricular canal formation. Genes and Development. 22 (6), 734-739 (2008).
- Scott, G. R., Johnston, I. A. Temperature during embryonic development has persistent effects on thermal acclimation capacity in zebrafish. Proceedings of the National Academy of Sciences. 109 (35), 14247-14252 (2012).
- Sehnert, A. J., et al. Cardiac troponin T is essential in sarcomere assembly and cardiac contractility. Nature Genetics. 31 (1), 106-110 (2002).
- Sidhwani, P., Yelon, D., Wellik, D. M. Fluid forces shape the embryonic heart: Insights from zebrafish. Current Topics in Developmental Biology. 132, 395-416 (2019).
- Jou, C. J., Spitzer, K. W., Tristani-Firouzi, M. Blebbistatin effectively uncouples the excitation-contraction process in zebrafish embryonic heart. Cell Physiology and Biochemistry. 25 (4-5), 419-424 (2010).
- Chow, R. W. -. Y., Lamperti, P., Steed, E., Boselli, F., Vermot, J. following endocardial tissue movements via cell photoconversion in the zebrafish embryo. Journal of Visualized Experiments. (132), e57290 (2018).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proccedings of the National Academy of Sciences. 100 (24), 13940-13945 (2003).
- Knollmann, B. C. Pacing lightly: optogenetics gets to the heart. Nature Methods. 7 (11), 889-891 (2010).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten