Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Förster Resonanz-Energietransfermessungen in lebenden Pflanzenzellen
In diesem Artikel
Zusammenfassung
Es wird ein Protokoll für die Einrichtung eines konfokalen Standard-Laser-Scanning-Mikroskops für in vivo Förster-Resonanzenergieübertragungsmessungen mit anschließender Datenauswertung bereitgestellt.
Zusammenfassung
Experimente mit sensibilisierter Emissionsbasis des Förster-Resonanz-Energietransfers (FRET) sind einfach durchzuführen, hängen jedoch vom mikroskopischen Aufbau ab. Konfokale Laser-Scanning-Mikroskope sind zu einem Arbeitstier für Biologen geworden. Kommerzielle Systeme bieten eine hohe Flexibilität bei der Laserleistungsanpassung und Detektorempfindlichkeit und kombinieren oft verschiedene Detektoren, um das perfekte Bild zu erhalten. Der Vergleich von intensitätsbasierten Daten aus verschiedenen Experimenten und Aufbauten ist aufgrund dieser Flexibilität jedoch oft unmöglich. Biologenfreundliche Verfahren sind von Vorteil und ermöglichen eine einfache und zuverlässige Anpassung der Laser- und Detektoreinstellungen.
Da FRET-Experimente in lebenden Zellen von der Variabilität der Proteinexpression und des Spender-Akzeptor-Verhältnisses beeinflusst werden, müssen Proteinexpressionsniveaus für die Datenauswertung berücksichtigt werden. Beschrieben wird hier ein einfaches Protokoll für zuverlässige und reproduzierbare FRET-Messungen, einschließlich Routinen zur Abschätzung der Proteinexpression und Anpassung der Laserintensität und der Detektoreinstellungen. Die Datenauswertung erfolgt durch Kalibrierung mit einer Fluorophorfusion bekannter FRET-Effizienz. Um die Einfachheit zu verbessern, wurden Korrekturfaktoren verglichen, die in Zellen und durch Messung rekombinanter fluoreszierender Proteine erhalten wurden.
Einleitung
Der Förster-Resonanzenergietransfer ((F)RET) wird typischerweise durch Fluoreszenzspektroskopie beobachtet, obwohl der Prozess selbst nicht auf die Durchführung zwischen Fluorophoren beschränkt ist. Die zugrunde liegende Dipol-Dipol-Kopplung erfordert lediglich ein lichtemittierendes Donormolekül und einen lichtabsorbierenden Akzeptor. Dies leitet sich aus dem erforderlichen spektralen Überlappungsintegrat J der normierten Donoremissions- und Akzeptorabsorptionsspektren1 ab. Da RET jedoch mit der Fluoreszenz konkurriert, wird der Energietransfer durch Änderungen der Fluoreszenzemission messbar: RET induziert Donorabschreckung und sensibilisierte Akzeptoremission.
Fluorophor-basierte RET wurde als Fluoreszenz-Resonanz-Energietransfer (FRET) bezeichnet, um sie von der Biolumineszenz-Resonanz-Energieübertragung (BRET) zu trennen. Die RET hängt stark vom Abstand zwischen Donor und Akzeptor ab, der weit im Bereich von 0,5-10 nm2 liegt und damit im gleichen Bereich wie die Abmessungen von Proteinen und ihren Komplexen liegt. Zweitens hängt die RET von der Dipol-Dipol-Orientierung kappa im Quadrat ab. In Kombination mit der Tatsache, dass die Rotationsfreiheit von proteingebundenen Fluorophoren aufgrund des Molekulargewichts und der langsamen Rotationsrelaxation vernachlässigt werden kann, ermöglicht RET die Analyse von Konformationsveränderungen3.
Der sogenannte Försterradius basiert auf dem spektralen Überlappungsintegral und dem Wellenlängenbereich der Überlappung, so dass rotlichtabsorbierende Chromophore zu längeren Försterradien führen als blaulichtabsorbierende Farbstoffe. Da der Dynamikbereich der FRET-Messungen durch 0,5 × R0 und 1,5 × R0 begrenzt ist, hat das FRET-Paar ECFP-EYFP aufgrund seines R0 von 4,9 nm4 einen Dynamikbereich von 2,5-7,3 nm.
Die Helligkeit eines Fluorophors ist durch das Produkt seines molaren Extinktionskoeffizienten und seiner Quantenausbeute gegeben. Für FRET-Messungen ist es vorteilhaft, Fluorophore mit nahezu ähnlicher Helligkeit zu wählen. Dies verbessert den Nachweis von Donorabschreckung und sensibilisierter Akzeptoremission. Es begünstigt auch die Kalibrierung des Mikroskopiesystems. Betrachtet man die häufig verwendeten FRET-Paare von Cyan- und fluoreszierenden Proteinen, wird die geringere Helligkeit der cyanfluoreszierenden Proteine deutlich (Abbildung 1A).
Die Lebensdauer des Akzeptors muss jedoch niedriger sein als die Lebensdauer des Spenders, um die Verfügbarkeit des Akzeptors für die Energieübertragung sicherzustellen. Wenn die Lebensdauer des Akzeptors die Lebensdauer des Spenders überschreitet, befindet sich der Akzeptor möglicherweise noch im angeregten Zustand, wenn der Spender erneut angeregt wird. Fortschrittliche cyan fluoreszierende Proteine wie mTurquoise zeigen eine verlängerte Lebensdauer und tragen somit zu einer erhöhten WAHRSCHEINLICHKEIT von FRET bei (Abbildung 1B). Die Wahrscheinlichkeit einer FRET hängt auch vom molaren Extinktionskoeffizienten des Akzeptors ab.
Protokoll
HINWEIS: Für das folgende Protokoll wurde eine transiente Transfektion von Protoplasten durchgeführt, wie zuvor beschrieben12. Im Folgenden finden Sie eine kurze Beschreibung.
1. Transiente Transfektion von Protoplasten
- Schneiden Sie ~4 g gesunde Blätter von Arabidopsis thaliana ecotype Columbia in 1 mm dicke Scheiben und übertragen Sie sie auf 20 ml Enzymlösung (1,5% Cellulase; 0,4% Macerozym; 0,1% RinderserumalbuminFraktion V; 0,4 M Mannitol; 20 mM KCl; 20 mM 2-(N-Morpholino)ethansulfonsäure (MES), pH 5,7; 10 mM CaCl2).
- Vakuuminfiltrieren Sie die Blattscheiben, gefolgt von einer Inkubation mit Rührung für 2 h bei Raumtemperatur. Ernten Sie die Zellen durch Zentrifugation für 3 min bei 100 × g.
- Die Protoplasten werden mit W5-Lösung (154 mM NaCl; 125 mM CaCl2; 5 mM KCl; 2 mM MES, pH 5,7) gewaschen und in MMG-Lösung (0,4 M Mannitol; 15 mM MgCl2; 4 mM MES, pH 5,7) resuspendiert.
- Führen Sie die Transfektion in einem 8-Well-Objektträger durch osmotischen Schock in Gegenwart von Polyethylenglykol (PEG) 4000 durch. Mischen Sie 20 μL der Protoplastensuspension mit 5 μL Plasmid-DNA (5 μg/μL) und 25 μL PEG-Lösung (0,2 M Mannitol, 0,1 M CaCl2, 40% PEG 4000).
- Kehren Sie den osmotischen Schock durch sanftes Nachjustieren der osmotischen Bedingungen um.
ANMERKUNG: Neben der interessierenden Stichprobe ist die Expression des Donors allein und des Akzeptors allein erforderlich, um das spektrale Durchbluten des Donors bzw. des Akzeptors zu bestimmen. Ein Fusionsprotein des Donors und des Akzeptors muss ebenfalls zu Kalibrierzwecken exprimiert werden. Die fluoreszierende Proteinexpression stand unter der Kontrolle eines Blumenkohlmosaikvirus 35S Promotors (pCaMV35S). Für alle Messungen wurden zwei konfokale Laser-Scanning-Mikroskope (LSM1 und LSM2) verwendet. LSM1 verfügt über zwei Arten von Detektoren: Für FRET-Messungen wurde das Donorsignal von einem GaAsP-Detektor detektiert, während FRET- und Akzeptoremission mit einem Photomultiplier aufgezeichnet wurden. LSM2 verfügt über zwei Photomultiplier, die zum Nachweis von Donor-, FRET- und Akzeptoremissionen verwendet wurden.
2. Laser-Einstellung
HINWEIS: Hier wurden 458 nm und 514 nm Linien eines Argon-Ionen-Lasers für die FRET-Analyse zwischen Enhanced Cyan Fluorescent Protein (ECFP)- und Enhanced Yellow Fluorescent Protein (EYFP)-markierten Proteinen angewendet. Zur reproduzierbaren Datenerfassung wurden beide Linien auf eine ähnliche Intensität eingestellt. Dies wurde entweder durch einen Transmissionsphotomultiplier oder den Reflexionsmodus erreicht.
- Lasereinstellung mit einem Transmissionsphotomultiplier
- Verwenden Sie einen leeren Brunnen zur Anpassung.
- Wählen Sie den Zeilenscanmodus und die Histogrammansicht.
- Verringern Sie die Laserintensität auf ein Minimum und passen Sie die Detektorverstärkung an erkennbare Hintergrundgeräusche an.
- Erhöhen Sie die Laserintensität in Schritten von 0,5% und zeichnen Sie das entsprechende Signal auf.
- Wenden Sie die Routine für beide Laserlinien an.
- Lasereinstellung mit Reflexionsmodus
- Verwenden Sie einen leeren Brunnen zur Anpassung.
- Wenden Sie einen Reflexionsfilter an und schalten Sie den Reflexionsmodus ein, falls verfügbar.
- Stellen Sie sicher, dass der Wellenlängenbereich des Detektors die Wellenlänge des Lasers abdeckt.
- Wählen Sie den Zeilenscanmodus und die Histogrammansicht.
- Verringern Sie die Laserintensität auf ein Minimum und passen Sie die Detektorverstärkung an erkennbare Hintergrundgeräusche an.
- Verschieben Sie das Ziel an die niedrigste Position.
- Bewegen Sie das Ziel nach oben, bis die Reflexion des Deckglases sichtbar ist.
- Erhöhen Sie die Laserintensität in Schritten von 0,5% und zeichnen Sie das entsprechende Signal auf.
- Wenden Sie die Routine für beide Laserlinien an.
- Datenauswertung
- Tabellieren Sie die Daten und sortieren Sie die Daten nach Signalintensitäten.
- Zeichnen Sie die Signalintensitäten gegen die relative Laserleistung auf.
- Wählen Sie Laserintensitäten, die zu einer ähnlichen Signalintensität führen.
3. Einstellung von Photomultipliern
HINWEIS: Nach der Laseranpassung wurden die Photomultiplier an einzelne Gewinne angepasst, um eine ähnliche Empfindlichkeit zu erhalten. Diese Kalibrierung wurde mit der 514 nm Laserlinie durchgeführt, die sich im Zentrum des interessierenden Wellenlängenbereichs befindet.
- Verwenden Sie einen leeren Brunnen zur Anpassung.
- Wenden Sie einen Reflexionsfilter an, und wechseln Sie in den Reflexionsmodus, falls verfügbar.
- Stellen Sie sicher, dass der Wellenlängenbereich des Detektors die Wellenlänge des Lasers (514 nm) abdeckt.
- Wählen Sie den Zeilenscanmodus und die Histogrammansicht.
- Verringern Sie die Detektorverstärkung auf die Hälfte des Maximums und passen Sie die Laserintensität an erkennbare Hintergrundgeräusche an.
- Verschieben Sie das Ziel an die niedrigste Position.
- Bewegen Sie das Ziel nach oben, bis die Reflexion des Deckglases sichtbar ist.
- Erhöhen Sie die Detektorverstärkung in Schritten von 50 bis 100 V und zeichnen Sie das entsprechende Signal auf.
- Wenden Sie die Schritte 3.1 bis 3.8 für beide Detektoren an.
- Datenauswertung
- Zeichnen Sie die Intensität gegen die Detektorverstärkung für jeden Detektor auf.
- Wählen Sie die einzelnen Detektorgewinne, um eine ähnliche Empfindlichkeit zu erhalten.
4. FRET-Bilderfassung
HINWEIS: Beginnen Sie mit der interessanten Stichprobe für die Einrichtung der Bilderfassung.
- Wählen Sie die geeigneten Filter/dichroiten Spiegel, z.B. einen doppelten dichroitischen Spiegel MBS 458/514 für das FRET-Paar ECFP/EYFP. Verwenden Sie für alle Kanäle denselben dichroitischen Spiegel, um zeilenweises Scannen zu ermöglichen. Wählen Sie ein Wasserimmersionsobjektiv für die Bildgebung lebender Zellen. Wählen Sie 12-Bit- oder 16-Bit-Scanning und moderate Scangeschwindigkeit.
- Definieren Sie den Nachweisbereich, vorzugsweise 470-510 nm für den Spenderdetektion und 530-600 nm für den Akzeptor-/FRET-Nachweis im Fall von ECFP/EYFP. Wenn Sie einen 445 nm oder 440 nm Diodenlaser verwenden, verwenden Sie 450 bis 510 nm als Erfassungsbereich. Definieren Sie im Falle eines akusto-optischen Strahlteilers (AOBS) die Donordetektion im Bereich von 450 bis 500 nm, um eine Erkennung unerwünschter Akzeptoren zu verhindern.
- Wenden Sie die Detektoreinstellung gemäß 3.10.2 an.
- Wenden Sie die Lasereinstellung gemäß 2.3.2 an. Überarbeiten Sie bei Bedarf die Laserintensität basierend auf der erhaltenen Laserleistungstabelle. Stellen Sie sicher, dass das Signal-Rausch-Verhältnis den gesamten Dynamikbereich der Detektoren abdeckt (Intensität von 0 bis 4095 für 12-Bit-Scanning).
- Halten Sie die Laserintensitäten und Detektorgewinne konstant. Verwenden Sie den Lochdurchmesser für die Feinabstimmung.
HINWEIS: Beachten Sie, dass Änderungen des Lochdurchmessers die räumliche Auflösung beeinflussen. - Führen Sie die Messungen durch (nehmen Sie Bilder von mindestens 20 Zellen auf).
5. Ermittlung von Übersprechkorrekturen
HINWEIS: Zellen, die nur den Donor oder den Akzeptor exprimieren, müssen das Donor Spectral Bleed-Through (DSBT) bzw. das Acceptor Spectral Bleed-Through (ASBT) bestimmen. Behalten Sie die in Abschnitt 4 beschriebenen Einstellungen bei.
- Führen Sie FRET-Messungen mit Zellen durch, die das Donorfluorophor exprimieren.
- Führen Sie FRET-Messungen mit Zellen durch, die den Akzeptorfluorophor exprimieren.
6. Kalibrierung der Messungen nach Beemiller et al.13
HINWEIS: Es werden Zellen benötigt, die eine Donor-Akzeptor-Fusion mit bekannter FRET-Effizienz exprimieren. Hier kam eine ECFP-5 aa-EYFP-Fusion mit einem FRET Wirkungsgrad von 0,46 zum Einsatz4. Behalten Sie die in Abschnitt 4 beschriebenen Einstellungen bei.
- Führen Sie FRET-Messungen mit Zellen durch, die die Donor-Akzeptor-Fusion exprimieren
7. Datenauswertung
- Rufen Sie Linienprofile der Zellen ab, und stellen Sie sicher, dass jedes Profil nicht mehr als eine Zelle enthält. Speichern Sie die Profile als Textdateien.
- Importieren Sie die Textdateien mithilfe der Option zum Importieren von Textdateien im Abschnitt Daten in eine Tabelle.
- Lesen Sie die Maximalwerte aus, indem Sie die Max-Funktion anwenden.
- Listen Sie die erhaltenen Werte in einer Tabelle auf, haben Sie jeweils eine Spalte für Donor-Emissions-ID, FRET-Emission IF, Akzeptor-Emission IA und mindestens vier Datensätze: nur Donor, Nur Akzeptor, Donor-Akzeptor-Fusion und Messung.
HINWEIS: Die Anregung des Donors führt auch zu einer direkten Anregung des Akzeptors und verursacht ASBT, das durch den α Wert beschrieben wird. - Berechnen Sie die ASBT-α-Werte mit dem reinen Akzeptor-Dataset unter Verwendung von Gleichung (1).
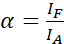 (1)
(1)
HINWEIS: Verwenden Sie den Median aller α-Werte in den folgenden Gleichungen. Der Donor zeigt ein breites Emissionsspektrum, das zu einem Emissionsübersprechen mit der sensibilisierten Emission des Akzeptors führt. Dieser DSBT wird durch den β-Wert angegeben. - Berechnen Sie die Spektraldurchblutungswerte des Spenders β mit dem reinen Spenderdatensatz unter Verwendung von Gleichung (2).
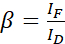 (2)
(2)
HINWEIS: Verwenden Sie den Median aller β Werte in den folgenden Gleichungen. Der Kalibrierfaktor ξ beschreibt die lineare Beziehung von FRET-abgeleiteter Donorabschreckung und sensibilisierter Emission des Akzeptors. Verwenden Sie in den folgenden Gleichungen die Mediane von 7,5 und 7,6. - Berechnen Sie die Kalibrierfaktoren ξ mit dem Donor-Akzeptor-Fusionsdatensatz und seiner FRET-Effizienz E (0,46) unter Verwendung der Gleichung (3).
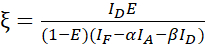 (3)
(3)
HINWEIS: Verwenden Sie den Median aller ξ-Werte in den folgenden Gleichungen. - Berechnen Sie die FRET-Wirkungsgrade des interessierenden Proteinpaares anhand der Gleichungen (4) und (5).
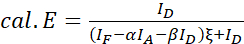 (4)
(4)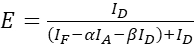 (5)
(5) - Schätzen Sie die Auswirkungen der Expressionsstärke und/oder des Donor-Akzeptor-Verhältnisses: Zeichnen Sie die Summe von ID, IF und IA gegen die FRET-Wirkungsgrade auf. Führen Sie eine lineare Regression durch. Beachten Sie, dass je steiler der Graph und je höher R2 ist, desto höher ist der Einfluss des Expressionsniveaus oder desto größer ist die Differenz der Donor- und Akzeptorhäufigkeit.
Ergebnisse
Justierung des konfokalen Laser-Scanning-Mikroskops
Die Lasereinstellung ergab eine lineare Zunahme der Emission mit zunehmender Laserintensität (Abbildung 2 und Tabelle 1). Wie für Argon-Ionen-Laser zu erwarten, war die Emission der 514-nm-Linie viel höher als die Emission der 458-nm-Linie, wie eine steilere Steigung belegt. Für nachfolgende Experimente wurde eine Laserleistung von 4,5% bzw. 6,5% für die 514-nm-Linie bzw. die 458-nm-Linie gewählt. ...
Diskussion
Die Donorabschreckung und die sensibilisierte Akzeptoremission zeichnen sich durch eine lineare Beziehung aus, die eine donor- oder akzeptorbasierte Berechnung der FRET ermöglicht. Die entsprechenden Faktoren der Linearität werden entweder G-Faktor (Donor zu Akzeptor) oder xi (Akzeptor zu Donor) genannt, die reziproke Werte sind4. Die Messung des FRET zwischen fluoreszierenden Proteinen mittels Fluoreszenzmikroskopie erfordert aufgrund der breiten Absorptions- und Emissionsspektren der fluoreszi...
Offenlegungen
Wir stellen sicher, dass alle Autoren alle Interessenkonflikte offengelegt haben und keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Die Experimente wurden an der Technologieplattform Lichtmikroskopie (LiMiTec) der Fakultät für Biologie der Universität Bielefeld durchgeführt. Diese Arbeit wurde von der Universität Bielefeld gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| 8-well slides | Ibidi | 80821 | |
| Immersion oil Immersol W2010 | Zeiss | 444969-0000-000 | refraction index of water |
| LSM 1: AxioObserver with LSM 780 scan head, confocal laser scanning microscope | Zeiss | ||
| LSM 2: AxioObserver with LSM 5 scan head, confocal laser scanning microscope | Zeiss |
Referenzen
- Lakowicz, J. R. . Principles of Fluorescent Spectroscopy. Third Edition. , (2006).
- Clegg, R. M. Förster resonance energy transfer- FRET what it is, why do it, and how it's done. Laboratory Techniques in Biochemistry and Molecular Biology. 33, 1-57 (2009).
- Vogel, S. S., Nguyen, T. A., vander Meer, B. W., Blank, P. S. The impact of heterogeneity and dark acceptor states on FRET: implications for using fluorescent protein donors and acceptors. PLoS ONE. 7, 49593 (2012).
- Müller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Förster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Science. 4, 413 (2013).
- Gadella, T. W. J., vander Krogt, G. N., Bisseling, T. GFP-based FRET-microscopy in living plant cells. Trends in Plant Science. 4, 287-291 (1999).
- Van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86, 2517-2529 (2004).
- Seidel, T., Golldack, D., Dietz, K. J. Mapping of C-termini of V-ATPase subunits by in vivo-FRET measurements. FEBS Letters. 579, 4374-4382 (2005).
- Seidel, T., Schnitzer, D., Golldack, D., Sauer, M., Dietz, K. J. Organelle-specific iso-enzymes of plant V-ATPase as revealed by in vivo-FRET. BMC Cell Biology. 9, 28 (2008).
- Schnitzer, D., Seidel, T., Sander, T., Golldack, D., Dietz, K. J. The cellular energization state affects peripheral stalk stability of plant vacuolar H+-ATPase and impairs vacuolar acidification. Plant Cell Physiology. 52, 946-956 (2011).
- Roshchina, V. V. Vital autofluorescence: application to the study of plant living cells. International Journal of Spectroscopy. 2012, 124672 (2012).
- Holtorf, S., Apel, K., Bohlmann, H. Comparison of different constitutive and inducible promoters for the overexpression of transgenes in Arabidopsis thaliana. Plant Molecular Biology. 29, 637-646 (1995).
- Seidel, T., et al. Colocalization and FRET-analysis of subunits c and a of the vacuolar H+-ATPase in living plant cells. Journal of Biotechnology. 112 (1-2), 165-175 (2004).
- Beemiller, P., Hoppe, A. D., Swanson, J. A. A phosphatidylinositol-3-kinase-dependent signal transition regulates ARF1 and ARF6 during FCγ receptor-mediated phagocytosis. PLoS Biology. 4, 162 (2006).
- Lambert, T. J. FPbase: a community-editable fluorescent protein database. Nature Methods. 16, 277-278 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten