Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Thrombozyten-abgeleitete extrazelluläre Vesikelfunktionalisierung von Ti-Implantaten
In diesem Artikel
Zusammenfassung
Hier stellen wir eine Methode zur Isolierung von extrazellulären Vesikeln (EVs) vor, die von den Thrombozytenlysaten (PL) abgeleitet sind, und deren Verwendung zur Beschichtung von Titan (Ti) Implantatoberflächen. Wir beschreiben das Drop-Casting-Beschichtungsverfahren, das EVs-Freisetzungsprofil von den Oberflächen und die In-vitro-Biokompatibilität von EVs beschichteten Ti-Oberflächen.
Zusammenfassung
Extrazelluläre Vesikel (EVs) sind biologische Nanovesikel, die eine Schlüsselrolle in der Zellkommunikation spielen. Ihr Inhalt umfasst aktive Biomoleküle wie Proteine und Nukleinsäuren, die ein großes Potenzial in der regenerativen Medizin darstellen. In jüngerer Zeit haben EVs, die von Thrombozytenlysat (PL) abgeleitet wurden, eine osteogene Fähigkeit gezeigt, die mit PL vergleichbar ist. Außerdem werden Biomaterialien häufig in der Orthopädie oder Zahnrestauration eingesetzt. Hier stellen wir eine Methode zur Funktionalisierung von Ti-Oberflächen mit PL-abgeleiteten EVs zur Verfügung, um ihre osteogenen Eigenschaften zu verbessern.
EVs werden durch Größenausschlusschromatographie von PL isoliert, und anschließend werden Ti-Oberflächen mit PL-EVs durch Drop-Casting funktionalisiert. Die Funktionalisierung wird durch die Freisetzung von EVs und ihre Biokompatibilität durch den Laktatdehydrogenase (LDH) -Freisetzungsassay nachgewiesen.
Einleitung
EVs sind Membranvesikel (30-200 nm), die von jeder Zelle sezerniert werden und eine Schlüsselrolle in der Zell-zu-Zell-Kommunikation spielen, indem sie ihre Fracht liefern. Sie enthalten eine Vielzahl von aktiven Biomolekülen, die Nukleinsäuren, Wachstumsfaktoren oder bioaktive Lipide enthalten können1. Aus diesen Gründen wurden EVs auf ihren potenziellen Einsatz in Therapeutika hin untersucht. In Bezug auf Orthopädie und Knochenregeneration wurden EVs aus verschiedenen Quellen getestet. Unter ihnen wurde gezeigt, dass Thrombozyten-abgeleitete EVs einen Differenzierungseffekt auf Stammzellen induzieren und gleichzeitig ein niedriges zytotoxisches Profil beibehalten2,3. Daher ist weitere Forschung erforderlich, um die Möglichkeit der Kombination von Elektrofahrzeugen mit Biomaterialien zu untersuchen, um sie in der täglichen klinischen Praxis zu verwenden.
Biomaterialien auf Titanbasis werden aufgrund ihrer mechanischen Eigenschaften, ihrer hohen Biokompatibilität und ihrer langfristigen Haltbarkeit häufig als Gerüste für klinische Eingriffe zur Knochenheilung eingesetzt4. Dennoch sind Ti-Implantate ein bioinertes Material und weisen daher eine schlechte Bindungsfähigkeit mit dem umgebenden Knochengewebe auf5. Aus diesem Grund werden Titanmodifikationen untersucht, um ihre Leistung zu verbessern, indem eine funktionellere Mikroumgebung auf ihrer Oberfläche erreicht wird4,6,7. In diesem Sinne können EVs durch chemische8 oder physikalische Wechselwirkungen an Titan verankert werden9,10. Immobilisierte EVs, die aus Stammzellen oder Makrophagen gewonnen werden, verbessern die Bioaktivität von Ti, indem sie die zelluläre Adhäsion und Proliferation fördern und dadurch eine osteogene Wirkung hervorrufen8,9,10.
Dieser Artikel konzentriert sich im Detail auf eine Tropfengussstrategie für die Beschichtung von Ti-Oberflächen mit PL-abgeleiteten Elektrofahrzeugen. Darüber hinaus werden wir das Freisetzungsprofil von Elektrofahrzeugen von der beschichteten Oberfläche im Laufe der Zeit bewerten und seine zelluläre Biokompatibilität in vitro bestätigen.
Protokoll
Thrombozytenlysat (PL) wird wie zuvor beschrieben in Übereinstimmung mit den institutionellen Richtlinien3 unter Verwendung von frischen Büffelmänteln gewonnen, die von der IdISBa Biobank als Ausgangsmaterial zur Verfügung gestellt werden. Ihre Verwendung für das aktuelle Projekt wurde von ihrer Ethikkommission genehmigt (IB 1995/12 BIO).
1. EVs Isolierung von PL
- Entfernung größerer Körper
- PL bei Raumtemperatur auftauen.
- Zentrifuge PL bei 1.500 x g für 15 min bei 4 °C. Entsorgen Sie das Pellet, da es Zellablagerungen enthält.
- Sammeln Sie den Überstand und führen Sie zwei aufeinanderfolgende Zentrifugationen bei 10.000 x g für 30 min bei 4 °C durch.
HINWEIS: Das Pellet entspricht größeren Elektrofahrzeugen wie Mikrovesikeln und wird in diesem Fall verworfen. - Filtern Sie den Überstand zuerst durch 0,8 μm poröse Membran und dann durch 0,2 μm poröse Membran.
HINWEIS: Mit diesen Schritten werden alle nicht gewünschten EVs entfernt. - Den gefilterten PL in einem Pool auffüllen und bis zum Gebrauch bei -20 °C lagern.
- Größenausschlusschromatographie
- Die an Chromatographiegeräte gekoppelte Säule wird mit der gewünschten Durchflussrate mit gefiltertem PBS ausgeglichen.
ANMERKUNG: Der verwendete Durchfluss hängt von den Spalteneigenschaften ab. in diesem Fall wird sie auf 0,5 ml/min eingestellt. - Laden Sie das verarbeitete PL (5 ml) mit einer Spritze auf das Gerät.
- Injizieren Sie das PL in die Säule und beginnen Sie, 5 ml Fraktionen in 15 ml Röhrchen zu sammeln.
- Sammeln Sie die mit Elektrofahrzeugen angereicherten Fraktionen und lagern Sie sie bis zum Gebrauch bei -80 °C.
HINWEIS: Wenn Sie das Experiment zum ersten Mal durchführen, charakterisieren Sie alle Fraktionen durch Proteinquantifizierung und Immundetektion, um diejenige zu bestimmen, die mit EVs angereichert ist3,11. In diesem Experiment wird die 9. Fraktion gesammelt. - Waschen Sie die chromatographische Säule mit 30 ml 0,2% iger NaOH-Lösung und lagern Sie sie in 20% iger Ethanollösung, sobald sie das Gleichgewicht erreicht hat.
- Die an Chromatographiegeräte gekoppelte Säule wird mit der gewünschten Durchflussrate mit gefiltertem PBS ausgeglichen.
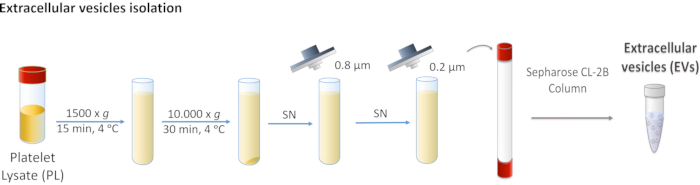
Abbildung 1: Schematische Darstellung der Isolierung von extrazellulären Vesikeln (EVs) durch Thrombozytenlysat (PL). PL wird zuerst bei 1.500 x g und dann bei 10.000 x g zentrifugiert, um größere Körper zu entfernen. Der Überstand wird durch 0,8- und 0,2-μm-Filter filtriert. Verarbeitetes PL wird auf die Säule geladen, und EVs werden durch Größenausschlusschromatographie getrennt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Charakterisierung von Elektrofahrzeugen
HINWEIS: Die Charakterisierung von Elektrofahrzeugen ist notwendig, um funktionelle Studien durchzuführen12. Über Elektronenmikroskopie oder Western-Blot-Charakterisierung wurde bereits berichtet13. Dieser Bericht konzentriert sich auf die wesentlichen Charakterisierungstechniken für die Ti-Oberflächenfunktionalisierung.
- Nanopartikel-Tracking-Analyse (NTA)
- Verdünnen Sie die EVs (1:1000) in 0,2 μm gefiltertem PBS.
HINWEIS: Zu konzentrierte Proben oder zu verdünnte Proben liegen außerhalb des Bereichs für die NTA-Bestimmung, und es ist eine Anpassung erforderlich. - Laden Sie 1 ml der verdünnten EVs mit einer Spritze auf die NTA-Ausrüstung und injizieren Sie sie in die NTA-Ausrüstung.
- Befolgen Sie das Protokoll des Herstellers zur Bestimmung der Partikelkonzentration und der Größenverteilung.
- Verdünnen Sie die EVs (1:1000) in 0,2 μm gefiltertem PBS.
- Proteinkonzentration
- Bestimmen Sie die Konzentration mit 1 μL der EVs-Lösung. Messen Sie die Absorption mit einem Spektralphotometer bei einer Wellenlänge von 280 nm.
HINWEIS: EVs sollten im Vergleich zur Anzahl der Partikel einen geringen Proteingehalt aufweisen. - Befolgen Sie die Anweisungen des Herstellers, um den Absorptionswert mit dem Spektralphotometer zu erhalten.
- Bestimmen Sie die Konzentration mit 1 μL der EVs-Lösung. Messen Sie die Absorption mit einem Spektralphotometer bei einer Wellenlänge von 280 nm.
3. Titan-Oberflächenfunktionalisierung
HINWEIS: Bei diesem Verfahren werden bearbeitete Titanscheiben, c.p. Grad IV, 6,2 mm Durchmesser und 2 mm Höhe, verwendet. Die Scheiben können mit einer Ti-Pinzette manipuliert werden, aber es ist wichtig, nicht an der Oberfläche zu kratzen. Darüber hinaus muss die bearbeitete Seite während des gesamten Prozesses nach oben zeigen.
- Ti Discs waschen
HINWEIS: Das Volumen der für das Ti-Waschen verwendeten Lösungen sollte ausreichen, um Ti-Platten abzudecken. Legen Sie Ti-Scheiben in ein Glasbecherglas und gießen Sie Lösungen darauf. Entfernen Sie dann die Lösung durch Dekantieren.- Waschen Sie Ti-Implantate mit entionisiertem (DI) Wasser und entsorgen Sie dann das Wasser.
- Waschen Sie Ti-Implantate mit Ethanol 70% und dekantieren Sie dann, um die Lösung zu entfernen.
- Setzen Sie die Implantate in DI-Wasser und beschallen Sie sie bei 50 °C für 5 min. Entsorgen Sie das Wasser.
- Inkubieren Sie Ti-Implantate in einer 40% igen NaOH-Lösung bei 50 °C für 10 min unter Rühren. Verwerfen Sie die Lösung.
ACHTUNG: NaOH-Lösung erwärmt sich während der Zubereitung. Die Lösung ist korrosiv und sollte in einem Abzug verwendet werden. - Beschallen Sie die Implantate in DI-Wasser bei 50 °C für 5 min und entfernen Sie dann das Wasser.
- Führen Sie mehrere Wäschen mit DI-Wasser (mindestens 5) durch, bis der neutrale pH-Wert erreicht ist. Überprüfen Sie den pH-Wert mit pH-Indikatoren.
- Die Implantate in DI-Wasser bei 50 °C für 5 min beschallen und das Wasser entfernen.
- Inkubieren Sie Ti-Implantate in einer 50% igen HNO3-Lösung bei 50 °C für 10 min unter Rühren. Entfernen Sie die Lösung.
VORSICHT: HNO3 ist eine korrosive und oxidierende Substanz und sollte in einem Abzug verwendet werden. - Beschallung der Implantate in DI-Wasser bei 50 °C für 5 min. Entfernen Sie das Wasser.
- Führen Sie mehrere Wäschen mit DI-Wasser (mindestens 5) durch, bis ein neutraler pH-Wert erreicht ist. Überprüfen Sie den pH-Wert mit pH-Indikatoren.
- Beschallung der Implantate in DI-Wasser bei 50 °C für 5 min. Entfernen Sie das Wasser.
HINWEIS: An diesem Punkt kann das Experiment gestoppt werden, indem Ti-Implantate in einer 70% igen Ethanollösung gelagert werden.
- Ti Passivierung
HINWEIS: Ti-Passivierungsschritte werden durchgeführt, indem Ti-Discs vollständig mit den verschiedenen Lösungen in der unten aufgeführten Reihenfolge abgedeckt werden. Ti-Scheiben werden in ein Glasbecherglas gelegt und Lösungen werden sanft auf sie gegossen. Die in allen Waschschritten verwendeten Volumina müssen die Implantate vollständig bedecken und werden durch Dekantieren entfernt.- Inkubieren Sie die Ti-Implantate in einer 30% HNO3-Lösung für 30 min bei Raumtemperatur unter sanfter Bewegung. Entfernen Sie die Lösung.
- Führen Sie mehrere Wäschen mit DI-Wasser (mindestens 5) durch, bis der neutrale pH-Wert erreicht ist. Überprüfen Sie den pH-Wert mit pH-Indikatoren.
- Inkubieren Sie Ti-Implantate über Nacht bei Raumtemperatur in DI-Wasser.
- Trocknen Sie die Implantate unter Vakuumbedingungen bei 40 °C für 10 min ab.
- EVs Drop Casting
HINWEIS: Für Zellfunktionsstudien ist es wichtig, in einem Zellkulturschrank zu arbeiten.- Legen Sie die Ti-Implantate in eine 96-Well-Platte, wobei die bearbeitete Seite nach oben zeigt.
HINWEIS: Wenn die Implantate auf den Kopf gestellt werden, kann eine Nadel verwendet werden, um sie zurückzusetzen. - Tauen Sie die EVs-Lösung auf und mischen Sie sie mit Rührung. Verwenden Sie einen Wirbel, um für 3 s zu pulsieren.
- Legen Sie die EVs auf der Ti-Oberfläche ab. In dieser Studie werden Tropfen von 40 μL EVs-Lösung auf das Ti gegeben, um maximal 4 x 1011 EVs pro Implantat entsprechend der durch NTA bestimmten Konzentration zu immobilisieren.
- Stellen Sie die Platten mit dem Ti unter Vakuumbedingungen bei 37 °C auf, bis die Tropfen vollständig trocken sind (~2 h).
HINWEIS: Stellen Sie die Zeit in Abhängigkeit von der Anzahl der Implantate und dem in der Vakuumkammer vorhandenen Wasser ein.
- Legen Sie die Ti-Implantate in eine 96-Well-Platte, wobei die bearbeitete Seite nach oben zeigt.
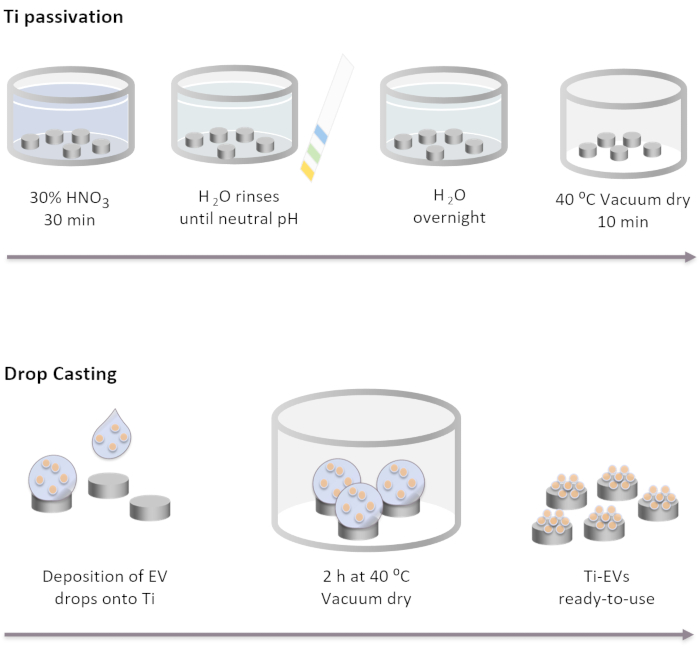
Abbildung 2: Schematische Darstellung der Ti-Passivierung und der Funktionalisierung von Elektrofahrzeugen durch Tropfenguss. Ti-Implantate werden zunächst durch Inkubation für 30 min in einer 30% igen HNO3-Lösung bei Raumtemperatur passiviert. Nach mehreren Wäschen mit DI-Wasser erreicht der pH-Wert neutral. Dann werden Ti-Implantate über Nacht bei Raumtemperatur in DI-Wasser inkubiert. Danach werden die Implantate unter Vakuumbedingungen bei 40 °C abgetrocknet. Für die Immobilisierung von Elektrofahrzeugen werden 40 μL EVs-Lösung auf Ti-Implantate aufgefüllt. Als nächstes werden Implantate im Vakuum für 2 h inkubiert, bis EVs physisch an die Oberfläche gebunden sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Ti-Oberflächencharakterisierung
- Release-Studie
- Inkubieren Sie die Ti-Oberfläche mit 200 μL gefiltertem PBS bei 37 °C.
HINWEIS: PBS wird gefiltert, um Interferenzen mit der NTA-Messung zu vermeiden. - Ersetzen Sie den PBS zu verschiedenen Zeitpunkten und lagern Sie ihn bei -80 °C.
HINWEIS: In dieser Studie wurden 2-, 6-, 10- und 14-Tage-Zeitpunkte analysiert. - Analysieren Sie gespeichertes PBS für Partikelstudien durch NTA gemäß den Anweisungen des Herstellers.
HINWEIS: Die Partikelkonzentration in PBS zu verschiedenen Zeiten ist eine Darstellung des Freisetzungsprofils von Elektrofahrzeugen im Laufe der Zeit.
- Inkubieren Sie die Ti-Oberfläche mit 200 μL gefiltertem PBS bei 37 °C.
- Biokompatibilitätsstudien
HINWEIS: Menschliche nabelschnurgeleitete mesenchymale Stammzellen (hUC-MSC) werden aus der IdISBa Biobank in Übereinstimmung mit institutionellen Richtlinien gewonnen.- Halten Sie hUC-MSC in DMEM niedriger Glukose, ergänzt mit 20% FBS bis zur Verwendung. Wechseln Sie das Medium zweimal pro Woche.
- Für die Zellaussaat waschen Sie die Zellen zweimal in Kolben mit 5 ml PBS.
- Trypsinisieren Sie hUC-MSC, indem Sie 1 ml Trypsinlösung hinzufügen. Stellen Sie sicher, dass es die Monoschicht der Zellen vollständig bedeckt. Die Trypsinlösung wird entfernt und der Zellkulturkolben bei 37 °C für ca. 2 min aufgestellt. Sehen Sie sich die Zellablösung unter dem Mikroskop an. Abgelöste Zellen erscheinen rund in der Form und sind in Suspension.
- Resuspend Zellen in DMEM niedrige Glukose mit 1% EVs erschöpften FBS.
HINWEIS: Bereiten Sie Medien vor, die mit 1% FBS ergänzt wurden, und zentrifugieren Sie dann 18 h lang bei 120.000 x g , um FBS-EVs zu entfernen. Es ist wichtig, Elektrofahrzeuge zu entfernen, um Interferenzen mit Thrombozyten-Elektrofahrzeugen zu vermeiden. - Bestimmen Sie die Zellkonzentration, indem Sie die Anzahl der Zellen mit einer Neubauer-Kammer zählen14.
- Bringen Sie hUC-MSC auf eine Konzentration von 50.000 Zellen/ ml.
- Säen Sie 200 μL der Zelllösung auf die Ti-Implantate.
- Sammeln Sie nach 48 h 50 μL Medien und führen Sie die zytotoxische Bestimmung unter Verwendung des Laktatdehydrogenase (LDH) -Aktivitätskits gemäß dem Protokoll des Herstellers durch.
Ergebnisse
Die in diesem Artikel vorgestellte Methode ermöglicht es, funktionalisierte Titanscheiben von Elektrofahrzeugen zu erhalten. EVs sind physisch an die Oberfläche gebunden, was eine anhaltende Freisetzung im Laufe der Zeit ermöglicht. Die Anzahl der freigesetzten EVs kann durch NTA an Tag 2, 6, 10 und 14 gemessen werden. Die ersten Messungen an Tag 2 zeigen, dass rund 109 EVs freigesetzt werden, gefolgt von einer anhaltenden Freisetzung an Tag 6 (~ 108 EVs); Tag 10 (~107 EVs) und Tag 14 ...
Diskussion
Dieses Protokoll zielt darauf ab, klare Anweisungen für die Funktionalisierung von Elektrofahrzeugen auf Ti-Oberflächen bereitzustellen. Das vorgestellte Verfahren basiert auf einer Tropfengießstrategie, bei der es sich um eine Physisorptionsart der Funktionalisierung handelt. Es gibt eine schlechte Bibliographie in Bezug auf die Funktionalisierung von Elektrofahrzeugen auf Ti-Oberflächen, obwohl es nur wenige Studien gibt, die unterschiedliche Vorteile durch die Immobilisierung von Elektrofahrzeugen auf
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Diese Forschung wurde vom Instituto de Salud Carlos III, Ministerio de Economía y Competitividad, kofinanziert durch den Europäischen Sozialfonds ESF und den Europäischen Fonds für regionale Entwicklung EFRE (MS16/00124; CP16/00124; PI17/01605), die Direcció General d'Investigació, Conselleria d'Investigació, Govern Balear (FPI/2046/2017), und PROGRAMA JUNIOR del projecte TALENT PLUS, construyendo SALUD, generando VALOR (JUNIOR01/18), finanziert durch die nachhaltige Tourismussteuer der Balearen.
Materialien
| Name | Company | Catalog Number | Comments |
| 0,8 µm syringe filter | Sartorius | 16592K | |
| 1.5 mL Centrifuge tube | SPL life sciences | PLC60015 | |
| 1mL syringe | BD | 303174 | |
| 96-well culture plate | SPL life sciences | PLC30096 | |
| Absolut ethanol | Scharlau | ET0006005P | Used to prepare 20 % ethanol with Milli-Q® water |
| AKTA purifier System | GE Healthcare | 8149-30-0014 | |
| Allegra X-15R Centrifuge | Beckman Coutler | 392934 | SX4750A swinging rotor |
| Centrifuge 5430 R | Eppendorf | 5428000210 | F-45-48-11 rotor |
| Conical Tube, Conical Bottom, 50ml | SPL life sciences | PLC50050 | |
| Cytotoxicity Detection Kit (LDH) | Roche | 11644793001 | |
| Disposable Syringes 10 ml | Becton Dickinson | BDH307736 | |
| DMEM Low Glucose Glutamax | GIBCO | 21885025 | |
| Dulbecco's PBS (1x) | Capricorn Scientific | PBS-1A | |
| Fetal Bovine Serum (FBS) Embrionic Certified | GIBCO | 16000044 | |
| Filtropur S 0.2 µm syringe filter | Sarstedt | 83.1826.001 | |
| HiPrep 16/60 Sephacryl S-400 HR | GE Healthcare | 28-9356-04 | Precast columns |
| human umbilical cord-derived mesenchymal stem cells (hUC-MSC) | IdISBa Biobank | ||
| Nanodrop 2000 spectrophotometer | ThermoFisher | ND-2000 | |
| NanoSight NS300 nanoparticle tracking analysis | Malvern | NS300 | Device with embedded laser at λ= 532 nm and camera sCMOS |
| Needle | Terumo | 946077135 | |
| Nitric acid 69,5% | Scharlau | AC16071000 | |
| Optima L-100 XP Ultracentrifuge | Beckman Coulter | 8043-30-1124 | SW-32Ti Rotor |
| Penicillin-Streptomycin Solution 100X | Biowest | L0022 | |
| pH Test strips 4.5-10.0 | Sigma | P-4536 | |
| Platelet Lysate (PL) | IdISBa Biobank | Obtained from buffy coats discarded after blood donation | |
| Polypropylene centrifuge tubs | Beckman Coutler | 326823 | |
| Power wave HT | BioTek | 10340763 | |
| Screw cap tube, 15 ml, (LxØ): 120 x 17 mm, PP, with print | Sarstedt | 62554502 | |
| Sodium hidroxide | Sharlau | SO04251000 | |
| Titanium implants replicas | Implantmedia, SA | NA | Titanium grade IV. Diameter: 6,2 mm. Height: 1,95 mm |
| Trypsin-EDTA 1 X | Biowest | L0930 | |
| Tryton X100 | Sigma | T8787 |
Referenzen
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19 (4), 213-228 (2018).
- Torreggiani, E., et al. Exosomes: novel effectors of human platelet lysate activity. European Cells & Materials. 28, 137-151 (2014).
- Antich-Rosselló, M., et al. Platelet-derived extracellular vesicles promote osteoinduction of mesenchymal stromal cells. Bone and Joint Research. 9 (10), 667-674 (2020).
- Li, Y., et al. New developments of Ti-based alloys for biomedical applications. Materials. 7 (3), 1709-1800 (2014).
- Lan, W. C., et al. The potential of a nanostructured titanium oxide layer with self-assembled monolayers for biomedical applications: Surface properties and biomechanical behaviors. Applied Sciences. 10 (2), 590 (2020).
- Jemat, A., Ghazali, M. J., Razali, M., Otsuka, Y. Surface modifications and their effects on titanium dental implants. BioMed Research International. 2015, 791725 (2015).
- Damiati, L., et al. Impact of surface topography and coating on osteogenesis and bacterial attachment on titanium implants. Journal of Tissue Engineering. 9, 2041731418790694 (2017).
- Chen, L., et al. Self-assembled human adipose-derived stem cell-derived extracellular vesicle-functionalized biotin-doped polypyrrole titanium with long-term stability and potential osteoinductive ability. ACS Applied Materials & Interfaces. 11 (49), 46183-46196 (2019).
- Wei, F., Li, M., Crawford, R., Zhou, Y., Xiao, Y. Exosome-integrated titanium oxide nanotubes for targeted bone regeneration. Acta Biomaterialia. 86, 480-492 (2019).
- Wang, X., et al. Exosomes influence the behavior of human mesenchymal stem cells on titanium surfaces. Biomaterials. 230, 119571 (2020).
- Lozano-Ramos, I., et al. Size-exclusion chromatography-based enrichment of extracellular vesicles from urine samples. Journal of Extracellular Vesicles. 4, 27369 (2015).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Liu, J., et al. Isolation and characterization of extracellular vesicles from adult schistosoma japonicum. Journal of Visualized Experiments: JoVE. (135), e57541 (2018).
- JoVE. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE Science Education Database. , (2021).
- Chouirfa, H., Bouloussa, H., Migonney, V., Falentin-Daudré, C. Review of titanium surface modification techniques and coatings for antibacterial applications. Acta Biomaterialia. 83, 37-54 (2019).
- Córdoba, A., Monjo, M., Hierro-Oliva, M., González-Martín, M. L., Ramis, J. M. Bioinspired quercitrin nanocoatings: A fluorescence-based method for their surface quantification, and their effect on stem cell adhesion and differentiation to the osteoblastic lineage. ACS Applied Materials and Interfaces. 7 (30), 16857-16864 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten