Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Messung der zeitlichen Entwicklung von nanoskaligen Materialien mit gestopptem Fluss und Kleinwinkel-Neutronenstreuung
In diesem Artikel
Zusammenfassung
Dieses Protokoll stellt die Verwendung einer Probenumgebung mit gestopptem Durchfluss dar, um während einer Neutronenstreumessung mit kleinem Winkel schnell mehrere flüssige Lösungen in situ zu mischen und kinetische Prozesse auf Nanometer-Längenskalen und Zweitzeitskalen zu untersuchen.
Zusammenfassung
In diesem Artikel wird die Verwendung einer SANS-Probenumgebung (Stoped-Flow-Kleinwinkel-Neutronenstreuung) vorgestellt, um flüssige Proben schnell zu mischen und kinetische Prozesse im Nanobereich auf Zeitskalen von Sekunden bis Minuten zu untersuchen. In der Probenumgebung mit gestopptem Durchfluss werden handelsübliche Spritzenpumpen verwendet, um die gewünschten Mengen an flüssigen Proben zu mischen, die dann in ca. 1 s durch einen dynamischen Mischer in eine Quarzglaszelle injiziert werden. Die zeitaufgelöste SANS-Datenerfassung wird mit dem Mischen der Probe synchronisiert, um die Entwicklung der Nanostruktur in Lösung nach dem Mischen zu verfolgen.
Um die Zeit des Neutronenstrahls so effizient wie möglich zu nutzen, verwenden wir eine Reihe von Durchflusswahlventilen, um die Zelle zwischen den Messungen automatisch zu laden, zu spülen und zu trocknen, was eine wiederholte Datenerfassung während mehrerer Probeninjektionen ermöglicht. Die Probeninjektionen werden so lange wiederholt, bis eine ausreichende Neutronenstreustatistik erfasst ist. Der Mischaufbau kann so programmiert werden, dass die Bedingungen systematisch variiert werden, um die Kinetik bei verschiedenen Mischungsverhältnissen, Probenkonzentrationen, Additivkonzentrationen und Temperaturen zu messen. Das minimale Probenvolumen, das pro Injektion benötigt wird, beträgt ca. 150 μl, abhängig von der Weglänge der Quarzzelle.
Repräsentative Ergebnisse unter Verwendung dieser Stoped-Flow-Probenumgebung werden für die Kinetik des schnellen Lipidaustauschs in Gegenwart eines Additivs, Cyclodextrin, präsentiert. Die Vesikel tauschen äußere (äußere) Lipide in der Größenordnung von Sekunden aus und tauschen sowohl innere als auch äußere Lipide innerhalb von Stunden vollständig aus. Die Messung der Lipidaustauschkinetik erfordert In-situ-Mischungen , um die schnelleren (Sekunden) und langsameren (Minuten) Prozesse zu erfassen und die kinetischen Geschwindigkeitskonstanten zu extrahieren. Die gleiche Probenumgebung kann auch verwendet werden, um den molekularen Austausch in anderen Arten von flüssigen Proben wie Lipid-Nanopartikeln, Proteinen, Tensiden, Polymeren, Emulsionen oder anorganischen Nanopartikeln zu untersuchen. Die Messung der nanoskaligen strukturellen Umwandlungen und der Kinetik von austauschenden oder reagierenden Systemen wird neue Einblicke in Prozesse liefern, die sich auf der Nanoskala entwickeln.
Einleitung
Die Kleinwinkel-Neutronenstreuung (SANS) bietet eine einzigartige Möglichkeit, die Größe, Form, Wechselwirkung und Organisation verschiedener Materialien auf Längenskalen von ≈1 nm bis ≈100 nm 1,2,3 zu messen. Neuere Instrumente, darunter VSANS-Instrumente (Very Small-Angle Neutron Scattering) mit fokussierenden Spiegeln, verschieben die Grenzen für die Messung noch größerer Längenskalen bis ≈1000 nm 4,5. Im Allgemeinen bietet der einzigartige Streukontrast, der Neutronenstreumethoden innewohnt, mehrere Vorteile bei der Messung der zeitlichen Entwicklung von nanoskaligen Strukturen, wie z.B. der Aggregation von Komponenten in pharmazeutischen Formulierungen6, Vernetzungs- und Gelierungsreaktionen in Polymersystemen 7,8, bei der Mesokristallisation von Membranproteinen9,10, dem Abbau und der Entfaltung von Proteinen11,12 und das Wachstum von Materialien auf Kieselsäurebasis13,14,15. Der einzigartige Streukontrast macht zeitaufgelöste SANS (TR-SANS) zu einer nützlichen Ergänzung zu anderen Stopped-Flow-basierten Messungen.
Stopped-Flow-Mischmethoden werden häufig in der Kleinwinkel-Röntgenstreuung (SAXS)16,17,18,19,20,21, der Fluoreszenzspektroskopie 22,23,24,25,26 und der Lichtstreuung 27,28,29,30 eingesetzt. 31,32 Experimente zur Untersuchung kinetischer Prozesse auf Millisekunden-Zeitskalen. Ein wichtiger Unterschied zwischen SANS und SAXS besteht darin, dass die Neutronenstreuung eine zerstörungsfreie Charakterisierungstechnik ist und SANS als solche verwendet werden kann, um dieselbe Probe stunden- oder sogar tagelang zu messen, ohne dass ionisierende Strahlung die Probe schädigt, was bei Röntgenstreuexperimenten mit höherem Fluss auftreten kann33. Da wiederholte SANS-Messungen die chemische Struktur des Sondenmoleküls oder der Probe nicht verändern, kann die Zeitentwicklung ohne Effekte von z. B. Photobleichung untersucht werden, die kinetische Messungen erschweren können, die auf Fluoreszenz basieren23,24. Darüber hinaus können mit SANS hochkonzentrierte und optisch undurchsichtige Proben gemessen werden, die mit lichtbasierten Techniken wie dynamischer Lichtstreuung oft nur schwer zu charakterisieren sind.
SANS liefert nicht nur strukturelle Informationen auf der Nanoskala, sondern kann auch verwendet werden, um die lokale Zusammensetzung dieser Strukturen durch die Variation des Längendichtekontrasts der Neutronenstreuung zu untersuchen. Die Streulängendichte (SLD) verschiedener Elemente variiert zufällig über das Periodensystem und variiert mit verschiedenen Isotopen desselben Elements. Ein häufig genutztes Beispiel sind Wasserstoff (1H oder H) und Deuterium (2H oder D), die sehr unterschiedliche Neutronenstreulängen haben. Daher können wasserstoffreiche Materialien wie Tenside, Lipide, Proteine, RNA, DNA und andere Polymere mit SANS von deuterierten Lösungsmitteln unterschieden werden, ohne die physikalischen Eigenschaften des Systems wesentlich zu verändern. Es ist jedoch wichtig zu beachten, dass der H/D-Austausch die Dichte, die Wasserstoffbrückenbindung und die Phasenübergangstemperaturen in der Probe beeinflussen kann. Nichtsdestotrotz ist die einzigartige Empfindlichkeit von SANS gegenüber wasserstoffreichen Materialien besonders nützlich in der Forschung an weicher Materie, wo die interessierenden Proben in röntgenbasierten Techniken wie SAXS einen geringeren Streukontrast und ein geringeres Signal aufweisen. Die Isotopensubstitution macht SANS auch zu einem leistungsstarken Werkzeug für die Untersuchung der molekularen Austauschkinetik in wasserstoffreichen Materialien, indem einfach H-markierte und D-markierte Moleküle gemischt werden. Die Isotopensubstitution ist besonders nützlich in Systemen, in denen voluminöse Fluoreszenzfarbstoffe größer sind als die interessierenden Tensid- oder Lipidmoleküle und die Austauschkinetik beeinflussen können34,35.
Zeitaufgelöste SANS-Messungen sind von Vorteil, da die gemessene Intensität eine Funktion von Zeit, Längenskala und SLD-Kontrast ist. Daher können TR-SANS-Experimente so konzipiert werden, dass sie die zeitabhängigen Änderungen der räumlichen Verteilungen und der Zusammensetzung der Proben untersuchen. Diese einzigartigen Vorteile von SANS haben zu wichtigen Erkenntnissen über kinetische Prozesse in vielen weichen Materialsystemen geführt, wie z.B. Tenside 36,37,38, Emulsionen 39,40,41, Lipide 34,42,43,44,45,46,47,48,49 50 und Polymere 51, 52, 53, 54, 55, 56, 57, 58, 59, 60,61, 62. Die meisten TR-SANS-Studien haben sich auf Zeitskalen von Minuten bis Stunden konzentriert. Viele kinetische Prozesse, die von Interesse sind, finden jedoch auf der zweiten Zeitskala statt und sind essentiell für das Verständnis der zugrunde liegenden Mechanismen. Um diese frühen Zeitpunkte zu erfassen, müssen die Lösungen schnell gemischt und in situ gemessen werden, wobei die Durchmischung mit der Datenerfassung während der gestoppten Lichtstreuung 27,28,29,30,31,32, Fluoreszenz 22,23,24,25,26 und Röntgenstrahlung synchronisiert wird 16,17,18,19,20,21 Experimente. Diese Arbeit beschreibt die Verwendung einer Probenumgebung, die darauf ausgelegt ist, mehrere flüssige Proben schnell zu mischen und die Mischung für TR-SANS-Messungen in eine Quarzglaszelle zu injizieren. Die Mischvorrichtung ist eine Adaption der kürzlich entwickelten KapillarrheoSANS-Vorrichtung63 und verwendet mehrere Spritzenpumpen und Ventile, um die Probenmischung zu steuern und die Zellreinigung zu automatisieren. Durch den Anschluss von Spritzenpumpen an eine Reihe von Durchflusswahlventilen können mehrere Einlassströme wiederholt gemischt, gemessen, gespült und getrocknet werden, um TR-SANS-Messungen auf der Sekunden-Zeitskala zu erleichtern.
Das derzeitige Verfahren geht davon aus, dass die interessierenden Proben identifiziert und aufbereitet wurden. Wir konzentrieren uns auf den in situ Mischaufbau und Methoden zur Erfassung von TR-SANS-Daten. Neutronenstreudaten wurden mit dem VSANS-Instrument am NIST Center for Neutron Research (NCNR) gesammelt; Das Verfahren sollte jedoch auch auf andere SANS-Instrumente anwendbar sein. Leser, die daran interessiert sind, ähnliche Protokolle auf anderen SANS-Instrumenten zu implementieren, sollten sich mit den lokalen Instrumentenwissenschaftlern beraten, um die optimale Instrumentenkonfiguration zu bestimmen, um den Neutronenfluss auf der gewünschten Längenskala und Zeitskala zu maximieren, die für die interessierenden kinetischen Prozesse am relevantesten ist. Die hier vorgestellten Daten wurden unter Verwendung der Hochfluss-"Weißstrahl"-Konfiguration auf VSANS gesammelt, um die Neutronenzahl bei Verlust der räumlichen Auflösungzu maximieren 5. Die Detektorschlitten wurden so positioniert, dass sie einen Bereich von Streuvektoren (q) von 0,005 Å-1 < q < 0,5 Å-1 abdecken, was Längenskalen von ≈130 nm bis ≈13 nm entspricht. Der Streuvektor ist definiert als q = 4π/λ sin (θ/2), wobei λ die Neutronenwellenlänge und θ der Streuwinkel ist.
Das für die TR-SANS-Messungen verwendete Mischgerät mit gestopptem Durchfluss besteht aus mehreren Pumpen, Spülspritzen, Probenspritzen, Durchflussselektoren sowie einem dynamischen Mischer, einer Probenzelle und einem Mischprobenbehälter, wie in Abbildung 1 dargestellt. Alle abgedichteten Flüssigkeitswege befinden sich in einem klimatisierten Gehäuse, das die Spritzen, Ventile, Verbindungsschläuche, den dynamischen Mischer und die Probenzellen umfasst. Ein programmierbares thermoelektrisches Klimagerät wird verwendet, um die Gehäusetemperatur im Bereich von 10 °C bis 50 °C innerhalb von ±1 °C zu regeln. Beachten Sie, dass ein Teil der Gehäuseisolierung entfernt wurde, um die funktionierenden Teile des Geräts zu zeigen. Das Hauptgehäuse des Mischgeräts befindet sich auf einem Translationstisch an der NG3 VSANS-Strahllinie am NCNR. Die Position des Gehäuses wird mit dem Translationstisch eingestellt, um die Probenzelle im Pfad des Neutronenstrahls zu positionieren (gelbe gestrichelte Linie).

Abbildung 1: Ein Beispielaufbau für die Kombination von Stopped-Flow-Mixing und Kleinwinkel-Neutronenstreumessungen an der VSANS-Beamline am NIST Center for Neutron Research. Der Aufbau besteht aus vier Spritzenpumpen, zwei Spritzen zum Spülen von Lösungsmitteln und zwei Spritzen zur Probeninjektion, vier Pumpenwahlventilen, zwei Mischerwahlventilen, einem dynamischen Mischer, einer Durchfluss-Quarzzelle und einem Mischprobenbehälter. Einfallende Neutronen werden an der gemischten Probe gestreut, die sich in der Probenzelle befindet. Ein isoliertes Gehäuse mit Quarzfenstern und einer thermoelektrischen Klimaanlage dient zur Steuerung der Probe und aller Geräte bei konstanter Temperatur. Die gelbe gestrichelte Linie zeigt den Strahlengang der Neutronen. Maßstabsleiste = 10 cm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Das in Abbildung 1 dargestellte Gerät ist mit zwei Probenspritzen, zwei Spülspritzen und einer Probenzelle konfiguriert. Entsprechende Flussdiagramme für die verschiedenen Schritte des Protokolls sind in Abbildung 2 dargestellt. Die gewünschten Volumina der beiden unterschiedlichen Proben werden in den Mischer und die Probenzelle injiziert (Abbildung 2A). Sobald die Probenzelle gefüllt ist, werden das Einlassschaltventil (ISV) und das Auslassschaltventil (OSV) geschlossen, um die Probenzelle vom dynamischen Mischer zu isolieren und eine Rückdiffusion der Probe in die Zelle während der TR-SANS-Datenerfassung zu verhindern (Abbildung 2B). Vor dem dynamischen Mischer variiert der Verbindungsschlauch in der Länge von 10 cm bis 1 m und hat keinen Einfluss auf die Mischverzögerungszeit. Schlauchverbindungen zwischen dem dynamischen Mischer und der Probenzelle wirken sich jedoch auf die Mischverzögerungszeit und das erforderliche Probeninjektionsvolumen aus. Vorgeschnittene Edelstahlrohre mit einem Innendurchmesser von 1 mm (0,04 Zoll) und einer Länge von 100 mm werden verwendet, um den dynamischen Mischer, die Mischerwahlventile (MSV1 und MSV2) sowie den ISV und OSV zu verbinden. Fluorierte Schläuche mit 1 mm Innendurchmesser und 115 mm Länge werden verwendet, um den ISV und OSV (oder den dynamischen Mischerausgang) mit der Probenzelle zu verbinden. Das gesamte Hohlraumvolumen, das die Mischverzögerungszeit beeinflusst, umfasst das Hohlraumvolumen des Mischers (0,15 ml), den Schlauch zwischen dem Mischerauslass und dem Probenzelleneinlass (0,09 ml) und das Probenzellenvolumen (0,16 ml). In diesem Beispiel beträgt das gesamte Hohlraumvolumen 0,4 ml. Die internen Hohlraumvolumina der Ventile sind im Vergleich zu den Hohlraumvolumina der Schläuche, des Mischers und der Probenzelle vernachlässigbar. So enthalten beispielsweise die eingesetzten Niederdruck-Wahlventile (0,75 mm Bohrungsdurchmesser) ein ungefähres Hohlraumvolumen von 4 μl, während die Hochdruck-Wahlventile und Umschaltventile (0,25 mm Bohrungsdurchmesser) ein ungefähres Hohlraumvolumen von 0,5 μl aufweisen.
Nach Abschluss der TR-SANS-Messung wird die Probe mit Lösungsmittel aus der Zelle gedrückt und wiederholt Spüllösungsmittel durch die Zelle gepumpt, um die Restprobe zu entfernen und die Probenzelle zu reinigen (Abbildung 2C). Beachten Sie, dass die Spülspritzen über Pumpenwahlwerte mit größeren Lösungsmittelbehältern (z. B. Wasser und Ethanol) verbunden sind, um sicherzustellen, dass zwischen den Messläufen ausreichende Lösungsmittelmengen zur Reinigung der Probenzelle zur Verfügung stehen. Lösungsmittelquellen, Probenquellen und gemischte Probenbehälter, die brennbare Flüssigkeiten enthalten, werden in einem separaten Gehäuse ohne elektrische Ausrüstung positioniert, um alle möglichen Zündquellen auszuschließen. Darüber hinaus werden dampfverschließende Flaschenverschlüsse verwendet, um brennbare Dämpfe und die Verdunstung von Lösungsmitteln zu minimieren. Schließlich wird die Probenzelle mit einem Stickstoffgasstrom getrocknet, um das restliche Spüllösungsmittel zu entfernen (Abbildung 2D). Der Stickstoffgasdruck am Eingang des Mischerwahlventils wird mit einem manuellen Druckregler an der Stickstoffgasflasche auf ca. 2 bar (0,2 MPa, Überdruck) geregelt. Sobald die Probenzelle ausreichend gereinigt und getrocknet ist, wird eine neu gemischte Probe für den nächsten Messzyklus in die Probenzelle injiziert (Wiederholung des Mischens und der Injektion, dargestellt im Flussdiagramm in Abbildung 2A).
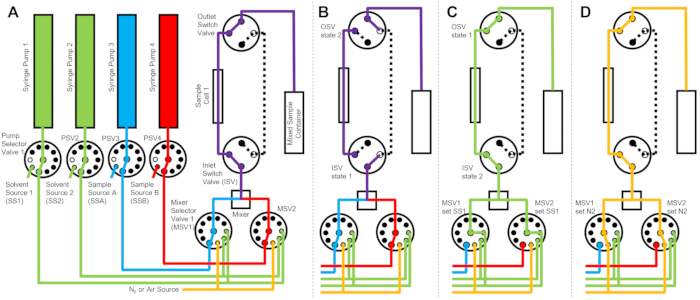
Abbildung 2: Beispiel für ein Flussdiagramm mit einer Probenzelle, zwei Probenmischungen und zwei Spüllösungsmitteln zur Reinigung . (A) Mischen von Probe A (blau) und Probe B (rot) und anschließendes Einfließen der gemischten Probe (violett) in die Probenzelle. (B) Während der Datenerfassung befindet sich das Gerät mit gestopptem Durchfluss, in dem die ISV- und OSV-Umschaltventile geschlossen sind, um die Probenzelle zu isolieren und eine Rückdiffusion der Probe während der Datenerfassung zu verhindern. (C) Die Reinigungsschritte, bei denen die Probenzelle nach der Datenerfassung mit dem Spüllösungsmittel von SS1 (grün) gespült wird. (D) Trocknungsschritt, bei dem die Probenzelle mit Stickstoffgas (orange) getrocknet wird. Abkürzungen: PSV = Pumpenwahlventil; MSV = Mischer-Wahlventil; OSV = Auslassschalterventil; ISV = Einlassschalterventil; SS1 = Lösungsmittelquelle 1; SSA = Probenquelle A; N2 = Stickstoffgasquelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Abbildung 3 zeigt Flussdiagramme für eine etwas andere Version, bei der der Mischaufbau mit zwei separaten Probenzellen konfiguriert ist, die an dieselben Umschaltventile angeschlossen sind (Abbildung 3A). Während die TR-SANS-Daten in Probenzelle 1 erfasst werden, wird Probenzelle 2 gespült (Abbildung 3B) und getrocknet (Abbildung 3C). Wenn die Datenerfassung für Probenzelle 1 abgeschlossen ist, leitet das Einlassschaltventil eine neu gemischte Probe zur Datenerfassung in Probenzelle 2 (Abbildung 3D). Während die TR-SANS-Daten in Probenzelle 2 erfasst werden, wird Probenzelle 1 gespült und getrocknet (Abbildung 3E). Dieser alternierende, parallele Prozess zwischen zwei Probenzellen minimiert die Zeit zwischen nachfolgenden Probeninjektionen und maximiert die Nutzung der Neutronenstrahlzeit.
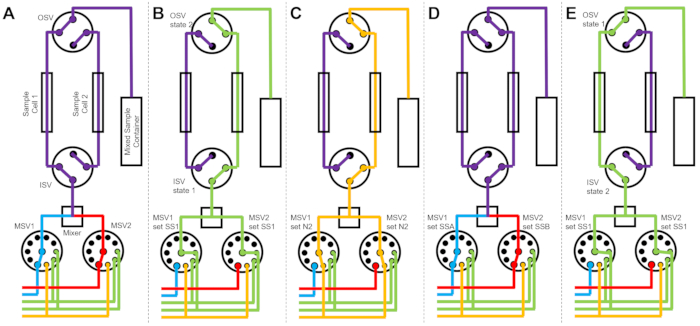
Abbildung 3: Beispiel für ein Flussdiagramm mit einer Zwei-Proben-Zellen, zwei Proben, die gemischt werden, und zwei Spüllösungsmitteln zur Reinigung. (A) Mischen von Probe A (blau) und Probe B (rot) und anschließendes Einfließen der gemischten Probe (violett) in Probenzelle 1. (B) Der Zustand des Geräts mit gestopptem Durchfluss während der Datenerfassung an Probenzelle 1, während Probenzelle 2 mit Lösungsmittel aus SS1 (grün) gespült wird. (C) Der Zustand des Geräts mit gestopptem Durchfluss während der Datenerfassung an der Probenzelle 1, während die Probenzelle 2 mit Stickstoffgas (orange) getrocknet wird. (D) Sobald die Datenerfassung der Probenzelle 1 abgeschlossen ist, wird sofort eine neue Probe (violett) gemischt und in die Probenzelle 2 eingebracht. (E) Der Zustand der Stoped-Flow-Vorrichtung während der Datenerfassung an Probenzelle 2, während Probenzelle 1 mit Lösungsmittel aus SS1 (grün) gespült wird. Während eine Probenzelle gemessen wird, wird die andere Probenzelle gereinigt und getrocknet. Der Stopped-Flow-Messprozess wechselt zwischen zwei Probenzellen, um die Zeit zwischen nachfolgenden Probenmischinjektionen zu minimieren. Abkürzungen: PSV = Pumpenwahlventil; MSV = Mischer-Wahlventil; OSV = Auslassschalterventil; ISV = Einlassschalterventil; SS1 = Lösungsmittelquelle 1; SSA = Probenquelle A; N2 = Stickstoffgasquelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Im Folgenden wird ein Schritt-für-Schritt-Protokoll für das Anschließen der Pumpen und Schlauchleitungen, das Ansaugen des Systems, das Spülen und Trocknen der Probenzelle und das Einspritzen der gemischten Probe beschrieben. Obwohl die Einzelzellenkonfiguration der Einfachheit halber demonstriert wird (Abbildung 2), können der flexible modulare Aufbau, das Protokoll und die Skripte leicht geändert werden, um mehr Spritzenpumpen, Ventile, Mischer oder Probenzellenkonfigurationen zu implementieren, wie z. B. die in Abbildung 3 gezeigte Konfiguration mit zwei Probenzellen. Repräsentative Rohdaten der Neutronenzählrate, die während der Misch- und Reinigungsinjektionszyklen gesammelt wurden, sind in Abbildung 4 dargestellt, während die bei 3 verschiedenen Temperaturen gemessene Lipidaustauschkinetik und die extrahierte normalisierte Streuintensität, die dem Anteil der ausgetauschten Lipide entspricht, in Abbildung 5 bzw. Abbildung 6 dargestellt sind.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Einrichten und Einschalten des Stopped-Flow-Systems.
- Schalten Sie alle Pumpennetzteile und dynamischen Mischer mit dem Netzschalter ein.
- Starten Sie alle Pumpen und Ventile in der grafischen Benutzeroberfläche (GUI) der Steuerung des gestoppten Durchflusssystems, indem Sie den Gerätekonfigurationspfad eingeben und die Befehle bus=qmixbus verwenden. Bus(), bus.open(), bus.start(), pump=qmixpump. Pump(), pump.enable() und valve=ViciMultiposSelector() (siehe Beispiel-Initiierungscode, der in einem Online-Open-Source-Repository64 verfügbar ist).
- Kalibrieren Sie die Pumpen vor dem Anbringen von Spritzen mit dem Befehl pump.calibrate().
- Vergewissern Sie sich, dass die Ventile initiiert wurden, und bewegen Sie sich auf Befehl mit den Befehlen valve.setPort() und valve.getPort() zum richtigen Selektorport.
- Weisen Sie den Spritzentyp zu, der für jede Pumpe verwendet werden soll, indem Sie den Befehl pump.set_syringe_param(A, B) verwenden, wobei A der Innendurchmesser des Spritzenzylinders (mm) und B der maximale Kolbenhub der Spritze (mm) ist.
- Schließen Sie die Probenspritzen an die Spritzenpumpen an.
- Nachdem Sie sich vergewissert haben, dass die Pumpen kalibriert sind, schrauben Sie saubere Spritzenzylinder an den Anschluss an der Oberseite der Pumpe (Spritzenmontagekopf) ein.
- Stellen Sie bei der Verwendung von Glasspritzen sicher, dass der Spritzenhalterungskopf vor der Abgabe des Füllvolumens gelöst ist, damit die Glasspritze nicht durch übermäßige Kraft des Spritzenkolbens bricht.
- Schrauben Sie den Spritzenkolben in den Anschluss an der Unterseite der Pumpe (Spritzenhalterungsende).
- Nachdem der Spritzenzylinder und der Spritzenkolben mit der Pumpe verbunden sind, geben Sie das Füllvolumen des Spritzentyps mit dem Befehl pump.empty() ab, der den Spritzenkolben an die Oberseite des Spritzenzylinders bewegt.
- Wenn Sie Glasspritzen verwenden, ziehen Sie den Spritzenhalterungskopf fest, nachdem die Kolbenbewegung gestoppt wurde.
- Schließen Sie den Schlauch an die Proben- und Lösungsmittelquellen, Spritzen, Ventile, Mischer, Probenzellen und den gemischten Probenbehälter an.
- Verbinden Sie den Schlauch der Spritzenpumpe mit den Pumpenwahlventilen.
- Schließen Sie den Schlauch des Pumpenwahlventils an die Probenquellen an.
- Schließen Sie den Schlauch des Pumpenwahlventils an die Spüllösungsmittelquellen an.
- Verbinden Sie den Schlauch des Pumpenwählventils mit dem Schlauch des Mischerwahlventils.
- Schließen Sie den Schlauch des Mischerwahlventils an die Stickstoffgasquelle an.
- Verbinden Sie den Schlauch des Mischerwahlventils mit den Mischereinlässen.
- Verbinden Sie den Mischerausgang mit dem Einlassschalterventil.
- Verbinden Sie das Einlassschalterventil mit dem Probenzelleneinlass.
- Verbinden Sie den Ausgang der Probenzelle mit dem Auslassschalterventil.
- Schließen Sie das Auslassschalterventil an den Mischprobenbehälter an.
- Definieren Sie alle Schlauch- und Ventilverbindungen (Schritt 1.7) in der GUI für die Steuerung des Systems mit gestopptem Durchfluss, indem Sie die entsprechenden Anschlussnummern eingeben, die zu jedem Ventil hergestellt wurden (siehe Beispiel-Steuercode im Online-Open-Source-Repository64).
- Berechnen Sie das Hohlraumvolumen des Schlauchs zwischen dem Mischereinlass und dem Auslass der Probenzelle, das die Mindestmenge an Probe definiert, die zum Füllen der Probenzelle für jede Messung erforderlich ist.
2. Legen Sie die Probe ein.
- Stellen Sie das gewünschte Probenfüllvolumen und das Lösungsmittelfüllvolumen in der Steueroberfläche des Stopped-Flow-Systems ein, indem Sie die gewünschten Zahlen eingeben (siehe Beispiel-Steuercode im Online-Open-Source-Repository64).
- Verwenden Sie den Befehl pump.aspirate(), um die gewünschten Proben- und Lösungsmittelvolumina aus ihren Quellen durch die Pumpenwahlventile in die Probenspritzen zu ziehen (anzusaugen).
Anmerkungen: Beim ersten Laden einer leeren Spritze befindet sich oben in der Spritze Luft, die gespült werden muss, um das System in Schritt 3 mit Probe und Lösungsmittel zu befüllen.
3. Bereiten Sie das System vor.
- Verwenden Sie den Befehl pump.dispense(), um die gesamte Luft aus Spritzen, Schlauchleitungen und Ventilen herauszudrücken (abzugeben). Stellen Sie sicher, dass aus jeder Spritze genügend Flüssigkeitsvolumen abgegeben wird, um die gesamte Luft vollständig aus den Spritzen, Schläuchen und Ventilen zu entfernen. Wenn Luftblasen in einem Schlauch sichtbar sind, setzen Sie die Abgabe des Lösungsmittels oder der Probe fort, bis die Blasen entfernt sind.
- Sobald die Luft aus dem System gespült wurde, führen Sie mindestens einen Probeninjektions- und Spülvorgang durch (ohne Neutronenstreuung).
- Klicken Sie auf die Zelle mit der Bezeichnung Mischexperiment starten in der Steuerungs-GUI, um sie auszuwählen.
- Wenn diese Zelle aktiv ausgewählt ist, klicken Sie auf die Schaltfläche Ausführen (rechtes Dreieck) oben in der GUI des Steuerelements oder drücken Sie gleichzeitig die Umschalt - und Eingabetaste auf der Tastatur.
- Untersuchen Sie die Probenzelle visuell, um sicherzustellen, dass keine Luftblasen vorhanden sind.
- Wenn Luftblasen vorhanden sind, wiederholen Sie die Protokollschritte 3.1 und 3.2, um die Luft weiter aus den Schlauchleitungen zu spülen.
- Wenn in der Probenzelle keine Luftblasen vorhanden sind, fahren Sie mit Schritt 4 fort, um die verbleibenden Schritte des Experimentprotokolls zu definieren.
4. Definieren Sie das Stopped-Flow-Mixing-Protokoll im Programmskript (siehe Codebeispiel im Online-Open-Source-Repository64).
- Geben Sie den Temperatursollwert des programmierbaren Klimageräts (AC) ein, das die Temperatur des isolierten Gehäuses steuert, das das Gerät mit gestopptem Durchfluss umgibt.
- Halten Sie die Sterntaste am AC-Steuergerät gedrückt und drücken Sie die Aufwärts- und Abwärtspfeile, um die Solltemperatur zu ändern. Alternativ können Sie den gewünschten Temperatursollwert in der Steuerungsoberfläche eingeben und auf Ausführen klicken.
- Warten Sie 15-30 Minuten, damit sich das Innere des Gehäuses bei der gewünschten Temperatur ausgleichen kann, bevor Sie mit den kinetischen Experimenten beginnen.
HINWEIS: Der zugängliche Temperaturbereich liegt derzeit zwischen 10 °C und 50 °C, die Temperaturstabilität liegt ± 1 °C.
- Geben Sie alle Schritte der Spülsequenz ein, indem Sie die entsprechenden Volumina, Durchflussraten, Zeiten und die Anzahl der Wiederholungen in die Steuerungs-GUI eingeben.
- Definieren Sie das Volumen jeder zu injizierenden Probe, das die Gesamtflussrate (Q) definiert.
- Definieren Sie das Volumen jedes Lösungsmittels, das während des Spülvorgangs injiziert werden soll.
- Definieren Sie die Trocknungszeit zwischen den einzelnen Spülteilschritten (tdry).
- Legen Sie die Anzahl der Spülteilschritte fest.
- Definieren Sie die verschiedenen Lösemittel für die nachfolgenden Spülschritte.
- Definieren Sie die Anzahl der Spülwiederholungen, die nach jeder Messung durchgeführt werden sollen (nSpülen).
- Definieren Sie die Zeit für die vollständige Trocknung der Probenzelle und des Mischers, um eine saubere Probenzelle für die anschließende Probeninjektion bereitzustellen (tdry_final).
- Definieren Sie alle Sequenzschritte der Probeninjektion, indem Sie die entsprechenden Volumina, Durchflussraten und Zeiten in die GUI des Stopped-Flow-Systems eingeben.
- Definieren Sie das Volumen jeder zu injizierenden Probe und die Durchflussrate.
- Berechnen Sie die Verzögerungszeit (t-Verzögerung) aus dem Hohlraumvolumen (V-Verzögerung) und der Gesamtdurchflussrate (t-Verzögerung = V-Verzögerung/Q).
Anmerkungen: Die Verzögerungszeit ist die Zeit, die benötigt wird, um die Probenzelle mit der gemischten Probe zu füllen. - Definieren Sie den gewünschten Erfassungszeitpunkt für die TR-SANS-Daten so, dass der gesamte kinetische Prozess von Interesse stattgefunden hat (tscatt).
- Stellen Sie die Wartezeit zwischen dem Ende des Streuexperiments und dem Beginn der Spülzyklen ein (twait).
Anmerkungen: Diese Wartezeit sollte mindestens 100 s betragen, wenn die Neutronentransmission der Probe gemessen werden soll, bevor sie aus der Zelle gespült wird. Die Probenübertragung wird während der Datenverarbeitung benötigt, um die Daten auf absolute Intensität zu reduzieren. - Definieren Sie die Anzahl der Einspritzzyklen, die mit den in Schritt 4.2 (n Zyklus) definierten Spülsequenzen zwischen den einzelnen Injektionen durchgeführt werden sollen.
- Berechnen Sie die Gesamtzeit eines einzelnen gestoppten Datenerfassungszyklus (t-Zyklus) mit Gleichung (1).
tZyklus = nSpülen × (t Verzögerung + ttrocken) + tdry_final + tVerzögerung + t scatt (1)
wobei nSpülen = Anzahl der Spülwiederholungen (Schritt 4.2.6); tVerzögerung = Verzögerungszeit der gestoppten Durchflussvorrichtung (Schritt 4.3.2); tdry = Trocknungszeit zwischen den einzelnen Spülschritten (Schritt 4.2.3); tdry_final = Zeit für die vollständige Trocknung der Probenzelle und des Mischers (Schritt 4.2.7); tscatt = gewünschte TR-SANS-Datenerfassungszeit (Schritt 4.3.3)
5. Definieren Sie die Parameter für die Kleinwinkel-Neutronenstreuung in der SANS-Gerätesteuerungs-GUI.
- Bestimmen Sie die Längenskalen und den Q-Bereich, die für jede Probe von Interesse sind.
- Definieren Sie die Gerätekonfiguration, um den gewünschten Q-Bereich von Interesse abzudecken und gleichzeitig den Neutronenfluss an der Probe zu maximieren.
- Stellen Sie die gesamte VSANS-Datenerfassungszeit in der SANS-Gerätesteuerungs-GUI auf die berechnete Zykluszeit in Schritt 4.4 ein (Neutronenstreuungs-Datenerfassungszeit =t-Zyklus).
- Stellen Sie die Messzeit für die Probenübertragung in der SANS-Gerätesteuerungs-GUI auf 100 s ein.
- Aktivieren Sie mithilfe der SANS-Gerätesteuerungs-GUI die Datenerfassung im Ereignismodus, indem Sie GenerateEventModeData true in die Befehlszeile eingeben.
6. Sammeln Sie Standardstreuungsmessungen zur Datenreduktion, bevor Sie mit dem Stopped-Flow-Experiment beginnen, um die TR-SANS-Daten zu verarbeiten.
- Messen Sie die Hintergrundstreuung.
- Stellen Sie sicher, dass der lokale Instrumentenverschluss geschlossen ist.
- Befestigen Sie die Probe mit blockiertem Strahl an der Rückseite der Probenöffnung, sichern Sie die lokale Geräteumgebung und öffnen Sie den lokalen Geräteverschluss.
- Definieren Sie die Datenerfassungszeit für die Streuung des blockierten Strahls in der Software und erfassen Sie die Daten zur Streuung des blockierten Strahls, wobei die gleiche Dauer wie die längste Datenerfassungszeit für die Streuung des Strahls (tscatt) gezählt wird.
- Sobald die Datenerfassung abgeschlossen ist, schließen Sie den Geräteverschluss und entfernen Sie die Probe mit blockiertem Strahl aus der Probenöffnung.
- Messen Sie die Streuung leerer Zellen.
- Stellen Sie sicher, dass die Probenzelle gründlich gespült und getrocknet wurde.
- Öffnen Sie den lokalen Instrumentenverschluss.
- Erfassen Sie die Transmissionsmessung der leeren Zelle für 100 s.
- Erfassen Sie die Messung der Leerzellenstreuung, wobei mindestens die längste Erfassungszeit (tscatt) gezählt wird.
7. Beginnen Sie mit dem Stopped-Flow-Experiment.
8. Verarbeiten und reduzieren Sie die Daten, um alle Hintergründe zu entfernen, die Empfindlichkeit des Detektors zu korrigieren und die Probenübertragung zu korrigieren.
- Laden Sie die Streudatendateien und die zugehörigen Ereignisdateien vom Server herunter.
HINWEIS: Nach jeder VSANS-Messung werden separate Detektor-Ereignisdateien generiert, eine Ereignisdatei für jeden aktiven Detektorträger (z. B. vorderer, mittlerer und/oder hinterer Detektor). - Binden Sie die Streudaten in die gewünschten Zeitabschnitte mit dem Befehl events=Rebin(filename ) gefolgt vom Befehle vents.do_rebinning(timebins), wobei der eingegebene Dateiname dem Namen der gewünschten SANS-Datendatei entspricht und timebins eine Liste der gewünschten Zeitabschnittsgrenzen in Sekunden ist.
HINWEIS: Wenn die Eingabe-Timebins als einzelne Zahl anstelle einer Liste eingegeben werden, werden die Daten in N Bins mit gleicher Zeitbreite eingeteilt, wobei N die Eingabe-Timebins sind (siehe Software-Skripte, die von der Beamline bereitgestellt werden, und das verfügbare Online-Open-Source-Repository64). - Reduzieren Sie die Bind-Streudaten mit der Software, die mit der Beamline65 geliefert wird.
9. Analysieren Sie die TR-SANS-Daten.
- Berechnen Sie die interessierende Prozesszeit (t-Prozess) aus den Messzeiten mit Gleichung (2).
t-Prozess = ti -t Stopp + tVerzögerung (2)
Dabei ist ti die Messzeitklassen, die nach dem Stoppen des Durchflusses beginnen, tstop ist die Messzeit, die unmittelbar nach dem Stoppen des Durchflusses beginnt, und tdelay ist die Verzögerungszeit. - Zeichnen Sie die q-abhängige Intensität I(q) als Funktion der Prozesszeit unter Verwendung der in Schritt 8.2 definierten Zeitklassen und des in Schritt 9.1 berechnetent-Prozesses.
HINWEIS: Die früheste zugängliche Prozesszeit ist durch tVerzögerung begrenzt. Um frühere Prozesszeitpunkte zu messen, erhöhen Sie den Gesamtdurchfluss (Q) oder verringern Sie das Gesamtvolumen des Hohlraums (V-Hohlraum). - Extrahieren Sie die interessierenden kinetischen Parameter aus der Änderung von I(q) als Funktion der Prozesszeit.
10. Beenden Sie das Experiment.
- Schalten Sie den Neutronenstrahl aus, indem Sie den lokalen Instrumentenverschluss schließen.
- Führen Sie eine Strahlungsprüfung mit einem vom Strahlrohr bereitgestellten Strahlungsmonitor durch, bevor Sie Teile, Rohre oder Proben oder gemischte Probenbehälter entladen.
- Übergeben Sie die Spritzen, den Schlauch und den Mischprobenbehälter an die Abteilung für Gesundheitsphysik.
- Füllen Sie die Formulare für Gesundheitsphysik aus und warten Sie auf die Bewertung durch das Personal der Gesundheitsphysik.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Die hier gezeigten repräsentativen Neutronendaten messen die Lipidaustauschkinetik in Gegenwart von Methyl-β-Cyclodextrin (mβCD), einem Additiv, das den Lipidaustausch zwischen Vesikeln mit der Austauschrate (ke)66,67 katalysiert. Frühere Fluoreszenzstudien haben gezeigt, dass ke von der mβCD-Konzentration abhängt und die Halbwertszeit des Austauschprozesses in der Größenordnung von68 Minuten liegt. Die vorlie...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Das aktuelle Verfahren beschreibt das Mischgerät und die Schritte zur Durchführung von TR-SANS-Messungen mit gestopptem Durchfluss. Das Gerät und das Protokoll sind für flüssige Proben mit niedriger Viskosität optimiert, bei denen die interessierenden Zeitskalen ≈1 s bis 5 min betragen. Bei Zeitskalen von mehr als 5 Minuten kann es einfacher und wünschenswerter sein, die Proben manuell zu mischen und in Standard-Streuzellen zu laden, insbesondere bei hochviskosen Proben, Gelen oder Pasten. Der Zugriff auf Zeitsk...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben keine Interessenkonflikte zu erklären.
Danksagungen
Der Zugang zum NG3 VSANS wurde vom Center for High-Resolution Neutron Scattering bereitgestellt, einer Partnerschaft zwischen dem National Institute of Standards and Technology und der National Science Foundation im Rahmen der Vereinbarung Nr. DMR-2010792. M.H.L.N bedankt sich für die Finanzierung durch Mitacs Globalink (Kanada). Die Identifizierung kommerzieller Produkte oder Handelsnamen dient der Förderung des Verständnisses und impliziert keine Befürwortung oder Empfehlung durch das National Institute of Standards and Technology.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Dynamic mixer | Analytical Scientific Instruments | 462-0150A | Magnetically coupled rotor, binary dynamic mixer assembly (ternary type available), 0.15 mL dead volume (larger dead volume available) |
| Fluoropolymer tubing | IDEX Health & Science | 1507L | PFA Tubing Natural 1/16 inch OD x 0.040 inch ID x 50 ft |
| Fluoropolymer 1/4-28 flangeless fittings | IDEX Health & Science | XP-245 | PFA flangeless fitting with ferrules, 1/4-28 threading, 1/16 inch OD tubing |
| Glass syringes | Hamilton Company | 81660 | Hamilton 1000 series syringes, 10 mL (81660), model 1010 C syr, 1/4"-28 thread termination, other volumes available |
| High-pressure flow selector valves | Vici Valco | C85X-1570EUTB | Vici 10 position selector valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure switch valves | Vici Valco | C82X-1574EUHB | Vici 4 port switch valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure syringes | Cetoni | A2019000358 | 3 mL stainless steel syringe, 510 bar max, 21 mL/min flow rate max |
| Low-pressure flow selector valves | Vici Valco | C25-3180EUHB | Vici 10 position selector valves, max 250 psi liquid, 0.75 mm bore, 1/16 inch OD tubing, 1/4-28 threaded ports, USB universal actuator |
| neMESYS high-pressure syringe pumps | Cetoni | A3921000103 | Max force 2600 N |
| neMESYS mid-pressure syringe pumps | Cetoni | A3921000131 | Max force 1000 N |
| Power supply | Cetoni | A3921000127 | Base 600, supplies power for up to 4 high pressure pumps |
| Quartz flow-through sample cell | Starna Scientific | 3-2.30-Q-1/TC | Quartz micro flow cells, 2 mm path length (1 mm available), 2 mm by 2 mm by 30 mm internal dimension |
| Quartz windows | Technical Glass Products | NA | GE 124 Clear fused quartz ground and polished plates, 11.75 inch by 23.75 inch by 0.375 inch thick |
| Stainless steel 10-32 coned compression fittings | IDEX Health & Science | U-321X, U-320X | 316 stainless steel ferrule (U-321X) and nut (U-320X) -Valco type, 10-32 coned, for 1/16 inch OD stainless steel tubing |
| Stainless steel tubing | IDEX Health & Science | U-102 | Stainless Steel Tubing 1/16 inch OD x 0.020 inch ID, 10 cm, various precut lengths available |
| Syringe pump control software | Cetoni | T6000000004 | QmixElements software for nemesys pumps, QmixSDK software development kit |
| Thermoelectric air conditioner | EIC Solutions | AAC-140C-4XT-HC | Thermoelectric air conditioner mounted on insulated enclosure to control the pump, valve, mixer, and sample temperature |
| T-slot railing | McMaster-Carr | 47065T103 | Aluminum t-slotted railing (1.5 inch by 1.5 inch) cut to various lengths |
| Vapor locking bottle caps | Cole-Parmer | EW-12018-02 | Four 304 SS port inserts, 1/4"-28 threads, GL45 bottle cap size, PTFE body, SS threads, PP collar |
Referenzen
- Melnichenko, Y. B., Wignall, G. D. Small-angle neutron scattering in materials science: Recent practical applications. Journal of Applied Physics. 102 (2), 021101(2007).
- Grillo, I. Small-angle neutron scattering and applications in soft condensed matter. Soft Matter Characterization. Borsali, R., Pecora, R. , Springer. Dordrecht. (2008).
- Hollamby, M. J. Practical applications of small-angle neutron scattering. Physical Chemistry Chemical Physics. 15 (26), 10566-10579 (2013).
- Pipich, V., Fu, Z. KWS-3: Very small angle diffractor with focusing mirror. Journal of large-scale research. 1, 31(2015).
- Kline, S. 2019 NCNR Annual Report, Special Publication (NIST SP). , National Institute of Standards and Technology. Gaithersburg, MD. (2019).
- Gilbert, P. H., et al. Preservative induced polysorbate 80 micelle aggregation. Journal of Pharmaceutical Sciences. 10 (6), 2395-2404 (2021).
- Terashima, T., et al. In situ and time-resolved small-angle neutron scattering observation of star polymer formation via arm-linking reaction in ruthenium-catalyzed living radical polymerization. Macromolecules. 43 (19), 8218-8232 (2010).
- Hashimoto, K., Fujii, K., Nishi, K., Shibayama, M. Ion gel network formation in an ionic liquid studied by time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 122 (40), 9419-9424 (2018).
- Conn, C. E., et al. Membrane protein structures in lipid bilayers; small-Angle neutron scattering with contrast-matched bicontinuous cubic phases. Frontiers in Chemistry. 8, 619470(2021).
- van't Hag, L., et al. Protein-eye view of the in meso crystallization mechanism. Langmuir. 35 (25), 8344-8356 (2019).
- Mahieu, E., et al. Observing protein degradation by the PAN-20S proteasome by time-resolved neutron scattering. Biophysical Journal. 119 (2), 375-388 (2020).
- Ibrahim, Z., et al. Time-resolved neutron scattering provides new insight into protein substrate processing by a AAA+ unfoldase. Scientific Reports. 7 (1), 40948(2017).
- Hollamby, M. J., et al. Growth of mesoporous silica nanoparticles monitored by time-resolved small-angle neutron scattering. Langmuir. 28 (9), 4425-4433 (2012).
- Blin, J. L., Impéror-Clerc, M. Mechanism of self-assembly in the synthesis of silica mesoporous materials: in situ studies by X-ray and neutron scattering. Chemical Society Reviews. 42 (9), 4071-4082 (2013).
- Impéror-Clerc, M., Grillo, I., Khodakov, A. Y., Durand, D., Zholobenko, V. L. New insights into the initial steps of the formation of SBA-15 materials: an in situ small angle neutron scattering investigation. Chemical Communications. 8, 834-836 (2007).
- Narayanan, T., Rüter, A., Olsson, U. SAXS/WAXS investigation of amyloid-β(16-22) peptide nanotubes. Frontiers in Bioengineering and Biotechnology. 9, 654349(2021).
- Angelov, B., et al. DNA/Fusogenic lipid nanocarrier assembly: millisecond structural dynamics. The Journal of Physical Chemistry Letters. 4 (11), 1959-1964 (2013).
- Amann, M., et al. Kinetic pathways for polyelectrolyte coacervate micelle formation revealed by time-resolved synchrotron SAXS. Macromolecules. 52 (21), 8227(2019).
- Varga, Z., Wacha, A., Bóta, A. Osmotic shrinkage of sterically stabilized liposomes as revealed by time-resolved small-angle X-ray scattering. Journal of Applied Crystallography. 47 (1), 35-40 (2014).
- Panine, P., Finet, S., Weiss, T. M., Narayanan, T. Probing fast kinetics in complex fluids by combined rapid mixing and small-angle X-ray scattering. Advances in Colloid and Interface Science. 127 (1), 9-18 (2006).
- Grillo, I. Applications of stopped-flow in SAXS and SANS. Current Opinion in Colloid & Interface Science. 14 (6), 402-408 (2009).
- Gomez-Hens, A., Perez-Bendito, D. The stopped-flow technique in analytical chemistry. Analytica Chimica Acta. 242, 147-177 (1991).
- Patel, J. T., Belsham, H. R., Rathbone, A. J., Friel, C. T. Use of stopped-flow fluorescence and labeled nucleotides to analyze the ATP turnover cycle of kinesins. Journal of Visualized Experiments: JoVE. (92), e52142(2014).
- Biro, F. N., Zhai, J., Doucette, C. W., Hingorani, M. M. Application of stopped-flow kinetics methods to investigate the mechanism of action of a DNA repair protein. Journal of Visualized Experiments: JoVE. (37), e1874(2010).
- Raney, K. D., Sowers, L. C., Millar, D. P., Benkovic, S. J. A fluorescence-based assay for monitoring helicase activity. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6644-6648 (1994).
- Roder, H., Maki, K., Cheng, H. Early events in protein folding explored by rapid mixing methods. Chemical reviews. 106 (5), 1836-1861 (2006).
- Milon, A., et al. Osmotic swelling of unilamellar vesicles by the stopped-flow light scattering method. Influence of vesicle size, solute, temperature, cholesterol and three α,ω-dihydroxycarotenoids. Biochimica et Biophysica Acta (BBA) - Biomembranes. 859 (1), 1-9 (1986).
- Gast, K., Nöppert, A., Müller-Frohne, M., Zirwer, D., Damaschun, G. Stopped-flow dynamic light scattering as a method to monitor compaction during protein folding. European Biophysics Journal. 25 (3), 211-219 (1997).
- Antoun, A., Pavlov, M. Y., Tenson, T., Ehrenberg, M. M. Ribosome formation from subunits studied by stopped-flow and Rayleigh light scattering. Biological Procedures Online. 6, 35-54 (2004).
- Zhu, Z., Armes, S. P., Liu, S. pH-Induced micellization kinetics of ABC triblock copolymers measured by stopped-flow light scattering. Macromolecules. 38 (23), 9803-9812 (2005).
- Ye, J., et al. Comparative study of temperature-induced association of cyclic and linear poly(N-isopropylacrylamide) chains in dilute solutions by laser light scattering and stopped-flow temperature jump. Macromolecules. 41 (12), 4416-4422 (2008).
- Liu, X., et al. Early stage kinetics of polyelectrolyte complex coacervation monitored through stopped-flow light scattering. Soft Matter. 12 (44), 9030-9038 (2016).
- Garman, E. F., Weik, M. X-ray radiation damage to biological samples: recent progress. Journal of Synchrotron Radiation. 26 (4), 907-911 (2019).
- Garg, S., Porcar, L., Woodka, A. C., Butler, P. D., Perez-Salas, U. Noninvasive neutron scattering measurements reveal slower cholesterol transport in model lipid membranes. Biophysical Journal. 101 (2), 370-377 (2011).
- Marquardt, D., et al. 1H NMR shows slow phospholipid flip-flop in gel and fluid bilayers. Langmuir. 33 (15), 3731-3741 (2017).
- Egelhaaf, S. U., Olsson, U., Schurtenberger, P. Time-resolved SANS for surfactant phase transitions. Physica B: Condensed Matter. 276-278, 326-329 (2000).
- Tabor, R. F., Eastoe, J., Grillo, I. Time-resolved small-angle neutron scattering as a lamellar phase evolves into a microemulsion. Soft Matter. 5 (10), 2125-2129 (2009).
- Gradzielski, M., Bergmeier, M., Hoffmann, H., Müller, M., Grillo, I. Vesicle gel formed by a self-organization process. The Journal of Physical Chemistry B. 104 (49), 11594-11597 (2000).
- Lee, Y. -T., Li, D. S., Pozzo, L. D. Kinetic analysis of ultrasound-induced oil exchange in oil-in-water emulsions through contrast variation time-resolved small-sngle neutron scattering. Langmuir. 35 (47), 15204-15213 (2019).
- Lee, Y. -T., Pozzo, L. D. Contrast-variation time-resolved small-angle neutron scattering analysis of oil-exchange kinetics between oil-in-water emulsions stabilized by anionic surfactants. Langmuir. 35 (47), 15192-15203 (2019).
- Roger, K., Olsson, U., Schweins, R., Cabane, B. Emulsion ripening through molecular exchange at droplet contacts. Angewandte Chemie International Edition. 54 (5), 1452-1455 (2015).
- Nakano, M., Fukuda, M., Kudo, T., Endo, H., Handa, T. Determination of Interbilayer and Transbilayer Lipid Transfers by Time-Resolved Small-Angle Neutron Scattering. Physical Review Letters. 98 (23), 238101(2007).
- Nakano, M., et al. Flip-flop of phospholipids in vesicles: kinetic analysis with time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 113 (19), 6745-6748 (2009).
- Nguyen, M. H. L., et al. Methanol accelerates DMPC flip-flop and transfer: A SANS study on lipid dynamics. Biophysical Journal. 116 (5), 755-759 (2019).
- Nguyen, M. H. L., et al. Peptide-induced Lipid flip-flop in asymmetric liposomes measured by small angle neutron scattering. Langmuir. 35 (36), 11735-11744 (2019).
- Nguyen, M. H. L., et al. Time-resolved SANS reveals pore-forming peptides cause rapid lipid reorganization. New Journal of Chemistry. 45 (1), 447-456 (2021).
- Xia, Y., et al. Effects of nanoparticle morphology and acyl chain length on spontaneous lipid transfer rates. Langmuir. 31 (47), 12920-12928 (2015).
- Xia, Y., et al. Morphology-induced defects enhance lipid transfer rates. Langmuir. 32 (38), 9757-9764 (2016).
- Maric, S., et al. Time-resolved small-angle neutron scattering as a probe for the dynamics of lipid exchange between human lipoproteins and naturally derived membranes. Scientific Reports. 9 (1), 7591(2019).
- Nielsen, J. E., Bjørnestad, V. A., Pipich, V., Jenssen, H., Lund, R. Beyond structural models for the mode of action: How natural antimicrobial peptides affect lipid transport. Journal of Colloid and Interface Science. 582, 793-802 (2021).
- Willner, L., Poppe, A., Allgaier, J., Mokenbusch, M., Richter, D. TIme-resolved SANS for the determintioan of unimer exchange kinetics in block copolymer micelles. Europhysics Letters. 55 (5), 667(2001).
- Lund, R., Willner, L., Stellbrink, J., Lindner, P., Richter, D. Logarithmic chain-exchange kinetics of diblock copolymer micelles. Physical Review Letters. 96 (6), 068302(2006).
- Lund, R., Willner, L., Richter, D., Dormidontova, E. E. Equilibrium chain exchange kinetics of diblock copolymer micelles: Tuning and logarithmic relaxation. Macromolecules. 39 (13), 4566-4575 (2006).
- Lund, R., Willner, L., Richter, D. Kinetics of block copolymer micelles studied by small-angle scattering methods. in Controlled Polymerization and Polymeric Structures. Advances in Polymer Science. Abe, A., Lee, K. S., Leibler, L., Kobayashi, S. , Springer. Cham. 51(2013).
- Choi, S. -H., Lodge, T. P., Bates, F. S. Mechanism of molecular exchange in diblock copolymer micelles: hypersensitivity to core chain length. Physical Review Letters. 104 (4), 047802(2010).
- Choi, S. -H., Bates, F. S., Lodge, T. P. Molecular exchange in ordered diblock copolymer micelles. Macromolecules. 44 (9), 3594-3604 (2011).
- Lu, J., Bates, F. S., Lodge, T. P. Chain exchange in binary copolymer micelles at equilibrium: confirmation of the independent chain hypothesis. ACS Macro Letters. 2 (5), 451-455 (2013).
- Lu, J., Bates, F. S., Lodge, T. P. Remarkable effect of molecular architecture on chain exchange in triblock copolymer micelles. Macromolecules. 48 (8), 2667-2676 (2015).
- Kelley, E. G., et al. Size evolution of highly amphiphilic macromolecular solution assemblies via a distinct bimodal pathway. Nature Communications. 5 (1), 3599(2014).
- Murphy, R. P., Kelley, E. G., Rogers, S. A., Sullivan, M. O., Epps, T. H. Unlocking chain exchange in highly amphiphilic block polymer micellar systems: influence of agitation. ACS Macro Letters. 3 (11), 1106-1111 (2014).
- Schantz, A. B., et al. PEE-PEO block copolymer exchange rate between mixed micelles is detergent and temperature activated. Macromolecules. 50 (6), 2484-2494 (2017).
- Lantz, K. A., et al. Cavitation enables switchable and rapid block polymer exchange under high-χN conditions. Macromolecules. 51 (17), 6967-6975 (2018).
- Murphy, R. P., et al. Capillary RheoSANS: measuring the rheology and nanostructure of complex fluids at high shear rates. Soft Matter. 16 (27), 6285-6293 (2020).
- Stopped Flow Sans. usnistgov. , Available from: https://github.com/usnistgov/stopped-flow-sans (2021).
- Kline, S. Reduction and analysis of SANS and USANS data using IGOR Pro. Journal of Applied Crystallography. 39 (6), 895-900 (2006).
- Doktorova, M., et al. Preparation of asymmetric phospholipid vesicles for use as cell membrane models. Nature Protocols. 13 (9), 2086-2101 (2018).
- Huang, Z., London, E. Effect of cyclodextrin and membrane lipid structure upon cyclodextrin-lipid interaction. Langmuir. 29 (47), 14631-14638 (2013).
- Sugiura, T., Ikeda, K., Nakano, M. Kinetic analysis of the methyl-β-cyclodextrin-mediated intervesicular transfer of pyrene-labeled phospholipids. Langmuir. 32 (51), 13697-13705 (2016).
- Scott, H. L., et al. On the mechanism of bilayer separation by extrusion, or why your LUVs are not really unilamellar. Biophysical Journal. 117 (8), 1381-1386 (2019).
- Dicko, C., et al. NUrF-Optimization of in situ UV-vis and fluorescence and autonomous characterization techniques with small-angle neutron scattering instrumentation. Review of Scientific Instruments. 91 (7), 075111(2020).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten