Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Hochdurchsatz-, robuste und hochzeitflexible Methode zur Oberflächensterilisation von Arabidopsis-Samen
In diesem Artikel
Zusammenfassung
Ein Hochdurchsatzprotokoll für die Oberflächensterilisation von Arabidopsisthaliana (Arabidopsis) -Samen wird bereitgestellt, das die Liquid-Handling-Schritte mit einer einfachen Absaugvorrichtung, die mit einer Vakuumpumpe konstruiert ist, optimiert. Hunderte von Samenproben können an einem Tag oberflächensterilisiert werden.
Zusammenfassung
Arabidopsis ist bei weitem die Pflanzenmodellart, die am häufigsten für funktionelle Studien verwendet wird. Die Oberflächensterilisation von Arabidopsis-Samen ist ein grundlegender Schritt, der zu diesem Zweck erforderlich ist. Daher ist es von größter Bedeutung, Arabidopsis-Samenoberflächensterilisationsmethoden mit hohem Durchsatz zu etablieren, um Dutzende bis Hunderte von Proben (z. B. transgene Linien, Ökotypen oder Mutanten) gleichzeitig zu verarbeiten. In dieser Studie wird eine Saatgutoberflächensterilisationsmethode vorgestellt, die auf der effizienten Eliminierung von Flüssigkeit in Röhrchen mit einer selbstgebauten Absaugvorrichtung basiert, die aus einer herkömmlichen Vakuumpumpe besteht. Durch die drastische Reduzierung der arbeitsintensiven Hands-on-Zeit mit dieser Methode ist die Handhabung von mehreren hundert Proben an einem Tag mit wenig Aufwand möglich. Reihen-Zeitverlaufsanalysen zeigten ferner einen hochflexiblen Zeitbereich der Oberflächensterilisation durch Aufrechterhaltung hoher Keimraten. Diese Methode könnte leicht für die Oberflächensterilisation anderer Arten von kleinen Samen mit einfacher Anpassung der Saugvorrichtung an die Samengröße und die gewünschte Geschwindigkeit zur Beseitigung der Flüssigkeit angepasst werden.
Einleitung
Arabidopsis ist eine diploide Pflanzenart aus der Familie der Brassicaceae. Sein relativ kurzer Lebenszyklus (zwei Monate pro Generation unter langen Wachstumsbedingungen), die geringe Pflanzengröße und die Selbstbestäubung mit der Produktion von Hunderten von Samen pro Pflanze haben es zur ersten grundlegenden Pflanzenmodellartgemacht 1,2. Darüber hinaus wurde sein Genom vollständig sequenziert3,umfangreiche reverse genetische Werkzeuge (gesättigte T-DNA, Transposon und chemisch mutagene Populationen) sind verfügbar4,5,6, und eine effektive Agrobacterium-vermittelteTransformation ist gut etabliert, um genügend transgene Linien für weitere nachgelagerte Arbeiten zu erhalten7 . So wurden in den letzten zwei Jahrzehnten große Fortschritte erzielt, indem Arabidopsis als Modellart verwendet wurde, um verschiedene Aspekte der Pflanzenbiologie auf molekularer Ebene zu sezieren, einschließlich natürlicher, genetischer und phänotypischer Variationen8,9.
Um Gene von Interesse an Arabidopsis funktionell zu charakterisieren, ist die Sterilisation der Samenoberfläche zur Beseitigung von Pilz- und Bakterienverunreinigungen die Voraussetzung für viele nachgeschaltete Protokolle, die axenische Kulturen erfordern. Genetische Transformation für die Überexpression10, Knock-Down (RNA-I11) oder Knock-Out (Genome Editing12,13) der Genfunktion, subzelluläre Lokalisation14, Promotoraktivität15,16, Protein-Protein17 und Protein-DNA-Interaktion18, um nur die häufigsten Anwendungen zu nennen, erfordern alle einen Samenoberflächen-Sterilisationsschritt. So spielt die Samenoberflächensterilisation trotz ihrer relativen Einfachheit in vielen Funktionsanalysen eine grundlegende Rolle.
Bisher wurden zwei Hauptkategorien von Saatgutoberflächensterilisationsverfahren entwickelt, die entweder auf der Gas- oder auf der Flüssigphasensterilisationbasieren 19. Während der Durchsatz der Gasphasen-Seed-Oberflächensterilisation mittel bis hoch ist, hat die Verwendung des gefährlichen ReagenzChlorgases als Oberflächensterilisationsmittel seine breite Anwendung behindert. Methoden, die auf der Flüssigphasensterilisation basieren, beruhen im Gegenteil auf milderen Chemikalien wie Ethanol und Bleichlösungen für die Oberflächensterilisation und werden häufiger verwendet, obwohl sie von Natur aus einen geringeren Durchsatz haben als die Chlorbegasung. Im Allgemeinen werden zwei verschiedene Methoden verwendet, die flüssige Reagenzien verwenden. Eine weitgehend verwendete Methode basiert auf dem Waschen mit Ethanol und Bleichmittel in unterschiedlichen Konzentrationen für unterschiedliche Zeitdauer20,21. Eine andere Methode basiert auf der Anwendung von Bleichmittel nur21,22. Beide Methoden werden hauptsächlich für die kleinräumige Sterilisation von Saatgutoberflächen angewendet. In vielen Experimenten ist es jedoch notwendig, viele transgene Arabidopsis-Linien, die von einer Transformation15,23 abgeleitetsind,zu screenen oder parallel viele transgene Linien zu screenen, die aus verschiedenen Transformationen erzeugt wurden24,25. Nach unserem besten Wissen wurde keine flüssigkeitsbasierte Methode zur Hochdurchsatz-Samenoberflächensterilisation veröffentlicht, die, wenn auch wenig erkannt, einen wichtigen Engpass für funktionelle Genomik-Ansätze darstellt. Daher ist die Entwicklung sicherer, robuster und Hochdurchsatzmethoden für die Sterilisation von Saatgutoberflächen ein notwendiger und kritischer Schritt für den Erfolg der funktionellen Charakterisierung vieler Gene auf einmal.
Zu diesem Zweck wird in der aktuellen Studie eine verbesserte Methode zur Oberflächensterilisation von Arabidopsis-Samen vorgestellt. Diese Methode ist sicher, kostengünstig, äußerst robust und mit hohem Durchsatz ausgestattet und ermöglicht die Handhabung von 96 unabhängigen Linien innerhalb einer Stunde vom Beginn der Samenoberflächensterilisation bis zum Ende der Saatgutaussaat in Petrischalen. Die demonstrierte Methode stützt sich auf weit verbreitete, grundlegende Laborinstrumente wie eine Vakuumpumpe, Verbrauchsglaswaren und Kunststoffwaren. Diese verbesserte Methode bietet der wissenschaftlichen Gemeinschaft einen sicheren, einfachen und erschwinglichen Ansatz zur Rationalisierung der Samenoberflächensterilisation mit einem Durchsatz, der für moderne funktionelle Genomikansätze bei Arabidopsis und anderen Nicht-Modellpflanzenarten geeignet ist.
Protokoll
1. Reagenzien und Medienvorbereitung
- 70% ige Ethanollösung zubereiten: Fügen Sie 737 ml 95% technisches Ethanol zu 263 ml destilliertem Wasser hinzu. Gründlich mischen.
HINWEIS: Bereiten Sie 70% ige Ethanollösung auf einem nicht sterilen Arbeitstisch vor.
VORSICHT: Ethanol ist leicht entzündlich und kann die Augen ernsthaft reizen. Von Flammen und Wärmequellen fernhalten. Bei Kontakt mit den Augen mit reichlich Wasser abspülen. - 5% ige Bleichlösung zubereiten: Fügen Sie 5 ml Haushaltsbleiche (mit ~ 3,5% Natriumhypochlorit, NaClO) zu 95 ml sterilem destilliertem Wasser hinzu. Fügen Sie ein paar Tropfen nichtionisches Reinigungsmittel (z. B. Tween 20) hinzu und mischen Sie es gründlich.
HINWEIS: Bereiten Sie 5% ige Bleichlösung in der laminaren Haube vor.
VORSICHT: Natriumhypochlorit, der aktive Bestandteil von Bleichmittel, ist sehr reizend. Es ist sehr korrosiv und kann schwere Schäden am Magen-Darm-Trakt verursachen. Bei Kontakt sofort mit reichlich Wasser abspülen. Im Falle einer Einnahme rufen Sie die Giftnotrufzentrale oder einen Arzt an, um eine Behandlungsberatung zu erhalten. - Bereiten Sie halbkräftige Murashige und Skoog (1/2 MS) Medium26 vor.
- 2,2 g MS-Mediumpulver (einschließlich Vitamine) und 10 g Saccharose in 800 ml destilliertem Wasser zugeben. Stellen Sie den pH-Wert der Lösung mit 1 M KOH ein und bringen Sie das Volumen mit destilliertem Wasser auf 1 L. Aliquot 500 ml in eine 1 L Flasche und fügen Sie 4 g Agar hinzu, um ein festes Medium herzustellen. Autoklavieren Sie die Lösung.
- Nach dem Autoklavieren das Medium in einem Wasserbad auf 50-53 °C abkühlen und in Petrischalen unter der Laminar-Flow-Haube gießen. Zur Herstellung des selektiven Mediums werden 1000 μL/L 50 mg/ml Kanamycin-Stammlösung (mischen Sie 500 mg Kanamycinsulfat-Monohydrat in 10 ml destilliertem Wasser, filtrieren sie sterilisieren und bei -20 °C lagern) in das Medium (50-53 °C) gegeben. Mischen Sie gut durch Schwenken und gießen Sie in Petrischalen, wie bereits erwähnt.
2. Aspirator-Setup
HINWEIS: Der Geräteaufbau ist in Abbildung 1zusammengefasst.
- Schließen Sie den Einlass der Vakuumpumpe an ein Ende eines Polyethylenrohrs (PE) geeigneter Größe an. Verbinden Sie das andere Ende des Rohres mit dem Auslass des Zwei-Wege-Deckels der Dekantierungsflasche. Wickeln Sie die Verbindung des Schlauches fest mit einerDichtungsfolie( Table of Materials ), um eine luftdichte Verbindung zu gewährleisten.
- Verbinden Sie ein zweites PE-Rohr mit dem Einlass (dem Loch, das an die Innenseite der Flasche ragt) der Schraubkappe der Dekantationsflasche. Passen Sie die andere Seite des Rohres an den Auslass eines Aquarienventils an. Falls erforderlich, wickeln Sie mit einer Dichtungsfolie entlang der Verbindung, um Luftleckagen zu vermeiden.
- Befestigen Sie kurz vor Gebrauch eine sterile 200 μL Pipettenspitze am Einlass des Aquarienfilters unter der Laminar-Flow-Haube.
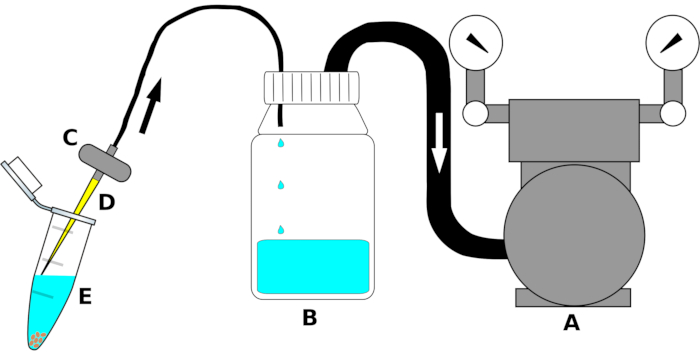
Abbildung 1: Schematische Zeichnung der Absaugvorrichtung zur Hochdurchsatzentnahme von Sterilisationsflüssigkeiten. Aus Gründen der Übersichtlichkeit werden die einzelnen Teile nicht maßstabsgetreu gezeichnet. Buchstabe(A)bezeichnet die Vakuumpumpe,(B)die Reservoirflasche zum Sammeln von Flüssigkeiten (Ethanol, Bleichmittel oder steriles Wasser), (C) das Ventil zur Vermeidung des Rückflusses der Flüssigkeiten, (D) die sterile 200 μL Pipettenspitze und (E) das 1,5 ml Mikrozentrifugenröhrchen, das Samen und Sterilisationsflüssigkeit enthält. Pfeile zeigen die Richtung des Luftstroms an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Hochdurchsatz-Flüssigoberflächensterilisation von Samen
HINWEIS: Das Gesamtverfahren und die minimale Zeit, die für die Oberflächensterilisation von Arabidopsis thaliana (L.) Heynh Wildtyp (Col-0) (Arabidopsis) Samen mit 96 unabhängigen Proben erforderlich sind, sind in Abbildung 2zusammengefasst.
- Etikettieren Sie mit einem Permanentmarker zwei Chargen von 48 x 1,5 ml Mikrozentrifugenröhrchen mit progressiven Zahlen.
- Geben Sie 100-200 Arabidopsis-Samen zu jedem der 96 sterilen 1,5 ml Mikrozentrifugenröhrchen (etwa 1-2 mm über dem Boden des konischen Endes des Röhrchens).
- Aliquot etwa 1000 μL 70% Ethanol in jedes Röhrchen mit einer 10 ml sterilen serologischen Pipette in der Laminar-Flow-Haube (Seed Batch one, 48 Röhrchen) und schließen Sie vorsichtig die Deckel.
HINWEIS: Die Dosierung der Lösungen muss nicht sehr genau sein, solange das dosierte Volumen um ein Vielfaches höher ist als das Volumen der Samen. Alternativ können Sie diesen Schritt außerhalb der laminaren Haube durchführen (nicht steriler Zustand). - Schütteln Sie die Röhren bei einer Schwingungsfrequenz von 8,0 Hz für mindestens 3 min in einem Shaker.
- Nehmen Sie die Adapter aus dem Shaker und geben Sie sie in den Korb einer Tischmikrozentrifuge.
- Drehen Sie die Samen mit der Pulsfunktion (in den meisten Tischzentrifugen vorhanden) schnell herunter, um 1880 x g (~ 15 s) zu erreichen.
HINWEIS: Längere Zeit oder höhere Zentrifugationskräfte wirken sich negativ auf die Samenkeimung aus. - Übertragen Sie die 48 Röhren von den Adaptern auf ein Rack und öffnen Sie alle Rohre unter der Laminar-Flow-Haube. Vermeiden Sie Verunreinigungen, indem Sie den Teil der Deckel, der in die Röhrchen passt, nicht berühren. Wenn die Deckel zu nahe beieinander liegen, teilen Sie die Rohre zur einfacheren Handhabung in zwei Racks auf.
- Setzen Sie eine sterile 200 μL gelbe Spitze auf den Aquarienventileinlass des selbstgebauten Saugers unter der Laminar-Flow-Haube und schalten Sie die Pumpe ein.
- Führen Sie die gelbe Spitze knapp über dem Niveau der Samen ein, um zu vermeiden, dass die Samen beim Saugen der Flüssigkeit berührt werden. Alternativ können Sie die Spitze schnell an der Unterseite des Rohrs positionieren. Wenn ein Samen das Absaugen der Flüssigkeit blockiert, entfernen Sie die gelbe Spitze und legen Sie eine neue ein.
- Aliquot in jedes Röhrchen um 1000 μL 5% Bleichmittel mit einer 10 ml sterilen serologischen Pipette in der Laminar-Flow-Haube.
- Schließen Sie alle Deckel fest und stecken Sie alle Schläuche wieder in die Shaker-Adapter. Schütteln Sie die Röhren mit einer Schwingungsfrequenz von 8,0 Hz für mindestens 3 min im Shaker.
- Drehen Sie die Samen schnell mit der Pulsfunktion der Tischzentrifuge für die Zeit herunter, die erforderlich ist, um 1880 x g (~ 15 s) zu erreichen.
- Setzen Sie eine neue sterile 200 μL gelbe Spitze auf das Aquarienventil, das mit der Vakuumpumpe unter der Laminar-Flow-Haube verbunden ist, und schalten Sie die Pumpe ein.
- Führen Sie die gelbe Spitze über das Niveau der Samen ein, um zu vermeiden, dass die Samen beim Saugen der Bleichlösung berührt werden.
- Aliquot in jedes Röhrchen ca. 1000 μL sterilisiertesH2O unter Verwendung einer 10 ml sterilen serologischen Pipette in der Laminar-Flow-Haube.
HINWEIS: Kombinieren Sie die beiden Samenchargen, um die Betriebszeit zu minimieren. - Setzen Sie eine neue sterile 200 μL gelbe Spitze auf das Aquarienventil, das mit der Vakuumpumpe unter der Laminar-Flow-Haube verbunden ist, und schalten Sie die Pumpe ein.
- Setzen Sie die gelbe Spitze knapp über dem Niveau der Samen ein, um zu vermeiden, dass die Samen beim Saugen desH2O berührt werden.
- Aliquot in jedes Röhrchen ca. 500 μL sterilisiertesH2Omit einer 10 mL sterilen serologischen Pipette und schließen Sie alle Deckel in der Laminar-Flow-Haube. Die Samen sind bereit, gesät zu werden. Bei Bedarf die Röhrchen maximal einige Stunden bei Raumtemperatur oder über Nacht bei 4 °C aufbewahren.
- Füllen Sie die Behälterflasche, die zum Sammeln von Flüssigkeit verwendet wird, mit einer ausreichenden Menge Wasser und autoklavieren Sie sie. Anschließend entsorgen Sie die Flüssigkeit in eine normale Spüle.
HINWEIS: Autoklavieren Sie die Flüssigkeit, um alle Samen im Reservoir abzutöten.
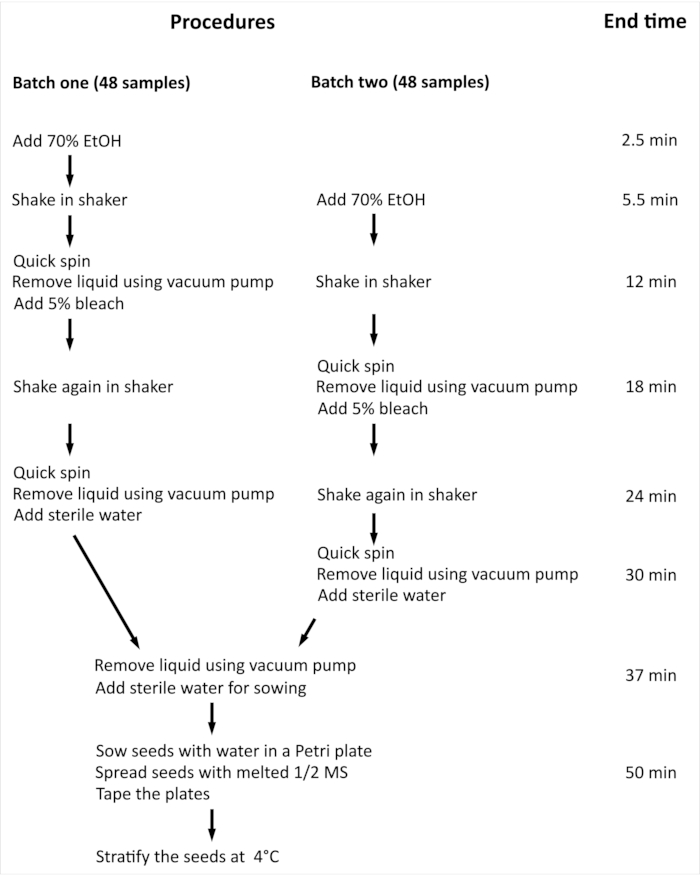
Abbildung 2: Überblick über das Verfahren und minimaler Zeitaufwand für die Oberflächensterilisation von Arabidopsis-Samen mit 96 unabhängigen Proben. Im vorgestellten Experiment werden 96 unabhängige Proben in zwei gleich großen Chargen gehandhabt. Der gesamte Vorgang ist für beide Chargen gleich, und sie werden parallel verarbeitet, aber Charge zwei wird mit einer Schrittverzögerung im Vergleich zu Charge eins verarbeitet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Beschichtung und Ritzung von Arabidopsis auf 1/2 MS-Platten
- Die Samen und 300-400 μL sterilesH2Owerden durch schonendes Pipettieren mit einer 1000 μL Pipette in eine Petrischale überführt.
- Nach dem Transfer von 10 Röhrchen werden etwa 1,5-2,0 ml geschmolzenes 1/2 MS-Medium ohne Antibiotika in jede Platte gegossen.
HINWEIS: Schmelzen Sie im Voraus und bewahren Sie dann das 1/2 MS geschmolzene Medium in einem Thermostatbad auf, das auf 50-53 °C eingestellt ist, um eine Erstarrung zu vermeiden. Achten Sie darauf, dass die Temperatur 58 °C nicht überschreitet, um eine Verringerung der Keimfähigkeit der Samen zu vermeiden. - Schwenken Sie die Platte schnell, um die Samen darin zu verteilen. Kleben Sie die Platten auf gegenüberliegenden Seiten ab.
- Wickeln Sie die Platten in eine Kunststoff- oder Aluminiumfolie und stellen Sie sie dann für 3 Tage im Dunkeln in einen Kühlschrank (4 °C), um eine gleichmäßige Keimung zu erhalten.
- Die Platten werden in eine auf 23 °C eingestellte Wachstumskammer unter langen Tagesbedingungen (16 h licht/8 h dunkel) mit einer Lichtintensität von 100-120 μmol·m-2·s-1 und 60% relativer Luftfeuchtigkeit überführt.
- Nach zwei Tagen bewerten Sie die Pflanzen durch das Vorhandensein von Radikeln. Erkennen Sie das Entstehen von Radikeln und die Bildung des grünen Keimblatts (vollständige Öffnung der beiden Keimblätter), um die Keimung der Samen zu bewerten.
5. Statistische Auswertungen
HINWEIS: Hier wurde tukeys paarweiser Test für statistische Analysen verwendet.
- Betrachten Sie die P-Werte unter 0,01 als statistisch signifikant. Führen Sie alle Experimente mindestens mit fünf biologischen Replikaten durch.
Ergebnisse
Um den Zeitaufwand für das gesamte Saatgutsterilisationsverfahren zu beurteilen, wurden die Zeitunterschiede für liquid handling 96 Proben im aktuellen Protokoll berechnet und mit herkömmlichen Pipettiermethoden verglichen. Das Ergebnis zeigt, dass das aktuelle Protokoll Zeit spart und die Zeit für die Handhabung von Flüssigkeiten auf ein Viertel der Zeit mit den herkömmlichen Protokollen reduziert (Tabelle 1). Die Tabelle hebt weiter hervor, dass die Flüssigkeitsentfernungszeit im aktuellen Proto...
Diskussion
Die Sterilisation von Samen ist der grundlegende Schritt für funktionelle Studien bei Arabidopsis. Obwohl es häufig für viele verschiedene Zwecke durchgeführt wird, sind begrenzte Studien zur Hochdurchsatz-Samenoberflächensterilisation bei Arabidopsis verfügbar.
Bisher ist eine der Methoden mit dem höchsten Durchsatz die Verwendung von Chlorgas, das durch Mischen von Bleichmittel mit konzentriertem HCl erzeugt wird. Obwohl diese Methode nur eine begrenzte praktische Zeit erfordert, verw...
Offenlegungen
Alle Autoren erklären keine Interessenkonflikte.
Danksagungen
Diese Forschung wurde von der Autonomen Provinz Trient durch eine Kernfinanzierung der Ecogenomics-Gruppe der Fondazione E. Mach finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Aquarium valve | Amazon | B074CYC5SD | Kit including 2 valves and thin-walled tubings. The valve prevents the liquids to go back to the sterile tip |
| Arabidopsis Col-0 wild-type seeds | Nottingham Arabidopsis Stock Center | N1093 | Wild type seeds (sensitive to kanamycin) |
| Arabidopsis transgenic line AdoIspS-79 seeds | NA | NA | Transgenic line overexpressing an isoprene synthase gene from Arundo donax transformed in the Col-0 background, resistant to kanamycin (Li et al. (2017) Mol. Biol. Evol., 34, 2583–2599). Available on request from the authors |
| Microcentrifuge | Eppendorf | EP022628188 | Benchtop microcentrifuge used for spinning down the seeds |
| Murashige & Skoog medium including vitamins | Duchefa | M0222 | Standard medium for plant sterile culture |
| Pipette controller | Brand | 26300 | Used to operate the serological pipette |
| Polyethylene tube 1 | Roth | 9591.1 | Tube for connection from vacuum pump to decantation bottle (inner diameter: 7 mm; outer diameter: 9 mm) |
| Polyethylene tube 2 | Roth | 9587.1 | Tube for connection from decantation bottle to the aquarium valve (inner diameter: 5 mm; outer diameter: 7 mm) |
| Screw cap with connectors | Roth | PY86.1 | 2-way dispenser screw cap GL45 in polypropylene for decanting bottle |
| Serological pipette | Brand | 27823 | Graduated glass (reusable) serological pipette. Disposable pipettes can be used instead |
| Shakeret al. | Qiagen | 85300 | TissueLyser II bead mill used normally for tissue homogenization. Without the addition of beads to the tubes it works as shaker. |
| Technical ethanol | ITW Reagents (Nova Chimica Srl) | 212800 | Ethanol 96% v/v partially denatured technical grade |
| Tween 20 | Merck Millipore | 655205 | Non-ionic detergent acting as surfactant |
| Universal tubing connectors | Roth | Y523.1 | Can be used to improve/simplify tubing connections |
| Vacuum pump | Merck Millipore | WP6222050 | Used for making the suction device |
Referenzen
- Somerville, C., Koornneef, M. A fortunate choice: The history of Arabidopsis as a model plant. Nature Reviews Genetics. 3 (11), 883-889 (2002).
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. Plant Journal. 61 (6), 909-921 (2010).
- Initiative, T. A. G. Analysis of the genome sequence of the flowering plant Arabidopsis thaliana. Nature. 408 (6814), 796-815 (2000).
- Krysan, P. J., Young, J. C., Sussman, M. R. T-DNA as an insertional mutagen in Arabidopsis. Plant Cell. 11 (12), 2283-2290 (1999).
- Speulman, E., et al. A two-component enhancer-inhibitor transposon mutagenesis system for functional analysis of the arabidopsis genome. Plant Cell. 11 (10), 1853-1866 (1999).
- Jander, G., et al. Ethylmethanesulfonate saturation mutagenesis in Arabidopsis to determine frequency of herbicide resistance. Plant Physiology. 131 (1), 139-146 (2003).
- Zhang, X., Henriques, R., Lin, S. -. S., Niu, Q. -. W., Chua, N. -. H. Agrobacterium-mediated transformation of Arabidopsis thaliana using the floral dip method. Nature Protocols. 1 (2), 641-646 (2006).
- Togninalli, M., et al. AraPheno and the AraGWAS catalog 2020: A major database update including RNA-Seq and knock-out mutation data for Arabidopsis thaliana. Nucleic Acids Research. 48 (1), 1063-1068 (2020).
- Lan, Y., et al. AtMAD: Arabidopsis thaliana multi-omics association database. Nucleic Acids Research. 49 (1), 1445-1451 (2021).
- Xu, J., Trainotti, L., Li, M., Varotto, C. Overexpression of isoprene synthase affects ABA-and drought-related gene expression and enhances tolerance to abiotic stress. International Journal of Molecular Sciences. 21 (12), 1-21 (2020).
- Czarnecki, O., et al. Simultaneous knock-down of six non-family genes using a single synthetic RNAi fragment in Arabidopsis thaliana. Plant Methods. 12 (1), 1-11 (2016).
- Yan, L., et al. high-efficiency genome editing in arabidopsis using YAO promoter-driven CRISPR/Cas9 system. Molecular Plant. 8 (12), 1820-1823 (2015).
- Liu, Y., Gao, Y., Gao, Y., Zhang, Q. Targeted deletion of floral development genes in Arabidopsis with CRISPR/Cas9 using the RNA endoribonuclease Csy4 processing system. Horticulture Research. 6 (1), (2019).
- Grefen, C., et al. Subcellular localization and in vivo interactions of the Arabidopsis thaliana ethylene receptor family members. Molecular Plant. 1 (2), 308-320 (2008).
- Gazzani, S., et al. Evolution of MIR168 paralogs in Brassicaceae. BMC Evolutionary Biology. 9 (1), (2009).
- Lee, S., Korban, S. S. Transcriptional regulation of Arabidopsis thaliana phytochelatin synthase (AtPCS1) by cadmium during early stages of plant development. Planta. 215 (4), 689-693 (2002).
- Long, Y., et al. In vivo FRET-FLIM reveals cell-type-specific protein interactions in Arabidopsis roots. Nature. 548 (7665), 97-102 (2017).
- Freire-Rios, A., et al. Architecture of DNA elements mediating ARF transcription factor binding and auxin-responsive gene expression in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 117 (39), 24557-24566 (2020).
- Rivero, L., et al. Handling arabidopsis plants: Growth, preservation of seeds, transformation, and genetic crosses. Methods in Molecular Biology. 1062, 3-25 (2014).
- Chen, J. H., et al. Drought and salt stress tolerance of an arabidopsis glutathione S-transferase U17 knock-out mutant are attributed to the combined effect of glutathione and abscisic acid. Plant Physiology. 158 (1), 340-351 (2012).
- Li, D. Z., et al. Comparative analysis of a large dataset indicates that internal transcribed spacer (ITS) should be incorporated into the core barcode for seed plants. Proceedings of the National Academy of Sciences of the United States of America. 108 (49), 19641-19646 (2011).
- Mathur, J., Koncz, C. Establishment and maintenance of cell suspension cultures. Arabidopsis Protocols. Methods in Molecular Biology. 82, 27-30 (1998).
- Li, M., Cappellin, L., Xu, J., Biasioli, F., Varotto, C. High-throughput screening for in planta characterization of VOC biosynthetic genes by PTR-ToF-MS. Journal of Plant Research. 133 (1), 123-131 (2020).
- Li, M., et al. In planta recapitulation of isoprene synthase evolution from ocimene synthases. Molecular Biology and Evolution. 34 (10), 2583-2599 (2017).
- Li, M., et al. Evolution of isoprene emission in Arecaceae (palms). Evolutionary Applications. 14, 902-914 (2020).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Bent, A. Arabidopsis thaliana floral dip transformation method. Methods in Molecular Biology. 343, 87-104 (2006).
- Lundberg, D. S., et al. Defining the core Arabidopsis thaliana root microbiome. Nature. 488 (7409), 86-90 (2012).
- Tkacz, A., Cheema, J., Chandra, G., Grant, A., Poole, P. S. Stability and succession of the rhizosphere microbiota depends upon plant type and soil composition. ISME Journal. 9 (11), 2349-2359 (2015).
- Singh, N., Gaddam, S. R., Singh, D., Trivedi, P. K. Regulation of arsenic stress response by ethylene biosynthesis and signaling in Arabidopsis thaliana. Environmental and Experimental Botany. 185, 104408 (2021).
- Lindsey, B. E., Rivero, L., Calhoun, C. S., Grotewold, E., Brkljacic, J. Standardized method for high-throughput sterilization of Arabidopsis seeds. Journal of Visualized Experiments: JOVE. (128), e56587 (2017).
- Acemi, A., Özen, F. Optimization of in vitro asymbiotic seed germination protocol for Serapias vomeracea. The EuroBiotech Journal. 3 (3), 143-151 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten