Method Article
Charakterisierung neuromuskulärer Verbindungen bei Mäusen mittels kombinierter konfokaler und hochauflösender Mikroskopie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine Methode zur morphometrischen Analyse neuromuskulärer Verbindungen durch kombinierte konfokale und STED-Mikroskopie, die zur Quantifizierung pathologischer Veränderungen in Mausmodellen von SMA und ColQ-bezogenen CMS verwendet wird.
Zusammenfassung
Neuromuskuläre Verbindungen (NMJs) sind hochspezialisierte Synapsen zwischen unteren Motoneuronen und Skelettmuskelfasern, die eine wesentliche Rolle bei der Übertragung von Molekülen vom Nervensystem auf willkürliche Muskeln spielen, was zu einer Kontraktion führt. Sie sind bei vielen menschlichen Krankheiten betroffen, einschließlich erblicher neuromuskulärer Erkrankungen wie Duchenne-Muskeldystrophie (DMD), kongenitalen myasthenischen Syndromen (CMS), spinaler Muskelatrophie (SMA) und amyotropher Lateralsklerose (ALS). Daher stellt die Überwachung der Morphologie neuromuskulärer Verbindungen und ihrer Veränderungen in Krankheitsmausmodellen ein wertvolles Werkzeug für pathologische Studien und die präklinische Bewertung therapeutischer Ansätze dar. Hier werden Methoden zur Markierung und Analyse der dreidimensionalen (3D) Morphologie der prä- und postsynaptischen Teile motorischer Endplatten aus murinen neckischen Muskelfasern beschrieben. Die Verfahren zur Probenvorbereitung und zur Messung des NMJ-Volumens, der Fläche, der Tortuosität und der Axonterminalmorphologie/-belegung durch konfokale Bildgebung sowie des Abstands zwischen postsynaptischen Verbindungsfalten und der Streifenbreite des Acetylcholinrezeptors (AChR) durch hochauflösende Stimulated Emission Depletion (STED)-Mikroskopie sind detailliert. Veränderungen dieser NMJ-Parameter sind bei mutierten Mäusen dargestellt, die von SMA und CMS betroffen sind.
Einleitung
Die neuromuskuläre Verbindung (NMJ) ist eine komplexe Struktur, die aus einem motorischen Axonterminal, einer perisynaptischen Schwann-Zelle und einem skelettalen Myofaserteil besteht, der an der Übertragung chemischer Informationen und der Kopplung der Aktivität der unteren Motoneuronen an die Muskelkontraktion beteiligt ist. Bei Säugetieren ändert sich die Morphologie der neuromuskulären Verbindung während der Entwicklung, nimmt nach der Reifung eine typische brezelartige Form an, mit Unterschieden in Form und Komplexität zwischen den Arten, und zeigt ein gewisses Maß an Plastizität als Reaktion auf physiologische Prozesse wie Bewegung oder Alterung 1,2,3,4 . Die postsynaptische motorische Endplatte bildet Membraninvaginationen, die als Junctionfalten bezeichnet werden, wobei der obere Teil, der Acetylcholinrezeptoren (AChR) enthält, in engem Kontakt mit dem präsynaptischen terminalen Axonzweig5 steht.
Morphologische und funktionelle Veränderungen neuromuskulärer Verbindungen tragen zur Pathophysiologie verschiedener neurodegenerativer Erkrankungen wie spinale Muskelatrophie (SMA) und amyotrophe Lateralsklerose (ALS), Myopathien wie Duchenne-Muskeldystrophie (DMD), kongenitale myasthenische Syndrome (CMS), Myasthenia gravis (MG) und zentronukleäre Myopathien (CNM) sowie altersassoziierte Sarkopenie 3,6,7,8,9 bei. 10,11,12. Bei diesen Erkrankungen werden NMJ-Strukturveränderungen wie Endplattenfragmentierung, reduzierte postsynaptische Verbindungsfaltengröße und/oder Denervierung beobachtet. Die Pathologie von NMJs kann ein primäres oder frühes Ereignis während der Krankheitsprogression sein oder in jüngerer Zeit als sekundäres Ereignis auftreten, das zu den klinischen Manifestationen beiträgt. In jedem Fall stellt die Überwachung der Morphologie von NMJs in Tiermodellen dieser Krankheiten einen wertvollen Parameter dar, um pathologische Veränderungen zu untersuchen und die Wirksamkeit potenzieller Behandlungen zu bewerten.
Die Morphologie neuromuskulärer Verbindungen wird in der Regel mit Techniken der konfokalen Mikroskopie 2,13,14,15 oder der Elektronenmikroskopie 5,16 mit ihren inhärenten Einschränkungen wie Auflösung bzw. technischen Schwierigkeiten analysiert. In jüngerer Zeit wurde die hochauflösende Mikroskopie auch verwendet, um bestimmte Regionen des NMJ, wie präsynaptische aktive Zonen oder AChR-Verteilung auf der postsynaptischen Membran16,17,18, als alternativen oder ergänzenden Ansatz zur ultrastrukturellen Analyse durch Elektronenmikroskopie zu visualisieren.
Dieses Protokoll zielt darauf ab, eine detaillierte und reproduzierbare Methode zur Bewertung morphologischer NMJ-Parameter durch die Kombination von konfokaler Fluoreszenzmikroskopie und stimulierter Emissionsverarmung (STED) bereitzustellen. Wichtige Merkmale der präsynaptischen und postsynaptischen Endplatten, wie Volumen, Fläche, relative Tortuosität, AChR-Streifenbreite und Axonterminalverteilung in innervierten neckischen Muskelfasern von Mausgastrocnemius und Tibialis anterior wurden im Kontext normaler und kranker Bedingungen quantifiziert. Insbesondere wurden NMJ-Defekte im Smn2B/- Mausmodell der spinalen Muskelatrophie, einer neuromuskulären Erkrankung mit Motoneurondegeneration, die durch Mutationen im SMN1-Gen 11,19 verursacht wird, und in einer kollagenartigen Schwanzuntereinheit von asymmetrischen Acetylcholinesterase-Knockout-Mäusen (ColQ Dex2/Dex2 oder ColQ-KO) als Modell des kongenitalen myasthenischen Syndroms20 veranschaulicht. 21,22.
Protokoll
Die Pflege und Manipulation von Mäusen erfolgte gemäß der nationalen und europäischen Gesetzgebung zu Tierversuchen und wurde von der institutionellen Ethikkommission genehmigt. Männchen und Weibchen von Smn2B/- (C57Bl/6J Hintergrund) und ColQ Dex2/Dex2 (B6D2F1/J Hintergrund) Mäusen im Alter von 3 bzw. 6 Wochen wurden in der Studie verwendet.
1. Euthanasie von Mäusen und Dissektion von Muskeln: Tibialis anterior und Gastrocnemius
- Fahren Sie mit der Mausanästhesie durch intraperitoneale Injektion einer Ketamin (87,5 mg / kg) / Xylazin (12,5 mg / kg) Mischlösung (0,1 ml / 20 g Körpergewicht) vor der Euthanasie durch zervikale Dislokation fort.
HINWEIS: Da SMA und ColQ-CMS Individuen unabhängig von ihrem Geschlecht betreffen, wurden im vorliegenden Protokoll männliche und weibliche Mäuse verwendet. - Entfernen Sie die Haare der Hinterbeine mit einem kleinen Elektrorasierer und spülen Sie die Beine mit 70% Ethanol aus.
HINWEIS: Das Dissektionsverfahren unterscheidet sich für jeden Muskel. Für die Dissektion von Tibialis anterior (TA) folgen Sie den Schritten 1.2.1-1.2.3 und für Gastrocnemius (GA) (mediale und laterale Teile) den Schritten 1.2.4-1.2.6. Behandeln Sie die Muskeln sanft, um Gewebeschäden zu vermeiden und sie während der Dissektion zu zerquetschen oder zu dehnen.- Platzieren Sie die Maus in Rückenlage.
- Machen Sie einen Hautschnitt von 5 mm mit einer scharf-stumpfen Schere entlang des antero-äußeren Teils der distalen Hinterbeine, parallel zur Tibia, um den Muskel freizulegen. Verwenden Sie eine extradünne Schere, um die Faszie zu entfernen.
- Schneiden Sie zuerst die distale Sehne (nahe der Pfote) und dann die proximale Sehne (nahe dem Knie) mit einer extradünnen Schere und einer gebogenen dünnen Pinzette. Behandeln Sie den Muskel vorsichtig, um Schäden an Myofasern und Nerven zu vermeiden.
HINWEIS: Die proximale Sehne muss so nah wie möglich am Knochen geschnitten werden, um den gesamten Muskel zu entnehmen. - Stellen Sie die Maus in die Bauchlage, verwenden Sie eine scharf-stumpfe Schere, um einen Hautschnitt vom oberen Teil des distalen hinteren Teils der Hinterbeine bis zur Pfote zu machen, und entfernen Sie die Haut.
- Fassen Sie die Achillessehne mit einer mittelgroßen gezackten Pinzette, schneiden Sie sie mit einer extradünnen Schere ab und trennen Sie die GA vorsichtig vom umgebenden Gewebe zurück zum proximalen Einsetzen.
- Führen Sie auf der proximalen Seite die mittlere gezackte Pinzette in die Tasche ein, die zwischen dem Bizeps femoris (BF) und der GA gebildet wird. Trennen Sie die beiden Muskeln, um die GA-Sehne mit einer extradünnen Schere so nah wie möglich an der Knocheneinführung zu schneiden.
- Zur Gewebefixierung wird jeder Muskel in ein 2-ml-Mikrozentrifugenröhrchen gegeben, das 1 ml 4% w/v Paraformaldehyd (PFA)-Lösung enthält, verdünnt in Phosphatpuffersalzlösung (PBS ohne Ca 2+Mg 2+) und18-24 h bei 4 °C aufbewahren.
ACHTUNG: Paraformaldehyd und Formaldehyd sind giftig und müssen in einem chemischen Abzug mit geeigneter Schutzausrüstung gehandhabt werden. - Am nächsten Tag waschen Sie die angespannten Muskeln 3x für 5 Minuten mit PBS in 12-Well-Platten, indem Sie sie bei Raumtemperatur (RT) in einem chemischen Abzug leicht schütteln.
HINWEIS: Das Protokoll kann bei diesem Schritt gestoppt und innerhalb eines Monats fortgesetzt werden. In diesem Fall werden PBS, ergänzt mit 0,01% Natriumazid, hinzugefügt, um Proben bei 4 °C zu lagern. - Necken Sie jeden Muskel in kleinen Faserbündeln von etwa 1 mm Breite mit zwei fein gezackten Pinzetten.
HINWEIS: Es ist wichtig, die Muskeln sehr sanft mit der Pinzette zu manipulieren, ohne übermäßige Kraft, um Gewebeschäden während des Neckens zu verhindern.- Dissoziieren Sie den TA-Muskel je nach Größe in 3 oder 4 Bündel.
- Für GA trennen Sie die medialen und lateralen Teile des Muskels und dissoziieren Sie dann jeden Teil in 4-5 Bündel, abhängig von ihrer Größe.
2. Immunfärbung
- Fahren Sie mit der Permeabilisierung der Muskelfasern fort: Übertragen Sie die Muskelbündel in 24-Well-Platten, die 1% (v/v) Triton X-100 in PBS enthalten, und halten Sie sie unter sanfter Bewegung (50 U/min) für 1 h bei RT oder 5 h bei 4 °C.
HINWEIS: Teilen Sie die Muskelbündel auf zwei Platten auf, um mit separaten Immunfärbungen fortzufahren und das Risiko einer Antikörperverwirrung zu minimieren. Teilen Sie sie nicht in mehr als zwei Vertiefungen (1 Vertiefung / Platte); Andernfalls kann die Anzahl (N) der NMJs, die für ihren allgemeinen Status im analysierten Muskel repräsentativ sind, unzureichend sein. - Die Proben werden 3x für 5 min mit PBS bei RT gewaschen und mit einer Blocklösung aus 4% Rinderserumalbumin (BSA) in PBS/Triton X-100 1% für 4 h bei 4 °C unter leichtem Rühren (50 U/min) inkubiert.
HINWEIS: Verwenden Sie während der Waschschritte keine Aspirationspumpe, sondern saugen Sie die Lösung manuell mit einer 200-μL-Pipette und kleinen Spitzen ab (die Referenz ist in der Materialtabelle angegeben). - Die Proben werden über Nacht (O/N) bei 4 °C unter leichtem Rühren (50 U/min) mit der in Schritt 2.2 angegebenen Blockierungslösung inkubiert, die primäre monoklonale Antikörper gegen entweder Neurofilament M (NF-M, 2H3, Verdünnung 1/200) oder synaptisches Vesikelglykoprotein 2 (SV2, Verdünnung 1/200) enthält, um präsynaptische Axonterminals bzw. aktive Zonen zu markieren.
- Am nächsten Tag waschen Sie die Muskelbündel 3x für 5 min in PBS unter Rühren (50 U/min).
- Für die konfokale Bildgebung: Inkubieren Sie die Muskelbündel mit sekundären Anti-Maus-Antikörpern, die mit einem rot emittierenden Fluorophor (F594) (Verdünnung 1/500) konjugiert sind, und α-Bungarotoxin, konjugiert mit einem grün emittierenden Fluorophor (α-BTX-F488) (Verdünnung 1/1000) in PBS für 2 h bei RT unter Rühren (50 U/min).
- Für die STED-Bildgebung: Inkubieren Sie die Muskelbündel mit sekundären Anti-Maus-Antikörpern, die mit einem grün emittierenden Fluorophor (F488) (Verdünnung 1/500) konjugiert sind, und α-Bungarotoxin, konjugiert mit einem weit rot emittierenden Fluorophor mit hoher Photostabilität (α-BTX-F633) (Verdünnung 1/1000) in PBS für 2 h bei RT unter Rühren (50 U/min).
HINWEIS: Setzen Sie die Proben während der Inkubation nicht dem Licht aus, um ein Photobleichen zu vermeiden.
- Waschen Sie die beschrifteten Muskelbündel 3x für 5 min mit PBS unter Rühren (50 U/min) und legen Sie sie mit einem Montagemedium auf einen Schieber.
HINWEIS: Platzieren Sie maximal 4 bis 5 Muskelbündel pro Schieber, um das Versiegeln zu ermöglichen. - Fügen Sie ein Glasdeckglas der Klasse # 1,5 (oder # 1,5 H) (0,17 mm Dicke) auf der Oberseite hinzu und platzieren Sie zylindrische Magnete auf beiden Seiten des Objektträgers, um Druck auszuüben und die Muskeln abzuflachen.
- Bewahren Sie die Dias vor Lichtstrom bei 4 °C geschützt auf. Versiegeln Sie die Objektträger dauerhaft mit Nagellack.
3. Bildaufnahme
- Aufnahmen mit einem konfokalen Mikroskop
HINWEIS: Die Bilder wurden mit einem inversen konfokalen Laserscanning-Mikroskop unter Verwendung eines Ölimmersionsobjektivs der Größenordnung (HCX Plan Apo CS, 1,4 numerische Apertur (NA)) aufgenommen.- Für eine verblindete Analyse lassen Sie eine Person, die nicht am Analysecode beteiligt ist, jede Folie mit einer bestimmten Nummer erstellen. Bleiben Sie blind für die experimentellen Gruppen, bis die Quantifizierung der NMJ-Parameter für alle Proben abgeschlossen ist.
- Starten Sie die Mikroskopsoftware im Konfigurationsmodus > machine.xlhw (ergänzende Abbildung 1).
- Legen Sie den Objektträger auf den Mikroskoptisch und finden Sie die Beobachtungsebene innerhalb der Probe, indem Sie mit dem DAPI-Filterset unter DAPI-Weitfeldfluoreszenzbeleuchtung suchen.
- Klicken Sie auf Projekt öffnen > Neue Projekte und erstellen Sie einen Ordner zum Speichern von Bildaufnahmen (ergänzende Abbildung 1).
Hinweis: Erstellen Sie ein neues Projekt für jeden NMJ, um die Ordnergröße zu begrenzen und Probleme mit dem Computerspeicher zu vermeiden. - Um die Erfassungsparameter zu verwalten, klicken Sie auf das Registerkartenfenster Erfassung und stellen Sie die konfokale Lochblende auf 1,0 Airy-Einheit und Laserleistung ein, um die Verstärkungs- und Offset-Werte für die grüne/F488 (α-BTX) Fluoreszenz mit einem 488-nm-Laser an der zu bebildernden Endplatte zu optimieren (Live-Modus ON).
- Als nächstes optimieren Sie die Rot/F594 (NF-M oder SV2) Fluoreszenzerfassung mit einem Laser, der an die F594-Beobachtung angepasst ist. In dieser Studie wurde ein 552-nm-Laser verwendet (Live-Modus ON). Stellen Sie das Spektrum der Farbstoffemission mit den folgenden Bereichen für jeden Laser ein: Laser 405 (DAPI) von 414 bis 483 nm, Laser 488 (F488-α-BTX) von 506-531 nm und Laser 552 (NF-M/SV2) von 622-650 nm.
- Sammeln Sie Bildstapel von neuromuskulären Verbindungen in jeder Versuchsgruppe mit den gleichen Einstellungen: Bildgröße 1024 x 1024 Pixel (73,7 x 73,7 μm) bei 400 Hz Abtastrate, bidirektional X ON, Zoomfaktor 2,5, Z-Schrittgröße 0,5 μm im Z-Wide-Modus.
HINWEIS: Für jeden NMJ wird die Anzahl der Slices so festgelegt, dass die gesamte Verbindung erfasst wird. Die oben beschriebenen Erfassungseinstellungen erfüllen das Nyquist-Shanon-Abtasttheorem. Der Benutzer kann jedoch auf die Schaltfläche Format optimieren klicken, die in allen aktuellen konfokalen Betriebsprogrammen vorhanden ist, um sicherzustellen, dass Pixelgröße und Z-Schritt die ideale Nyquist-Abtastrate erfüllen. Dadurch werden über- oder unterabgetastete Bilder vermieden, was zu einem Verlust der Genauigkeit bei Volumenmessungen führt. - Speichern Sie die Originaldatei (.lif) oder Z-Stack-Bilder (.tif) in einem Ordner mit einem Namen, der den Codenamen der Folie, den Färbetyp und die Endplattennummer enthält.
HINWEIS: Erfassen Sie die Scans sequenziell (nicht gleichzeitig) mit den 488-nm- und 552-nm-Lasern (F488 und F594), um Übersprechen der F488-Fluoreszenz in den F594-Kanal und umgekehrt (Durchbluten) zu vermeiden. Hinweis: Der Strahlengang kann mit dem Dye Assistant in der Mikroskopsoftware konfiguriert werden. - Wechseln Sie zum nächsten codierten Objektträger und wiederholen Sie die Schritte 3.1.3-3.1.8 für jeden NMJ.
- Klicken Sie am Ende der Sitzung auf Im 3D-Viewer öffnen und wählen Sie einen NMJ-Vertreter einer experimentellen Gruppe, um die 3D-Beschriftung zu visualisieren.
HINWEIS: Mit diesem Ansichtsmodus können Sie überprüfen, ob die Erfassungsparameter korrekt waren. - Schließen Sie die Mikroskopsoftware, reinigen Sie die Objektive mit Linsengeweben, und schalten Sie dann das System aus.
- Akquisitionen durch STED-Mikroskopie
HINWEIS: Die Bilder wurden mit einem inversen konfokalen Laserscanning-Mikroskop mit Gated STED bei 775 nm unter Verwendung eines 100-fachen Ölimmersionsobjektivs (HC PL APO CS2 1.4 NA) aufgenommen.- Für eine verblindete Analyse lassen Sie eine Person, die nicht am Analysecode beteiligt ist, jede Folie mit einer bestimmten Nummer erstellen. Bleiben Sie blind für die experimentellen Gruppen, bis die Quantifizierung der NMJ-Parameter für alle Proben abgeschlossen ist.
- Starten Sie die Mikroskopsoftware im Konfigurationsmodus > machine.xlhw und STED ON (ergänzende Abbildung 2).
- Klicken Sie auf Projekt öffnen > Neue Projekte , um einen Ordner zum Speichern von Bildaufnahmen zu erstellen.
Hinweis: Generieren Sie für jede Folie einen neuen Ordner, um die Ordnergröße zu begrenzen und Probleme mit dem Computerspeicher zu vermeiden. - Legen Sie den Objektträger auf den Mikroskoptisch und betrachten Sie ihn unter Weitfeld-Fluoreszenzbeleuchtung mit dem 488-nm-Laser, um die Beobachtungsebene innerhalb der Probe zu finden.
- Suchen Sie nach einem NMJ, der mit Neurofilament M (NF-M) oder SV2-Färbungen markiert ist, indem Sie den 488-nm-Laser mit einer spektralen Detektion von 506-531 nm verwenden.
- Wenn ein NMJ identifiziert wurde, klicken Sie auf STED aktivieren und beginnen Sie mit der Aufnahme von Bildern in einem Bereich, der mehrere Verbindungsfalten enthält (ergänzende Abbildung 3) mit dem 635-nm-Laser mit einer spektralen Detektion von 640-750 nm.
HINWEIS: Achten Sie während der Bildaufnahme auf die Sättigungstabelle und klicken Sie auf die Schaltfläche Quick LUT , um eine Überbelichtung zu vermeiden (Grauwerte >255; für 8 Bit). - Sammeln Sie die Bilder jeder experimentellen Gruppe mit den gleichen Einstellungen: Bildgröße 2048 x 2048 Pixel (38,75 x 38,75 μm) bei einer Abtastrate von 400 Hz.
HINWEIS: Die Leistung des Erschöpfungslasers (STED) ist auf 65 % eingestellt. - Speichern Sie die Bilder unter einem Dateinamen, der den Code der Folie enthält.
HINWEIS: Es ist möglich, auf Optimiertes XY-Format: Format einstellen zu klicken, um die beste Aufnahmeeinstellung mit STED-Bildgebung zu erhalten. - Wechseln Sie zum nächsten codierten Objektträger und wiederholen Sie die Schritte 3.2.3-3.2.8. Wiederholen Sie diesen Vorgang für alle Folien.
- Übertragen Sie am Ende der STED-Mikroskopiesitzung die Bilddateien auf einen anderen Computer und speichern Sie die Originaldateien (. lif) in einem externen Laufwerk oder Server.
- Schalten Sie die Mikroskopsoftware aus, reinigen Sie die Objektive mit Linsengeweben, und schalten Sie dann das System aus.
4. Bildanalyse - konfokale Mikroskopie
HINWEIS: Alle Bilder wurden mit Computern mit dem professionellen Betriebssystem Microsoft Windows 10 verarbeitet.
- Starten Sie ImageJ und ein benutzerdefiniertes Makro zur Berechnung des postsynaptischen NMJ-Endplattenvolumens, der MIP-Fläche (Maximum Intensity Projection) und der relativen Tortuosität.
- Verarbeiten Sie NMJ-Image-Stacks mit der NIH ImageJ-Freeware23, dem iGeodesic-Plugin und dem benutzerdefinierten Makro, um NMJ-Parametermessungen zu erhalten. Starten Sie die ImageJ-Software.
HINWEIS: Die neueste Version von ImageJ ist frei verfügbar und kann24 heruntergeladen werden. Um proprietäre Dateiformate zu öffnen, muss das Bio-Formats Package25 Pluginheruntergeladen werden 26 . Dieser Schritt ist nicht notwendig, wenn der Betreiber Fidschi verwendet, da das Plugin bereits in der Software installiert ist. Das iGeodesic-Plugin27 zur Berechnung der Tortuosität ist auch onlineverfügbar 28; Überprüfen Sie die Verfügbarkeit dieses Plugins in der ImageJ / Fiji-Version, die verwendet wird. Die maßgeschneiderten Makros sind auch online verfügbar29. - Ziehen Sie die Macro_NMJ_VOL_Marinelloetal.ijm (benutzerdefiniert, ergänzende Kodierungsdatei 1) per Drag & Drop in das ImageJ-Fenster. Das Makro wird in einem zweiten Fenster geöffnet. Klicken Sie in diesem neuen Fenster auf Makros > Makro ausführen.
Hinweis: Das Makro kann sowohl proprietäre als auch TIFF-Dateien verarbeiten. Dateien müssen die folgenden Kriterien erfüllen: Speichern Sie für proprietäre Dateiformate nur eine Verbindung (d. h. den Bildstapel) pro Datei, sortiert in einem Ordner; Für TIFF-Bilder müssen Dateien in einem Ordner gespeichert werden, der Unterordner mit dem Namen JunctionX (X entspricht einer NMJ-Nummer) mit den Bildstapeln einer bestimmten Junction (RGB-TIFF) enthält (ergänzende Abbildung 4). - Wählen Sie den nativen Ordner aus, der die zu analysierenden Junction-Unterordner enthält und klicken Sie auf Auswählen.
- Wählen Sie im neuen Einblendmenü " Ordner speichern" den Speicherordner aus und klicken Sie auf "Auswählen".
- Wählen Sie im neuen Einblendmenü " Bildtyp" das Format der Z-Stack-Aufnahmen aus.
- Wählen Sie den RGB-Kanal aus, der der interessierenden Färbung entspricht, und geben Sie die XY-Pixelgröße und den Z-Schritt (z) an. Das Makro führt die Analyse automatisch durch.
HINWEIS: Wenn proprietäre Dateiformate ausgewählt sind, liest das Makro direkt die Pixelgröße und den Z-Schritt (z). Der Benutzer muss jedoch immer noch den Kanal des Interesses angeben (C1, C2 oder C3). Das Makro stellt ein Datenblatt (.csv) für jeden Junction-Parameter (Endplattenvolumen, MIP-Bereich und Tortuosität) im Speicherordner bereit. Das Makro generiert auch drei . TIF-Dateien , die dem Umfang von α-BTX-Färbung Drawing_MaxprojX.tif, DrawingJunctionX.tif und MIP MaxprojX entsprechen.tif. Diese TIFF-Dateien werden generiert, um die Qualität der Aufnahmen zu überprüfen und sicherzustellen, dass die Bildverarbeitung korrekt durchgeführt wurde.
Postsynaptisches NMJ-Volumen (V): Das Makro trennt Bilder von einem einzelnen NMJ und behält den α-Bungarotoxin-F488-Kanal bei, der der postsynaptischen Endplatte entspricht. Der Stapel wird mit dem Otsu-Schwellenwert30 auf der Zwischenscheibe des Stapels segmentiert. Das resultierende binäre Bild ist um 1 Pixel erweitert, und die Funktion Partikel analysieren wird verwendet, um den Endplattenbereich jedes erkannten Objekts zu messen. Um das postsynaptische NMJ-Volumen zu erhalten, summiert das Makro alle gemessenen Endplattenflächen des Stapels und multipliziert es mit dem Z-Schritt-Wert (z) in μm.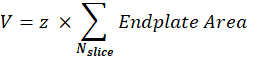
MIP-Endplattenbereich (Maximum Intensity Projection): Nachdem der Schwellenwert für den Stack festgelegt wurde, wird die maximale Intensitätsprojektion (MIP) mit der ImageJ-Funktion des Z-Projekts ermittelt. Die Funktion Partikel analysieren wird dann verwendet, um den MIP-Endplattenbereich zu quantifizieren.
NMJ MIP-Tortuosität (T): Die NMJ-Tortuosität, die den Grad der Komplexität der postsynaptischen motorischen Endplatte einschließlich Falten und Perforationen31 widerspiegelt, wird basierend auf jeder MIP unter Verwendung der folgenden Formel berechnet, wobei d Obj(AB) der Abstand zwischen A und B entlang des Objektumfangs und dEuc(AB) der euklidische Abstand zwischen A und B (gerade Linie) ist.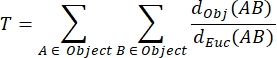
- Legen Sie den höchsten Tortuositätswert in der Wildtypgruppe jeder experimentellen Bedingung auf 100 % fest, und normalisieren Sie alle anderen Werte der experimentellen Bedingung auf diesen Wert, um die relative NMJ-Tortuosität zu erhalten.
- Verarbeiten Sie NMJ-Image-Stacks mit der NIH ImageJ-Freeware23, dem iGeodesic-Plugin und dem benutzerdefinierten Makro, um NMJ-Parametermessungen zu erhalten. Starten Sie die ImageJ-Software.
- Starten Sie ImageJ und ein benutzerdefiniertes Makro zur Quantifizierung der präsynaptischen Neurofilamentakkumulation und der synaptischen Vesikel-Glykoprotein-2-Färbung.
HINWEIS: Neurofilamentakkumulation (hier NF-M) und/oder veränderte Verteilung synaptischer Vesikel (hier SV2) sind Marker für abnormalen axonalen Transport und/oder gestörten Vesikeltransport und wurden zuvor in NMJs verschiedener SMA-Mausmodellebeobachtet 32,33,34.- Ziehen Sie die Macro_NMJ_ACCU_Marinelloetal.ijm (Custom made, Supplementary Coding File 2) per Drag & Drop in das ImageJ-Fenster. Das Makro wird in einem zweiten Fenster geöffnet. Klicken Sie in diesem neuen Fenster auf Makros > Makro ausführen.
Hinweis: Das Makro kann sowohl proprietäre Dateiformate als auch TIFF-Dateien verarbeiten. Dateien müssen die Kriterien erfüllen, die im HINWEIS unter Schritt 4.1.2 angegeben sind. - Wählen Sie den nativen Ordner aus, der die zu analysierenden Junction-Unterordner enthält und klicken Sie auf Auswählen.
- Wählen Sie im neuen Einblendmenü " Ordner speichern" den Speicherordner aus und klicken Sie auf "Auswählen".
- Wählen Sie im neuen Einblendmenü " Bildtyp" das Format der Z-Stack-Aufnahmen aus.
- Geben Sie im Popup-Fenster " Färbeinformationen " das präsynaptische und postsynaptische Etikett und die Farbe an und klicken Sie auf OK. Zum Beispiel, Präsynaptische Markierung: SV2 oder NF, Präsynaptische Farbe: R, Postsynaptische Markierung: BTX, Postsynaptische Farbe: G.
HINWEIS: Bei proprietären Dateiformaten müssen Labels und entsprechende Kanäle (C1, C2 oder C3) angegeben werden. - Geben Sie im Popup-Fenster Pixelgröße XY-Pixelgröße 0,072 μm und Z-Schritt 0,5 μm (z) an und klicken Sie auf OK. Das Makro führt die Analyse automatisch durch.
HINWEIS: Dieser Parameter entspricht der Bildgröße 1024 x 1024 Pixel (73,7 x 73,7 μm), die vor konfokalen Mikroskopaufnahmen ausgewählt wurde, und korreliert mit den Objektiv- und Zoomeinstellungen. Wenn die proprietären Dateiformate ausgewählt sind, liest das Makro direkt die Pixelgröße und den Z-Schritt (z). Das Makro speichert im Speicherordner ein Datenblatt (.csv) der präsynaptischen und postsynaptischen Volumes, ein mehrseitiges TIFF-Bild der aktuellen Erkennung für jede (prä- und postsynaptische) Beschriftung. Wie oben angegeben, werden diese TIFF-Dateien generiert, um die Qualität der Aufnahmen zu überprüfen und sicherzustellen, dass die Bildverarbeitung korrekt durchgeführt wurde.
Das Makro berechnet das Volumen der axonalen Neurofilament-M-Färbung (NF-Volumen) aus dem NF-M-F594-Kanal, der mit der α-Bungarotoxin-F488-Markierung kolokalisiert, und das Volumen der NMJ-synaptischen Vesikel-Glykoprotein-2-Färbung (SV2-Volumen) aus dem SV2-F594-Kanal, der mit der α-BTX-F488-Markierung kolokalisiert. Die NF-M-Akkumulation wird quantifiziert, indem das Verhältnis zwischen NF-Volumen und postsynaptischem Endplattenvolumen (α-BTX) und NMJ-Axonterminalbelegung durch das Verhältnis von SV2- und α-BTX-Volumina berechnet wird, wie unten gezeigt.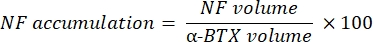
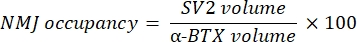
- Ziehen Sie die Macro_NMJ_ACCU_Marinelloetal.ijm (Custom made, Supplementary Coding File 2) per Drag & Drop in das ImageJ-Fenster. Das Makro wird in einem zweiten Fenster geöffnet. Klicken Sie in diesem neuen Fenster auf Makros > Makro ausführen.
5. Bildanalyse - STED-Mikroskopie
HINWEIS: Die Bildverarbeitung wurde mit der Offline-Software des STED-Mikroskopherstellers durchgeführt.
- Starten Sie die Mikroskopsoftware.
- Öffnen Sie das Projekt, indem Sie auf die Schaltfläche Projekt öffnen klicken. Wählen Sie die Projektdatei (.lif) aus und öffnen Sie sie. Die Bilder werden zusammen mit ihren Namen auf dem Bildschirm angezeigt.
- Im Prozessfenster : Klicken Sie auf Rauschunterdrückung > Median. Legen Sie unten im mittleren Fenster Radius auf 5.00 und Iteration auf 1.00 fest und deaktivieren Sie 3D-Filterung.
- Wählen Sie dann die Registerkarte Projekte öffnen oben links im Fenster und wählen Sie ein Bild aus.
- Klicken Sie auf Übernehmen , um die Parameter zu validieren. Ein neues Image namens "nameofimage_median001" wird erstellt.
HINWEIS: Es ist möglich, vor Anwenden auf Vorschau zu klicken, um den Effekt des Medianfilters zu überwachen, wodurch der Bildkontrast verbessert und die für die Quantifizierung verwendeten Linienprofile geglättet werden. - Wenden Sie den Filter auf alle Bilder an, wie in den Schritten 5.4-5.5 beschrieben.
- Klicken Sie auf den Registerkarten Projekte öffnen auf das Diskettenlaufwerksymbol, um alle Projekte einschließlich der neu erstellten gefilterten Images zu speichern.
HINWEIS: Der nächste Schritt wird mit dem gefilterten Bild namens "nameofimage_median001" durchgeführt. - Berechnen Sie den Abstand zwischen AChR-Streifen
HINWEIS: Veränderungen in der Morphologie der postjunctionalen Falten werden häufig bei neuromuskulären Erkrankungen als Zeichen der NMJ-Pathologie (Unreife oder Degeneration) beobachtet. Der Abstand (d) zwischen AChR-Streifen, die durch α-Bungarotoxin-Färbung detektiert werden, wird berechnet, indem Intensitätsprofile generiert und der Abstand zwischen den einzelnen maximalen Intensitätsspitzen durch Zeichnen eines Linienprofils quantifiziert wird (ergänzende Abbildung 5).- Wählen Sie mit der Mikroskopsoftware das Menü Quantifizieren oben im mittleren Fenster.
- Klicken Sie oben links auf die Registerkarte Extras . Wählen Sie im oberen linken Bereich Intensität und klicken Sie auf das Symbol Linienprofil . Setzen Sie Oversampling auf 1 und aktivieren Sie Kanäle sortieren.
- Klicken Sie auf die Registerkarte Projekte öffnen und wählen Sie das gefilterte Bild aus, das analysiert werden soll.
HINWEIS: Es ist möglich, das Bild durch Scrollen mit der Computermaus zu vergrößern. Der Dynamikumfang des Bildes kann über den Balken auf der linken Seite neben dem angezeigten Bild geändert werden, was die Visualisierung der Streifen erleichtert. - Klicken Sie dann auf das Symbol Linie zeichnen im oberen Menü des rechten Fensters und zeichnen Sie eine Linie nach, die senkrecht mehrere Streifen / Verbindungsfalten kreuzt.
HINWEIS: Das Intensitätsprofil wird im mittleren Fenster angezeigt. - Klicken Sie auf die Spitze des ersten Gipfels und bewegen Sie den Mauszeiger bei gedrückter linker Maustaste, bis der nächste maximale Peak erreicht ist.
HINWEIS: Die Informationen werden im Intensitätsprofil angezeigt, während der Abstand zwischen den beiden Spitzen unter dem Diagramm mit der Bezeichnung "dx" angezeigt wird. - Klicken Sie mit der rechten Maustaste, während Sie sich im Bild des rechten Fensters befinden, und wählen Sie ROIs speichern. Öffnen Sie die gespeicherten ROIs (Regions of Interest), indem Sie auf ROIs laden klicken.
- Klicken Sie auf das Pfeilsymbol oben links im rechten Fenster, klicken Sie auf den ROI und löschen Sie ihn, indem Sie auf das Papierkorbsymbol klicken.
- Wiederholen Sie diesen Vorgang so oft wie nötig aus verschiedenen Intensitätsprofilen, um die vorhergesagte Anzahl von AChR-Streifenabständen zu erhalten, die den globalen Wert im analysierten Muskel darstellen.
HINWEIS: Der optimale N-Wert kann im Voraus basierend auf der geschätzten Differenz zwischen Gruppen, α Risiko-, Leistungs- und ein- oder zweiseitigem Test berechnet werden. Im aktuellen Versuchsdesign wurde ein einseitiger Mann-Whitney-Test (α Risiko = 10%; Leistung = 80%) angewendet, und der N-Wert wurde auf mindestens fünf AChR-Streifenabstände pro NMJ geschätzt, um die beiden Tiergruppen zu vergleichen.
- AChR-Streifenbreite
HINWEIS: Die Streifenbreite (w) entspricht dem Halbmaximum (FWHM) der vollen Breite des Intensitätsprofils, d. h. dem Abstand zwischen den Punkten, an denen der α-BTX-Signalfluoreszenzwert die Hälfte seiner maximalen Intensität beträgt (ergänzende Abbildung 5).- Wählen Sie mit der Mikroskopsoftware das Menü Quantifizieren im mittleren Fenster.
- Klicken Sie oben links auf die Registerkarte Extras . Wählen Sie im oberen linken Bereich die Option Intensität und klicken Sie auf das Symbol FWHM bestimmen . Aktivieren Sie Kanäle sortieren.
HINWEIS: Um die Peak-Erkennung durch die Software zu optimieren, wurden Set Threshold und Width auf 50 bzw. 3 gesetzt. Passen Sie diese Werte für jedes Experiment an und lassen Sie sich von einem erfahrenen Bildgebungswissenschaftler beraten. - Klicken Sie auf die Registerkarte Projekte öffnen und wählen Sie das gefilterte Bild aus, das analysiert werden soll.
HINWEIS: Es ist möglich, das angezeigte Bild im rechten Fenster durch Scrollen mit der Computermaus zu vergrößern. Wie oben angegeben (HINWEIS nach Schritt 5.8.3), kann der Dynamikumfang des Bildes für eine optimale Streifenvisualisierung geändert werden. - Klicken Sie anschließend auf das Symbol Rechteck zeichnen im oberen Menü des rechten Fensters. Wählen Sie einen horizontalen oder vertikalen Streifen aus, und zeichnen Sie ein Rechteck senkrecht zum Streifen. Im mittleren Fenster wird ein Profil angezeigt.
- Klicken Sie im Menü "Durchschnittliche Projektion" im linken Bereich auf "Vertikal" oder "Horizontal", je nachdem, ob die Streifenausrichtung vertikal oder horizontal ist.
- Klicken Sie im zentralen Fenster auf Statistik und lesen Sie den FWHM-Wert.
- Klicken Sie mit der rechten Maustaste auf das Bild, das im rechten Fenster angezeigt wird, und wählen Sie ROIs speichern.
HINWEIS: Öffnen Sie die gespeicherten ROIs, indem Sie auf ROIs laden klicken. - Klicken Sie auf das Pfeilsymbol oben links im rechten Fenster, klicken Sie auf den ROI und löschen Sie ihn, indem Sie auf das Papierkorbsymbol klicken.
- Wiederholen Sie diesen Vorgang so oft wie nötig aus verschiedenen Rechteck-ROIs, bis Sie die vorhergesagte Anzahl von AChR-Streifenbreiten erhalten, die für den Gesamtwert im analysierten Muskel repräsentativ ist.
6. Versuchsplanung und statistische Tests
- Führen Sie statistische Analysen mit einer speziellen Software durch.
HINWEIS: Die Daten wurden von N ≥ 3 biologischen Replikaten und mindestens 20 NMJs pro Genotyp für konfokale Mikroskopbildgebung und N ≥ 5 biologischen Replikaten und N = 5 NMJs pro Genotyp für STED-Bildgebung in jeder Versuchsgruppe gesammelt. Die Signifikanz wurde durch einen ungepaarten Mann-Whitney-Test (nichtparametrisch) bewertet, und p-Werte sind in den entsprechenden Abbildungslegenden angegeben.
Ergebnisse
Um die morphologische Analyse neuromuskulärer Verbindungen auf prä- und postsynaptischer Ebene reproduzierbar zu erleichtern, wurde ein Workflow von der Muskelentnahme bis zur Bildgebung und Quantifizierung mit der Mikroskopsoftware und ImageJ Custom Macros entwickelt (Abbildung 1). Um den Nutzen dieses Protokolls zu veranschaulichen, wurde die Morphologie von NMJs in zwei Mausmodellen genetischer Störungen, Smn2B /- und ColQDex2/Dex2-Mäusen , die von spinaler Muskelatrophie (SMA) bzw. einer angeborenen myasthenischen Syndromform (CMS) betroffen sind, ausgewertet und die Daten mit altersangepassten Kontroll-Wurfgeschwistern verglichen.
Die NMJ-Struktur wurde anhand von Tibialis anterior- und Gastrocnemius-Muskeln von 3- und 6 Wochen alten Smn2B/- (C57Bl/6 Hintergrund) bzw. ColQDex2/Dex2 (B6D2F1/J Hintergrund) Mäusen beurteilt, wenn bei diesen Tieren bereits Anzeichen der Krankheit vorhanden sind. Im Alter von 3 Wochen zeigen Smn2B/- Mäuse Anzeichen einer verzögerten Skelettmuskelentwicklung und Denervierung, wie NMJ-Atrophie und Verlust35,36. CMS-Mäuse haben eine primäre Pathologie bei NMJs und zeigen eine Verringerung des Körpergewichts ab der ersten Lebenswoche und eine ausgeprägte Muskelschwäche20 (Daten nicht gezeigt). Wie in Abbildung 2A gezeigt, erschien die postsynaptische motorische Endplatte, die mit fluoreszierendem α-Bungarotoxin markiert war, in Mutanten der beiden Mauslinien durch konfokale Mikroskopie kleiner und/oder fragmentiert. Die Quantifizierung von NMJ-Z-Stacks mit diesen kundenspezifischen ImageJ-Makros zeigte deutliche Abnahmen des Endplattenvolumens, der maximalen Intensitätsprojektion (MIP) und der relativen Tortuosität sowohl bei SMA- als auch bei CMS-Mäusen im Vergleich zu Kontrollen als Anzeichen für NMJ-Reifungsdefekte32 (Abbildung 2B-D). Postsynaptisches Endplattenvolumen und MIP waren bei erkrankten Tieren vermindert (Faltenänderung von 2,7 und 2,0 für Volumen und 2,5 und 2,0 für MIP bei Smn2B/- bzw. ColQ Dex2/Dex2 Mäusen). Die relative Tortuosität war auch bei SMN- und ColQ-defizienten Muskeln geringer als bei WT (16,97% ± 1,33% bei SMA versus 48,84% ± 5,90% WT-Mäusen und 13,29% ± 2,79% bei CMS gegenüber 30,20% ± 4,44% Kontrollmäusen). Darüber hinaus zeigte die Quantifizierung der Verteilung präsynaptischer axonendlicher Zweige mit dem benutzerdefinierten Makro ImageJ ein verändertes Muster in der Verteilung von Neurofilament M in den beiden Tiermodellen mit erhöhter Immunmarkierung (84,65% ± 0,32% versus 16,57% ± 2,03% und 23,64% ± 2,78% versus 18,77% ± 1,73% bei Smn2B/- und ColQ Dex2/Dex2 Mäusen im Vergleich zu Kontrollen) (Abbildung 3A-D ). Durch SV2-Färbung wurde auch bei Smn2B/- Mäusen (49,36% ± 3,76% bei SMA versus 85,69% ± 2,34% WT-Mäusen) eine 43%ige Reduktion des Belegungsverhältnisses, d.h. Prozent der AChR-haltigen Regionen mit benachbarten nerventerminalen aktiven Zonen, beobachtet (Abbildung 3E,F). Dieser NMJ-Parameter wurde auch in GA von ColQ Dex2/Dex2-Mutanten berechnet, aber es wurde kein statistisch signifikanter Unterschied im Vergleich zu Kontroll-Wurfgeschwistern gefunden (Daten nicht gezeigt).
Wir analysierten die postsynaptischen Membraneigenschaften weiter, indem wir den Abstand zwischen den Verbindungsfalten und die Breite der AChR-Streifen, die sich am Kamm dieser Falten befinden, in ColQ-defizienten Muskeln unter Verwendung von hochauflösender stimulierter Emissionsverarmung (STED) Mikroskopie quantifizierten. Wie in Abbildung 4 gezeigt, kann der Aspekt dieser Strukturen durch fluoreszierende α-Bungarotoxin-Markierung und Intensitätsprofilanalyse deutlich visualisiert werden. Wir bewerteten diese NMJ-Parameter und fanden eine Zunahme des Verbindungsfaltenabstands (d) und der Breite (w) von AChR-Streifen im Musculus gastrocnemius von Mutanten (358,3 nm ± 11,97 nm und 320,8 nm ± 10,90 nm für die Entfernung und 216,9 nm ± 10,51 nm und 186,3 nm ± 7,015 nm für die Breite, in ColQ Dex2/Dex2 im Vergleich zu Wildtyp-Mäusen. jeweils p < 0,05) (Abbildung 4C,D).
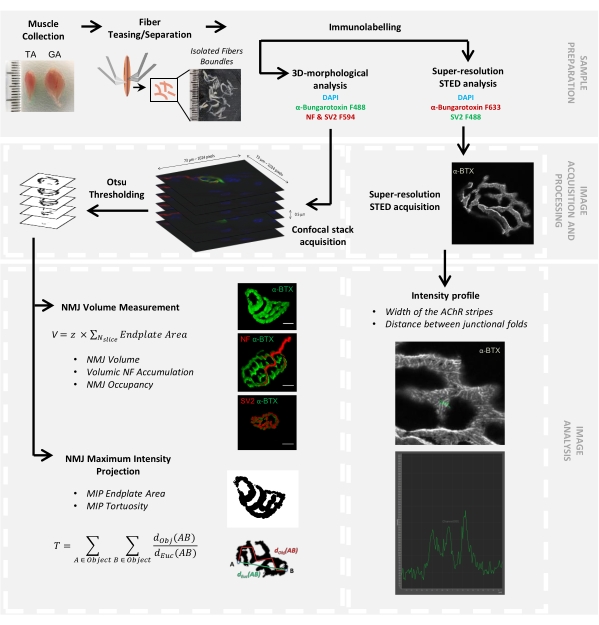
Abbildung 1: Flussdiagramm des Videoprotokolls zur 3D-Multiskalen-NMJ-Charakterisierung mittels konfokaler und STED-Mikroskopie. Tibialis anterior (TA) und Gastrocnemius (GA) Muskeln wurden von Mäusen gesammelt, und Muskelfasern wurden gehänselt, bevor sie mit α-Bungarotoxin-F488 oder α-Bungarotoxin-F633, DAPI, primären Antikörpern gegen Neurofilament M (NF-M) und synaptischem Vesikelglykoprotein 2 (SV2) und Fluorophor (F488 oder F594)-konjugierten sekundären Antikörpern markiert wurden. Bildstapel wurden mittels konfokaler Mikroskopie aufgenommen und verarbeitet, um das postsynaptische NMJ-Volumen, die präsynaptische NF-M-Akkumulation, die NMJ-Axonterminalbelegung, die postsynaptische Maximumintensitätsprojektion (MIP) und die Tortuosität zu messen (d Obj(AB) ist der Abstand zwischen A und B entlang des Objektumfangs (rote Linie), während dEuc(AB) ist der euklidische Abstand zwischen A und B (grüne Linie)). Für die STED-Mikroskopieanalyse wurden die Breite der Acetylcholinrezeptor (AChR)-Streifen und der Abstand zwischen den Verbindungsfalten aus Intensitätsprofilen der α-BTX-F633-Färbung quantifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
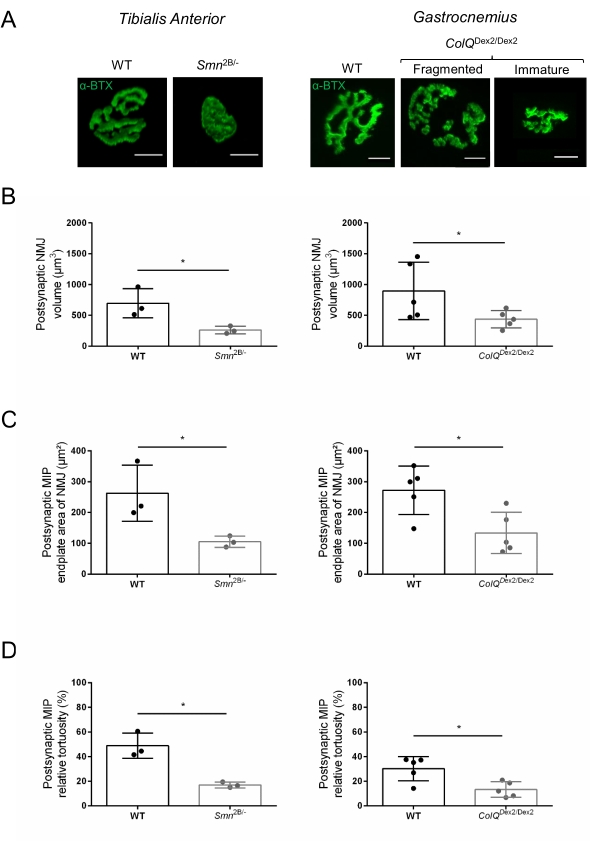
Abbildung 2: Multiparameter-postsynaptische NMJ-Charakterisierung in Mausmodellen der spinalen Muskelatrophie (SMA) und des ColQ-assoziierten kongenitalen myasthenischen Syndroms (CMS). (A) Repräsentative Bilder von postsynaptischen motorischen Endplatten aus TA- und GA-Muskeln, markiert mit α-Bungarotoxin-F488 (α-BTX). (B) Quantifizierung des postsynaptischen NMJ-Endplattenvolumens, (C) der Projektionsfläche maximaler Intensität (MIP) und (D) relativer Tortuosität in TA von 3 Wochen alten Wildtyp- (WT) und Smn2B/- Mäusen (linke Grafiken, N = 3 Tiere pro Genotyp, n = 37 bzw. n = 56 NMJs) und 6 Wochen alten WT und ColQ Dex2/Dex2 Mäuse (rechte Grafiken, N = 5 Mäuse pro Genotyp, n = 89 bzw. n = 97 NMJs). Die Daten werden als Mittelwert pro Maus (Punkt) ± REM ausgedrückt. Unterschiede zwischen den Gruppen wurden mit dem Mann-Whitney-Test (* p < 0,05) analysiert. Der Maßstabsbalken beträgt 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
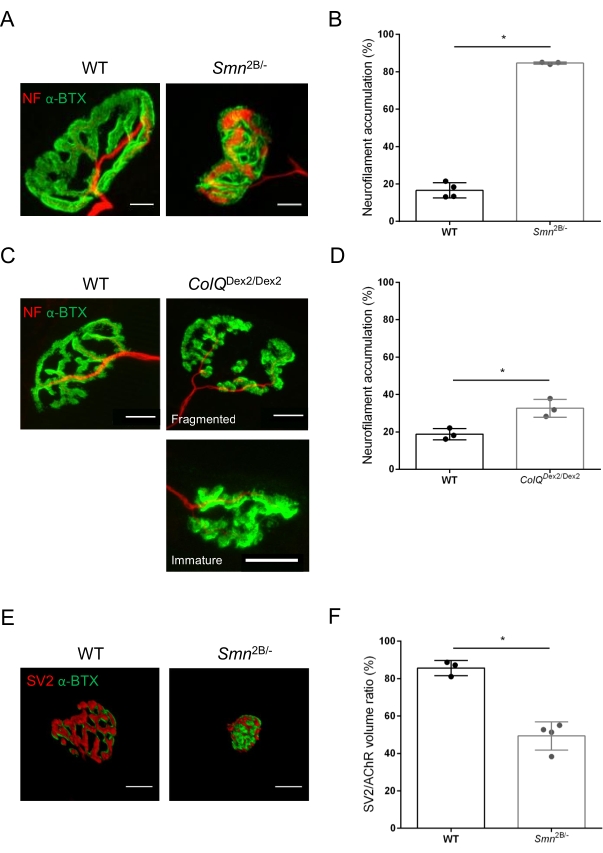
Abbildung 3: Morphometrische Analyse der präsynaptischen axonterminalen Verteilung in Muskeln von WT- und mutierten Mäusen. NMJ-Innervationsmuster in Tibialis anterior (TA) und Gastrocnemius (GA) Muskeln von Wildtyp-, SMA- und ColQ-verwandten CMS-Mäusen. (A, B) Repräsentative neuromuskuläre Verbindungen aus TA von WT- und Smn2B/- Mäusen im Alter von 21 Tagen, markiert mit Antikörpern gegen Neurofilament M (NF-M, rot) und α-Bungarotoxin-F488 (α-BTX, grün) (A), und Ergebnisse der quantitativen Analyse der Neurofilamentakkumulation (B); (C, D) Repräsentative neuromuskuläre Verbindungen von GA von 6 Wochen alten WT- und ColQ Dex2/Dex2-Mäusen, markiert mit Antikörpern gegen Neurofilament M (NF-M, rot) und α-Bungarotoxin-F488 (α-BTX, grün), zeigten fragmentierte und unreife postsynaptische Endplatten (C) und Ergebnisse der Neurofilamentakkumulation in den beiden Tiergruppen (D). N= 4 (n = 34 NMJs) (B) und N = 3 (n = 54 NMJs) (D) WT-Tiere, und N=3 (n = 36 NMJs) Smn2B/- und N = 3 (n = 55 NMJs) ColQ Dex2/Dex2-Mäuse wurden in den Experimenten analysiert (B, D). (E, F) Repräsentative Bilder der Axonterminalbelegung in NMJs aus TA von 3 Wochen alten WT- und Smn 2B/-Mäusen, markiert mit Antikörpern gegen synaptisches Vesikel-Glykoprotein 2 (SV2, rot) und α-Bungarotoxin-F488 (α-BTX, grün) (E), und Ergebnisse der NMJ-Belegung (SV2/AChR-Volumenverhältnis) (F). Muskeln von N = 3 (n = 50 NMJs) Wildtyp- und N = 4 (n = 62 NMJs) Smn2B/- Mäusen wurden analysiert. Die Daten werden als Mittelwert pro Maus (Punkt) ± REM ausgedrückt. Unterschiede zwischen den Gruppen wurden mit dem Mann-Whitney-Test (* p < 0,05) analysiert. Maßstabsbalken sind 20 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
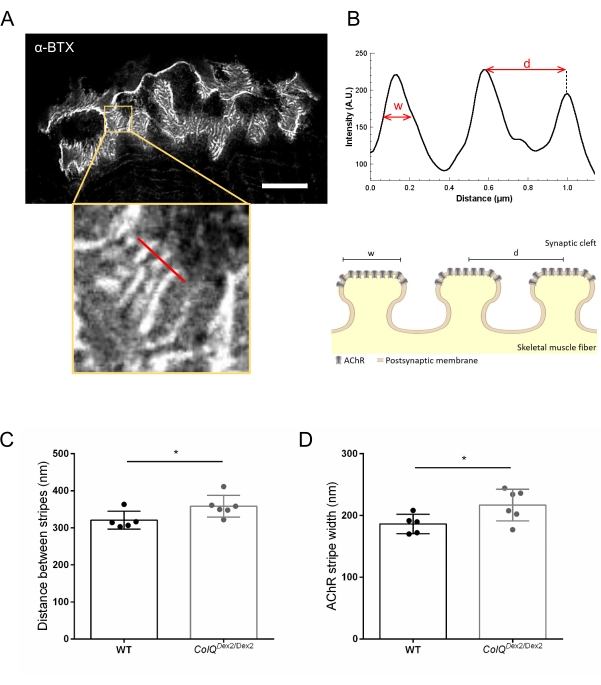
Abbildung 4: STED-Bildgebung von NMJ-postsynaptischen Endplatten. (A) Repräsentatives STED-Bild eines NMJ, markiert mit α-Bungarotoxin-F633 (α-BTX) von Gastrocnemius einer 6 Wochen alten Wildtyp-Maus mit postjunctionalen AChR-Streifen (Maßstabsbalken ist 5 μm). (B) Höhere Vergrößerung eines Bereichs mit AChR-Streifen (unteres Bild), der zur Erzeugung des Intensitätsprofils verwendet wurde. Die Breite (w) von AChR-Streifen und der Abstand zwischen zwei benachbarten Streifen (d) dieser Region wurden quantifiziert und im Balkendiagramm dargestellt. Schematische Darstellung der postsynaptischen Endplatte zur Veranschaulichung der AChR-Streifenbreite (w) und des Abstands (d). Diese Parameter, (C) AChR-Streifenabstand und (D) Breite, wurden bei ColQ Dex2/Dex2-Mäusen und Kontroll-Wurfgeschwistern im Alter von 6 Wochen gemessen. NMJs von 5 WT (insgesamt n = 29 NMJs) und 6 ColQ Dex2/Dex2 (insgesamt n = 43 NMJs) Tieren wurden blind analysiert. Die Daten werden als Mittelwert pro Maus (Punkt) ± REM ausgedrückt. Statistische Unterschiede zwischen den Gruppen wurden mit dem Mann-Whitney-Test (* p < 0,05) analysiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Abbildung 1: Einführung der LAS X-Software und Parameter für konfokale Erfassungen. Die verschiedenen Schritte zur Aufnahme konfokaler Bilder sind in den Abschnitten 3.1.2 bis 3.1.7 des Protokolls beschrieben. Für jede NMJ-Stack-Erfassung wird ein Projekt geöffnet (Schritt 3.1.4) und die Parameter Bildgröße, Aufnahmegeschwindigkeit, X-, Y- und Z-Achsen ausgewählt (Schritt 3.1.7), wobei jeder sequentielle Scan angezeigt wird (Seq.1, Laser 405 für DAPI; Seq.2, Laser 488 für α-BTX-F488; und Seq.3, Laser 552 für F594 konjugierte sekundäre Antikörper). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Einführung der LAS X-Software und Parameter für STED-Akquisitionen. Die Schritte zur Erfassung von STED-Bildern sind in den Abschnitten 3.2.2 bis 3.2.8 des Protokolls beschrieben. Das Mikroskop wird im Konfigurationsmodus STED ON gestartet (Schritt 3.2.2) und ein Projekt wird geöffnet (Schritt 3.2.3). Die Parameter für die Bildaufnahme (Schritt 3.2.7) (Bildgröße, Aufnahmegeschwindigkeit, Zoomfaktor, X-Achse) werden bei jedem sequentiellen Scan angegeben (Seq.1 für α-BTX-F633; Seq.2 für F488 konjugierte sekundäre Antikörper). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 3: Bilder von α-BTX-gefärbten Verbindungsfalten, die durch STED-Mikroskopie erhalten wurden. Bildbeispiele einer postsynaptischen Endplatte, beschriftet mit α-BTX-F633 von einer 6 Wochen alten Wildtyp-Maus, die entweder mit einem korrekten (links) oder falschen Fokus (rechts) aufgenommen wurden. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 4: Windows-Popups zum Beschreiben der Eingabe- und Ausgabedaten, die von den benutzerdefinierten ImageJ-Makros abgerufen werden. Beispiele für Eingabedaten (.tif und .lif-Dateien) von NMJ-Bildern werden in der linken Spalte angezeigt. Die Ausgabedaten der Makros (rechte Spalte) werden in Ordnern (Save_Volume, Save_Accu) gespeichert, die Bilder der Kreuzung (.tif) und Datenblätter mit den Ergebnissen (.csv Dateien) enthalten. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 5: AChR-Streifenabstands- und -breitenanalyse aus einer STED-Erfassung mit der LAS X-Software. Die Schritte zur Analyse von NMJ-STED-Bildern sind in Abschnitt 5 des Protokolls beschrieben. A) Bild einer markierten postsynaptischen Endplattenregion mit AChR-Streifen. Der für die Streifenanalyse interessierende Bereich wird ausgewählt, indem eine senkrechte Linie (grüne Linie für Streifenabstand) oder ein senkrechtes Rechteck (violettes Rechteck für Streifenbreite) gezeichnet wird. (B, C) Es werden Intensitätsprofile der ausgewählten Bereiche und Messungen zur Berechnung des Abstands zwischen AChR-Streifen (B) und der AChR-Streifenbreite (C) gezeigt. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Kodierungsdatei 1: Macro_NMJ_VOL_Marinelloetal. Benutzerdefiniertes ImageJ-Makro zum Extrahieren von NMJ-Parametermessungen (NMJ-Volumen, MIP-Endplattenfläche und NMJ-Tortuosität). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Kodierungsdatei 2: Macro_NMJ_ACCU_Marinelloetal. ImageJ benutzerdefiniertes Makro zum Extrahieren von NF-M-Akkumulation und SV2-Färbung. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Das beschriebene Videoprotokoll bietet eine detaillierte Methode zur Quantifizierung der 3D-Struktur neuromuskulärer Verbindungen durch Kombination von konfokaler und STED-Mikroskopie, mit der pathologische Veränderungen auf prä- und postsynaptischer Ebene charakterisiert werden können. Die hohe Auflösung der STED-Mikroskopie ermöglicht die Visualisierung und morphometrische Analyse von Nanostrukturen, die mit herkömmlicher konfokaler Bildgebung nicht identifizierbar sind. Dieses Verfahren ermöglichte es uns, strukturelle Veränderungen von NMJs in zwei appendikulären Muskeln, Tibialis anterior und Gastrocnemius, von SMA- und ColQ-verwandten CMS-Mäusen zu messen.
Um zuverlässige Ergebnisse mit dieser Technik zu erzielen, ist es wichtig, die Muskeln richtig zu sezieren und zu necken, wobei besonders auf die Faszien geachtet wird, die den Muskel umgeben, und die angewandte Kraft, um Muskelbündel zu trennen. Andernfalls könnte das Innervationsmuster gestört werden, was eine ordnungsgemäße präsynaptische NMJ-Beurteilung behindert. Obwohl detaillierte Informationen zur Analyse von NMJs aus TA und GA bereitgestellt werden, könnte dieses Protokoll prinzipiell an andere Muskeln angepasst werden, einschließlich flacher Muskeln, wie dem Zwerchfell oder dem transversalen Abdominis37, die den neckenden Schritt nicht erfordern. Die Gewebefixierung ist ebenfalls entscheidend, um eine gute Färbungsqualität zu gewährleisten. Daher wird empfohlen, hochwertiges PFA in einem geeigneten Volumen (15-20-mal so viel wie der Muskel) zu verwenden. Darüber hinaus ist die Belichtungszeit gegenüber dem Fixiermittel ein wichtiger Schritt, da Artefakte wie Schrumpfung und Verklumpung aufgrund von Überfixierung auftreten und NMJ-Merkmale beeinflussen können. Angesichts der Größe der Proben und der Eindringrate der Paraformaldehydlösung in Gewebe38 wird für diesen Muskeltyp eine Fixationszeit von 18-24 h empfohlen. Falls der Färbeschritt mehr als eine Woche nach der Gewebeentnahme geplant ist, wird empfohlen, PFA-fixierte Muskeln in PBS mit Natriumazid bei 4 °C zu halten, um eine bakterielle Proliferation zu verhindern.
Dieses Protokoll stellt einen Ansatz dar, der α-BTX-F488 für die konfokale und α-BTX-F633 für die STED-Bildgebung verwendet. Diese Fluorophore wurden so ausgewählt, dass sie zum beschriebenen experimentellen Design passen, können jedoch entsprechend den verfügbaren Geräten und Materialien modifiziert werden. Beispielsweise kann die α-BTX F488-Beschriftung ausgewählt werden, wenn ein STED CW 592 nm-Laser zur Bildaufnahme und Quantifizierung verwendet wird. Es scheint jedoch, dass die in der vorliegenden Studie verwendete Konfiguration (gepulste Anregung mit STED, 775 nm Verarmung) eine höhere Leistung und eine bessere Auflösung aufweist als andere Ansätze, wie z. B. Dauerstrich STED39, wodurch sie für die aktuelle Anwendung besser geeignet ist. Es ist auch wichtig, die Laserleistungseinstellungen sorgfältig auszuwählen, insbesondere für STED (sowohl Anregung als auch Verarmung), da die Eigenschaften eines Intensitätsprofils im Falle einer Sättigung nicht gemessen werden können und daher jedes gesättigte Signal in einem NMJ-Bild die gesamte Analyse gefährden könnte.
Dieser detaillierte Workflow, einschließlich Bildaufnahmen und -analysen mit Mikroskopsoftware und ImageJ-Makros, wurde entwickelt, um eine autonome NMJ-morphometrische Analyse durch konfokale und STED-Mikroskopie von einem einzigen Muskel aus zu ermöglichen. Zuvor beschriebene Arbeitsabläufe für die konfokale NMJ-Analyse wie NMJ-morph2 oder NMJ-Analyser14 ebneten den Weg für die Entwicklung halbautomatischer Methoden, die morphologische Analysen von NMJs und vergleichende Studien ermöglichen. NMJ-morph (und seine aktualisierte Version aNMJ-morph15) ist eine freie ImageJ-basierte Plattform, die die maximale Intensitätsprojektion verwendet, um 21 morphologische Merkmale zu messen, und NMJ-Analyser verwendet ein in Python entwickeltes Skript, das 29 relevante Parameter aus der gesamten 3D-NMJ-Struktur generiert. Die manuelle Schwellenwertbestimmung ist der einzige Schritt während der Bildverarbeitung bei diesen beiden Methoden, die eine Benutzeranalyse erfordern. Dieses integrierte Protokoll beschreibt die Schritte für die Gewebevorbereitung, die konfokale 3D-Bildaufnahme und die ImageJ-basierte Verarbeitung von NMJs aus ganzen Skelettmuskeln und bietet einen vereinfachten Überblick über fünf wichtige Parameter der postsynaptischen (Volumen, maximale Projektionsfläche und Tortuosität) und präsynaptischen (Axonterminalbelegung und Neurofilamentakkumulation) Endplatten. Ein zusätzlicher Parameter von biologischer Relevanz, das AChR-Organisationsmuster der postsynaptischen Verbindungsfalten, wurde für die morphometrische Analyse auf nanoskaliger Ebene durch hochauflösende STED-Mikroskopie (Auflösung 20-30 nm) integriert40. Interessanterweise ist die Gewebevorbereitung für die STED-Bildgebung einfacher als andere Methoden, die für NMJ-Ultrastrukturstudien verwendet werden, wie die konventionelle Transmissionselektronenmikroskopie (TEM)9, ein ziemlich komplexes und zeitaufwendiges Verfahren, das einen erfahrenen Manipulator erfordert, um ultradünne Abschnitte der entsprechenden Muskelregion zu erhalten. Darüber hinaus können quantitative Daten aus mehreren Verbindungsfalten mithilfe der STED-assoziierten Software automatisch abgerufen werden.
Dieses Protokoll wurde angewendet, um bereits bekannte NMJ-Defekte in SMN- und ColQ-defizienten Muskeln 20,36,41,42 zu veranschaulichen. Gemeinsame Veränderungen wurden in den beiden Mausmodellen durch konfokale Mikroskopie gefunden, wie z.B. vermindertes postsynaptisches Endplattenvolumen, MIP-Fläche und relative Tortuosität sowie erhöhte Neurofilamentakkumulation, während einige spezifischere Befunde (verminderte NMJ-Belegung) nur bei SMA-Mäusen als Indikator für einen gestörten Vesikeltransport beobachtet wurden36. Schließlich wurde eine Zunahme des AChR-Streifenabstands und der AChR-Breite in ColQ-KO durch STED-Analyse festgestellt, die Anzeichen für ultrastrukturelle Defekte in den postsynaptischen Verbindungsfalten sind, wie zuvor von TEM20 beobachtet. Wichtig ist, dass dieses Protokoll zu einer tieferen morphologischen Charakterisierung neuromuskulärer Verbindungen während der Entwicklung, Aufrechterhaltung und unter verschiedenen pathologischen Bedingungen beitragen kann.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte im Zusammenhang mit diesem Werk.
Danksagungen
Wir danken der "Imaging and Cytometry Core Facility" von Genethon sowie dem histologischen Dienst, die teilweise durch Ausrüstungsfonds der Region Ile-de-France, des Conseil General de l'Essonne, der Genopole Recherche von Evry, der Universität Evry Val d'Essonne und des INSERM, Frankreich, unterstützt werden. Wir danken auch Dr. Rashmi Kothary für die Bereitstellung der Mauslinie Smn 2B/2B (University of Ottawa, Kanada) und Dr. Eric Krejci für die Mauslinie ColQDex2/+ (unveröffentlicht, Universität Paris, Frankreich). Wir danken Guillaume Corre für seine Unterstützung bei der statistischen Analyse. Die monoklonalen Antikörper 2H3 (entwickelt von Jessel, T.M. und Dodd, J.) und SV2 (entwickelt von Buckley, K.M.) wurden von der Developmental Studies Hybridoma Bank (DSHB) erhalten, die vom NICHD des NIH erstellt und an der University of Iowa, Department of Biology, Iowa City, IA 52242, gepflegt wird. Diese Arbeit wurde von der Association Française contre les Myopathies (AFM-Telethon), dem INSERM und der Universität Evry Val d'Essonne unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Buffers and Reagents | |||
| Alexa Fluor 488 goat anti-mouse IgG (F488) | Life Technologies, Thermofisher | A-11001 | |
| Alexa Fluor 488 α-bungarotoxin (F488-a-BTX) | Life Technologies, Thermofisher | B13422 | |
| Alexa Fluor 594 goat anti-mouse IgG (F594) | Life Technologies, Thermofisher | A-11032 | |
| ATTO-633 α-bungarotoxin (F633-a-BTX) | Alomone Labs | B-100-FR | |
| Bovine serum albumin (BSA) | Sigma | A2153 | |
| DAPI Fluoromount-G | Southern Biotech | 00-4959-52 | |
| DPBS | Gibco, Invitrogen | 14190-169 | |
| Ethanol Absolute | VWR | 20821.296 | |
| Immersion Oil, n = 1.518 | THORLABS | MOIL-10LF | Low autofluorescence |
| Neurofilament (NF-M) antibody | DSHB | AB_531793 | |
| Paraformaldehyde (PFA) | MERCK | 1.04005 | |
| Synaptic vesicle glycoprotein 2 (SV2) antibody | DSHB | AB_2315387 | |
| Triton X-100 | Sigma | T8787 | |
| Materials | |||
| Alnico Button cylindrical magnets | Farnell France | E822 | diameter of 19.1 mm with maximal pull of 1.9 Kg |
| 63x 1.4 NA magnitude oil immersion HCX Plan Apo CS objective | Leica Microsystems | ||
| 100x 1.4 NA HC PL APPO CS2 Objective | Zeiss | ||
| Curved thin forceps-Moria iris forceps | Fine Science Tools | 11370-31 | |
| Extra thin scissors - Vannas-Tübingen Spring Scissors | Fine Science Tools | 15-003-08 | |
| Fine serrated forceps | Euronexia | P-95-AA | |
| Gel loading tip round 1-200 µL | COSTAR | 4853 | |
| Leica laser-scanning confocal microscope TCS SP8 | Leica Microsystems | ||
| Leica Laser-scanning confocal microscope TCS SP8 Gated STED 775 nm | Leica Microsystems | ||
| Lens Cleaning Tissue | Whatman (GE Healthcare) | 2105-841 | |
| Medium serrated forceps | Euronexia | P-95-AB | |
| Microscope cover glasses 24x50 nm No 1.5H 170±5 µm | Marienfield | 107222 | High precision |
| Nunclon delta surface (12-well plates) | Thermo Scientific | 150628 | |
| Nunclon delta surface (24-well plates) | Thermo Scientific | 142475 | |
| Safeshield scalpel | Feather | 02.001.40.023 | |
| Sharp-blunt scissors - fine Scissors - Martensitic Stainless Steel | Fine Science Tools | 14094-11 | |
| Superfrost plus slides | Thermo Scientific | J1800AMNZ | |
| Software | |||
| GraphPad | Prism, San Diego (US) | Release N°6.07 | Statistical software |
| ImageJ software | National Institutes of Health | Release N° 1.53f | |
| Leica Application Suite X software | Leica Microsystems | Release N°3.7.2.2283 | Free microscope software available at https://www.leica-microsystems.com/products/microscope-software/p/leica-las-x-ls/downloads/ |
Referenzen
- Slater, C. R. Postnatal maturation of nerve-muscle junctions in hindlimb muscles of the mouse. Developmental Biology. 94 (1), 11-22 (1982).
- Jones, R. A., et al. NMJ-morph reveals principal components of synaptic morphology influencing structure-function relationships at the neuromuscular junction. Open Biology. 6 (12), (2016).
- Willadt, S., Nash, M., Slater, C. Age-related changes in the structure and function of mammalian neuromuscular junctions. Annals of the New York Academy of Sciences. 1412, 41-53 (2018).
- Boehm, I., et al. Comparative anatomy of the mammalian neuromuscular junction. Journal of Anatomy. 237 (5), 827-836 (2020).
- Nishimune, H., Shigemoto, K. Practical anatomy of the neuromuscular junction in health and disease. Neurologic Clinics. 36 (2), 231-240 (2018).
- Moloney, E. B., de Winter, F., Verhaagen, J. ALS as a distal axonopathy: molecular mechanisms affecting neuromuscular junction stability in the presymptomatic stages of the disease. Frontiers in Neuroscience. 8, (2014).
- Lovering, R. M., Iyer, S. R., Edwards, B., Davies, K. E. Alterations of neuromuscular junctions in Duchenne muscular dystrophy. Neuroscience Letters. 737, 135304 (2020).
- Koneczny, I., Herbst, R. Myasthenia Gravis: Pathogenic effects of autoantibodies on neuromuscular architecture. Cells. 8 (7), 671 (2019).
- Dowling, J. J., et al. Myotubular myopathy and the neuromuscular junction: a novel therapeutic approach from mouse models. Disease Models & Mechanisms. 5 (6), 852-859 (2012).
- Gibbs, E. M., et al. Neuromuscular junction abnormalities in DNM2-related centronuclear myopathy. Journal of Molecular Medicine. 91 (6), 727-737 (2013).
- Swoboda, K. J., et al. Natural history of denervation in SMA: Relation to age, SMN2 copy number, and function. Annals of Neurology. 57 (5), 704-712 (2005).
- Rodríguez Cruz, P. M., Palace, J., Beeson, D. The neuromuscular junction and wide heterogeneity of congenital myasthenic syndromes. International Journal of Molecular Sciences. 19 (6), 1677 (2018).
- Tse, N., et al. The neuromuscular junction: Measuring synapse size, fragmentation and changes in synaptic protein density using confocal fluorescence microscopy. Journal of Visualized Experiments: JoVE. (94), e52220 (2014).
- Mejia Maza, A., et al. NMJ-Analyser identifies subtle early changes in mouse models of neuromuscular disease. Scientific Reports. 11 (1), 12251 (2021).
- Minty, G., et al. aNMJ-morph: a simple macro for rapid analysis of neuromuscular junction morphology. Royal Society Open Science. 7 (4), 200128 (2020).
- Modla, S., Mendonca, J., Czymmek, K. J., Akins, R. E. Identification of neuromuscular junctions by correlative confocal and transmission electron microscopy. Journal of Neuroscience Methods. 191 (2), 158-165 (2010).
- Kittel, R. J., et al. Bruchpilot promotes active zone assembly, Ca2+ channel clustering, and vesicle release. Science. 312 (5776), 1051-1054 (2006).
- York, A. L., Zheng, J. Q. Super-resolution microscopy reveals a nanoscale organization of acetylcholine receptors for trans-synaptic alignment at neuromuscular synapses. eNeuro. 4 (4), (2017).
- Bowerman, M., Murray, L. M., Beauvais, A., Pinheiro, B., Kothary, R. A critical smn threshold in mice dictates onset of an intermediate spinal muscular atrophy phenotype associated with a distinct neuromuscular junction pathology. Neuromuscular Disorders. 22 (3), 263-276 (2012).
- Feng, G., Krejci, E., Molgo, J., Cunningham, J. M., Massoulié, J., Sanes, J. R. Genetic analysis of collagen Q: Roles in acetylcholinesterase and butyrylcholinesterase assembly and in synaptic structure and function. Journal of Cell Biology. 144 (6), 1349-1360 (1999).
- Sigoillot, S. M., et al. Neuromuscular junction immaturity and muscle atrophy are hallmarks of the ColQ-deficient mouse, a model of congenital myasthenic syndrome with acetylcholinesterase deficiency. The FASEB Journal. 30 (6), 2382-2399 (2016).
- Vanhaesebrouck, A. E., Beeson, D. The congenital myasthenic syndromes: expanding genetic and phenotypic spectrums and refining treatment strategies. Current Opinion in Neurology. 32 (5), 696-703 (2019).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Linkert, M., et al. Metadata matters: access to image data in the real world. Journal of Cell Biology. 189 (5), 777-782 (2010).
- Legland, D., Beaugrand, J. Automated clustering of lignocellulosic fibres based on morphometric features and using clustering of variables. Industrial Crops and Products. 45, 253-261 (2013).
- . GitHUb Available from: https://github.com/Genethon/ImCy (2021)
- Otsu, N. A Threshold selection method from gray-level histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Sanes, J. R., Lichtman, J. W. Induction, assembly, maturation and maintenance of a postsynaptic apparatus. Nature Reviews Neuroscience. 2 (11), 791-805 (2001).
- Kong, L., et al. Impaired synaptic vesicle release and immaturity of neuromuscular junctions in spinal muscular atrophy mice. The Journal of Neuroscience. 29 (3), 842-851 (2009).
- Cifuentes-Diaz, C., et al. Neurofilament accumulation at the motor endplate and lack of axonal sprouting in a spinal muscular atrophy mouse model. Human Molecular Genetics. 11 (12), 1439-1447 (2002).
- Murray, L. M., Comley, L. H., Thomson, D., Parkinson, N., Talbot, K., Gillingwater, T. H. Selective vulnerability of motor neurons and dissociation of pre- and post-synaptic pathology at the neuromuscular junction in mouse models of spinal muscular atrophy. Human Molecular Genetics. 17 (7), 949-962 (2008).
- Boyer, J. G., et al. Myogenic program dysregulation is contributory to disease pathogenesis in spinal muscular atrophy. Human Molecular Genetics. 23 (16), 4249-4259 (2014).
- Ling, K. K. Y., Gibbs, R. M., Feng, Z., Ko, C. -. P. Severe neuromuscular denervation of clinically relevant muscles in a mouse model of spinal muscular atrophy. Human Molecular Genetics. 21 (1), 185-195 (2012).
- Murray, L., Gillingwater, T. H., Kothary, R. Dissection of the transversus abdominis muscle for whole-mount neuromuscular junction analysis. Journal of Visualized Experiments: JoVE. (83), e51162 (2014).
- Baker, J. R. . Principles of biological microtechnique; a study of fixation and dyeing. , (1958).
- Vicidomini, G., et al. STED Nanoscopy with time-gated detection: Theoretical and experimental aspects. PLoS ONE. 8 (1), 054421 (2013).
- Badawi, Y., Nishimune, H. Super-resolution microscopy for analyzing neuromuscular junctions and synapses. Neuroscience Letters. 715, 134644 (2020).
- Thomson, S. R., et al. Morphological characteristics of motor neurons do not determine their relative susceptibility to degeneration in a mouse model of severe spinal muscular atrophy. PLoS ONE. 7 (12), 052605 (2012).
- McMacken, G. M., et al. Salbutamol modifies the neuromuscular junction in a mouse model of ColQ myasthenic syndrome. Human Molecular Genetics. 28 (14), 2339-2351 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten