Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Vielseitigkeit von Protokollen für Widerstandstraining und -bewertung mit statischen und dynamischen Leitern in Tiermodellen
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt Widerstandstraining und Tests mit statischen und dynamischen Leitern in Tiermodellen.
Zusammenfassung
Widerstandstraining ist ein körperliches Bewegungsmodell mit tiefgreifenden Vorteilen für die Gesundheit während des gesamten Lebens. Die Verwendung von Widerstandstrainingsmodellen ist eine Möglichkeit, Einblicke in die zugrunde liegenden molekularen Mechanismen zu gewinnen, die diese Anpassungen orchestrieren. Ziel dieses Artikels ist es, Übungsmodelle und Trainingsprotokolle für das Krafttraining und die Bewertung von Resistenzen in Tiermodellen zu beschreiben und Beispiele zu geben. In diesem Artikel basieren Krafttraining und Widerstandsbewertung auf der Leiterkletteraktivität mit statischen und dynamischen Leitern. Diese Geräte ermöglichen eine Vielzahl von Trainingsmodellen sowie eine präzise Steuerung der Hauptvariablen, die die Widerstandsübung bestimmen: Volumen, Last, Geschwindigkeit und Frequenz. Darüber hinaus ist dies im Gegensatz zu Widerstandsübungen beim Menschen eine erzwungene Übung. Daher müssen bei diesem Eingriff aversive Reize vermieden werden, um das Tierwohl zu wahren. Vor der Implementierung ist ein detailliertes Design sowie eine Akklimatisierungs- und Lernphase erforderlich. Die Akklimatisierung an Trainingsgeräte wie Leitern, Gewichte und klinisches Klebeband sowie an die erforderlichen Manipulationen ist notwendig, um Trainingsabstoßung zu vermeiden und Stress zu minimieren. Gleichzeitig wird den Tieren beigebracht, die Leiter hinaufzuklettern, nicht nach unten, zum Ruhebereich oben auf der Leiter. Die Widerstandsbewertung kann die körperliche Kraft charakterisieren und die Anpassung und Quantifizierung der Trainingsbelastung und der Reaktion auf das Training ermöglichen. Darüber hinaus können verschiedene Arten von Festigkeiten bewertet werden. In Bezug auf Trainingsprogramme können sie bei entsprechendem Design und Geräteeinsatz ausreichend vielseitig sein, um verschiedene Arten von Kraft zu modulieren. Darüber hinaus sollten sie flexibel genug sein, um je nach Anpassungs- und Verhaltensreaktion der Tiere oder dem Vorhandensein von Verletzungen modifiziert zu werden. Zusammenfassend lässt sich sagen, dass Widerstandstraining und -beurteilung mit Leitern und Gewichten vielseitige Methoden in der Tierforschung sind.
Einleitung
Körperliche Bewegung ist ein entscheidender Lebensstilfaktor für die Förderung der Gesundheit und die Verringerung der Inzidenz der häufigsten chronischen Krankheiten sowie einiger Krebsarten beim Menschen1.
Widerstandstraining hat aufgrund seiner überwältigenden Relevanz für die Gesundheit während des gesamten Lebens Interesse geweckt2, insbesondere aufgrund seiner Vorteile bei der Bekämpfung altersbedingter Krankheiten, die den Bewegungsapparat betreffen, wie Sarkopenie, Osteoporose usw.3. Darüber hinaus betrifft Widerstandstraining auch Gewebe und Organe, die nicht direkt an der Ausführung von Bewegungen beteiligt sind, wie das Gehirn4. Diese Relevanz hat in den letzten Jahren die Entwicklung von Widerstandstrainingsmodellen bei Tieren gefördert, um die zugrunde liegenden tisulären und molekularen Mechanismen zu untersuchen, wenn dies beim Menschen nicht möglich ist oder wenn die Tiere bessere Einblicke bieten und ein kontrollierteres Modell sind.
Im Gegensatz zur Widerstandsübung beim Menschen verlassen sich die Forscher bei Tiermodellen in der Regel auf erzwungene Verfahren. Allerdings müssen in diesem Zusammenhang aversive Reize vermieden werden, vor allem um das Tierwohl zu wahren, Stress abzubauen und die Schwere der experimentellen Verfahren zu verringern5. Es sollte beachtet werden, dass Tiere sich auch in freier Wildbahn gerne bewegen6. Aus diesen Gründen ist es notwendig, die Anpassung an das Experiment durch eine längere schrittweise Akklimatisierung zu verbessern.
Die Geräte, Materialien und Protokolle, die für das Widerstandstraining und die Bewertung bei Versuchstieren verwendet werden, müssen die präzise Kontrolle und Modulation zahlreicher Variablen ermöglichen: Last, Volumen, Geschwindigkeit und Frequenz7. Sie sollten auch verschiedene Arten von Muskelkontraktionen ermöglichen: konzentrisch, exzentrisch oder isometrisch. In Anbetracht dessen sollten die verwendeten Protokolle in der Lage sein, verschiedene Kraftanwendungen spezifisch zu bewerten oder zu trainieren: maximale Kraft, Hypertrophie, Geschwindigkeit und Ausdauer.
Es gibt verschiedene Methoden des Krafttrainings, wie Springen im Wasser8,9, gewichtetes Schwimmen im Wasser 10 oder Muskelelektrostimulation11. Statische und dynamische Leitern sind jedoch vielseitige Geräte, die weit verbreitet sind12,13,14.
Die Resistenzbewertung in experimentellen Tiermodellen liefert wertvolle Informationen für viele Forschungsumgebungen, wie z.B. die Beschreibung der phänotypischen Merkmale genetisch veränderter Tiere, die Bewertung der Wirkung verschiedener Interventionsprotokolle (Nahrungsergänzung mit Nahrungskomponenten, medikamentöse Behandlungen, Mikrobiota-Transplantation usw.) oder die Bewertung der Wirkung von Trainingsprotokollen. Trainingsmodelle geben Einblick in die Physiologie der Anpassung an Kraftübungen, was hilft, die Auswirkungen von Bewegung auf den Gesundheitszustand und die Pathophysiologie besser zu verstehen.
Folglich gibt es kein universelles Protokoll für das Widerstandstraining oder die funktionelle Bewertung der Kraft in Tiermodellen, so dass vielseitige Protokolle benötigt werden.
Ziel dieser Studie ist es, die relevantesten Faktoren zu identifizieren, die bei der Gestaltung und Anwendung eines Protokolls für Widerstandstraining und -bewertung mit statischen und dynamischen Leitern in Tiermodellen zu berücksichtigen sind, sowie spezifische Beispiele zu liefern.
Protokoll
Die in diesem Protokoll vorgestellten Methoden wurden vom technischen Ausschuss für Tierforschung bewertet und genehmigt (Referenz PROAE 04/2018, Principado de Asturias, Spanien).
1. Planung
- Wählen Sie sorgfältig die Tiere für die Studie auf der Grundlage der interessierenden Merkmale (genetisch verändert, Pathologiemodelle, Alter usw.) aus und wenden Sie spezifische Anpassungen des Protokolls an (Klettern ohne Gewichte, Verringerung der Anzahl der zu kletternden Sprossen und Neigung).
- Identifizieren Sie die Kraftmodalität, die bewertet oder trainiert werden soll: maximale Kraft, Ausdauerwiderstand, Geschwindigkeit usw. in Abhängigkeit von den Zielen der Studie.
- Passen Sie die Parameter sorgfältig an, wenn die funktionelle Bewertung oder das Training festgelegt wird, und berücksichtigen Sie, ob sie sich auf die Ergebnisse dieser Tests konzentrieren oder ob sie andere Arten klinischer, funktioneller, histologischer oder molekularer Bestimmungen ergänzen.
- Planen Sie alle Fragen im Zusammenhang mit der Ausbildung, insbesondere den Zeitplan, die Dauer der Trainingszeit und die Häufigkeit der Sitzungen, und zeichnen Sie eine Trainingstabelle.
- Geben Sie die Aufwärmschritte und die Neigung der Leiter an, die während des gesamten Trainings gleich sein wird. Legen Sie Sätze, Wiederholungen, Belastung (basierend auf den Ergebnissen der Widerstandstests, die vor der Trainingsphase durchgeführt wurden) fest und ruhen Sie sich dazwischen aus, wobei Sie auf Belastungserhöhungen achten, die auf der vorherigen Sitzung basieren.
- Ändern Sie den Plan, wie beim menschlichen Training, abhängig vom Wohlergehen des Tieres. Zu den Modifikationen gehören das Verringern von Wiederholungen, die Erhöhung der Ruhezeit zwischen Sätzen oder Wiederholungen und die Verringerung der Belastung, um Übertraining und Verletzungen zu vermeiden.
- Nach Fertigstellung reichen Sie das Design zur Bewertung und Genehmigung durch die Tierethik-Forschungskommission ein.
2. Geräte und Materialien für die Widerstandsübung
- Geräte: Statische und dynamische Leitern
HINWEIS: Zwei Arten von Leitern, sogenannte statische und dynamische Leitern (siehe Abbildung 1), können für das Widerstandstraining und die Bewertung verwendet werden (siehe Materialtabelle).- Verwenden Sie eine vertikale Leiter mit mindestens 30 Stahldrahtstufen von 1,5 mm Durchmesser, getrennt durch 15 mm, und einer Ruhefläche von mindestens 20 x 20 cm auf der Oberseite der Leiter. Die Neigung der Leiter muss mit der horizontalen Ebene von 80° bis 110° verstellbar sein (Abbildung 1C). Begrenzen Sie zwei Fahrspuren, um nichtlineares Klettern zu verhindern.
- Verwenden Sie eine dynamische Leiter ähnlich der statischen Leiter, mit einer Kunststoff-Filamentbarriere an der Oberseite, die geöffnet werden kann, um den Zugang zum Ruhebereich zu kontrollieren, und einer Kunststoff-Filamentbarriere an der Unterseite, um zu verhindern, dass die Tiere herunterklettern. Der Neigungswinkel der Leiter muss zwischen 80° und 100° einstellbar sein, wobei der häufigste 85° ist.
HINWEIS: Die Leiter kann mittels eines oberen und eines unteren Schaftes mit einem Durchmesser von 8 cm zirkulieren. Die untere Welle wird von einem Elektromotor angetrieben, der die Stufen vorne absteigen und hinten aufsteigen lässt, wodurch eine endlose Leiter entsteht. Es ist mit einem Untersetzungsgetriebe und einem Geschwindigkeitsregler zum Absenken der Geschwindigkeit von 11,6 cm / s auf 3,3 cm / s ausgestattet, und die häufigste Geschwindigkeit beträgt 5,6 cm / s.
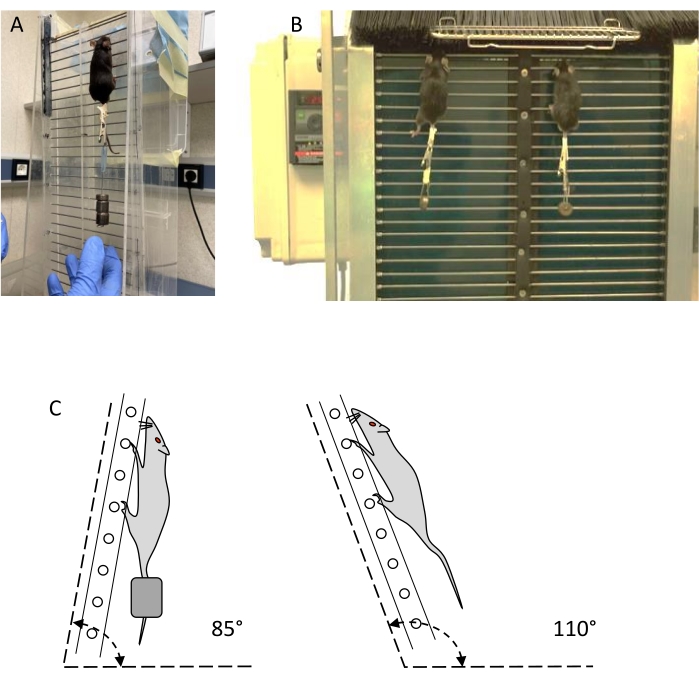
Abbildung 1: Widerstandstrainingsgeräte: statische und dynamische Leitern. (A) Maustraining mit Außengewicht auf einer statischen Leiter. (B) Zwei Mäuse trainieren mit Gewicht auf einer dynamischen Leiter. (C) Schematische Darstellung der Leiterwinkel für Training und Bewertung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Materialien
- Bereiten Sie die folgenden Materialien vor: Gewichte, Draht zum Halten von Gewichten, Stahlgatorclip und klinisches Klebeband.
HINWEIS: Die Gewichte sind Stahlzylinder unterschiedlicher Masse (5, 10, 15, 20, 25 und 50 g) mit einem Loch von 5 mm Durchmesser in der Mitte, um sie auf einem Draht zu fädeln (Tabelle der Materialien). Der Draht zur Aufnahme der Gewichte besteht aus Stahl mit einem Durchmesser von 1-1,5 mm und einer Länge von 5-10 cm, abhängig von der Anzahl der zu ladenden Gewichte. - Schneiden Sie ein Stück elastische Klebebandage (Table of Materials) von ca. 3,0-3,5 cm x 1,0-1,5 cm Größe und befestigen Sie es um den Schwanz des Tieres, um die Gewichte zu halten. Achten Sie darauf, nicht zu straffen, da dies zu einer Einschränkung des Blutflusses führen kann.
HINWEIS: Zuerst wird das Verhalten der Tiere gegen das Band kämpfen und es beißen, aber nach ein paar Tagen werden sie es tolerieren, sich wie gewohnt pflegen und keine Anzeichen von Stress zeigen. - Stecken Sie die gewünschten Gewichte in den Draht und haken Sie den Gatorclip ein (Materialtabelle: Gatorclip aus Stahl und Draht zum Halten von Gewichten).
- Klemmen Sie den Gator an das klinische Klebeband, das am Schwanz des Tieres befestigt ist.
- Entfernen Sie unmittelbar nach dem Erklimmen der erforderlichen Sprossen die Klemme und lassen Sie das Tier mit dem klinischen Klebeband am Schwanz, jedoch ohne das Gewicht, ruhen (Abbildung 1).
- Bereiten Sie die folgenden Materialien vor: Gewichte, Draht zum Halten von Gewichten, Stahlgatorclip und klinisches Klebeband.
3. Akklimatisierung
HINWEIS: Die richtige Akklimatisierung ist wichtig, um Trainingsablehnungen zu vermeiden und Stress zu minimieren. Die Akklimatisierung ist eine entscheidende Phase, bevor Widerstandsbewertungstests oder Trainingsprotokolle durchgeführt werden. Es sollte ausreichend Zeit aufgewendet werden, um Verhaltenszeichen von Komfort bei den Tieren zu erreichen. Details zur täglichen Akklimatisierung mit den statischen und dynamischen Leitern sind in Tabelle 1 bzw. Tabelle 2 dargestellt.
- Gewöhnen Sie die Tiere daran, im Ruhebereich oben auf der Leiter zu bleiben (statisch oder dynamisch). Lassen Sie die Tiere an diesem Ort in Vierergruppen, mit Einstreu aus ihrem Käfig, für 15 Minuten jeden Tag. Normalerweise zeigen die Tiere nach 3-5 Tagen keine Anzeichen von Stress.
- Bringen Sie Tieren bei, die Leiter hinaufzuklettern, nicht herunterzuklettern. Setzen Sie die Mäuse mit der statischen Leiter auf eine Sprosse in der Nähe der Spitze, von wo aus sie den Ruhebereich sehen können. Sie werden instinktiv dorthin gehen. Bringen Sie ihnen dann bei, schrittweise von fünf Sprossen (3x) am ersten Tag auf 10 Sprossen (3x) am nächsten Tag bis zu 15 Sprossen (3x) aufzusteigen (Tabelle 1).
Verwenden Sie das gleiche Verfahren mit der dynamischen Leiter, zuerst ohne Bewegung, und dann mit einer Leiter, die sich mit 5,4 cm/s und 6,6 cm/s bewegt und die Tiere 2 Minuten lang nach oben klettern und fünf Serien vervollständigen (Tabelle 2). - Passen Sie die Tiere ab dem dritten Tag der Akklimatisierung an das Tragen von Gewichten an. Kleben Sie ein Stück klinisches Klebeband an die Basis des Schwanzes, das zum Halten von Gewichten verwendet wird.
- Befestigen Sie ab dem siebten Tag der Akklimatisierung kleine Gewichte (5-10 g) mit einem Gatorclip am klinischen Band. Vermeiden Sie es, zu viele Serien auszuführen, damit die Anpassung nicht in Training umgewandelt wird.
HINWEIS: Die Akklimatisierung der Kontrollgruppe ist obligatorisch, wenn diese Gruppe den Widerstandstest durchführt. Führen Sie nach dieser Zeit einmal pro Woche eine Leiterklettererinnerung mit Klebeband, aber ohne Gewichte durch.
4. Bewertung der Resistenz
- Inkrementelle Tests zur Beurteilung der Maximalfestigkeit
HINWEIS: Dieser Test zielt darauf ab, den maximalen Widerstand zu bestimmen, der als maximales Gewicht gemessen wird, mit dem die Tiere 10 Sprossen auf der statischen Leiter erklimmen können, was das Maximum von 10 Wiederholungen (10 RM)4 definiert. Dieses Protokoll wurde aus früheren Studien übernommen (überprüft in Kregel et al.15).- Zum Aufwärmen führen Sie drei Serien von 10-Wiederholungen, 10 Schritte / Wiederholung, ohne externe Belastung durch. Für die erste Serie wurde die Neigung auf 90° und danach auf 85° eingestellt. Erlauben Sie eine Ruhezeit von 60 s zwischen den Serien.
- Stellen Sie die Neigung auf 85° ein (um zu verhindern, dass die Gewichte an den Sprossen der Leiter grasen oder hängen).
- Befestigen Sie das Klebeband um den Schwanz des Tieres, um die Gewichte zu halten, und bereiten Sie die Gewichte wie zuvor erklärt vor.
- Starten Sie den Test mit einer äußeren Belastung von 10 g und führen Sie eine Reihe von 10 Schritten durch.
- Entfernen Sie das Gewicht und lassen Sie eine Ruhezeit von 120 s im Ruhebereich.
- Führen Sie aufeinanderfolgende Serien von 10 Schritten durch, wobei Sie die externe Belastung bis zur Erschöpfung um 5 g erhöhen. Lassen Sie die Ruhezeit (120 s) zwischen den Serien zu.
- Wenn ein Tier 10 Stufen mit einer bestimmten Gewichtsbelastung nicht erklimmt, erlauben Sie nach 120 s Ruhezeit einen weiteren Versuch mit der gleichen Belastung. Gelingt es ihm, mit der Last zu klettern, setzt er den Test mit der nächsten Last fort. Wenn es erneut fehlschlägt, notieren Sie die Gewichtslast der letzten abgeschlossenen Serie als maximale Gewichtsbelastung.
- Das Testergebnis kann als absolutes Außengewicht (g), als maximale Belastung im Verhältnis zum Körpergewicht (%) oder als die pro Gramm Körpergewicht gehobene Masse nach Ermessen des Forschers ausgedrückt werden.
HINWEIS: Das vorherige Protokoll stellt ein Modell dar, an dem zahlreiche Modifikationen möglich sind, um beispielsweise die maximale Widerstandsfähigkeit von genetisch veränderten Mäusen mit neuromuskulären Behinderungen zu beurteilen. Diese Tiere sind nicht in der Lage, mit äußeren Lasten zu klettern und haben Schwierigkeiten, 10 Sprossen mit der Leiter auf 90° Neigung zu klettern (unveröffentlichte Daten). Das Protokoll bestand darin, fünf Stufen ohne äußere Last zu erklimmen, beginnend mit einer Neigung von 110°. Die Neigung verringerte sich in jeder Serie um 5° bis 85° mit 120 s Pause nach jeder Serie. In diesem Fall wurde der maximale Widerstand als die akkumulierte Anzahl der erklommenen Stufen ausgedrückt (ohne Berücksichtigung von Wiederholungen nach Misserfolgen). Die Wildtyp-Kontrollgruppe wird nach Erreichen der 85°-Neigung den Test fortsetzen, indem sie dem Schwanz gemäß dem vorherigen Protokoll bis zur Erschöpfung externes Gewicht hinzufügt.
- Maximale Dauerfestigkeitsprüfung mit der statischen Leiter
- Zum Aufwärmen führen Sie drei Serien von 10-Wiederholungen, 10 Schritte / Wiederholung, ohne externe Belastung durch. Stellen Sie für die erste Serie die Neigung auf 90° und danach auf 85° ein. Erlauben Sie eine Ruhezeit von 60 s zwischen den Serien.
- Stellen Sie die Neigung auf 85° ein.
- Clippen Sie das Gewicht auf das klinische Klebeband, das um den Schwanz der Maus gelegt ist.
HINWEIS: Abhängig vom Alter und den Eigenschaften der Tiere kann die äußere Belastung das maximale Gewicht sein, das in einem vorherigen inkrementellen Test erhalten wurde, ein Prozentsatz davon (z. B. 50%) oder ein Prozentsatz des Körpergewichts (z. B. 100% -200%). Wenn dieser Test nach einer Trainingsphase durchgeführt wird, wird empfohlen, die gleiche Belastung wie im ersten Test zu verwenden, um die Änderungen zu beurteilen. - Führen Sie aufeinanderfolgende Serien von 10 Schritten bis zur Erschöpfung durch. Nach jeder Serie ist keine Ruhezeit erlaubt.
- Das Testergebnis ist die Anzahl der erklommenen Sprossen.
- Maximaler Dauerwiderstandstest mit der dynamischen Leiter
HINWEIS: Die Verwendung der dynamischen Leiter ermöglicht es dem Forscher, die Steiggeschwindigkeit zu kontrollieren.- Stellen Sie die Neigung auf 85° ein.
- Stellen Sie die Geschwindigkeit auf 4,2 cm/s ein.
- Zum Aufwärmen führen Sie drei Serien von 100 Schritten ohne externe Belastung durch. Erlauben Sie eine Ruhezeit von 60 s zwischen den Serien.
- Clippen Sie das Gewicht auf dem klinischen Klebeband, das um den Mausschwanz gelegt ist.
HINWEIS: Abhängig vom Alter und den Eigenschaften der Tiere kann die äußere Belastung das maximale Gewicht sein, das in einem vorherigen inkrementellen Test erhalten wurde, ein Prozentsatz davon (z. B. 50%) oder ein Prozentsatz des Körpergewichts (z. B. 100% -200%). Wenn dieser Test nach einer Trainingsphase durchgeführt wird, wird empfohlen, die gleiche Belastung wie im ersten Test zu verwenden, um die Änderungen zu beurteilen. - Beginnen Sie bei 4,2 cm/s und erhöhen Sie die Geschwindigkeit alle 60 s um 1,2 cm/s bis zur Erschöpfung.
HINWEIS: Das Testergebnis ist die Übungszeit, die Anzahl der erklommenen Sprossen oder die maximale Geschwindigkeit.
5. Widerstandstraining mit statischer Leiter
HINWEIS: Vor Beginn der Trainingszeit sind Akklimatisierung (Tabelle 1) und Trainingsplanung notwendig. Um Angst zu reduzieren, passen Sie die Mäuse an und trainieren Sie sie in Gruppen von vier Tieren, die sich den gleichen Käfig teilen.
- Für das tägliche Aufwärmen führen Sie drei Serien von 10 Wiederholungen, 10 Schritte / Wiederholung, ohne externe Belastung durch. Für die erste Serie wurde die Neigung auf 90° und danach auf 85° eingestellt. Erlauben Sie eine Ruhezeit von 60 s zwischen den Serien.
- Die Trainingseinheit beginnt im Ruhebereich. Befestigen Sie den Gator mit dem Gewicht auf dem klinischen Band.
- Legen Sie die Maus vorsichtig 10-20 Sprossen unter den Ruheplatz. Lassen Sie die Maus die Sprosse greifen und klettern Sie zum Ruhebereich.
Wiederholen Sie diesen Vorgang, bis die Anzahl der Sprossen in dieser Serie (z. B. 10 Sprossen x 10 Serie) abgeschlossen ist. - Entfernen Sie das Gewicht vom Mausschwanz und warten Sie 120 s bis zur nächsten Serie.
- Erhöhen Sie die Anzahl der Schritte und die maximalen Gewichtsbelastungen der Serie während der gesamten Trainingszeit unter Beibehaltung des Wochenplans.
ANMERKUNG: Ein Beispiel für die Variation der Lasten während einer Wochenplanung ist in Tabelle 3 dargestellt. Kurz Dienstag und Freitag mit hoher Gewichtsbelastung (40-50 g) und geringer Schrittzahl (500-400); Montag und Donnerstag mit mittlerer Gewichtsbelastung (25-35 g) und einer mittleren Anzahl von Schritten (800-600); und Mittwoch ohne Gewichtsbelastung, aber eine hohe Anzahl von Schritten (2.000). Dieses Design erleichtert die Erholung von früheren Trainingseinheiten und vermeidet Verletzungen und Übertraining. Beispiele für 3 Wochen Training mit mehreren Ausführungen unter Verwendung der statischen Leiter sind in Tabelle 4 (zu Beginn, in der Mitte bzw. am Ende der Trainingsperiode)4 dargestellt.
6. Widerstandstraining mit dynamischer Leiter
HINWEIS: Nach der Akklimatisierung ist das Training auf der dynamischen Leiter dem statischen ähnlich (Tabelle 2). Das Training wird an 2-4 Mäusen gleichzeitig durchgeführt.
- Stellen Sie die Neigung auf 85° ein, schließen Sie die Tür zum Ruhebereich und starten Sie die Leiter mit der gewünschten Geschwindigkeit (z. B. 5,4 cm / s).
- Zum Aufwärmen führen Sie drei Serien von 100 Schritten ohne externe Belastung durch. Erlauben Sie eine Ruhezeit von 60 s zwischen den Serien.
- Bevor die Trainingseinheiten beginnen, wenn sich die Maus im Ruhebereich befindet, befestigen Sie den Gator mit dem Gewicht auf dem klinischen Band. Alternativ kann das Gewicht angebracht werden, wenn sich die Maus bereits auf der Leiter befindet.
- Platzieren Sie die Maus vorsichtig oben auf der beweglichen Treppe mit dem Gewicht auf dem Schwanz. Lassen Sie die Mäuse die Sprosse greifen und klettern.
- Wenn die Anzahl der Sprossen in dieser Reihe erreicht ist (z. B. 100), entfernen Sie die Gewichte. Dann wird die Tür geöffnet, damit das Tier in den Ruhebereich gehen kann. Die Ruhezeit beträgt 120 s vor der nächsten Serie.
HINWEIS: Die Anzahl der erklommenen Stufen wird als Funktion der Steigzeit bei der eingestellten Geschwindigkeit gezählt. - Wiederholen Sie diesen Vorgang, bis die Trainingseinheit abgeschlossen ist. Das detaillierte tägliche Trainingsprogramm ist in Tabelle 5 dargestellt.
7. Bewertung des Crossover-Effekts von Widerstandstraining auf die Ausdauerleistung
HINWEIS: Dazu wird nach 24 Stunden Ruhezeit ein inkrementeller Laufbandtest4 durchgeführt.
- Nach einem Aufwärmen von 3 min bei 10 cm/s starten Sie den Inkrementaltest bei 10 cm/s und 10° Neigungswinkel.
- Erhöhen Sie die Geschwindigkeit um 3,33 cm/s alle 3 min bis zur Erschöpfung.
HINWEIS: Es werden keine Elektroschocks verwendet, daher wird ein Malerpinsel an der Rückseite des Laufbandes platziert, um zu verhindern, dass die Mäuse davon laufen.
8. Verhalten der Tiere während der Eingriffe
HINWEIS: Eine kontinuierliche Überwachung der Anpassung von Mäusen an das Training sollte durchgeführt werden, um extreme Ermüdung, Übertraining oder Verletzungen zu erkennen.
- Beobachten Sie Anzeichen von Tierschutz, insbesondere Pflege und Verweigerung der Ausbildung. Das normale Verhalten der Maus besteht nach einer Reihe intensiver Trainingseinheiten darin, aufgrund von Müdigkeit etwa eine Minute lang inaktiv zu bleiben. Danach beginnen sie mit der Pflege, Erkundung oder dem Versuch, das Klebeband am Schwanz zu entfernen.
- Im Falle einer Maus, die sich weigert, eine Serie zu trainieren, versuchen Sie, längere Pausen zu geben oder diese Serie sogar nicht auszuführen, um Hemmungen zu vermeiden.
- Gelegentlich drücken Sie bei leichten Übungen sanft den Schwanz des Tieres, um es zu ermutigen, die Serie zu beenden. Die Tiere hören auf zu klettern, weil es keine anspruchsvolle Aufgabe ist. Umgekehrt, wenn Tiere eine schwere Last tragen, verlagern Sie sanft das Gewicht des Tieres, um die Last zu erleichtern und es zu ermutigen, die Serie zu beenden, und lassen Sie das Tier dann bis zur nächsten Trainingseinheit ruhen. Die Tiere können wegen der schweren Last anhalten oder sogar versuchen, abzusteigen.
9. Sicherheitsverfahren
- Sicherheitsverfahren für Forscher: Führen Sie Forschungen im Labor der Tiereinrichtung durch und verwenden Sie Schuhüberzieher, Overalls, Handschuhe, Mützen und Masken. Es gibt keine zusätzlichen Anforderungen außer denen, die spezifisch für Tierversuche sind.
- Sicherheit für Tiere: Während der Übungseinheiten muss aufgrund möglicher Risiken wie Stürze oder Sprünge ständig auf die Tiere geachtet werden. Legen Sie eine Hand unter die Gewichte, um die Mäuse im Falle eines Sturzes aufgrund von Erschöpfung zu fangen und zu halten, da ihre Fähigkeit, sich richtig an den Sprossen festzuhalten, eingeschränkt ist.
Ergebnisse
Ergebnisse mit statischer Leiter
Das von Codina-Martinez et al.4 verwendete und beschriebene progressive Widerstandstrainingsprotokoll (Tabelle 4) wurde in einer Vorstudie getestet, die aus 7 Wochen Training auf einer statischen Leiter mit 6 Monate alten Wildtyp-C57BL6J-Mäusen bestand (n = 4). In dieser Vorstudie wurden inkrementelle Tests zur Beurteilung der Maximalkraft vor und nach der Trainingsphase durchgeführt. Wir beobachteten eine Steigerung der Maxim...
Diskussion
Training ist eine Intervention mit mehreren Anwendungen in der Forschung, abgesehen vom Studium der Übung selbst. So hat die Analyse seiner Auswirkungen auf das Altern20 oder bestimmte pathologische Zustände und Physiotherapie21 in den letzten Jahren viel Aufmerksamkeit erhalten. Darüber hinaus haben zahlreiche Autoren die Wirkung von pharmakologischen22 oder diätetischen21 Interventionen auf die körperliche Fitness analy...
Offenlegungen
Der korrespondierende Autor stellt sicher, dass alle Autoren keine Interessenkonflikte haben.
Danksagungen
Diese Arbeit wurde teilweise vom Ministerio de Economía y Competitividad, Spanien unterstützt (DEP2012-39262 an EI-G und DEP2015-69980-P an BF-G). Vielen Dank an Frank Mcleod Henderson Higgins vom McLeod's English Centre in Asturien, Spanien, für die Sprachunterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| Dynamic ladder | in-house production | ||
| Elastic adhesive bandage 6 cm x 2.5 m | BSN medical | 4005556 | |
| Gator Clip Steel NON-INSUL 10A | Digikey electronics | BC60ANP | |
| Static ladder | in-house production | ||
| Weights | in-house production | ||
| Wire for holding weigths | in-house production |
Referenzen
- Pedersen, B. K., Saltin, B. Exercise as medicine - evidence for prescribing exercise as therapy in 26 different chronic diseases. Scandinavian Journal of Medicine & Science in Sports. 25, 1-72 (2015).
- Westcott, W. L. Resistance training is medicine: effects of strength training on health. Current Sports Medicine Reports. 11 (4), 209-216 (2012).
- Garatachea, N., et al. Exercise attenuates the major hallmarks of aging. Rejuvenation Research. 18 (1), 57-89 (2015).
- Codina-Martinez, H., et al. Autophagy is required for performance adaptive response to resistance training and exercise-induced adult neurogenesis. Scandinavian Journal of Medicine & Science in Sports. 30 (2), 238-253 (2020).
- Conner, J. D., Wolden-Hanson, T., Quinn, L. S. Assessment of murine exercise endurance without the use of a shock grid: an alternative to forced exercise. Journal of Visualized Experiments: JoVE. (90), e51846 (2014).
- Meijer, J. H., Robbers, Y. Wheel running in the wild. Proceedings of the Royal Society B: Biological Sciences. 281 (1786), 20140210 (2014).
- Suchomel, T. J., Nimphius, S., Bellon, C. R., Hornsby, W. G., Stone, M. H. Training for muscular strength: Methods for monitoring and adjusting training intensity. Sports Medicine. 51 (10), 2051-2066 (2021).
- Pousson, M., Perot, C., Goubel, F. Stiffness changes and fibre type transitions in rat soleus muscle produced by jumping training. Pflügers Archive. 419 (2), 127-130 (1991).
- Marqueti, R. C., et al. Biomechanical responses of different rat tendons to nandrolone decanoate and load exercise. Scandinavian Journal of Medicine & Science in Sports. 21 (6), 91-99 (2011).
- Cunha, T. S., Tanno, A. P., Costa Sampaio Moura, M. J., Marcondes, F. K. Influence of high-intensity exercise training and anabolic androgenic steroid treatment on rat tissue glycogen content. Life Sciences. 77 (9), 1030-1043 (2005).
- Heinemeier, K. M., et al. Expression of collagen and related growth factors in rat tendon and skeletal muscle in response to specific contraction types. The Journal of Physiology. 582, 1303-1316 (2007).
- Hornberger, T. A., Farrar, R. P. Physiological hypertrophy of the FHL muscle following 8 weeks of progressive resistance exercise in the rat. Canadian Journal of Applied Physiology. 29 (1), 16-31 (2004).
- Yarasheski, K. E., Lemon, P. W., Gilloteaux, J. Effect of heavy-resistance exercise training on muscle fiber composition in young rats. Journal of Applied Physiology. 69 (2), 434-437 (1990).
- Khamoui, A. V., et al. Aerobic and resistance training dependent skeletal muscle plasticity in the colon-26 murine model of cancer cachexia. Metabolism. 65 (5), 685-698 (2016).
- Kregel, K. C., et al. Resource book for the design of animal exercise protocols. American Physiological Society. 152, (2006).
- Marino, G., et al. Autophagy is essential for mouse sense of balance. The Journal of Clinical Investigation. 120 (7), 2331-2344 (2010).
- Figueiredo, V. C., de Salles, B. F., Trajano, G. S. Volume for muscle hypertrophy and health outcomes: The most effective variable in resistance training. Sports Medicine. 48 (3), 499-505 (2018).
- Gentil, P., et al. Using velocity loss for monitoring resistance training effort in a real-world setting. Applied Physiology, Nutrition, and Metabolism. 43 (8), 833-837 (2018).
- Fernández-Sanjurjo, M., et al. Is physical performance (in mice) increased by Veillonella atypica or decreased by Lactobacillus bulgaricus. Journal of Sport and Health Science. 9 (3), 197-200 (2020).
- Shiguemoto, G. E., et al. Effects of resistance training on matrix metalloproteinase-2 activity and biomechanics and physical properties of bone in ovariectomized and intact rats. Scandivavian Journal of Medicine & Science in Sports. 22 (5), 607-617 (2012).
- de Sousa Neto, I. V., et al. Effects of resistance training on matrix metalloproteinase activity in skeletal muscles and blood circulation during aging. Frontiers in Physiology. 9, 190 (2018).
- Ghosh, S., Golbidi, S., Werner, I., Verchere, B. C., Laher, I. Selecting exercise regimens and strains to modify obesity and diabetes in rodents: an overview. Clinical Science. 119 (2), 57-74 (2010).
- Mônico-Neto, M., et al. Resistance training minimizes catabolic effects induced by sleep deprivation in rats. Applied Physiology, Nutrition, and Metabolism. 40 (11), 1143-1150 (2015).
- Hawley, J. A., Hargreaves, M., Joyner, M. J., Zierath, J. R. Integrative biology of exercise. Cell. 159 (4), 738-749 (2014).
- Booth, F. W., Laye, M. J., Spangenburg, E. E. Gold standards for scientists who are conducting animal-based exercise studies. Journal of Applied Physiology. 108 (1), 219-221 (1985).
- Kruger, K., et al. Functional and muscular adaptations in an experimental model for isometric strength training in mice. PLoS One. 8 (11), 79069 (2013).
- Hendrickse, P. W., Krusnauskas, R., Hodson-Tole, E., Venckunas, T., Degens, H. Endurance exercise plus overload induces fatigue resistance and similar hypertrophy in mice irrespective of muscle mass. Experimental Physiology. 105 (12), 2110-2122 (2020).
- Knab, A. M., et al. Repeatability of exercise behaviors in mice. Physiology & Behavior. 98 (4), 433-440 (2009).
- Konhilas, J. P., et al. Loaded wheel running and muscle adaptation in the mouse. American Journal of Physiology-Heart and Circulatory Physiology. 289 (1), 455-465 (2005).
- Reiter, A., et al. Functional measures of grip strength and gait remain altered long-term in a rat model of post-traumatic elbow contracture. The Journal of Biomechanical Engineering. , (2019).
- Stieglitz, T., Schuettler, M., Schneider, A., Valderrama, E., Navarro, X. Noninvasive measurement of torque development in the rat foot: measurement setup and results from stimulation of the sciatic nerve with polyimide-based cuff electrodes. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 11 (4), 427-437 (2003).
- Seo, D. Y., et al. Humanized animal exercise model for clinical implication. Pflügers Archiv. 466 (9), 1673-1687 (2014).
- Tanaka, H., Swensen, T. Impact of resistance training on endurance performance. A new form of cross-training. Sports Medicine. 25 (3), 191-200 (1998).
- Hakkinen, K., Mero, A., Kauhanen, H. Specificity of endurance, sprint and strength training on physical performance capacity in young athletes. The Journal of Sports Medicine and Physical Fitness. 29 (1), 27-35 (1989).
- Vellers, H. L., Kleeberger, S. R., Lightfoot, J. T. Inter-individual variation in adaptations to endurance and resistance exercise training: genetic approaches towards understanding a complex phenotype. Mammalian Genome. 29 (1), 48-62 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten