Method Article
Quantifizierung des potenziellen Einflusses von Glyphosat-basierten Produkten auf Mikrobiome
In diesem Artikel
Zusammenfassung
Glyphosat-basierte Produkte (GBP) sind die weltweit am weitesten verbreiteten Breitband-Herbizide. In diesem Artikel stellen wir allgemeine Richtlinien vor, um die Wirkung von GBP auf Mikrobiome zu quantifizieren, von Feldexperimenten bis hin zu bioinformatischen Analysen.
Zusammenfassung
Glyphosat-basierte Produkte (GBP) sind die weltweit am weitesten verbreiteten Breitband-Herbizide. Das Ziel von Glyphosat ist das Enzym 5-Enolpyruvylshikimat-3-phosphat-Synthase (EPSPS) im Shikimatweg, das in Pflanzen praktisch universell ist. Die Hemmung des Enzyms stoppt die Produktion von drei essentiellen Aminosäuren: Phenylalanin, Tyrosin und Tryptophan. EPSPS ist auch in Pilzen und Prokaryoten wie Archaeen und Bakterien vorhanden; Daher kann die Verwendung von GBP Auswirkungen auf die Mikrobiomzusammensetzung von Böden, Pflanzen, Pflanzenfressern und Sekundärverbrauchern haben. Dieser Artikel zielt darauf ab, allgemeine Richtlinien zur Bewertung der Wirkung von GBP auf Mikrobiome von Feldexperimenten bis hin zu bioinformatischen Analysen vorzustellen und einige überprüfbare Hypothesen zu liefern. Zwei Feldexperimente werden vorgestellt, um das GBP an Nichtzielorganismen zu testen. Zunächst werden pflanzenassoziierte Mikroben aus 10 replizierten Kontroll- und GBP-Behandlungsflächen, die den Direktsaatanbau simulieren, beprobt und analysiert. Im zweiten Versuch wurden Proben aus Versuchsflächen entnommen, die entweder mit Geflügelmist befruchtet wurden, der Glyphosatrückstände enthielt, oder mit nicht behandeltem Kontrollmist. Die bioinformatische Analyse von EPSPS-Proteinsequenzen wird verwendet, um die potenzielle Empfindlichkeit von Mikroben gegenüber Glyphosat zu bestimmen. Der erste Schritt bei der Abschätzung der Wirkung von GBP auf Mikrobiome besteht darin, ihre potenzielle Empfindlichkeit gegenüber dem Zielenzym (EPSPS) zu bestimmen. Mikrobielle Sequenzen können entweder aus öffentlichen Repositorien oder mittels PCR-Amplifikation gewonnen werden. In den meisten Feldstudien wurde die Zusammensetzung des Mikrobioms jedoch auf der Grundlage universeller DNA-Marker wie der 16S rRNA und des internen transkribierten Spacers (ITS) bestimmt. In diesen Fällen kann die Sensitivität gegenüber Glyphosat nur durch eine probabilistische Analyse von EPSPS-Sequenzen unter Verwendung eng verwandter Spezies abgeschätzt werden. Die Quantifizierung der potenziellen Empfindlichkeit von Organismen gegenüber Glyphosat, basierend auf dem EPSPS-Enzym, bietet einen robusten Ansatz für weitere Experimente zur Untersuchung von ziel- und nichtzielresistenten Mechanismen.
Einleitung
Der starke Einsatz von Pestiziden in der modernen Landwirtschaft trägt eindeutig wesentlich zum Rückgang der biologischen Vielfaltbei 1. Dieses Papier konzentriert sich auf Glyphosat, da glyphosatbasierte Produkte (GBPs) aufgrund ihrer Effizienz und ihres erschwinglichen Preises zu den weltweit am häufigsten verwendeten Pestiziden gewordensind 2,3. Neben der Abtötung von Unkräutern auf landwirtschaftlichen Feldern werden GBPs häufig im Waldbau, in städtischen Umgebungen und in Hausgärten verwendet. Darüber hinaus wurden sie als ungiftig für Nichtzielorganismen proklamiert, wenn sie gemäß den Anweisungen des Herstellers verwendet werden. Immer mehr neuere Studien haben jedoch gezeigt, dass Rückstände von Glyphosat und seinen Abbauprodukten in Böden zurückgehalten und transportiert werden können, wodurch kaskadierende Auswirkungen auf Nichtzielorganismen haben 4,5,6,7,8 . Die Wirkung von Glyphosat ist nicht nur auf Pflanzen beschränkt - der Shikimatweg ist auch in vielen Pilzen und Prokaryoten vorhanden. Glyphosat zielt auf das Enzym 5-Enolpyruvylshikimat-3-phosphat-Synthase (EPSPS) im Shikimatweg, auch bekannt als aroA9. Dieses Enzym befindet sich im Zentrum des Shikimatweges bei der Synthese der drei essentiellen aromatischen Aminosäuren (Phenylalanin, Tyrosin und Tryptophan) und ist in den meisten Prokaryoten, Pflanzen und Pilzen vorhanden10,11. Einige mikrobielle Spezies haben durch verschiedene Mechanismen, einschließlich Mutationen in den EPSPS-Sequenzen, eine teilweise oder absolute Resistenz gegen Glyphosat entwickelt. Daher wurde vorgeschlagen, dass die Verwendung von GBPs eine direkte Wirkung auf pflanzliche und tierische Mikrobiome, einschließlich des menschlichen Darmmikrobioms12,13,14, haben könnte. Dennoch kann die Verwendung von GBP negative Auswirkungen auf praktisch jede Ökosystemfunktion und -dienstleistung haben, die auf Mikroben und mikrobengestützten Prozessen beruht. Die daraus resultierenden Bedrohungen können biochemische Bodenprozesse, die Bestäubungsbiologie sowie das Wohlergehen von Tieren und Menschen betreffen. Dies erfordert ein umfassenderes Verständnis der Auswirkungen von Glyphosat auf Shikimatwege und Methoden zur Beurteilung der Empfindlichkeit von Mikroben gegenüber Glyphosat.
In diesem Protokoll stellen wir eine Pipeline vor, um die Wirkung von Glyphosat und GBP auf das Mikrobiom zu testen, von Feldexperimenten bis hin zu bioinformatischen Analysen. Wir beschreiben detailliert eine kürzlich veröffentlichte bioinformatische Methode, mit der die potenzielle Empfindlichkeit von Organismen gegenüber Glyphosat12 bestimmt werden kann. Nach Kenntnis der Forscher ist dies das erste und bisher einzige bioinformatische Instrument, um die intrinsische Empfindlichkeit des Enzyms EPSPS gegenüber der aktiven Komponente von GBPs zu bewerten. Diese bioinformatische Methode basiert auf dem Nachweis bekannter Aminosäuremarker im Glyphosat-Zielenzym (EPSPS)12. Die Pipeline ist in fünf Hauptarbeitsphasen unterteilt (Abbildung 1): 1) eine kurze Einführung in zwei Feldexperimente, um die Wirkung von GBPs zu testen, 2) eine kurze Zusammenfassung von Mikrobiomanalysen (16S rRNA, ITS und EPSPS-Gen), 3) Sammeln von EPSPS-Sequenzen aus öffentlichen Repositorien, 4) Bestimmung der potenziellen Empfindlichkeit von Organismen gegenüber Glyphosat und 5) Bewertung der EPSPS-Klasse aus universellen mikrobiellen Markern (16S rRNA und ITS ).
Protokoll
1. Zwei Feldexperimente, um die Wirkung von GBPs zu testen
HINWEIS: Dieses Protokoll präsentiert zwei Beispiele für experimentelle Felddesigns, um die Wirkung von GBPs auf pflanzenassoziierte Mikroben zu testen. Beide Experimente wurden in stillgelegten Feldern ohne vorherige Vorgeschichte von Herbiziden oder landwirtschaftlichen Anwendungen am Botanischen Garten der Universität Turku Ruissalo in Finnland (60º26'N, 22º10'E) durchgeführt. Der Boden besteht aus sandigem Ton mit einem hohen Anteil an organischer Substanz.
- Versuch 1
HINWEIS: Dieses Experiment wurde entwickelt, um die allgemeinen landwirtschaftlichen Praktiken der Direktsaatlandwirtschaft mit GBP-Anwendungen vor und nach der Vegetationsperiode zur Bekämpfung von Unkräutern zu simulieren.- Teilen Sie das Versuchsfeld in 10 replizierte Kontroll- und GBP-Behandlungsflächen (23 m x 1,5 m) mit Pufferstreifen der Vegetation zwischen den Parzellen auf (in dieser Studie im Frühjahr 201415) (Abbildung 2).
- Stellen Sie sicher, dass die Parzellen mit einer Drehfräse bis zu einer Tiefe von 5 cm bearbeitet und zweimal im Jahr behandelt werden. Hier wurden die Parzellen zu Beginn (Mai) und am Ende (Oktober) der Vegetationsperiode behandelt.
- Behandlung der Kontrollparzellen mit Leitungswasser (5 l/Grundstück) und der GBP-Parzellen mit kommerziellem GBP (Glyphosatkonzentration 450 g· L-1, Aufwandmenge 6,4 l·ha-1 in 5 l Leitungswasser pro Parzelle), um die maximal zulässige Glyphosatdosierung in landwirtschaftlichen Praktiken (3 kg·ha-1) nachzuahmen.
- Wenden Sie die Behandlungen mit einem handbetriebenen Drucktank an, der über ein manuelles Sprühgerät verfügt. Zwei Wochen nach dem GBP-Antrag säen Hafer (Avena sativa), Ackerbohnen (Vicia faba), Rübenraps (Brassica rapa subsp. oleifera) und Pflanzenkartoffeln (Solanum tuberosum) in den Parzellen nach landwirtschaftlichen Gepflogenheiten.
- Während der Vegetationsperiode die Parzellen von Hand unkraut jäten, um die Pflanzenkonkurrenz und die Bodenstruktur in den Kontroll- und GBP-behandelten Parzellen so ähnlich wie möglich zu halten.
- Probieren Sie die Mikrobiota aus Versuchspflanzen. In dieser Studie wurden die Mikrobiota von 2017 bis 2020 sowohl in den GBP-behandelten als auch in den Kontrollbehandlungsflächen einmal pro Vegetationsperiode im Laufe der Studie nacheinander beprobt.
- Sammeln Sie zehn Nachbildungen der Pflanzenproben (Wurzel und Blatt) vom Feld, legen Sie sie sofort auf Eis und bringen Sie sie zur weiteren Verarbeitung ins Labor, wie in Abschnitt 2.1 beschrieben.
- Versuch 2
HINWEIS: Dieses Experiment wurde entwickelt, um Risiken im Zusammenhang mit der zirkulären Lebensmittelwirtschaft zu testen. Genauer gesagt wurde es entwickelt, um die Folgen von GBP-Rückständen in Gülle zu untersuchen, die als Dünger auf Kulturpflanzen ausgebracht wird 2 (Abbildung 3).- Sammeln Sie Bettwäsche, einschließlich Holzspäne, Kot und etwas verschüttetes Futter, von Wachteln, die mit GBP-kontaminierten oder Kontrollfutter in einem 12-monatigen Volierenexperimentgefüttert wurden 16,17.
HINWEIS: Das GBP-kontaminierte Futter bestand aus Bio-Futter für Legehennen in Kombination mit einem Äquivalent von 160 mg Glyphosat/kg, was einer täglichen Aufnahme von 12-20 mg Glyphosat pro Kilogramm Körpermasse bei erwachsenen japanischen Wachteln16,17 entspricht. - Zur Validierung senden Sie die Proben an ein akkreditiertes Labor für Glyphosat-Konzentrationsmessungen in sechs Chargen von Futtermitteln.
- Messen Sie außerdem die Glyphosatrückstände in Wachtelausscheidungsproben nach 12 Monaten Exposition. Die Kontrollgruppe wurde mit dem gleichen Bio-Futter ohne GBP-Zusatz16,17 gefüttert.
- Wechseln Sie während des Volierenexperiments die Bettwäsche alle zwei Wochen. Sammeln Sie die gebrauchte Einstreu regelmäßig von 8-12 Monaten Exposition aus GBP-Behandlung und -Kontrollen, Pool pro Behandlung und lagern Sie in geschlossenen Behältern in einem trockenen, dunklen Lagerraum bei 6 ° C, bevor Sie als Dünger verwendet werden.
- Verteilen Sie 12 L der Einstreu manuell auf jedem der 18 GBP und 18 Kontrollflächen (Größe 1 m x 1 m) in einem 6 x 6 Schachbrettgitter im Versuchsfeld an zwei Zeitpunkten. In dieser Studie wurden die Bettwäsche im August 2018 und im Mai 2019 verteilt.
- Senden Sie die Einstreuproben direkt nach der Ausbreitung (in dieser Studie im Mai 2019) an ein akkreditiertes Labor für die Glyphosat-Konzentrationsmessungen.
- Pflanzen Sie mehrjährige Gras- und Erdbeerpflanzen in jeder Parzelle, um ihre Wurzel- und Blattmikrobiota zu untersuchen.
HINWEIS: In dieser Studie wurden vier mehrjährige Graspflanzen (Festuca pratensis) und zwei Erdbeerpflanzen (Fragaria x vescana) auf jeder Parzelle gepflanzt und auf ihre Wurzel- und Blattmikrobiota untersucht.
- Sammeln Sie Bettwäsche, einschließlich Holzspäne, Kot und etwas verschüttetes Futter, von Wachteln, die mit GBP-kontaminierten oder Kontrollfutter in einem 12-monatigen Volierenexperimentgefüttert wurden 16,17.
2. Mikrobiom-Analysen (16S rRNA-, ITS- und EPSPS-Gen)
HINWEIS: Die meisten Mikrobiomstudien basieren auf der Analyse des 16S rRNA-Gens für bakterielle und interne transkribierte Spacer-Regionen (ITS) für Pilzgemeinschaften unter Verwendung von Sequenzierungstechnologien der nächsten Generation. Daher enthält das Papier keine Informationen über die Art des EPSPS. EPSPS-Sequenzen von Tausenden von Arten sind in öffentlichen Datenspeichern verfügbar (Protokollabschnitt 3) (Abbildung 4).
- 16S rRNA-Gen
- Identifizieren Sie aus den abgelösten Blatt- und Wurzelproben, die in den oben beschriebenen Experimenten gesammelt wurden, die endophytischen Mikroben (dh Mikroben, die in Pflanzengeweben leben).
- Waschen Sie die Pflanzenproben mit Leitungswasser und sterilisieren Sie sie dann, um die epiphytischen Mikroben (dh Mikroben auf der Oberfläche von Pflanzengeweben) zu entfernen. Sterilisieren Sie mit 3% Bleichmittel für 3 min, gefolgt von einer 70% igen Ethanollösung für 1 min und waschen Sie dreimal mit autoklaviertem Reinstwasser für jeweils 1 Minute.
- Die Proben werden bei -80 °C eingefroren, bis die genomische DNA-Extraktion erfolgt.
- Führen Sie eine genomische DNA-Extraktion mit einem kommerziell erhältlichen pflanzlichen DNA-Extraktionskit gemäß dem Protokoll des Herstellers durch.
- Zielen Sie auf die variablen Regionen V6-V8 des 16S rRNA-Gens aus extrahierten DNA-Proben ab, indem Sie einen verschachtelten Ansatz mit unterscheidenden Primern verwenden, die spezifisch an bakterielle DNA18 binden und so die Amplifikation von Wirtspflanzen-DNA minimieren.
- Nach drei Runden Polymerase-Kettenreaktion (PCR) markieren Sie das Zielgen mit Barcode- und Adaptersequenzen, um es als Vorlage für die Sequenzierung vorzubereiten. Befolgen Sie die Schritte 2.1.7- 2.1.11 für die PCR-Amplifikation
- Bereiten Sie die PCR-Mastermischung für die erforderliche Anzahl von Proben so vor, dass jede Reaktion ein Gesamtvolumen von 30 μLof hat und aus 30 ng DNA, 1x PCR-Puffer, 0,2 mM dNTPs, 0,3 μM jedes Primers und 2000 U / ml DNA-Polymerase besteht. Befolgen Sie den gleichen Schritt für die zweite und dritte Runde der PCR.
- Für die erste Runde der PCR verwenden Sie die Primer 799F19 und 1492R (modifiziert von20) (Tabelle 1). Richten Sie das Verstärkungsprofil auf dem Thermocycler ein (3-minütige anfängliche Denaturierung bei 95 °C, gefolgt von 35 Zyklen Denaturierung bei 95 °C für 45 s, Glühen bei 54 °C für 45 s und Verlängerung bei 72 °C für 1 min). Führen Sie die letzte Verlängerung bei 72 °C für 5 min durch.
- Überprüfen Sie als Vorlage für die zweite Runde der PCR die Amplifikation durch Elektrophorese (5 μL der PCR-Produkte auf 1,5% Agarosegel) und verdünnen Sie dann die restlichen 25 μL des PCR-Produkts in autoklaviertem Reinstwasser im Verhältnis 1:10.
- Wiederholen Sie die PCR mit den verdünnten PCR-Schablonen und Grundierungen uni-1062F21 und uni-1390R22 (Tabelle 1). Die gleichen PCR-Reaktionsbedingungen und das gleiche Amplifikationsprofil (Schritt 2.1.8) beibehalten werden, außer die Anzahl der Zyklen auf 25 zu reduzieren.
- Verdünnen Sie die resultierenden PCR-Produkte in autoklaviertem Reinstwasser im Verhältnis 1:1. Führen Sie die dritte Runde der PCR durch, um die Produkte mit den Barcodes und der P1-Adaptersequenz mit 8 Zyklen des gleichen PCR-Profils wie in Schritt 2.1.8 erwähnt zu kennzeichnen.
- Bibliotheksvorbereitung
- Überprüfen Sie die Konzentration und Qualität von PCR-Produkten auf einem Bioanalysator und bündeln Sie die Volumina, die 30 ng DNA jeder Probe ausmachen, in einem 1,5-ml-Röhrchen, um eine äquimolare Bibliothek vorzubereiten.
- Wählen Sie die Amplikone der Größe 350-550 bp durch Größenfraktionierung mit einem automatisierten DNA-Größenauswahlsystem auf einer Agarosegelkassette. Beachten Sie, dass dadurch auch unspezifische Amplikone und PCR-Reagenzien aus der Bibliothek entfernt werden. Sammeln Sie die Elute, bestehend aus Amplikonen der angegebenen Größe, in einem Fläschchen in der Kassette, was zu einer gereinigten 16S rRNA-Genbibliothek führt.
- Pipette die Elute in ein 1,5-ml-Röhrchen und überprüfen Sie die Reinheit und Konzentration auf dem Bioanalysator. Verdünnen Sie die DNA-Bibliothek mit autoklaviertem Reinstwasser auf eine Endkonzentration von 26 pM; Die Probe ist bereit für die Sequenzierung.
- SEIN
HINWEIS: Die ITS-Region wird mit ITS-spezifischen Primern verstärkt (Tabelle 1), und das resultierende PCR-Produkt wird mit Barcodes und einer P1-Adaptersequenz für die Sequenzierung gekennzeichnet.- Bereiten Sie den PCR-Master-Mix nach dem gleichen Protokoll wie in Abschnitt 2.1 mit ITS-Primern vor.
- Stellen Sie das Verstärkungsprofil auf dem Thermocycler als 5-minütige anfängliche Denaturierung bei 95 °C ein, gefolgt von 35 Zyklen Denaturierung, Glühen und Verlängerung bei 95 °C für 30 s, 55 °C für 30 s, 72 °C für 1 min und Endverlängerung 72 °C für 7 min.
- Analysieren Sie 5 μL des PCR-Produkts auf 1,5 % Agarosegel und verdünnen Sie die restlichen 25 μL mit autoklaviertem Reinstwasser auf 1:10. Verwenden Sie das verdünnte PCR-Produkt als Vorlage für die zweite Runde der PCR.
- Bereiten Sie den PCR-Master-Mix für die erforderliche Anzahl von Proben vor (siehe Schritt 2.1.6) mit Barcode-getaggten Vorwärtsprimern und P1-Adapter-getaggten Reverse-Primern. Verstärken Sie mit dem gleichen Verstärkungsprofil wie in Schritt 2.3.2, außer mit 8 Zyklen.
- Bereiten Sie die resultierenden PCR-Produkte für die Sequenzierung gemäß den in Abschnitt 2.2 genannten Protokollen vor.
- EPSPS-Gen
- Sequenzieren und analysieren Sie die EPSPS-Gene der Mikroben.
HINWEIS: Um herauszufinden, ob die GBP-Exposition die Zusammensetzung von Glyphosat-empfindlichen und resistenten Mikroben in der Gemeinschaft verändert hat, müssen die EPSPS-Gene der Mikroben sequenziert und analysiert werden. So wurden 353 Sequenzen von EPSPS-Genen aus einer breiten Sammlung mikrobieller Taxa in der Datenbank Alignable Tight Genomic Clusters (ATGC) gesammelt und alle Proteinsequenzen ausgerichtet22. Diese Alignments sind in derATGC-Datenbank 23 verfügbar und können verwendet werden, um Primer aus konservierten Regionen zu generieren. Ein einfach zu bedienendes Bioinformatik-Tool wurde entwickelt, um konservierte Regionen aus einer multiplen Sequenzausrichtung zu identifizieren, und dies ist auf Pere Puigbo Forschungsseite24 verfügbar. Es würde jedoch den Rahmen dieser Veröffentlichung sprengen, eine detaillierte Beschreibung dieses Webservers bereitzustellen. Nichtsdestotrotz ist ein prospektives Protokoll zur Verwendung dieser Primer zur Amplifikation des EPSPS-Gens enthalten, um die Empfindlichkeit des Mikrobioms gegenüber Glyphosat in Abbildung 4 zu finden.
- Sequenzieren und analysieren Sie die EPSPS-Gene der Mikroben.
3. Sammeln von EPSPS-Proteinsequenzen aus öffentlichen Repositorien
- EPSPS-Sequenzen zur Verwendung in Makroevolutionsstudien
- Sammlung von EPSPS-Proteinen aus öffentlichen Repositorien wie PFAM23 (eine Datenbank der Proteinfamilien 25), GenBank 24 (eine Datenbank von Genen, Genomen und Proteinen26), COG 25 (Cluster orthologer Gruppen 27; eine Datenbank orthologer Proteine aus Archaeen und Bakterien); und PDB26 (Protein Data Bank28; eine Datenbank von Proteinstrukturen).
HINWEIS: Eine kürzlich von den Forschern durchgeführte Studie zeigte, dass diese Proteine verwendet werden können, um mikroevolutionäre und vergleichende Analysen der möglichen Wirkung von Glyphosat auf Organismen mit dem Shikimatweg12 durchzuführen. Die Autoren haben eine benutzerfreundliche Website entwickelt, die Informationen zu Zehntausenden von EPSPS-Proteinsequenzensammelt 29, einschließlich eines manuell kuratierten Datensatzes von Proteinen aus dem menschlichen Darmmikrobiom12. Die Informationen in diesen vorberechneten Datensätzen umfassen die aktuelle EPSPS-Klassifizierung in mutmaßlich empfindlich und glyphosatresistent, taxonomische Informationen zu Arten, Anmerkungen des EPSPS-Aktivzentrums und Links zu PDB- und NCBI-Datenbanken. Darüber hinaus enthält der Webserver die ID-Codes des EPSPS und Links zu mehreren externen Datenbanken (Tabelle 2).
- Sammlung von EPSPS-Proteinen aus öffentlichen Repositorien wie PFAM23 (eine Datenbank der Proteinfamilien 25), GenBank 24 (eine Datenbank von Genen, Genomen und Proteinen26), COG 25 (Cluster orthologer Gruppen 27; eine Datenbank orthologer Proteine aus Archaeen und Bakterien); und PDB26 (Protein Data Bank28; eine Datenbank von Proteinstrukturen).
- EPSPS-Sequenzen zur Verwendung in Mikroevolutionsstudien ATGC
HINWEIS: Allgemeine Repositorien von Proteinsequenzen sind nützlich für die Durchführung von Vergleichsstudien bei relativ weit entfernten Organismen; Die mögliche Wirkung von Glyphosat ist jedoch aus evolutionärer Sicht relativ neu. Daher ist es in einigen Studien notwendig, eng verwandte Spezies (z. B. verschiedene Stämme derselben Bakterienart) zu vergleichen, um die Wirkung von Glyphosat14 zu bestimmen. In diesen Fällen ist die Datenbank der Alignable Tight Genomic Clusters (ATGC)30, die eine umfassende Liste eng verwandter archaealer und bakterieller Genome enthält, eine geeignetere Ressource. Die ATGC-Datenbank enthält Informationen über mehrere Millionen Proteine aus Tausenden von Genomen, die in Hunderten von Clustern organisiertsind 30. Jeder Genomcluster ist ausrichtbar (Genome teilen Syntenie über ≥85% ihrer Längen) und eng (mit einer synonymen Substitutionsrate unterhalb der Sättigung). Die Forscher verwendeten den ATGC-Datensatz in einer aktuellen Studie, um mikroevolutionäre Veränderungen in EPSPS-Proteinenzu analysieren 14. Die folgenden Schritte sind erforderlich, um die EPSPS-Proteinsequenz im ATGC zu identifizieren:- Laden Sie die gesamte Datenbank der ATGCs vom Link31 und alle Proteine des COG0128 (Code, der den EPSPS-Proteinen in der Datenbank entspricht)32 in ein lokales Projekt herunter.
HINWEIS: Wenn die Forscher / Experimentatoren in Finnland ansässig sind, stellt das CSC-IT Centerfor Science 33 Speicher- und Softwareeinrichtungen zur Verfügung. Es ist wichtig, alle Sequenzen im FASTA-Format zu sammeln. - Aufbau einer Blast-Datenbank des COG0128, die Orthologe des EPSPS-Proteins in einem repräsentativen Satz von Prokaryotenarten enthält. Das CSC hat das Blast-Programm34 vorinstalliert, so dass der Befehl makeblastdb -in COG0128.fa -dbtype prot verwendet werden kann, um eine Referenzdatenbank von EPSPS-Sequenzen zu erstellen.
- Ordnen Sie die ATGC-Datenbank mit dem Befehl blastp - query [ATGC_X.fa] -db [COG0128.fa] -max_target_seqs 1 -outfmt 6 -out tmpfile -evalue 1e-150 auf die COG0128.fa (EPSPS-Proteine) ab.
- Als Ergebnis erstellt es einen Datensatz von EPSPS-Proteinsequenzen in jedem. Ein vorberechneter Datensatz eng verwandter EPSPS-Proteinsequenzen aus der ATGC-Datenbank istverfügbar 29.
- Laden Sie die gesamte Datenbank der ATGCs vom Link31 und alle Proteine des COG0128 (Code, der den EPSPS-Proteinen in der Datenbank entspricht)32 in ein lokales Projekt herunter.
4. Algorithmus zur Bestimmung der potenziellen Empfindlichkeit von Organismen gegenüber Glyphosat (EPSPSClass-Webserver: Eingänge, Verarbeitung und Ausgänge)
HINWEIS: Die Forscher haben einen einfach zu bedienenden Server implementiert, der bei 29 frei verfügbar ist, um die Klasse der EPSPS-Proteinsequenzen12,35 zu bestimmen. Der Server benötigt nur eine Eingabe der Proteinsequenz im FASTA-Format, um den Identitätsprozentsatz für jede der EPSPS-Klassen und ihre potenzielle Empfindlichkeit gegenüber Glyphosat zu bestimmen. Darüber hinaus können Benutzer den Webserver nutzen, um ihre eigenen Referenzsequenzen und Aminosäuremarker zu testen. Zunächst richtet der Algorithmus (Abbildung 5) Abfragesequenzen und Referenzsequenzen mithilfe eines Mehrsequenzausrichtungsprogramms35 aus, um Aminosäurepositionen zu bestimmen. Dann sucht es nach dem Vorhandensein von Aminosäuremarkern, um die EPSPS-Klasse (I, II, III oder IV) der Abfragesequenz zu identifizieren.
- Geben Sie eine EPSPS-Proteinsequenz im FASTA-Format in das Eingabetextfeld ein, um die Klasse des Enzyms zu identifizieren (Abbildung 6A), und drücken Sie Senden.
- Bewerten Sie die potenzielle Empfindlichkeit der Abfragesequenz gegenüber Glyphosat (Abbildung 6B-E) aus den vom Server bereitgestellten Ausgaben:
Ausgabe 1: Anteil der Aminosäuremarker (d. h. Identität), die in den Abfragesequenzen (Klasse I, II und IV) vorhanden sind, und die Anzahl der Motive (Klasse III).
Ausgabe 2: Ausrichtungen der Abfrage- und Referenzsequenzen basierend auf Markerresten.
Ausgabe 3: Vollständige paarweise Ausrichtung der Abfrage- und Referenzsequenzen.
Ausgabe 4: EPSPS-Referenzsequenzen: Vibrio cholerae(vcEPSPS, Klasse I), Coxiella burnetii(cbEPSPS, Klasse II), Brevundimonas vesicularis(bvEPSPS, Klasse III), Streptomyces davawensis(sdEPSPS, Klasse IV). - Am Ende der Ausgabeseite finden Sie Links zu externen Tools wie blastp und konservierten Domänen, um die Abfrage-EPSPS-Sequenz weiter zu analysieren (Abbildung 6F).
5. Bewertung der EPSPS-Klasse anhand universeller mikrobieller Marker (16S rRNA und ITS )
HINWEIS: Die meisten Mikrobiom-Studien basieren auf der Analyse der 16S rRNA und/oder ITS36. In solchen Fällen ist es nicht möglich, eine direkte Analyse der EPSPS-Sequenz durchzuführen. Daher ist ein probabilistischer Ansatz zur Abschätzung der potenziellen Empfindlichkeit von Organismen gegenüber Glyphosat notwendig. Diese Analyse ist unkompliziert und liefert eine vernünftige Schätzung der Art der EPSPS-Sequenzen in einem Mikrobiomprojekt. Der Prozess ist in 3 Schritte unterteilt (Abbildung 7 und Abbildung 8):
- Identifizieren Sie EPSPS-Sequenzen aus öffentlichen Repositories. Die EPSPS-Klasse eines umfassenden Datensatzes repräsentativer Sequenzen wurde aus PFAM37, GenBank38, COG 39, PDB 40,ATGC 30 zusammengestellt und vorberechnet. Greifen Sie auf diese Datensätze von der Hauptseite des EPSPSClass-Servers zu, die taxonomische Informationen und die EPSPS-Klasse mit über 50.000 Sequenzen enthält (Abbildung 7).
- Messen Sie die Höhe der Versuchspflanzen zweiwöchentlich während der Vegetationsperiode und wiegen Sie die oberirdische Biomasse der Pflanzen am Ende der Feldsaison, um das Wachstum der Pflanzen in GBP und Kontrollflächen zu vergleichen.
HINWEIS: Die Mikrobiota-Analysen aus den Feldexperimenten wurden noch nicht vollständig analysiert. - Verwenden Sie eine Tabelle, um die bakteriellen OTUs (basierend auf 16S rRNA oder ITS) aus Mikrobiom-Experimenten in vorberechnete Datensätze abzubilden.
HINWEIS: Frühere Studien haben gezeigt, dass die EPSPS-Klasse (d.h. die intrinsische Empfindlichkeit gegenüber Glyphosat) innerhalb einer phylogenetischen Gruppe14 stark konserviert ist. Daher ist es relativ sicher anzunehmen, dass eng verwandte Arten aus stark konservierten Taxonen ähnliche EPSPS-Reaktionen auf Glyphosat haben können (Abbildung 8). - Berechnen Sie in derselben Tabelle die intrinsische Empfindlichkeit gegenüber Glyphosat, basierend auf einem probabilistischen Wert (S = s / (s + r + u) wobei S: Sensitivitätsfaktor; s: Anzahl der potenziell empfindlichen Sequenzen; r: Anzahl der potenziell resistenten Sequenzen; u: Anzahl der nicht klassifizierten Sequenzen), berechnet aus bekannten EPSPS-Sequenzen in öffentlichen Datenbanken.
HINWEIS: Diese Punktzahl reicht von 0 (in einem Taxon sind keine empfindlichen EPSPS-Sequenzen gefunden) bis 1 (alle Sequenzen in einem Taxon sind empfindlich gegenüber Glyphosat) (Abbildung 8). Darüber hinaus gibt es Zwischenwerte - d.h. Arten mit empfindlichen, resistenten oder unbekannten Stämmen.
Ergebnisse
Ziel dieses Protokolls ist es, eine allgemeine Pipeline von Feldexperimenten bis hin zu bioinformatischen Analysen bereitzustellen, die die potenzielle Empfindlichkeit von Organismen gegenüber dem Herbizid Glyphosat quantifiziert. In Experiment 2 betrug die durchschnittliche Glyphosatkonzentration im Wachtelfutter 164 mg/kg und die durchschnittliche Glyphosatkonzentration der Exkrementproben (Urin und Kot kombiniert) 199 mg/kg. Einstreu von Wachteln, die mit GBP-kontaminiertem Futter gefüttert wurden, hatte im Durchschnitt 158 mg/kg und Kontrolleinstreu 0,17 mg/kg Glyphosat (Tabelle 3). In den Feldversuchen reagierten Pflanzenarten unterschiedlich auf Glyphosatrückstände in den Böden (Abschnitt 1). Die Biomasse von Hafer- und Rübenraps war in Kontrollböden im Vergleich zu GBP-behandelten Böden größer. Fababohnen und Kartoffeln schienen jedoch am Ende der Vegetationsperiode15 von der GBP-Behandlung zu profitieren. Glyphosat in Geflügelmist verringerte das Pflanzenwachstum in Gras (Festuca pratensis) und Erdbeere (Fragaria x vescana) (Abschnitt 1). Die Mikrobiota-Analysen aus den Feldexperimenten sind noch nicht vollständig analysiert und werden hier nicht vorgestellt (Abschnitt 2). Die Ergebnisse dieses Protokolls liefern, wenn sie entweder direkt (wie in den Abschnitten 3 und 4 gezeigt) oder indirekt (Abschnitt 5) gelesen werden, ein Maß für den Anteil potenziell empfindlicher und resistenter Organismen an Glyphosat in einem Datensatz (Abbildung 9). Die Verwendung dieser Methode wurde mit einer Sammlung von EPSPS-Proteinsequenzen aus mikrobiellen Spezies des Kernmikrobioms des menschlichen Darmmikrobioms getestet, die aus öffentlichen Repositorien gewonnen wurden12. In der Studie wurden 890 Stämme der 101 häufigsten Bakterienarten mit der EPSPSClass-Methode analysiert, um den Anteil empfindlicher und resistenter Bakterien zu quantifizieren. Die Ergebnisse zeigten, dass 54% der Spezies im Kernmikrobiom des menschlichen Darms potenziell empfindlich auf Glyphosat12 reagieren. Dieser Trend ist auch in den meisten prokaryotischen Ländern zu beobachten; Darüber hinaus ist bei Eukaryoten (hauptsächlich Pflanzen und Pilze) der Anteil potenziell empfindlicher Arten sogarnoch höher als bei 12. Darüber hinaus haben wir diese Methode verwendet, um Veränderungen der Empfindlichkeit im EPSPS-Protein auf mikroevolutionärer Ebene zu quantifizieren (Abbildung 10) 14. Wir identifizierten Veränderungen des Sensitivitätsstatus in 12 von 32 eng verwandten Gruppen von analysierten Prokaryoten (Tabelle 4)14. Daher kann die kontinuierliche Verwendung der GBPs zu mikrobieller Dysbiose (dh einem Ungleichgewicht empfindlicher und resistenter Bakterienarten) in Pflanzen-, Tier- und Bodenmikrobiomen führen. Darüber hinaus wurde die Hypothese aufgestellt, dass eine Zunahme von Glyphosat-resistenten Bakterien multiresistente Mikrobiome fördern kann 14,41,42. Somit gibt dieses Protokoll Aufschluss über die Interpretation all dieser Szenarien, da die EPSPS-Klassifikationsmethode eine direkte Abschätzung der intrinsischen Empfindlichkeit von Mikrobiomen gegenüber Glyphosat liefert. Da die intrinsische Empfindlichkeit des EPSPS-Proteins gegen Glyphosat phylogenetisch konserviert ist14, ist es möglich, die Ergebnisse aus bestehenden Datensätzen in unbekannte Mikrobiome zu extrapolieren (Abbildung 8).
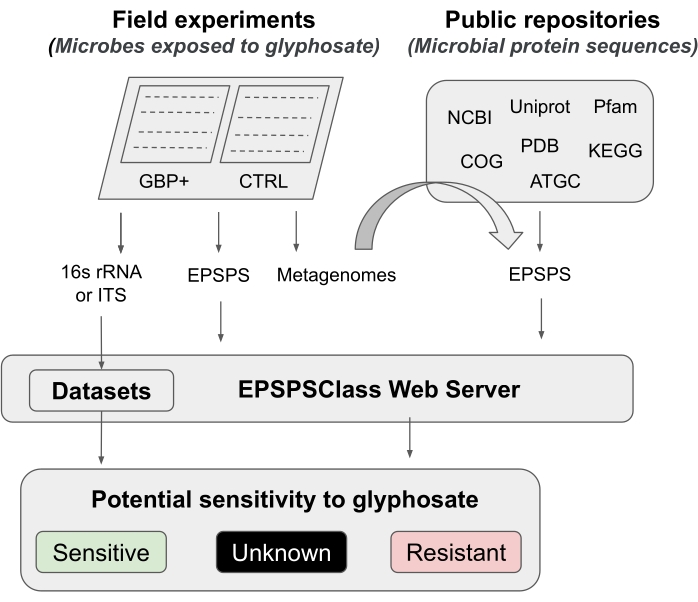
Abbildung 1: Allgemeine Pipeline Dies ist eine allgemeine Pipeline zur Analyse der GBP-Empfindlichkeit von Feldexperimenten bis hin zur bioinformatischen Analyse. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
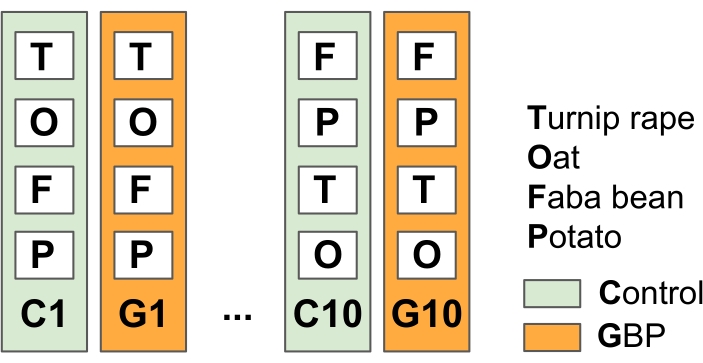
Abbildung 2: Feldversuch 1 zur Prüfung der Auswirkungen von GBP-Rückständen auf pflanzenassoziierte Mikroben. Das Versuchsfeld besteht aus abwechselnd 10 Kontrollparzellen und 10 GBP-Behandlungsflächen (23 m x 1,5 m) mit 1,5 m Pufferstreifen zwischen den Parzellen. Seit 2014 wurden die GBP-Parzellen zweimal jährlich mit kommerziellem GBP (Glyphosatkonzentration 450 g L-1, Aufwandmenge 6,4 L ha-1 in 5 L Leitungswasser pro Parzelle) und die Kontrollflächen mit der gleichen Menge Leitungswasser ohne Glyphosat behandelt. Die Behandlungen wurden mit einem handbetriebenen Drucktank unter Verwendung einer Kunststoffhaube in der Sprinklerspitze durchgeführt, um GBPs vor der Ausbreitung außerhalb der Behandlungsflächen zu schützen. Nach einer zweiwöchigen Sicherheitsphase nach dem GBP-Antrag wurden Hafer (Avena sativa), Fababohnen (Vicia faba) und Rübenraps (Brassica rapa subsp. oleifera) ausgesät und Kartoffeln (Solanum tuberosum) auf den Parzellen gepflanzt. Mikrobiota-Proben aus den untersuchten Kulturpflanzen, Blättern und Wurzeln wurden seit Beginn des Experiments im Jahr 2014 mehrfach entnommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
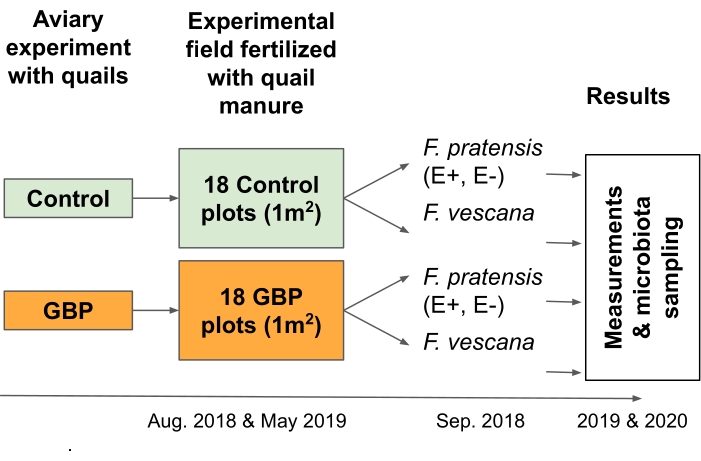
Abbildung 3: Feldversuch 2 testete die Folgen von GBP-Rückständen in Gülledünger für zwei mehrjährige Kulturen und die damit verbundenen Mikrobiota. Bettwäsche, die aus einem 12-monatigen Volierenexperiment mit japanischen Wachteln gesammelt wurde, die mit Kontroll- oder GBP-kontaminiertem Futter gefüttert wurden, wurden in einem Feldexperiment als Dünger verwendet. Das Versuchsfeld bestand aus 18 Kontroll- und 18 GBP-Plots (1 m x 1 m), die in einem 6 x 6 Schachbrettraster angeordnet waren. Die Bettwäsche wurde zweimal auf dem Versuchsfeld ausgebreitet, im August 2018 und Mai 2019 (25 L / Grundstück). Die Kontrollflächen wurden mit Einstreu gedüngt, das von Wachteln gesammelt wurde, die mit Kontrollfutter gefüttert wurden, und GBP-Parzellen mit Einstreu von Wachteln, die mit GBP-kontaminiertem Futter gefüttert wurden. Die Glyphosatrückstände in Kontrolleinstreu betrugen 0,17 mg/kg Glyphosat und in GBP-Einstreu betrug die Menge 158 mg/kg Glyphosat. Zwei endophytensymbiotische (E+), zwei endophytenfreie (E-) Festuca pratensis und zwei Fragaria x vescana wurden im September 2018, etwa einen Monat nach der Ausbreitung der ersten Einstreu, pro Parzelle gepflanzt. Messungen der Pflanzenleistung und -fitness sowie Probenahmen für wurzel- und blattassoziierte Mikrobiota wurden während zweier aufeinanderfolgender Vegetationsperioden (2019 & 2020) durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
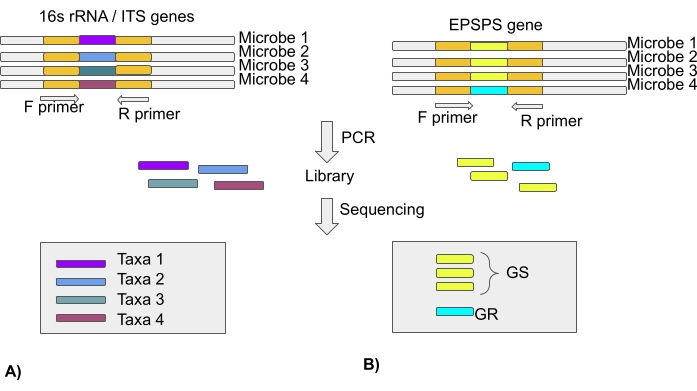
Abbildung 4: Analyse der mikrobiellen Taxa mittels 16S rRNA-Gen/ITS-Region und Empfindlichkeit von Mikrobiomen gegenüber Glyphosat unter Verwendung des EPSPS-Gens. (A) Analyse von 16S rRNA- oder ITS-Sequenzen zur Identifizierung mikrobieller Taxa. (B) Analyse von EPSPS-Sequenzen zur Identifizierung der Empfindlichkeit von Mikroben gegenüber Glyphosat (GS-Glyphosat-sensitiv/GR-glyphosat-resistent) Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
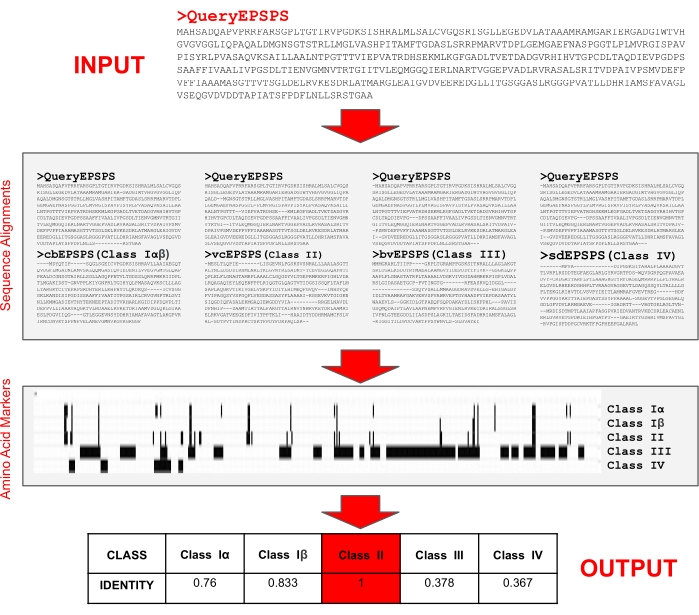
Abbildung 5: Algorithmus zur Identifizierung der Klasse von EPSPS-Proteinsequenzen. Der Input ist eine EPSPS-Proteinsequenz im FASTA-Format. Der Algorithmus führt Vergleiche mit bekannten Aminosäuremarkern in Referenzproteinsequenzen durch, die die potenzielle Empfindlichkeit gegenüber Glyphosat bestimmen. Der Algorithmus wurde auf dem frei zugänglichen Webserver EPSPSClass29 implementiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 6: Grundlegende Ein- und Ausgänge des EPSPSClass-Webservers. (A) Input: eine EPSPS-Proteinsequenz im FASTA-Format. (B) Ausgabe 1 - Identität: Anteil der Aminosäuremarker, die in den Abfragesequenzen (Klassen I-IV) und Motiven (Klasse III) vorhanden sind. (C) Ausgabe 2 - Identität: Ausrichtung der Abfrage- und Referenzsequenzen. (D) Ausgabe 3 - paarweise Ausrichtung der Abfrage- und Referenzsequenzen. (E) EPSPS-Referenzsequenzen: Vibrio cholerae (vcEPSPS, Klasse I), Coxiella burnetii (cbEPSPS, Klasse II), Brevundimonas vesicularis (bvEPSPS , Klasse III), Streptomyces davawensis (sdEPSPS, Klasse IV). (F) Links zur Durchführung von zusätzlichen Blasp-Suchen und Identifizierung von konservierten Domains Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
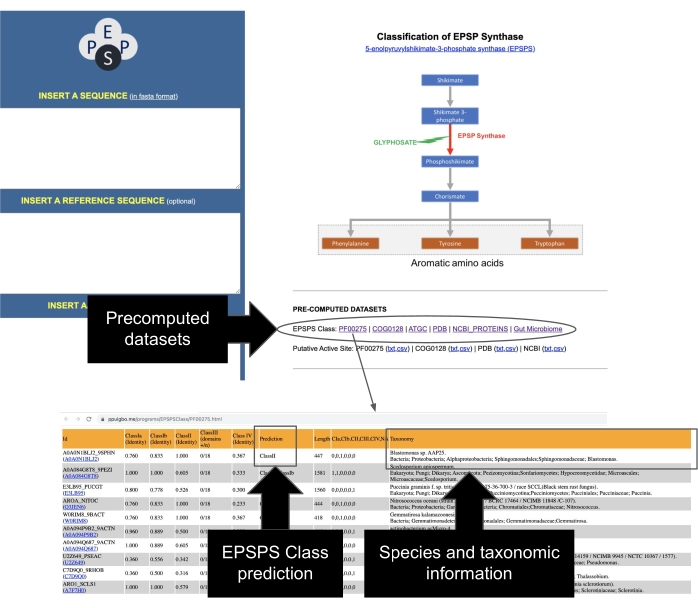
Abbildung 7: Zugriff auf vorberechnete Datensätze von EPSPS-Sequenzen. Befolgen Sie die Anweisungen in der Abbildung, um auf das vorberechnete Dataset der EPSPS-Sequenzen zuzugreifen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
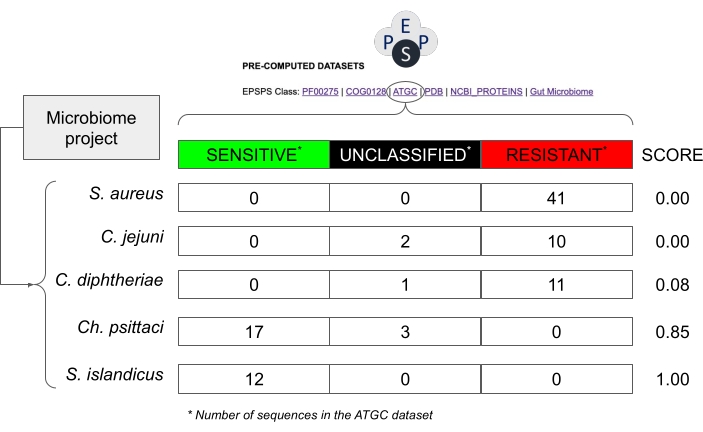
Abbildung 8: Beispiel für die Abschätzung der potenziellen Sensitivität in Mikrobiomprojekten ohne EPSPS-Sequenzen. Das Beispiel verwendet Werte aus der Datenbank von Alignable Tight Genomic Clusters30, die Sequenzen von prokaryotischen Spezies enthält. Hypothetische Spezies aus einem Mikrobiom-Projekt sind Staphylococcus aureus, Corynebacterium diphtheriae, Campylobacter jejuni, Chlamydia psittaci und Sulfolobus islandicus. Der Sensitivitätswert für Glyphosat wird als Number_Sensitive_Sequences/Total_Number_Of_Sequences berechnet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
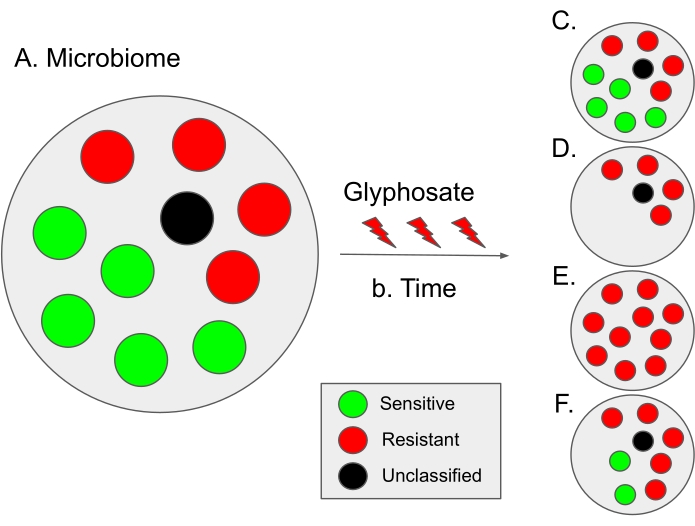
Abbildung 9: Schema der Interpretation der Ergebnisse aus diesem Protokoll und hypothetische Evolutionsszenarien. (A) In einem Mikrobiom beträgt der Anteil potenzieller Empfindlichkeits- (in grün) und Resistenzbakterien (in rot) etwa 50:50. Schwarze Punkte kennzeichnen mikrobielle Arten, die nicht klassifiziert sind; Daher ist ihre Empfindlichkeit gegenüber Glyphosat unbekannt. In einigen Mikrobiomen ist der Anteil empfindlicher Bakterien etwas höher, wie im menschlichen Darmmikrobiom12. (B) Im Laufe der Zeit kann die Verwendung von Glyphosat zu mikrobieller Dysbiose (d. h. einem Ungleichgewicht im Anteil empfindlicher und resistenter Bakterien) führen, die zu verschiedenen hypothetischen Szenarien führt. (C) Hypothetischer Fall 1 (keine Auswahl): Die Verwendung von Glyphosat hat keinen Einfluss auf das Mikrobiom; So bleibt der Anteil empfindlicher und resistenter Bakterien konstant. (D) Hypothetischer Fall 2: Die Verwendung von Glyphosat entfernt Glyphosat-empfindliche Bakterien aus der Population. Wir spekulieren, dass dieses Szenario dosisabhängig sein könnte. (E) Hypothetischer Fall 3: Selektionsdruck durch die Verwendung von Glyphosat verstärkt Mutationen im EPSPS-Gen, die den Empfindlichkeitsstatus von Bakterien verändern. So wird die gesamte mikrobielle Population resistent gegen Glyphosat. Darüber hinaus könnte es in diesem Szenario zu einer Zunahme multiresistenter Bakterien kommen. (F) Hypothetischer Fall 4: Die Verwendung von Glyphosat verändert die Zusammensetzung bestimmter Bakterienarten und erzeugt ein Ungleichgewicht gegenüber resistenten Bakterien, während einige Bakterienarten unverändert bleiben, möglicherweise aufgrund zusätzlicher resistenter Mechanismen wie Austrittspumpen oder durch Überexpression des EPSPS-Gens 13. Dieses Szenario kann auch zu einer Zunahme von Glyphosat-resistenten Bakterien sowie zu einer Zunahme der bakteriellen Resistenz gegen zusätzliche Antibiotika führen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
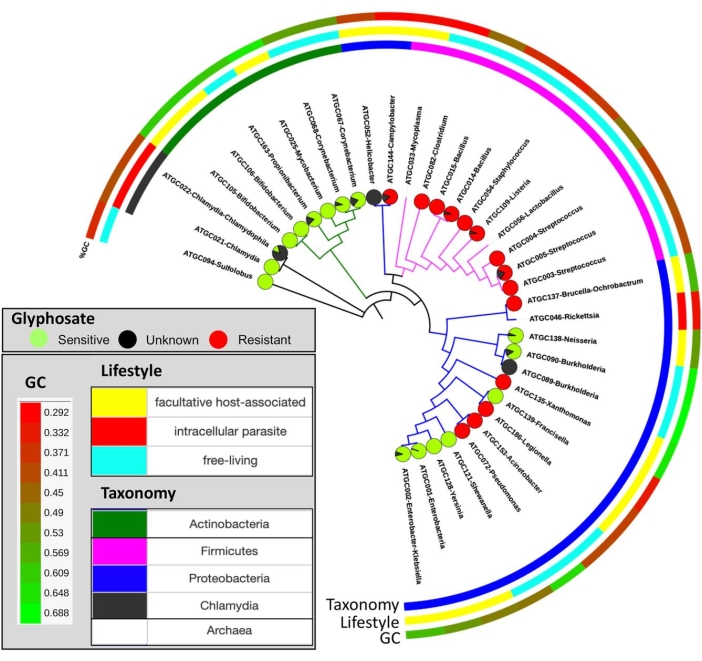
Abbildung 10: Verteilung der vorhergesagten Empfindlichkeit gegenüber Glyphosat im Artenbaum. Kreisdiagramme geben den Anteil der Arten an, die mutmaßlich empfindlich (grün) oder resistent (rot) gegen Glyphosat und nicht klassifiziert (schwarz) sind. Diese Figur wurde mit Genehmigung von Rainio et al.14 angepasst. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
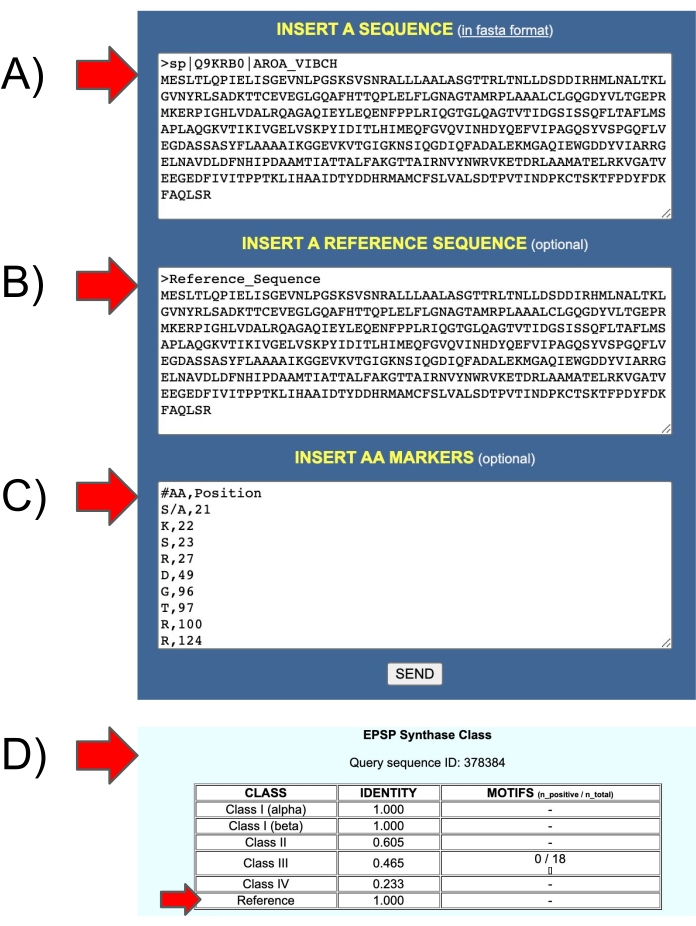
Abbildung 11: Ein- und Ausgänge des EPSPSClass-Webservers zum Testen der benutzereigenen Referenzsequenz. (A) Eingabe 1: Abfragesequenz. (B) Eingang 2: Referenzsequenz. (C) Eingabe 3: Aminosäuremarker in den Referenzsequenzen. (D) Ausgabe: Identität: Anteil der Aminosäuremarker in den Abfragesequenzen (Klasse I-IV und benutzereigene Referenzsequenzen). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Tabelle 1: Liste der Primer für die PCR-Amplifikation des 16S-rRNA-Gens und der ITS-Region in der Mikrobiom-Analyse Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Codes des Enzyms 5-Enolpyruvylshikimat-3-phosphat-Synthase (EPSPS) in verschiedenen Datenbanken Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 3: Durchschnittliche Glyphosatkonzentration Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 4: Zusammenfassende Tabelle des Prozentsatzes der Glyphosatempfindlichen/-resistenten Spezies. Diese Tabelle wurde mit Genehmigung von Rainio et al.14 angepasst. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 5: Positionen der Aminosäuremarker in den Referenzsequenzen Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Dieses Protokoll enthält allgemeine Anleitungen zur Quantifizierung der Wirkung von GBP auf Mikrobiome auf der Grundlage der Analyse des EPSPS-Proteins. Das Protokoll hat drei wichtige kritische Schritte: (i) Quantifizierung des EPSPS-Proteins aus Mikrobiomdaten. Dieser Schritt ist entscheidend, da EPSPS das direkte Zielenzym des Herbizids ist. Daher können Arten, die eine Kopie des EPSPS-Gens haben, durch die Verwendung von GBP beeinflusst werden. Dennoch können auch Arten, denen eine Kopie des EPSPS-Gens fehlt, durch alternative Nichtzielmechanismen von dem Herbizid beeinflusst werden43,44. (ii) Wenn die Analyse des EPSPS-Gens nicht in das Design der Studie einbezogen wird, ist es möglich, eine gute Schätzung zu erhalten, indem die 16S rRNA (Bakterien) oder ITS (Pilze) analysiert werden. In diesem Fall ist es wichtig, sich auf eine umfassende Referenztabelle zu verlassen (z. B. liefert die ATGC-Datenbank Sequenzen des EPSPS-Proteins von mehreren eng verwandten Spezies). (iii) Das EPSPS-Protein wird in Abhängigkeit von bestimmten Aminosäureresten des aktiven Zentrums des EPSPS in potentiell empfindliche oder glyphosatresistente unterteilt. Mutationen, die eine einzelne Aminosäure betreffen, können diese Klassifizierungjedoch verändern 45 und Übergänge zwischen Klassen können in relativ kurzer Zeit auftreten14.
Die potenzielle Empfindlichkeit von Organismen gegenüber Glyphosat kann durch Referenzgenome, Aminosäuremarker und Sequenzausrichtungen bestimmt werden. (i) Referenzgenome: Das EPSPS-Enzym kann als potentiell empfindlich (Klasse I [alpha oder beta]46,47) oder resistent (Klassen II48,49, III50 und IV 51) gegen Glyphosat eingestuft werden, basierend auf dem Vorhandensein von Aminosäuremarkern und -motiven (im Falle der Klasse III). Diese Aminosäuremarker und -motive basieren auf der Lage von Aminosäureresten im EPSPS-Protein von Vibrio cholerae (vcEPSPS, Klasse I), Coxiella burnetii (cbEPSPS, Klasse II), Brevundimonas vesicularis (bvEPSPS, Klasse III) und Streptomyces davawensis (sdEPSPS, Klasse IV). (ii) Aminosäuremarker: Glyphosat interagiert mit dem EPSPS-Enzym und konkurriert mit Phosphoenolpyruvat (PEP, dem zweiten Substrat des EPSPS-Enzyms)52,53. Bei bestimmten Spezies sorgen kleine Aminosäureveränderungen in der EPSPS-Sequenz für eine höhere Affinität für das PEP und eine Resistenz gegen Glyphosat 12,14,52,54,55. In anderen Sequenzen bindet Glyphosat die EPSPS-Sequenz in einer nicht-inhibitorischen Konformation 45. Obwohl viele resistente 12,14,48,49,52,54,55 und tolerante 56,57 EPSP-Sequenzen gegen Glyphosat beschrieben wurden, ist das derzeitige Klassifizierungssystem für das EPSPS in vier Hauptklassen (I-IV)12 unterteilt (Tabelle 5 ). (iii) Sequenzausrichtungen: Um ein EPSPS-Enzym zu klassifizieren, führten wir paarweise Ausrichtungen mit einem Mehrsequenzausrichtungsprogramm-Standardparameter35- der Abfragesequenz für jede der Referenzsequenzen (vcEPSPS, cbEPSPS, bvEPSPS und sdEPSPS) durch. Diese Ausrichtungen sind notwendig, um die Positionen der Aminosäuremarker in der Abfragesequenz zu identifizieren. Als Ergebnis wird ein Enzym wie beschrieben12-Klasse I, II und/oder IV klassifiziert, basierend auf dem Vorhandensein von Aminosäuremarkern und Motivmarkern basierend auf Klasse III.
Das Protokoll basiert auf vier bekannten Arten von EPSPS: Ein Typ ist empfindlich, der andere drei ist resistent). Etwa 10 % der EPSPS-Sequenzen in Prokaryoten sind jedoch noch nicht klassifiziert (16 % bei Archaeen und 8 % bei Bakterien)12. Daher sollten weitere Forschungen diese Sequenzen analysieren, um die Glyphosatempfindlichkeit zu bestimmen. Der EPSPSClass-Server bietet die Möglichkeit, neue genetische Marker zu testen. Die Identifizierung bekannter Klassen des EPSPS ist einfach, wie in Abschnitt 4.4 gezeigt. und Abbildung 5. Darüber hinaus bietet der Server in den Fällen, in denen Benutzer ihre eigenen Abfrage- und Referenzproteine vergleichen möchten, die Möglichkeit, manuell eine Referenzsequenz und einen Satz von Aminosäuremarkern einzuschließen (Abbildung 11). Diese Option kann verwendet werden, um neue Klassen des EPSPS zu identifizieren sowie andere Herbizide und Zielsequenzen zu testen.
Die Analyse der EPSPS-Klasse wird durch Sequenzanalyse und das Vorhandensein/Fehlen von Aminosäuremarkern bestimmt. Dies ist eine vorläufige Schätzung, die für Hypothesentests in diesem Bereich verwendet werden kann. Aminosäuremarker wurden in der Literatur auf der Grundlage von empirischen und Beobachtungsstudien 46,47,48,49,50,51 bestimmt. Referenzproteinsequenzen zur Bestimmung der EPSPS-Klasse wurden jedoch nur in einer begrenzten Anzahl von Spezies getestet und können gelegentlich die Resistenz gegen Glyphosat nicht erklären. Die Wirkung kompensatorischer Mutationen und EPSPS-assoziierter Domänen (meist in Pilzen) kann auch die Empfindlichkeit gegenüber Glyphosatbeeinflussen 58. Die Analyse dieses Papiers basiert auf vier EPSPS-Klassen. Eine Untersuchung von Bakterien im menschlichen Darmmikrobiom ergab, dass etwa 30% von ihnen nicht klassifiziert waren (dh EPSPS-Proteine aus diesen Spezies gehören zu keiner der bekannten Klassen), und zusätzliche Studien sind erforderlich, um andere EPSPS-Klassen zu identifizieren. Es sollte auch beachtet werden, dass die EPSPS-Proteinsequenz in Bakterien und Pflanzen unidomäne ist, während pilzliche EPSPS-Proteine mehrere Domänen59 enthalten. So kann eine Proteinfaltung in Pilzen zu einer anderen Reaktion des EPSPS-Enzyms auf Glyphosat führen. Darüber hinaus werden zusätzliche Nichtzielmechanismen der Resistenz (z. B. Austrittspumpen und Überexpression des EPSPS-Gens 13) oder der Empfindlichkeit gegenüber Glyphosat (z. B. die Wirkung von Glyphosat auf die mitochondriale Transportkette12) nicht berücksichtigt.
Obwohl GBPs seit 1974 als Herbizid existieren und seit 1991 weit verbreitet sind, ist dies die erste bioinformatische Methode, um die potenzielle Empfindlichkeit von Organismen gegenüber Glyphosat zu bestimmen. Die Methode basiert auf der Identifizierung bekannter Aminosäurereste in der Zielsequenz. Somit liefert unsere Methode eine Basisschätzung der möglichen Wirkung von Glyphosat auf die Spezies. In naher Zukunft sollten neuartige bioinformatische Methoden zusätzliche Klassen des EPSPS-Proteins umfassen, um die potenzielle Empfindlichkeit gegenüber Glyphosat von nicht klassifizierten Sequenzen 12,54,55 zu bestimmen. Da das genaue Verhalten des EPSPS-Enzyms durch einzelne Aminosäureänderungen 12,14,52,54,55 variieren kann, sollten weitere In-silico-Experimente kleine Variationen in der Faltung des EPSPS-Proteins sowie die Wirkung der EPSPS-assoziierten Domänen auf die Proteinstruktur in Pilzen berücksichtigen 58 . Darüber hinaus wurde gezeigt, dass eine Toleranz gegenüber Glyphosat durch Überexpression des EPSPS-Proteins56,57 erzeugt werden kann; So können bioinformatische Analysen, die auf der Verbesserung der Codon-Nutzung60 basieren, verwendet werden, um neuartige EPSPS-Sequenzen zu identifizieren, die die Genexpression maximieren oder minimieren.
Landwirte, Politiker und Entscheidungsträger brauchen dringend ein gründliches Verständnis der Risiken, die mit dem starken Einsatz von Pestiziden verbunden sind. Daher sind sowohl bioinformatische Werkzeuge, die die potenzielle Empfindlichkeit von Organismen gegenüber Pestiziden aufdecken, als auch gut replizierte, randomisierte und feldrealistische experimentelle Studien in verschiedenen Umgebungen erforderlich. Die vorgestellte bioinformatische Methode zur Untersuchung der Empfindlichkeit von Organismen gegenüber Glyphosat kann für andere Pestizide moduliert werden. In ähnlicher Weise können die Methoden der experimentellen Ökologie angewendet werden, um alle damit verbundenen ökologischen Fragen zu untersuchen. Zusammen können die Methoden verwendet werden, um Verluste zwischen Feldbeobachtungen, genomischen Daten und Pestizideinsatz nachzuweisen. Alle vorgestellten Methoden sind für die Risikobewertung von unschätzbarem Wert. Bioinformatische Methoden können beispielsweise zur Überwachung mikrobieller Anpassungen an Agrochemikalien eingesetzt werden und bieten eine quantitative Methode zur Prüfung der potenziellen anderen damit verbundenen Risiken, wie z. B. eine Erhöhung der Resistenz von Krankheitserregern gegen Agrochemikalien, negative Auswirkungen auf Mikroben, die als biologische Bekämpfungsmittel in der integrierten Schädlingsbekämpfung (IPM) verwendet werden, und Antibiotikaresistenzen bei Bakterien.
Offenlegungen
Interessenkonflikte: keine.
Danksagungen
Diese Arbeit wurde von der Akademie von Finnland finanziert (Stipendium Nr. 311077 an Marjo Helander).
Materialien
| Name | Company | Catalog Number | Comments |
| 2100 Bioanalyzer Instrument | Agilent | G2939B | To check the concentration and quality of PCR products |
| dNTP mix (10 mM each) | ThermoFisher Scientific | R0192 | For PCR reactions |
| GoTaq G2 DNA Polymerase kit | Promega | M7848 | PCR buffer and DNA Polymerase for PCR amplification |
| Invisorb Spin Plant Mini Kit | INVITEK Molecular | 1037100300 | Genomic DNA extraction from plant tissues |
| Ion Chip Minifuge | ThermoFisher Scientific | 4479672 | For targeted sequencing of microbial PCR products |
| Ion PGM System | ThermoFisher Scientific | 4462921 | For targeted sequencing of microbial PCR products |
| Ion PGM Torrent Server | ThermoFisher Scientific | 4483643 | For targeted sequencing of microbial PCR products |
| Pippinprep | SageScience | PIP0001 | For size fractionation of PCR amplicons |
| Pressure tank | Berthoud | 102140 | For sprayin glyphosate based products in field |
| Primers | Sigma Aldrich | Custom-made | For PCR amplification |
| Rotary tiller | Grillo | 984511 | For tilling the soil in experimental plots |
| S1000 ThermalCycler | BIO-RAD | 1852196 | For PCR amplification |
Referenzen
- Williams, G. M., Kroes, R., Munro, I. C. Safety evaluation and risk assessment of the herbicide Roundup and its active ingredient, glyphosate, for humans. Regulatory Toxicology and Pharmacology. 31, 117-165 (2000).
- Muola, A., et al. Risk in the circular food economy: Glyphosate-based herbicide residues in manure fertilizers decrease crop yield. The Science of the Total Environment. 750, 141422(2021).
- Helander, M., Saloniemi, I., Saikkonen, K. Glyphosate in northern ecosystems. Trends in Plant Science. 17 (10), 569-574 (2012).
- Fuchs, B., Saikkonen, K., Helander, M. Glyphosate-Modulated Biosynthesis Driving Plant Defense and Species Interactions. Trends in Plant Science. 26 (4), 312-323 (2021).
- Helander, M., Saloniemi, I., Omacini, M., Druille, M., Salminen, J. -P., Saikkonen, K. Glyphosate decreases mycorrhizal colonization and affects plant-soil feedback. The Science of the Total Environment. 642, 285-291 (2018).
- Bai, S. H., Ogbourne, S. M. Glyphosate: environmental contamination, toxicity and potential risks to human health via food contamination. Environmental Science and Pollution Research International. 23 (19), 18988-19001 (2016).
- Cuhra, M., Bøhn, T., Cuhra, P. Glyphosate: too much of a good thing. Frontiers in Environmental Science. 4, (2016).
- de Brito Rodrigues, L., et al. Impact of the glyphosate-based commercial herbicide, its components and its metabolite AMPA on non-target aquatic organisms. Mutation Research. 842, 94-101 (2019).
- Steinrücken, H. C., Amrhein, N. The herbicide glyphosate is a potent inhibitor of 5-enolpyruvylshikimic acid-3-phosphate synthase. Biochemical and Biophysical Research Communications. 94 (4), 1207-1212 (1980).
- Bentley, R. The shikimate pathway--a metabolic tree with many branches. Critical Reviews in Biochemistry and Molecular Biology. 25 (5), 307-384 (1990).
- Richards, T. A., et al. Evolutionary origins of the eukaryotic shikimate pathway: gene fusions, horizontal gene transfer, and endosymbiotic replacements. Eukaryotic Cell. 5 (9), 1517-1531 (2006).
- Leino, L., et al. Classification of the glyphosate target enzyme (5-enolpyruvylshikimate-3-phosphate synthase) for assessing sensitivity of organisms to the herbicide. Journal Of Hazardous Materials. 408, 124556(2021).
- Rainio, M. J., Ruuskanen, S., Helander, M., Saikkonen, K., Saloniemi, I., Puigbò, P. Adaptation of bacteria to glyphosate: a microevolutionary perspective of the enzyme 5-enolpyruvylshikimate-3-phosphate (EPSP) synthase. BioRxiv. , (2020).
- Rainio, M. J., Ruuskanen, S., Helander, M., Saikkonen, K., Saloniemi, I., Puigbò, P. Adaptation of bacteria to glyphosate: a microevolutionary perspective of the enzyme 5-enolpyruvylshikimate-3-phosphate synthase. Environmental Microbiology Reports. 13 (3), 309-316 (2021).
- Helander, M., Pauna, A., Saikkonen, K., Saloniemi, I. Glyphosate residues in soil affect crop plant germination and growth. Scientific Reports. 9 (1), 19653(2019).
- Ruuskanen, S., Rainio, M. J., Uusitalo, M., Saikkonen, K., Helander, M. Effects of parental exposure to glyphosate-based herbicides on embryonic development and oxidative status: a long-term experiment in a bird model. Scientific Reports. 10 (1), 6349(2020).
- Ruuskanen, S., et al. female preference and adverse developmental effects of glyphosate-based herbicides on ecologically relevant traits in Japanese quails. Environmental Science & Technology. 54 (2), 1128-1135 (2020).
- Mäki, A., Rissanen, A. J., Tiirola, M. A practical method for barcoding and size-trimming PCR templates for amplicon sequencing. Biotechniques. 60 (2), 88-90 (2016).
- Chelius, M. K., Triplett, E. W. The diversity of archaea and bacteria in association with the roots of Zea mays L. Microbial Ecology. 41 (3), 252-263 (2001).
- Lane, D. J. 16S/23S rRNA sequencing. Nucleic acid techniques in bacterial systematics. , John Wiley & Sons. New York. 115-175 (1991).
- Ghyselinck, J., Pfeiffer, S., Heylen, K., Sessitsch, A., De Vos, P. The effect of primer choice and short read sequences on the outcome of 16S rRNA gene based diversity studies. Plos One. 8 (8), 71360(2013).
- Zheng, D., Alm, E. W., Stahl, D. A., Raskin, L. Characterization of universal small-subunit rRNA hybridization probes for quantitative molecular microbial ecology studies. Applied and Environmental Microbiology. 62 (12), 4504-4513 (1996).
- JoVE Supplementary Material. , Available from: https://ppuigbo.me/programs/EPSPSClass/JOVE_SM (2021).
- Alignments Conserved Positions. , Available from: https://ppuigbo.me/programs/primers (2021).
- Protein Families. , Available from: http://pfam.xfam.org (2021).
- NCBI GenBank. , Available from: https://www.ncbi.nim.nih.gov/genbank (2021).
- COG Database. , Available from: https://www.ncbi.nim.nih.gov/research/cog (2021).
- Protein Data Bank. , Available from: https://www.rcsb.org (2021).
- EPSPSClass. , Available from: https://ppuigbo.me/programs/EPSPSClass (2021).
- Kristensen, D. M., Wolf, Y. I., Koonin, E. V. ATGC database and ATGC-COGs: an updated resource for micro- and macro-evolutionary studies of prokaryotic genomes and protein family annotation. Nucleic Acids Research. 45, 210-218 (2017).
- ATG_NCBI. , Available from: http://ftp.ncbi.nim.nih.gov/pub/kristensen/ATGC/atgc_home.html (2021).
- COG2020. , Available from: http://ftp.ncbi.nim.nih.gov/pub/COG/COG2020/data (2021).
- CSC - IT CENTER FOR SCIENCE LTD. , Available from: https://www.csc.fi (2021).
- Altschul, S. F., Gish, W., Miller, W., Myers, E. W., Lipman, D. J. Basic local alignment search tool. Journal of Molecular Biology. 215 (3), 403-410 (1990).
- Edgar, R. C. MUSCLE: multiple sequence alignment with high accuracy and high throughput. Nucleic Acids Research. 32 (5), 1792-1797 (2004).
- Tkacz, A., Hortala, M., Poole, P. S. Absolute quantitation of microbiota abundance in environmental samples. Microbiome. 6 (1), 110(2018).
- El-Gebali, S., et al. The Pfam protein families database in 2019. Nucleic Acids Research. 47, 427-432 (2019).
- Benson, D. A., et al. GenBank. Nucleic Acids Research. 41, Database issue 36-42 (2013).
- Galperin, M. Y., Makarova, K. S., Wolf, Y. I., Koonin, E. V. Expanded microbial genome coverage and improved protein family annotation in the COG database. Nucleic Acids Research. 43, Database issue 261-269 (2015).
- Burley, S. K., Berman, H. M., Kleywegt, G. J., Markley, J. L., Nakamura, H., Velankar, S. Protein data bank (PDB): the single global macromolecular structure archive. Methods in Molecular Biology. 1607, 627-641 (2017).
- Raoult, D., Hadjadj, L., Baron, S. A., Rolain, J. -M. Role of glyphosate in the emergence of antimicrobial resistance in bacteria. The Journal of Antimicrobial Chemotherapy. 76 (7), 1655-1657 (2021).
- Liu, J., Gefen, O., Ronin, I., Bar-Meir, M., Balaban, N. Q. Effect of tolerance on the evolution of antibiotic resistance under drug combinations. Science. 367 (6474), 200-204 (2020).
- Peixoto, F. Comparative effects of the Roundup and glyphosate on mitochondrial oxidative phosphorylation. Chemosphere. 61 (8), 1115-1122 (2005).
- Peillex, C., Pelletier, M. The impact and toxicity of glyphosate and glyphosate-based herbicides on health and immunity. Journal of Immunotoxicology. 17 (1), 163-174 (2020).
- Funke, T., Han, H., Healy-Fried, M. L., Fischer, M., Schönbrunn, E. Molecular basis for the herbicide resistance of Roundup Ready crops. Proceedings of the National Academy of Sciences of the United States of America. 103 (35), 13010-13015 (2006).
- Light, S. H., Krishna, S. N., Minasov, G., Anderson, W. F. An unusual cation-binding site and distinct domain-domain interactions distinguish Class II Enolpyruvylshikimate-3-phosphate synthases. Biochemistry. 55 (8), 1239-1245 (2016).
- Firdous, S., Iqbal, S., Anwar, S., Jabeen, H. Identification and analysis of 5-enolpyruvylshikimate-3-phosphate synthase (EPSPS) gene from glyphosate-resistant Ochrobactrum intermedium Sq20. Pest Management Science. 74 (5), 1184-1196 (2018).
- Barry, G. F., Kishore, G. M., Padgette, S. R., Stallings, W. C. Glyphosate-tolerant 5-enolpyruvylshikimate-3-phosphate synthases. United States Patient. , US5627061A (1997).
- Priestman, M. A., Funke, T., Singh, I. M., Crupper, S. S., Schönbrunn, E. 5-Enolpyruvylshikimate-3-phosphate synthase from Staphylococcus aureus is insensitive to glyphosate. FEBS Letters. 579, 728-732 (2005).
- Carozzi, N., Carr, B., Hammer, P. E. Identification of a new class of EPSP synthases. World Intellectual Property Organization Publ.of the Int.Appl. without Int.search. , REP. WO2006US13161 (2006).
- Lira, J. M., Cicchillo, R. M., Nair, S. K. Novel class of glyphosate resistance genes. US Patent. , US20130217577A1 (2013).
- Funke, T., et al. Structural basis of glyphosate resistance resulting from the double mutation Thr97 -> Ile and Pro101 -> Ser in 5-enolpyruvylshikimate-3-phosphate synthase from Escherichia coli. The Journal of Biological Chemistry. 284 (15), 9854-9860 (2009).
- Schönbrunn, E., et al. Interaction of the herbicide glyphosate with its target enzyme 5-enolpyruvylshikimate 3-phosphate synthase in atomic detail. Proceedings of the National Academy of Sciences of the United States of America. 98 (4), 1376-1380 (2001).
- Stalker, D. M., Hiatt, W. R., Comai, L. A single amino acid substitution in the enzyme 5-enolpyruvylshikimate-3-phosphate synthase confers resistance to the herbicide glyphosate. The Journal of Biological Chemistry. 260 (8), 4724-4728 (1985).
- Eschenburg, S., Healy, M. L., Priestman, M. A., Lushington, G. H., Schönbrunn, E. How the mutation glycine96 to alanine confers glyphosate insensitivity to 5-enolpyruvyl shikimate-3-phosphate synthase from Escherichia coli. Planta. 216 (1), 129-135 (2002).
- Achary, V. M. M., et al. Overexpression of improved EPSPS gene results in field level glyphosate tolerance and higher grain yield in rice. Plant Biotechnology Journal. 18 (12), 2504-2519 (2020).
- Huang, Z., Liu, Y., Zhang, C., Jiang, C., Huang, H., Wei, S. Molecular basis of natural tolerance to glyphosate in Convolvulus arvensis. Scientific Reports. 9 (1), 8133(2019).
- Tall, T. A census analysis of the 5-enolpyruvylshikimate-3-phosphate (EPSP) synthase and EPSP-associated domains. , (2020).
- Tall, T., Puigbò, P. The glyphosate target enzyme 5-Enolpyruvyl Shikimate 3-Phosphate Synthase (EPSPS) contains several EPSPS-associated domains in fungi. ATLA Summary of Proceedings. 76 (1), 6(2020).
- Puigbò, P., Guzmán, E., Romeu, A., Garcia-Vallvé, S. OPTIMIZER: a web server for optimizing the codon usage of DNA sequences. Nucleic Acids Research. 35, Web server issue 126-131 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten