Method Article
Mit der 2-Photonen-Mikroskopie die Auswirkungen einer chronischen einseitigen Harnleiterobstruktion auf glomeruläre Prozesse quantifizieren
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein Protokoll mit 2-Photonen-Mikroskopie in München Wistar Fromter Ratten mit Oberflächenglomeruli, um die Auswirkungen einer verlängerten Harnleiterobstruktion auf die glomeruläre Dynamik und Funktion zu quantifizieren.
Zusammenfassung
Die Anwendung neuartiger Mikroskopiemethoden auf geeignete Tierkrankheitsmodelle zur Erforschung der dynamischen Physiologie der Niere bleibt eine Herausforderung. Ratten mit Oberflächenglomeruli bieten eine einzigartige Möglichkeit, physiologische und pathophysiologische Prozesse mittels intravitaler 2-Photonenmikroskopie zu untersuchen. Die Quantifizierung des glomerulären kapillaren Blutflusses und die Vasokonstriktion und -dilatation als Reaktion auf Medikamente, Permeabilität und Entzündung sind nur einige der Prozesse, die untersucht werden können. Darüber hinaus bieten transgene Ratten, d.h. Podozyten, die mit Fluoreszenzfarbstoffen und anderen molekularen Biomarkeransätzen markiert sind, eine erhöhte Auflösung, um Protein-Protein-Interaktionen und die Auswirkungen spezifischer molekularer Veränderungen direkt zu überwachen und zu quantifizieren.
Bei Mäusen, denen nach einem Alter von vier Wochen Oberflächenglomeruli fehlen, wurde die einseitige Harnleiterobstruktion (UUO) für mehrere Wochen verwendet, um Oberflächenglomeruli zu induzieren. Da dieses Induktionsmodell keine Baseline-Studien zulässt, quantifizierten wir die Auswirkungen von UUO auf glomeruläre Prozesse im UUO-Modell in München Wistar Frömter (MWF) Ratten, die unter physiologischen Bedingungen Oberflächenglomeruli aufweisen. Das UUO-Modell für fünf Wochen oder länger induzierte signifikante Veränderungen der groben Nierenmorphologie, der peritubulären und glomerulären Mikrovaskulatur sowie der Struktur und Funktion tubulärer Epithelien. Der Fluss der glomerulären und peritubulären roten Blutkörperchen (RBC) nahm signifikant ab (p < 0,01), wahrscheinlich aufgrund der signifikanten Zunahme der Adhärenz weißer Blutkörperchen (WBCs) in glomerulären und peritubulären Kapillaren. Der glomeruläre Siebkoeffizient von Albumin stieg von 0,015 ± 0,002 in unbehandelten MWFs auf 0,045 ± 0,05 bei 5 Wochen alten UUO-MWF-Ratten. Zwölf Wochen UUO führten zu einem weiteren Anstieg der glomerulären Oberflächendichte und des glomerulären Siebkoeffizienten (GSC) für Albumin. Fluoreszierendes Albumin, das über die Glomeruli gefiltert wurde, wurde von den proximalen Tubuli nicht resorbiert. Diese Daten deuten darauf hin, dass die Verwendung von UUO zur Induktion von Oberflächenglomeruli die Fähigkeit einschränkt, normale glomeruläre Prozesse und Krankheitsveränderungen zu untersuchen und zu interpretieren.
Einleitung
Das Verständnis glomerulärer Prozesse, insbesondere der Podozytenbiologie, ist seit über 50 Jahren ein Ziel. Munich Wistar-Ratten mit Oberflächenglomeruli haben in diesen Studien, einschließlich Mikropunktionsstudien, eine zentrale Rolle gespielt, um zahlreiche Aspekte physiologischer und pathologischer Prozesse zu verstehen 1,2,3. Die Verwendung der Mikroskopie zur intravitalen Untersuchung glomerulärer Komponenten war aufgrund der Auswirkungen der Phototoxizität bis zum Aufkommen der 2-Photonenmikroskopie, die diese toxische Exposition minimierte und die Eindringtiefe erhöhte 1,2, begrenzt. Zusammen mit den rasanten Fortschritten in der Computerhardware und -software hat dies dreidimensionale (3D) und vierdimensionale (Zeit) Studien für Stunden in einer einzigen Einstellung ermöglicht 1,4,5.
Die Quantifizierung des glomerulären kapillaren Blutflusses, Vasokonstriktion und Dilatation als Reaktion auf Medikamente, Permeabilität und die Auswirkungen von Ladung auf Permeabilität und Entzündung sind nur einige der glomerulären Prozesse, die untersucht wurden. Darüber hinaus ist das S1-Segment des proximalen Tubulus identifizierbar, und die Unterschiede im Verhalten von S1- und S2-Röhrenepithel können quantifiziert werden 1,4. Studien an Mäusen, insbesondere mit der universellen Verfügbarkeit transgener Einrichtungen der Maus, haben zu schnellen Fortschritten im Verständnis der Molekularbiologie glomerulärer Krankheitsprozesse geführt. Einzelne Proteine sind in Knockout-Studien für glomeruläre Dysfunktion verantwortlich, insbesondere im Hinblick auf Proteinurie 6,7,8. Die Verwendung von Mausmodellen für glomeruläre Bildgebungsstudien war jedoch begrenzt, da Glomeruli in den zahlreichen untersuchten Stämmen mehr als 100 μm unter der Oberfläche liegen9.
Dies hat die Forscher dazu veranlasst, Mausmodelle zu entwickeln und zu verwenden, was zu Oberflächenglomeruli führt, die untersucht werden können. Das gebräuchlichste Modell ist die Verwendung von vollständigem UUO10,11,12. Am Ende der verlängerten UUO-Periode gibt es zahlreiche Oberflächenglomeruli in Mäusenieren, die untersucht werden können und wurden13,14. Es gab keine Baseline- oder Kontrollstudie in diesen Mausstudien, um die Auswirkungen einer verlängerten UUO auf die glomeruläre Biologie zu bestimmen. Da es sich um ein schweres und anhaltendes Verletzungsmodell handelt, das zu einer schnellen Fibrose und kortikalen Zerstörung führt10,11,12, stellten wir die Hypothese auf, dass es Auswirkungen auf glomeruläre Prozesse und Funktionen geben würde. Um diese Frage zu beantworten, wurden Munich Wistar Fromter (MWF) Ratten mit Oberflächenglomeruli verwendet, um Kontroll-/Baseline-Parameter zu untersuchen, und der Baseline-Befund wurde mit glomerulären Studien an MWF-Ratten nach fünf Wochen UUO verglichen. Wir untersuchten auch Sprague Dawley (SD) Ratten, die nach UUO keine Oberflächenglomeruli haben. Die Ergebnisse deuten darauf hin, dass 5 Wochen UUO bei MWF- und SD-Ratten tatsächlich die Anzahl der Oberflächenglomeruli erhöhen. Dies waren jedoch abnormale Glomeruli mit deutlichen Veränderungen des glomerulären Blutflusses, der Entzündung und der Permeabilität und Größe von Makromolekülen.
Protokoll
Alle Experimente folgten dem Leitfaden für die Pflege und Verwendung von Labortieren und wurden vom Animal Care and Use Committee an der Indiana University School of Medicine genehmigt.
1. Vorbereitung der Münchner Wistar Frömter oder SD-Ratte auf die UUO-Operation
- Betäuben Sie die Ratte mit Isofluoran (5% Induktion, 1,5-2,5% Erhaltung), rasieren, waschen und desinfizieren Sie den Operationsbereich mehrmals in kreisenden Bewegungen mit einem Peeling auf Jod- oder Chlorhexidinbasis und Alkohol. Wenden Sie ein lang wirkendes / langsam freisetzendes Analgetikum zur Schmerzbehandlung gemäß den institutionellen IACUC-Richtlinien an.
- Machen Sie einen Schnitt entlang der Mittellinie mit einem Skalpell; Lokalisieren Sie die linke Niere und befreien Sie sie von den umliegenden Peritonealorganen.
- Suchen Sie sorgfältig den Nierenstiel, der die Nierenarterie, die Nierenvene und den Harnleiter umfasst. Trennen Sie den Harnleiter von den anderen Strukturen und treffen Sie Vorsichtsmaßnahmen, um die empfindliche Struktur nicht zu beschädigen.
- Verwenden Sie eine feine Pinzette, schlingen Sie vorsichtig eine 3-0-Naht um den Harnleiter und binden Sie sie ab, achten Sie darauf, sie nicht zu reißen. Wiederholen Sie diesen Vorgang einige Millimeter auf beiden Seiten des ersten Knotens, um einen zweiten Knoten zu binden und eine vollständige Obstruktion zu gewährleisten.
- Sobald der Eingriff abgeschlossen ist, schließen Sie vorsichtig die aufeinanderfolgenden Muskelschichten. Bevor Sie die letzte Schicht schließen, fügen Sie 2 ml warme, sterile 0,9% Kochsalzlösung in den Bauch ein, bevor Sie sie vollständig verschließen. Verschließen Sie die Außenhaut mit chirurgischen Klammern.
- Wenden Sie lang wirkendes / langsam freisetzendes Analgetikum zur Schmerzbehandlung an und beobachten Sie die Genesung genau gemäß den institutionellen IACUC-Richtlinien. Überwachen Sie danach regelmäßig und bereiten Sie sich am Ende der fünften Woche auf die Bildgebung vor.
2. Synthese von Texas Red Rattenserumalbumin (TR-RSA)
- Wiegen Sie 100 mg Rattenserumalbumin aus und lösen Sie es in 6,67 ml 0,1 M Natriumbicarbonatpuffer bei pH 8,4 in einem 50 ml konischen Röhrchen auf.
- In eine Durchstechflasche mit 5 mg Texas Red-X-Succinimidylester 100 μL Dimethylformamid (DMF, hohe Qualität) und Wirbel geben, bis der gesamte Farbstoff gelöst ist.
- Legen Sie die Rattenserumalbuminlösung auf einen Wirbel bei einer niedrigen/mittleren Einstellung, so dass sich das Lösungsvolumen weit unter der Oberseite des offenen Röhrchens dreht.
- Fügen Sie den gelösten Farbstoff hinzu, während das Röhrchen gewirbelt wird.
- Nehmen Sie das 50-ml-konische Rohr, wickeln Sie es in Folie, legen Sie das Rohr auf eine Wippe oder Rolle und rühren Sie langsam für 1 Stunde bei Raumtemperatur (RT).
- In einem 5 L Eimer mit 0,9% NaCl mit einem Rührstab unter leichtem Rühren die Membranen eines geeigneten 50 kDa Molekulargewichts-Cut-Off-Dialysators benetzen (eine Membran mit Clips, geschlossene Membranschläuche oder Dialysekassetten sind geeignet).
- Laden Sie die TR-RSA-Lösung in das Membransystem und befestigen Sie sie an den Flotationsaufsätzen, die normalerweise im Lieferumfang des Systems enthalten sind. Stellen Sie den 5 L Behälter mit der 0,9%igen Kochsalzlösung/TR-RSA über Nacht bei 4 °C (in einem Kühlraum) unter leichtem Rühren auf eine Rührplatte. Wechseln Sie die Dialyselösung in den nächsten 36 Stunden mindestens dreimal.
- Das Aufquellen der Membran erhöht das Volumen der nun klaren TR-RSA-Lösung. Teilen Sie die ursprünglichen 100 mg durch das Volumen, um eine ungefähre Konzentration zu erhalten: Das Farbstoff-Protein-Verhältnis beträgt 1:1. Aliquot in geeignete Volumina und lyophilisieren für die Langzeitlagerung.
3. Vorbereitung für die intravitale 2-Photonen-Bildgebung am inversen Mikroskop
- Entfernen Sie den Deckel einer 50-mm-Deckglas-Bodenschale (mit 40 mm Deckglasdurchmesser) und legen Sie 8 Stück Autoklavband auf den inneren Boden entlang des Randes. Machen Sie ein pyramidenförmiges, leeres Fenster mit 4 Stück pro Seite, damit die äußere Niere eng in diesen Raum passt, während sie peripher mit dem Autoklavenband in Kontakt bleibt, wodurch die Bewegung minimiert wird. Passen Sie den Abstand entsprechend der Größe der Ratte an, um den besten Kontakt mit der Niere zu gewährleisten.
- Legen Sie 1 Wärmeleitpad auf jede Seite der 50-mm-Deckglasbodenschale. Stellen Sie sicher, dass das Wärmekissen die Bühne bedeckt.
- Verwenden Sie ein 40-faches Wasserimmersionsobjektiv mit 0,75-fachem Zoom und 1,5-fachem Zoom, um 30-fache bzw. 60-fache Bilder zu erzeugen, die Bilder mit geringerer und höherer Vergrößerung ermöglichen. Falls erforderlich, fügen Sie dem Objektiv Wasser hinzu, indem Sie eine 1-ml-Spritze mit einem langen Stück PE-200-Schlauch verwenden, das die Oberseite des Objektivs in einem Abwärtswinkel erreichen kann, um ein Ableiten des Wassertropfens zu verhindern.
- Verwenden Sie 2% Laserdurchlässigkeit, wobei blaue, grüne und rote Detektoren auf vorbestimmte Werte eingestellt sind, um die Konsistenz der Bilder zwischen den Studien zu gewährleisten. Stellen Sie die Anregungswellenlänge auf 800 nm auf dem referenzierten Laser ein (siehe Materialtabelle), wodurch alle in dieser Studie verwendeten Fluorophore effizient angeregt werden.
- Verwenden Sie externe (nicht gescannte) Detektoren, um blaue Emissionen mit einer Photomultiplierröhre (PMT) (420-490 nm, Verstärkung 950) zu sammeln.
- Verwenden Sie einen Hyd-Detektor, um grüne Emissionen zu erfassen (500-550 nm, Verstärkung 100).
- Verwenden Sie einen Hyd-Detektor, um rote Emissionen (590-660 nm, Verstärkung 200) zu erfassen.
- Stellen Sie den Offset im PMT (blaue Emissionen) so ein, dass nur wenige Pixel in den leeren Gewebebereichen einen Wert von Null haben.
HINWEIS: Die HyD-Detektoren für die grünen und roten Emissionen verfügen über eine automatische Offset-Anpassung. Nur die Verstärkung kann eingestellt werden. - Stellen Sie die Bittiefe auf 12 Bit ein, um Bildern eine Intensitätsskala von 4.096 zwischen Schwarzweiß zu geben.
HINWEIS: Es ist notwendig, die unteren Grenzwerte der Detektoren (versetzt in PMT) festzulegen, um diese Werte nicht auszuschließen, um die Erfassung der Emissionen geringer Intensität im Raum von Bowman sicherzustellen. Wenn die Empfindlichkeitseinstellung zu niedrig ist, zeigen die visuellen Warnmarkierungen dies an. Diese Werte erhalten einen Intensitätswert von Null.
- Etwa 6 mg Texas-Red-X-Ratten-Serumalbumin werden auf ein Gesamtvolumen von 1 ml verdünnt, die Lösung in eine 1-ml-Spritze geladen und in Schritt 4.1 nach Infusion von Hoechst 33342 in Schritt 9.1 auf den intravenösen Dauerkatheter gelegt.
4. Chirurgische Vorbereitung für intravitale 2-Photonen-Bildgebung
- Legen Sie die voranästhesierte Ratte mit einer verweilten venösen Zugangslinie (Femur oder jugulär) auf die Seite, wobei die rasierte linke Flanke flach und gerade auf den Tisch zeigt. Stellen Sie sicher, dass sich die Vorderpfoten berühren, ebenso wie die hinteren Pfoten.
- Palpieren Sie sanft die linke Flanke direkt unter den Rippen, um die Niere zu fühlen, um die natürliche Position im Bauch zu bestimmen. Zeichnen Sie bei Bedarf eine Linie mit einem permanenten Marker entlang des rasierten Bereichs und halbieren Sie das Nierenzentrum in einer Nase-zu-Schwanz-Ausrichtung.
- Fassen Sie die Haut mit einer gezähnten Pinzette und heben Sie sie nach oben, um das Einklemmen der permanenten Markerlinie mit einem Paar Hämostatika zu erleichtern, um das darunter liegende Gefäßsystem zu zerquetschen und Blutungen zu verhindern, wenn Sie den Schnitt mit einer chirurgischen Schere machen. Wiederholen Sie dies für die dünne äußere Muskelschicht, um Blutungen zu minimieren.
- Um den letzten Schnitt der dünnen inneren Bauchmuskelschicht zu machen, repalpate die Niere, um die Größe und Position zu schätzen. Heben Sie die innere Muskelschicht vorsichtig mit einer Pinzette an und zerquetschen Sie eine Linie, die die Haut über der Niere mit den Hämostaten halbiert, die etwa 1/3 der geschätzten Größe der Niere beträgt.
- Halten Sie den Griff auf die Muskelschicht mit der Pinzette, machen Sie den letzten Einschnitt.
HINWEIS: Es ist besser, einen kleineren Einschnitt zu machen und nach Bedarf zu erweitern, als ihn zu groß zu machen, was ein teilweises Schließen mit einer Naht erfordert. - Fassen Sie die Niere vorsichtig durch das umgebende Fett. Verwenden Sie beide Hände mit einer Pinzette in jeder Hand, um das Fett am unteren Pol der Niere zu greifen, indem Sie eine Hand-über-Hand-Technik verwenden, um das Nierenfett zu greifen und zu halten und nach unten zu arbeiten.
- Wenn Sie das Fett am unteren Pol der Niere mit einer Hand fest im Griff haben, ziehen Sie das Fett sanft und drücken Sie die Niere bei Bedarf sehr sanft durch den Einschnitt. Wenn die Niere nicht leicht durchgeht, erweitern Sie den Einschnitt.
5. Positionierung der Ratte für die Bildgebung
- Legen Sie die freiliegende Niere vorsichtig gegen den Rand der Schale, mit einer leichten Drehung, so dass die Bauchseite der Niere das Deckglas berührt und die dorsale Seite vom Rand abgewandt ist.
- Um die Bewegung weiter zu minimieren, nehmen Sie zwei sterile 2 x 2 Mullbinden, befeuchten Sie sie mit Kochsalzlösung und packen Sie sie gegen die dorsale Seite der Niere, um den Kontakt der Bauchseite der Niere zum Rand zu verstärken.
- Schauen Sie durch das Mikroskopokular unter Epifluoreszenzbeleuchtung mit einem Dual-Pass-Rhodamin/FITC-Würfel. Wenn eine Bewegung erkannt wird, nehmen Sie geringfügige Anpassungen an der Position vor und passen Sie die Gaze sorgfältig an, um sicherzustellen, dass sie nicht unter die Niere drückt. Um die Bewegung weiter zu reduzieren, rollen Sie die Ratte leicht um, so dass der Thorax weiter von der Schale entfernt ist.
6. Bildaufnahme für die quantitative Analyse
- Scannen Sie die Oberfläche der Niere mit Epifluoreszenzbeleuchtung (Schritt 5.3) und markieren Sie die Glomeruli-Position(en) mit der Software, die mit dem motorisierten Bühnenregler verbunden ist (ein Merkmal moderner Systeme).
- Nehmen Sie für jeden Farbkanal unter 2-Photonen-Beleuchtung ein flaches 3D-Volumen des oberen Teils jedes markierten Glomerulus, das als Hintergrundbilder dient. Verwenden Sie eine Pseudofarbpalette in der Anzeigeoption der Bildgebungssoftware, um die schwachen Intensitäten der Hintergrundfluoreszenz der glomerulären Kapillarschleifen besser zu visualisieren.
- Verwenden Sie ein oberflächliches Blutgefäß als Brennpunkt, infundieren Sie langsam das fluoreszierende Albumin, um den Anstieg und Abfall der Fluoreszenz aufgrund der systemischen Verteilung zu beobachten. Gießen Sie genügend TR-RSA auf, um eine Intensität im peritubulären Gefäßsystem und in den Kapillarschleifen zu erreichen, die knapp unter der Sättigung liegt.
HINWEIS: Es gibt typischerweise eine Verzögerung von 5 s zwischen der Infusion von Material und seinem Auftreten im Blutkreislauf, wenn die Nierenperfusion normal ist. - Warten Sie ca. 10 Minuten, bevor Sie 3D-Volumen (1 μm-Intervalle) für alle markierten und abgebildeten Glomeruli aus Schritt 6.2 erfassen.
HINWEIS: Simonsens Münchner Wistar-Ratten haben weniger Oberflächenglomeruli. Da der Frömterstamm von MW-Ratten jedoch eine größere Anzahl von Oberflächenglomeruli aufweist, können oft bis zu 10 Glomeruli abgebildet werden. - Euthanasieren Sie die Ratte am Ende der Studie durch eine Überdosis Isofluran. Führen Sie eine duale Pneumothorakotamie durch, um die Euthanasie sicherzustellen.
7. Berechnung der glomerulären Permeabilität
- Exportieren Sie die Bilder mithilfe der dem Mikroskopsystem zugeordneten Bildbetrachtungssoftware zur Verarbeitung und Analyse in 12-Bit-Rohbilder.
- Laden Sie die Hintergrund-3D-Volumen und das rohe 3D-Volumen, das das zirkulierende fluoreszierende Albumin enthält. Lokalisieren Sie die Fokusebene im 3D-Volumen mit der hellsten oberflächlichen Kapillarschleife in den Glomeruli mit genügend Platz zum Rand der umgebenden Bowman-Kapsel.
- Suchen Sie mithilfe visueller Orientierungspunkte die gleiche Fokusebene wie im Hintergrundvolumen. Wählen Sie einen Bereich in der Kapillarschleife und einen innerhalb des Bowman-Raums aus, wobei Sie die durchschnittlichen Intensitätswerte jedes einzelnen notieren. Verwenden Sie diese Intensitätswerte als Hintergrundwerte.
- Skizzieren Sie einen Bereich (mindestens 20 x 20 Pixel groß) innerhalb des Bowman-Raums im albuminhaltigen Bild und notieren Sie sich die Intensitätsmessung (wählen Sie einen Bereich, der nicht an eine Kapillarschleife oder die Bowman-Kapsel angrenzt, um die sauberste Messung der Raumintensitäten von Bowman zu gewährleisten). Verschieben Sie den gezeichneten Bereich über zwei andere Regionen, um einen Durchschnittswert für die durchschnittliche Intensität innerhalb von Bowman's Space zu erhalten.
- Wählen Sie die hellste plasmafluoreszierende Intensität innerhalb des Kapillarschleifenabschnitts und umkreisen Sie diesen Bereich. Markieren Sie mit der Schwellenwertfunktion die hellen Werte (normalerweise an den Rändern der Kapillarschleifenwände), vermeiden Sie zirkulierende RBC-Schatten und zeichnen Sie den Wert auf.
HINWEIS: Da Faktoren im Blut zu einer Unterschätzung der Plasmafluoreszenzwerte führen, ist es wichtig, die hellsten Bereiche auszuwählen. - Geben Sie die Werte in eine Tabelle ein, um den GSC mit Eq (1) zu berechnen:
GSC = (1)
(1)
8. Berechnung des Flusses roter Blutkörperchen in glomerulären Kapillarschleifen und Nierengefäßen mit Hilfe einer Linescan-Funktion
- Finden Sie ein geeignetes Gefäß (entweder eine Kapillarschleife oder ein peritubuläres Gefäß). Da die Zeilenscan-Funktion in der referenzierten Bildaufnahmesoftware (siehe Materialtabelle) erfordert, dass das Gefäß senkrecht steht, drehen Sie das Bild mit der Drehfunktion .
- Sobald das Schiff gedreht ist und flach liegt, wählen Sie die XT-Funktion im Erfassungsmenü . Richten Sie das Scannen von 4.000 Zeilen ein. Legen Sie die Linie quer über das zu untersuchende Gefäß; Stellen Sie sicher, dass die Fokusebene den maximalen Durchmesser des abzubildenden Segments hat.
- Klicken Sie mit der linken Maustaste auf das farbige zusammengesetzte Bild und wählen Sie Schnappschuss aufnehmen , um ein Referenzbild des Bereichs zu generieren, in dem der Linienscan aufgenommen wurde. Klicken Sie sofort auf die Schaltfläche Start , um den Zeilenscan des Schiffes aufzunehmen.
- Um den RBC-Durchfluss zu ermitteln, importieren Sie die Linescans in die Bildverarbeitungssoftware (siehe Materialtabelle). Öffnen Sie das Dialogfeld Regionsstatistik anzeigen im Dropdown-Menü Measure . Wählen Sie das Einzellinienzeichnungswerkzeug aus und zeichnen Sie eine Linie, die der Neigung der RBC-Schatten entspricht. Beachten Sie die Werte für Breite und Höhe.
HINWEIS: Die für die Breite ermittelten Pixelwerte entsprechen der Entfernung. Die Pixel für die Höhe entsprechen der Zeit. - Verwenden Sie die folgende Formel (Eq (2)), um die Geschwindigkeit zu berechnen.
RBC-Durchfluss in μm/s =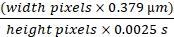 (2)
(2)
HINWEIS: Dies entspricht Erfassungsparametern bei 60-facher Vergrößerung und einer Scanrate von 400 Hz mit dem referenzierten Mikroskop (siehe Materialtabelle).- Führen Sie mindestens fünf Berechnungen durch und mitteln Sie sie, um die Geschwindigkeit für jeden Zeilencan zu melden.
HINWEIS: Diese Parameter hängen von der Pixelgröße und der Aufnahmegeschwindigkeit des Mikroskopsystems ab.
- Führen Sie mindestens fünf Berechnungen durch und mitteln Sie sie, um die Geschwindigkeit für jeden Zeilencan zu melden.
9. Berechnung der Leukozytenokklusion in glomerulären Kapillarschleifen
- Verabreichen Sie Hoechst 33342 Kernfärbung (bei ~8 μg/kg Rattengewicht) über eine verweilvenöse Zugangsleitung, um Leukozyten in den Kapillarschleifen zu identifizieren.
HINWEIS: Die nutzbare Tiefe ist aufgrund der Photonenstreuung und Absorption durch Hämoglobin begrenzt, insbesondere bei kürzerwelligen blauen Emissionen. - Zentrieren Sie einen Glomerulus im Bildgebungsfeld und nehmen Sie einen 3D-Datensatz, der an der glomerulären Oberfläche beginnt und die Daten mindestens 30 bis 35 μm beendet. Verwenden Sie eine Schrittweite von 1 μm in Z-Richtung.
- Identifizieren Sie WBCs, indem Sie den blauen Hoechst-Kanal mit dem Texas Red-Albuminkanal vergleichen. Achten Sie auf den Ausschluss von rotem Farbstoff in der Kapillarschleife und eine entsprechende Kernfärbung, um die Leukozyten eindeutig zu identifizieren. Definieren Sie weiße Blutkörperchen als "haftend", wenn sie über 3 optische Abschnitte statisch erscheinen. Geben Sie die Werte als Vorkommen/10 optische Schnitte von der Oberseite des Glomerulus an, aufgenommen in Abständen von 1 μm.
10. Bewertung des Vorhandenseins von Rouleaux-Formationen in Oberflächenglomeruli
- Folgen Sie den Anweisungen für Schritt 9.3 und erfassen Sie einen 3D-Datensatz. Suchen Sie nach Rouleaux-Formationen, die als RBCs erscheinen, die in Paketen gestapelt sind, die der Dissoziation widerstehen, während sie sich entlang der Kapillarschleifen bewegen. Verwenden Sie ein rotes Fluorophor zur besseren Visualisierung der Struktur in größeren Tiefen aufgrund der geringeren Photonenstreuung für die längerwelligen roten Emissionen. Geben Sie die Werte als Vorkommen/25 optische Schnitte von der Oberseite des Glomerulus an, aufgenommen in Abständen von 1 μm.
11. Isolierung von Glomeruli
- Isolieren Sie drei Gruppen von Glomeruli aus frischen Nieren mit einer Standardsiebtechnik, die zu einer Reinheit von fast 90% von Rattenglomeruliführt 15.
- Legen Sie die Nierenrinde in kalte phosphatgepufferte Kochsalzlösung (PBS) und zerkleinern Sie sie mit mehreren feinen Scheren oder Rasierklingen.
- Geben Sie das gehackte Gewebe in ein 100 μm steriles Zellsieb und drücken Sie es vorsichtig mit einem 5-ml-Spritzenkolben und 50-100 ml kaltem PBS durch.
HINWEIS: Die meisten Tubuli bleiben erhalten, während die Glomeruli durchgehen. - Die angereicherte Glomerulifraktion auf einen 70 μm Filter geben und ausgiebig mit kaltem PBS waschen. Waschen Sie den Filter mit 100-200 ml kaltem PBS, um die meisten verbleibenden Röhrchen zu entfernen.
- Sammeln Sie die Glomeruli aus dem Filter mit 1-2 ml kaltem PBS, Zentrifuge (10.000 × g, 2 min, 4 °C) und frieren Sie sie in flüssigem Stickstoff bis zur RNA-Isolierung ein.
HINWEIS: Die durch Phasenkontrastmikroskopie bestimmte glomeruläre Reinheit beträgt >90% und die Ausbeute beträgt ca. 10 mg aus 2 Nieren.
12. Glomeruläre RNA-Isolierung
- Das gefrorene Glomeruli-Pellet wird mit dem RNA-Isolierreagenz homogenisiert, indem 400 μL des Reagenzes hinzugefügt und das Pellet mit einer 200-μL-Pipettenspitze aufgebrochen wird, gefolgt von einem kurzen Wirbel und 5 Minuten Inkubation bei RT16.
- 40 μL 1-Brom-3-chlorpropan (BCP), Wirbel für 15 s zugeben und 15 min bei RT halten.
- Zentrifuge bei 12.000 × g, 15 min, 4 °C. Entfernen Sie die wässrige Schicht, verdünnen Sie die untere Schicht mit einem gleichen Volumen von 70% Ethanol und laden Sie sie direkt auf eine Spinsäule (siehe Materialtabelle).
- Nach dem Waschen, jeweils bestehend aus Zugabe der jeweiligen Lösung in die Säule, gefolgt von einer Zentrifugation bei 12.000 x g, 15 s, 26 °C [3 insgesamt, erste 2 mit 500 μL RPE (proprietärer milder Waschpuffer mit Ethanol zur Entfernung von Salzspuren, 3. Waschgang mit 500 μL 80% EtOH], eluieren Sie die RNA durch Zugabe von 15 μLH2 O und Zentrifuge, wie für die Waschungen. Überprüfen Sie die Konzentration und Reinheit der RNA und transportieren Sie die RNA-Proben zur Kernanlage zur Nanostring-Analyse17,18.
HINWEIS: Die gesamte RNA-Ausbeute beträgt ca. 1-2 μg. Hier enthielten die 24 Proben 200 ng RNA bei 30 ng/μL.
13. Nanostring-Analyse
HINWEIS: Die Nanostring-Technologie basiert auf der digitalen Detektion und dem direkten molekularen Barcoding von Zielmolekülen, die farbcodierte Sondenpaare verwenden. Die Capture-Sonde trägt eine Biotin-Einheit am 3'-Ende, und die Reporter-Sonde trägt das Signal an ihrem 5'-Ende.
- Senden Sie die Nanostring-Gensondenpaare und CodeSets an die Genomic Core Facility des Staates Michigan und verwenden Sie sie gemäß den Anweisungen von NanoString.
HINWEIS: Es gibt sechs Positionen für die Farbcodes, und jede Position kann eine von vier Farben sein, was eine große Vielfalt von Tags ermöglicht, die während der Datenerfassung einzeln aufgelöst und identifiziert werden können. - Beziehen Sie die von den Mitarbeitern der Genomic Core-Einrichtung gesammelten Daten mit dem proprietären Nanostring nCounter Digital-Analysator, der Sichtfelder mit einem Mikroskopobjektiv und einer CCD-Kamera sammelt und die Barcode-Anzahl tabellarisch darstellt und anzeigt.
- Importieren Sie die Rohdaten zur Analyse in die nSolver-Software von Nanostring. Normalisieren Sie die normalisierten Daten mit ihren Standardeinstellungen und vergleichen Sie Daten zwischen Gruppen, wie in ihrem Handbuch beschrieben.
HINWEIS: Ziel war es, Genveränderungen zu überwachen, von denen zuvor gezeigt wurde, dass sie in kortikalem Gewebe aus einem UUO-Modell19, Nierenerkrankung 17,20,21,22,23,24,25,26 verändert waren. Insgesamt 126 Gene, einschließlich der empfohlenen positiven und negativen Kontrollen, wurden in jeder Glomeruli-Gruppe (CONT, SHAM & UUO) analysiert.
Ergebnisse
Drei Gruppen von Glomeruli wurden unter Verwendung einer Standardsiebtechnik isoliert, die zu einer Reinheit von fast 90% von Rattenglomeruliführt 15. Die erste Glomeruli-Gruppe stammte aus der linken Niere von SD-Ratten, die 5 Wochen lang einer linken Nieren-Harnleiterklemme unterzogen wurden, UUO (5 Männchen, 3 Weibchen). Die zweite Glomeruli-Gruppe wurde aus der kontralateralen Kontrollniere derselben Ratte, CONT, isoliert (5 Männchen, 3 Weibchen). Die dritte Gruppe von Glomeruli wurde aus SD-Ratten isoliert, die sich einer SHAM-Operation unterzogen hatten, und die linke Niere wurde nach 5 Wochen zur Glomeruli-Isolierung verwendet, SHAM (4 Männchen, 4 Weibchen).
Morphologische Veränderungen
Die Externalisierung der blockierten Niere für die Bildgebung ergab eine stark vergrößerte Niere, etwa viermal so groß wie normal, mit dünnen Epithelien, die durch das flüssigkeitsgefüllte Niereninnere sichtbar waren. Durch ein 20x-Objektiv mit Epifluoreszenzbeleuchtung und einem FITC/Rhodamin-Dual-Pass-Würfel war die offensichtlichste Veränderung die Ausdünnung der röhrenförmigen Epithelien und der gleichmäßige Kollaps der röhrenförmigen Lumen über die gesamte röhrenförmige Länge. Die Histologie wurde gut beschrieben und ist um eine Woche UUO10,11,12 schwer. Die Anzahl der an der Oberfläche sichtbaren Glomeruli bei MWF- und SD-Ratten nahm nach fünf Wochen einseitiger Harnleiterobstruktion zu. Abbildung 1A zeigt die Methode zum Erstellen des UUO-Modells. Die rechte Niere ist unberührt und bietet eine ausreichende glomeruläre Filtrationsrate für die Ratte. Die Anzahl der Glomeruli pro Feld mit einem 20x-Objektiv (363 μm x 363 μm) wurde gezählt und in einer Grafik in Abbildung 1B dargestellt. Die Anzahl der Oberflächenglomeruli bei MWF-Ratten stieg von 1,08 ± 0,11/Feld bei unbehandelten Ratten auf 2,97 ± 0,65/Feld in der fünfwöchigen UUO-Gruppe. SD-Ratten stiegen nach 5 Wochen UUO von keinen Oberflächenglomeruli auf 2,02 ± 0,37/Feld.
Intravitale 2-Photonen-Bilder dieser Ratten wurden nach Injektion mit TR-RSA (rot), einem 10 kDa Kaskadenblau-Dextran (10 kDa-CB) und Hoechst 33342 aufgenommen, um die Kerne (Cyan) zu markieren. Diese werden für normale MWF-Ratten (Abbildung 1C), MWF-Ratten nach fünf Wochen UUO (Abbildung 1D) und SD-Ratten nach fünf Wochen UUO (Abbildung 1E) gezeigt. Diese Bilder zeigen dramatische Veränderungen, die in den röhrenförmigen Epithelien auftreten. Proximale Tubulus-Lysosomen, die normalerweise kleine punktförmige orangefarbene Ansammlungen in unbehandelten MWF- und SD-Ratten sind, werden zu großen singulären vakuolären Strukturen, die den Großteil der geschrumpften röhrenförmigen Zelle füllen. Wie im TR-RSA-Albumin beschrieben, schien das Gefäßsystem begradigt und in vielen Gefäßen frei von fließenden Erythrozyten zu sein, die nur strömendes Plasma zeigten. Die Fixierung der Nieren ergab, dass sich der Kortex zu einer faserigen Haut ausgedünnt hatte, die nicht dicker als ein Millimeter war. Diese Beobachtungen stimmen mit der frühen Literatur überein, die dieses Modellverwendet 3,10,11,12.
Veränderungen der renalen Gefäßdynamik und glomerulären Permeabilität
Der renale Blutfluss war sowohl in der fünfwöchigen UUO-MWF- als auch in der SD-Gruppe im Vergleich zu unbehandelten Ratten signifikant reduziert (Abbildung 2). Sham-betriebene MWF-Ratten hatten eine peritubuläre RBC-Flussrate von 885 ± 25 μm/s. Der peritubuläre RBC-Fluss bei fünfwöchigen UUO-MWF- und SD-Ratten sank auf 250 ± 100 μm/s bzw. 200 ± 125 μm/s. Diese Werte wurden berechnet, indem Linienscans über peritubuläre Gefäße gesammelt wurden, um die RBC-Geschwindigkeit zu berechnen. Abbildung 2D zeigt ein Diagramm dieser Daten.
Die RBC-Geschwindigkeit innerhalb der glomerulären Kapillarschleifen war bei den fünfwöchigen UUO MWF- und SD-Ratten im Vergleich zu unbehandeltem MWF signifikant verringert (Abbildung 3). In vielen Fällen wurde festgestellt, dass Glomeruli Kapillarschleifen ohne fließende Erythrozyten aufweisen. Die Kapillarschleifen-RBC-Durchflussraten betrugen 1.405 ± 425 μm/s, 250 ± 220 μm/s ± und 190 ± 200 μm/s oder unbehandelte MWF, fünfwöchige UUO MWF bzw. fünfwöchige UUO SD-Ratten (Abbildung 3D). Innerhalb der Kapillarschleifen der fünfwöchigen UUO-Gruppen zeigte der träge Fluss der RBCs das Vorhandensein von adhärenten Leukozyten, die den Fluss entweder verlangsamten oder blockierten, wobei nur der Plasmafluss stromabwärts von der teilweisen oder vollständigen Obstruktion sichtbar wurde. Um diese Beobachtung zu quantifizieren, wurde die Anzahl der adhärenten Leukozyten, die in einem 3D-Volumen gefunden wurden, gezählt und dann auf das Auftreten pro 10 μm 3D-Volumentiefe normalisiert. Die Struktur der anhaftenden weißen Blutkörperchen konnte mit dem Cyan-Kernfarbstoff Fluoreszenz von Hoechst 33342 erkannt werden. Leider beschränkte die größere Photonenstreuung von blau emittierenden Lichtern die zuverlässige Identifizierung von Leukozyten durch ihre Kerne auf die oberen 10 optischen Abschnitte von oben, die in 1μm-Schritten des glomerulären Volumens aufgenommen wurden. Unbehandelte MWF-Ratten hatten weniger als 0,125 ± 0,05 Leukozyten/10 optische Schnitte von oben, die bei einem Volumen von 1 μm aufgenommen wurden, während diese Zahl bei 5-wöchigen UUO-MWF- bzw. 5-wöchigen UUO-SD-Ratten auf 1,5 ± 0,5 bzw. 3,25 ± 0,7 anstieg (Abbildung 3E).
Eine weitere vaskuläre Veränderung, die auch für einen reduzierten RBC-Fluss in den 5-wöchigen UUO-Gruppen verantwortlich sein könnte, war das regelmäßige Auftreten von Rouleaux-Formationen (gruppierte RBCs, die in einer "gestapelten Münze" -Konfiguration haften, siehe Einschub von Abbildung 3F). Rouleaux-Formationen fließen langsamer und können durch einen adhärenten WBC gestoppt werden. Unbehandelte WMF-Ratten haben praktisch keine Rouleaux-Formationen in ihren glomerulären Kapillaren, mit nur 0,05 ± 0,05 Vorkommen pro 25 optische Schnitte von oben, die in 1 μm-Schritten aufgenommen werden. Die fünfwöchigen UUO-MWF- und SD-Ratten hatten einen deutlichen Anstieg der Rouleaux-Formationen von 2,27 ± 0,46 und 1,46 ± 0,73 pro 25 optische Schnitte, beginnend von oben, jeweils in Schritten von 1 μm (Abbildung 3F).
Zusätzlich zu der Verringerung der glomerulären RBC-Flussraten, die mit UUO beobachtet wurde, wurde eine Zunahme der Albuminpermeabilität beobachtet. Es gab eine größere Heterogenität in der Albuminpermeabilität zwischen Glomeruli. Gelegentlich war die Albuminansammlung im Bowman's Space intensiv genug, um deutlich gesehen zu werden (Abbildung 4B, Sternchen). Der glomeruläre Siebkoeffizient von Albumin stieg von 0,015 ± 0,002 in unbehandelten MWFs auf 0,045 ± 0,05 in 5-wöchigen UUO MWF und 0,052 ± 0,075 in fünfwöchigen UUO SD-Ratten.
Veränderte proximale Tubulusfunktion
Interessanterweise konnte das gefilterte Albumin in proximalen Tubuluszellen nach UUO nicht nachgewiesen werden. Das S1-Segment endozytiert normalerweise große Mengen Albumin27,28,29,30, wie hier unter physiologischen Bedingungen bei unbehandelten MWF-Ratten gezeigt (Abbildung 5A). Dieselbe Aufnahme konnte in der MWF oder SD PT nach 5 Wochen UUO nicht beobachtet werden (Abbildung 5B,C). Proximale Tubuli um die Glomeruli, die zwischen 45 und 60 Minuten nach der TR-RSA-Infusion abgebildet wurden, wurden entweder auf Vorhandensein (1) oder Abwesenheit (0) von Albumin untersucht. Es ist wichtig zu beachten, dass das S1-Segment unter physiologischen Bedingungen eifrig Albumin bindet und verinnerlicht, wobei wenig bis gar kein Albumin die distalen Tubuli oder Sammelkanäle erreicht. Daher liegt es nahe, dass die letzteren proximalen Tubulussegmente möglicherweise kein Albumin enthalten, was zu einer bruchteiligen Positivität für die Albuminaufnahme von weniger als 1,0 führt. Abbildung 5D zeigt eine Grafik mit den Ergebnissen der proximalen Tubulus-Albuminaufnahme. Unbehandeltes MWF hatte einen proximalen Tubulus-Teilaufnahmewert von 0,556 ± 0,126. Sowohl fünfwöchige UUO MWF- als auch SD-Ratten hatten signifikant niedrigere Werte von 0,049 ± 0,126 bzw. 0,00 ±0,00.
Studien wurden auch an 12-wöchigen UUO-MWF-Ratten abgeschlossen (Tabelle 1). Zwölf Wochen UUO ist die Standardzeit für Mausstudien, um Oberflächenglomeruli zu induzieren. Drei männliche UUO-Ratten wurden abgebildet, und die glomeruläre Dichte stieg bei diesen Ratten weiter auf 6,16 ± 1,83 Glomeruli pro 20x-Feld. Die RBC-Durchflussrate betrug 293 ± 67 μm/s, die Leukozytenadhäsion betrug 1,47 ± 1,12, beides ähnlich den 5-Wochen-UUO-Daten. Die GSC von Albumin stieg im Vergleich zu den 5-wöchigen UUO-Ratten ebenfalls auf 0,109 ± 0,04.
Glomeruläre mRNA-Veränderungen, die durch die chronische UUO induziert werden
Tabelle 2 zeigt alle Gene (Sonden) mit ihren gruppierten Expressions- und Standardabweichungswerten. Beachten Sie, dass Gene für die Analyse ausgewählt wurden, basierend auf früheren Dokumentationen der Veränderung der Nierenerkrankung, einschließlich UUO, wie in der Anmerkung von Protokoll Abschnitt 13 beschrieben. Abbildung 6 ist eine Heatmap der Daten, die die dramatischen Veränderungen der Genexpression für die meisten Gene in den UUO-Glomeruli im Vergleich zu Kontroll- oder Scheinglomeruli hervorheben.
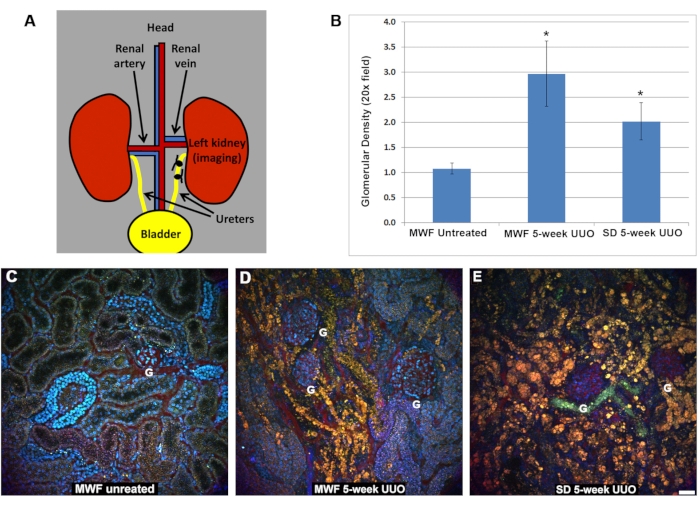
Abbildung 1: Anstieg der Anzahl der Oberflächenglomeruli und Induktion von Oberflächenglomeruli bei SD-Ratten nach 5-wöchiger UUO bei MWF-Ratten. (A) Ein chirurgisches Diagramm des Harnleiters an der linken Niere, das sorgfältig von der Nierenarterie und Vene befreit wurde, bevor es mit zwei Bindungen unter Verwendung einer chirurgischen Naht verschlossen wird. (B) Eine Grafik, die die Zunahme der Anzahl der Oberflächenglomeruli bei MWF-Ratten vor und fünf Wochen nach UUO zusammen mit der Anzahl der Oberflächenglomeruli bei SD-Ratten zeigt, die normalerweise keine Oberflächenglomeruli haben. Die Anzahl der Oberflächenglomeruli bei MWF-Ratten stieg von 1,08 ± 0,11/Feld bei unbehandelten Ratten auf 2,97 ± 0,65/Feld in der 5-wöchigen UUO-Gruppe. SD-Ratten stiegen von keiner Oberflächenglomeruli auf 2,02 ± 0,37/Feld. Dreidimensional rekonstruierte Bilder zeigen die Nierenoberfläche für unbehandelte MWF (C), MWF nach 5-wöchiger UUO (D) und SD nach fünfwöchiger UUO (E). Beachten Sie das Auftreten großer, orangefarbener vakuolärer Strukturen, die von kleinen einzelnen Lysosomen zu großen abnormalen Körpern verschmolzen sind. Die 5-wöchige UUO bei SD-Ratten führte nicht zu Bereichen, die normalen tubulären Epithelien ähnelten, die in C und teilweise in D beobachtet wurden. Das Gefäßsystem schien in einigen Regionen begradigt zu sein und hatte in vielen partielle Okklusionen, die Plasma, aber keine Erythrozyten fließen ließen. (n = 3 männliche Ratten pro Gruppe) Maßstabsbalken = 40 μm. Fehlerbalken zeigen die Standardabweichung an. Abkürzungen: UUO = unilaterale Harnleiterobstruktion; SD = Sprague-Dawley; MWF = München Wistar Frömter; G = Glomerulus; RBCs = rote Blutkörperchen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
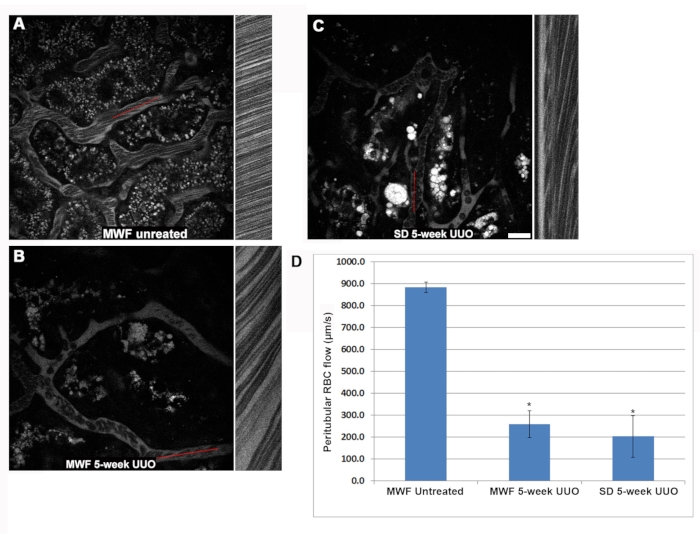
Abbildung 2: Reduktion des RBC-Flusses innerhalb des oberflächlichen peritubulären Gefäßsystems nach 5-wöchiger UUO. Linescans wurden in peritubulären Blutgefäßen gesammelt, um die RBC-Flussgeschwindigkeit in μm / s zu bestimmen. Kurz gesagt, die roten Referenzlinien in A, B und C stellen einen kleinen Bereich dar, in dem der gleiche pixelbreite Bereich wiederholt gescannt wurde, und die Bilder in einer Spalte gestapelt, um die Verzerrung zu visualisieren, die durch die fließenden RBCs verursacht wird, die sich schneller bewegen, als das Mikroskop sie erfassen kann. Die Spalte neben der Referenzfigur ist der Linescan, wobei die Steigung der RBC-Verzerrung zur Berechnung der Geschwindigkeit verwendet wird (x-Achse = Entfernung und y-Achse = Zeit). Hier entsprechen zunehmend steilere Steigungen langsameren RBC-Geschwindigkeiten, da sie länger im Linienbereich bleiben. Beachten Sie den Unterschied im Auftreten der RBCs bei unbehandelten MWF-Ratten (A) im Vergleich zu den fünfwöchigen UUO-Bildern für die MWF (B) und SD (C) -Ratten. Die RBC-Strömungsgeschwindigkeiten für die drei Rattengruppen sind in D dargestellt. Der peritubuläre RBC-Fluss in unbehandelten MWFs betrug durchschnittlich 885 ± μm/s. Diese Werte fielen fünf Wochen nach UUO bei MWF- und SD-Ratten signifikant auf 250 ± 100 μm/s bzw. 200 ± 125 μm/s. Maßstabsbalken = 20 μm, n = 3 männliche Ratten pro Gruppe. Fehlerbalken zeigen die Standardabweichung an. Abkürzungen: UUO = unilaterale Harnleiterobstruktion; SD = Sprague-Dawley; MWF = München Wistar Frömter; RBC = rote Blutkörperchen; WBC = weiße Blutkörperchen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
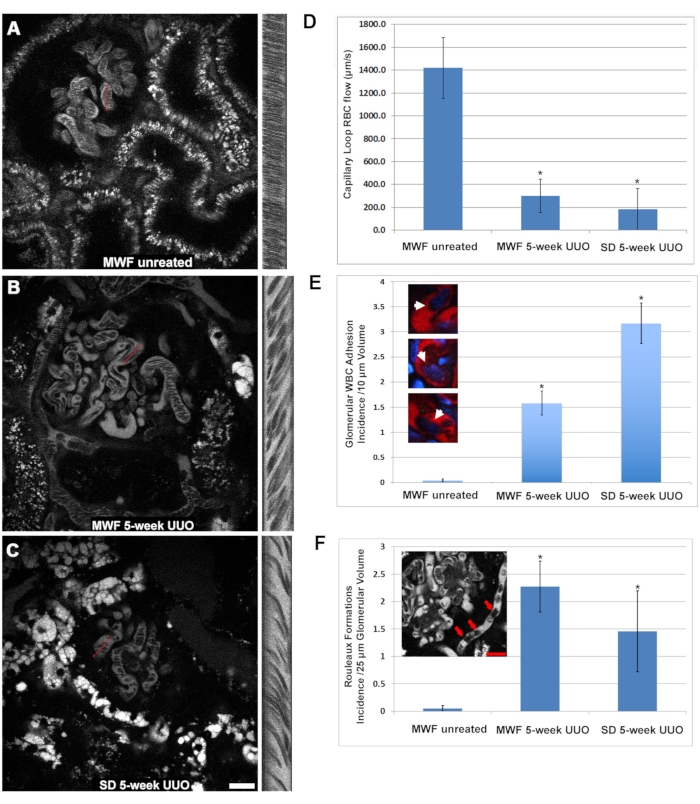
Abbildung 3: Signifikante Reduktion des glomerulären Kapillarschleifen-RBC-Flusses und induzierte Aktivierung der Leukozytenadhäsion durch 5-wöchige UUO. Der gleiche Linescan-Ansatz, der zur Bestimmung des peritubulären RBC-Flusses verwendet wurde, wurde verwendet, um Veränderungen im glomerulären kapillaren Blutfluss zu untersuchen. Die Panels A, B und C zeigen ein ähnliches Layout wie Abbildung 2 und konzentrieren sich auf einen Glomerulus in scheinbetriebenen MWF, fünfwöchigen UUO MWF bzw. fünfwöchigen UUO SDs. (D) Eine Grafik, die die physiologisch hohe RBC-Flussrate in den Kapillarschleifen von scheinbetriebenen MWF-Ratten mit durchschnittlich 1.405 ± 425 μm/s ± 425 zeigt, verringerte sich auf 250 ± 220 μm/s bzw. 190 ± 200 μm/s für die 5-wöchigen UUO MWF- bzw. 5-wöchigen UUO SD-Ratten. Bei der Untersuchung der glomerulären Kapillarschleifen waren adhärente Leukozyten während der Fokussierung durch den Glomerulus gut sichtbar. Dreidimensionale optische Schnitte einzelner Glomeruli wurden aufgenommen, und die ersten 10 optischen Schnitte, die 1 μm voneinander entfernt waren, wurden verwendet, um die Anzahl der adhärenten Leukozyten zu messen. Unbehandelte MWF-Ratten hatten praktisch keine sichtbaren Leukozyten in ihren Volumina, durchschnittlich weniger als 0,125 ± 0,05 Leukozyten/10 optische Schnitte von oben, die in 1μm-Schritten entnommen wurden. Bei 5-wöchigen UUO-MWF- und SD-Ratten stiegen diese Zahlen auf 1,5 ± 0,5 und 3,25 ± 0,7 Leukozyten/10 optische Schnitte von oben, jeweils in Schritten von 1 μm. Diese Ergebnisse sind in der Grafik in Panel E dargestellt, mit Farbeinsätzen, die Leukozyten zeigen, die Kapillarschleifen verschließen. Rouleaux-Formationen (Pfeile, Einschub in Panel F) erscheinen als RBCs, die in einer "gestapelten Münze" -Konfiguration eng miteinander verbunden sind und ihre gebündelte Gruppierung auch in den Turbulenzen des Blutflusses weitgehend beibehalten. Diese pathologischen Strukturen waren in größeren Tiefen innerhalb des Glomerulus leicht erkennbar. Sham-betriebene MWF-Ratten waren weitgehend frei von diesen Strukturen und hatten nur 0,05 ± 0,05 Vorkommen 25 optische Schnitte von oben, aufgenommen in 1 μm Schritten glomerulären Volumens. Im Gegensatz dazu hatte die 5-wöchige UUO sowohl bei MWF- als auch bei SD-Ratten einen deutlichen Anstieg der Rouleaux-Formationen mit Vorkommen von 2,27± 0,46 bzw. 1,46 ± 0,73/25 optischen Schnitten von oben, die in Schritten von 1 μm aufgenommen wurden. Maßstabsbalken = 20 μm, n = 3 männliche Ratten pro Gruppe. Fehlerbalken zeigen die Standardabweichung an. Abkürzungen: UUO = unilaterale Harnleiterobstruktion; SD = Sprague-Dawley; MWF = München Wistar Frömter; RBC = rote Blutkörperchen; WBC = weiße Blutkörperchen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
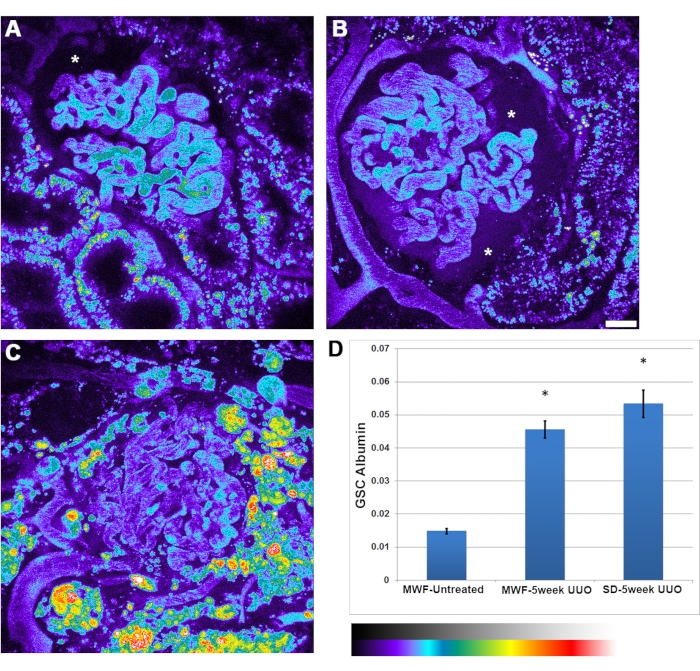
Abbildung 4: Signifikanter Anstieg der glomerulären Kapillaralbuminpermeabilität nach 5-wöchiger UUO. Die Panels A, B und C zeigen Pseudofarbbilder eines 3D-Volumens für den Rattenserumalbuminkanal bei unbehandelten MWF-, 5-wöchigen UUO-MWF- bzw. fünfwöchigen UUO-SD-Ratten. Die Bilder werden in einer Pseudofarbpalette präsentiert, um die beträchtliche Menge an gefiltertem Albumin hervorzuheben, die im Raum des Bowman zu sehen ist, insbesondere in Panel B (Sternchen). (A) Der Bowman-Raum (Sternchen) zeigt den normalen Albuminspiegel, der typischerweise bei unbehandelten MWF-Ratten beobachtet wird und für das Auge nicht wahrnehmbar ist. Bilder von Glomeruli wurden vor der Infusion von Albumin aufgenommen, um Hintergrundfluoreszenzwerte von denen nach Albumingabe zu subtrahieren. (D) Eine Grafik mit dem glomerulären Siebkoeffizienten für Albumin bei unbehandelten MWF-Ratten mit einem Wert von 0,015 ± 0,002. Dieser Wert stieg signifikant auf 0,045± 0,05 bei 5-wöchigen UUO MWF-Ratten und 0,052 ± 0,075 bei fünfwöchigen UUO SD-Ratten. Dieser Parameter ist ein Verhältniswert der Fluoreszenzintensitäten des Bowman-Raums dividiert durch den Plasmawert und hat keine zugehörige Maßeinheit. Maßstabsbalken = 20 μm, n = 3 männliche Ratten pro Gruppe. Die Pseudofarbintensitätsskala befindet sich unterhalb von Feld D. Fehlerbalken zeigen die Standardabweichung an. Abkürzungen: UUO = unilaterale Harnleiterobstruktion; SD = Sprague-Dawley; MWF = München Wistar Frömter; RBC = rote Blutkörperchen; WBC = weiße Blutkörperchen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
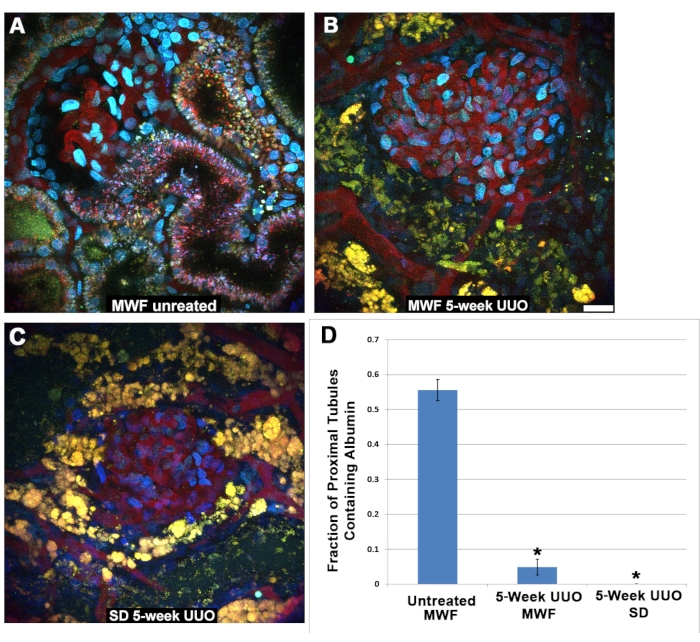
Abbildung 5: Reduzierte Funktion in proximalen Tubuli nach 5-wöchiger UUO. (A) Ein Bild eines oberflächlichen Glomerulus und des S1-Segments einer normalen Münchner Wistar Frömter-Ratte, aufgenommen 40 min nach Infusion von TR-RSA und Cascade Blue Dextran. Die Internalisierung des TR-RSA ist im S1-Segment und im proximalen Tubulus zu sehen. Im Gegensatz dazu zeigen MWF-Ratten (B) und SD-Ratten (C), die einer 5-wöchigen UUO unterzogen wurden, stark veränderte proximale Tubuli mit minimaler oder keiner Aufnahme von TR-RSA. Die normalerweise kleinen, punktförmigen autofluoreszierenden Lysosomen (A) werden zu großen und vakuolären gelb-orangen Strukturen, oft mit einem vollständigen Kollaps des röhrenförmigen Lumens, die in den dreidimensionalen Datensätzen nicht zu finden sind. (C) Distale Tubuli, die normalerweise keine Form von Autofluoreszenz aufweisen, enthalten jetzt autofluoreszierende Ansammlungen. Die Bewertung der proximalen Tubuli um die Glomeruli in ähnlichen Bildern, die 45-60 Minuten nach der Infusion aufgenommen wurden, zur Albuminaufnahme zeigte einen signifikanten Unterschied zwischen der scheinoperierten MWF-Gruppe und beiden 5-wöchigen UUO-Gruppen. Unbehandelte MWF-Ratten hatten einen proximalen Tubulus-Teilaufnahmewert von 0,556 ± 0,126. Sowohl fünfwöchige UUO MWF- als auch SD-Ratten hatten signifikant niedrigere Werte von 0,049 ± 0,126 bzw. 0,00 ±0,00. Maßstabsbalken = 20 μm, n = 3 männliche Ratten pro Gruppe. Fehlerbalken zeigen die Standardabweichung an. Abkürzungen: UUO = unilaterale Harnleiterobstruktion; SD = Sprague-Dawley; MWF = München Wistar Frömter; RBC = rote Blutkörperchen; Leukozyten = weiße Blutkörperchen; TR-RSA = Texas Red Ratte Serumalbumin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
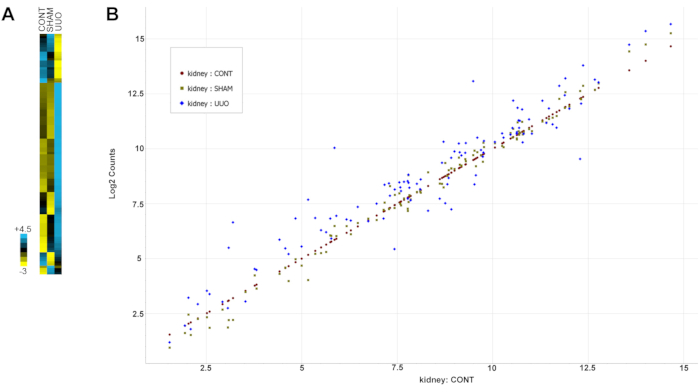
Abbildung 6: Veränderungen der Genexpression mit UUO . (A) Eine Heatmap der Daten. (B) Normalisierte Genveränderungen für alle Daten in einem Streudiagramm. Die Expression von Genen in den Kontrollnieren wurde von niedriger bis hoher Expression dargestellt, und die Gene von SHAM- und UUO-Nieren wurden mit den Kontrollexpressionsniveaus verglichen. Gendatenpunkte, die nahe am diagonalen Wert der Kontrollgene liegen, zeigen ähnliche Expressionsniveaus für beide Gruppen an, während Datenpunkte über oder unter der Diagonale höhere bzw. niedrigere Expressionsniveaus anzeigen. Beachten Sie, dass die SHAM-Gene näher an der Kontrolldiagonalexpression gruppieren als die UUO-Gene, die variabler sind. Abkürzung: UUO = unilaterale Harnleiterobstruktion. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Tabelle 1: Verlauf der Verletzung von 5 bis 12 Wochen UUO. Vergleich von 5- und 12-wöchigen UUO-Bildgebungsparametern bei drei männlichen MWF-Ratten und drei männlichen SD-Ratten zu jedem Zeitpunkt. Die Fünf-Wochen-Daten sind die gleichen wie in den vorherigen Zahlen. Beachten Sie die Zunahme der glomerulären Dichte und die GSC für Albumin mit fortgesetzter UUO. Abkürzungen: UUO = unilaterale Harnleiterobstruktion; SD = Sprague-Dawley; MWF = München Wistar Frömter; GSC = glomerulärer Siebkoeffizient. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Analyse von Entzündungsmarkern in Glomeruli von UUO und Kontrollratten. Gensondenpaare und CodeSets wurden gemäß den Anweisungen von NanoString entworfen und verwendet. Über 100 Gene wurden analysiert, plus Positiv- und Negativkontrollen gemäß Nanostring. Alle Gene (Sonden) mit ihren gruppierten Expressions- und SD-Werten sind in der Tabelle dargestellt. Abbildung 6A ist eine Heatmap der Daten, während Abbildung 6B die Genveränderungen für alle Daten in einem Streudiagramm darstellt. Beachten Sie die Ähnlichkeiten zwischen Kontrollen und SHAM und deutliche Veränderungen für die meisten Gene in der UUO. Abkürzungen: UUO = unilaterale Harnleiterobstruktion; SD = Standardabweichung. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Das Studium der glomerulären Physiologie hat viele verschiedene Ansätze gesehen, vor allem die Verwendung von Mikropunktion, Perfusion von isolierten Glomeruli und Mikroskopie. Die Verfügbarkeit von Oberflächenglomeruli in München Wistar-Ratten, Fromter- und Simonsen-Stämmen hat dynamische In-vivo-Studien ermöglicht. Ein wichtiger Hinweis für Forscher, die diese Technologie anwenden, ist die Notwendigkeit, Aufnahmeparameter festzulegen, um konsistente Bilder zwischen den Studien zu erhalten, damit die Autofluoreszenz im Gewebe konsistent bleibt. Die Verwendung eines Dual-Pass-Fluorescein/Rhodamin-Epifluoreszenzwürfels und die Anpassung der Verstärkungseinstellungen an die grünen und roten Emissionskanäle, um auf dem Computerbildschirm nachzuahmen, was durch die Okulare gesehen wird, gewährleistet eine konsistente Farbsignatur in der Autofluoreszenz auch zwischen verschiedenen Mikroskopsystemen.
Der Fromter-Stamm wurde ausgiebig verwendet, da er eine reduzierte Anzahl von Gesamtglomeruli aufweist, ~ 75% normal, und die Männchen entwickeln spontan Bluthochdruck im Alter von etwa 12 Wochen, mit progressiver Proteinurie und anschließender fokaler glomerulärer Sklerose, die schließlich an Nierenversagen sterben12. Die Verwendung dieser Ratten und die Zugabe der 2-Photonenmikroskopie mit ihrer reduzierten Phototoxizität, der verbesserten Eindringtiefe und der Möglichkeit, mehrere fluoreszierende Sonden gleichzeitig zu betrachten, ebneten den Weg für neue Entdeckungen 1,4,5. Mit der Entwicklung von Computerhardware und -software sind quantitative Daten heute der Standard für alle 2-Photonen-Labore. Mehrere quantitative Techniken wurden entwickelt und auf glomeruläre, proximale Tubulus, vaskuläre und interstitielle Prozesse unter physiologischen und Krankheitsbedingungenangewendet 1,4,5,27,28,29,30.
Transgene Mauserzeugungsanlagen fügten dem Studium der Nierenphysiologie und -pathologie eine neue Dimension hinzu, und es war nur eine Frage der Zeit, bis dies mit der 2-Photonenmikroskopie kombiniert wurde, um die Bedeutung spezifischer Genprodukte für die Nierenstruktur und -funktion weiter abzugrenzen. Glomeruli der Maus befinden sich jedoch, außer bei sehr jungen Mäusen, über 100 μm von der Oberfläche der Niereentfernt 9. Die Zwei-Photonen-Mikroskopie wird am besten in einer Tiefe zwischen 20 und 50 μm als Auflösung durchgeführt, und die Fluoreszenzintensität nimmt danach aufgrund der Lichtstreuung des emittierten Lichts und der Absorption durch Wechselwirkung mit Hämoglobin schnell ab. Daher war es notwendig, Oberflächenglomeruli zu induzieren. Der üblicherweise verwendete Ansatz ist ein verlängertes einseitiges Obstruktionsmodell für 12 Wochen. Da diese Modelle keine Baseline-Bestimmungen zulassen, ist eine Trennung der Wirkungen von UUO vom untersuchten Prozess nicht möglich.
Unter Verwendung von MWF-Ratten kann man die glomeruläre Baseline-Funktion mit der folgenden UUO vergleichen. Dieses UUO-Modell ist dafür bekannt, Entzündungen und eine schnelle Fibroserate zu induzieren und wurde verwendet, um CKD und Fibrose zu untersuchen10,11,12. Wie erwartet, gab es sowohl bei den MWF- als auch bei den SD-Ratten eine Zunahme der Oberflächenglomeruli. Darüber hinaus waren die quantitativen Ergebnisse, die nach UUO für die MWF- und SD-Ratten erzielt wurden, sehr vergleichbar. Die hier aufgezeichnete Verringerung des Blutflusses wurde zuvor berichtet, indem mikroskopische Daten nach UUO mit Mikropunktionsdaten verglichen wurden3. Es war auch bekannt, dass die tubuläre und interstitielle Histologie deutlich verändert ist und die PTs meist nicht-funktional sind, wie hier berichtet, mit einem Mangel an Albumin-Endozytose. Die Studien in Abbildung 2 und Abbildung 3 zeigen eine dramatische Verringerung der RBC-Flussrate in glomerulären und peritubulären Kapillaren und eine verbesserte Leukozytenadhäsion. Die Verringerung der Strömung ist wahrscheinlich auf Kapillarblockaden durch Leukozytenadhäsion und Rouleaux-Formationen zurückzuführen.
Um die Entzündung weiter zu bewerten, quantifizierten wir die Albuminpermeabilität und zeigten, dass sie sich verzehnfacht. Darüber hinaus zeigten isolierte Glomeruli, dass die mRNA-Expression für viele Gene zunahm, von denen bisher bekannt war, dass sie bei Nierenentzündungen in einer Vielzahl von Nierenerkrankungszuständen erhöht waren 17,19,20,21,22,23,24,25,26 . Die Zunahme der glomerulären Oberflächendichte und der Albuminpermeabilität war progressiv, wie die 12-Wochen-UUO-Daten zeigen. Die vorliegenden Daten sind die ersten, die direkt zeigen, dass Glomeruli signifikante strukturelle Schäden, Entzündungen und molekulare Veränderungen im UUO-Modell erfahren. Die Ergebnisse stimmen mit einer früheren Studie des gesamten Nierengewebes überein, die Nierenbiopsien von Schafen nach UUO analysierte und mehrere Entzündungsmarker mit erhöhten19 fand. Die vorliegenden Ergebnisse deuten auf eine ausgeprägte Entzündung innerhalb der Glomeruli hin, die bisher nur für kortikales Gewebe bekannt waren.
Die vorliegenden Daten unterscheiden sich von früheren Studien an Mäusen, bei denen keine Veränderungen in der Adhäsionsmolekülexpression, Komplementablagerung und Neutrophileninfiltration zwischen 12-wöchigen posthydronephrotischen und normalen Glomeruli gefunden wurden31. Darüber hinaus verwendete das Hickey-Labor das 12-wöchige UUO-Modell, um Immunreaktionen in Glomeruli von Mäusen zu untersuchen. Sie fanden keine Unterschiede in der Neutrophileninfiltration zwischen vier Wochen alten Glomeruli der Maus und postobstruktiven Glomeruli32,33. Diese späteren Studien wurden durchgeführt, nachdem das Becken der verstopften Niere vom Urin befreit wurde. Wir haben dies nicht getan, da wir die Wirkung von UUO auf die glomeruläre Funktion in vivo bestimmen wollten, ohne die Flüssigkeit, die die Obstruktion verursacht, künstlich zu entfernen. Schließlich wird die Verwendung von UUO bei Mäusen durch die Bildgebung von Glomeruli bei mehr als 100 μm unter der Oberfläche ersetzt. Obwohl möglich, gibt es einen Kompromiss zwischen Auflösung und Intensität, die beide signifikant reduziert werden, wenn man über 50 μm34 hinausgeht.
Die vorgestellten Ergebnisse sind nicht überraschend, wenn man die Daten aus der vorhandenen Literatur zu histologischen Veränderungen, Bildung von atubulären Glomeruli, Entzündungen, Fibrose, Hämodynamik zusammenfügt10,11,12. Die vorgestellten Daten, einschließlich Leukozytenadhäsion, Rouleaux-Formationen, glomerulären molekularen Entzündungsmarkern und erhöhter Albuminpermeabilität, deuten weiter auf die ausgedehnte Entzündung hin, die in diesem UUO-Modell auch nach fünf Wochen andauert und auch nach zwölf Wochen vorhanden ist. Es ist klar, dass chronische UUO kein physiologischer Zustand ist, und die Verwendung von UUO zur Induktion von Oberflächenglomeruli stellt ein Verletzungsmodell dar. Die MWF-Ratten, die unter physiologischen Bedingungen oberflächliche Glomeruli aufweisen, können longitudinal untersucht werden, wenn eine Verletzung auftritt. Es ist möglich, transgene Ratten zu erzeugen, und zahlreiche Forscher erzeugen sie mit Biosensoren, um spezifische Fragen zu stellen. Insbesondere das Medical College of Wisconsin hat jetzt eine Kolonie von MWF-Ratten und hat transgene Ratten hergestellt, um glomeruläre Prozesse unter physiologischen und pathologischen Bedingungen zu untersuchen. Diese MWF-Ratten bieten eine großartige Gelegenheit, glomeruläre Prozesse bei normalen, kranken und genetisch veränderten Ratten zu untersuchen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte.
Danksagungen
Diese Arbeit wurde vom National Institute of Diabetes and Digestive and Kidney Diseases Grants RO1DK091623 und P30DK079312 (an B.A.M.) unterstützt. Wir danken den Mitarbeitern der Genomics Core Facility der Research Technology Support Facility (RTSF) der Michigan State University für die Durchführung der Nanostring-Analyse.
Materialien
| Name | Company | Catalog Number | Comments |
| 70 µm sterile cell strainer | Corning | #421751 | |
| 100 µm sterile cell strainer | Corning | #421752 | |
| CA Micro scissors Model 1C300 | Electron Microscopy Sciences | Cat# 72930 | |
| Electric heating pad | Sunbeam | Kroger | |
| Handling Forceps | Electron Microscopy Sciences | Cat# 72962 | |
| Kelly Hemostatic Forceps (straight) | Electron Microscopy Sciences | Cat#72930 | |
| Leica Dive SP-8 Multi-Photon Inverted Microscope | Leica Microsystems | Note: Version 7.1r1 | |
| MaiTai DeepSee titanium-sapphire laser | Spectra-Physics | NA | |
| Mayo Dissecting Scissors | Electron Microscopy Sciences | Cat# 78180-1C3 | |
| Metamorph Image processing Software | Molecular Dynamics | Cat# 78266-04 | |
| Microsoft Excel | Microsoft Corportation | 2007 version | |
| Quant-iT RNA Assay Kit | Invitrogen/ThermoFisher | Q33140 | |
| Reptitherm Undertank Heater | Zoomed | Amazon | |
| RNeasy MinElute Cleanup Kit (Spin columns) | Qiagen | 74204 | |
| RPE buffer | Qiagen | 1018013 | |
| Strate-Line Autoclave Tape | Fisher Scientific | Cat# 11-889-1 | |
| TRI Reagent | Sigma | T9424 | |
| Willco-dish Coverslip Bottom Dishes (50 mm/40 mm coverslip) | Electron Microscopy Sciences | Cat# 70665-07 |
Referenzen
- Dunn, K. W., Molitoris, B. A., Dagher, P. C. The Indiana O'Brien center for advanced renal microscopic analysis. American Journal of Physiology-Renal Physiology. 320 (5), 671-682 (2021).
- Dunn, K. W., et al. Functional studies of the kidney of living animals using multicolor two-photon microscopy. American Journal of Physiology-Cell Physiology. 283 (3), 905-916 (2002).
- Eisenbach, G., Liew, J., Boylan, J., Manz, N., Muir, P. Effect of angiotensin on the filtration of protein in the rat kidney: a micropuncture study. Kidney International. 8 (2), 80-87 (1975).
- Sandoval, R. M., Molitoris, B. A. Intravital multiphoton microscopy as a tool for studying renal physiology and pathophysiology. Methods. 128, 20-32 (2017).
- Sandoval, R. M., Molitoris, B. A., Palygin, O. Fluorescent imaging and microscopy for dynamic processes in rats. Methods in Molecular Biology. 2018, 151-175 (2019).
- Huber, T., et al. Molecular basis of the functional podocin-nephrin complex: mutations in the NPHS2 gene disrupt nephrin targeting to lipid raft microdomains. Human Molecular Genetics. 12 (24), 3397-3405 (2003).
- Kawachi, H., Koike, H., Kurihara, H., Sakai, T., Shimizu, F. Cloning of rat homologue of podocin: expression in proteinuric states and in developing glomeruli. Journal of the American Society of Nephrology JASN. 14 (1), 46-56 (2003).
- Roselli, S., et al. Early glomerular filtration defect and severe renal disease in podocin-deficient mice. Molecular and Cellular Biology. 24 (2), 550-560 (2004).
- Schießl, I., Bardehle, S., Castrop, H. Superficial nephrons in BALB/c and C57BL/6 mice facilitate in vivo multiphoton microscopy of the kidney. PloS One. 8 (1), 52499 (2013).
- Chevalier, R., Forbes, M., Thornhill, B. Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy. Kidney International. 75 (11), 1145-1152 (2009).
- Forbes, M., Thornhill, B., Chevalier, R. Proximal tubular injury and rapid formation of atubular glomeruli in mice with unilateral ureteral obstruction: a new look at an old model. American Journal of Physiology. Renal physiology. 301 (1), 110-117 (2011).
- Yang, H. -. C., Zuo, Y., Fogo, A. B. Models of chronic kidney disease. Drug Discovery Today. Disease Models. 7 (1-2), 13-19 (2010).
- Hackl, M. J., et al. Tracking the fate of glomerular epithelial cells in vivo using serial multiphoton imaging in new mouse models with fluorescent lineage tags. Nature Medicine. 19 (12), 1661-1666 (2013).
- Kitching, A., Kuligowski, M., Hickey, M. In vivo imaging of leukocyte recruitment to glomeruli in mice using intravital microscopy. Methods in Molecular Biology. 466, 109-117 (2009).
- Savin, V. J., Terreros, D. A. Filtration in single isolated mammalian glomeruli. Kidney International. 20 (2), 188-197 (1981).
- Chomczynski, P., Sacchi, N. The single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction: twenty-something years on. Nature Protocols. 1 (2), 581-585 (2006).
- El Karoui, K., et al. Endoplasmic reticulum stress drives proteinuria-induced kidney lesions via Lipocalin 2. Nature Communications. 7, 10330 (2016).
- VA, M., et al. Multiplexed measurements of gene signatures in different analytes using the Nanostring nCounter Assay System. BMC Research Notes. 2, 80 (2009).
- Springer, A., et al. A combined transcriptome and bioinformatics approach to unilateral ureteral obstructive uropathy in the fetal sheep model. The Journal of Urology. 187 (2), 751-756 (2012).
- Braun, F., Becker, J., Brinkkoetter, P. Live or let die: Is there any cell death in podocytes. Seminars in Nephrology. 36 (3), 208-219 (2016).
- Kim, W. The role of angiopoietin-1 in kidney disease. Electrolyte & Blood Pressure E & BP. 6 (1), 22-26 (2008).
- Liu, F., Zhuang, S. Role of receptor tyrosine kinase signaling in renal fibrosis. International Journal of Molecular Sciences. 17 (5), 972 (2016).
- Martini, S., et al. Integrative biology identifies shared transcriptional networks in CKD. Journal of the American Society of Nephrology: JASN. 25 (11), 2559-2572 (2014).
- Mühlberger, I., et al. Integrative bioinformatics analysis of proteins associated with the cardiorenal syndrome. International Journal of Nephrology. 2011, 809378 (2010).
- Satirapoj, B., et al. Periostin: novel tissue and urinary biomarker of progressive renal injury induces a coordinated mesenchymal phenotype in tubular cells. Nephrology, Dialysis, Transplantation. 27 (7), 2702-2711 (2012).
- Fengxin, Z., et al. Numb contributes to renal fibrosis by promoting tubular epithelial cell cycle arrest at G2/M. Oncotarget. 7 (18), 25604-25619 (2016).
- Sandoval, R. M., Molitoris, B. A. Quantifying glomerular permeability of fluorescent macromolecules using 2-photon microscopy in Munich Wistar rats. Journal of Visualized Experiments: JoVE. (74), e50052 (2013).
- Russo, L. M., et al. Impaired tubular uptake explains albuminuria in early diabetic nephropathy. Journal of the American Society of Nephrology: JASN. 20 (3), 489-494 (2009).
- Russo, L. M., et al. The normal kidney filters nephrotic levels of albumin retrieved by proximal tubule cells: retrieval is disrupted in nephrotic states. Kidney International. 71 (6), 504-513 (2007).
- Sandoval, R. M., Wang, E., Molitoris, B. A. Finding the bottom and using it: Offsets and sensitivity in the detection of low intensity values in vivo with 2-photon microscopy. Intravital. 2 (1), 23674 (2014).
- Kuligowski, M. P., Kitching, A. R., Hickey, M. J. Leukocyte recruitment to the inflamed glomerulus: a critical role for platelet-derived P-selectin in the absence of rolling. Journal of Immunology. 176 (11), 6991-6999 (2006).
- Devi, S., et al. Multiphoton imaging reveals a new leukocyte recruitment paradigm in the glomerulus. Nature Medicine. 19 (1), 107-112 (2013).
- Finsterbusch, M., et al. Patrolling monocytes promote intravascular neutrophil activation and glomerular injury in the acutely inflamed glomerulus. Proceedings of the National Academy of Sciences of the United States of America. 113 (35), 5172-5181 (2016).
- Shroff, U. N., Gyarmati, G., Izuhara, A., Deepak, S., Peti-Peterdi, J. A new view of macula densa cell protein synthesis. American Journal of Physiology. Renal Physiology. 321 (6), 689-704 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten