Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Optroden-Array zur simultanen optogenetischen Modulation und elektrischen neuronalen Aufzeichnung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier stellen wir das Herstellungsverfahren eines Optrode-Systems mit optischen Fasern für die Lichtabgabe und einem Elektrodenarray für die neuronale Aufzeichnung vor. In-vivo-Experimente mit transgenen Mäusen, die Kanalrhodopsin-2 exprimieren, zeigen die Machbarkeit des Systems für die gleichzeitige optogenetische Stimulation und elektrophysiologische Aufzeichnung.
Zusammenfassung
In den letzten zehn Jahren ist die Optogenetik aufgrund ihrer einzigartigen Fähigkeit zur selektiven neuronalen Modulation oder Überwachung zu einem wesentlichen Werkzeug für die Untersuchung neuronaler Signale geworden. Da bestimmte Arten von neuronalen Zellen genetisch verändert werden können, um Opsin-Proteine zu exprimieren, ermöglicht die Optogenetik die optische Stimulation oder Hemmung der ausgewählten Neuronen. Es gab mehrere technologische Fortschritte im optischen System für die Optogenetik. Vor kurzem wurde vorgeschlagen, den Lichtwellenleiter für die Lichtabgabe mit elektrophysiologischer Aufzeichnung zu kombinieren, um gleichzeitig die neuronalen Reaktionen auf optogenetische Stimulation oder Hemmung zu überwachen. In dieser Studie wurde ein implantierbares Optrode-Array (2x2 optische Fasern) mit eingebetteten Mehrkanalelektroden entwickelt.
Eine Leuchtdiode (LED) wurde als Lichtquelle verwendet, und ein mikrofabriziertes Mikrolinsenarray wurde integriert, um eine ausreichende Lichtleistung an der Spitze der optischen Fasern bereitzustellen. Das optrode Array-System besteht aus dem Einwegteil und dem Mehrwegteil. Der Einwegteil verfügt über optische Fasern und Elektroden, während der wiederverwendbare Teil über die LED und die elektronische Schaltung für die Lichtsteuerung und die neuronale Signalverarbeitung verfügt. Das neuartige Design des implantierbaren Optrode-Array-Systems wird im begleitenden Video zusätzlich zum Ablauf der Optrode-Implantationschirurgie, der optogenetischen Lichtstimulation und der elektrophysiologischen neuronalen Aufzeichnung vorgestellt. Die Ergebnisse von In-vivo-Experimenten zeigten erfolgreich zeitgebundene neuronale Spikes, die durch die Lichtreize von Hippocampus-erregenden Neuronen von Mäusen hervorgerufen wurden.
Einleitung
Die Aufzeichnung und Kontrolle der neuronalen Aktivität ist unerlässlich, um zu verstehen, wie das Gehirn in einem neuronalen Netzwerk und auf zellulärer Ebene funktioniert. Herkömmliche elektrophysiologische Aufzeichnungsmethoden umfassen die Patch-Klemme 1,2,3,4 mit einer Mikropipette und die extrazelluläre Aufzeichnung mit mikroneuralen Elektroden 5,6,7,8. Als Neuromodulationsmethode wurde die elektrische Stimulation häufig verwendet, um eine fokale Hirnregion durch direkte oder indirekte Depolarisation neuronaler Zellen direkt zu stimulieren. Das elektrische Verfahren kann jedoch keine neuronalen Zelltypen zur Aufzeichnung oder Stimulation unterscheiden, da sich die elektrischen Ströme in alle Richtungen ausbreiten.
Als aufstrebende Technologie hat die Optogenetik eine neue Ära eingeleitet, um zu verstehen, wie das Nervensystem funktioniert 9,10,11,12,13,14,15,16. Das Wesen der optogenetischen Techniken besteht darin, Licht zu verwenden, um die Aktivität von lichtempfindlichen Opsinproteinen zu kontrollieren, die von genetisch veränderten Zellen exprimiert werden. So ermöglicht die Optogenetik die ausgeklügelte Modulation oder Überwachung genetisch selektierter Zellen in komplizierten neuronalen Schaltkreisen14,17. Die breitere Anwendung des optogenetischen Ansatzes erforderte eine gleichzeitige neuronale Aufzeichnung, um die optische Neuromodulation direkt zu bestätigen. Daher wäre ein integriertes Gerät mit Lichtsteuerungs- und Aufzeichnungsfunktionen äußerst wertvoll 16,18,19,20,21,22,23,24,25.
Es gibt Einschränkungen der herkömmlichen, laserbasierten optogenetischen Stimulation, die ein sperriges und teures Lichtabgabesystem26,27,28,29,30 erfordert. Daher verwendeten einige Forschungsgruppen μLED-basierte Siliziumsonden, um die Größe des Lichtabgabesystems31,32,33,34 zu minimieren. Es besteht jedoch die Gefahr von thermischen Hirnschäden, die durch direkten Kontakt mit μLEDs aufgrund der geringen Energieumwandlungseffizienz von LEDs verursacht werden. Lichtwellenleiter wie optische Fasern, SU-8 und Siliziumoxynitrid (SiON) wurden angewendet, um thermische Schäden zu vermeiden 30,35,36,37,38,39. Diese Strategie hat jedoch auch einen Nachteil aufgrund ihrer geringen Kopplungseffizienz zwischen Lichtquellen und den Wellenleitern.
Das Mikrolinsen-Array wurde zuvor eingeführt, um die Lichtkopplungseffizienz zwischen LEDs und optischen Fasernzu verbessern 40. Es wurde ein optrode-System entwickelt, das auf mikroelektromechanischen Systemen (MEMS) Technologien zur optischen Stimulation und elektrischen Aufzeichnung im Mikromaßstab40 basiert. Das Mikrolinsenarray zwischen einer LED und optischen Fasern erhöhte die Lichtausbeute um 3,13 dB. Wie in Abbildung 1 gezeigt, wird ein 2x2-Glasfaser-Array auf dem 4x4-Mikrolinsen-Array ausgerichtet, und die LED wird unter dem Mikrolinsen-Array positioniert. Die 2x2 optischen Fasern werden anstelle von 4x4 montiert, um Hirnschäden zu reduzieren. Ein Wolfram-Elektroden-Array wird neben dem Optrode-Array positioniert, wobei Silizium über Löcher für die elektrophysiologische Aufzeichnung verwendet wird (Abbildung 1B).
Das System besteht aus einem oberen Einwegteil und abnehmbaren unteren Teilen. Der Top-Einwegteil, der das optische Faserarray, das Mikrolinsen-Array und das Wolfram-Elektroden-Array umfasst, ist so konzipiert, dass es für In-vivo-Experimente dauerhaft in das Gehirn implantiert werden kann. Der untere Teil enthält eine LED-Lichtquelle und eine externe Stromversorgungsleitung, die leicht abnehmbar und für einen anderen Tierversuch wiederverwendbar ist. Eine aufsteckbare Kunststoffabdeckung schützt das Einwegteil, wenn das abnehmbare Teil entfernt wird.
Die Machbarkeit des Systems wird durch Implantation in das Gehirn transgener Mäuse bestätigt, die Channelrhodopsin-2 (ChR2) in Ca2+/Calmodulin-abhängigen Proteinkinase II-positiven Neuronen exprimieren (CaMKIIα::ChR2-Maus). Aufzeichnungselektroden wurden verwendet, um die neuronalen Aktivitäten einzelner Neuronen während der optischen Stimulation der Neuronen aufzuzeichnen.
Protokoll
Die Tierpflege und chirurgischen Eingriffe wurden vom Institutional Animal Care and Use Committee (IACUC) an der Ewha Womans University (Nr. 20-029) genehmigt.
1. Vorbereitung eines optrode Arrays (Abbildung 1 und Abbildung 2)
- Befestigen Sie optische Fasern mit dem Mikrolinsenarray.
- Entfernen Sie die Passivierungsbeschichtung der optischen Faser und schneiden Sie sie mit einem Präzisions-Glasfaserspalt in 5 mm lange Stücke.
- Tauchen Sie die optische Faser in das klare UV-Harz und legen Sie die optischen Fasern auf das Mikrolinsenarray.
- Aushärten Sie das Harz mit einer UV-Lampe.
- Befestigen Sie das Mikrolinsen-Array mit Epoxidharz am 3D-gedruckten Gehäuse.
- Ausrichtung von perfluoralkoxy (PFA)-beschichteten Wolframdrähten.
- Löten Sie die 4 Stück 30 mm langen PFA-Wolframdrähte und 1 Silberdraht an den 5-poligen Buchsenstecker mit 1,27 mm Raster. Verwenden Sie Silberdraht als Referenzelektrode.
- Schließen Sie die Buchse mit einem Rastermaß von 1,27 mm an den Kopfstufenvorverstärker an.
- Setzen Sie Wolframdrähte vorsichtig über die Löcher durch das Silizium (Abbildung 1B), um die feine Ausrichtung der Wolframelektroden zu unterstützen.
- Schneiden Sie die ausgerichteten Wolframdrähte 1 mm kürzer als die optische Faserlänge.
- Befestigen Sie den Stecker mit Epoxidharz am 3D-gedruckten Gehäuse.
- LED-Platzierung
- Platzieren Sie die LED im 3D-gedruckten Gehäuse.
- Schließen Sie die LED an die Antriebsschaltung an, die eine Pulsweitenmodulation (PWM) erzeugt.
HINWEIS: Der PWM-Impuls wird vom Mikrocontroller erzeugt. - Stellen Sie angesichts des durch die LED-Antriebsschaltung induzierten Rauschens sicher, dass die Aufzeichnungselektroden 50 mm von der LED-Treiberschaltung entfernt sind.
- Messen Sie die Lichtintensität am Ende der Glasfaserspitze mit einer Fotodiode.
- Tauchen Sie die Wolframelektroden und optischen Fasern für 15 min in Alkohol. Tauchen Sie dann das System in steriles D.I-Wasser und sterilisieren Sie es mit Ethylenoxidgas.
2. Implantationschirurgie (Abbildung 3 und Abbildung 4)
HINWEIS: Während der Operation muss eine sterile Technik befolgt werden.
- Bereiten Sie die transgenen Tiere vor, die genetisch verändert sind, um lichtempfindliche Opsinproteine in der spezifischen Art von neuronalen Zellen zu exprimieren.
HINWEIS: Eine männliche, 2 Monate alte, transgene Maus, die Kanalrhodopsin-2 (ChR2) in Ca2+/Calmodulin-abhängigen Proteinkinase II-positiven Neuronen (CaMKIIα::ChR2-Maus) exprimierte, wurde in dieser Studieverwendet 41. - Betäuben Sie die Maus mit einem Ketamin-Xylazin-Cocktail - einer Mischung aus Ketamin (100 mg / kg) und Xylazin (10 mg / kg) - durch intraperitoneale Verabreichung.
- Überprüfen Sie das betäubte Tier alle 30 Minuten, indem Sie die Bewegung des Schnurrbartes und die Reaktion auf Pfotendruck überwachen.
- Injizieren Sie den Ketamin-Xylazin-Cocktail in der Hälfte der Anfangsdosis, wenn eine zusätzliche Anästhesie erforderlich ist.
- Rasieren Sie die Kopfhaut und legen Sie die betäubte Maus in den stereotaktischen Rahmen.
HINWEIS: Führen Sie eine chirurgische Hautvorbereitung durch und drapieren Sie das Tier. Die Hautvorbereitung beinhaltet die Haarentfernung, gefolgt von der Reinigung der Haut mit antimikrobiellen Mitteln.- Positionieren Sie den Kopf innerhalb des stereotaktischen Rahmens und führen Sie Ohrstangen in den Meatus ein.
- Zentrieren Sie den Mauskopf im stereotaktischen Rahmen, indem Sie die Ohrstangen wiederholt lösen und anziehen, um eine genaue Positionierung zu erzielen.
- Platzieren Sie die Schneidezähne so, dass die oberen Schneidezähne über der vorderen Innenkante eingehängt werden.
- Stellen Sie die Schneidezahnstange ein, um die Höhe der Schneidezahnstange einzustellen, und ziehen Sie die Nasenklemme gegen die Schnauze fest.
- Schalten Sie das im stereotaktischen Rahmen eingebettete Wärmekissen im Voraus ein, um die Körpertemperatur während der gesamten chirurgischen Eingriffe bei 37 ° C zu halten.
- Setzen Sie die Wärmesonde zur homöothermischen Regulation in das Rektum der Maus ein.
HINWEIS: Die Platzierung der Ohrstange muss durch sanftes Greifen und Schwanken der Schnauze überprüft werden. Die Ohrstange muss nachjustiert werden, wenn die Schnauze seitlich um mehr als ~4 mm bewegt werden kann.
- Bedecken Sie die Augen mit Vaseline (siehe Materialtabelle), um Trockenheit zu vermeiden.
- Injizieren Sie 1% Lidocain in die Kopfhaut. Heben Sie die Haut des Kopfes mit einer Pinzette an, sichern Sie einen Injektionsraum und injizieren Sie das Lidocain unter die Kopfhaut.
- Führen Sie einen sagittalen Schnitt mit einem Skalpell und einer feinen Schere durch. Halten Sie die eingeschnittene Haut mit einer Mikroklemme, um die Sichtbarkeit des Operationsbereichs zu erweitern.
HINWEIS: Die Schnittlänge beträgt <1 cm über der Bregma und dem Schwanzrand des Interparietalknochens. - Entfernen Sie das Periost mit Wattestäbchen. Wenn es Blutungen gibt, kauterisieren Sie den Schädel mit einem Bovie, um die Blutgefäße zu versiegeln.
- Reinigen Sie den Schädel mit Kochsalzlösung und markieren Sie die Kraniotomiestellen mit einem Manipulatorarm: Hippocampus Anterior-Posterior (AP) −1,8 bis −2,8 mm, Medial-Lateral (ML) 0,5-2,5 mm und Dorsal-Ventral (DV) −1 bis −2 mm.
HINWEIS: Fügen Sie unter Berücksichtigung der Dicke des Mausschädels das Optrode-Array -1,2 bis -2,2 mm aus dem exponierten Gehirnbereich ein. Angesichts des Hippocampus-Weges senden Pyramidenzellen von CA3 ihre Axone zu CA1. Daher sind optische Fasern 1 mm länger als Aufnahmeelektroden, so dass die optischen Fasern in CA3 und die Aufnahmeelektroden in CA1 platziert werden. - Bohren Sie ein Loch über dem Kleinhirn und setzen Sie eine Schraube für den Boden ein. Setzen Sie die geschliffene Schraube 0,5 mm tief mit einer Präzisionsschraube ein, bis sie die Oberseite des Kleinhirns erreicht.
HINWEIS: Stellen Sie sicher, dass die Schraube, die als geschliffene Elektrode und Stützstruktur verwendet wird, fest eingesetzt wird, um die Langzeitstabilität der Implantation zu maximieren, da sie die dreidimensionale Oberfläche für die Haftung des Zahnzements erhöht. - Bohren Sie den markierten Bereich und entfernen Sie ein Stück des Schädels mit einer Pinzette.
- Biegen Sie eine Nadelspitze von 26 G im Uhrzeigersinn um 120° und legen Sie den Gehirnbereich frei, indem Sie die abgeschrägte Seite der Nadel nach oben einführen. Achten Sie darauf, das Gehirn und die Blutgefäße nicht zu beschädigen.
- Reinigen Sie das exponierte Gehirn mit Kochsalzlösung, um Knochenstaub und Fremdkörper auszuwaschen.
- Fixieren Sie das Optrode-Array im Manipulatorarm und bewegen Sie sich in die Nähe des exponierten Bereichs.
HINWEIS: Wenn Sie das Gerät platzieren, kann die Neuberechnung des Zielbereichs aus dem Bregma die Genauigkeit der Platzierung erhöhen. - Setzen Sie das Optrode-Array langsam ein und verbinden Sie die Erdungsschraube mit dem Silberdraht, der am System42 befestigt ist.
HINWEIS: Bei diesem Prozess muss das Array fest am Manipulatorarm befestigt werden, um das Wackeln zu minimieren und Hirnschäden durch Mikrobewegungen während des Einführens zu verhindern. Die Insertion muss langsam durchgeführt werden, mit einer Pause von 10 Minuten, um eine Schwellung des Gehirns zu berücksichtigen, die nach dem Einsetzen möglicherweise gedrückt wurde. Eine Einfügegeschwindigkeit unter 1 μm/s in das Hirngewebe wird für die hohe Qualität des Signal-Rausch-Verhältnisses und die Anzahl der trennbaren Einzeleinheiten42 empfohlen. - Wenn es Blutungen gibt, üben Sie direkten Druck auf die Entlüftungen mit einem trockenen Wattestäbchen aus oder verwenden Sie Kauterisation. Fahren Sie nicht mit den nächsten Schritten fort, bis die Blutung vollständig gestoppt ist.
- Legen Sie Gelschaum zwischen das exponierte Gehirn und das Gerät ein, um Chemikalien vor direktem Kontakt mit dem Gehirn zu schützen.
HINWEIS: Gelschaum hilft auch bei der Hämostase und hält das Gehirn feucht. - Wischen Sie den Schädel mit Wattestäbchen ab, um die Feuchtigkeit so weit wie möglich zu entfernen, und fahren Sie mit dem nächsten Fixierungsschritt fort.
- Tragen Sie vorsichtig Zahnzement auf den Schädel auf, um das Gerät zu fixieren und den Gelschaum abzudecken. Bevor der Zahnzement vollständig ausgehärtet ist, trennen Sie die Kopfhaut, wenn sie an Zahnzement befestigt ist. Ziehen Sie die eingeschnittene Haut mit einer Pinzette ab, um den ausgehärteten Zahnzement zu bedecken, und nähen Sie die Kopfhaut. Lassen Sie dann das Gerät vom Manipulatorarm los.
HINWEIS: Stellen Sie sicher, dass der Zahnzement nicht auf der Haut haftet und nur die Schädelregion bedeckt. Wenn die Haut wächst, kann sie den Zement wegdrücken und schließlich fällt das Gerät ab. Dies wird ein kritisches Problem für langfristige In-vivo-Experimente verursachen.
3. Genesung und Implantatpflege
- Nehmen Sie die Maus aus dem stereotaktischen Rahmen.
- Verabreichen Sie Carprofen-Lösung mit einer 26-G-Nadel. Einmal vor der Operation und 12 h (am nächsten Morgen im Falle einer Nachmittagsoperation) und 24 h nach der Operation injizieren, um Schmerzen zu lindern.
HINWEIS: Die Arzneimittelkonzentration in der Flasche beträgt 50 mg / ml und wird bei 4 ° C gelagert. Carprofen ist viskos und muss in sterilem Wasser 1:10 verdünnt werden. Wenn die Sterilität erhalten bleibt, kann die Lösung bis zu 4 Wochen gelagert werden. Um die effektive Dauer des Arzneimittels aufrechtzuerhalten, injizieren Sie die Carprofen-Lösung in Abständen von 12 h. - Legen Sie die Maus auf das Heizkissen und prüfen Sie, ob sie sich gut von der Anästhesie erholt.
HINWEIS: Das Tier wird nicht unbeaufsichtigt gelassen, bis es wieder genügend Bewusstsein erlangt hat. - Entfernen Sie die Nahtfäden 7 - 10 Tage nach der Operation.
- Lassen Sie das Tier sich für 1 Woche erholen. Überwachen Sie die Nahrungs- und Wasseraufnahme während der Erholungszeit. Verabreichen Sie das Analgetikum und überprüfen Sie auf die Anzeichen von Beschwerden oder Schmerzen.
HINWEIS: Die Tiere, die operiert wurden, können nicht bei den anderen Tieren bleiben, bis sie sich vollständig erholt haben.- Wiegen Sie die Maus während der Erholungsphase jeden Tag, um nach Gewichtsveränderungen zu suchen. Opfern Sie die Maus (siehe Abschnitt 6), wenn im Vergleich zu alters- und geschlechtsangepassten Kontrolltieren ein Gewichtsverlust von 20% auftritt.
4. Optogenetische Stimulation und elektrophysiologische Aufzeichnung
- Betäuben Sie die Maus und legen Sie die betäubte Maus in den stereotaktischen Rahmen.
- Richten Sie die Stimulationsparameter ein.
- Stellen Sie das Lichtimpulsrezept auf 4% Tastverhältnis und 10 Hz Frequenz43 ein. Richten Sie die Lichtstimulation für 2 s (20 Impulse) während der neuronalen Aufzeichnung ein.
- Verwenden Sie einen Strom von 50 mA, um eine Lichtintensität von 3 mW/mm2 an der Lichtwellenleiterspitze zu erzeugen. Messen Sie die Lichtleistung mit einer Fotodiode und einem Leistungsmesser und teilen Sie die Lichtleistung durch die optische Faserfacettenfläche.
- Entfernen Sie die Kunststoffabdeckung und befestigen Sie den oberen Teil, der das Lichtabgabesystem enthält, mit der wiederverwendbaren LED und den Schaltkreisen.
- Schließen Sie den Headstage-Vorverstärker an den implantierten 5-poligen Stecker an.
- Öffnen Sie die Software, um neuronale Signale aufzuzeichnen.
- Richten Sie die Softwarefilter ein. Verwenden Sie einen Bandpassfilter bei 0,1-20 kHz und einen Notch-Filter bei 60 Hz. Stellen Sie die Abtastrate des Verstärkers auf 20 kHz ein.
- Überprüfen Sie vor der Aufzeichnung, ob die neuronalen Spike-Signale erkannt werden.
HINWEIS: Die Rauschunterdrückung ist wichtig, da neuronale Signale zu klein sind. Wenn der Rauschpegel zu hoch ist, können neuronale Signale durch Rauschen verdeckt werden und unsichtbar werden. Verwenden Sie eine geeignete Erdung und elektromagnetische Wellenabschirmung, um Geräusche zu reduzieren. - Nach der Signalprüfung zeichnen Sie neuronale Signale ohne Lichtstimulation für die Baseline-Aufzeichnung auf.
- Liefern Sie LED-Licht und zeichnen Sie gleichzeitig neuronale Reaktionen auf (Abbildung 5 und Abbildung 6).
HINWEIS: Nach der Stimulation muss das nächste Stimulationsexperiment nach einem Intervall von mindestens 5 Minuten durchgeführt werden, damit die durch die vorherige Stimulation hervorgerufene neuronale Aktivität das nächste Experiment nicht beeinflusst.
5. Datenanalyse
- Laden Sie die erfassten Daten mit dem MATLAB-Programm.
- Erhalten Sie einzelne neuronale Aktivitäten mit einem Spike-Sortieralgorithmus "Wave-Clus"44,45. Erkennen Sie die Spitzen in jedem Kanal anhand einer Amplitudenschwelle wie in Eq (1)45.
Schwellenwert = 5 × Median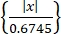 (1)
(1)
Dabei ist x das bandpassgefilterte Signal.- Um "Wave-Clus" zu installieren, klicken Sie auf den Download-Link in der Tabelle der Materialien.
- Um die grafische Benutzeroberfläche (GUI) zu öffnen, geben Sie wave_clus in die Eingabeaufforderung von MATLAB ein.
- Geben Sie Get_spikes('Dateiname.ext')- Funktion für die Dateierweiterung ein, die für die Spike-Erkennung vorbereitet ist. Führen Sie dann Do_clustering('filename_spikes.mat') für die Spike-Sortierung aus.
- Zählen Sie die sortierten Spikes vor, während und nach der Lichtstimulation mit bestimmten Zeitbehältern. Verwenden Sie 0,2 s und 2 s Zeitfächer für die Analyse.
- Zeichnen Sie die Anzahl der Spitzen aus jedem Aufnahmekanal auf.
HINWEIS: Der Mittelwert mit Standardfehler der Mittelwerte (REM) der Daten aus den Ergebnissen von 8 wiederholten Experimenten wurde berechnet und aufgetragen.
6. Euthanasie
- Nach all den Experimenten, opfern Sie die Maus durch Kohlendioxid (CO2) Inhalation.
- Ohne die Kammer vorzuladen, legen Sie die Maus in die transparente Euthanasiekammer, ohne CO2 -Zufuhr und / oder Leckagen.
- Schalten Sie das CO2 -Gas ein und verdrängen Sie die Luft mit einer Rate von 30 - 50% des Volumens der Euthanasiekammerluft pro Minute.
HINWEIS: Ein Durchflussmesser muss an die CO2 -Gasflasche angeschlossen werden, um sicherzustellen, dass die Luftverdrängungsrate 30-50% des Volumens der Euthanasiekammer pro Minute beträgt. - Überwachen Sie die geopferte Maus auf mangelnde Atmung und veränderte Augenfarbe.
HINWEIS: Die erwartete Zeit für Euthanasie liegt in der Regel innerhalb von 10 bis 15 Minuten. - Nachdem Sie die Todeszeichen beobachtet haben, entfernen Sie die Maus aus der Euthanasiekammer.
- Um das Euthanasieverfahren abzuschließen, überprüfen Sie den Tod, indem Sie den Atem- und Herzstillstand bestätigen.
Ergebnisse
Das optrode-System wurde erfolgreich hergestellt, um eine ausreichende Lichtleistung zur Aktivierung der Zielneuronen bereitzustellen. Die feine Ausrichtung der Wolframelektroden wird durch das mikrofabrizierte Silizium über die Löcher erreicht. Die gemessene Lichtintensität beträgt 3,6 mW/mm2 an der Lichtwellenleiterspitze, wenn 50 mA Strom angelegt wird. Die Mikrolinse erhöhte die Lichtausbeute um 3,13 dB. Aufgrund des Mikrolinsenarrays, das die Lichtkopplung verbessert, beträgt der angelegte Strom etw...
Diskussion
Die Machbarkeit des Systems zur gleichzeitigen optogenetischen Stimulation und elektrophysiologischen Aufzeichnung wurde nachgewiesen (Abbildung 6). Die großen Spikes während der Lichtstimulation sind photoelektrische Artefakte, die gleichzeitig mit der Lichtstimulation auftreten (Abbildung 6A). Dies wird in der gezoomten Ansicht der Wellenform im rot gestrichelten Rechteck deutlich (Abbildung 6A). Wie in Abbi...
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Forschung wurde durch das Convergent Technology R&D Program for Human Augmentation der National Research Foundation of Korea (NRF) unterstützt, das vom Ministerium für Wissenschaft und IKT (NRF-2019M3C1B8090805) finanziert und durch einen von der koreanischen Regierung (MSIT) finanzierten Zuschuss der National Research Foundation of Korea (NRF) (Nr. 2019R1A2C1088909) unterstützt wurde. Wir danken Seung-Hee Lees Labor am Department of Biological Sciences, KAIST, Daejeon, Korea, für die freundliche Bereitstellung der transgenen Mäuse.
Materialien
| Name | Company | Catalog Number | Comments |
| 5-pin Connector | NW3 | HD127K | 1.27 mm (.050") pitch |
| Bovie | Fine Science Tools(F.S.T) | 18010-00 | High Temperature Cautery Kit |
| Data Acquisition Software | Intan Technologies, LLC | USB Interface Board software | Work with the RHD USB Interface Board |
| Dental Cement | Lang Dental Manufacturing Company, Inc. | 1223CLR | Use Jet Liquid and powder in jet denture repair package |
| Digital Manipulator Arm | Stoelting Co. | 51904/51906 | Left, Right each Digital Manipulator Arm, 3-Axes, Add-On |
| Gel Foam | Cutanplast | Standard (70*50*10 mm) | Sterile re-absorbable gelatin sponge with a haemostatic effect |
| Headstage Preamplifier | Intan Technologies, LLC | #C3314 | RHD 16-Channel Recording Headstages |
| Heating Pad | Stoelting Co. | 53800R | Stoelting Rodent Warmer X1 with Rat Heating Pad |
| LED | OSLON | GB CS8PM1.13 | λ typ. 470 nm, Viewing angle 80 °, Forward voltage 2.85 V |
| MATLAB | MathWorks, Inc. | R2019a | |
| Micro Clamp | SURGIWAY | 12-1002-04 | Straight type, Serre-fine DIEFFENBACH droite 3.5 cm |
| Optical Fiber | Thorlabs, Inc. | FT200UMT | 0.39 NA, Ø 200 µm Core Multimode Optical Fiber, High OH for 300 - 1200 nm |
| PFA-Coated Tungsten Wire | A-M System | Custom ordered | Rod type, Ø 101.6 μm (.004") |
| Photodiode | Thorlabs | S121C | |
| power meter | Thorlabs Inc. | PM100D | |
| Precision cleaver | FITEL | S326 | Fiber slicer tool |
| Prism | GraphPad | 5.01 version | |
| Scalpel | Feather™ | #20 | Scalpel blade with 100mm long Scalpel Handle |
| screw | Nasa Korea | stainless steel | diameter: 1.2 mm, length: 3 mm |
| Silver Wire | The Nilaco Corporation | AG-401265 | Ø 200 µm |
| Stereotaxic Fxrame | Stoelting Co. | 51500D | Digital new standard stereotaxic, rat and mouse |
| suture | ETHICON | W9106 | suture size: 4-0, length:75 cm, wire diameter: 4-0 |
| Vaseline | Unilever PLC | Original | 100% pure petroleum jelly |
| Wave_Clus | N/A | N/A | https://github.com/csn-le/wave_clus |
Referenzen
- Wang, Y., Liu, Y. Z., Wang, S. Y., Wang, Z. In vivo whole-cell recording with high success rate in anaesthetized and awake mammalian brains. Molecular Brain. 9 (1), 86 (2016).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell patch-clamp recordings in brain slices. Journal of Visualized Experiments: JoVE. (112), e54024 (2016).
- Lee, D., Shtengel, G., Osborne, J. E., Lee, A. K. Anesthetized- and awake-patched whole-cell recordings in freely moving rats using UV-cured collar-based electrode stabilization. Nature Protocols. 9 (12), 2784-2795 (2014).
- Tao, C., Zhang, G., Xiong, Y., Zhou, Y. Functional dissection of synaptic circuits: in vivo patch-clamp recording in neuroscience. Frontiers in Neural Circuits. 9, 23 (2015).
- Henze, D. A., et al. Intracellular features predicted by extracellular recordings in the hippocampus in vivo. Journal of Neurophysiology. 84 (1), 390-400 (2000).
- Takahashi, S., Anzai, Y., Sakurai, Y. Automatic sorting for multi-neuronal activity recorded with tetrodes in the presence of overlapping spikes. Journal of Neurophysiology. 89 (4), 2245-2258 (2003).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Rossant, C., et al. Spike sorting for large, dense electrode arrays. Nature Neuroscience. 19 (4), 634-641 (2016).
- Balasubramaniam, S., et al. Wireless communications for optogenetics-based brain stimulation: present technology and future challenges. IEEE Communications Magazine. 56 (7), 218-224 (2018).
- Bedbrook, C. N., et al. Machine learning-guided channelrhodopsin engineering enables minimally invasive optogenetics. Nature Methods. 16 (11), 1176-1184 (2019).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Deng, W., Goldys, E. M., Farnham, M. M., Pilowsky, P. M. Optogenetics, the intersection between physics and neuroscience: light stimulation of neurons in physiological conditions. American journal of physiology. Regulatory, Integrative and Comparative Physiology. 307 (11), 1292-1302 (2014).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annual Review Neuroscience. 34, 389-412 (2011).
- Mahmoudi, P., Veladi, H., Pakdel, F. G. Optogenetics, tools and applications in neurobiology. Journal of Medical Signals and Sensors. 7 (2), 71-79 (2017).
- Sasaki, Y., et al. Near-infrared optogenetic genome engineering based on photon-upconversion hydrogels. Angewandte Chemie International Edition in English. 58 (49), 17827-17833 (2019).
- Zhang, Y., et al. Battery-free, lightweight, injectable microsystem for in vivo wireless pharmacology and optogenetics. Proceedings of National Academy of Sciences of the United States of America. 116 (43), 21427-21437 (2019).
- Bernstein, J. G., Boyden, E. S. Optogenetic tools for analyzing the neural circuits of behavior. Trends in Cognitive Sciences. 15 (12), 592-600 (2011).
- Wang, J., et al. Integrated device for combined optical neuromodulation and electrical recording for chronic in vivo applications. Journal of Neural Engineering. 9 (1), 016001 (2012).
- Royer, S., et al. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. European Journal of Neuroscience. 31 (12), 2279-2291 (2010).
- Zhang, J., et al. Integrated device for optical stimulation and spatiotemporal electrical recording of neural activity in light-sensitized brain tissue. Journal of Neural Engineering. 6 (5), 055007 (2009).
- Park, S. I., et al. Stretchable multichannel antennas in soft wireless optoelectronic implants for optogenetics. Proceedings of National Academy of Sciences of the United States of America. 113 (50), 8169-8177 (2016).
- Kravitz, A. V., Owen, S. F., Kreitzer, A. C. Optogenetic identification of striatal projection neuron subtypes during in vivo recordings. Brain Research. 1511, 21-32 (2013).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. Journal of Neural Engineering. 4 (3), 143-156 (2007).
- Anikeeva, P., et al. Optetrode: a multichannel readout for optogenetic control in freely moving mice. Nature Neuroscience. 15 (1), 163-170 (2011).
- Obaid, S. N., et al. Multifunctional flexible biointerfaces for simultaneous colocalized optophysiology and electrophysiology. Advanced Functional Materials. 30 (24), 1910027 (2020).
- Wang, L., et al. An artefact-resist optrode with internal shielding structure for low-noise neural modulation. Journal of Neural Engineering. 17 (4), 046024 (2020).
- Shin, H., et al. Multifunctional multi-shank neural probe for investigating and modulating long-range neural circuits in vivo. Nature Communications. 10 (1), 3777 (2019).
- Kampasi, K., et al. Dual color optogenetic control of neural populations using low-noise, multishank optoelectrodes. Microsystem & Nanoengineering. 4, 10 (2018).
- Schwaerzle, M., Paul, O., Ruther, P. Compact silicon-based optrode with integrated laser diode chips, SU-8 waveguides and platinum electrodes for optogenetic applications. Journal of Micromechanics and Microengineering. 27 (6), 065004 (2017).
- Son, Y., et al. In vivo optical modulation of neural signals using monolithically integrated two-dimensional neural probe arrays. Scientific Reports. 5, 15466 (2015).
- Yasunaga, H., et al. Development of a neural probe integrated with high-efficiency MicroLEDs for in vivo application. Japanese Journal of Applied Physics. 60 (1), 016503 (2020).
- Kim, K., et al. Artifact-free and high-temporal-resolution in vivo opto-electrophysiology with microLED optoelectrodes. Nature Communications. 11 (1), 2063 (2020).
- Mendrela, A. E., et al. A high-resolution opto-electrophysiology system with a miniature integrated headstage. IEEE Transactions on Biomedical Circuits and Systems. 12 (5), 1065-1075 (2018).
- Scharf, R., et al. Depth-specific optogenetic control in vivo with a scalable, high-density muLED neural probe. Scientific Reports. 6, 28381 (2016).
- Oh, K., Sonsi, Y. -. A., Ha, S. Optogenetic stimulator with µLED-coupled optical fiber on flexile substrate via 3D printed mount. 2021 21st International Conference on Solid-State Sensors, Actuators and Microsystems (Transducers). , 1476-1479 (2021).
- McAlinden, N., et al. Multisite microLED optrode array for neural interfacing. Neurophotonics. 6 (3), 035010 (2019).
- Kwon, K. Y., Lee, H. M., Ghovanloo, M., Weber, A., Li, W. Design, fabrication, and packaging of an integrated, wirelessly-powered optrode array for optogenetics application. Frontiers in Systems Neuroscience. 9, 69 (2015).
- Bernstein, J. G., Allen, B. D., Guerra, A. A., Boyden, E. S. Processes for design, construction and utilisation of arrays of light-emitting diodes and light-emitting diode-coupled optical fibres for multi-site brain light delivery. Journal of Engineering. , (2015).
- Stark, E., Koos, T., Buzsaki, G. Diode probes for spatiotemporal optical control of multiple neurons in freely moving animals. Journal of Neurophysiology. 108 (1), 349-363 (2012).
- Jeon, S., et al. Implantable optrode array for optogenetic modulation and electrical neural recording. Micromachines. 12 (6), 725 (2021).
- Song, Y. H., et al. A neural circuit for auditory dominance over visual perception. Neuron. 93 (4), 940-954 (2017).
- Fiáth, R., et al. Slow insertion of silicon probes improves the quality of acute neuronal recordings. Scientific Reports. 9 (1), 111 (2019).
- Melchior, J. R., Ferris, M. J., Stuber, G. D., Riddle, D. R., Jones, S. R. Optogenetic versus electrical stimulation of dopamine terminals in the nucleus accumbens reveals local modulation of presynaptic release. Journal of Neurochemistry. 134 (5), 833-844 (2015).
- Quiroga, R. Q., Nadasdy, Z., Ben-Shaul, Y. Unsupervised spike detection and sorting with wavelets and superparamagnetic clustering. Neural Computation. 16 (8), 1661-1687 (2004).
- Chaure, F. J., Rey, H. G., Quian Quiroga, R. A novel and fully automatic spike-sorting implementation with variable number of features. Journal of Neurophysiology. 120 (4), 1859-1871 (2018).
- Casanova, F., Carney, P. R., Sarntinoranont, M. Effect of needle insertion speed on tissue injury, stress, and backflow distribution for convection-enhanced delivery in the rat brain. PLoS One. 9 (4), 94919 (2014).
- Iseri, E., Kuzum, D. Implantable optoelectronic probes for in vivo optogenetics. Journal of Neural Engineering. 14 (3), 031001 (2017).
- Arias-Gil, G., Ohl, F. W., Takagaki, K., Lippert, M. T. Measurement, modeling, and prediction of temperature rise due to optogenetic brain stimulation. Neurophotonics. 3 (4), 045007 (2016).
- Jeon, S., et al. Multi-wavelength light emitting diode-based disposable optrode array for in vivo optogenetic modulation. Journal of Biophotonics. 12 (5), 201800343 (2019).
- Korposh, S., James, S. W., Lee, S. -. W., Tatam, R. P. Tapered optical fibre sensors: current trends and future perspectives. Sensors. 19 (10), 2294 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten