Method Article
Erweiterung des Toolkits für die In-vivo-Bildgebung des axonalen Transports
In diesem Artikel
Zusammenfassung
Unter Verwendung transgener fluoreszierender Mäuse werden detaillierte Protokolle beschrieben, um den axonalen Transport von Signalendosomen und Mitochondrien innerhalb motorischer und sensorischer Axone des intakten Ischiasnervs bei lebenden Tieren in vivo zu beurteilen.
Zusammenfassung
Der axonale Transport erhält die neuronale Homöostase, indem er den bidirektionalen Handel mit verschiedenen Organellen und Ladungen ermöglicht. Störungen des axonalen Transports haben verheerende Folgen für einzelne Neuronen und ihre Netzwerke und tragen zu einer Vielzahl neurologischer Erkrankungen bei. Da viele dieser Bedingungen sowohl zellautonome als auch nicht-autonome Mechanismen beinhalten und oft ein Spektrum der Pathologie über neuronale Subtypen hinweg aufweisen, sind Methoden zur genauen Identifizierung und Analyse neuronaler Teilmengen unerlässlich.
Dieses Papier beschreibt Protokolle zur Beurteilung des axonalen In-vivo-Transports von Signalendosomen und Mitochondrien in Ischiasnerven von anästhesierten Mäusen. Schrittweise Anweisungen werden bereitgestellt, um 1) motorische von sensorischen Neuronen in vivo, in situ und ex vivo zu unterscheiden, indem Mäuse verwendet werden, die selektiv fluoreszierende Proteine in cholinergen Motoneuronen exprimieren; und 2) den axonalen Transport von Signalendosomen und Mitochondrien separat oder gleichzeitig in vivo beurteilen. Diese komplementären intravitalen Ansätze erleichtern die gleichzeitige Bildgebung verschiedener Ladungen in verschiedenen peripheren Nervenaxonen, um den axonalen Transport in Gesundheit und Krankheit quantitativ zu überwachen.
Einleitung
Das periphere Nervensystem (PNS) verbindet das zentrale Nervensystem (ZNS) mit seinen distalen Zielen, so dass die Übertragung von efferenten Signalen zur motorischen Kontrolle und afferenten Signalen zur sensorischen Rückmeldung ermöglicht wird. Unter Verwendung der Vielzahl von Fortschritten in der Mausgenetik haben Wissenschaftler verschiedene Mausmodelle entwickelt, um viele Krankheiten / Syndrome zu untersuchen, die das PNS 1,2,3 betreffen. Da die meisten neurodegenerativen Pathologien multifaktoriell mit zellautonomen und nicht-autonomen Beiträgen4,5 sind, kann das Entwirren von zell- / neuronenspezifischen Pathologien entscheidende, neuartige Einblicke in Krankheitsmechanismen liefern.
Zu diesem Zweck hat die Entwicklung von bakteriellen künstlichen Chromosomen (BAC)-transgenen Mäusen6 die selektive endogene Expression von fluoreszierenden Proteinen in gezielten Untergruppen von Neuronen ermöglicht. Zum Beispiel sind BAC-transgene Mäuse verfügbar, die grün fluoreszierendes Protein (GFP) in cholinergen7 oder glycinergen Neuronen8 oder ein variantes rotfluoreszierendes Protein (tdTomato) in Parvalbumin-positiven Neuronen9 exprimieren. Alternativ kann eine selektive neuronale Expression fluoreszierender Proteine über die Cre-loxP-Technologie 10 erreicht werden. Zum Beispiel können Mausstämme, die Cre-Rekombinase in Teilmengen von Neuronen exprimieren (z. B. Cholin-Acetyltransferase (ChAT)-Cre), mit Mäusen gezüchtet werden, die ein fluoreszierendes Protein (z. B. tdTomato oder GFP) aus einem konstitutiven Ort (z. B. Gt (ROSA) 26Sor) unter der Kontrolle eines transkriptionellen Repressors exprimieren, der von loxP-Stellen11 flankiert wird (z. B. Mäuse erzeugen, die tdTomato nur in cholinergen Neuronen exprimieren). Tatsächlich wurden unter Verwendung der Cre-loxP-Rekombination transgene Mäuse erzeugt, die gelb fluoreszierendes Protein in Axonen des absteigenden kortikospinalen Traktesexprimieren 12.
Darüber hinaus ermöglichen jüngste Fortschritte in der CRISPR / Cas9-Genbearbeitung, wie ORANGE, die fluoreszierende Markierung mehrererendogener neuronaler Proteine, wobei die Expression mit nanoskaliger Auflösung 13 erreichbar ist. Darüber hinaus kann ORANGE-CAKE in Kombination mit Cre-exprimierenden Mausstämmen verwendet werden, um mehrere endogene Proteine in einzelnen Neuronen13 zu markieren. Alternativ erlaubt das viral-vermittelte neuronale Tracing auch die Markierung neuronaler Untergruppen und kann mit gezielten Kombinationen von viralen Serotypen und/oder zellspezifischen Promotoren14,15,16,17 erreicht werden.
Zusätzlich zu den neuronalen Markierungsmethoden wurden Mauslinien auch entwickelt, um Reporterproteine zu exprimieren, die auf bestimmte Organellen abzielen, wie Mitochondrien, die Cyan-Fluoreszenzprotein exprimieren (Mito.CFP)18 oder Autophagosomen, die GFP exprimieren (LC3.GFP)19. Darüber hinaus wurden Mauslinien entwickelt, um die Kalziumdynamik spezifisch in Neuronen zu bewerten (z. B. Thy1.GCaMP)20,21. Insgesamt ermöglichen neuartige experimentelle Anwendungen den Wissenschaftlern, mit der Weiterentwicklung solcher Modelle präzisere biologische und pathologische Fragen zum ZNS und PNS zu stellen.
Die Hauptaufgabe peripherer motorischer Nerven besteht darin, elektrische Signale an die Skelettmuskulatur zu übertragen, um Bewegung hervorzurufen. Darüber hinaus durchlaufen neurochemische und physiologische Nachrichten in Form verschiedener Organellen (z. B. Mitochondrien, Endolysosomen, Signalendosomen) das Zytoskelettnetzwerk uni- oder bidirektional, um die neuronale Homöostase aufrechtzuerhalten22,23,24. Beeinträchtigungen des axonalen Transports haben katastrophale Folgen für die neuronale Gesundheit und sind mit vielen neurologischen Entwicklungs- und neurodegenerativen Erkrankungen verbunden25. Auf molekularer Ebene können Beeinträchtigungen des axonalen Transports physiologische Ereignisse stören, die die synaptische Signalgebung und Plastizität, die Gentranskription und die lokale Translation im gesamten Axon regulieren26,27. Während es eine Vielzahl von Werkzeugen gibt, um diese Ereignisse in kultivierten Zellen / Neuronen zu untersuchen28, 29, sind die Beurteilung der axonalen Transportdynamik und der axonal-verknüpften biologischen Ereignisse in vivo erforderlich, um wichtige Erkenntnisse über physiologische und pathologische Prozessezu bestätigen 30.
Im Laufe der Jahre hat das Schiavo-Labor Protokolle optimiert, um verschiedene Fragen zum axonalen Transport zu stellen 31,32,33,34,35,36. Diese Experimente haben sich von der Entdeckung erweitert, dass ein fluoreszierend markiertes atoxisches Fragment von Tetanus-Neurotoxin (HCT) durch Wechselwirkungen mit Nidogen und Polysialogangliosiden37 in Axonterminals in der Skelettmuskulatur internalisiert wird. Nach der Internalisierung wird HCT rückläufig in Rab7-positive, neurotrophinhaltige Signalendosomen transportiert, die für die Zellkörper motorischer und sensorischer Neuronen bestimmt sind 38,39,40,41. Parallel dazu haben Fortschritte in der Bildgebungstechnologie die Echtzeitanalyse von peripheren Nervenbündeln und einzelnen Axonen in lebenden, anästhesiertenMäusen ermöglicht 30. Der erste Vorstoß zur Beurteilung der axonalen Transportdynamik in Pathologie in vivo ergab präsymptomatische Beeinträchtigungen des Transports von Signalendosomen und Mitochondrien im SOD1G93A-Mausmodell der amyotrophen Lateralsklerose (ALS)35. Wichtig ist, dass diese Defekte wahrscheinlich nicht einfach sekundäre Folgen der Neurodegeneration darstellen, da festgestellt wurde, dass der Verlust von Motoneuronen in Abwesenheit von axonalen Transportstörungen in einem Mausmodell der Kennedy-Krankheit42 und einem heterozygoten mutierten FUS-Modell von ALS43 auftreten kann. Solche axonalen Transportdefizite können bei ALS-Mäusen mit Inhibitoren spezifischer Kinasen33 oder Wachstumsfaktorrezeptoren34 behoben werden. Darüber hinaus verändert die Behandlung von Neuronen mit einem spezifischen Histon-Deacetylase-Blocker den mitochondrialen Transport in vivo36. Zuletzt berichteten wir, dass die BDNF-abhängige Modulation des axonalen Transports bei ALS-Mäusen44 bei verschiedenen Motoneuron-Subtypen fehlreguliert ist.
Durch die Verwendung eines ständig wachsenden Toolkits zur Bewertung der axonalen Transportdynamik28,29 skizziert dieses Videoprotokoll mehrere Anwendungen, die weitere Einblicke in verschiedene biologische und pathologische Szenarien ermöglichen. Erstens werden transgene Mäuse, die selektiv fluoreszierende Proteine in cholinergen Neuronen (d.h. Motoneuronen) exprimieren, verwendet, um sowohl in vivo als auch ex vivo zwischen motorischen und sensorischen Axonen zu unterscheiden. Fluoreszenzmarkiertes HCT wird dann in drei transgenen Linien in Signalendosomen geladen, um die axonale Transportdynamik in verschiedenen peripheren Neuronen zu differenzieren. Das nächste experimentelle Protokoll beschreibt einen Multiplex-Fluoreszenzansatz zur Beurteilung des mitochondrialen Transports speziell in Motoneuronen durch Zucht von ChAT.tdTomato-Mäusen mit Mito-CFP-Mäusen. Schließlich werden Anweisungen zur gleichzeitigen Abbildung von Mitochondrien und Signalendosomen innerhalb desselben Axons in vivo gegeben.
Protokoll
Alle Mäusehandhabung und -experimente wurden in Übereinstimmung mit dem Animals (Scientific Procedures) Act (1986) durchgeführt und vom University College London - Queen Square Institute of Neurology Ethics Committee genehmigt.
1. Tiere
- Unterbringe alle Tiere in individuell belüfteten Käfigen in einer temperatur- und feuchtigkeitskontrollierten Umgebung und halte sie in einem 12-stündigen Hell-Dunkel-Zyklus mit Ad-libitum-Zugang zu Nahrung und Wasser.
- Verwenden Sie sowohl männliche als auch weibliche Mäuse der folgenden transgenen Stämme: 1) heterozygote Tg(Chat-EGFP) GH293Gsat/Mmucd-Mäuse, bezeichnet als ChAT.eGFP-Mäuse; 2) heterozygotes B6.Cg-Tg(Hlxb9-GFP)1Tmj/J, bezeichnet als HB9. GFP-Mäuse; und 3) heterozygote B6.Cg-Tg(Thy1-CFP/COX8A)S2Lich/J, bezeichnet als Mito.CFP-Mäuse.
- Erzeugen Sie ChAT.tdTomato-Mäuse, indem Sie homozygote B6;129S6-Chat tm2(cre)Lowl/J, bezeichnet als ChAT.Cre-Mäuse, mit homozygoten B6.Cg-Gt(ROSA)26Sor tm9(CAG-tdTomato)Hze/J, bezeichnet als Rosa26.tdTomato-Mäuse, kreuzen.
- Erzeugen Sie ChAT.tdTomato::Mito.CFP-Mäuse, indem Sie heterozygote ChAT.tdTomato-Mäuse mit heterozygoten Mito.CFP-Mäusen kreuzen.
2. Intramuskuläre Injektionen von fluoreszierendem HCT
- Vorbereitung vor der Operation
- Express H CT (HCT441, Rückstände 875-1315) verschmolz zu einem verbesserten Cystein-reichen Tag in Bakterien als Glutathion-S-Transferase-Fusionsprotein gemäß 45. H C T mit AlexaFlour555C2 Maleimid31 beschriften, in eiskaltem Dialysepuffer (10 mM HEPES-NaOH, 100 mM NaCl, pH 7,4) dialysieren, in flüssigem Stickstoff einfrieren und bei -80 °C lagern. Vor der Durchführung von In-vivo-Experimenten sollten zunächst HCT in vitro auf eine erfolgreiche Aufnahme und einen erfolgreichen Transport in primären Neuronen getestet werden.
- Verdünnte fluoreszierende HC T (z. B. HCT-555) auf eine endgültige und experimentell konsistente Konzentration von 2,5 bis 10 μg/μL in steriler phosphatgepufferter Kochsalzlösung (PBS) in einem 0,2 ml-Röhrchen. Fügen Sie in diesem Schritt der HCT-Lösung bei Bedarf weitere Verbindungen/Faktoren hinzu (z. B. vom Gehirn abgeleiteter neurotropher Faktor).
HINWEIS: Das endgültige Volumen muss für die Größe der interessierenden Muskeln angemessen sein. Bereiten Sie beispielsweise ein Injektionsvolumen von 3-4 μL für den Musculus tibialis anterior (TA) und ~1 μL für den kleineren Musculus soleus vor. Halten Sie die Arbeitskonzentration von HCT unabhängig vom Endvolumen zwischen 2,5 und 10 μg/μL. - Mischen Sie die HCT-Lösung mit einer Pipette oder einem Wirbel und drehen Sie sie kurz mit niedriger Geschwindigkeit mit einer Tischzentrifuge nach unten, um die Flüssigkeit zu sammeln und große Blasen zu entfernen. Schützen Sie das HCT vor Licht und Transport auf Eis.
- Verwenden Sie eine gezogene Glasmikropipette für optimale intramuskuläre Injektionen in kleinere Muskeln (z. B. Soleus) oder für intraunziatische Nerveninjektionen. Ziehen Sie vor der Operation abgestufte Glasmikropipetten (gemäß 46).
HINWEIS: Um das Pipettieren zu aktivieren und den Fluss auf der Rückseite der Mikropipette einzuschränken, brechen Sie vorsichtig ein kleines Stück von der scharfen Spitze mit einer feinen Pinzette unter einem Seziermikroskop ab. Achten Sie darauf, das zerbrochene Ende in der entsprechenden Tonne zu entsorgen. - Sterilisieren und reinigen Sie alle chirurgischen Werkzeuge vor dem Gebrauch.
- Chirurgisch-intramuskuläre Injektionen
- Bereiten Sie sich auf die Operation vor, indem Sie einen sterilen chirurgischen Vorhang auf einer auf 37 ° C eingestellten Wärmematte befestigen. Positionieren und fokussieren Sie das Operationsmikroskop. Damit die Operation beginnen kann, packen Sie die vorsterilisierten chirurgischen Werkzeuge, das chirurgische Klebeband, sterile Wattestäbchen, 70% (v / v) Ethanol in Wasser, sterile Kochsalzlösung, Nähte und eine Hamilton-Nadel oder gezogene Glasmikropipetten auf die chirurgische Drapierung.
- Stellen Sie sicher, dass das Anästhesiegerät für die Dauer des chirurgischen Eingriffs über ausreichend Sauerstoff und Isofluran verfügt. Leiten Sie den Anästhesiefluss in die Induktionskammer und schalten Sie die Anästhesiemaschine ein.
- Verwenden Sie zunächst eine Sauerstoffdurchflussrate von 1-2 l / min und 5% Isofluran. Legen Sie die Maus in die Induktionskammer, um die Anästhesie einzuleiten. Wenn der Rechtfertigungsreflex fehlt, reduzieren Sie die Anästhesie auf 2-3% Isofluran, lenken Sie den Anästhesiefluss auf das Mundstück und übertragen Sie die Maus auf das Mundstück, das sich in einem separaten Bereich des Operationsraums befindet.
- Stellen Sie sicher, dass sowohl die Hornhaut- als auch die Pedalentzugsreflexe fehlen, bevor Sie den Fellbereich rasieren, der die zu injizierenden Muskeln bedeckt. Wenn Sie fertig sind, entfernen Sie so viel rasiertes Fell wie möglich von der Maus mit der klebrigen Seite des chirurgischen Bandes und legen Sie die Maus auf eine Waage, um ihr präoperatives Gewicht aufzuzeichnen.
- Tragen Sie Augengleitmittel vorsichtig mit einem Wattestäbchen auf und übertragen Sie Maus und Mundstück in den Operationsbereich.
HINWEIS: Versuchen Sie, die Menge an rasiertem Fell zu begrenzen, die auch in den Operationsbereich übertragen wird. Verwenden Sie chirurgisches Klebeband, um den Kopf am Mundstück zu befestigen, um zu verhindern, dass die Maus herausrutscht. Tragen Sie mit einem separaten Wattestäbchen Ethanol auf die rasierte Region auf, um die Fellkontamination zu sterilisieren und zu reduzieren. - Positionieren Sie den Körper entsprechend dem zu injizierenden Muskel. Legen Sie beispielsweise für den TA die Maus auf den Rücken und strecken Sie das Hinterbein um ~ 10 ° von der Mittellinie aus. Alternativ können Sie bei Soleus-Injektionen das Tier auf die Seite legen und das Hinterbein um ~ 45 ° von der Mittellinie aus verlängern. Wenn sich das Hinterbein in der richtigen Position befindet, verwenden Sie chirurgisches Klebeband über den Fuß, um unerwünschte Bewegungen während der Operation zu verhindern.
HINWEIS: Die Injektionsverfahren für TA-, Gastrocnemius- und Soleusmuskeln wurden zuvordetailliert beschrieben 32. - Bevor Sie einen Schnitt machen, bestätigen Sie, dass die Anästhesie ausreicht, indem Sie den Pedalentzugsreflex testen. Überwachen Sie die Anästhesie kontinuierlich und halten Sie sie während des gesamten chirurgischen Eingriffs mit regelmäßiger Beurteilung der Atmung und des Entzugsreflexes aufrecht.
- Ziehen Sie an dieser Stelle die funktionierende HCT-Lösung in die Hamilton-Spritze oder die gezogene Glasmikropipette.
- Machen Sie einen kleinen Schnitt über die Muskeln, die in dem/den Bereich(en) von Interesse sind, der/die mit den motorischen Endplattenregionen46,47,48 korrespondiert(en). Durchbohren Sie die äußere Faszie am Muskel und injizieren Sie langsam das HCT gemäß 32. Lassen Sie die Spritze/Mikropipette 5-10 s in Position, bevor Sie sich langsam zurückziehen.
- Schließen Sie die Schnitte mit 1-2 Nähten und bringen Sie die Maus in einen isolierten Auffangkäfig. Überwachen Sie die Maus nach der Operation für mindestens 30 Minuten, bevor Sie sie in den Heimkäfig zurückbringen. Wenn sich die Maus erfolgreich erholt hat und die Überwachung nach der Operation abgeschlossen ist, bringen Sie den Käfig in normale Haltungsbedingungen zurück.
3. Axonaler In-vivo-Transport
- Freilegung des Ischiasnervs
- Stellen Sie die Umgebungskammer des Mikroskops mindestens 1 h vor der Bildgebung auf 37 °C ein.
- Bereiten Sie sich darauf vor, den Ischiasnerv freizulegen, indem Sie den chirurgischen Vorhang, die Werkzeuge, das Klebeband, die sterilen Wattestäbchen, 70% Ethanol und die sterile Kochsalzlösung um den Operationsbereich herum anordnen. Stellen Sie sicher, dass das Anästhesiegerät über ausreichende Vorräte an Sauerstoff und Isofluran für bis zu 2 Stunden pro Maus verfügt. Erstellen Sie einen Keil aus Parafilm oder unsichtbarem Klebeband, indem Sie ihn in ein schmales Rechteck (z. B. ~ 1 cm Breite für größere Mäuse) mit einer abgewinkelten Spitze schneiden und unter den freiliegenden Ischiasnerv legen, um den Bildgebungsprozess zu unterstützen. Legen Sie die Induktionskammer auf eine Wärmematte und stellen Sie sie auf Körpertemperatur ein.
HINWEIS: Vier Stunden sind ausreichend Zeit, bis HCT aufgenommen und rückläufig von der Injektionsstelle zum Ischiasnerv transportiert wurde; Daher kann eine einzelne Maus nach dieser Zeit für die erneute Anästhesie vorbereitet werden. - Leiten Sie den Anästhesiefluss in die Induktionskammer, schalten Sie die Anästhesiemaschine mit einer Sauerstoffflussrate von 1-2 l / min und 3-4% Isofluran ein und legen Sie die Maus in die Induktionskammer, um die Anästhesie einzuleiten.
HINWEIS: Da es sich bei dem in vivo axonalen Transportexperiment um ein terminales Verfahren handelt, müssen die Augen nicht geschmiert werden. - Wenn der Aufrichtreflex fehlt, reduzieren Sie die Anästhesie auf 2-3% Isofluran, lenken Sie den Anästhesiefluss auf das Mundstück und übertragen Sie die Maus auf das Mundstück. Verwenden Sie chirurgisches Klebeband, um den Kopf am Mundstück zu befestigen, verlängern Sie das gezielte Hinterbein um ~ 45 ° von der Mittellinie und verwenden Sie chirurgisches Klebeband über dem Fuß, um diese Position beizubehalten.
HINWEIS: Eine reduzierte Anästhesie ist an dieser Stelle von Vorteil, da sie die Auswirkungen von Atemartefakten während des Bildgebungsprozesses begrenzen kann. - Stellen Sie sicher, dass Hornhaut- und Pedalentzugsreflexe fehlen, und verwenden Sie dann eine Schere, um die Haut über dem Ischiasnerv32 (dh einem großen Bereich, der sich vom zentralen Rückenmark bis zur mittleren unteren Hinterbein) erstreckt) abzuschneiden. Entfernen Sie den darüber liegenden Bizeps-femoris-Muskel sowie alle anderen Muskeln und das Bindegewebe, die sich in der Nähe des Ischiasnervs befinden. Vermeiden Sie es, den Ischiasnerv und die umliegenden Blutgefäße zu schädigen, insbesondere diejenigen, die sich in der Nähe des lateralen Aspekts des Patella- / Proximalaspekts des lateralen Gastrocnemiuskopfes befinden.
- Wenn der intakte Ischiasnerv ausreichend exponiert ist, tragen Sie vorgewärmte sterile Kochsalzlösung auf den Bereich um den Ischiasnerv auf, um eine Austrocknung zu verhindern. Verwenden Sie eine gekrümmte Pinzette, um das tief liegende Bindegewebe zu stören, und platzieren Sie den vorbereiteten Parafilm-"Keil" unter dem Nerv. Wenn Sie fertig sind, legen Sie salzhaltige Watte auf die exponierte Stelle und bewegen Sie die Maus in die Induktionskammer, die sich oben auf der Wärmematte befindet (auf 37 °C eingestellt), die noch mit Isofluran inO2 gefüllt sein sollte.
- In vivo axonale Bildgebung
- Legen Sie ein 22 x 64 mm großes Deckglas auf den kundenspezifischen Mikroskoptisch und sichern Sie seine Position mit Klebeband. Wählen und tragen Sie Tauchöl auf das Objektiv auf, und schließen Sie dann den Mikroskoptisch an das inverse Mikroskop an. Heben Sie das in Öl eingetauchte Objektiv langsam an, bis ein Kontakt zwischen Öl und Deckglas hergestellt ist.
HINWEIS: Entweder die 40x, 1.3 numerische Apertur (NA) DIC Plan-Apochromat oder 63x, 1.4 NA DIC Plan-Apochromat Öl-Tauchobjektive können verwendet werden, um den In-vivo-Transport im Ischiasnerv abzubilden. - Bewegen Sie das Anästhesiemundstück auf den Mikroskoptisch und sichern Sie die Anästhesieschläuche mit Klebeband, um eine Störung der Anästhesie zu vermeiden. Entfernen Sie die Watte vom Ischiasnerv und bringen Sie die Maus von der Induktionskammer zum Mundstück, wobei der freiliegende Nerv dem Deckglas zugewandt ist. Verwenden Sie chirurgisches Klebeband, um sicherzustellen, dass der Kopf der Maus am Mundstück befestigt ist und das niedrigste und effektivste Anästhesieniveau aufrechterhalten wird. Heben Sie die Maus vorsichtig am Schwanz an und fügen Sie sterile Kochsalzlösung zum Deckglas in der Nähe des freiliegenden Ischiasnervs hinzu, um die Austrocknung einzuschränken und die Bildgebung zu unterstützen.
HINWEIS: Schließen Sie alle Türen der Umweltkammer, um sicherzustellen, dass der Bereich auf Körpertemperatur bleibt. - Lokalisieren Sie mit dem Okular den Ischiasnerv, bestimmen Sie den optimalen Brennpunkt und wählen Sie einen Interessenbereich aus, der bewegliche axonale Organellen enthält.
HINWEIS: Eine detaillierte Erläuterung dieses Prozesses wurde zuvorbeschrieben 32. - Wechseln Sie zur Computersoftware, indem Sie auf die Schaltfläche Erfassung (oder eine gleichwertige Schaltfläche) klicken, und wählen Sie einen Interessenbereich aus. Verwenden Sie einen digitalen Zoom, um eine insgesamt >80-fache Vergrößerung zu erhalten, und drehen Sie den ausgewählten Bereich, um die Axone horizontal zu visualisieren (z. B. von rechts nach links bewegte retrograde Fracht und von links nach rechts bewegte anterograde Fracht).
HINWEIS: Die Richtungsparameter sind benutzerabhängig, müssen aber während der gesamten Experimente konsistent bleiben. - Optimieren Sie die Signalintensität, indem Sie Parameter wie Laserintensität (0,2 - 1%), Pinhole-Blende (1 AU - max), Verstärkung (Master) (700 - 1000), digitalen Offset (-50 - 0) und digitale Verstärkung (1,0 - 4,0) anpassen. Um den potenziellen Einfluss der Phototoxizität zu reduzieren, sollten Sie die Laserintensität nach Möglichkeit bei ≤ 1% und eine maximale Laserintensität von 2% beibehalten. Ändern Sie alle anderen Parameter, bevor Sie die Laserintensität für eine optimale Signalerkennung einstellen.
- Klicken Sie auf das Feld Bereiche (oder ein gleichwertiges Feld), wählen Sie einen gewünschten rechteckigen Bereich aus, legen Sie dann im Erfassungsmodus (oder einem gleichwertigen Bereich) die Framegröße auf mindestens 1024 x 1024 Pixel fest, und beginnen Sie mit der Zeitraffererfassung von 100-1.000 Frames.
HINWEIS: Die gewünschte Bilderfassungsrate ist benutzerabhängig (z. B. kann der Transport mit Bildraten zwischen 0,1 und 6 s bewertet werden) und kann mit Softwareparametern wie Region of Interest, Scan-Geschwindigkeitszeit, Erfassungsmittelung und Laserdirektionalität angepasst werden. Um beispielsweise eine langsamere Bildrate zu erhalten, erhöhen Sie die Höhe/Breite des interessierenden Bereichs, erzielen Sie langsamere Scangeschwindigkeiten, erhöhen Sie die Mittelwertbildung der Erfassung, verwenden Sie die Einzellaserdirektionalität und umgekehrt für eine schnellere Bildrate. Die Bilderfassungsrate muss über vergleichbare Datensätze hinweg konsistent bleiben, da die Bildgebung mit unterschiedlichen Frequenzen zu Inkonsistenzen führen kann. Schnelle Ladungen wie Signalisierungsendosomen erfordern eine schnellere Bildrate (z. B. 0,1-3 s) im Vergleich zu langsameren Organellen wie Mitochondrien, die mit einer langsameren Rate (z. B. 2,5-6 s) analysiert werden können. - Ziel ist es, mindestens 10 bewegliche Ladungen von mindestens drei Axonen pro Maus zu erfassen.
HINWEIS: Basierend auf zweiseitigen Leistungsberechnungen mit zwei Stichproben (mit einer Standardpotenz von 0,8 (1−β) und einer Typ-I-Fehlerrate von 5% (α)) reichen Stichprobengrößen von 6-8 aus, um axonale Transportunterschiede zwischen Wildtyp- und Krankheitsmodellenzu identifizieren 35,43. - Sobald die Bildgebung abgeschlossen ist, euthanasieren Sie die Maus sofort unter Narkose (z. B. Zervixdislokation). Postmortales Gewebe wie Muskeln und Ischiasnerven kann ebenfalls für die weitere Analyse entnommen werden.
- Legen Sie ein 22 x 64 mm großes Deckglas auf den kundenspezifischen Mikroskoptisch und sichern Sie seine Position mit Klebeband. Wählen und tragen Sie Tauchöl auf das Objektiv auf, und schließen Sie dann den Mikroskoptisch an das inverse Mikroskop an. Heben Sie das in Öl eingetauchte Objektiv langsam an, bis ein Kontakt zwischen Öl und Deckglas hergestellt ist.
Ergebnisse
Dieses Dokument beschreibt ein vielseitiges Protokoll, das das in vivo axonale Transport-Toolkit in Nagetiermodellen erweitert. Abbildung 1 zeigt, dass Motoneuronenaxone sowohl von sensorischen Neuronenaxonen als auch von Schwann-Zellen durch transgene Mäuse unterschieden werden können. Abbildung 1A zeigt die eGFP-Expression in cholinergen motorischen Axonen von einer lebenden, betäubten ChAT.eGFP-Maus. Abbildung 1B verwendet eine alternative Methode, um eine tdTomato-Expression in einem frisch ausgeschnittenen Nerv (d. h. keine zusätzliche Gewebeverarbeitung) einer ChAT.tdTomato-Maus zu erreichen. Die Verwendung transgener Stämme wie ChAT.eGFP, ChAT.tdTomato oder Hb9.GFP ermöglicht daher eine motoraxonspezifische Markierung in vivo.
Alternativ können Axone auch identifiziert werden, indem Tracer/Marker (z. B. HCT31,32 oder Viren, die für eGFP15 kodieren) in die Skelettmuskulatur injiziert werden. Abbildung 2 zeigt eine solche Anwendung und zeigt acht robust exprimierende ChAT.eGFP-positive Axone, die HCT-555-positive Signalendosomen (weiße Pfeile) enthalten, ~ 4 h nach der Sondeninjektion in den TA-Muskel. Mit diesem experimentellen Design konnten wir TA-innervierende α-Motoneuronen identifizieren, die überwiegend schnell ermüdbarsind 44. Weitere fünf ChAT.eGFP-Axone mit weniger robuster eGFP-Expression (Abbildung 2A, orangefarbene Sternchen) waren teilweise unscharf und befanden sich wahrscheinlich etwas tiefer im Ischiasnerv.
Darüber hinaus identifizierten wir HCT-555-positive Signalendosomen in eGFP-negativen sensorischen Axonen (gelbe Pfeile). So kann man mit diesem experimentellen Paradigma den axonalen Transport von Signalendosomen in motorischen und sensorischen Neuronen in vivo spezifisch beurteilen und vergleichen. Tatsächlich entdeckten wir mit diesem transgenen Reporterstamm, dass der Transport von signalisierenden Endosomen in ChAT.eGFP-positiven motorischen Axonen schneller ist als in ChAT.eGFP-negativen sensorischen Axonen, die anhand von Axonbreiten zuverlässig unterschiedenwerden können 43.
Wir haben zuvor Motoneuronenaxone mit der ChAT.eGFP-Maus in vivo43 identifiziert. Wir berichten nun, dass HB9. GFP-Mäuse können auch verwendet werden, um die Identifizierung von Motoneuronenaxonen in vivo zu erreichen. Tatsächlich zeigt Abbildung 3 eine Reihe von Zeitrafferbildern von HB9. GFP-Axone mit retrograd bewegten HCT-555-positiven Signalendosomen. Beachten Sie, dass GFP im Gegensatz zu ChAT-gesteuerten Ausdrücken in HB9 ein interpunktierteres/granulareres Muster aufweist. GFP-Axone; Der Grund dafür ist unklar.
Wir haben zuvor beschrieben, wie die mitochondriale Dynamik in Ischiasnerven in vivo durch intraischiatische Nerveninjektionen des mitochondrialen Zielfarbstoffs, Tetramethylrhodamin, Ethylester, Perchlorat (TMRE) 32,36 überwacht werden kann. Um motorische und sensorische Mitochondrien zuverlässig zu unterscheiden, kann die Mito.CFP-Maus, die CFP unter dem Thy1-Promotor 18 exprimiert, mit transgenen Mäusen gekreuzt werden, die ein fluoreszierendes Reportergen in bestimmten neuronalen Typen exprimieren. Tatsächlich konnten wir durch die Züchtung von Mito.CFP-Mäusen mit ChAT.tdTomato-Mäusen (bezeichnet als ChAT.tdTomato::Mito.CFP) Mitochondrien speziell in motorischen Axonen visualisieren, wie in Abbildung 4 gezeigt. In diesem Live-Multiplex-Beispiel konnten fünf ChAT.tdTomato-Axone visualisiert werden, von denen vier CFP-positive Mitochondrien enthalten. Darüber hinaus konnte auch der Knoten von Ranvier (weißer Pfeil in Panel iii) identifiziert werden. Darüber hinaus sind die Knoten von Ranvier in ChAT.eGFP, HB9 eindeutig nachweisbar. GFP- und Mito.CFP-Mäuse (nicht abgebildet). Diese doppelt transgenen Stämme ermöglichen eine intravitale Zeitraffer-Bildgebung von lebenden, anästhesierten Mäusen zur Überwachung des motoneuronenspezifischen mitochondrialen Inhalts und der axonalen Transportdynamik.
Schließlich können signalisierende Endosomen und Mitochondrien gleichzeitig innerhalb derselben Axone in vivo visualisiert werden, indem HCT in die Muskeln von Mito.CFP-Mäusen injiziert wird (Abbildung 5). Intramuskuläre Injektionen von HCT-555 wurden in TA-Muskeln in einer Mito.CFP-Maus ~ 4 h vor der Bildgebung durchgeführt. Sowohl Mitochondrien (i-Panels) als auch Signalendosomen (ii-Panels) wurden gleichzeitig in muskelspezifischen Axonen (d.h. Axonen, die die TA innervieren) visualisiert. Tatsächlich können anterograde (gelbe Dreiecke) und retrograde (grüne Dreiecke und Kreise) bewegte Organellen sowie festgefahrene Organellen (orange Dreiecke und Kreise) beobachtet werden. Mit diesem experimentellen Paradigma kann man die komplexen funktionellen Wechselwirkungen zwischen axonalen Mitochondrien und signalisierenden Endosomen in vivo beurteilen. Insgesamt zeigen wir verschiedene experimentelle Ansätze zur Beurteilung des axonalen Transports von Signalendosomen und/oder Mitochondrien, insbesondere in cholinergen Motoneuronen in vivo.
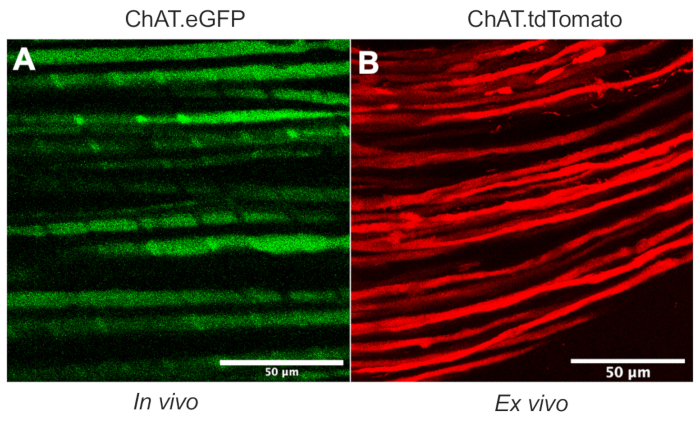
Abbildung 1: Ischiasnervenmotorische Axone . (A) Repräsentatives Einzelebenenbild von eGFP-positiven motorischen Axonen, aufgenommen in vivo von einer ChAT.eGFP-Maus. (B) Repräsentatives Einzelebenenbild von tdTomato-positiven motorischen Axonen in einem ausgeschnittenen Ischiasnerv von einer ChAT.tdTomato-Maus. Unterschiede im Axonkaliber ergeben sich aus Unterschieden in Alter und Größe der Maus. Maßstabsstäbe = 50 μm. Abkürzungen: eGFP = enhanced green fluorescent protein; ChAT = Cholin-Acetyltransferase. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: In vivo axonaler Transport von Signalendosomen in lebenden Ischiasnervenmotoriken und sensorischen Neuronen einer ChAT.eGFP-Maus. (A-C) Repräsentative Bilder von cholinergen Axonen, die eGFP (A) exprimieren und H C T-555-positive Signalendosomen (B) und die Verschmelzung (C) enthalten. Die weißen Pfeile markieren ein eGFP-positives Motoraxon, das H C T-555-positive Signalendosomen enthält, die Cyan-Pfeile identifizieren ein motorisches Axon ohne H C T-555-positive Signalendosomen, und die gelben Pfeile markieren ein eGFP-negatives sensorisches Axon, das HCT-555-positive Signalendosomen transportiert. Orangefarbene Sternchen kennzeichnen motorische Axone mit schwächerer eGFP-Expression. Maßstabsleiste = 25 μm. Abkürzungen: eGFP = enhanced green fluorescent protein; ChAT = Cholin-Acetyltransferase; HCT-555 = Tetanus-Toxin-bindende Domäne. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
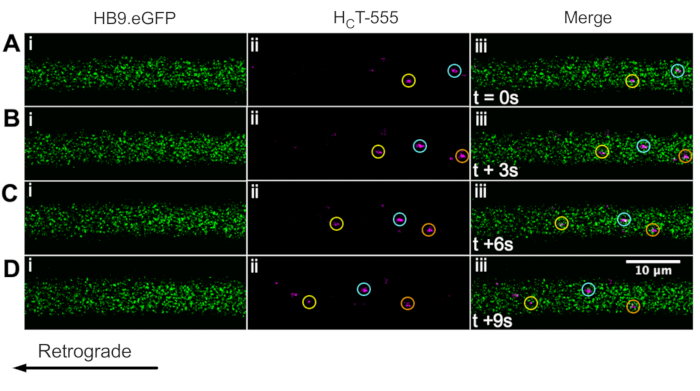
Abbildung 3: Zeitraffer-Bildserie, die den axonalen Transport von Signalendosomen in lebenden Motoneuronen eines HB9 in vivo darstellt. GFP-Maus. (A-D) Alle 3 s aufgenommene Zeitrafferbilder, die Motoneuronenaxone zeigen, die grün fluoreszierendes Protein (i) exprimieren und HCT-555-positive Signalendosomen (ii) und die Verschmelzung (iii) enthalten. Jeder Kreis der gleichen Farbe identifiziert das gleiche sich bewegende Endosom über verschiedene Frames hinweg. Retrograde Bewegung ist von rechts nach links. Maßstabsleiste = 10 μm. Abkürzungen: GFP = grün fluoreszierendes Protein; HCT-555 = Tetanus-Toxin-bindende Domäne. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
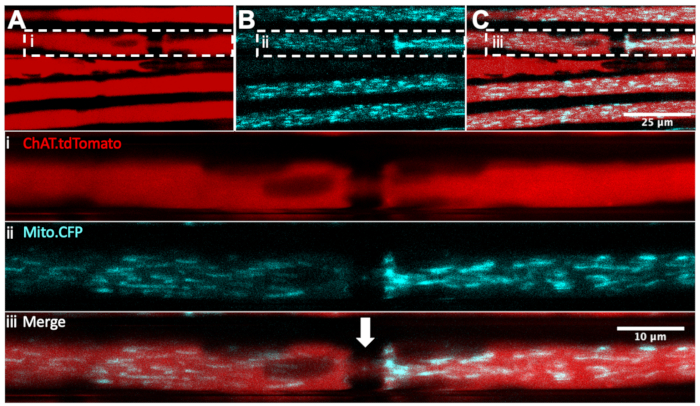
Abbildung 4: In vivo axonaler Transport von Mitochondrien in lebenden Ischiasnerven-Motoneuronen eines ChAT.tdTomato:: Mito.CFP: Maus. (A-C) Repräsentative Bilder von tdTomato-positiven motorischen Axonen (A), die CFP-positive Mitochondrien (B) enthalten, und der Verschmelzung (C). Die eingelassenen Bilder i-iii enthalten eine höhere Vergrößerung von jedem Bedienfeld. Der weiße Pfeil stellt einen vermuteten Knoten von Ranvier dar. Skalenbalken = 25 (A-C) und 10 μm (i-iii). Abkürzungen: ChAT = Cholin-Acetyltransferase; CFP = Cyan-fluoreszierendes Protein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
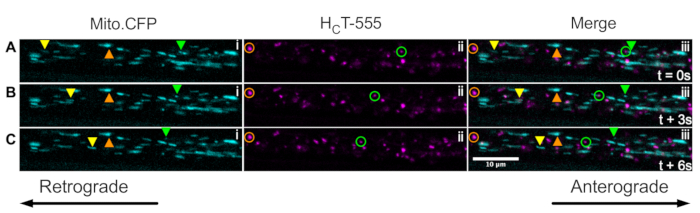
Abbildung 5: Zeitraffer-Bildserien, die den gleichzeitigen axonalen Transport von Mitochondrien in vivo darstellen und Endosomen in lebenden Ischiasnerven-Motoneuronen einer Mito.CFP-Maus signalisieren. (A-C) Alle 3 s aufgenommene Zeitrafferbilder, die den axonalen Transport sowohl der Mitochondrien (i) als auch der Signalendosomen (ii) innerhalb desselben Ischiasnervaxons (iii) darstellen. Die gelben Dreiecke kennzeichnen anterograde bewegte Ladungen, die grünen Kreise / Dreiecke identifizieren rückläufig bewegte Ladungen und die orangefarbenen Kreise / Dreiecke identifizieren stationäre Ladungen. Die anterograde Bewegung verläuft von links nach rechts, während die retrograde Bewegung in die entgegengesetzte Richtung geht. Maßstabsleiste = 10 μm. Abkürzungen: HCT-555 = Tetanus-Toxin-bindende Domäne; CFP = Cyan-fluoreszierendes Protein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Dieses Protokoll beschreibt Schritte zur Beurteilung des axonalen In-vivo-Transports von Signalendosomen und Mitochondrien in intakten Axonen des Ischiasnervs der Maus. In der Tat wird ein Versuchsaufbau bereitgestellt, der es den Benutzern ermöglicht, 1) motorische von sensorischen Neuronen in vivo, in situ und ex vivo zu unterscheiden, indem sie Mäuse verwenden, die fluoreszierende Reporterproteine exprimieren, die selektiv in Motoneuronen exprimiert werden; 2) den axonalen In-vivo-Transport von Signalendosomen spezifisch in Motoneuronenaxonen mit drei verschiedenen transgenen Mäusen zu beurteilen; 3) den axonalen Transport von Mitochondrien in vivo spezifisch in Motoneuronenaxonen untersuchen; und 4) gleichzeitig die In-vivo-Transportdynamik von signalisierenden Endosomen und Mitochondrien innerhalb desselben Axons zu bewerten. Dieser Ansatz hat ein enormes Potenzial für die Untersuchung des axonalen Transports unter basalen Bedingungen und kann verwendet werden, um pathologische Störungen bei verschiedenen Krankheiten zu beurteilen, die periphere motorische und sensorische Nerven betreffen.
Unter Verwendung früherer experimenteller Paradigmen als Grundlage31,32 haben wir hier detaillierte neuartige, robuste Möglichkeiten, den axonalen Transport in motorischen und sensorischen Neuronen mit transgenen Reportermäusen zu unterscheiden. Mit der Mito.CFP-Maus wurde dieser Ansatz weiterentwickelt, um den mitochondrialen Transport in vivo zu beurteilen, indem intraziatische Nerveninjektionen von TMRE36 vermieden wurden. Dadurch werden mögliche neuronale Schäden und Störungen im axonalen Transport umgangen, die durch die intranerväre Injektion der Sonde verursacht werden. Darüber hinaus ermöglicht dieses Protokoll die Visualisierung des axonalen Transports mehrerer Organellen in motorischen Axonen, die Muskeln mit ausgeprägten physiologischen Eigenschaften innervieren (z. B. schnell zuckende ermüdungsresistente Muskeln vs. langsam zuckende, ermüdungsresistente Muskeln). So kann die Signalisierungsendosomen- und/oder mitochondriale axonale Transportdynamik in verschiedenen Untergruppen von α-Motoneuronen44 beurteilt werden. Darüber hinaus kann der axonale Transport dieser Organellen in pathologischen Umgebungen auch durch Kreuzung mit Mausmodellen verschiedener neurodegenerativer Erkrankungen beurteiltwerden 1,2,3.
Das axonale Transport-Toolkit wird kontinuierlicherweitert 28,29, und es wurden Ex-vivo-Protokolle entwickelt, um die Transportdynamik mit kultivierten ventralen Maushornexplantaten 49 oder ausgeschnittenen Mausnerven-Muskel-Präparaten50 zu bewerten. Darüber hinaus hat die Entwicklung von Protokollen zur Beurteilung des axonalen Transports in induzierten humanen pluripotenten Stammzellen (hiPSC)-abgeleiteten kortikalen51-Neuronen oder hiPSC-abgeleiteten spinalen Motoneuronen52 die Untersuchung menschlicher Neuronen mit krankheitsverursachenden Mutationen ermöglicht. Solche hochmodernen Protokolle in Mausgewebe und menschlichen Zellen können kritische Einblicke in die neuronale Funktion liefern, neuartige pathomechanistische Entdeckungen in neurodegenerativen Krankheitsmodellen erleichtern und zum Testen therapeutischer Moleküle und Strategien verwendet werden.
Für die erfolgreiche Implementierung dieser Techniken müssen mehrere kritische Schritte befolgt werden, und im Protokollabschnitt wurden einige wichtige Hinweise gegeben. Die wichtigsten Anforderungen an die intravitale Bildgebung sind das inverse konfokale Mikroskop mit kundenspezifischem Tischeinsatz und die Ausrüstung zur Aufrechterhaltung der Anästhesie und der optimalen Temperatur. In der Tat ist ein spezialisiertes mobiles Anästhesiesystem für 1) Induktion der Anästhesie, 2) Dissektion / Gewebeverarbeitung (dh Freilegung des Ischiasnervs) und 3) Aufrechterhaltung der Anästhesie während der intravitalen Bildgebung (wie zuvor in 31,32 beschrieben) erforderlich. Insbesondere bei Verwendung höherer Vergrößerungsobjektive (z. B. 40x oder 63x) kann die Tiefe der Anästhesie die Bildqualität beeinflussen, da eine tiefere Anästhesie große "keuchende" Atemzüge induziert, die zu häufigen Fokusverschiebungen führen. Solche großen Bewegungen werden sich zweifellos auf die Transportanalysen nach der Bildgebung auswirken (z. B. die Verfolgung von Ladungen mit den Fidschi-Plugins TrackMate53 oder KymoAnalyzer54), da die Atembewegungen Artefakte in Zeitraffervideos erzeugen, die sie für die automatisierte Verfolgung ungeeignet machen können oder eine zeitaufwändigere Bewertung erfordern. Darüber hinaus haben wir auch bildgebende Artefakte beobachtet, die durch pulsierende Arterien im Ischiasnerv verursacht werden, die nur durch die Wahl einer anderen Bildgebungsregion aufgelöst werden können. Das Mikroskop muss mit einer Umgebungskammer ausgestattet sein, die in der Lage ist, eine konstante Körpertemperatur aufrechtzuerhalten, da Temperatur und pH-Wert den axonalen Transport beeinflussen55. Darüber hinaus sollte die Anwendung von Analgetika nach der Operation vermieden werden, da sie die Transportdynamik verändern können56. Wenn das experimentelle Design längsschnittlich ist und eine wiederholte Bildgebung erfordert (z. B. 57), müssen die Dissektionsprotokolle entsprechend angepasst werden, um minimal-invasiv zu sein, und erfordern möglicherweise eine zusätzliche ethische Genehmigung / Lizenzgenehmigung.
Bestimmte experimentelle Überlegungen müssen im Auge behalten werden. Erstens beinhalten die meisten der hier beschriebenen Protokolle die Verwendung von transgenen Mäusen, die fluoreszierende Reporterproteine in Mitochondrien oder Motoneuronenaxonen besitzen. Jede dieser Mauslinien sollte als Hemi-/Heterozygote gezüchtet und abgebildet werden. Die Ausnahmen sind jedoch die ChAT.Cre- und Rosa26.tdTomato-Mauslinien, die separat als Homozygoten beibehalten werden können, wobei die resultierenden hemizygoten Nachkommen die tdTomato-Expression in cholinergen Neuronen nach Cre-loxP-Rekombination ermöglichen. Bei der Kreuzung transgener Hemi-/heterozygoter Mäuse (z. B. Mito.CFP) mit anderen transgenen Hemi-/heterozygoten Mäusen (z. B. ChAT.eGFP) muss die Zuchtstrategie sorgfältig geprüft werden, da die Ermittlung der gewünschten Anzahl von Nachkommen mit doppelter Mutante zeitaufwändig sein kann. Darüber hinaus sollte man bei der Züchtung der F1-Generation von ChAT.Cre- und Rosa26.tdTomato-Mäusen (d.h. ChAT.tdTomato) mit zusätzlichen transgenen Stämmen (z.B. Mito.CFP) noch weniger Mäuse erwarten, die die gewünschten dreifachen Transgene tragen. Darüber hinaus muss man auch die potenzielle Fluorophorüberlappung berücksichtigen, wenn Zwei-Reporter-Mäuse mit nahe gelegenen Wellenlängeneigenschaften gezüchtet werden (z.B. Mito-CFP-Anregung: 435 nm, Emission: 485 nm, gezüchtet mit ChAT.eGFP-Anregung: 488 nm, Emission:510 nm), obwohl es möglich sein könnte, dieses Problem mit spektraler Entmischung 58 zu überwinden.
Diese Technik hat einige Einschränkungen, die berücksichtigt werden müssen. In dieser Arbeit und unseren früheren Protokollen31,32 haben wir gezeigt, wie mehrere genetisch kodierte Marker und verschiedene Färbemethoden verwendet werden können, um verschiedene Organellen in vivo zu markieren und zu verfolgen. Allerdings sind nicht alle Sonden für diesen experimentellen Ansatz geeignet. Wir untersuchten Injektionen in TA oder Soleusmuskel der Choleratoxin-beta-Untereinheit (CTB)-488 (0,5-1,5 μg/μL ~4 h vor der Bildgebung), einer Sonde, die routinemäßig zur Markierung von Motoneuronzellkörpern in in vivo retrograden Tracer-Experimenten59,60 verwendet wird. Wenn sie jedoch allein injiziert oder mit HCT-555 co-injiziert wurde, war die CTB-488-Markierung schlecht, obwohl Konzentrationen verwendet wurden, die denen für eine erfolgreiche retrograde Motoneuronenverfolgung ähnlich waren. Daher kommen wir zu dem Schluss, dass, obwohl CTB ein ausgezeichneter In-vitro-Marker für signalisierende Endosomen in neuronalen Kulturenist 61, HCT die Goldstandardsonde bleibt, um signalisierende Endosomen in vivo in Ischiasnervaxonen zu identifizieren.
Auf verschiedenen Routen testeten wir auch Sonden, die routinemäßig zur Markierung von Lysosomen verwendet werden, wie LysoTracker grün DND-26, und Marker aktiver lysosomaler Hydrolasen wie BODIPY-FL-Pepstatin A für Cathepsin D62 und Magic Red für Cathepsin B, jedoch ohne Erfolg. Wir versuchten die intramuskuläre Verabreichung von BODIPY-FL-Pepstatin A (2,5 μg in die TA ~4 h vor der Bildgebung) sowie die intrainziatorische Nerveninjektion von 2 μL LysoTracker (10 μM), BODIPY-FL-pepstatin A (10 μM) oder Magic Red (1/10) 30-60 min vor der Bildgebung. Trotz dieser Sonden, die den Nerv hervorhoben, konnten wir keine eindeutig gekennzeichneten Organellen finden. Die Sonden sammelten sich um Axone an und wurden wahrscheinlich von Schwann-Zellen zurückgehalten. Daher kann die erfolglose Markierung von Lysosomen auf eine mangelhafte Sondenabgabe in Neuronen zurückzuführen sein, obwohl das Vorhandensein geeigneterer Konzentrationen nicht ausgeschlossen werden kann. Da die TMRE-Markierung unter ähnlichen Bedingungen funktioniert (d. h. intraziatische Nerveninjektionen), kann die Markierungsintensität farbstoffabhängig sein und muss für jeden Marker unabhängig getestet werden. Wir kommen jedoch zu dem Schluss, dass das Targeting von Lysosomen in vivo mit diesen Sonden bei den oben genannten Konzentrationen nicht möglich ist.
Anästhesiemethoden können unterschiedliche physiologische Auslesungen verändern (z. B. Cochlea-Funktion63 und kortikale Elektrophysiologie64); Ob die Anästhesie jedoch den axonalen Transport im Ischiasnerv in vivo beeinflusst, ist derzeit nicht bekannt. Angesichts der reduzierten neuromuskulären Aktivität unter Isofluran-induzierter Anästhesie ist es möglich, dass sich die Transportkinetik im Vergleich zum Wachzustand unterscheidet. Die einzige In-vivo-Studie, die dies direkt untersucht hat, ergab jedoch, dass sich der Transport von dichten Kernvesikeln in thalamokortikalen Projektionen zwischen anästhesierten und wachen Mäusennicht unterscheidet 65. Da Unterschiede im Transport zwischen Wildtyp- und Krankheitsmodellmäusen unter Narkose35,43 nachweisbar sind, ist es außerdem klar, dass die Isofluran-Exposition die Identifizierung von Perturbanen bei der Signalübertragung von Endosomen- oder Mitochondrienverkehr nicht verhindert.
Dieses Protokoll hat andere potenzielle Anwendungen, die im Folgenden beschrieben wurden. Die Züchtung der in diesem Protokoll beschriebenen transgenen Mäuse (z. B. Mito.CFP, ChAT.eGFP) mit den Mausmodellenfür neurodegenerative Erkrankungen 1,2,3 ermöglicht neuronensubtyp- und/oder frachtspezifische Untersuchungen. Darüber hinaus würden kürzlich entwickelte Cre-Linien66 der Maus auch die Visualisierung von fluoreszierenden Reporterproteinen in verschiedenen sensorischen Axonpopulationen ermöglichen. Zum Beispiel können Rosa26.tdTomatenmäuse mit einem Neuropeptid Y-Rezeptor-2-exprimierend (Npy2r) gekreuzt werden. Cre-Maus zur Aktivierung der tdTomato-Fluoreszenz in myelinisierten A-Faser-Nozizeptoren67. Darüber hinaus kann die zeitliche Kontrolle auch durch den Einsatz induzierbarer Cre-Systeme (z. B. Tamoxifen) erreicht werden68. Eine weitere mögliche Anwendung beruht auf der Verfügbarkeit von transgenen Mäusen, die fluoreszierende Reporterproteine in Schwann-Zellen exprimieren. Tatsächlich ermöglichen S100-GFP 69- undPLP-GFP 70-Mäuse In-vivo- und/oder In-situ-Bildgebung von Schwann-Zellen und stehen an der Spitze der Forschung, die an der Migration von Schwann-Zellen während der peripheren Nervenregeneration beteiligt ist.
Zusätzlich zu diesen Anwendungen und ergänzend zur Mito.CFP-Maus ist die Verfügbarkeit mehrerer transgener Mauslinien, die fluoreszierende Proteine in verschiedenen Organellen wie Mitochondrien und Autophagosomen exprimieren. Zum Beispiel könnte die Untersuchung des mitochondrialen Transports in vivo mit der mito::mKate2 Maus71 oder der photokonvertierbaren mitoDendra Maus57 möglich sein. Darüber hinaus kann ein In-vivo-Mitophagosomentransport mit der pH-sensitiven Mito-Keima-Maus72 und der Mito-QC-Maus73 für mitophagische Analysen möglich sein. Darüber hinaus können die lysosomalen Markierungsschwierigkeiten, auf die wir gestoßen sind, durch die Verwendung von Mäusen, die LAMP1-GFP exprimieren, überwunden werden, mit dem Vorbehalt, dass LAMP1 auch in endokytischen Organellen vorhanden ist, die sich von Lysosomen74 unterscheiden.
Zusammenfassend haben wir neue Wege aufgezeigt, um den axonalen Transport mehrerer Organellen in bestimmten peripheren Nervenaxonen von verschiedenen transgenen Mäusen in vivo zu beurteilen. Die gleichzeitige Bildgebung verschiedener Organellen wird angesichts der jüngsten Erkenntnisse über axonale Wechselwirkungen und den gemeinsamen Handel mit Organellen wie Mitochondrien und Endosomen besonders wichtig sein75,76. Wir glauben, dass die vorgestellten Methoden nützlich sein werden, um das Verständnis der Basalphysiologie von Axonen in vivo zu verbessern und wichtige Pathomechanismen zu entwirren, die die Neurodegeneration peripherer Nerven vorantreiben.
Offenlegungen
Die Autoren haben keine Interessenkonflikte.
Danksagungen
Wir danken Robert M. Brownstone (Queen Square Institute of Neurology, University College London) für die gemeinsame Nutzung der ChAT-eGFP-, ChAT.Cre- und Rosa26.tdTomato-Mäuse sowie Pietro Fratta (Queen Square Institute of Neurology, University College London) für die gemeinsame Nutzung des HB9. GFP-Maus. Wir danken Elena R. Rhymes, Charlotte J.P. Kremers und Qiuhan Lang (Queen Square Institute of Neurology, University College London) für die kritische Lektüre des Manuskripts. Diese Arbeit wurde unterstützt durch ein Junior Non-Clinical Fellowship der Motor Neuron Disease Association (UK) (Tosolini/Oct20/973-799) (APT), die Wellcome Trust Senior Investigator Awards (107116/Z/15/Z und 223022/Z/21/Z) (GS), einen Preis der UK Dementia Research Institute Foundation (GS); und einen Medical Research Council Career Development Award (MR/S006990/1) (JNS).
Materialien
| Name | Company | Catalog Number | Comments |
| 0.2 mL PCR tube | |||
| 70% (v/v) ethanol in distilled water | |||
| AlexaFlour555 C2 maleimide | ThermoFisher Scientific | A-20346 | Can also use AlexaFlour-488 or -647 Maleimide |
| B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze/J | Jackson Laboratory | 7909 | Rosa26.tdTomato mice |
| B6.Cg-Tg(Hlxb9-GFP)1Tmj/J mice | Jackson Laboratory | 5029 | HB9.GFP mice |
| B6.Cg-Tg(Thy1-CFP/COX8A)S2Lich/J mice | Jackson Laboratory | 7967 | Mito.CFP mice |
| B6;129S6-Chattm2(cre)Lowl/J mice | Jackson Laboratory | 6410 | ChAT.Cre mice |
| Computer with microscope control and image acquisition software | Zeiss | Zen | |
| Cotton swab | |||
| Desktop centrifuge | |||
| Dissecting microscope | |||
| Eye lubricant | |||
| Fine curved forceps | Dumont | ||
| Fine straight forceps | Dumont | ||
| Glass coverslip (22 x 64 mm, thickness no. 1) | |||
| Graduated, glass micropipette with microliter markings and plunger | Drummond Scientific | 5-000-1001-X10 | |
| Hair clippers | |||
| Hamilton microliter syringe (701 N, volume 10 μL, needle size 26 s G, bevel tip, needle L 51 mm) | Merck | 20779 | |
| HcT-441 | N/A | N/A | See Restani et al., 2012 for more details |
| Heating pad | |||
| Immersion oil for fluorescent imaging at 37 °C | |||
| Inverted confocal microscope with environmental chamber | Zeiss | LSM 780 | Most inverted confocals should be adaptable |
| Isoflurane | |||
| Isoflurane vaporizer/anesthesia machine with induction cham-ber and mask stabilizer | |||
| Magic tape | invisible tape | ||
| Micropipette puller | |||
| Parafilm | Parafilm | ||
| Phosphate-buffered saline (PBS): 137 mM NaCl, 10 mM Na2HPO4, 2.7 mM KCl, 1.8 mM KH2PO4–HCl, pH 7.4 | |||
| Recombinant human brain-derived neurotrophic factor (BDNF) | Peprotech | 450-02 | BDNF that can be co-injected with HcT-555 |
| Saline | |||
| Scalpel blade | Dumont | ||
| Small spring scissors | Dumont | ||
| Surgery/operating microscope | |||
| Surgical drape | |||
| Surgical suture | |||
| Surgical tape | |||
| Tg(Chat-EGFP) GH293Gsat/Mmucd mice | MMRRC | 000296-UCD | ChAT.eGFP |
| Vortex mixer |
Referenzen
- Webster, R. G. Animal models of the neuromuscular junction, vitally informative for understanding function and the molecular mechanisms of congenital myasthenic syndromes. International Journal of Molecular Sciences. 19 (5), 1326 (2018).
- Sleigh, J. N., Gillingwater, T. H., Talbot, K. The contribution of mouse models to understanding the pathogenesis of spinal muscular atrophy. Disease Models & Mechanisms. 4 (4), 457-467 (2011).
- De Giorgio, F., Maduro, C., Fisher, E. M. C., Acevedo-Arozena, A. Transgenic and physiological mouse models give insights into different aspects of amyotrophic lateral sclerosis. Disease Models & Mechanisms. 12 (1), 037424 (2019).
- Ilieva, H., Polymenidou, M., Cleveland, D. W. Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. The Journal of Cell Biology. 187 (6), 761-772 (2009).
- Brown, R. H., Al-Chalabi, A. Amyotrophic lateral sclerosis. The New England Journal of Medicine. 377 (2), 162-172 (2017).
- Gong, S., et al. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425 (6961), 917-925 (2003).
- Tallini, Y. N., et al. BAC transgenic mice express enhanced green fluorescent protein in central and peripheral cholinergic neurons. Physiological Genomics. 27 (3), 391-397 (2006).
- Zeilhofer, H. U., et al. Glycinergic neurons expressing enhanced green fluorescent protein in bacterial artificial chromosome transgenic mice. The Journal of Comparative Neurology. 482 (2), 123-141 (2005).
- Kaiser, T., Ting, J. T., Monteiro, P., Feng, G. Transgenic labeling of parvalbumin-expressing neurons with tdTomato. Neuroscience. 321, 236-245 (2016).
- Zheng, B., Sage, M., Sheppeard, E. A., Jurecic, V., Bradley, A. Engineering mouse chromosomes with Cre-loxP: range, efficiency, and somatic applications. Molecular and Cellular Biology. 20 (2), 648-655 (2000).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Bareyre, F. M., Kerschensteiner, M., Misgeld, T., Sanes, J. R. Transgenic labeling of the corticospinal tract for monitoring axonal responses to spinal cord injury. Nature Medicine. 11 (12), 1355-1360 (2005).
- Willems, J., et al. A CRISPR/Cas9-based genome editing toolbox for epitope tagging of endogenous proteins in neurons. PLoS Biology. 18 (4), 3000665 (2020).
- Huh, Y., Oh, M. S., Leblanc, P., Kim, K. -. S. Gene transfer in the nervous system and implications for transsynaptic neuronal tracing. Expert Opinion on Biological Therapy. 10 (5), 763-772 (2010).
- Tosolini, A. P., Morris, R. Targeting motor end plates for delivery of adenoviruses: an approach to maximize uptake and transduction of spinal cord motor neurons. Scientific Reports. 6, 33058 (2016).
- Andrews, M. R. Gene therapy in the CNS-one size does not fit all. Gene Therapy. 28 (7-8), 393-395 (2021).
- Kügler, S. Tissue-specific promoters in the CNS. Methods in Molecular Biology. 1382, 81-91 (2016).
- Misgeld, T., Kerschensteiner, M., Bareyre, F. M., Burgess, R. W., Lichtman, J. W. Imaging axonal transport of mitochondria in vivo. Nature Methods. 4 (7), 559-561 (2007).
- Mizushima, N., Yamamoto, A., Matsui, M., Yoshimori, T., Ohsumi, Y. In vivo analysis of autophagy in response to nutrient starvation using transgenic mice expressing a fluorescent autophagosome marker. Molecular Biology of the Cell. 15 (3), 1101-1111 (2004).
- Dana, H., et al. Thy1-GCaMP6 transgenic mice for neuronal population imaging in vivo. PLoS One. 9 (9), 108697 (2014).
- Chen, Q., et al. Imaging neural activity using Thy1-GCaMP transgenic mice. Neuron. 76 (2), 297-308 (2012).
- Maday, S., Twelvetrees, A. E., Moughamian, A. J., Holzbaur, E. L. F. Axonal transport: cargo-specific mechanisms of motility and regulation. Neuron. 84 (2), 292-309 (2014).
- Terenzio, M., Schiavo, G., Fainzilber, M. Compartmentalized signaling in neurons: from cell biology to neuroscience. Neuron. 96 (3), 667-679 (2017).
- Abouward, R., Schiavo, G. Walking the line: mechanisms underlying directional mRNA transport and localisation in neurons and beyond. Cellular and Molecular Life Sciences. 78 (6), 2665-2681 (2021).
- Sleigh, J. N., Rossor, A. M., Fellows, A. D., Tosolini, A. P., Schiavo, G. Axonal transport and neurological disease. Nature Reviews. Neurology. 15 (12), 691-703 (2019).
- Bronfman, F. C., Moya-Alvarado, G. BDNF/TrkB signaling endosomes mediate long-distance dendritic growth by activating CREB/PI3K-mTOR-dependent translation in neuronal cell bodies. BioRxiv. , (2020).
- Nagano, S., Araki, T. Axonal Transport and Local Translation of mRNA in Neurodegenerative Diseases. Frontiers in Molecular Neuroscience. 14, 697973 (2021).
- Boecker, C. A., Olenick, M. A., Gallagher, E. R., Ward, M. E., Holzbaur, E. L. F. ToolBox: Live Imaging of intracellular organelle transport in induced pluripotent stem cell-derived neurons. Traffic. 21 (1), 138-155 (2020).
- Surana, S., et al. The evolution of the axonal transport toolkit. Traffic. 21 (1), 13-33 (2020).
- Sleigh, J. N., Vagnoni, A., Twelvetrees, A. E., Schiavo, G. Methodological advances in imaging intravital axonal transport. F1000Research. 6, 200 (2017).
- Gibbs, K. L., Kalmar, B., Sleigh, J. N., Greensmith, L., Schiavo, G. In vivo imaging of axonal transport in murine motor and sensory neurons. Journal of Neuroscience Methods. 257, 26-33 (2016).
- Sleigh, J. N., Tosolini, A. P., Schiavo, G. In vivo imaging of anterograde and retrograde axonal transport in rodent peripheral nerves. Methods in Molecular Biology. 2143, 271-292 (2020).
- Gibbs, K. L., et al. Inhibiting p38 MAPK alpha rescues axonal retrograde transport defects in a mouse model of ALS. Cell Death & Disease. 9 (6), 596 (2018).
- Fellows, A. D., Rhymes, E. R., Gibbs, K. L., Greensmith, L., Schiavo, G. IGF1R regulates retrograde axonal transport of signalling endosomes in motor neurons. EMBO Reports. 21 (3), 49129 (2020).
- Bilsland, L. G., Sahai, E., Kelly, G., Golding, M., Greensmith, L., Schiavo, G. Deficits in axonal transport precede ALS symptoms in vivo. Proceedings of the National Academy of Sciences of the United States of America. 107 (47), 20523-20528 (2010).
- Kalinski, A. L., et al. Deacetylation of Miro1 by HDAC6 blocks mitochondrial transport and mediates axon growth inhibition. The Journal of Cell Biology. 218 (6), 1871-1890 (2019).
- Bercsenyi, K., et al. Tetanus toxin entry. Nidogens are therapeutic targets for the prevention of tetanus. Science. 346 (6213), 1118-1123 (2014).
- Deinhardt, K., et al. Rab5 and Rab7 control endocytic sorting along the axonal retrograde transport pathway. Neuron. 52 (2), 293-305 (2006).
- Debaisieux, S., Encheva, V., Chakravarty, P., Snijders, A. P., Schiavo, G. Analysis of signaling endosome composition and dynamics using SILAC in embryonic stem cell-derived neurons. Molecular & Cellular Proteomics. 15 (2), 542-557 (2016).
- Surana, S., et al. The travel diaries of tetanus and botulinum neurotoxins. Toxicon. 147, 58-67 (2018).
- Villarroel-Campos, D., Schiavo, G., Lazo, O. M. The many disguises of the signalling endosome. FEBS Letters. 592 (21), 3615-3632 (2018).
- Malik, B., et al. Absence of disturbed axonal transport in spinal and bulbar muscular atrophy. Human Molecular Genetics. 20 (9), 1776-1786 (2011).
- Sleigh, J. N., et al. Mice carrying ALS mutant TDP-43, but not mutant FUS, display in vivo defects in axonal transport of signaling endosomes. Cell Reports. 30 (11), 3655-3662 (2020).
- Tosolini, A. P., Sleigh, J. N., Surana, S., Rhymes, E. R., Cahalan, S. D., Schiavo, G. modulation of axonal transport is selectively impaired in ALS. BioRxiv. , (2021).
- Restani, L., et al. Botulinum neurotoxins A and E undergo retrograde axonal transport in primary motor neurons. PLoS Pathogens. 8 (12), 1003087 (2012).
- Mohan, R., Tosolini, A. P., Morris, R. Intramuscular injections along the motor end plates: a minimally invasive approach to shuttle tracers directly into motor neurons. Journal of Visualized Experiments: JoVE. (101), e52846 (2015).
- Tosolini, A. P., Mohan, R., Morris, R. Targeting the full length of the motor end plate regions in the mouse forelimb increases the uptake of fluoro-gold into corresponding spinal cord motor neurons. Frontiers in Neurology. 4, 58 (2013).
- Mohan, R., Tosolini, A. P., Morris, R. Targeting the motor end plates in the mouse hindlimb gives access to a greater number of spinal cord motor neurons: an approach to maximize retrograde transport. Neuroscience. 274, 318-330 (2014).
- Altman, T., Maimon, R., Ionescu, A., Pery, T. G., Perlson, E. Axonal transport of organelles in motor neuron cultures using microfluidic chambers system. Journal of Visualized Experiments: JoVE. (159), e60993 (2020).
- Boyer, N. P., Azcorra, M., Jung, P., Brown, A. Imaging and analysis of neurofilament transport in excised mouse tibial nerve. Journal of Visualized Experiments: JoVE. (162), e61264 (2020).
- Mou, Y., Mukte, S., Chai, E., Dein, J., Li, X. -. J. Analyzing mitochondrial transport and morphology in human induced pluripotent stem cell-derived neurons in hereditary spastic paraplegia. Journal of Visualized Experiments: JoVE. (156), e60548 (2020).
- Stoklund Dittlau, K., et al. Generation of human motor units with functional neuromuscular junctions in microfluidic devices. Journal of Visualized Experiments: JoVE. (175), e62959 (2021).
- Tinevez, J. -. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Neumann, S., Chassefeyre, R., Campbell, G. E., Encalada, S. E. KymoAnalyzer: a software tool for the quantitative analysis of intracellular transport in neurons. Traffic. 18 (1), 71-88 (2017).
- Bohnert, S., Schiavo, G. Tetanus toxin is transported in a novel neuronal compartment characterized by a specialized pH regulation. The Journal of Biological Chemistry. 280 (51), 42336-42344 (2005).
- Kanai, A., et al. Low-concentration lidocaine rapidly inhibits axonal transport in cultured mouse dorsal root ganglion neurons. Anesthesiology. 95 (3), 675-680 (2001).
- Bolea, I., Gan, W. -. B., Manfedi, G., Magrané, J. Imaging of mitochondrial dynamics in motor and sensory axons of living mice. Methods in Enzymology. , 97-110 (2014).
- Cohen, S., Valm, A. M., Lippincott-Schwartz, J. Multispectral live-cell imaging. Current Protocols in Cell Biology. 79 (1), 46 (2018).
- Blum, J. A., et al. Single-cell transcriptomic analysis of the adult mouse spinal cord reveals molecular diversity of autonomic and skeletal motor neurons. Nature Neuroscience. 24 (4), 572-583 (2021).
- Xu, J., et al. An approach to maximize retrograde transport based on the spatial distribution of motor endplates in mouse hindlimb muscles. Frontiers in Cellular Neuroscience. 15, 707982 (2021).
- Wang, T., et al. Flux of signalling endosomes undergoing axonal retrograde transport is encoded by presynaptic activity and TrkB. Nature Communications. 7, 12976 (2016).
- Chen, C. S., Chen, W. N., Zhou, M., Arttamangkul, S., Haugland, R. P. Probing the cathepsin D using a BODIPY FL-pepstatin A: applications in fluorescence polarization and microscopy. Journal of Biochemical and Biophysical Methods. 42 (3), 137-151 (2000).
- Cederholm, J. M. E., et al. Differential actions of isoflurane and ketamine-based anaesthetics on cochlear function in the mouse. Hearing Research. 292 (1-2), 71-79 (2012).
- Michelson, N. J., Kozai, T. D. Y. Isoflurane and ketamine differentially influence spontaneous and evoked laminar electrophysiology in mouse V1. Journal of Neurophysiology. 120 (5), 2232-2245 (2018).
- Knabbe, J., Nassal, J. P., Verhage, M., Kuner, T. Secretory vesicle trafficking in awake and anaesthetized mice: differential speeds in axons versus synapses. The Journal of Physiology. 596 (16), 3759-3773 (2018).
- Gong, S., et al. Targeting Cre recombinase to specific neuron populations with bacterial artificial chromosome constructs. The Journal of Neuroscience. 27 (37), 9817-9823 (2007).
- Arcourt, A., et al. Touch receptor-derived sensory information alleviates acute pain signaling and fine-tunes nociceptive reflex coordination. Neuron. 93 (1), 179-193 (2017).
- Valny, M., Honsa, P., Kirdajova, D., Kamenik, Z., Anderova, M. Tamoxifen in the mouse brain: implications for fate-mapping studies using the tamoxifen-inducible Cre-loxP system. Frontiers in Cellular Neuroscience. 10, 243 (2016).
- Hayashi, A., et al. A double-transgenic mouse used to track migrating Schwann cells and regenerating axons following engraftment of injured nerves. Experimental Neurology. 207 (1), 128-138 (2007).
- Chen, B., Chen, Q., Parkinson, D. B., Dun, X. -. P. Analysis of schwann cell migration and axon regeneration following nerve injury in the sciatic nerve bridge. Frontiers in Molecular Neuroscience. 12, 308 (2019).
- Barrasso, A. P., Tong, X., Poché, R. A. The mito::mKate2 mouse: A far-red fluorescent reporter mouse line for tracking mitochondrial dynamics in vivo. Genesis. 56 (2), (2018).
- Sun, N., et al. A fluorescence-based imaging method to measure in vitro and in vivo mitophagy using mt-Keima. Nature Protocols. 12 (8), 1576-1587 (2017).
- McWilliams, T. G., et al. mito-QC illuminates mitophagy and mitochondrial architecture in vivo. The Journal of Cell Biology. 214 (3), 333-345 (2016).
- Cheng, X. -. T., et al. Characterization of LAMP1-labeled nondegradative lysosomal and endocytic compartments in neurons. The Journal of Cell Biology. 217 (9), 3127-3139 (2018).
- Cioni, J. -. M., Lin, J. Q., et al. Late Endosomes Act as mRNA Translation Platforms and Sustain Mitochondria in Axons. Cell. 176 (12), 56 (2019).
- Liao, Y. -. C., Fernandopulle, M. S., et al. RNA Granules Hitchhike on Lysosomes for Long-Distance Transport, Using Annexin A11 as a Molecular Tether. Cell. 179 (1), (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten