Method Article
In vitro Beurteilung der Aorteninsuffizienz mittels vierdimensionaler Strömungsmagnetresonanztomographie
In diesem Artikel
Zusammenfassung
Aorteninsuffizienz ist eine Herzerkrankung der Aortenklappe. Dieses Manuskript zeigt, wie die vierdimensionale Strömungsmagnetresonanztomographie die Aorteninsuffizienz unter Verwendung von In-vitro-Herzklappen bewerten kann, die das Aorteninsuffizienz nachahmen.
Zusammenfassung
Aorteninsuffizienz (AR) bezieht sich auf den rückwärtigen Blutfluss von der Aorta in den linken Ventrikel (LV) während der ventrikulären Diastole. Der aus der komplexen Form entstehende aufdringliche Strahl ist durch die dreidimensionale Strömung und den Hochgeschwindigkeitsgradienten gekennzeichnet, was manchmal eine genaue Messung des aufstoßenden Volumens mittels 2D-Echokardiographie einschränkt. Die neu entwickelte vierdimensionale Strömungsmagnetresonanztomographie (4D-Durchfluss-MRT) ermöglicht dreidimensionale Volumenstrommessungen, mit denen die Menge des Aufstoßens genau quantifiziert werden kann. Diese Studie konzentriert sich auf (i) magnetresonanzkompatible AR-Modellherstellung (Dilatation, Perforation und Prolaps) und (ii) systematische Analyse der Leistung der 4D-Strömungs-MRT in der AR-Quantifizierung. Die Ergebnisse zeigten, dass die Bildung der Vorwärts- und Rückwärtsdüsen im Laufe der Zeit stark von den Arten der AR-Herkunft abhängig war. Die Verzerrung des Aufstoßensvolumens für die Modelltypen betrug -7,04%, -33,21%, 6,75% und 37,04% im Vergleich zum Ground Truth (48 ml) Volumen, gemessen am Pumpenhubvolumen. Der größte Fehler der Regurgitationsfraktion lag bei etwa 12%. Diese Ergebnisse deuten darauf hin, dass eine sorgfältige Auswahl der Bildgebungsparameter erforderlich ist, wenn das absolute Regurgitationsvolumen wichtig ist. Das vorgeschlagene In-vitro-Flussphantom kann leicht modifiziert werden, um andere Herzklappenerkrankungen wie Aortenstenose oder Bikuspidalaortenklappe (BAV) zu simulieren, und kann als Standardplattform verwendet werden, um in Zukunft verschiedene MRT-Sequenzen zu testen.
Einleitung
Aorteninsuffizienz (AR) bezieht sich auf den Rückfluss von der Aorta in den linken Ventrikel während der diastolischen Phase des Ventrikels. AR wird typischerweise in Aortendilatation, Cups-Prolaps, Cups-Perforation, Cups-Retraktion und andereunterteilt 1. Chronische AR kann die Volumenüberlastung des LV hauptsächlich aufgrund von Hypertrophie und Dilatation verursachen und schließlich seine Dekompensationverursachen 2. Akute AR wird hauptsächlich durch infektiöse Endokarditis, Aortendissektion und traumatische Ruptur verursacht, die zu hämodynamischen Notfällen führt2.
Aktuelle klinische Standards für die AR-Diagnostik basieren hauptsächlich auf der transthorakalen Echokardiographie (TTE) oder der transösophagealen Echokardiographie (TEE)3. Trotz der Vorteile der Echtzeitbildgebung und der kurzen Untersuchungszeit ist die Genauigkeit der Echokardiographie stark bedienerabhängig. Insbesondere bei der Regurgitantenvolumenmessung ist die direkte Messung des Regurgitationsvolumens begrenzt, da sich der Regurgitationsstrahl aufgrund der Bewegung der Aortenklappe aus der zweidimensionalen (2D) Messebene verschiebt. Indirekte Schätzungen mit PISA-Methoden (Proximal Iso-Velocity Surface) werden häufig verwendet, aber Annahmen wie die kreisförmige Öffnungsfläche begrenzen oft die genaue Messung4.
Jüngste medizinische Leitlinien5 empfehlen auch eine kardiale MR (CMR), insbesondere für mittelschwere oder schwere AR-Patienten, um die Einschränkung der Echokardiographie durch Messung der Masse und der globalen Funktion der LV auszugleichen. Strukturparameter wie Aortenblättchen und LV-Größe sowie Durchflussparameter wie Strahlbreite, Vena-Contracta-Breite und Aufstoßensvolumen können in der AR-Diagnostik ebenfalls umfassend berücksichtigtwerden 6 . Das mit der globalen LV-Funktion geschätzte Aorteninsuffizienzvolumen kann jedoch insbesondere bei Patienten mit anderen Herzklappenerkrankungen oder Shunt fehlschlagen.
Alternativ wurde die 4D-Strömungs-MRT als vielversprechende Technik angesehen, die das aufstoßende Volumen direkt mit zeitaufgelösten Geschwindigkeitsinformationen innerhalb des interessierenden Volumensmessen kann 7. Die Bewegung des Ventils entsprechend der Zeit kann bei der Messung des aufstoßenden Durchflussvolumens 8,9 leicht verfolgt und kompensiert werden. Auch eine beliebige Ebene senkrecht zum aufdringlichen Strahl kann retrospektiv positioniert werden, was die Genauigkeit der Messung10 erhöht. Da die 4D-Strömungs-MRT jedoch von Natur aus die räumlich-zeitlich gemittelten Informationen erhält, rechtfertigt die Genauigkeit dieser Technik immer noch eine Validierung durch die Verwendung gut kontrollierter In-vitro-Flussexperimente.
Diese Studie zielt darauf ab, (i) eine MRT-kompatible In-vitro-Versuchsplattform zu entwickeln, die die verschiedenen klinischen Szenarien von AR (Dilatation, Perforation und Prolaps) reproduzieren kann, und (ii) unser Verständnis der 4D-Flow-MRT-Leistung bei der Quantifizierung verschiedener AR an diesen AR-Modellen zu bereichern. Darüber hinaus wurden hämodynamische 3D-Visualisierungen und Quantifizierungen auf Basis der 4D-Strömungs-MRT nach den verschiedenen klinischen Szenarien durchgeführt. Dieses Protokoll ist nicht auf AR beschränkt und kann auf andere Arten von Studien zu Herzklappenerkrankungen ausgeweitet werden, die eine Reihe von In-vitro-Experimenten und hämodynamischer Quantifizierung erfordern.
Protokoll
HINWEIS: Das Protokoll besteht größtenteils aus drei Phasen: (1) Modellherstellung, (2) MRT-Scan und Parameterauswahl und (3) Datenanalyse. Abbildung 1 ist ein Flussdiagramm, das den Gesamtprozess des Protokolls zeigt.
1. Modellherstellung
- Aortenwurzelmodell
- Wie in Abbildung 2 dargestellt, bestimmen Sie die Parameterwerte der Aortenwurzel, z. B. den Durchmesser der Ventilbasis und den Sinusradius. Für dieses Experiment waren die Werte D A = 32,24 mm, DO = 26 mm, LB = 8,84 mm, LA = 26 mm, r min = 16,64 mm, rmax = 21,32 mm.
- Führen Sie die 3D-Modellierungssoftware aus, indem Sie auf Skizzieren > Werkzeuge Skizzenwerkzeuge > Skizzenbild (Sketch Picture) klicken.
HINWEIS: Solidwork wird im Experiment für die 3D-Modellierung verwendet. - Um ein Sinusmodell zu erstellen, skizzieren Sie mit dem Kreiswerkzeug Kreise, die rmax und rmin entsprechen. Zeichnen Sie eine gekrümmte Linie des Sinus mit der freien Kurvenfunktion11, klicken Sie auf Loft-Werkzeug und wählen Sie den Skizzenbereich für Loft aus.
- Skizzieren Sie zusätzliche Kreise oben und unten im aktuellen Modell, klicken Sie auf Extrusionswerkzeug (Extrude Tool), und wählen Sie die Kreise aus. Legen Sie die Optionen auf 20 mm nach unten und 30 mm nach oben fest. Machen Sie ein Hexaedermodell der Größe 100 mm x 100 mm x 76 mm auf die gleiche Weise.
- Klicken Sie unter Einfügen > KEs > Kombinieren auf Werkzeug kombinieren. Wählen Sie in der Hausverwaltung Subtrahieren aus. Wählen Sie das Hexaedermodell und das Sinusmodell. Stellen Sie das endgültige Design als Acrylmodell mit einer 5-Achsen-CNC-Maschine gemäß den Anweisungen des Herstellers her.
- Ventilrahmen
- Führen Sie die 3D-Modellierungssoftware aus und öffnen Sie eine neue Skizze. Zeichnen Sie manuell ein Quadrat der Größe 100 mm x 100 mm und einen Kreis von 25 mm in der Mitte für die Ventilbasis. Klicken Sie auf das Extrude-Werkzeug und stellen Sie die Höhe des Ventilfußes auf 5 mm ein.
- Extrudieren Sie den Kreis mit einer Höhe von 23,5 mm und einer Dicke von 3 mm Dicke. Teilen Sie das Modell mit dem Linienwerkzeug in 12 einheitliche Teile auf, sodass jedes Stück 30 ° hat. Wählen Sie drei Stücke mit 120°-Abständen aus und extrudieren Sie mit einer Höhe von 16,5 mm, um drei Säulen herzustellen.
- Klicken Sie auf Verrundungswerkzeug und wählen Sie die Säulen aus. Stellen Sie den Verrundungsradius oben und unten auf 4 mm bzw. 10 mm ein. Speichern Sie es in einem STL-Dateiformat.
- 3D-Druck des Ventilrahmens. Stellen Sie die Fülldichte auf 100% ein und verwenden Sie Acrylnitril-Butadien-Styrol als Füllmaterial. Form und Abmessungen des Aortenklappenrahmens siehe Abbildung 3.
- Aorteninsuffizienzmodell mit expandiertem Polytetrafluorethylen (ePTFE)
- Führen Sie die 3D-Modellierungssoftware aus und öffnen Sie eine neue Skizze. Zeichnen Sie eine horizontale Linie von 23,24 mm und eine vertikale Linie von 15 mm unter Bezugnahme auf Abbildung 4A.
HINWEIS: Die geometrischen Parameter der Basis, der Höhe und der Länge der freien Kante des Blattes wurden gemäß einer früheren Studie12 ausgewählt. - Klicken Sie im Arc-Befehlsmanager auf das 3-Punkt-Arc-Werkzeug und legen Sie zwei Punkte an jedem Ende der horizontalen Linie und den letzten Punkt am Ende der vertikalen Linie fest. Extrudieren Sie die Skizze mit einer Dicke von 5 mm. Exportieren Sie das Modell im STL-Dateiformat und drucken Sie es in 3D.
- Überlappen Sie die ePTFE-Membran in zwei Schichten und zeichnen Sie mit dem gedruckten Beipackzettel drei Prospektränder in Abständen von 2 mm. Nähen Sie entlang der gezogenen Linien und Seitenränder in Abständen von 1 mm mit einer Polyamidnaht mit einem Durchmesser von 0,1 mm. Nähen Sie das ePTFE-Ventil im Abstand von 1 mm von oben nach unten auf den Rahmen.
- Schneiden Sie die Außenseite der Membran ab und nähen Sie sie miteinander. Führen Sie die folgenden drei Änderungen aus, um drei verschiedene Modelle zu erhalten.
- Dilatationsmodell: Reduzieren Sie das Verhältnis der entworfenen Packungsbeilagenparameter auf 90%.
- Perforationsmodell: Machen Sie ein kreisförmiges Loch mit einem Durchmesser von 2 mm mit einer Schere in der Mitte einer Packungsbeilage.
- Prolaps: Befestigen Sie die beiden Öffnungen des Ventils an einem Loch mit niedriger Pfostenhöhe.
HINWEIS: Abbildung 4 zeigt die Materialien und die Herstellungsmethode des ePTFE-Ventils. Abbildung 5 zeigt die Eigenschaften der einzelnen AR-Typen.
- Führen Sie die 3D-Modellierungssoftware aus und öffnen Sie eine neue Skizze. Zeichnen Sie eine horizontale Linie von 23,24 mm und eine vertikale Linie von 15 mm unter Bezugnahme auf Abbildung 4A.
2. MRT-Scan und Parameterauswahl
- Bereiten Sie das experimentelle System vor, das aus einem AR-Modell, einem Aortennebenhöhlenmodell, einer Herzsimulationspumpe und einer MRT besteht.
- Stellen Sie die Experimentmodelle im MRT-Raum ein und verbinden Sie die Pumpe, das Reservoir und die Modelle mit einem Silikonschlauch von 25 mm (Innendurchmesser). Verwenden Sie einen 10 cm langen Kabelbinder, um die Verbindungsteile zu befestigen, um mögliche Leckagen zu vermeiden.
- Verwenden Sie eine motorgesteuerte Kolbenpumpe, um die Aorten-Blutflusswellenformen zu simulieren, um eine physiologische Strömungswellenform durch das Strömungskreislaufsystem zu erzeugen. Verwenden Sie Wasser als Arbeitsflüssigkeit und befestigen Sie Einwegventile am Ein- und Auslass, um einen Rückfluss zu verhindern. Details zur Durchflusspumpe finden Sie in der vorherigen Studie23.
- Suchen Sie das Modell im Sichtfeld (FOV) des MRT. Führen Sie einen Scout-Scan durch, um Phantombilder in den koronalen, axialen und sagittalen Ansichten im MRT-Operationskonsolenmonitor zu beobachten. Dieses Bild wird als Leitfaden verwendet, um die folgenden Bildsequenzen zu positionieren.
- Suchen Sie die 2D-Bildebene in der Mitte des Aortenmodells. Führen Sie eine 2D-Phasenkontrastbildgebung (Variable Velocity-Encoding Parameter) aus, um den am besten geeigneten VENC-Wert für die 4D-Durchfluss-MRT auszuwählen.
- Stellen Sie VENC in der 4D-Durchfluss-MRT auf einen um 10 % höheren Wert ein, um ein mögliches Geschwindigkeits-Aliasingzu minimieren 7. Geben Sie die gewünschte räumliche Auflösung und die zeitliche Auflösung auf der MRT-Konsole ein. Die räumliche und zeitliche Auflösung für die Aortenströmung wird auf 2-3 mmbzw. 20-40 ms empfohlen. Tabelle 2 zeigt die MRT-Scan-Parameter.
- Erfassen Sie Daten sowohl mit als auch ohne Durchfluss mit den 3 Arten von AR-Ventilen und ohne Ventil.
3. Datenanalyse
- Datensortierung und -korrektur
- Kopieren Sie Rohdatendateien vom Scanner, um mit der Datenanalyse fortzufahren. Sortieren Sie die dicom-Dateien nach dem Header namens series description mit der Dicom-Sortiersoftware. Klicken Sie in der Dicom-Sortiersoftware auf Bilder sortieren, um Drei-Richtungs-Phasenbilder und Magnitudenbilder in separaten Ordnern zu sortieren.
- Laden Sie das Magnitudenbild in die ITK-snap-Software. Klicken Sie im ITK-Snap auf Pinsel und malen Sie den internen Fluidbereich des Phantoms manuell mit dem Pinselwerkzeug. Speichern Sie segmentiertes Bild.
- (Optional) Laden Sie beide Phasenbilddaten, die mit dem ein- und ausgeschalteten Fluss erhalten wurden, mit MATLAB. Subtrahieren Sie die Daten mit dem Fluss durch die Daten ohne Fluss, um Hintergrundfehler zu entfernen. Wiederholen Sie dies für jede Richtung und jeden Herzzyklus.
- Berechnen Sie die Geschwindigkeit von 5D-Matrixphasendaten (Zeile x Spalte x Slice x Richtung x Zeit) mit einer herstellerspezifischen Pixel-zu-Geschwindigkeit-Gleichung. Im Allgemeinen entspricht die maximale Intensität des Pixels dem ausgewählten VENC-Wert.
- Visualisierung
- Laden Sie die 5D-Matrixgeschwindigkeit aus Schritt 3.1.4 in die Strömungsvisualisierungsanalysesoftware.
HINWEIS: Die Eingangsgeschwindigkeitsmatrix kann je nach Analysesoftware variieren. Ensight-Benutzer sollten die Anleitung zum Ensight-Goldgehäuseformat13 befolgen. - Klicken Sie auf das Isoflächenteil, und ändern Sie den Datentyp von isosurface in isovolume für die 3D-Analyse, indem Sie auf die Schaltfläche Isovolume klicken. Ziehen Sie die Geschwindigkeitsdaten in den Variablen-Befehlsmanager und fügen Sie sie dem Isovolume hinzu, um die Geschwindigkeitsverteilung des Modells zu überprüfen.
- Klicken Sie im Hauptmenü auf Particle Trace Emitters Tool . Aktivieren Sie die Option Erweitert, um eine genauere Analyse zu erhalten. Wählen Sie die gewünschte Visualisierung wie Streamlines oder Pathlines in der Erstellung aus.
- Legen Sie für dieses Experiment den folgenden Wert fest: Aussenden von Option = Teil, Teile-ID = 2, Nein. Anzahl der Emitter = 10000, Richtung = +/-. Erstellen und überprüfen Sie die Ergebnisse im Laufe der Zeit.
- Klicken Sie mit der rechten Maustaste auf das Partikelspurmodell, und klicken Sie dann auf Farbe nach. Wählen Sie die Geschwindigkeitskomponente aus, um die Stromlinie mit der Geschwindigkeit zu färben.
- Laden Sie die 5D-Matrixgeschwindigkeit aus Schritt 3.1.4 in die Strömungsvisualisierungsanalysesoftware.
- Quantifizierung
- Laden Sie die Geschwindigkeitsdaten (Schritt 3.1.4) und das segmentierte Bild (Schritt 3.1.2) auf MATLAB. Legen Sie die Geschwindigkeit außerhalb des Segmentierungsbereichs auf Null fest. Dies kann leicht durch elementweise Multiplikation der segmentierten Matrixdaten und der Geschwindigkeitsmatrixdaten erfolgen.
- Überprüfen Sie mit der Imshow-Funktion von MATLAB, ob die Geschwindigkeitsdaten phasenumhüllt sind. Die Inversion der Geschwindigkeitsrichtung zeigt eine Phasenumhüllung an.
- Segmentieren Sie die gewünschte Ebene der Matrixdaten. Summieren Sie alle Geschwindigkeitsdaten innerhalb der Ebene und multiplizieren Sie die räumliche Auflösung, um die Durchflussrate durch die Ebene zu berechnen. Addieren Sie alle Durchflussraten während des Herzzyklus und multiplizieren Sie die zeitliche Auflösung, um das Schlagvolumen zu berechnen.
Ergebnisse
Drei repräsentative Klassen von Aorteninsuffizienzmodellen wurden hergestellt, und ein Gehäuse ohne Ventil wurde zum Vergleich hergestellt (Abbildung 3). Das Dilatationsmodell zeigte deutlich einen unvollständigen Verschluss der Ventilpackung aufgrund der kleineren Blättchen. Ein Loch wurde an einem der Flugblätter mit einer Schere durchbohrt, um das Perforationsmodell nachzuahmen. Ein Flugblatt des Prolapse-Modells sah kleiner aus als die anderen beiden Flugblätter, da die beiden Broschüren an einer Position unterhalb der ursprünglichen Höhe vernäht waren. Es gab keine signifikanten Unterschiede zur Draufsicht.
Mit den 3D-Geschwindigkeitsinformationen, die im Laufe der Zeit mithilfe der 4D-Strömungs-MRT erfasst wurden, wurden Stromlinien von Normal- und Aufstoßensdüsen während der Systole und Diastole visualisiert (Abbildung 6). Der Vorwärtsstrahl war in allen Modellen mit Ausnahme des Perforationsmodells gerade. Im Perforationsmodell trat während der Systolephase ein wandverzerrter Strahl auf. Der aufstoßende Strahl zeigte eine andere Geschwindigkeit und Form gemäß der AR-Klassifizierung. Im Falle von ohne Ventil trat eine allgemeine Vorwärts- und Rückwärtsströmung auf. Der aufdringliche Strahl des Dilatationsmodells kam aus dem Zentrum und neigte dazu, im Laufe der Zeit die Richtung zu ändern. Der Perforations- und Prolapsmodell-Regurgitant-Jet neigte sich zur Wand. Die Spitzengeschwindigkeit des Vorwärts- und Regurgitantenstrahls betrug 0,28 m/s, -0,29 m/s im Modell ohne Ventil, 2,03 m/s, -3,53 m/s im Dilatationsmodell, 2,52 m/s, -3,13 m/s im Perforationsmodell und 2,76 m/s, -2,88 m/s im Prolapsmodell.
Abbildung 7 zeigt die Durchflussrate für jedes Ventil und die Vorwärts- und Regurgitationsvolumina in einer 3D-Ebene weg von der Ventilbasis. Die Durchflussraten zeigten für jedes Modell unterschiedliche Wellenformen und Größen. Die Menge des Aufstoßensvolumens betrug 51,38 ml, 63,94 ml, 44,76 ml und 30,22 ml für Modelle ohne Ventil, Dilatation, Perforation und Prolaps. Die Verzerrung für ohne Ventil, Dilatation, Perforation und Prolapsmodell betrug -7,04%, -33,21%, 6,75% bzw. 37,04%, verglichen mit der Bodenwahrheit (48 ml), gemessen am Pumpenhubvolumen. Die positiven Prozentwerte deuten auf eine Unterschätzung hin, während die negativen Prozentwerte eine Überschätzung darstellen. Der Fehler der Regurgitationsfraktion betrug -7,78%, -6,00%, 0,33% und -11,18% für das Modell ohne Ventil, Dilatation, Perforation und Prolaps.
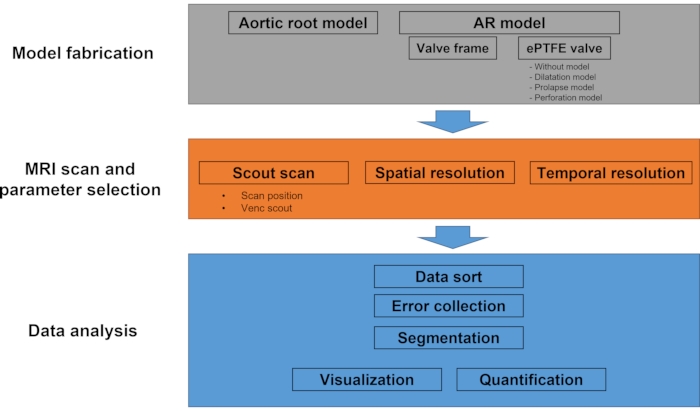
Abbildung 1: Workflowdiagramm des Protokolls. Dieses experimentelle Protokoll besteht hauptsächlich aus Modellherstellung, MRT-Scan und Datenanalyse. Im Modellherstellungsschritt werden das äußere Aortenwurzelmodell und vier verschiedene Arten von AR-Modellen (ohne Ventil, Dilatation, Prolaps und Perforation) hergestellt. Während des MRT-Scans wird eine Scout-Bildgebung durchgeführt, gefolgt von einem Multi-VENC-Scan und einer 4D-Flow-MRT. Der Datenanalyseteil umfasst Datensortierung, Bildsegmentierung, Geschwindigkeitsberechnung, Visualisierung und Quantifizierung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
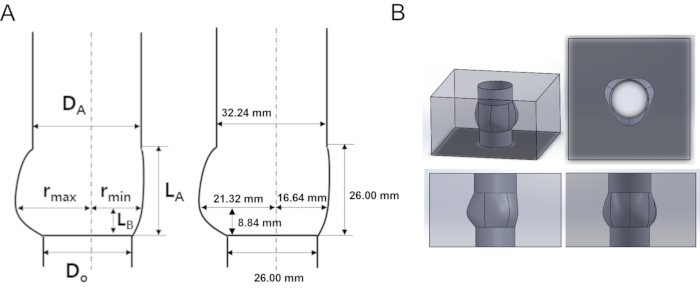
Abbildung 2: Schematisches und entworfenes Acrylmodell der Aortenwurzel (A) Geometrische Charakterisierung und Parameter der Aortenwurzelgeometrie. (B) Aortenwurzel-3D-Modell in mehrdimensionaler Ansicht. D A: Durchmesser der sinotubulären Verbindung (STJ), DO: Durchmesser des Rings, rmax: maximaler Sinusdurchmesser, rmin: minimaler Sinusdurchmesser, LA: Höhe des Sinus, LB: Höhe von STJ. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
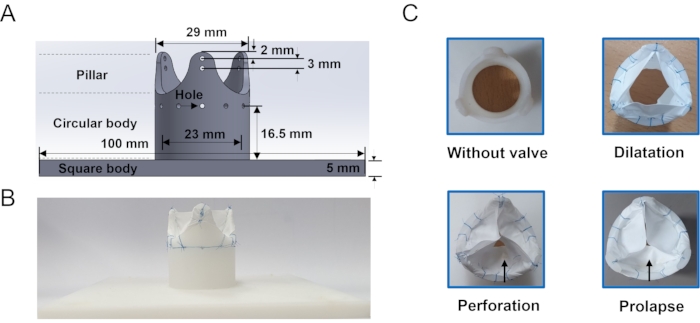
Abbildung 3: Aorteninsuffizienzrahmen und Modell (A) Geometrische Informationen des Aortenklappenrahmens, der zum Halten der Packungsbeilage verwendet wird. Löcher um den Körper des Rahmens sind, wo die Nahtlinie verläuft. (B) Beispiel für ein ePTFE-Membran-Nahtventil. (C) En-face-Ansicht der in dieser Studie hergestellten In-vitro-Modelle : ohne Ventil, Dilatation, Perforation und Prolaps. Der Pfeil zeigt die beschädigte Spitze an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
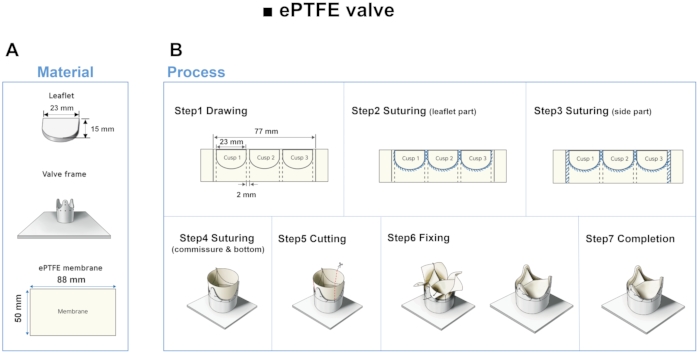
Abbildung 4: Material und Herstellungsschritt der ePTFE-Packungsbeilage . (A) Unter Verwendung von 3D-gedruckten Beipackzetteln als Leitfaden werden Beipackzettel mit ePTFE-Membran hergestellt. (B) Zieh-, Näh-, Schneid- und Befestigungsschritte des ePTFE-Ventils. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
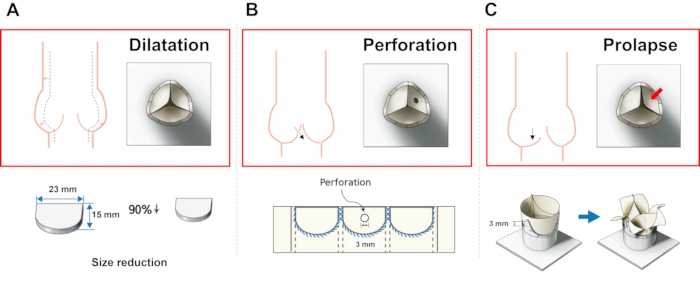
Abbildung 5: Herstellungsverfahren verschiedener AR-Modelle. (A) Dilatationsmodell, (B) Perforationsmodell und (C) Prolapsmodell. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
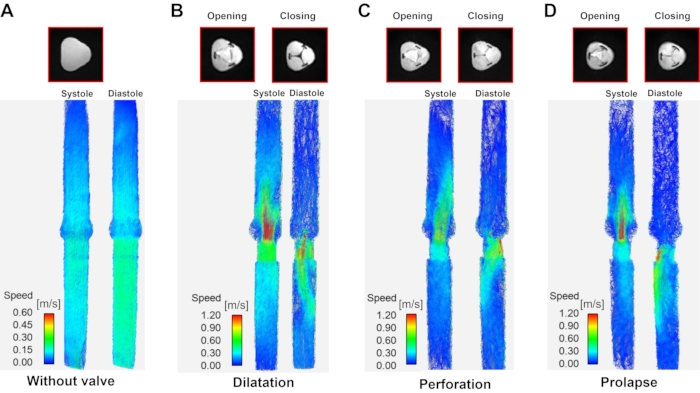
Abbildung 6: Optimieren Sie die Visualisierung nach Aorteninsuffizienztyp. Eine optimierte Visualisierung an Systole (links von jedem Panel) und Diastole (rechts von jedem Panel) nach Aorteninsuffizienztyp. (A) Modell ohne Ventil (das Diastole/Systole-Bild ist aufgrund des Fehlens eines Ventils dasselbe), (B) Dilatation, (C) Perforation und (D) Prolaps. Systole- und Diastole-Daten wurden dort aufgenommen, wo die Einlassgeschwindigkeit während des Herzzyklus am höchsten und am niedrigsten ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
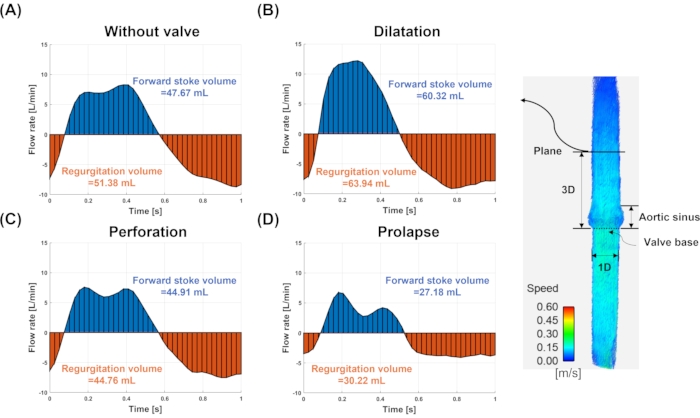
Abbildung 7: Durchfluss und Hubvolumen. Die Durchflussrate und das Hubvolumen für (A) Modell ohne Ventil, (B) Dilatation, (C) Perforation und (D) Prolaps. Der Durchfluss und das Hubvolumen werden an der Ebene (durchgezogene Linie) mit drei Durchmessern hinter dem Ventilring gemessen. Die blauen und roten Farben zeigen die Vorwärts- bzw. Aufstoßenden Strömungen an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Verhältnis (Do= 26 mm) | DA/Do | LA/Do | LB/Do | rmax/Do | rmin/Do |
| 1.24 | 1 | 0.34 | 0.82 | 0.64 |
Tabelle 1. Geometrische Parameter der Aortenwurzelgeometrie in Abbildung 1.
| Zeitliche Auflösung | 0,025 ms/40 Phasen |
| Räumliche Auflösung | 2mm x 2mm/0,5 Pixel pro 1 mm |
| Matrix | 96 x 160 x 26 Pixel |
| Dicke der Scheibe | 2 Millimeter |
| Echozeit | 2,54 ms |
| Codierungsgeschwindigkeit | 25-330 cm/s |
Tabelle 2. 4D Flow MRT Sequenzparameter in vitro.
Diskussion
Die vierdimensionale Fließ-MRT wurde kürzlich durch verschiedene Ex-vivo- und In-vivo-Studien als Anwendung für den klinischen Routineeinsatzverifiziert 14. Da die 4D-Strömungs-MRT 3D-Geschwindigkeitsinformationen über den gesamten Herzzyklus erhält, ist eine starke Anwendung eine direkte Quantifizierung des valvulären Regurgitantenvolumens, die die herkömmliche 2D-Doppler-Echokardiographie nicht quantifizieren kann15. In-vitro-Experimente mit 4D Flow MRT können die 3D-Strömungsgeschwindigkeit und die damit verbundenen hämodynamischen Parameter liefern, die zur Untersuchung des Zusammenhangs zwischen Herz-Kreislauf-Erkrankungen und Hämodynamik verwendet werden können. Trotz seiner vielversprechenden Fähigkeit wurden jedoch noch keine systematischen Studien zu dieser Anwendung berichtet. Dies ist möglicherweise auf das Fehlen gut kontrollierter In-vitro-Experimente zurückzuführen, die das Aufstoßen der Dreiblattventile nachahmen.
Jüngste Entwicklungen in In-vitro-Studien haben genauere und realistischere experimentelle Methoden für den Zugang zur prä- und postvalvulären Hämodynamikgeliefert 16,17. In Verbindung mit einer optischen bildbasierten Partikelbildvelocimetrie (PIV) war in früheren In-vitro-Studien eine genaue Messung und Quantifizierung des Durchflusses um das Ventil möglich18. Genaue 3D-Strömungsfelder, insbesondere für die postvalvuläre Strömung, waren jedoch aufgrund des undurchsichtigen Modells und der Brechung begrenzt. Auf der anderen Seite waren auch 3D-Geschwindigkeitsmessungen mittels MRT begrenzt, da Metallbauteile nicht verwendet werdenkönnen 19,20.
Daher wird in dieser Studie ein Protokoll zum Aufbau einer experimentellen Flussplattform eingeführt, die MR-kompatibel und hochgradig modifizierbar ist, um verschiedene klinische Szenarien von Klappenerkrankungen zu reproduzieren. Die ePTFE-Membran wird verwendet, um die Trikuspidalklappe ohne Metallkomponenten nachzuahmen, da sie aufgrund ihrer hohen Zugfestigkeit und chemischen Beständigkeit 17,21,22 häufig als Ventil- und Gefäßtransplantatmaterial verwendet wurde. Basierend auf ePTFE-Filmen wurden drei verschiedene Ursprünge des AR reproduziert (Dilatation, Perforation und Prolaps) sowie ein Modell ohne Ventil zum Vergleich. Der nächste wichtige Schritt in diesem experimentellen Flussprotokoll ist die MR-Bildgebung und -Quantifizierung. Eine motorgesteuerte Kolbenpumpe, die die Aorten-Blutflusswellenformen simulieren kann, wird verwendet, um eine physiologische Strömungswellenform durch das Strömungskreislaufsystem zu erzeugen. Details zur Durchflusspumpe finden Sie in der vorherigen Studie23. Da diese Studie auch darauf abzielt, die Genauigkeit der 4D-Durchfluss-MRT bei der Durchflussquantifizierung zu validieren, werden alle Bildgebungsparameter basierend auf der vorherigen Studie ausgewählt, die die Parameter zusammenfasst, die in der klinischen Routine verwendet werden können24. Da das MRT-System inhärente Fehler aufgrund von Unvollkommenheiten wie Wirbelströmen und Nichtlinearität des Magnetfeldes25 enthält, wird die Hintergrundkorrekturstrategie vor der eigentlichen Datenquantifizierung angewendet, wie in Schritt 3.1.3 beschrieben.
Das in dieser Studie vorgeschlagene handgefertigte Aorteninsuffizienzmodell zeigte ähnliche hämodynamische Eigenschaften des aufstoßenden Jets gemäß der Modellklassifikation, wie frühere Studien berichteten26,27. Die geschlossene Form war symmetrisch, und ein gerader Strahl trat in der Mitte des Ventils im Dilatationsmodell auf. Ein posterior gerichteter exzentrischer Jet erscheint aufgrund von Spitzenschäden im Perforationsmodell. Ein partieller Prolaps des Ventils zeigt einen Strahl, dessen Richtung aufgrund der eingeschränkten Mobilität vom Täterbecher gebogen wurde. Das direkt mit dem 4D-Durchfluss-MRT gemessene Aorteninsuffizienzvolumen wurde im Modell ohne Ventil und Dilatation überschätzt, während es im Prolapsmodell im Vergleich zur Bodenwahrheit weitgehend unterschätzt wurde. Als jedoch der Regurgitantanteil berechnet wurde, betrug der größte Bias nur 11% im Prolapsmodell. Dies deutet stark darauf hin, dass nicht nur der Aufstossfluss, sondern auch der normale Aortenstrahl durch den MR-Scan beeinflusst wurde. Zum aktuellen Zeitpunkt wurden einzelne Scanparameter nicht für jedes AR-Modell optimiert. Eine zukünftige systemische Parameterstudie kann die Genauigkeit der Messung des Regurgitationsvolumens verbessern. Alternativ ist die Verwendung der Regurgitantenfraktion robuster, da sie die inhärenten Fehler in der 4D-Durchfluss-MRT aufhebt, aber auch klinisch relevanter ist als die einfache Messung des absoluten Aufstoßensvolumens.
Zusammenfassend lässt sich sagen, dass diese Studie ein MR-kompatibles experimentelles In-vitro-Flow-Modell vorschlägt, das in hohem Maße modifizierbar ist, um verschiedene Arten von AR zu simulieren. Auch die Genauigkeit der AR-Volumenmessung mittels 4D-Durchfluss-MRT wurde verglichen. Die Einschränkung dieser Studie besteht darin, dass die Bewegung der Aortenklappe nicht simuliert wurde, was die tatsächliche Entwicklung des Regurgitantenstrahls beeinflussen kann. Darüber hinaus können der partielle Volumeneffekt und die zeitliche Mittelung der 4D-Durchfluss-MRT die Genauigkeit der Durchflussmessung einschränken, insbesondere angesichts des hohen Dynamikbereichs der Geschwindigkeit innerhalb des Jets und der Umgebung. Daher ist eine weitere systematische Parameterstudie erforderlich.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Forschung wurde durch das Basic Science Research Program durch die National Research Foundation of Korea unterstützt, das vom Bildungsministerium finanziert wird (2021R1I1A3040346, 2020R1A4A1019475, 2021R1C1C1003481 und HI19C0760). Diese Studie wurde auch durch den 2018 Research Grant (PoINT) der Kangwon National University unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 3D modeling software(SolidWorks) | Dassault Systèmes SolidWorks Corporation | Waltham, MA, USA | |
| 3D printer | Zortrax S.A. | the construction of a three-dimensional object from a CAD model or a digital 3D model,(zortrax m200 plus, Zortrax S.A.,Olsztyn, Poland) | |
| Dicom sort | Open source software | Jonathan Suever, Software Engineer | |
| Ensight | Ansys | Flow visualization software (Canonsburg, PA, USA). | |
| Expanded Polytetrafluoroethylene(ePTFE) | SANG-A-FRONTEC | Medical membrane (ePTFE,SANG-A-FRONTEC, Incheon, korea) | |
| Itk snap software | Open source software | GNU General Public License, | |
| MATLAB | MathWorks | Natick, MA, USA | |
| MRI | Siemens | 3T, Erlangen, Germany | |
| Scissors | Scanlan International Inc | n43 1765 | 7007-454, Scanlan International Inc., Saint Paul, USA |
| Suture | AILEE | NB530 | Ailee, Polyamide suture, UPS 5-0 |
Referenzen
- Koo, H. J., et al. Functional classification of aortic regurgitation using cardiac computed tomography: comparison with surgical inspection. The International Journal of Cardiovascular Imaging. 34 (8), 1295-1303 (2018).
- Bekeredjian, R., Grayburn, P. A. Valvular heart disease: aortic regurgitation. Circulation. 112 (1), 125-134 (2005).
- Lancellotti, P., et al. European Association of Echocardiography recommendations for the assessment of valvular regurgitation. Part 1: aortic and pulmonary regurgitation (native valve disease). European Journal of Echocardiography. 11 (3), 223-244 (2010).
- Zo, J. H. Echocardiographic Evaluation of Valvular Regurgitation:Semiquantitation Based on the Color Flow is Enough in Everyday Clinical Practice. Korean Circulation Journal. 29 (10), 1144-1150 (1999).
- Falk, V., et al. ESC/EACTS Guidelines for the management of valvular heart disease. European Journal of Cardio-Thoracic Surgery. 52 (4), 616-664 (2017).
- Members, W. C., et al. ACC/AHA guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Journal of the American College of Cardiology. 77 (4), 25 (2021).
- Ha, H., Huh, H., Yang, D. H., Kim, N. Quantification of Hemodynamic Parameters Using Four-Dimensional Flow MRI. Journal of the Korean Society of Radiology. 80 (2), 239-258 (2019).
- vander Geest, R. J., Garg, P. Advanced analysis techniques for intra-cardiac flow evaluation from 4D flow MRI. Current Radiology Reports. 4 (7), 38 (2016).
- Blanken, C. P., et al. Quantification of mitral valve regurgitation from 4D flow MRI using semiautomated flow tracking. Radiology: Cardiothoracic Imaging. 2 (5), 200004 (2020).
- Kim, B. G., et al. Evaluation of aortic regurgitation by using PC MRI: a comparison of the accuracies at different image plane locations. Journal of the Korean Physical Society. 61 (11), 1884-1888 (2012).
- de Tullio, M. D., Pedrizzetti, G., Verzicco, R. On the effect of aortic root geometry on the coronary entry-flow after a bileaflet mechanical heart valve implant: a numerical study. Acta Mechanica. 216 (1), 147-163 (2011).
- Fallahiarezoudar, E., Ahmadipourroudposht, M., Yusof, N. M. Geometric modeling of aortic heart valve. Procedia Manufacturing. 2, 135-140 (2015).
- Computational Engineering International. EnSight User Manual for Version 10.2. Computational Engineering International, Inc. , (2017).
- Garg, P., et al. Comparison of fast acquisition strategies in whole-heart four-dimensional flow cardiac MR: Two-center, 1.5 Tesla, phantom and in vivo validation study. Journal of Magnetic Resonance Imaging. 47 (1), 272-281 (2018).
- Gabbour, M., et al. 4-D flow magnetic resonance imaging: blood flow quantification compared to 2-D phase-contrast magnetic resonance imaging and Doppler echocardiography. Pediatric Radiology. 45 (6), 804-813 (2015).
- Kvitting, J. P. E., et al. et al. In vitro assessment of flow patterns and turbulence intensity in prosthetic heart valves using generalized phase-contrast MRI. Journal of Magnetic Resonance Imaging: An Official Journal of the International Society for Magnetic Resonance in Medicine. 31 (5), 1075-1080 (2010).
- Chang, T. I., et al. In vitro study of trileaflet polytetrafluoroethylene conduit and its valve-in-valve transformation. Interactive Cardiovascular and Thoracic Surgery. 30 (3), 408-416 (2020).
- Kim, D., et al. Comparison of Four-Dimensional Flow Magnetic Resonance Imaging and Particle Image Velocimetry to Quantify Velocity and Turbulence Parameters. Fluids. 6 (8), 277 (2021).
- Bai, K., Katz, J. On the refractive index of sodium iodide solutions for index matching in PIV. Experiments in Fluids. 55 (4), 1-6 (2014).
- Hargreaves, B., et al. Metal induced artifacts in MRI. AJR. American Journal of Roentgenology. 197 (3), 547 (2011).
- Zhu, G., Ismail, M. B., Nakao, M., Yuan, Q., Yeo, J. H. Numerical and in-vitro experimental assessment of the performance of a novel designed expanded-polytetrafluoroethylene stentless bi-leaflet valve for aortic valve replacement. PloS One. 14 (1), 0210780 (2019).
- Ebnesajjad, S. . Expanded PTFE applications handbook: Technology, manufacturing and applications. , (2016).
- Kim, J., Lee, Y., Choi, S., Ha, H. Pulsatile flow pump based on an iterative controlled piston pump actuator as an in-vitro cardiovascular flow model. Medical Engineering & Physics. 77, 118-124 (2020).
- Dyverfeldt, P., et al. 4D flow cardiovascular magnetic resonance consensus statement. Journal of Cardiovascular Magnetic Resonance. 17 (1), 1-19 (2015).
- Stankovic, Z., Allen, B. D., Garcia, J., Jarvis, K. B., Markl, M. 4D flow imaging with MRI. Cardiovascular Diagnosis and Therapy. 4 (2), 173 (2014).
- Patel, P. A., et al. Aortic regurgitation in acute type-A aortic dissection: a clinical classification for the perioperative echocardiographer in the era of the functional aortic annulus. Journal of Cardiothoracic and Vascular Anesthesia. 32 (1), 586-597 (2018).
- Boodhwani, M., et al. Repair-oriented classification of aortic insufficiency: impact on surgical techniques and clinical outcomes. The Journal of Thoracic and Cardiovascular Surgery. 137 (2), 286-294 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten