Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Werkzeuge zur Oberflächenbehandlung von siliziumplanaren intrakortikalen Mikroelektroden
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt Werkzeuge für die Handhabung von planaren intrakortikalen Mikroelektroden aus Silizium während der Behandlung zur Oberflächenmodifikation durch Gasabscheidung und wässrige Lösungsreaktionen. Die Montage der Komponenten, die für die Handhabung der Geräte während des gesamten Verfahrens verwendet werden, wird ausführlich erläutert.
Zusammenfassung
Intrakortikale Mikroelektroden haben ein großes therapeutisches Potenzial. Sie werden jedoch mit einer signifikanten Leistungsminderung nach bescheidenen Implantationsdauern konfrontiert. Ein wesentlicher Faktor für den beobachteten Rückgang ist die Schädigung des Nervengewebes proximal zum Implantat und die anschließende neuroinflammatorische Reaktion. Zu den Bemühungen zur Verbesserung der Langlebigkeit des Geräts gehören chemische Modifikationen oder Beschichtungsanwendungen an der Geräteoberfläche, um die Gewebereaktion zu verbessern. Die Entwicklung solcher Oberflächenbehandlungen erfolgt typischerweise mit nicht-funktionalen "Dummy" -Sonden, denen die für die beabsichtigte Anwendung erforderlichen elektrischen Komponenten fehlen. Die Translation zu funktionalen Bauelementen erfordert angesichts der Zerbrechlichkeit intrakortikaler Mikroelektrodenarrays zusätzliche Überlegungen. Die Handhabung von Werkzeugen erleichtert die Oberflächenbehandlung von montierten Geräten erheblich, insbesondere bei Modifikationen, die lange Verfahrenszeiten erfordern. Die hier beschriebenen Handhabungswerkzeuge werden für Oberflächenbehandlungen verwendet, die durch Gasphasenabscheidung und wässrige Lösungsexposition angewendet werden. Die Charakterisierung der Beschichtung erfolgt mittels Ellipsometrie und Röntgen-Photoelektronenspektroskopie. Ein Vergleich von Aufzeichnungen der elektrischen Impedanzspektroskopie vor und nach dem Beschichtungsverfahren an Funktionsgeräten bestätigte die Geräteintegrität nach Modifikation. Die beschriebenen Werkzeuge können leicht für alternative Elektrodenvorrichtungen und Behandlungsmethoden angepasst werden, die die chemische Kompatibilität aufrechterhalten.
Einleitung
Neuroprothesen zielen darauf ab, beeinträchtigte oder fehlende sensorische und motorische Fähigkeiten in einer Vielzahl von Patientenpopulationen wiederherzustellen, einschließlich solcher mit Rückenmarksverletzungen, Amyotropher Lateralsklerose (ALS), Zerebralparese und Amputationen 1,2,3. Intracortische Mikroelektroden (IMEs) können einen Kommunikationsweg zwischen kortikalen Neuronen und den Geräten zur Steuerung der Neuroprothetik herstellen. Ein deutlicher Vorteil von intrakortikalen Mikroelektroden ist ihre Fähigkeit, neuronale Signale mit der hohen räumlichen und zeitlichen Auflösung aufzuzeichnen, was für die anschließende Signalverarbeitung und Steuerung von Gehirn-Computer-Schnittstellenbevorzugt wird 4,5. Leider nimmt die Leistung intrakortikaler Mikroelektroden innerhalb von Monaten auf ein Jahr nach der Implantation dramatisch ab 2,6,7,8. Der Verlust der Signalqualität und -stabilität wirkt sich negativ auf die Anwendung der Technologie aus.
Ein wesentlicher Faktor für den beobachteten Leistungsabfall ist die biotische Reaktion auf implantationsbedingte Gewebeschäden und chronische Neuroinflammation 9,10,11. Die Implantation von IMEs fügt dem Hirngewebe Schäden zu, was zur Freisetzung von Signalmolekülen führt, die Kaskaden reaktionärer zellulärer Abwehrprozesse auslösen. Chronische Schnittstellen verschlimmern die Fremdkörperreaktion, was zu einer anhaltenden Neuroinflammation führt, die das Gewebe proximal zum Gerät schädigt; Oft als Symptome von Neuroinflammation, Narbenbildung und lokaler Neurodegeneration erkannt, die zum Rückgang der Aufzeichnung der Signalqualität beitragen12,13,14,15. Die Narbe, die die Elektrode einkapselt, besteht aus einem dichten Konglomerat von Astrozyten mit mitgerissenen aktivierten Mikroglia und Makrophagen und erzeugt eine ungünstige lokale Umgebung mit reduziertem Materialtransport und lokaler Ansammlung von Entzündungsfaktoren16,15,16,17,18.
Viele Studien haben die Reaktion des Gehirns auf intrakortikale Mikroelektroden oder Ansätze zur Abschwächung der Reaktion7 beschrieben. Forschung und Entwicklung zur Verbesserung der Gewebereaktion umfassten eine Reihe von Strategien, einschließlich Modifikationen der Gesamtstruktur, der Oberflächentopologie, der Materialien und der Beschichtungsauftragung. Diese Bemühungen zielen darauf ab, Schäden durch das Implantationsereignis zu minimieren, eine günstigere Schnittstelle zwischen dem Gerät und proximalen Zellen einzuführen oder die Gewebebelastung nach der Implantation von Geräten zu reduzieren7. Methoden, die speziell auf die chronische biologische Reaktion abzielen, haben zu mehreren bioaktiven Beschichtungen geführt, die darauf abzielen, die Implantationsstelle zu stabilisieren und die Zellgesundheit chemisch zu fördern. Beispiele hierfür sind leitfähige Polymere wie Poly(ethylendioxythiophen) (PEDOT)19,20, Kohlenstoffnanoröhren 21, Hydrogele 22 und die Zugabe von bioaktiven Molekülen und Medikamenten zur Ausrichtung auf spezifische zelluläre Prozesse23,24,25. Insbesondere unsere Forschungsgruppe hat viele Mechanismen untersucht, um eine Verringerung der Entzündungsreaktion auf implantierte Mikroelektroden zu fördern, einschließlich, aber nicht beschränkt auf die Minimierung des mit der Geräteimplantation verbundenen Traumas26, die Minimierung der Geräte- / Gewebesteifigkeitsabweichung 27,28,29,30,31,32,33, die Optimierung der Sterilisation Verfahren 34,35, Reduzierung von oxidativem Stress/Schaden 28,36,37,38,39,40,41,42, Erforschung alternativer Elektrodenmaterialien 43 und Nachahmung der Nanoarchitektur der natürlichen extrazellulären Matrix 44,45,46 . Neuestes Interesse gilt der Entwicklung biomimetischer Oberflächenbeschichtungen zur Abschwächung der neuroinflammatorischen Reaktion an der Mikroelektrodengewebe-Grenzflächedirekt 39.
Die Modifikation der Schnittstelle bietet den einzigartigen Vorteil, dass sie direkt auf die Wunde und das proximale Gewebe abzielt, die für die Signalaufzeichnung erforderlich sind. Eine Oberflächenbehandlung, die die Heilung fördert, ohne die Immunantwort zu verschlimmern, kann die Lebensdauer der Qualitätsaufzeichnung verbessern und Einschränkungen bei der Realisierung des therapeutischen und Forschungspotenzials intrakortikaler Mikroelektroden beseitigen. Die vorgestellte Arbeit beschreibt Methoden zur Anwendung von Oberflächenbehandlungen auf Mikroelektrodenarrays, die verlängerte Reaktionszeiten erfordern und gleichzeitig die Zerbrechlichkeit der Geräte berücksichtigen. Die vorgestellte Technik zielt darauf ab, Oberflächenmodifikationsmethoden mit funktionellen Geräten zu teilen, bei denen das Gerät nicht während der gesamten Behandlungsanwendung gehandhabt werden kann. Die Werkzeuge werden für die Handhabung von nicht-funktionalen Dummy-Sonden und funktionalen planaren Mikroelektrodenarrays aus Silizium vorgestellt.
Der vorgestellte Ansatz zur Modifikation der Elektrodenoberfläche ermöglicht die sichere Suspension von nicht-funktionalen Dummy-Sonden oder funktionellen planaren Silizium-Elektrodenarrays für die Gasphasenabscheidung und -reaktion mit wässrigen Lösungen. Für die Handhabung dieser zerbrechlichen Geräte werden mehrere 3D-gedruckte Teile verwendet (Abbildung 1 und Abbildung 2). Ein Beispiel für ein Verfahren, das sowohl Gas- als auch Lösungsphasenschritte für die Oberflächenmodifikation mit einer antioxidativen Beschichtung verwendet, die die Immobilisierung von Mn(III)tetrakis (4-Benzoesäure)-Porphyrin (MnTBAP) beinhaltet. MnTBAP ist ein synthetisches Metalloporphyrin, das antioxidative Eigenschaften mit nachgewiesener Entzündungsmediation47,48 besitzt. Das bereitgestellte Beispiel für funktionale planare Siliziumelektrodenarrays validiert eine Aktualisierung eines zuvor gemeldeten Protokolls für nicht funktionsfähige Bauelemente40. Die Adaption einer Gasphasenabscheidungstechnik von Munief et al. unterstützt die Kompatibilität des Protokolls mit Funktionselektroden49. Die Gasphasenabscheidung wird verwendet, um die Oberfläche in Vorbereitung auf die wässrige Reaktion mit Carbodiimid-Vernetzerchemie zur Immobilisierung des aktiven MnTBAP zu funktionalisieren. Die hier entwickelte Handhabungsmethodik wird als Plattform bereitgestellt, die modifiziert werden kann, um andere Beschichtungen und ähnliche Geräte aufzunehmen.
Das Protokoll veranschaulicht den Ansatz unter Verwendung von nicht-funktionalen Dummy-Sonden, die einen Siliziumschaft und eine 3D-gedruckte Lasche mit ähnlichen Abmessungen wie die funktionalen planaren Silizium-Elektrodenarrays umfassen. Die Steckerverpackung des Geräts wird analog zur 3D-gedruckten Lasche der nicht funktionsfähigen Dummy-Sonde in der mitgelieferten Anleitung betrachtet.
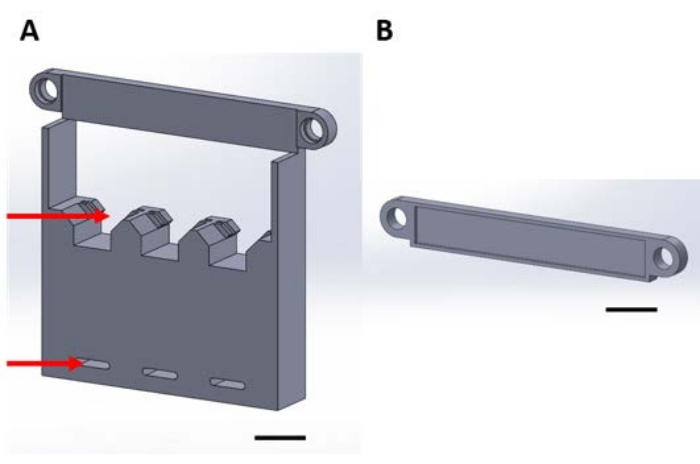
Abbildung 1: 3D-gedruckte Teile für die Handhabung von Funktionsgeräten während der Gasphasenabscheidung in einem Vakuum-Exsikkator. (A) Die Basis der Struktur umfasst Halter für 1 cm x 1 cm große Siliziumquadrate (oberer Pfeil) und Löcher zur Befestigung an der Exsikkatorplatte (unterer Pfeil). (B) Die Platte dient zur Sicherung der Aufhängung von Einrichtungen. Von nun an wird jedes Stück in dieser Abbildung entweder als Stück 1A oder 1B bezeichnet. Maßstabsleiste = 1 cm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
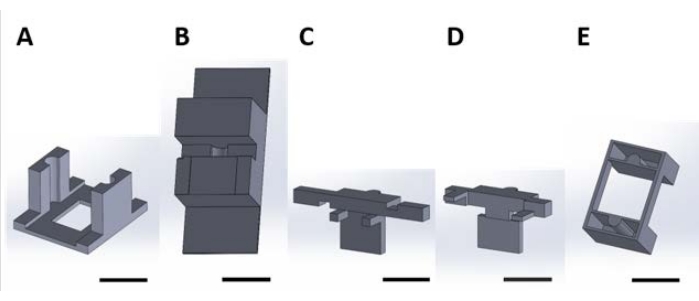
Abbildung 2: 3D-gedruckte Teile für die Handhabung von Funktionsgeräten für die in der wässrigen Lösung auftretende Oberflächenreaktion. (A) Führungsstück, das auf den Deckel der Kulturplatte geklebt werden soll. (B) Tischstücke, die zur Stabilisierung von Teilen (C) und (D) während der Montage verwendet werden. (C) und (D) sichern zusammen die Aufhängung von Vorrichtungen für die Platzierung in der Bohrlochplatte und (E) befestigen die Teile (C) und (D) weiter am Deckel der Bohrlochplatte. Von nun an werden einzelne Stücke in jeder Tafel dieser Abbildung als Stücknummern bezeichnet, die der Plattennummer dieser Abbildung entsprechen. Maßstabsleiste = 1 cm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protokoll
Alle Codierungsdateien für den 3D-Druck werden in den ergänzenden Codierungsdateien 1-16 bereitgestellt. Die in den repräsentativen Ergebnissen enthaltene Analyse wird unter Verwendung kommerziell erworbener funktioneller planarer Siliziumelektrodenarrays beschrieben (siehe Materialtabelle).
1. Handhabungsbaugruppe zur Gasphasenabscheidung in einem Vakuum-Exsikkator
HINWEIS: Die montierte Vorrichtung zur Handhabung und zum Halten von Geräten während der Gasphasenabscheidung ist in Abbildung 3 dargestellt. Die Schritte 1.1-1.8 beschreiben das Verfahren, das erforderlich ist, um die Geräte zur Abscheidung in die Vorrichtung einzubringen (Abbildung 4A).

Abbildung 3: Montage von 3D-gedruckten Teilen für die Handhabung von Funktionsgeräten während der Gasphasenabscheidung. Die Baugruppe ist ohne zu beschichtende Muster abgebildet. Schrauben und Flügelmuttern werden verwendet, um die Teile 1A und 2B miteinander zu verbinden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Abbildung der Montage und Platzierung der zu beschichtenden Proben. Dieses Schema beschreibt die Handhabung von Funktionsgeräten während der Gasphasenabscheidung, die in einem Vakuum-Exsikkator gesichert ist. (A) Doppelseitiges Polyimidband auf Stück 1A und Schaumstoffband auf 1B. (B) Auf Band befestigte Geräte. (C) Schrauben und Flügelmuttern werden verwendet, um die Teile 1B bis 1A zu befestigen, und die Baugruppe wird mit Reißverschlusskabelbindern (rote Pfeile) an der Exsikkatorschale befestigt. (D) 1 cm x 1 cm Silizium-Quadratproben werden in entsprechende Halter gelegt. (E) Die Aluminium-Wägeschale und das Manometer werden in der gezeigten Ausrichtung in den Exsikkator eingesetzt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Für die Oberflächenbehandlung erfassen Sie 1 cm x 1 cm große quadratische Proben des Substratmaterials der Geräte.
- Für Siliziumproben (ausgewählt für dieses Protokoll) schneiden Sie den Siliziumwafer mit einer Waferwürfelmaschine in 1 cm x 1 cm große Quadrate (siehe Materialtabelle).
- Drucken oder erfassen Sie die Teile 1A (Abbildung 1A, Ergänzende Kodierungsdatei 1, Ergänzende Kodierungsdatei 2) und 1B (Abbildung 1B, Ergänzende Kodierungsdatei 3, Ergänzende Kodierungsdatei 4).
- Befestigen Sie doppelseitiges Polyimidband an Stück 1A und befestigen Sie 1/8 "dickes Schaumstoffband mit einseitigem Klebstoff an Stück 1B.
- Kleben Sie die Steckverbinderverpackung des Geräts auf das Band auf Stück 1A.
HINWEIS: Durch die ideale Ausrichtung des Steckers am Band bleibt der Schaft über der Kante aufgehängt, wie in Abbildung 4B dargestellt. - Sichern Sie das Stück 1A und das Stück 1B zusammen (Abbildung 4C). Richten Sie die Löcher aus und sichern Sie sie mit Edelstahlschrauben und Flügelmuttern (siehe Materialtabelle).
- Befestigen Sie die Baugruppe mit Reißverschlüssen an der Vakuum-Exsikkatorschale mit den Löchern im Boden des Stücks 1A, wie in Abbildung 4C dargestellt.
- Platzieren Sie gegebenenfalls quadratische Materialproben in den Schlitzen am unteren Rand des Rahmens (Abbildung 4D). Hier werden 1 cm x 1 cm große quadratische Siliziumwafer gewürfelte Proben als Beispiel verwendet.
HINWEIS: Das genaue Material muss mit dem Substrat des behandelten Geräts übereinstimmen, das je nach Gerät variiert. - Vervollständigen Sie die Gasphasenabscheidung, indem Sie die Lösung in einen geeigneten Behälter innerhalb des Vakuum-Exsikkators gegenüber und in Übereinstimmung mit der gesicherten Baugruppe geben.
HINWEIS: Aluminium-Wiegegeschirr wurde als Behälter für die (3-Aminopropyl)triethoxysilan (APTES)-Abscheidung verwendet, als Beispiel hier.- Platzieren Sie ein Vakuummessgerät (siehe Materialtabelle) im Exsikkator, um den genauen Druck aufzuzeichnen. Positionieren Sie den Anschluss des Exsikkatordeckels in der Nähe der gesicherten Baugruppe und in einer Linie mit der Lösung (Abbildung 4E).
HINWEIS: Weitere Einzelheiten zu dieser Methode der Gasphasenabscheidung sind in einer zuvor veröffentlichten Referenz49 beschrieben.
- Platzieren Sie ein Vakuummessgerät (siehe Materialtabelle) im Exsikkator, um den genauen Druck aufzuzeichnen. Positionieren Sie den Anschluss des Exsikkatordeckels in der Nähe der gesicherten Baugruppe und in einer Linie mit der Lösung (Abbildung 4E).
2. Handhabung der Baugruppe für die Oberflächenreaktion über wässrige Lösung
HINWEIS: Die Komponenten und montierten Vorrichtungen für die Handhabung und das Halten von Geräten während der wässrigen Phasenabscheidung und Oberflächenbehandlung sind in den Abbildungen 5-7 dargestellt. In den folgenden Schritten wird das Verfahren beschrieben, das erforderlich ist, um die Geräte zur Abscheidung und Behandlung in die Vorrichtung zu bringen.

Abbildung 5: Montage von 3D-gedruckten Teilen für die Handhabung von Funktionsgeräten für die in wässriger Lösung auftretende Oberflächenreaktion . (A) Führungsstück, das auf den Deckel der Kulturplatte geklebt werden soll. (B) Das Tischstück wurde verwendet, um Teile (C) und (D) während der Montage zu stabilisieren. (C) und (D) zusammen die Aufhängung von Vorrichtungen für die Platzierung in der Bohrlochplatte sichern. (E) sichert die Teile (C) und (D) weiter am Deckel der Bohrlochplatte. Doppelseitiges Polyimidband wurde auf den unteren Teil von (C) und Schaumstoffband auf den unteren Teil von (D) (beide rot verpackt) gelegt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 6: Zellkulturplattendeckel mit 6 Führungen (Stück 2A). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 7: Reihenfolge zum Sichern und Laden von Sonden für die Lösungsreaktion. Die Farbe der Teile wurde in dieser Abbildung aus Gründen der Klarheit innerhalb des Bildes geändert. Dies sind die gleichen Teile wie in Abbildung 5 und Abbildung 6. (A) Stück 2C wird in Stück 2B platziert und das Gerät wird an dem geklebten Teil von 2C befestigt. (B) Stück 2D passt in Teil 2C, um eine Baugruppe zu erstellen, die den Geräteschaft aufhängt. (C) Die Montage von 2C, 2D und das Gerät wird vorsichtig auf dem Deckel der Bohrlochplatte mit der Führung positioniert. (D) Stück 2E passt auf die Oberseite der Baugruppe, um den Deckel weiter zu sichern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Konstruieren Sie einen Deckel für die Well-Platte, um das Elektrodenarray des Geräts in Lösung aufzuhängen (Abbildung 6). Dieses Protokoll beschreibt die Verwendung einer 24-Well-Platte.
- Schneiden Sie rechteckige Löcher 19 mm x 10,5 mm in den Deckel der Bohrlochplatte mit einem Laserschneider oder manuell mit einem Kistenschneider. Passen Sie die Anzahl der Löcher an die Anzahl der Geräte an, die für die Behandlung gewünscht werden.
HINWEIS: Zur Vereinfachung der Montage wird empfohlen, sechs Geräte pro Bohrlochplatte zu behandeln oder mindestens Löcher über nicht benachbarten Bohrlöchern zu platzieren (Abbildung 6). - Drucken oder erwerben Sie die entsprechende Anzahl von Hilfslinien (Stück 2A (Abbildung 2A), Supplementary Coding File 5, Supplementary Coding File 6).
- Verwenden Sie Cyanacrylat-Klebstoff, um Führungen am Deckel zu befestigen. Richten Sie die rechteckigen Löcher in den Führungen und Deckeln während des Klebens aus, um sicherzustellen, dass das rechteckige Loch der Führung ungehindert ist, wie in Abbildung 6 dargestellt.
- Schneiden Sie rechteckige Löcher 19 mm x 10,5 mm in den Deckel der Bohrlochplatte mit einem Laserschneider oder manuell mit einem Kistenschneider. Passen Sie die Anzahl der Löcher an die Anzahl der Geräte an, die für die Behandlung gewünscht werden.
- Füllen Sie die Bohrlochplatte mit der gewünschten Lösung an den Stellen, an denen die Behandlung stattfinden wird. Die Lösung umfasst beispielsweise EDC und Sulfo-NHS (siehe Materialverzeichnis) im MES-Puffer.
HINWEIS: Das Volumen der Lösung hängt von den Abmessungen des Elektrodengeräts ab. Für Mikroelektrodenarrays im Michigan-Stil (siehe Materialtabelle) mit flachen Steckverbindern von 8,6 mm und einer Schaftlänge von 3 mm gibt es ~ 9 mm Abstand50. Durch die Verwendung von 2 ml Lösung kann der Schaft des Geräts vollständig eingetaucht werden, während der Rest des Geräts von der Reaktionslösung ferngehalten wird.- Wenn Substratproben zur Bestätigung der Oberflächenbehandlung verwendet werden, legen Sie quadratische Materialproben in eine Vertiefung der Platte und tauchen Sie sie in die Reaktionslösung.
- Hängen Sie die Geräte (siehe Materialtabelle) sicher in einer Bohrlochplatte auf. Die Sequenz ist in Abbildung 7 dargestellt.
- Band 2B (Abbildung 2B, Supplementary Coding File 7, Supplementary Coding File 8) auf einem Benchtop (Abbildung 7A).
- Legen Sie doppelseitiges Polyimidband an, um die Basis von Stück 2C abzudecken (Abbildung 2C, Supplementary Coding File 9, Supplementary Coding File 10).
- Legen Sie 1/8 "Schaumstoffband mit einseitigem Klebstoff an, um die Basis des Stücks 2D abzudecken (Abbildung 2D, Supplementary Coding File 11, Supplementary Coding File 12).
- Passen Sie das Stück 2C in die Nut des Teils 2B an (Abbildung 7A).
- Kleben Sie die Steckverbinderverpackung des Geräts orientiert auf das Band, so dass die Länge des Geräteschaftes aufgehängt ist (Abbildung 7B).
- Sichern Sie das Gerät, indem Sie das Stück 2D (in Abbildung 7 orange dargestellt) in das Stück 2C schieben. Diese Baugruppe sichert das Gerät effektiv zwischen den Werkzeugteilen (Abbildung 7B).
- Halten Sie die Kanten der Baugruppe fest und heben Sie sie vorsichtig an, um sie von Teil 2A zu entfernen.
- Setzen Sie die Baugruppe in den Deckel ein, indem Sie die nach außen gerichteten Halbkreise auf den Teilen 2C und 2D mit den entsprechenden Führungen auf Stück 2A ausrichten (in Abbildung 7C grün dargestellt).
- Sichere Montageplatzierung durch Einpressen des Stücks 2E (Abbildung 2E) über die Führungen (grün dargestellt in Abbildung 7D, Supplementary Coding File 13, Supplementary Coding File 14).
- Bei Reaktionen, die von einer kontinuierlichen Durchmischung der Lösung profitieren, rühren Sie die Wellplatte auf. Übertragen Sie die montierte Wellplatte auf einen Shaker-Tisch und laufen Sie mit Geschwindigkeiten unter 100 U / min.
- Wenn mehrere lösungsbasierte Reaktionen oder Waschschritte gewünscht sind, übertragen Sie den Deckel vorsichtig auf eine neue Vertiefungsplatte mit den gewünschten Lösungen, die auf die entsprechenden Vertiefungen verteilt sind.
HINWEIS: Schritt 2.4 ist optional. - Entfernen Sie die Geräte von der Bohrlochplatte.
- Klebeband Stück 2B zu einer Tischplatte.
- Entfernen Sie das Stück 2E vom Deckel.
- Entfernen Sie vorsichtig die Baugruppe, die das Gerät hält, von der Bohrlochplatte.
- Richten Sie die Baugruppe so aus, dass Teil 2C der Tischplatte und Teil 2D nach oben zeigt. Der Schaft des Geräts muss parallel zur Tischplatte sein. Fügen Sie das Stück 2C der Baugruppe wie zuvor abgeschlossen (Schritt 2.3.4) in das Stück 2B ein, wenn die Baugruppe zusammengefügt wird.
- Trennen Sie das Stück 2D von Teil 2C, indem Sie es vorsichtig auseinanderziehen. Üben Sie leichten Druck auf die Laschen des Stücks 2C in die Bank aus, um Stabilität für diese Aufgabe zu gewährleisten.
HINWEIS: Die Registerkarten von 2C sind länger als die von 2D, um diese Handhabung zu erleichtern. - Verwenden Sie eine Pinzette, um die Anschlussverpackung des Geräts festzuhalten, um sie vom Band zu entfernen und das Gerät in den gewünschten Speicherbehälter zu übertragen.
Ergebnisse
Um die Verwendung der Handling-Komponenten zu demonstrieren, wurde die beschriebene Methodik implementiert, um die Immobilisierung eines Oxidationsmittelmediators an aktiviertes Silizium anzupassen. Die Anwendung dieser Chemie auf IMEs zur Reduzierung von oxidativem Stress wurde von Potter-Baker et al. entwickelt und an nicht-funktionellen Silizium-Dummy-Sonden40 demonstriert. Diese Oberflächenbehandlung immobilisiert das Antioxidans MnTBAP zu UV / Ozon-aktivierter Siliziumoberfläche durch
Diskussion
Das beschriebene Protokoll wurde für die Oberflächenbehandlung von planaren Mikroelektrodenarrays aus Silizium entwickelt. Die 3D-gedruckten Werkzeuge sind an Mikroelektroden-Arrays im Michigan-Stil mit Low-Profile-Steckverbindern50 angepasst. Nicht-funktionelle Sonden wurden montiert, indem eine Silikonsonde mit einem biokompatiblen Klebstoff auf 3D-gedruckte Laschen geklebt wurde. Die 3D-gedruckten Laschen wurden mit ähnlichen Abmessungen wie die Steckverbinder entwickelt, die in den kommerzi...
Offenlegungen
Der Inhalt gibt nicht die Ansichten des US-Ministeriums für Veteranenangelegenheiten, der National Institutes of Health oder der Regierung der Vereinigten Staaten wieder.
Danksagungen
Diese Studie wurde zum Teil durch den Merit Review Award IRX002611 (Capadona) und den Research Career Scientist Award IK6RX003077 (Capadona) des United States (US) Department of Veterans Affairs Rehabilitation Research and Development Service unterstützt. Darüber hinaus wurde diese Arbeit zum Teil auch vom National Institute of Health, dem National Institute of Neurological Disorders and Stroke R01NS110823 (Capadona/Pancrazio) und dem National Science Foundation Graduate Research Fellowship Program (Krebs) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1-[3-(Dimethylamino)propyl]-3-ethylcarbodiimide methiodide (EDC) | Sigma-Aldrich | 165344-1G | Solid, stored desiccated at -20 °C |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| 18 Pound Solid Nylon Cable/Zip Ties | Cole-Parmer | EW-06830-66 | Length 4 inches |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Sigma-Aldrich | 4432-31-9 | Solid |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 440140-100ML | Liquid, container with Sure/Seal |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Aluminum foil | Fisher Scientific | 01-213-103 | |
| Aluminum weighing dishes | Fisher Scientific | 08-732-102 | Diameter 66 mm |
| Bel-Art Vacuum Desiccator | Fisher Scientific | 08-594-15B | |
| Corning Costar TC-Treated Multiple Well Plates | Millipore Sigma | CLS3527-100EA | 24-well plate, polystyrene |
| Cyanoacrylate Adhesive | LocTite | N/A | |
| Digital Microscope | Keyence | VHX-S750E | |
| Disco DAD3350 Dicing Saw | Disco | DAD3350 | Used to cut silicon wafer into 1 cm x 1 cm samples |
| Double-Sided Polyimide Tape | Kapton Tape | PPTDE-1/4 | ¼” x 36 yds. |
| EP21LVMed – low viscosity, two component epoxy compound | Masterbond | EP21LVMed | Meets USP Class VI certification, Passes ISO 10993-5 for cytotoxicity |
| Epilog Fusion Pro 48 Laser Machine | Epilog | N/A | CO2 laser |
| Foam tape | XFasten | N/A | 1/8" Thick |
| Gamry Interface 1010E Potentiostat | Gamry | 992-00129 | |
| High precision 45° curved tapered very fine point tweezers/forceps | Fisher Scientific | 12-000-131 | |
| Lab tape | Fisher Scientific | 15-901-10L | |
| Mn(III)tetrakis (4-benzoic acid) porphyrin (MnTBAP) | EMD Millipore | 475870-25MG | Solid, stored at -20 °C |
| N-Hydroxysulfosuccinimide sodium salt, ≥98% (HPLC) | Sigma-Aldrich | 56485-250MG | Solid, stored desiccated at 4°C |
| Platinum clad niobium mesh anode | Technic | N/A | Clad with 125μ” of platinum on one side, framed in titanium with (1) 1” x 6” titanium strap centered on one 6” dimension |
| Silicon Planar Microelectrode Array, 16 Channel | NeuroNexus | A1x16-3mm-100-177-CM16LP | Electrode site material is iridium, shank thickness is 15 μm |
| Silicon Wafer | University Wafer | 1575 | Diameter 100 mm, p-type, boron-doped, 100 oriented, resistivity 0.01-0.02 Ohm-cm, thickness 525 um, single side polished, prime grade |
| Silver/silver Chloride reference electrode | Gamry Instruments | 930-00015 | |
| Solidworks | N/A | ||
| Stainless Steel Phillips Flat Head Screws | McMaster Carr | 96877A629 | #8-32, 1 1/2", fully threaded |
| Type I deionized water | ChemWorld | CW-DI1-20 | |
| Ultimaker 3 3D printer | Ultimaker | N/A | |
| Ultimaker Cura | Ultimaker | N/A | 3D printing software |
| Ultimaker NFC ABS Filament | Dynamism, Inc. | 1621 | 2.85 mm |
| Ultimaker NFC PLA Filament | Dynamism, Inc. | 1609 | 2.85 mm |
| Vacuum Gauge Vacuum Gauge | Measureman Direct | N/A | Glycerin Filled, 2-1/2” Dial Size, ¼”NPT, -30” Hg/-100kpa-0 |
| Wing nuts | Everbilt | 934917 | #8-32, zinc plated |
Referenzen
- Donoghue, J. Bridging the brain to the world: A perspective on neural interface systems. Neuron. 60 (3), 511-521 (2008).
- Ajiboye, A. B., et al. Restoration of reaching and grasping movements through brain-controlled muscle stimulation in a person with tetraplegia: a proof-of-concept demonstration. The Lancet. 398 (10081), 1821-1830 (2017).
- Ereifej, E. S., et al. Neural engineering: the process, applications, and its role in the future of medicine. Journal of Neural Engineering. 16 (6), 063002 (2019).
- Nicolas-Alonso, L. F., Gomez-Gil, J. Brain computer interfaces, a review. Sensors (Basel). 12 (2), 1211-1279 (2012).
- Leuthardt, E. C., Schalk, G., Moran, D., Ojemann, J. G. The emerging world of motor neuroprosthetics: a neurosurgical perspective. Neurosurgery. 59 (1), 1-14 (2006).
- Barrese, J. C., et al. Failure mode analysis of silicon-based intracortical microelectrode arrays in non-human primates. Journal of Neural Engineering. 10 (6), 066014 (2013).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Prasad, A., et al. Comprehensive characterization and failure modes of tungsten microwire arrays in chronic neural implants. Journal of Neural Engineering. 9 (5), 056015 (2012).
- Hermann, J. K., Capadona, J. R. Understanding the role of innate immunity in the response to intracortical microelectrodes. Critical Reviews in Biomedical Engineering. 46 (4), 341-367 (2018).
- Ravikumar, M., et al. The roles of blood-derived macrophages and resident microglia in the neuroinflammatory response to implanted intracortical microelectrodes. Biomaterials. 35 (28), 8049-8064 (2014).
- Sawyer, A. J., et al. The effect of inflammatory cell-derived MCP-1 loss on neuronal survival during chronic neuroinflammation. Biomaterials. 35 (25), 6698-6706 (2014).
- Prasad, A., Sanchez, J. C. Quantifying long-term microelectrode array functionality using chronic in vivo impedance testing. Journal of Neural Engineering. 9 (2), 026028 (2012).
- Salatino, J. W., Ludwig, K. A., Kozai, T. D. Y., Purcell, E. K. Glial responses to implanted electrodes in the brain. Nature Biomedical Engineering. 1 (11), 862-877 (2017).
- McConnell, G. C., et al. Implanted neural electrodes cause chronic, local inflammation that is correlated with local neurodegeneration. Journal of Neural Engineering. 6 (5), 056003 (2009).
- Rennaker, R. L., Miller, J., Tang, H., Wilson, D. A. Minocycline increases quality and longevity of chronic neural recordings. Journal of Neural Engineering. 4 (2), 1-5 (2007).
- Carnicer-Lombarte, A., Chen, S. T., Malliaras, G. G., Barone, D. G. Foreign body reaction to implanted biomaterials and its impact in nerve neuroprosthetics. Frontiers in Bioengineering and Biotechnology. 9, 622524 (2021).
- Roitbak, T., Sykova, E. Diffusion barriers evoked in the rat cortex by reactive astrogliosis. Glia. 28 (1), 40-48 (1999).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Cui, X., Martin, D. C. Electrochemical deposition and characterization of poly(3,4-ethylenedioxythiophene) on neural microelectrode arrays. Sensors and Actuators B: Chemical. 89 (1), 92-102 (2003).
- Ludwig, K. A., Uram, J. D., Yang, J., Martin, D. C., Kipke, D. R. Chronic neural recordings using silicon microelectrode arrays electrochemically deposited with a poly(3,4-ethylenedioxythiophene) (PEDOT) film. Journal of Neural Engineering. 3 (1), 59-70 (2006).
- Keefer, E. W., Botterman, B. R., Romero, M. I., Rossi, A. F., Gross, G. W. Carbon nanotube coating improves neuronal recordings. Nature Nanotechnology. 3 (7), 434-439 (2008).
- Kim, D. -. H., Wiler, J. A., Anderson, D. J., Kipke, D. R., Martin, D. C. Conducting polymers on hydrogel-coated neural electrode provide sensitive neural recordings in auditory cortex. Acta Biomaterialia. 6 (1), 57-62 (2010).
- He, W., McConnell, G. C., Bellamkonda, R. V. Nanoscale laminin coating modulates cortical scarring response around implanted silicon microelectrode arrays. Journal of Neural Engineering. 3 (4), 316-326 (2006).
- Azemi, E., Lagenaur, C. F., Cui, X. T. The surface immobilization of the neural adhesion molecule L1 on neural probes and its effect on neuronal density and gliosis at the probe/tissue interface. Biomaterials. 32 (3), 681-692 (2011).
- Zhong, Y., Bellamkonda, R. V. Controlled release of anti-inflammatory agent alpha-MSH from neural implants. Journal of Controlled Release. 106 (3), 309-318 (2005).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Bedell, H. W., et al. Understanding the effects of both CD14-meditated innate immunity and device/tissue mechanical mismatch in the neuroinflammatory response to intracortical microelectrodes. Frontiers in Neuroscience. 12, 772 (2018).
- Nguyen, J. K., et al. Influence of resveratrol release on the tissue response to mechanically adaptive cortical implants. Acta Biomaterialia. 29, 81-93 (2016).
- Sridharan, A., Nguyen, J. K., Capadona, J. R., Muthuswamy, J. Compliant intracortical implants reduce strains and strain rates in brain tissue in vivo. Journal of Neural Engineering. 12 (3), 036002 (2015).
- Nguyen, J. K., et al. Mechanically-compliant intracortical implants reduce the neuroinflammatory response. Journal of Neural Engineering. 11, 056014 (2014).
- Harris, J. P., et al. In vivo deployment of mechanically adaptive nanocomposites for intracortical microelectrodes. Journal of Neural Engineering. 8 (4), 046010 (2011).
- Shoffstall, A. J., et al. Characterization of the neuroinflammatory response to Thiol-ene/Acrylate shape memory polymer coated intracortical microelectrodes. Micromachines. 10, 486 (2018).
- Simon, D. M., et al. Design and demonstration of an intracortical probe technology with tunable modulus. Journal of Biomedical Materials Research. Part A. 105 (1), 159-168 (2017).
- Ravikumar, M., et al. The effect of residual endotoxin contamination on the neuroinflammatory response to sterilized intracortical microelectrodes. Journal of Materials Chemistry. B. 2 (17), 2517-2529 (2014).
- Ecker, M., et al. Sterilization of thiol-ene/acrylate based shape memory polymers for biomedical applications. Macromolecular Materials and Engineering. 302 (2), 160331 (2017).
- Ereifej, E. S., et al. Implantation of neural probes in the brain elicits oxidative stress. Frontiers in Bioengineering and Biotechnology. 6 (9), 1-12 (2018).
- Potter, K. A., et al. The effect of resveratrol on neurodegeneration and blood brain barrier stability surrounding intracortical microelectrodes. Biomaterials. 34 (29), 7001-7015 (2013).
- Potter, K. A., et al. Curcumin-releasing mechanically adaptive intracortical implants improve the proximal neuronal density and blood-brain barrier stability. Acta Biomaterialia. 10 (5), 2209-2222 (2014).
- Potter-Baker, K. A., Capadona, J. R. Reducing the "stress": Antioxidative therapeutic and material approaches may prevent intracortical microelectrode failure. ACS Macro Letters. 4 (3), 275-279 (2015).
- Potter-Baker, K. A., et al. Development of superoxide dismutase mimetic surfaces to reduce accumulation of reactive oxygen species for neural interfacing applications. Journal of Materials Chemistry B. 2 (16), 2248-2258 (2014).
- Potter-Baker, K. A., et al. Implications of chronic daily antioxidant administration on the inflammatory response to intracortical microelectrodes. Journal of Neural Engineering. 12 (4), 046002 (2015).
- Kim, Y., et al. Ventricular delivery of resveratrol improves microelectrode recording performance and reduces oxidative stress. Micromachines. 12, 1446 (2021).
- Deku, F., et al. Amorphous silicon carbide ultramicroelectrode arrays for neural stimulation and recording. Journal of Neural Engineering. 15 (1), 016007 (2018).
- Ereifej, E. S., et al. The neuroinflammatory response to nanopatterning parallel grooves into the surface structure of intracortical microelectrodes. Advanced Functional Materials. 28 (12), 1704420 (2018).
- Kim, Y., et al. Nano-architectural approaches for improved intracortical interface technologies. Frontiers in Neuroscience. 12, 456 (2018).
- Mahajan, S., et al. Towards standardization of electrophysiology and computational tissue strain in rodent intracortical microelectrode models. Frontiers in Bioengineering and Biotechnology. 8, 416 (2020).
- Suresh, M. V., et al. The protective role of MnTBAP in oxidant-mediated injury and inflammation in a rat model of lung contusion. Surgery. 154 (5), 980-990 (2013).
- Liu, D., Shan, Y., Valluru, L., Bao, F. Mn (III) tetrakis (4-benzoic acid) porphyrin scavenges reactive species, reduces oxidative stress, and improves functional recovery after experimental spinal cord injury in rats: comparison with methylprednisolone. BMC Neuroscience. 14 (1), 23 (2013).
- Munief, W. M., et al. Silane deposition via gas-phase evaporation and high-resolution surface characterization of the ultrathin siloxane coatings. Langmuir. 34 (35), 10217-10229 (2018).
- Hoogerwerf, A. C., Wise, K. D. A three-dimensional microelectrode array for chronic neural recording. IEEE Transactions on Biomedical Engineering. 41 (12), 1136-1146 (1994).
- Staros, J. V., Wright, R. W., Swingle, D. M. Enhancement by N-hydroxysulfosuccinimide of water-soluble carbodiimide-mediated coupling reactions. Analalytical Biochemistry. 156 (1), 220-222 (1986).
- Yuan, X., Wolf, N., Mayer, D., Offenhausser, A., Wordenweber, R. Vapor-phase deposition and electronic characterization of 3-Aminopropyltriethoxysilane self-assembled monolayers on silicon dioxide. Langmuir. 35 (25), 8183-8190 (2019).
- Montgomery, D. C. . Design and Analysis of Experiments. Eighth edition. , (2013).
- Shoffstall, A. J., Capadona, J. R. Bio-inspired materials and systems for neural interfacing. Current Opinions in Biomedical Engineering. 6, 110-119 (2018).
- Skousen, J. L., Tresco, P. A. . Neuroprosthetics. Theory and Practice 2nd Edition. , 259-299 (2017).
- Michelson, N. J., et al. multi-modal analysis uncovers complex relationship at the brain tissue-implant neural interface: new emphasis on the biological interface. Journal of Neural Engineering. 15 (3), 033001 (2018).
- Hofmann, U. G., Capadona, J. R. Editorial: Bridging the gap in neuroelectronic interfaces. Frontiers in Neuroscience. 14, 457 (2020).
- Usoro, J., Sturgill, B., Musselman, K., Capadona, J. R., Pancrazio, J. J. On the definition of 'chronic' for intracortical microelectrode array applications. Micromachines. 12 (8), 972 (2021).
- Thompson, C. H., Saxena, A., Heelan, N., Salatino, J., Purcell, E. K. Spatiotemporal patterns of gene expression around implanted silicon electrode arrays. Journal of Neural Engineering. 18 (4), 1741 (2021).
- Golabchi, A., Woeppel, K. M., Li, X., Lagenaur, C. F., Cui, X. T. Neuroadhesive protein coating improves the chronic performance of neuroelectronics in mouse brain. Biosensors and Bioelectronics. 155, 112096 (2020).
- Zheng, X. S., et al. A superoxide scavenging coating for improving tissue response to neural implants. Acta Biomaterialia. 99, 72-83 (2019).
- Lee, H. C., et al. Foreign body response to intracortical microelectrodes is not altered with dip-coating of Polyethylene Glycol (PEG). Frontiers in Neuroscience. 11, 513 (2017).
- Boehler, C., et al. Actively controlled release of Dexamethasone from neural microelectrodes in a chronic in vivo study. Biomaterials. 129, 176-187 (2017).
- Hess, A. E., et al. Development of a stimuli-responsive polymer nanocomposite toward biologically optimized, MEMS-based neural probes. Journal of Micromechanics and Microengineering. 21 (5), 054009 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten