Method Article
Flexible organische elektronische Bauelemente für die gepulste elektrische Feldtherapie des Glioblastoms
In diesem Artikel
Zusammenfassung
Diese Arbeit beschreibt die Entwicklung flexibler interdigitalisierter Elektroden für die Implementierung in 3D-Hirntumormodellen, nämlich In-vitro-Kultur, In-ovo-Modell und In-vivo-Mausmodell. Die vorgeschlagene Methode kann verwendet werden, um die Wirkungen von gepulsten elektrischen Feldern auf Tumore unterschiedlicher Komplexität zu bewerten.
Zusammenfassung
Das Glioblastom ist aufgrund seiner hohen Invasivität mit onkologischen Standardtherapien schwer auszurotten. Bioelektrische Behandlungen, die auf gepulsten elektrischen Feldern (PEFs) basieren, sind vielversprechend für die Verbesserung der Behandlungseffizienz. Sie sind jedoch auf starre Elektroden angewiesen, die akute und chronische Schäden verursachen, insbesondere in Weichteilen wie dem Gehirn. In dieser Arbeit wurde flexible Elektronik verwendet, um PEFs an Tumore abzugeben, und die biologische Reaktion wurde mit Fluoreszenzmikroskopie bewertet. Interdigitierte Goldelektroden auf einem dünnen, transparenten Parylene-C-Substrat wurden mit dem leitenden Polymer PEDOT:PSS beschichtet, was zu einem anpassungsfähigen und biokompatiblen Gerät führte. Die Auswirkungen von PEFs auf Tumore und deren Mikroumgebung wurden anhand verschiedener biologischer Modelle untersucht. Zunächst wurden Monoschichten von Glioblastomzellen auf den Elektroden kultiviert, um Phänomene in vitro zu untersuchen. Als Zwischenschritt wurde ein In-ovo-Modell entwickelt, bei dem gentechnisch veränderte Tumorsphäroide in die embryonale Membran einer Wachtel transplantiert wurden. Aufgrund des Fehlens eines Immunsystems führte dies zu stark vaskularisierten Tumoren. In diesem frühen Stadium der Entwicklung haben Embryonen kein Immunsystem und Tumore werden nicht als Fremdkörper erkannt. So können sie sich schnell entwickeln und gleichzeitig ihre eigenen Gefäße aus dem vorhandenen embryonalen Gefäßsystem entwickeln, was ein wertvolles 3D-Krebsmodell darstellt. Schließlich wurde die flexible Elektrodenabgabe von PEFs in einem vollständigen Organismus mit einem funktionierenden Immunsystem unter Verwendung eines syngenen, orthograften (intrakraniellen) Mausmodells untersucht. Tumorsphäroide wurden vor der Implantation flexibler organischer Elektrodenvorrichtungen in das Gehirn von transgenen multifluoreszierenden Mäusen transplantiert. Ein verschlossenes Schädelfenster ermöglichte die Multiphotonen-Bildgebung des Tumors und seiner Mikroumgebung während der Behandlung mit PEFs über einen Zeitraum von mehreren Wochen.
Einleitung
Glioblastoma multiforme (GBM) ist ein hochinvasiver Tumor und daher mit Standardbehandlungen wie Resektion, Strahlentherapie und Chemotherapie schwer auszurotten. Trotz multimodaler Behandlungen bleibt die Prognose sehr schlecht und bei den meisten Patienten kommt es innerhalb von 1 Jahr nach der Diagnose zu einem Fortschreiten der Erkrankung 1,2. In jüngster Zeit hat die Entwicklung bioelektrischer Behandlungen ein großes Potenzial zur Verbesserung bestehender Therapien gezeigt. Diese Therapien nutzen die Abgabe von gepulsten elektrischen Feldern (PEF), typischerweise in einer einzigen Behandlungssitzung, um die Integrität der Zellmembran und die Mikroumgebung von Tumoren zu stören. Diese Zellmembranstörung, auch Elektroporation genannt, kann je nach Intensität des elektrischen Feldes und der Anzahl der Impulse reversibel oder irreversibel sein. Die irreversible Elektroporation (IRE) wird als nicht-thermische Gewebeablationstechnik angewendet, bei der elektrische Impulse eine tödliche Schädigung der Zellmembranen verursachen, die zum Zelltod führen3. Die reversible Elektroporation wird in der Elektrochemotherapie (ECT) angewendet, einer etablierten Technik, die aus der Verabreichung von PEFs in Kombination mit Chemotherapeutika besteht, um die Medikamentenaufnahme in Krebszellen zu verbessern4. Darüber hinaus haben neuere Studien gezeigt, dass die Calcium-Elektroporation eine Alternative zur ECT mit hoher Effizienz für die Krebsbehandlung darstellt, die auch kostengünstig ist und weniger Nebenwirkungen hervorruft5. Trotz dieser vielversprechenden Fortschritte werden PEFs in der Regel mit starren, metallischen Elektroden aufgetragen, von denen bekannt ist, dass sie das Weichgewebe schädigen6. Das Gehirn reagiert besonders empfindlich auf solche invasiven Geräte, bei denen die mechanische Fehlanpassung Entzündungen und astrogliale Narben hervorruft7.
In diesem Zusammenhang wird ein flexibles PEF-Verabreichungssystem in Kombination mit 3D-Modellen von Glioblastom-Tumoren vorgestellt, von der Mikrofabrikation bis zum Mausmodell. Konforme Elektroden werden mit Standard-Dünnschicht-Mikrofabrikationsprozessen hergestellt, einschließlich der Verwendung weicher und biokompatibler Materialien wie Parylene-C, Gold und PEDOT:PSS 8,9. Ein interdigitalisiertes Elektrodendesign wird verwendet, um eine große Oberfläche abzudecken und gleichzeitig eine ausreichende Transparenz für die Bildgebung zwischen den Elektrodenfingern10 aufrechtzuerhalten. Für das Tumormodell werden 3D-Sphäroide von Glioblastomzellen, die einen genetisch kodierten Fluoreszenzreporter exprimieren, unter Verwendung einer Variation der Liquid-Overlay-96-Well-Plattenmethode11 hergestellt. Die Sphäroide werden in die Chorioallantoismembran eines Wachtelembryos eingepfropft, was zu einem In-ovo-Modell führt, das ausgiebig zur Untersuchung der Angiogenese oder der Arzneimitteltoxikologie verwendet wurde12,13. Tumore können durch das Gefäßsystem des Embryos transplantiert und vaskularisiert werden, wenn in diesem Stadium der Embryonalentwicklung kein Immunsystem vorhanden ist12. Flexible Elektroden werden dann auf den vaskularisierten Tumor gelegt, um die Wirkung der PEF-Abgabe auf das Sphäroid und sein Gefäßsystem zu untersuchen. Schließlich werden diese Effekte auf einen vollständigen lebenden Organismus, einschließlich der Tumormikroumgebung und des Immunsystems, untersucht, indem künstlich hergestellte Sphäroide in das Hirnparenchym von Mausmodellen implantiertwerden 14. Flexible Elektroden werden auf der Einstichstelle platziert und die Kraniotomie wird mit einem Glasfenster versiegelt, was eine wiederholte Zwei-Photonen-Bildgebung über mehrere Wochen ermöglicht.
Diese Methoden werden für Menschen nützlich sein, die sich für verschiedene Bereiche interessieren, die von der Mikroelektronik bis hin zu onkologischen Anwendungen reichen. Das Mikrofabrikationsprotokoll kann für jede Anwendung verwendet und angepasst werden, die Dünnschicht-Metallelektroden erfordert, die mit PEDOT:PSS beschichtet sind. Darüber hinaus werden die biologischen Modelle, die für die Evaluierung von elektrischen Antitumorbehandlungen entwickelt wurden, von allgemeinem Interesse für die Untersuchung der Differenzierung der zellulären, vaskulären und Immunantwort auf implantierte Materialien sein.
Protokoll
Alle Versuchsverfahren wurden in Übereinstimmung mit der französischen Gesetzgebung und in Übereinstimmung mit der Richtlinie des Rates der Europäischen Gemeinschaft vom 24. November 1986 (86/609/EWG) über die Pflege und Verwendung von Versuchstieren durchgeführt. Die Tierforschung wurde von der Direction Départementale des Services Vétérinaires des Bouches-du-Rhône genehmigt und von der Ethikkommission der Provence Côte d'Azur (Apafis # 22689-2019100414103054) genehmigt.
1. Mikrofabrikation flexibler Geräte (Abbildung 1)
- Reinigung der Objektträger
- Glasobjektträger in 2%iger Seifenlösung 15 Minuten lang beschallen. Spülen Sie sie mit Wasser ab.
- Erneut in einer Mischung aus 80% reinem Aceton und 20% reinem Isopropanol für 15 min beschallen.
ACHTUNG: Diese Lösungsmittel sind schädlich und brennbar. Tragen Sie persönliche Schutzausrüstung (PSA) und behandeln Sie diese unter einem Abzug. - Spülen Sie die Objektträger mit Isopropanol ab und trocknen Sie sie mit einer Luftpistole.
HINWEIS: Stellen Sie sicher, dass Aceton während des gesamten Vorgangs nicht auf den Substraten trocknet.
- Goldelektroden-Strukturierung (Abbildung 1A)
- Scheiden Sie eine 3 μm dicke Schicht aus Parylene-C (PaC) mit einem Parylene-Abscheidungssystem ab (Abbildung 1Aa).
- Legen Sie die gereinigten Objektträger in die Abscheidekammer. Sprühen Sie Seife auf den Kühler, lassen Sie ihn trocknen und führen Sie ihn in die dafür vorgesehene Kühlfalle des Ablagerungssystems ein. Dieses Antiadhäsivmittel erleichtert das Entfernen von PaC aus dem Kühler nach der Abscheidung.
ACHTUNG: PaC ist reizend und stellt ein Gesundheitsrisiko dar. Tragen Sie beim Umgang mit Handschuhen. - Wiegen Sie 6 g PaC in einem Aluminiumschiffchen und legen Sie es in den Ofen. Evakuieren Sie die Maschine (P = 10 mTorr) und starten Sie die Abscheidung mit den folgenden Parametern:T-Kühler = -100 °C,T-Ofen = 690 °C,T-Verdampfer = 175 °C undT-Kammer = 135 °C.
- Wenn die Abscheidung beendet ist und die Temperatur des Verdampfers unter 40 °C liegt, schalten Sie den Kühler, den Verdampfer und den Ofen aus. Entlüften Sie die Maschine und sammeln Sie die Proben.
- Legen Sie die gereinigten Objektträger in die Abscheidekammer. Sprühen Sie Seife auf den Kühler, lassen Sie ihn trocknen und führen Sie ihn in die dafür vorgesehene Kühlfalle des Ablagerungssystems ein. Dieses Antiadhäsivmittel erleichtert das Entfernen von PaC aus dem Kühler nach der Abscheidung.
- Aktivieren Sie die Oberfläche der Proben durch Sauerstoffplasmabehandlung für 30 s (100 W, 50 sccm).
- Schleudern Sie die mit Plasma behandelten Proben mit einem negativen Fotolack bei 1.000 x g für 40 s. Die Proben werden 2 Minuten lang bei 110 °C auf eine Heizplatte gelegt (Abbildung 1Ab).
VORSICHT: Die Fotolacklösung ist brennbar und verursacht Reizungen; Tragen Sie PSA und behandeln Sie sie unter einem Abzug. - Platzieren Sie einen i-Linienfilter in der Strahllinie des UV-Breitband-Kontaktaligners und belichten Sie den Fotolack durch eine Maske, die das Design der interdigitalisierten Elektrode aufweist (Abbildung 1Ac).
HINWEIS: Interdigitalisierte Elektroden mit einem Abstand von 50 oder 250 μm wurden mit einem Layout-Editor entworfen und Fotomasken wurden bei einem Unternehmen bestellt, das Polyester-Fotomasken durch Laser-Photoplotten herstellt. - Die oben genannten Proben bei 110 °C auf einer heißen Platte 3 min backen und 5 min auf Raumtemperatur abkühlen lassen. Tauchen Sie die Proben 3 Minuten lang in einen metallionenfreien Entwickler, um den nicht belichteten Fotolack zu entfernen. Spülen Sie die Proben mit Wasser ab und trocknen Sie sie mit einer Luftpistole (Abbildung 1Ad).
VORSICHT: Die Entwicklerlösung ist irritierend; Tragen Sie PSA und Griff unter einem Abzug. - Aktivieren Sie die Oberfläche der Proben durch Sauerstoffplasmabehandlung für 60 s (100 W, 50 sccm).
- Scheiden Sie eine 20 nm Haftschicht aus Chrom und eine 300 nm Schicht aus Gold mit einem thermischen Verdampfer wie folgt ab (Abbildung 1Ae).
- Entlüften Sie die Verdampfermaschine und befestigen Sie die Proben (mit der Vorderseite nach unten) mit Metallschrauben an der oberen runden Platte. Füllen Sie die dafür vorgesehenen Tiegel mit Chrom bzw. Gold. Versiegeln und evakuieren Sie die Maschine, um einen Druck unter 5·10-6 Torr zu erreichen. Starten Sie die Drehung des Probenhalters.
- Wählen Sie den chromhaltigen Tiegel und erhöhen Sie langsam den Strom, der durch ihn fließt, bis eine Abscheidungsrate von 0,2 Å·s-1 erreicht ist. Öffnen Sie den Verschluss und warten Sie, bis 20 nm Chrom abgeschieden sind. Schließen Sie den Verschluss und drosseln Sie den Strom langsam auf 0 mA.
- Wählen Sie den Tiegel mit Gold aus und erhöhen Sie langsam den Strom, der durch ihn fließt, bis eine Abscheidungsrate von 0,2 Å·s-1 erreicht ist. Öffnen Sie den Verschluss, um Gold zu verdampfen, warten Sie, bis 10 nm Gold abgelagert sind, und erhöhen Sie dann die Abscheidungsrate auf 1,5 Å·s-1 , bis etwa 300 nm abgelagert sind. Schließen Sie den Verschluss und drosseln Sie den Strom langsam auf 0 mA.
- Lassen Sie die Proben nach der Ablagerung 15 Minuten lang auf Raumtemperatur abkühlen. Stoppen Sie die Drehung des Probenhalters, entlüften Sie die Maschine und sammeln Sie die Proben.
- Tauchen Sie die Proben in ein Becherglas mit Aceton. Stellen Sie das Becherglas 15 Minuten lang auf eine Schüttelplatte, die auf 110 U/min eingestellt ist, um den Fotolack abzuheben. Spülen Sie die Proben mit Isopropanol ab und trocknen Sie sie mit einer Luftpistole (Abbildung 1Af).
- Aktivieren Sie die Oberfläche der Proben durch Sauerstoffplasmabehandlung für 30 s (100 W, 50 sccm).
- Abscheidung einer 3 μm dicken Isolationsschicht aus PaC mit einem Parylene-Abscheidungssystem (siehe Schritt 1.2.1) (Abbildung 1Ag).
- Scheiden Sie eine 3 μm dicke Schicht aus Parylene-C (PaC) mit einem Parylene-Abscheidungssystem ab (Abbildung 1Aa).
- Umrissöffnung (Abbildung 1B)
- Schleudern Sie die Proben mit einem positiven Fotolack bei 600 x g für 35 s. Legen Sie es für 2 min auf eine Kochplatte bei 110 °C (Abbildung 1Ba).
VORSICHT: Die Fotolacklösung ist brennbar und verursacht Reizungen; Tragen Sie PSA und Griff unter einem Abzug. - Stellen Sie sicher, dass sich kein i-Linienfilter in der Strahllinie des UV-Breitband-Kontaktaligners befindet, und belichten Sie den Fotolack durch eine Maske, die den Umriss des Geräts mit einem UV-Breitband-Kontaktaligner aufweist (Abbildung 1Bb).
- Tauchen Sie die Proben 4 Minuten lang in einen metallionenfreien Entwickler, um den belichteten Fotolack zu entfernen. Spülen Sie die Proben mit Wasser ab und trocknen Sie sie mit einer Luftpistole (Abbildung 1Bc).
- Der Umriss wird mit einem reaktiven Ionenätzer (160 W, 22 min, Ø2: 50 sccm, CF4: 10 sccm) durch die beiden PaC-Schichten geätzt (Abbildung 1Bd).
- Entfernen Sie den restlichen Fotolack mit Aceton, spülen Sie ihn mit Isopropanol ab und trocknen Sie die Proben mit einer Luftpistole.
- Schleudern Sie die Proben mit einem positiven Fotolack bei 600 x g für 35 s. Legen Sie es für 2 min auf eine Kochplatte bei 110 °C (Abbildung 1Ba).
- PEDOT:PSS-Beschichtung (Abbildung 1C)
- Eine 2%ige Seifenlösung wird 35 s lang bei 70 x g geschleudert (Abbildung 1Ca).
- Abscheidung einer 3 μm großen Opferschicht aus PaC mit einem Parylene-Abscheidungssystem (siehe Schritt 1.2.1) (Abbildung 1Cb).
- Spin-Coat-positiver Fotolack bei 600 x g für 35 s. Legen Sie die Proben für 2 min auf eine Heizplatte bei 110 °C (Abbildung 1 Cc).
- Stellen Sie sicher, dass sich kein i-Linienfilter in der Strahllinie des UV-Breitband-Kontaktaligners befindet, und belichten Sie den Fotolack durch eine Maske, die die aktive Oberfläche der Elektroden aufweist (Abbildung 1Cd).
- Tauchen Sie die Proben 4 Minuten lang in einen metallionenfreien Entwickler, um den belichteten Fotolack zu entfernen. Spülen Sie die Proben mit Wasser ab und trocknen Sie sie mit einer Luftpistole (Abbildung 1Ce).
- Ätzen Sie den PaC mit einem reaktiven Ionenätzer, um die aktive Oberfläche der Elektroden zu öffnen (160 W, 24 min, Ø2: 50 sccm, CF4: 10 sccm). Überprüfen Sie mit einem Mikroskop, ob sich kein Rest-PaC auf der aktiven Oberfläche befindet (Abbildung 1Cf).
- Entfernen Sie den restlichen Fotolack mit Aceton, spülen Sie ihn mit Isopropanol ab und trocknen Sie die Proben mit einer Luftpistole.
- Aktivieren Sie die Oberfläche der Proben mit einer Sauerstoffplasmabehandlung für 90 s (100 W, 50 sccm).
- Mischen Sie eine handelsübliche Dispersion von chemisch polymerisiertem PEDOT:PSS mit 5 Vol.-% Ethylenglykol (EG) und 0,1 Vol.-% Dodecylbenzolsulfonsäure (DBSA). 15 Minuten einwirken lassen. 1 Gew.-% (3-Glycydyloxypropyl)trimethylsiloxan (GOPS) zugeben und 5 Minuten lang beschallen. Filtern Sie die Lösung durch einen 1,2 μm Filter.
ACHTUNG: EG ist reizend und stellt eine Gesundheitsgefahr dar. DBSA ist reizend und ätzend. GOPS ist ätzend. Tragen Sie geeignete PSA und behandeln Sie diese Chemikalien unter einem Abzug.
HINWEIS: Das Gesamtvolumen hängt von der Anzahl der Proben ab. Bereiten Sie für 10 Standard-Objektträger mindestens 20 ml vor, die den folgenden Mengen entsprechen würden: 18,78 ml PEDOT:PSS, 1 ml EG, 20 μl DBSA und 200 μl GOPS. - Vier Schichten PEDOT:PSS-Lösung bei 150 x g 35 s lang schleudern. Nach der Abscheidung jeder Schicht werden die Proben 60 s lang bei 110 °C auf einer heißen Platte gebacken und 5 Minuten lang auf Raumtemperatur abgekühlt, bevor die nächste Schicht geschleudert wird (Abbildung 1Cg).
- Entfernen Sie die Opfer-PaC-Schicht, indem Sie die Proben in Wasser tauchen (Abbildung 1Ch).
- Die Proben bei 140 °C 1 h backen.
- Tauchen Sie die Proben 30 Minuten lang in deionisiertes Wasser, um die verbleibende Seife und niedermolekulare Verbindungen in der PEDOT:PSS-Folie zu entfernen und die Proben vom Glassubstrat zu lösen (Abbildung 1Ci).
- Anschlüsse und Gehäuse (Abbildung 1D)
- Tragen Sie eine dünne Schicht Acrylfarbe auf eine Polyimidfolie auf, die mit Kupfer beschichtet ist (Abbildung 1Da). Verwenden Sie ein Aerosol, um eine homogene Farbschicht zu erhalten (Abbildung 1Db).
- Mustern Sie die Acrylfarbe mit einem Laser (75 kHz, 7 W, 1 Laserdurchgang, 400 mm·s-1), um zwei rechteckige Kontaktflächen (5 mm x 15 mm; 1,5 mm Abstand) zu erhalten (Abbildung 1Dc).
- Nassätzen Sie das Kupfer mit gesättigtem 30 % (w/v) Eisenchlorid (FeCl3) in Wasser für 15 min bei 40 °C (Abbildung 1Dd).
VORSICHT: FeCl3 ist reizend und ätzend; Fassen Sie es mit Handschuhen unter einem Abzug an. - Entfernen Sie die Acrylfarbe mit Aceton, indem Sie sie leicht mit einem Tuch abreiben (Abbildung 1De).
- Schneiden Sie die gemusterte Polyimidfolie mit einem Laser (15 kHz, 10 W, 30 Laserdurchgänge, 130 mm·s-1) in rechteckige Formen (15 kHz, 10 W, 130 mm·s-1) (Abbildung 1Df).
- Dosieren Sie Silberpaste mit einer dreiachsigen Dosiermaschine bei einem Druck von drei bar mit einer Nadel mit einem Durchmesser von 330 μm (5 m·min-1) (Abbildung 1Dg).
VORSICHT: Silberpaste ist reizend; mit Handschuhen anfassen. - Richten Sie die PaC-Sonde mit einer Pinzette aus und befestigen Sie sie mit der Polyimidfolie unter einem binokularen Mikroskop (Abbildung 1Dh).
HINWEIS: Ausrichtungsmarkierungen können in Schritt 1.5.2 gemustert werden, um die Positionierung der Sonde auf den Kontaktflächen zu erleichtern. - Bei 140 °C 2 h im Ofen backen.
- Legen Sie ein 1 cm2 Polyimid-Schutzband auf die Kontaktpads (Abbildung 1Di).
- Tauchen Sie die Schnittstelle, an der die PaC-Sonde und die Polyimidfolie angeschlossen sind, in PDMS ein (Abbildung 1Dj).
- 2 h bei 50 °C backen.
- Entfernen Sie das Schutzband, um die Kontaktpads zu öffnen (Abbildung 1Dk).
HINWEIS: Die Mikrofabrikation von In-vitro-Produkten ist ähnlich, aber die Schritte 1.2.1, 1.3 und 1.5 müssen übersprungen werden.
2. Generierung einer stabilen Glioblastom-GCaMP6f-Zelllinie
- Lentivirus-Produktion
- In einem 75 cm² großen Kolben wird eine von HEK 293T abgeleitete Zelllinie, die für die Lentivirus-Produktion optimiert ist, in 10 ml Dulbeccos modifiziertem Adlermedium (DMEM) mit 4,5 g· L-1 von Glucose, L-Glutamin, Natriumpyruvat und Natriumbicarbonat und ergänzt mit 10% tetracyclin-freiem fetalem Rinderserum (FBS), 100 Einheiten ·mL-1 Penicillin und 100 μg·mL-1 Streptomycin für mindestens 3 Tage bis 80% Konfluenz.
- Nehmen Sie das Medium aus dem Kolben. Spülen Sie die Zellen vorsichtig mit 10 ml phosphatgepufferter Kochsalzlösung (PBS).
- 1 ml 0,25%ige Trypsin/EDTA-Lösung zugeben und den Kolben 5 min bei 37 °C inkubieren.
VORSICHT: Trypsin / EDTA-Lösung stellt eine Gesundheitsgefahr dar; Tragen Sie PSA und Griff unter einem Abzug. - Fügen Sie 8 ml Nährmedium hinzu. Spülen Sie die Zellsuspension vorsichtig aus.
- Zählen Sie die Zellen und geben Sie 4 x 106 Zellen in einer Petrischale in 8 ml Nährmedium.
- Am nächsten Tag werden 25 μg des Plasmids, das das Gen GCaMP6f und einen Selektionsmarker enthält, der eine Resistenz gegen Puromycin verleiht, in einem Gesamtvolumen von 600 μl Wasser verdünnt. Geben Sie es in ein Röhrchen mit Transfektionsreagenz. Wirbeln Sie 10 s lang bei 3.000 U / min und inkubieren Sie das Röhrchen bei Raumtemperatur für 10 Minuten, um die Produktion von Nanopartikeln zu ermöglichen.
- Den Inhalt des Röhrchens tropfenweise auf die Kultur der HEK 293 T-Zellen geben und vorsichtig von Hand schütteln. Die Zellen werden mindestens 4 h lang bei 37 °C inkubiert.
- Ersetzen Sie die Medien, die Nanopartikelkomplexe enthalten, durch frische Medien und geben Sie die Zellen bei 37 °C zurück.
- Sammeln Sie den Überstand drei Tage später und zentrifugieren Sie ihn 10 Minuten lang bei 500 x g , um Zelltrümmer zu entfernen. Sammeln Sie die flüssige Phase, die Viruspartikel enthält.
HINWEIS: Die Virusproduktion im Überstand kann mit einem quantitativen lentiviralen Titertest bestätigt werden und kann mindestens 2 Jahre bei -80 °C gelagert werden.
- Transduktion von Glioblastomzellen
- In einem 75 cm² großen Kolben werden Glioblastomzellen in 10 ml DMEM mit 1 g· L-1 von Glucose, L-Glutamin, Natriumpyruvat und Natriumbicarbonat und ergänzt mit 10% Tetracyclin-freiem FBS, 100 Einheiten · mL-1 Penicillin und 100 μg · mL-1 Streptomycin für mindestens 4 Tage.
- Das Medium wird verworfen und der in Schritt 2.1.9 erhaltene Überstand auf die Zielzellen gegeben.
- Geben Sie 5 μg·mL-1 Hexadimethrinbromid in das Medium, um die Transduktion zu verbessern. 6 h bei 37 °C inkubieren. Ersetzen Sie das Medium durch 10 ml frisches Medium.
ACHTUNG: Hexadimethrinbromid ist reizend. Behandeln Sie es mit Handschuhen.
- Generierung einer stabilen Zelllinie
- Zwei bis drei Tage nach der Transduktion 10 ml DMEM mit 1 g· L-1 von Glucose, L-Glutamin, Natriumpyruvat und Natriumbicarbonat, 10% FBS, 100 Einheiten ·mL-1 Penicillin, 100 μg·mL-1 von Streptomycin und ergänzt mit Puromycin, um die nicht transduzierten Zellen abzutöten. Kultivieren Sie die Zellen mindestens 3 Tage lang in diesem Medium.
ACHTUNG: Puromycin ist reizend; Behandeln Sie es mit Handschuhen.
HINWEIS: Die Empfindlichkeit der Zellen gegenüber Puromycin muss vor der Transduktion getestet werden, indem Zellen in ihrem empfohlenen Medium kultiviert werden, das unterschiedliche Konzentrationen von Puromycin enthält. Einen Tag später überprüfen Sie die Zellen mit einem Mikroskop. Wählen Sie die geeignete Konzentration, bei der die Mehrheit der Zellen tot ist, aber nur wenige noch am Leben sind, um sicherzustellen, dass das Antibiotikum nicht zu toxisch ist und auch die transfizierten Zellen töten könnte. - Entfernen Sie das Medium und spülen Sie die Zellen mit 10 ml PBS aus.
- 1 ml 0,25 % einer Trypsin/EDTA-Lösung zugeben und den Kolben 5 min bei 37 °C inkubieren.
- Fügen Sie 8 ml Nährmedium hinzu. Spülen Sie die Zellsuspension vorsichtig aus.
- Sammeln Sie 100 μl Zellsuspension und messen Sie die Zellkonzentration mit einem Zellzähler. Saugen Sie 50 μl Zellsuspension in einem tragbaren automatisierten Zellzähler mit einem 60-μm-Sensor ab.
- Säen Sie 1 Zelle/Well in eine 96-Well-Platte. Zum Beispiel wird für eine Konzentration von 1 x 10 3 Zellen pro ml 1 / (1 x 103) addiert, d. h. 0,001 ml Zellsuspension pro Vertiefung. Säen Sie jeden Brunnen, um die Erfolgschancen zu erhöhen. Komplett mit Nährmedium, um ein Gesamtvolumen von 200 μl pro Vertiefung zu erreichen.
- Einen Tag später finden Sie jede Vertiefung, die eine Zelle enthält, und überprüfen Sie ihre Fluoreszenz (λexc = 490 nm und λem = 530 nm). Markieren Sie die Vertiefungen, die nur eine transfizierte Zelle enthalten. Setzen Sie das Wachstum für einige Tage fort, bis der Brunnen fast zusammenfließt.
- Entsorgen Sie das Medium und spülen Sie die Zellen mit 200 μl PBS aus. 100 μl 0,25%ige Trypsin/EDTA-Lösung zugeben und die 96-Well-Platte 5 min bei 37 °C inkubieren.
- Fügen Sie 100 μl Medium hinzu und spülen Sie die Zellsuspension vorsichtig aus. Übertragen Sie die Zellsuspension in eine Petrischale. Fügen Sie 5 ml Medium hinzu und lassen Sie die Zellen einige Tage wachsen, bis die Petrischale fast zusammenfließt.
- Entsorgen Sie das Medium und spülen Sie die Zellen mit 5 ml PBS aus. 1 ml 0,25%ige Trypsin/EDTA-Lösung zugeben und die Petrischale 5 min bei 37 °C inkubieren.
- Fügen Sie 6 ml Medium hinzu und spülen Sie die Zellsuspension vorsichtig aus. Die Zellsuspension wird in einen T25-Kolben überführt. Setzen Sie das Wachstum für einige Tage fort, bis der Kolben fast konfluiert ist.
- Entsorgen Sie das Medium und spülen Sie die Zellen mit 5 ml PBS aus. 1 ml 0,25%ige Trypsin/EDTA-Lösung zugeben und den T25-Kolben 5 min bei 37 °C inkubieren. Fügen Sie 7 ml DMEM hinzu, das 1 g· L-1 von Glucose, L-Glutamin, Natriumpyruvat und Natriumbicarbonat und ergänzt mit 10% FBS, 100 Einheiten · mL-1 Penicillin und 100 μg · mL-1 Streptomycin. Spülen Sie die Zellsuspension vorsichtig aus.
- Teilen Sie die Zellsuspension auf vier T25-Kolben (2 ml pro Kolben) auf und geben Sie 5 ml Medium in jeden Kolben. Lassen Sie die Zellen einige Tage wachsen, bis die Kolben fast konfluierend sind.
- Wiederholen Sie Schritt 2.3.12 für drei Kolben und bewahren Sie den letzten Kolben für Schritt 3.1.3 auf. Die Zellsuspension wird in ein konisches 15-ml-Röhrchen überführt und bei 150 x g 5 min zentrifugiert. Entsorgen Sie den Überstand und resuspendieren Sie das Zellpellet in 900 μl. Mischen Sie die Zellen vorsichtig, um eine homogene Zellsuspension zu erhalten.
- Übertragen Sie die Zellsuspension in kryogene Lagerfläschchen. 100 μl Dimethylsulfoxid zugeben. Legen Sie die Kryozellen über Nacht bei -80 °C. Übertragen Sie gefrorene Zellen für weitere Experimente auf flüssigen Stickstoff.
HINWEIS: Die Effizienz der Transfektion kann durch Zugabe von 5 μM Ionomycin-Calciumsalz in das Medium und Überprüfung des induzierten Fluoreszenzanstiegs unter einem Fluoreszenzmikroskop (λexc = 490 nm und λem = 530 nm) beurteilt werden.
- Zwei bis drei Tage nach der Transduktion 10 ml DMEM mit 1 g· L-1 von Glucose, L-Glutamin, Natriumpyruvat und Natriumbicarbonat, 10% FBS, 100 Einheiten ·mL-1 Penicillin, 100 μg·mL-1 von Streptomycin und ergänzt mit Puromycin, um die nicht transduzierten Zellen abzutöten. Kultivieren Sie die Zellen mindestens 3 Tage lang in diesem Medium.
3.3D Modelle
- Sphäroid-Kultur
- Bereiten Sie eine Lösung von 1% (w/v) Agarose in deionisiertem (DI) Wasser vor.
- 100 g Agarosepulver in 100 ml DI-Wasser geben und die Lösung in der Mikrowelle erhitzen, bis sich das gesamte Pulver aufgelöst hat. Rühren Sie die Lösung regelmäßig um, um Klumpen zu vermeiden. Die Lösung wird 20 Minuten lang bei 120 °C autoklaviert.
- Nach der Entnahme aus dem Autoklaven 75 μl Agaroselösung pro Vertiefung vorsichtig in eine 96-Well-Platte geben. Legen Sie es an der Seite des Brunnens ab, um einen Meniskus zu bilden, was zu einem nicht haftenden runden Boden führt. 15 Minuten bei Raumtemperatur erstarren lassen.
- Die Zellen (Schritt 2.3.12) werden von dem in Schritt 2.3.14 erhaltenen Kolben abgenommen.
- Fügen Sie 10.000 Zellen pro Vertiefung von Glioblastomzellen hinzu und vervollständigen Sie, um ein Gesamtvolumen von 150 μl pro Vertiefung mit DMEM zu erreichen, das 1 g· L-1 von Glucose, L-Glutamin, Natriumpyruvat und Natriumbicarbonat und ergänzt mit 10% fetalem Rinderserum (FBS), 100 Einheiten · mL-1 Penicillin und 100 μg · mL-1 Streptomycin.
- Inkubieren Sie die Zellen 3 Tage lang bei 37 °C, ohne die Platte zu bewegen. Ersetzen Sie dann alle 2 Tage die Hälfte des Mediums durch frisches Medium mit einer Mehrkanalpipette, bis weitere Experimente durchgeführt werden. Halten Sie die Pipettenspitze im oberen Teil der Vertiefung, um eine Beschädigung der Agarose oder des Sphäroids selbst zu vermeiden.
HINWEIS: Die Größe der Sphäroide hängt von der Anzahl der ausgesäten Zellen und der Zelllinie ab und muss daher je nach Experiment angepasst werden.
- Bereiten Sie eine Lösung von 1% (w/v) Agarose in deionisiertem (DI) Wasser vor.
- Das In-ovo-Modell
- Legen Sie befruchtete Eier der japanischen Wachtel (C. japonica) in einen Brutkasten (37 °C und 57% Luftfeuchtigkeit) auf Tabletts mit einem automatischen Rotator, der die Eier alle 2 Stunden wendet. Dieser Tag gilt als Embryonaltag (ED) 0.
- Waschen Sie Kunststoff-Wiegeboote, indem Sie sie in 70% (w/v) Ethanol legen. Nehmen Sie die Wiegeboote heraus und trocknen Sie sie unter einem Abzug.
HINWEIS: Ab diesem Zeitpunkt werden die Experimente nicht mehr unter sterilen Bedingungen durchgeführt. Es sind jedoch saubere Bedingungen erforderlich, um die Entwicklung von Schimmel auf den Embryonen zu vermeiden. - Öffnen Sie die Eier auf ED3 vorsichtig mit einer Pinzette mit dünnen Spitzen, die mit 70% (w/v) Ethanol vorgewaschen sind. Gießen Sie den Embryo in ein Plastikwiegeboot, decken Sie es mit einem anderen Wiegeboot ab und legen Sie ihn 3 Tage lang bei 37 °C in einen befeuchteten Standardinkubator.
- Machen Sie bei ED6 mit einer 23-G-Nadel einen kleinen Einschnitt in die Chorioallantoismembran (CAM).
- Legen Sie mit einer Pipette ein 7-Tage-Sphäroid auf den Schnitt und geben Sie den Embryo bis zu weiteren Experimenten für 3 Tage in den Inkubator zurück.
HINWEIS: Ein Fluoreszenzfarbstoff kann in das Auge des Embryos injiziert werden, um Blutgefäße sichtbar zu machen. - Platzieren Sie die flexible Sonde am Tag des Experiments mit einem Mikromanipulator auf dem vaskularisierten Tumor.
- Das in vivo Modell
HINWEIS: Dieser Teil des Protokolls wurde von dem zuvor als Referenz veröffentlichten Teil angepasst14. Es wurden adulte mehrfarbige fluoreszierende AMU-Neuroinflam-Mäuse (B6.Cg-Tg(Thy1-CFP)23Jrs(Ly6a-EGFP)G5Dzk(Itgax-EYFP)1Mnz/FD) verwendet; Diese Mäuse zeigen die Markierung einer Subpopulation von Thy1+ Neuronen durch transgene Expression von ECFP, Markierung von peripherem LyzM+ Entzündungszellen durch transgene Expression von EGFP und Markierung eines Subtyps von Mikroglia, die EYFP unter der Kontrolle von Cd11c exprimieren+. Kurz gesagt, die Tiere werden vor jeder Behandlung oder Injektion 2 Minuten lang leicht mit 1,5% Isofluran sediert. Vor der Operation werden die Tiere mit Ketamin (120 mg/kg; IP) und Xylazin (12 mg/kg; IP). Dann wird 3% Lidocain-Gel lokal aufgetragen, um Schmerzen in den Ohren zu lindern, die mit der Fixierung der stereotaktischen Unterstützung verbunden sind. Dann wird 0,25% ige Bupivacain-Lösung an die Operationsstelle verabreicht, um Schmerzen aufgrund der Kraniotomie zu lindern. Nachdem die Maus für die Operation vorbereitet war, wurde eine Kraniotomie mit einem Durchmesser von 4 mm gemäß Referenz durchgeführt14. Mit einer 26-G-Nadel wurde in der Mitte der Kraniotomie ein Loch in die Dura mater gebohrt und dem Tumorsphäroid das in der Referenz beschriebene Injektionssystem injiziert14. Zusätzlich wurde, wie hier beschrieben, eine flexible Elektrode auf das GCamp6- oder DsRed-exprimierende Tumorsphäroid gelegt, bevor die Kraniotomie mit einem Glasfenster versiegelt wurde.- Geben Sie einen Tropfen Dulbeccos phosphatgepufferte Kochsalzlösung (DPBS) so auf, dass sie die Kraniotomie bedeckt. Setzen Sie die flexible Elektrode auf den Tropfen des DPBS und legen Sie die Rückseite der Sonde mit den Kontaktpads vorsichtig auf die Rückseite der Maus (Abbildung 4B).
HINWEIS: Verwenden Sie sterile Handschuhe und eine "Nur-Tipp"-Technik. Wechseln Sie die Handschuhe, wenn eine nicht sterile Oberfläche berührt wird. Sorgen Sie während dieses Vorgangs für thermische Unterstützung. - Berühren Sie den DPBS-Tropfen mit einem kleinen Stück Papier, um DPBS zu absorbieren, bis die Sonde flach auf der Dura liegen und der Krümmung des Gehirns folgen kann. Stellen Sie sicher, dass eine kleine DPBS-Schicht unter den Elektroden verbleibt, ohne von der Seite der Elektrode zu entweichen. Dies gewährleistet eine Barriere gegen das Überlaufen von Klebstoff während der nächsten Schritte.
HINWEIS: Sterilisieren Sie alle Geräte vor dem Gebrauch. - Geben Sie einen kleinen Tropfen Silikonkleber auf die Sonde und decken Sie sie mit einem 5 mm runden Deckglas ab. Drücken Sie das Deckglas nach unten, bis das Silikon gleichmäßig verteilt ist und der Abstand zwischen dem Deckglas und der Sonde minimal ist. Drücken Sie das Deckglas für weitere 30 s nach unten, damit sich das Silikon verfestigen kann.
- Um das Deckglas zu befestigen, tragen Sie schnell Sekundenkleber auf die Seiten auf und drücken Sie ihn nach unten, bis der Kleber fest aushärtet.
- Tragen Sie mit einem Zahnstocher Sekundenkleber auf den Hals der Sonde auf und achten Sie darauf, dass der Sekundenkleber unter den Hals gezogen wird, um ihn stabil zu stützen.
- Decken Sie den Schädel mit Zahnzement ab, um eine chronische Kappe aufzubauen. Achten Sie besonders darauf, nur die Kanten des Deckglases abzudecken.
- Heben Sie die Rückseite der Sonde an und tragen Sie Zement unter den Sondenhals auf. Legen Sie die Sonde auf den Zement, bevor sie aushärtet. Drücken Sie den Hals der Sonde vorsichtig mit einer stumpfen Pinzette nach unten, so dass sich ihre Oberfläche während des Experiments auf gleicher Höhe wie die des Deckglases befindet und nicht im Weg des Mikroskopobjektivs liegt.
- Decken Sie die Oberseite des Sondenhalses mit nicht mehr als 1,5 mm Zahnzementschicht ab, um einen festen Halt auf der Sonde zu erreichen. Bauen Sie einen Zementbrunnen mit einem 1,5 mm dicken Grat in einem Abstand von 1-2 mm um das Deckglas, um ein Becken für die Immersionsflüssigkeit für die Zwei-Photonen-Bildgebung zu schaffen (Abbildung 4C).
- Tragen Sie nach dem Aushärten des Zements postoperative Buprenorphin-Analgetika (0,05 mg/kg, 0,1 ml pro 10 g Körpergewicht subkutan) auf und halten Sie das Tier bis zum Aufwachen in einer warmen Atmosphäre. Dazu gehört die Nähe zu einer Infrarot-Glühbirne sowie das Einwickeln des Tieres in ein Papiertuch.
HINWEIS: Platzieren Sie ein Thermometer auf Höhe der Maus, um die Temperatur zu überwachen. - Charakterisieren Sie die Impedanz im Bereich von 1-10 kHz mit einem Potentiostaten.
- Lassen Sie das Tier mindestens 10 Tage lang von der Operation erholen. Verabreichen Sie sofort nach der Operation entzündungshemmende Medikamente und überwachen Sie weiterhin den Zustand des Tieres, um eine angemessene postoperative Analgesie bereitzustellen.
- Geben Sie einen Tropfen Dulbeccos phosphatgepufferte Kochsalzlösung (DPBS) so auf, dass sie die Kraniotomie bedeckt. Setzen Sie die flexible Elektrode auf den Tropfen des DPBS und legen Sie die Rückseite der Sonde mit den Kontaktpads vorsichtig auf die Rückseite der Maus (Abbildung 4B).
4. Abgabe und Bildgebung von gepulsten elektrischen Feldern (PEF)
- Legen Sie die Proben unter ein Fluoreszenzmikroskop. Bei 3D-Modellen können Tumore nur von oben beobachtet werden.
HINWEIS: Für das In-ovo-Modell wurden die Experimente unter einem Epifluoreszenzmikroskop durchgeführt (ist aber auch mit einem Zwei-Photonen-Mikroskop möglich), während die Experimente am In-vivo-Modell unter einem Zwei-Photonen-Mikroskop durchgeführt wurden (Abbildung 6). - Schließen Sie einen Impulsgenerator an die Kontaktpads der Geräte an, indem Sie Pogo-Pin-Anschlüsse (in vitro) oder Krokodilklemmen (in Ovo und in vivo) verwenden (Abbildung 4A). Stellen Sie die gewünschten Parameter ein (Anzahl der Impulse, Spannung, Impulsdauer, Frequenz) und wenden Sie PEFs an, indem Sie den Generator laufen lassen (Abbildung 4A). Messen Sie gleichzeitig die Fluoreszenz, um die Auswirkungen der PEFs in Echtzeit zu beobachten.
Ergebnisse
Dieses Protokoll ermöglicht die Anwendung auf zwei Glioblastommodelle, in die ein flexibles PEF-Verabreichungssystem integriert ist. Nach Mikrofabrikations- und Verpackungsschritten werden flexible Elektroden in Kochsalzlösung durch elektrochemische Impedanzspektroskopie (EIS) charakterisiert, um ihre Leistung zu bewerten und zu validieren. Die PEDOT:PSS-beschichteten Elektroden zeigen die typischen kapazitiven und resistiv dominierten Bereiche, die durch eine Grenzfrequenz getrennt sind, während die unbeschichteten Elektroden nur kapazitives Verhalten zeigen (Abbildung 2).
Eine Variation der Liquid-Overlay-96-Well-Plattenmethode wird verwendet, um 3D-Tumore aus transfizierten Glioblastomzellen zu züchten, die einen fluoreszierenden intrazellulären Calciumreporter stabil exprimieren. Das Wachstum der Sphäroide kann mit einem Hellfeldmikroskop beobachtet werden (Abbildung 3; ED 0). Mindestens 2 oder 3 Tage sind erforderlich, um sphärische und dichte Sphäroide zu erhalten, abhängig von der Zelllinie und der Anzahl der ausgesäten Zellen.
Im In-ovo-Modell werden Sphäroide in die Chorioallantoismembran eines Wachtelembryos gepfropft (Abbildung 3; ED 6). Der Erfolg des Transplantats kann einige Tage später durch Fluoreszenzmikroskopie beurteilt werden, da lebende Zellen intrazelluläres Kalzium aufweisen und somit fluoreszieren (Abbildung 3; ED 9). Die Vaskularisierung des Tumors kann unter einem Fluoreszenzmikroskop beobachtet werden, indem ein Fluoreszenzfarbstoff in die Blutgefäße injiziert wird (Abbildung 3; ED9). Es ist jedoch nicht immer möglich, die Blutgefäße im Tumor sichtbar zu machen, da das Sphäroid sehr dicht ist. Die flexiblen interdigitalisierten Elektroden werden auf dem vaskularisierten Tumor platziert (Abbildung 3; ED 9) und an einen Impulsgeber angeschlossen. Die Sonde muss vorsichtig platziert werden, um Blutungen des Embryos zu vermeiden. Andernfalls kann sich der Fluoreszenzfarbstoff ausbreiten, was jede Beobachtung durch Bildgebung behindert. Die korrekte Abgabe des Impulses an die biologische Umgebung kann durch Messung des Stroms, der durch den Stromkreis fließt, überprüft werden. Die Bildgebung dieser In-ovo-Modelle ermöglicht eine Echtzeitüberwachung der Wirkung von PEFs auf das intrazelluläre Calcium in einem 3D-Glioblastom-Tumor sowie der Vasokonstriktion, die auf das Gefäßsystem des Tumors induziert wird, wodurch jeglicher Einfluss anderer Zelltypen, einschließlich des Immunsystems, vermiedenwird 15.
Die Untersuchung der PEF-Wirkung auf das Glioblastom kann auch in einem vollständigeren und prädiktiveren Modell durchgeführt werden. Tatsächlich besteht das oben beschriebene In-vivo-Modell 14 aus der Transplantation eines 3D-Glioblastom-Tumors in das Hirnparenchym einer Maus (Abbildung 4). Die Injektionsstelle des Tumors wird durch eine vernetzte Dextran-Gel-Hemi-Perle verstopft, um die physiologischen biophysikalischen Einschränkungen während des Tumorwachstums zu rekapitulieren. Obwohl in Referenz14 beschrieben, sollte noch einmal betont werden, dass es von entscheidender Bedeutung ist, dass die Dextran-Halbperle präzise auf die Dura mater geklebt wird. Andernfalls kann der Tumor durch die offene Dura entweichen und das Gehirn vollständig bedecken, was die Bildgebung unmöglich macht. Für jede chronische Bildgebung stellt das Einwachsen von Gewebe, das bei der Heilung des Schädelfensters stattfindet, ein ernsthaftes Hindernis dar, da das neue Gewebe nicht transparent ist und Bilder neblig oder unbrauchbar macht. Daher müssen nach dem Einsetzen und Verkleben der Halbkugel die Seitenwände des geöffneten Schädelfensters mit einer dünnen Schicht Sekundenkleber versiegelt werden, die sorgfältig um die Hohlraumwand herum platziert wird, ohne dass der Sekundenkleber verrutscht oder auf die Dura fließt. Wenn die flexible Sonde auf der Tumorinjektionsstelle platziert wird, können aus zwei Gründen keine Blasen unter der Sonde verbleiben. Erstens kann die Bildgebung nicht fortgesetzt werden, wenn Blasen vorhanden sind. Zweitens dienen Blasen als Isolatoren und verändern so die elektrischen Stimulationseigenschaften. Nach den oben beschriebenen Vorsichtsmaßnahmen wird die Kraniotomie mit einem Glasfenster versiegelt, das am Schädel zementiert ist, um eine chronische Bildgebung über Wochen zu ermöglichen. Da der Tumor aus GCaMP- oder DsRed-exprimierenden Zellen besteht, kann die Injektion mit einem Fluoreszenzmikroskop bestätigt werden. Die elektrochemische Impedanz der Elektroden muss gemessen werden, um die Leistung nach der Implantation zu validieren. Im Vergleich zur Impedanz in Kochsalzlösung wird in vivo eine Erhöhung der Impedanz bei Frequenzen über 100 Hz aufgrund des Vorhandenseins einer biologischen Umgebung erwartet (Abbildung 5). Vaskularisiertes neurales Parenchym und Tumorinfiltration können durch das transparente Substrat über Wochen mittels Zwei-Photonen-Mikroskopie beobachtet und charakterisiert werden (Abbildung 6). Die Verwendung von transgenen Tieren, die fluoreszierende Proteine in interessierenden Zellen (Immunzellen und Neuronen) exprimieren, kann beispielsweise den Nachweis des minimalen Entzündungsprozesses ermöglichen, der allein durch Elektrodenimplantation induziert wird (Abbildung 6A) oder das Vorhandensein von Mikroglia und Monozyten 26 Tage nach der Implantation einer PEF-stimulierten Elektrode, die auf einen wachsenden GBM-Tumor implantiert wurde, zeigen (Abbildung 6B1 ). Im letzteren Fall wurden sowohl periphere Monozyten-abgeleitete Zellen als auch hirnresidente Mikrogliazellen um und innerhalb des Tumors gefunden (Abbildung 6B2). Am Tag der PEF-Lieferung können Kontaktpads der flexiblen Elektroden direkt unter dem Zwei-Photonen-Mikroskop an den Impulsgenerator angeschlossen werden. Insgesamt kann dieses Modell verwendet werden, um die Wirkung bioelektrischer Behandlungen über die Zeit mit verschiedenen Arten von Zellen, die an der Entwicklung von Hirntumoren beteiligt sind, bis zu einer Tiefe von etwa 500 μm zu untersuchen.
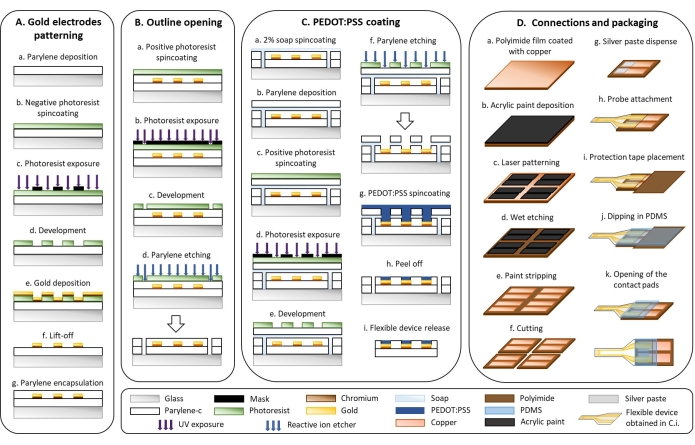
Abbildung 1: Mikrofabrikation flexibler Elektroden . (A) Goldelektrodenstrukturierung und Parylene-C-Substrat. (B) Umriss der Öffnung. (C) PEDOT:PSS-Beschichtung. (D) Anschlüsse und Verpackung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
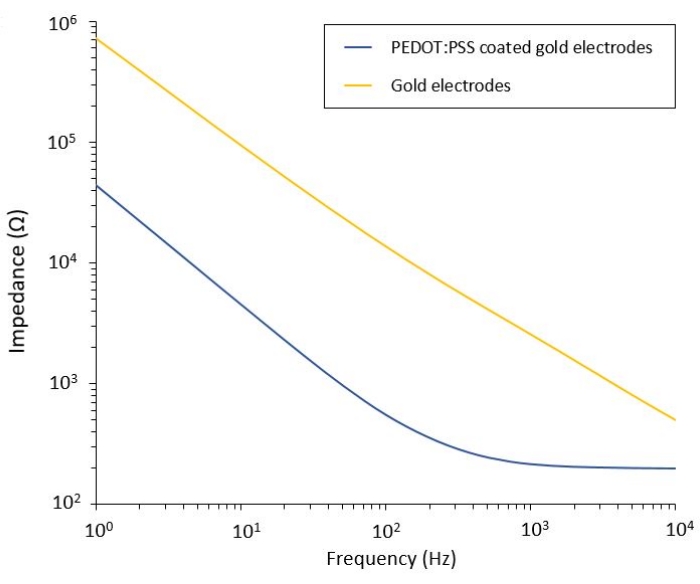
Abbildung 2: Elektrochemische Impedanzspektroskopie von flexiblen Goldelektroden und PEDOT:PSS-beschichteten Kaltelektroden in einer Salzlösung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
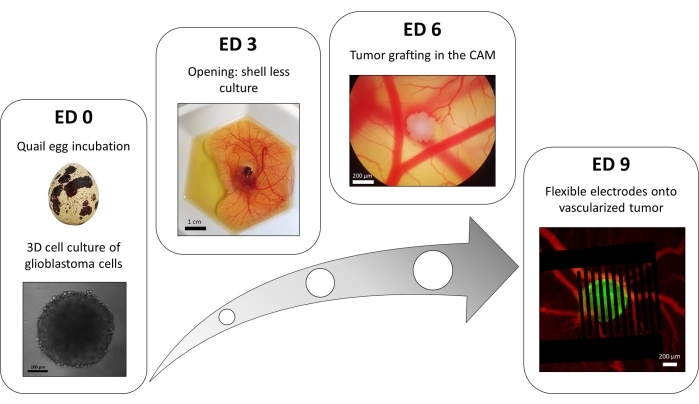
Abbildung 3: Das In-ovo-Modell des Glioblastoms. ED 0: Sphäroid, beobachtet mit einem Hellfeldmikroskop. ED 3: Schalenlose Kultur eines Wachtelembryos 3 Tage nach dem Öffnen. ED 6: In die CAM implantierter Tumor, beobachtet mit einem Hellfeldmikroskop. ED 9: Flexibles Gerät, das auf dem vaskularisierten Tumor platziert wird (Tumor in grün und Blutgefäße in rot). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
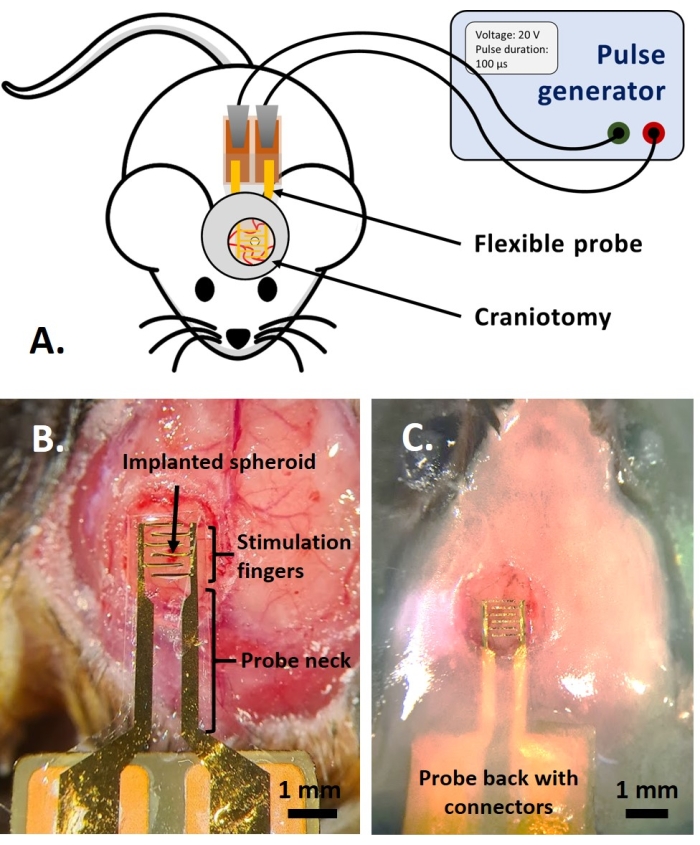
Abbildung 4: Die In-vivo-Anwendung. (A) Schema für In-vivo-Experimente. (B) Platzierung der Sonde vor dem Auftragen von Deckglas und Acrylharz. (C) Abgeschlossene Sondenimplantation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
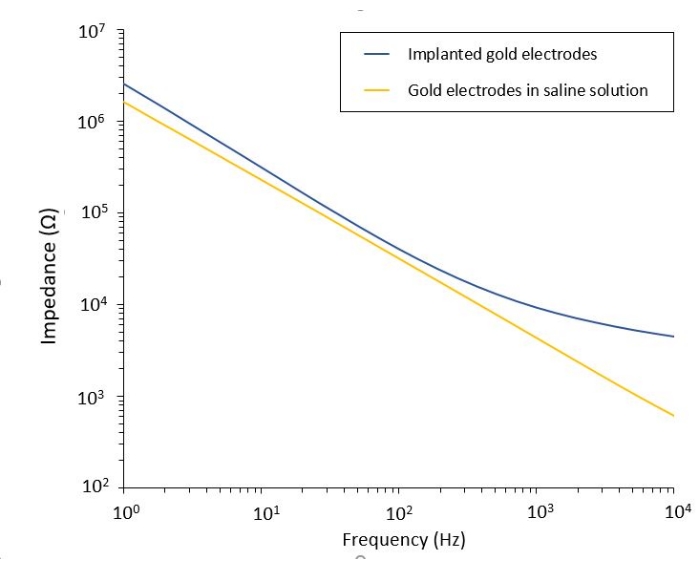
Abbildung 5: Elektrochemische Impedanzspektroskopie von flexiblen Goldelektroden in einer Salzlösung im Vergleich zu einer implantierten Sonde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
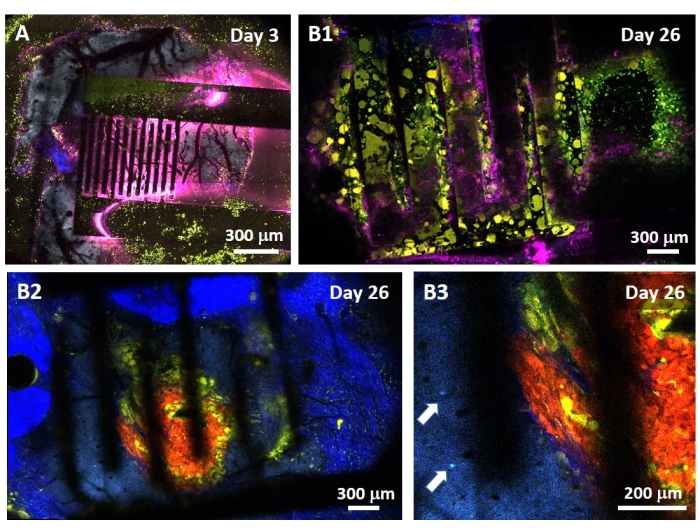
Abbildung 6: Intravitale multispektrale Zwei-Photonen-Bildgebung durch Elektroden . (A) Kachelbild der gesunden Gehirnoberfläche in einer Kontroll-Multifluoreszenz-AMU-Neuroinflam-Maus 3 Tage nach der Elektrodenimplantation. Cyan zeigt die dendritische Arborisierung von Schicht-5-Pyramidenneuronen, Grün zeigt rekrutierte Granulozyten und Monozyten und Gelb zeigt aktivierte Mikroglia und dendritische Zellen. Pink zeigt Infrarotdiffusion aufgrund von Wärmestau. (B1) Ähnliches Bild wie in A , aber 26 Tage nach der Tumor-Sphäroid-Implantation 200 μm tief im Kortex unmittelbar gefolgt von der Elektrodenimplantation. Beachten Sie die Anhäufung von grünen und gelben Immunzellen. (B2) Ähnliches Bild wie in B1 , jedoch 100 μm unter der Oberfläche der Elektroden. Beachten Sie das Vorhandensein einer blauen neuronalen dendritischen Arborisierung in der Peripherie der roten Tumormasse selbst, die von gelben Mikroglia und dendritischen Zellen infiltriert wird. Tiefblau zeigt ein zweites harmonisches Signal aus dem peritumoralen Kollagen. (B3) Vergrößerte Ansicht von B2 , die das Vorhandensein von Interneuron-Somas (durch Pfeile gekennzeichnet) in der Nähe des Tumors zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Der in dieser Arbeit beschriebene Ansatz ermöglicht es Hirntumormodellen mit einem integrierten PEF-Verabreichungssystem, die Wirkung von PEFs auf verschiedenen Ebenen der biologischen Organisation zu untersuchen. Das Mikrofabrikationsprotokoll besteht aus Standard-Dünnschichtprozessen, die einen großen Freiheitsgrad beim Elektrodendesign bieten, der an die spezifische Anwendung angepasst werden kann. Manchmal kann ein zusätzlicher thermischer Glühschritt am Ende der Herstellung nützlich sein, um die Biegung der Elektroden zu reduzieren, die während der Herstellung aufgetreten ist.
Die Verwendung einer stabilen Glioblastom-Zelllinie, die einen fluoreszierenden Calciumindikator exprimiert, vermeidet alle Komplikationen, die mit der Abgabe und Retention von Farbstoffen verbunden sind, insbesondere bei 3D-Tumoren, die sehr dicht sind16. In der Tat wird über einen langen Zeitraum ein hohes Expressionsniveau im Vergleich zu chemischen Fluoreszenz-Calcium-Standardindikatoren beobachtet17. Dieses Protokoll kann auf verschiedene Zelllinien angewendet werden, da es üblicherweise für die Bildgebung neuronaler Aktivitätverwendet wird 11. Hier wurden humane und murine Zelllinien verwendet (U87 und Gl261 zur Implantation in immundefiziente bzw. immunkompetente Mäuse). In der Tat zeigten neuere Studien, dass sich die U87-Zelllinie von der der ursprünglichen Zellen unterscheidet, da viele Mutationen über Jahre der Zellkultur erworben wurden, was die experimentelle Reproduzierbarkeit beeinträchtigt18. Das Verfahren zur Präparation von 3D-Tumoren ist hochdurchsatzfähig, reproduzierbar und ermöglicht die Erzeugung von Sphäroiden einer bestimmten Größe in Abhängigkeit von der Zelllinie, der Anzahl der Zellen bei der Aussaat und dem Zeitpunkt des Wachstums19. Diese Sphäroide sind jedoch dicht, was bei der Bildgebung im Kern des Tumors einen Nachteil darstellt.
Das In-ovo-Modell eignet sich als erster Ansatz, um die Wirkung von PEF auf 3D-Tumore und deren Gefäße zu untersuchen, ohne Wechselwirkungen mit anderen Zelltypen, die im Gehirn vorhanden sind. Dieses Modell ist kostengünstig, schnell, durchsatzreich und wirft weniger ethische Fragen auf als Tiermodelle. Es ist wichtig, die Integrität des Embryos während des gesamten Experiments zu erhalten, da dies sein Überleben und die Qualität der Bildgebung beeinträchtigen könnte. Beim Öffnen des Wachteleis ist besondere Vorsicht geboten, um Schäden an der embryonalen Membran zu vermeiden. Das Transplantat und die Platzierung der flexiblen Elektroden müssen ebenfalls sorgfältig durchgeführt werden, um Blutungen zu vermeiden, die den Embryo töten könnten. Die Injektion von Fluoreszenzfarbstoff in die Blutgefäße ermöglicht die gleichzeitige Visualisierung der Tumorzellen und die Vaskularisierung mit Fluoreszenzmikroskopie. Die intraokulare Injektion muss sorgfältig durchgeführt werden, um zu vermeiden, dass Farbstoff in die embryonale Flüssigkeit austritt, was zu einer Restfluoreszenz im Hintergrund führen könnte, die die Qualität der Bildgebung beeinträchtigt. Dieses Modell kann auch zur Nachverfolgung der Medikamentenaufnahme verwendet werden, da es den Zugang zum Kreislaufsystem ermöglicht. Die Experimente sind jedoch durch die 12-tägige Überlebenszeit des Embryos begrenzt, so dass eine Beobachtungszeit von 7 Tagen möglich ist, was deutlich kürzer ist als das In-vivo-Modell 21.
Das In-vivo-Hirntumormodell kann 4 bis 5 Wochen lang überwacht werden, bevor die Tiere einen ethischen experimentellen Endpunkt erreichen, der durch einen plötzlichen Gewichtsverlust von 20% bestimmt wird. Es ist gut verträglich und bleibt an Ort und Stelle, wenn der Verbindungsende der Elektrode nicht zu lang ist. Andernfalls neigen Tiere dazu, den Flipping-Stecker zu zerkratzen, der letztendlich gerissen werden kann, wodurch eine spätere Verbindung mit dem Stimulator verhindert wird. Dieser Zeitraum von 4 Wochen ist dennoch wertvoll, um die verschiedenen Stadien der Glioblastomentwicklung abzudecken. Beim Vergleich der Tumorzelldichten im gleichen interessierenden Volumen in unterschiedlichen Zeitintervallen kann die Entwicklung der Tumorwachstumskinetik beobachtet werden. Insbesondere wurde zum Zeitpunkt des Immunschalters ein verstärktes Tumorwachstum beobachtet22. Eine ähnliche Studie in Gegenwart einer stimulierenden Elektrode würde Aufschluss über die Wirkung von PEF auf die Tumorproliferationsrate und die Empfindlichkeit des Tumors gegenüber der Immunelimination geben. Im Vergleich zum In-ovo-Modell kann das In-vivo-Modell als wertvolles präklinisches Modell angesehen werden, um den Einfluss von Immunzellen auf die Tumorprogression und ihren Beitrag zur therapeutischen Wirkung von PEF zu untersuchen. Dieses Protokoll wird aus einem früheren Artikel mit der Hinzufügung einer flexiblen Elektrodenvorrichtung auf dem Tumor angepasst, bevor ein Schädelfenster14 platziert wird. Sowohl die akute als auch die chronische bioelektrische Behandlung von Tumoren können durch direkte und nachfolgende Beobachtungen mit Zwei-Photonen-Mikroskopie charakterisiert werden, da erwartet wird, dass die anfängliche Stimulation den Zelltod induziert und eine dauerhafte Fehlregulation der Immunantwort auslöst.
Die Anschlüsse der flexiblen Sonde sind unter dem Zwei-Photonen-Mikroskop leicht zugänglich. Die Parameter der elektrischen Stimulation können so in Echtzeit auf der Grundlage der beobachteten Wirkung auf das Nervengewebe und/oder die Zielzellen angepasst werden, ähnlich wie ein Arzt interventionelle Eingriffe bei der Beobachtung von MRT- oder CT-Bildern seines Patienten durchführen würde. Eine letzte Überlegung ist, wie wichtig es ist, die Elektrode am Gehirn sorgfältig mit Sekundenkleber und Silikonkleber abzudichten, um das Nachwachsen des Gewebes zu verhindern.
Zusammenfassend stellt das hier beschriebene Protokoll ein innovatives Modell dar, um die Wirkung der PEF-Therapie mit flexiblen organischen Polymerelektroden für Glioblastom-Tumormodelle zu untersuchen. Die beiden Modelle weisen unterschiedliche Komplexitätsgrade auf, so dass zelluläre, vaskuläre oder immunologische Effekte getrennt werden können, um die Wirkmechanismen besser zu verstehen. Konforme, oberflächliche Elektroden reduzieren die iatrogene Schädigung und ermöglichen gleichzeitig eine Störung der Tumormikroumgebung, wodurch eine Vasokonstriktion oder Dysregulation von intrazellulärem Calcium15 ausgelöst wird.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Die hier berichtete Arbeit wurde von der französischen Nationalen Forschungsagentur (ANR-18-CE19-0029) unterstützt. Die Autoren danken S.M. Bardet herzlich für ihren Beitrag zur Generierung einer stabilen GCaMP6f-Zelllinie und D. O'Connor für ihre Hilfe beim In-ovo-Modell .
Materialien
| Name | Company | Catalog Number | Comments |
| (3-Glycidyloxypropyl)trimethoxysilane | Sigma | 440167 | GOPS |
| 0.25% Trypsin-EDTA (1X) | Gibco | 25200-056 | |
| 4-Dodecylbenzenesulfonic acid | Sigma | 44198 | DBSA |
| 96-well plate | Falcon | 353075 | |
| Acetone | Technic | 530 | |
| Acrylic resin | Fischer scientific | NC1455685 | |
| agarose | Sigma | A9539 | |
| autoclave | Tuttnauer | 3150 EL | |
| AZ 10XT | Microchemicals | Positive photoresist | |
| AZ 826 MIF Developer | Merck | 10056124960 | Metal-ion-free developer for the negative photoresist |
| AZ Developer | Merck | 10054224960 | Metal-ion-free developer for the positive photoresist |
| AZ nLof 2070 | Microchemicals | Negative photoresist | |
| Buprenorphine | Axience | ||
| Carprofen | Rimadyl | ||
| Centrifuge Sorvall Legend X1R | Thermo Scientific | 75004260 | |
| CMOS camera Prime 95B | Photometrics | ||
| CO2 incubator HERAcell 150i | Thermo scientific | ||
| DAC board | National Instruments | USB 6259 | |
| Déco spray Pébéo | Cultura | 3167860937307 | Black acrylic paint |
| Dextran Texas Red 70.000 | Thermofisher | D1830 | |
| Die bonding paste "Epinal" | Hitachi | EN-4900GC | Silver paste |
| Dimethyl sulfoxide | Sigma | D2438 | |
| Dispensing machine | Tianhao | TH-2004C | |
| Dulbecco’s Modified Eagle’s Medium + GlutaMAX™-I | Gibco | 10567-014 | |
| Dulbecco's Modified Eagle's Medium | Sigma | D6429 | |
| Egg incubator COUVAD'OR 160 | lafermedemanon.com | ||
| Ethylene glycol | Carl Roth | 6881.1 | |
| Fertilized eggs of Japanese quail | Japocaille | ||
| Fetal Bovine Serum | VWR | S181BH | |
| Flask | Greiner | 658170 | |
| Fluorescence macroscope | Leica MZFLIII | ||
| Gl261 | DSMZ | ACC 802 | |
| Gold pellets - Dia 3 mm x 6 mm th | Neyco | ||
| Handheld automated cell counter | Millipore | PHCC00000 | |
| Heating and drying oven | Memmert | UF110 | |
| Hexadimethrine Bromide Sequa-brene | Sigma | S2667 | |
| hot plate Delta 6 HP 350 | Süss Microtec | ||
| Illumination system pE-4000 | CoolLed | ||
| Infrared tunable femtosecond laser (Maï-Taï) | Spectra Physics (USA) | ||
| Ionomycin calcium salt | Sigma | I3909 | |
| Kapton tape SCOTCH 92 33x19 | 3M | Polyimide protection tape | |
| Lab made pulse generator | |||
| Labcoter 2 Parylene Deposition system PDS 2010 | SCS | ||
| Lenti-X 293 T cell line | Takara Bio | 63218 | HEK 293T-derived cell line optimized for lentivirus production |
| Lenti-X GoStix Plus | Takara Bio | 631280 | Quantitative lentiviral titer test |
| Mask aligner MJB4 | Süss Microtec | ||
| Micro-90 Concentrated cleaning solution | International Products | M9050-12 | |
| Microscope slides 76 x 52 x 1 mm | Marienfeld | 1100420 | |
| Needles 30G | BD Microlance 3 | 304000 | |
| PalmSens4 potentiostat | PalmSens | ||
| parylene-c : dichloro-p-cyclophane | SCS | 300073 | |
| PCB Processing Tanks | Mega Electronics | PA104 | |
| PEDOT:PSS Clevios PH 1000 | Heraeus | ||
| penicillin / streptomycin | Gibco | 15140-122 | |
| Petri dish | Falcon | 351029 | |
| pGP-CMV-GCaMP6f | Addgene | 40755 | plasmid |
| Phosphate Buffer Saline solution | Thermofisher | D8537 | |
| Plasma treatment system PE-100 | Plasma Etch | ||
| PlasmaLab 80 Reactive Ion Etcher | Oxford Instruments | ||
| Plastic mask | Selba | ||
| Plastic weigh boat 64 x 51 x 19 mm | VWR | 10770-454 | |
| Poly-dimethylsiloxane: SYLGARD 184 Silicone Elastomer Kit | Dow chemicals | 1673921 | |
| Polyimide copper film 60 µm (Kapton) | Goodfellow | IM301522 | |
| Propan-2-ol | Technic | 574 | |
| Protolaser S | LPKF | ||
| puromycin | Gibco | A11103 | |
| Round cover glass 5 mm diameter | Fischer scientific | 50-949-439 | |
| Scepter Sensors - 60 µm | Millipore | PHCC60050 | |
| Silicone adhesive Kwik-Sil | World Precision Instruments | ||
| spin coater | Süss Microtec | ||
| Spin Coater | Laurell | WS-650 | |
| Super glue | Office depot | ||
| tetracycline-free fœtal bovine Serum | Takara Bio | 631105 | |
| Thermal evaporator Auto 500 | Boc Edwards | ||
| Two-photon microscope | Zeiss LSM 7MP | ||
| U87-MG | ATCC | HTB-14 | Human glioblastoma cells |
| Ultrasonic cleaner | VWR | ||
| Vortex VTX-3000L | LMS | VTX100323410 | |
| Xfect single shots reagent | Takara Bio | 631447 | Transfection reagent |
Referenzen
- Koshy, M., et al. Improved survival time trends for glioblastoma using the SEER 17 population-based registries. Journal of Neuro-Oncology. 107 (1), 207-212 (2012).
- Davis, M. E. Glioblastoma: Overview of disease and treatment. Clinical Journal of Oncology Nursing. 20, 2-8 (2016).
- Edd, J. F., Horowitz, L., Davalos, R. V., Mir, L. M., Rubinsky, B. In vivo results of a new focal tissue ablation technique: irreversible electroporation. IEEE transactions on Bio-Medical Engineering. 53 (7), 1409-1415 (2006).
- Breton, M., Mir, L. M. Microsecond and nanosecond electric pulses in cancer treatments. Bioelectromagnetics. 33 (2), 106-123 (2012).
- Frandsen, S. K., et al. Direct therapeutic applications of calcium electroporation to effectively induce tumor necrosis. Cancer Research. 72 (6), 1336-1341 (2012).
- Lee, J. H., Kim, H., Kim, J. H., Lee, S. -. H. Soft implantable microelectrodes for future medicine: prosthetics, neural signal recording and neuromodulation. Lab on a Chip. 16 (6), 959-976 (2016).
- Lee, H., Bellamkonda, R. V., Sun, W., Levenston, M. E. Biomechanical analysis of silicon microelectrode-induced strain in the brain. Journal of Neural Engineering. 2 (4), 81-89 (2005).
- Fattahi, P., Yang, G., Kim, G., Abidian, M. R. A review of organic and inorganic biomaterials for neural interfaces. Advanced Materials. 26 (12), 1846-1885 (2014).
- Lecomte, A., Degache, A., Descamps, E., Dahan, L., Bergaud, C. In vitro and in vivo biostability assessment of chronically-implanted Parylene C neural sensors. Sensors and Actuators B: Chemical. 251, 1001-1008 (2017).
- Dijk, G., Ruigrok, H. J., O'Connor, R. P. PEDOT:PSS-coated stimulation electrodes attenuate irreversible electrochemical events and reduce cell electropermeabilization. Advanced Materials Interfaces. 8 (19), 2100214 (2021).
- Chen, T. -. W., et al. Ultra-sensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Ribatti, D. Chapter 5 Chick embryo chorioallantoic membrane as a useful tool to study angiogenesis. International Review of Cell and Molecular Biology. 270, 181-224 (2008).
- Valdes, T. I., Kreutzer, D., Moussy, F. The chick chorioallantoic membrane as a novel in vivo model for the testing of biomaterials. Journal of Biomedical Materials Research. 62 (2), 273-282 (2002).
- Ricard, C., Stanchi, F., Rougon, G., Debarbieux, F. An orthotopic glioblastoma mouse model maintaining brain parenchymal physical constraints and suitable for intravital two-photon microscopy. Journal of Visualized Experiments: JoVE. (86), e51108 (2014).
- Lefevre, M. C. Integrating flexible electronics for pulsed electric field delivery in a vascularized 3D glioblastoma model. npj Flexible Electronics. 5, 19 (2021).
- Perry, J. L., Ramachandran, N. K., Utama, B., Hyser, J. M. Use of genetically-encoded calcium indicators for live cell calcium imaging and localization in virus-infected cells. Methods. 90, 28-38 (2015).
- Blömer, U., et al. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector. Journal of Virology. 71 (9), 6641-6649 (1997).
- Lenting, K., Verhaak, R., ter Laan, M., Wesseling, P., Leenders, W. Glioma: experimental models and reality. Acta Neuropathologica. 133 (2), 263-282 (2017).
- Hickman, J. A., et al. Three-dimensional models of cancer for pharmacology and cancer cell biology: Capturing tumor complexity in vitro/ex vivo. Biotechnology Journal. 9 (9), 1115-1128 (2014).
- Tay, S. L. M., Heng, P. W. S., Chan, L. W. The CAM-LDPI method: a novel platform for the assessment of drug absorption. Journal of Pharmacy and Pharmacology. 64 (4), 517-529 (2012).
- Kundeková, B., Máčajová, M., Meta, M., Čavarga, I., Bilčík, B. Chorioallantoic Membrane Models of Various Avian Species: Differences and Applications. Biology. 10 (4), 301 (2021).
- Ricard, C., et al. Phenotypic dynamics of microglial and monocyte-derived cells in glioblastoma-bearing mice. Scientific Reports. 6 (1), 26381 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten