Method Article
Zugspannungsmessstreifen zur Quantifizierung von Wachstumsfaktor-vermittelter Integrinmechanik und Adhäsion
In diesem Artikel
Zusammenfassung
TGT surface ist eine innovative Plattform zur Untersuchung von Wachstumsfaktor-Integrin-Crosstalk. Das flexible Sondendesign, die Spezifität des Adhäsionsliganden und die präzise Modulation der Stimulationsbedingungen ermöglichen robuste quantitative Bewertungen des EGFR-Integrin-Zusammenspiels. Die Ergebnisse unterstreichen EGFR als "Mechano-Organizer", der die Integrin-Mechanik abstimmt und die fokale Adhäsionsmontage und Zellausbreitung beeinflusst.
Zusammenfassung
Mehrzellige Organismen sind auf Wechselwirkungen zwischen Membranrezeptoren und verwandten Liganden in der umgebenden extrazellulären Matrix (ECM) angewiesen, um mehrere Funktionen zu orchestrieren, einschließlich Adhäsion, Proliferation, Migration und Differenzierung. Mechanische Kräfte können von der Zelle über den Adhäsionsrezeptor Integrin auf Liganden im ECM übertragen werden. Die Menge und räumliche Organisation dieser zellgenerierten Kräfte kann durch Wachstumsfaktorrezeptoren, einschließlich des epidermalen Wachstumsfaktorrezeptors (EGFR), moduliert werden. Die derzeit verfügbaren Werkzeuge, um Crosstalk-vermittelte Veränderungen in der Zellmechanik zu quantifizieren und sie mit fokalen Adhäsionen, zellulärer Morphologie und Signalgebung in Beziehung zu setzen, sind begrenzt. DNA-basierte molekulare Kraftsensoren, sogenannte Tension Gauge Tethers (TGTs), wurden eingesetzt, um diese Veränderungen zu quantifizieren. TGT-Sonden sind einzigartig in ihrer Fähigkeit, sowohl die zugrunde liegende Kraftschwelle zu modulieren als auch Piconewton-Skala-Rezeptorkräfte über die gesamte adhärente Zelloberfläche mit beugungsbegrenzter räumlicher Auflösung zu melden. Die hier verwendeten TGT-Sonden beruhen auf der irreversiblen Dissoziation eines DNA-Duplex durch Rezeptor-Liganden-Kräfte, die ein fluoreszierendes Signal erzeugen. Dies ermöglicht die Quantifizierung der kumulativen Integrinspannung (Kraftverlauf) der Zelle. Dieser Artikel beschreibt ein Protokoll, das TGTs verwendet, um den Einfluss von EGFR auf die Integrinmechanik und die Adhäsionsbildung zu untersuchen. Die Montage der mechanischen Sensorplattform TGT wird systematisch detailliert beschrieben und das Verfahren zur Abbildung von Kräften, fokalen Adhäsionen und Zellausbreitung skizziert. Insgesamt machen die Fähigkeit, die zugrunde liegende Kraftschwelle der Sonde, den Adhäsionsliganden und die Art und Konzentration des zur Stimulation verwendeten Wachstumsfaktors zu modulieren, dies zu einer robusten Plattform für die Untersuchung des Zusammenspiels verschiedener Membranrezeptoren bei der Regulierung integrinvermittelter Kräfte.
Einleitung
Zellen haben die intrinsische Fähigkeit, mechanische Kräfte wahrzunehmen, zu erzeugen und darauf zu reagieren, was zu Veränderungen des zellulären Phänotyps und zur Umgestaltung der lokalen Mikroumgebung führt 1,2. Kräfte spielen eine entscheidende Rolle bei der Regulierung vieler Aspekte des Zellverhaltens, einschließlich Adhäsion, Migration, Proliferation, Differenzierung und Wundheilung 3,4. Aberrationen im bidirektionalen mechanischen Austausch zwischen einer Zelle und der Mikroumgebung können zu erkrankten Zuständen führen, einschließlich Krebs5. Zahlreiche Membranrezeptoren sind an der Aufrechterhaltung der Zellmatrix-Homöostase beteiligt; Von diesen haben Integrine und der epidermale Wachstumsfaktorrezeptor (EGFR) eine robuste Synergie 6,7. Klassischerweise stellen Integrine die mechanische Verbindung zwischen der Mikroumgebung und dem intrazellulären Zytoskelett her, während EGFR das Wachstum, die Proliferation und das Überleben von Zellen reguliert 8,9. EGFR ist ein hoch untersuchtes therapeutisches Ziel, das sich auf die Outside-In-Regulation konzentriert und die intrazelluläre Signalgebung erleichtert. EGFR-Integrin-Crosstalk wurde genetisch und biochemisch etabliert, um das Fortschreiten mehrerer Krankheiten, einschließlich Krebs10,11, zu regulieren. Während Studien auf die Existenz eines EGFR-Integrin-Zusammenspiels hinweisen, werden die Ergebnisse auf Signalwege weg von der Plasmamembran 7,12,13,14 zurückgeführt. Der Einfluss von EGFR oder anderen Wachstumsfaktoren auf die Zellmechanik bleibt weitgehend unerforscht, was zum Teil auf den Mangel an Werkzeugen zur Messung zellulärer Kräfte und Signalergebnisse zurückzuführen ist. Die Herausforderung besteht darin, geeignete Werkzeuge zu identifizieren, um die Kommunikation zwischen diesen parallelen Signalisierungsparadigmen zu untersuchen und ihre spezifischen Beiträge zur Zellmechanik zu quantifizieren.
Es wurden mehrere Ansätze entwickelt, um Kräfte zu messen, die von Zelladhäsionsrezeptoren erzeugt werden, und der Leser wird zu eingehenden Überprüfungen dieser Technikengeleitet 15,16. Kurz gesagt, die Zugkraftmikroskopie und die Mikrosäulen-Array-Detektion beruhen auf der Verformung eines darunter liegenden Substrats, um Nanonewton (nN) -Kräfte abzuleiten, eine Größenordnung mehr als einzelne Rezeptorkräfte17,18. Einzelmolekültechniken, einschließlich AFM und optischer Pinzette, sind empfindlich gegenüber einzelnen Protein-Piconewton-Kräften (pN), messen jedoch jeweils nur einen Rezeptor und bieten keine gute (oder keine) räumliche Auflösung. DNA-basierte molekulare Spannungssonden und TGT-Sonden (Tension Gauge Tether) bieten eine pN-Kraftauflösung mit beugungsbegrenzter (oder besserer) räumlicher Auflösung, was ihnen eine einzigartige Rolle bei der Untersuchung von Einzelzellkräften19,20 aus verschiedenen Zelltypen verleiht, einschließlich Fibroblasten, Krebszellen, Blutplättchen und Immunzellen21,22,23,24 . Während molekulare Spannungssonden ein ausziehbares "Feder" -Element haben, das sich ideal für die Echtzeit-Bildgebung eignet, reißen TGT-Sonden irreversibel und hinterlassen eine fluoreszierende "Kraftgeschichte". TGTs modulieren zusätzlich die Spannungsschwelle des darunter liegenden Substrats; Eine Reihe von Sonden mit ähnlicher chemischer Zusammensetzung, aber unterschiedlichen Bruchkräften oder Spannungstoleranzen (Ttol) kann verwendet werden, um die minimale Spannung zu quantifizieren, die für die fokale Adhäsionsbildung und Zellausbreitung erforderlich ist. TGT-Sonden bestehen aus zwei komplementären DNA-Strängen, von denen einer an der Oberfläche verankert ist und der andere der Zelle einen Liganden präsentiert. Wenn ein Rezeptor den Liganden bindet und eine Kraft ausübt, die größer ist als derT-Tol der Sonde, werden die Stränge getrennt. T tol ist definiert als die konstante Kraft, die benötigt wird, um 50% der Sonden in einemIntervall von 2 s unter idealen Bedingungen zu brechen. Bei "einschaltenden" TGT-Sonden kann ein Quencher auf dem oberen Strang von einem Fluorophor auf dem unteren Strang getrennt werden. Nur wenn die TGT-Sonde gebrochen ist, vermutlich durch Kräfte größer oder gleich Ttol, wird ein fluoreszierendes Signal erzeugt. TGT-Sonden können auch repariert werden, was eine einfache Manipulation biologischer Systeme und das Testen mehrerer Bedingungen ermöglicht. Aus diesen Gründen wurden bei dieser Arbeit TGT-Sonden verwendet.
TGT-Sonden wurden eingesetzt, um zu untersuchen, wie integrinabhängige Zelladhäsion und mechanische Kräfte durch aktiviertes EGFR21 moduliert werden. Diese Arbeit etablierte EGFR als "Mechano-Organisator", der die fokale Adhäsionsorganisation und die Spannungserzeugung abstimmt. Darüber hinaus wurde festgestellt, dass die EGF-Stimulation die Verteilung und Reife fokaler Adhäsionen und eine verbesserte Zellausbreitung beeinflusst. Dieser Ansatz könnte in zukünftigen Studien verwendet werden, um zu untersuchen, wie Wachstumsfaktoren mechanische Kräfte in der Tumorprogression und -dynamik beeinflussen. Während die Rolle des EGFR-Integrin-Übersprechens bei der Regulierung des epithelialen Übergangs zum mesenchymalen Übergang etabliert ist, bleibt die Rolle mechanischer Kräfte in diesem Prozess wenig erforscht10.
Hier wird ein detailliertes Protokoll für diese Experimente vorgestellt, das die Synthese und den Zusammenbau von 56 pN TGT-Sonden, die Erzeugung von TGT-Oberflächen auf Glasabdeckungen, die Anwendung von Cos-7-Zellen auf der TGT-Oberfläche und die Stimulation mit EGF, die Fixierung und Färbung von Zellen mit Phalloidin und einem Anti-Paxillin-Antikörper, die hochauflösende Total-Interreflexionsfluoreszenz (TIRF) und die Reflexionsinterferenzkontrastmikroskopie (RICM) -Bildgebung abdeckt. und Bildquantifizierung. Dieses Protokoll, obwohl es geschrieben wurde, um die EGF-Stimulation von Cos-7-Zellen zu untersuchen, ist für viele TGT-basierte Experimente leicht anpassbar. Verschiedene Liganden,T-Tol, Zelltypen, Stimulationsparameter, Proteine, die nach der Fixierung markiert sind, und quantitative Analysen können leicht ersetzt werden, was dieses Protokoll robust und allgemein nützlich macht.
Protokoll
1. TGT Oligonukleotid-Präparation
HINWEIS: Die Details der Oligonukleotid-Sondensynthese werden hier beschrieben. Bitte beachten Sie, dass einige Modifikationen und Reinigungsschritte für die kundenspezifische Synthese ausgelagert werden können.
- Aktivieren Sie das primäre Amin des Cyclo[Arg-Gly-Asp-D-Phe-Lys(PEG-PEG)]-Peptids mit dem Azid-NHS-Linker, wie von Zhang et al22 beschrieben, indem Sie in einem Verhältnis von 1:1,5 (100:150 nmoles) in einem Endvolumen von 10 μL Dimethylformamid mischen. 0,1 μL der organischen Base Triethylamin zugeben und 12 h bei 4°C inkubieren.
- Reinigen Sie das Produkt durch Umkehrphasen-HPLC mit 0,1 m TEA (Lösungsmittel A) und 100% Acetonitril (Lösungsmittel B) mit einer Durchflussrate von 1 ml / min und der Anfangsbedingung von 10% Lösungsmittel B bei einem Gradienten von 0,5% / min. Kombinieren Sie die eluierten Peaks (Absorption bei 203 nm) und verifizieren Sie sie mittels MALDI-TOF-Massenspektrometrie. Das Produkt ist cRGDfK-azid.
- Um den TGT-Top-Strang zu erzeugen, kombinieren Sie cRGDfK-Azid und Alkin-21-BHQ2-Oligonukleotid (TGT-Top-Strang: 5Hexynyl/GTGAAATACCGCACAGATGCG/3BHQ_2) in einem Verhältnis von 2:1 (͂200 μM: 100 μM) in 100 μL 1x Phosphat Buffered Saline (PBS) mit 5 mM Natriumascorbat und 0,1 μM vorgeformtem Cu-THPTA. Lassen Sie die Reaktion mindestens 4 h bei Raumtemperatur (RT) oder über Nacht bei 4 °C ablaufen.
- Verarbeiten Sie die Mischung durch das P2-Entsalzungsgel, um überschüssigen Farbstoff, Nebenprodukte, organisches Lösungsmittel und nicht umgesetzte Reagenzien zu entfernen. Bereiten Sie die Zentrifugensäule mit 650 μL vorhydratisiertem P2-Gel vor, indem Sie sie 1 min lang mit 18.000 x g nach unten drehen. Entsorgen Sie die Durchflussflüssigkeit und fügen Sie die Reaktionsmischung hinzu. Drehen Sie erneut mit 18.000 x g für 1 min und sammeln Sie den Durchfluss. Bringen Sie das Reaktionsgemisch mit Reinstwasser auf ein Endvolumen von 300 μL.
HINWEIS: Hydratisieren Sie das P2-Gel 6 h lang mit Wasser vor. - Reinigen Sie das entsalzte Reaktionsgemisch durch Umkehrphasen-HPLC. Die für diese Reinigung verwendeten organischen Lösungsmittel umfassen 0,1 M TEAA inH2O(Lösungsmittel A) und 100% MeCN (Lösungsmittel B oder die mobile Phase).
- Vor dem Einspritzen der Mischung die Säule mit einer Anfangsbedingung von 10% Lösungsmittel B mit einem Gradienten von 1%/min ausgleichen. Stellen Sie die Durchflussrate auf 1 ml/min ein. Injizieren Sie das Reaktionsgemisch mit einer 500-μL-Injektionsnadel in die HPLC-Schleife.
- Sammeln Sie das Produkt, indem Sie die maximale Absorption bei 260 nm für die DNA und 560 nm für den BHQ2-Quencher visualisieren. Trocknen Sie das elastische Produkt über Nacht in einem Vakuumzentrifugalkonzentrator.
- Verwenden Sie nukleophile Substitution, um TGT-Bodenstrang mit Cy3B-NHS-Ester zu koppeln, wie in Ma et beschrieben. AL25. Mischen Sie 100 μM des 56 pN TGT-Bodenstrangs (5Biosg/TTTTTT/iUniAmM/CGCATCTGTGCGGTATTTCACTTT) mit 50 μg Cy3B-NHS-Ester, vorgelöst in 10 μL DMSO. Stellen Sie den pH-Wert dieser Mischung mit 0,1 M Natriumbicarbonat auf 9 ein und bringen Sie das Endvolumen mit 1x PBS auf 100 μL. Inkubieren Sie das Reaktionsgemisch über Nacht bei RT.
- Die Mischung wird nacheinander mit P2-Gelfiltration und Umkehrphasen-HPLC gereinigt, um nicht umgesetzte Reagenzien, Salze und organische Lösungsmittel zu trennen (beschrieben in den Schritten 1.4 und 1.5).
- Schätzen Sie die Konzentration der gereinigten Oligonukleotid-Farbstoff-Konjugate ab, indem Sie ihre Absorption bei 260 nm mit einem Spektralphotometer aufzeichnen.
- Charakterisieren Sie die gereinigten Produkte durch MALDI-TOF-Massenspektrometrie. Überschüssige 3-Hydroxypicolinsäure wird in TA50-Lösungsmittel (50:50 v/v Acetonitril und 0,1% TFA in ddH2O) gelöst,um die frische MALDI-Matrix herzustellen. Geschätzte und gemessene Molekulargewichte für die markierten Produkte sind: cRGDfK-1-BHQ2 - 8157.9 (berechnet), 8160.1 (gefunden); Cy3B markiert 56 pN TGT - 10272.7 (berechnet), 10295.8 (gefunden).
- Lösen Sie die oberen und unteren Stränge getrennt in nukleasefreiem Wasser in einer Konzentration zwischen 30-50 μM auf. Verwenden Sie DNase-freie Pipettenspitzen, um eine Kontamination des Lagers zu vermeiden. Bei 4 °C für kurzfristige Anwendungen oder -20 °C für Langzeitanwendungen lagern. Die Stabilität von Oligonukleotiden wird durch wiederholte Frost-Tau-Zyklen nicht beeinträchtigt.
2. Oberflächenvorbereitung
Tag 1:
- Legen Sie 25 mm Glasabdeckungen (bis zu 8) in ein Polytetrafluorethylen-Rack. Legen Sie das Gestell in ein 50 ml Borosilikatbecherglas, das 40 ml 200 Proof-Ethanol enthält. Decken Sie das Becherglas mit Paraffinfolie ab, um das Eindringen von Wasser zu vermeiden, und beschallen Sie es mit einer Betriebsfrequenz von 35 kHz für 10-15 min bei RT (Abbildung 1A).
- Füllen Sie ein 50 ml Becherglas mit 40 ml Piranha-Lösung, frisch zubereitet, indem Sie Schwefelsäure und Wasserstoffperoxid im Verhältnis 3:1 in einem Pyrexbecher mischen. Mit einer Glaspipette umrühren. Übertragen Sie das Deckglasgestell in das Becherglas und inkubieren Sie es 30 Minuten lang bei RT im Abzug, um die Deckglasoberfläche zu ätzen (Abbildung 1B).
HINWEIS: Tragen Sie volle PSA, einschließlich eines Laborkittels, Handschuhe und einer Schutzbrille, und arbeiten Sie in der chemischen Rauchhaut. Fügen Sie der Säure langsam Wasserstoffperoxid hinzu, um eine Überhitzung der Lösung zu verhindern. - Verwenden Sie nach dem Ätzen eine Pinzette, um das Deckglasgestell auf ein Becherglas mit Reinstwasser zu übertragen. Wiederholen Sie diesen Schritt sechsmal in Abständen von 15 s, um die Säure vollständig zu neutralisieren (Abbildung 1C).
HINWEIS: Lassen Sie die Piranha-Lösung über Nacht im chemischen Abzug, bevor Sie sie in den Säureabfallbehälter werfen. - Überprüfen Sie die Deckgläser visuell, um sicherzustellen, dass die Oberflächen sauber und ohne Muster oder Staubpartikel auf der Glasoberfläche aussehen. Wiederholen Sie die Schritte 2.1-2.4, wenn Muster oder Staub erkannt werden.
HINWEIS: Testen Sie die Hydrophilie der Oberfläche, indem Sie behandelte Deckgläser in Wasser tauchen und vertikal entfernen. Wasser auf behandelten Deckgläsern zieht sich als einheitliches Blatt zurück, um Youngs Ringe zu bilden, verglichen mit unbehandelten Deckgläsern, die Flecken bilden. - Das Deckglasgestell in ein Becherglas mit 200 Proof-Ethanol geben und zweimal für 15 s waschen, um die Oberflächen mit organischem Lösungsmittel auszugleichen. Überführen Sie das Deckglasgestell in 200 Proof-Ethanol-Lösung mit 3% APTES für 1 h bei RT, um die Deckgläser zu silanisieren (Abbildung 1D). Bedecken Sie das Becherglas mit Paraffinfolie.
HINWEIS: Die Abscheideparameter von APTES variieren je nach Oberflächenreinigungsmethode, Lösungsmittelwassergehalt, APTES-Konzentration, Inkubationszeiten und Temperatur für das Glühen. - Tauchen Sie das Gestell in ein sauberes Becherglas mit 200 Proof-Ethanol-Lösungen. Wiederholen Sie diese Wäsche dreimal für jeweils 15 s (Abbildung 1E).
- Trocknen Sie die Deckgläser mit Stickstoffgas (N2) mit niedrigem Austrittsdruck. Legen Sie die Deckgläser in eine 10 cm große Styroporschale mit einem Stück Paraffinfolie, das flach darin liegt. Stellen Sie sicher, dass die Deckgläser trocken und getrennt sind (Abbildung 1F).
- Fügen Sie 100 μL 2 mg/ml NHS-Biotinlösung in DMSO zu vier Deckgläsern hinzu, die auf Paraffinfolie gelegt wurden. Legen Sie ein "Sandwich" mit den anderen vier Deckgläsern darauf (zwei zueinander gerichtete Deckgläser mit der Funktionalisierungslösung dazwischen) und inkubieren Sie die Schale über Nacht bei 4 ° C (Abbildung 1G).
HINWEIS: Bei 4 °C ist das NHS-Reagenz stabiler, was eine gleichmäßige Oberflächenfunktionalisierung ermöglicht. Zusätzlich konserviert das Sandwich Reagenzien. Vermeiden Sie die Zugabe von überschüssiger Lösung in das Sandwich, da diese auslaufen und dazu führen kann, dass Deckgläser verrutschen.
Tag 2:
- Entfernen Sie die Schale von 4 ° C und trennen Sie die Sandwich-Deckgläser. Richten Sie die Schlupfscheine im Rack aus, wobei die beschichtete Oberfläche einander zugewandt ist, wie in Abbildung 2A dargestellt. Waschen Sie sie mit 200 Proof-Ethanol-Lösung dreimal für jeweils 15 s. MitN2-Gas trocknen und in eine neue Schale mit einer Paraffinfolie geben.
HINWEIS: Wenn Sie die Deckgläser wie angegeben ausrichten, können Sie die funktionalisierte Oberfläche identifizieren. - Waschen Sie die Deckgläser dreimal mit 1 ml 1x PBS, um sie wieder in die wässrige Phase zu bringen. 800 μL 0,1% Rinderserumalbumin (BSA) in 1x PBS (w/v) zu jedem der Deckgläser geben und bei RT für 30 min inkubieren, um die Oberfläche zu passivieren und die unspezifische Bindung nachfolgender Funktionalisierungsreagenzien zu blockieren (Abbildung 2B).
- Nach der Inkubation die Deckgläser dreimal mit 1 ml 1x PBS waschen. Fügen Sie 800 μL 1 μg/ml Streptavidin in 1x PBS bei RT für 45-60 min hinzu, um die Deckgläser zu funktionalisieren (Abbildung 2C).
HINWEIS: Behalten Sie einen Deckglas ohne Streptavidin bei, um die Passivierungseffizienz zu überprüfen (optional). Add10 nM biotinylierte Moleküle und Bild unter experimentellen Bedingungen. Diese Oberflächenintensität sollte dem dunklen Rauschen der Kamera nahe kommen. - Gleichzeitig mit Schritt 2.11 werden die TGT-Sonden (oben: unterer Strang im Molverhältnis 1:1) in einer Endkonzentration von 50 nM in 100 μL von 1 M NaCl in einem PCR-Röhrchen mit einem Thermocycler montiert. Disoziieren Sie Stränge bei 95 °C für 5 min und glühen Sie allmählich, indem Sie die Temperatur auf 25 °C reduzieren und 25 min lang aufrechterhalten (Abbildung 2D). Vermeiden Sie eine längere Exposition von TGT-Sonden gegenüber Licht.
- Verwenden Sie nach der Streptavidin-Inkubation 1x PBS, um die Deckgläser dreimal zu waschen. Fügen Sie 100 μL der vormontierten TGT-Sonden zu vier der Deckgläser hinzu und machen Sie Sandwiches mit den restlichen 4 Deckgläsern, wobei die funktionalisierte Seite den Sonden zugewandt ist (acht Oberflächen erfordern vier Röhrchen hybridisierter TGT-Sonden). Mit Aluminiumfolie abdecken und bei RT 1 h inkubieren, um eine Sondenbindung an die Oberfläche zu ermöglichen (Abbildung 2E).
- Nach der Inkubation die Sandwiches trennen und die Deckgläser dreimal mit 1x PBS waschen. Die TGT-Oberflächen sind nun bereit für die Bildgebung. Montieren Sie die Deckgläser vorsichtig in vorgereinigte Bildgebungskammern und fügen Sie 1x PBS hinzu, um die Oberflächen hydratisiert zu halten (Abbildung 2F).
HINWEIS: Wenn Sie die Kammern überziehen, wird die Oberfläche geknackt. Verhindern Sie das Austrocknen der Oberflächen.
3. Zellvorbereitung und Färbung
- Um die Wirkung der Stimulation des epidermalen Wachstumsfaktors (EGF) auf die Cos-7-Mechanik, Adhäsion und Zellausbreitung zu untersuchen, trypsinisieren Sie Cos-7-Zellen mit 0,05% Trypsin-EDTA für 2 min. Neutralisieren Sie das Trypsin durch Waschen mit HBSS und Zentrifugieren bei 800 x g für 5 min. Wiederholen Sie den Neutralisationsschritt noch einmal.
- Plattenzellen mit einer Dichte von 4 x 104 Zellen auf den montierten TGT-Oberflächen in Dulbeccos Modified Eagle Medium (DMEM) ergänzt mit 50 ng/ml EGF oder DMEM ohne EGF. Lassen Sie die Zellen 60 min bei 37 °C mit 5% CO2 in einem Zellkultur-Inkubator ausbreiten (Abbildung 3A).
HINWEIS: Zellen werden in DMEM ohne Serum inkubiert, um eine Stimulation durch Wachstumsfaktoren zu vermeiden. EGF wird in 10 mM Essigsäure verdünnt, um einen Vorrat von 1 mg/ml zu erhalten. Es wird bei 50 ng / ml in DMEM für bildgebende Experimente verwendet. - Nach der Inkubation die Zellen dreimal mit 1x PBS waschen und mit 2 ml 4% Paraformaldehyd für 12 min bei RT fixieren (Abbildung 3B).
HINWEIS: Alle Inkubationsschritte werden auf einem Rotationsschüttler bei ~35 U/min zur gleichmäßigen Verteilung der Lösungen durchgeführt. Schützen Sie die TGT-Oberflächen vor Licht, indem Sie sie abdecken, bis sie für die Bildgebung bereit sind. - Saugen Sie das Fixiermittel ab und waschen Sie die Deckgläser fünfmal mit 1x PBS in 5-Minuten-Intervallen bei RT. Optional können Sie die Deckgläser mit 50 mM NH4Cl in 1x PBS für 30 min bei 37 °C inkubieren, um die paraformaldehydassoziierte Autofluoreszenz abzuschrecken, und dreimal mit 1x PBS in 5-Minuten-Intervallen waschen (Abbildung 3B).
- Fügen Sie Puffer A (1x PBS, 5% normales Pferdeserum, 5% normales Ziegenserum, 1% BSA, 0,025% Triton X-100) hinzu und inkubieren Sie für 30 min bei 37 ° C, um die Zellen zu blockieren und zu durchpermeabilisieren. Dreimal waschen mit 1x PBS im Abstand von 5 min (Abbildung 3B).
- Legen Sie die Bildgebungskammern mit Deckgläsern in einen Feuchtigkeitsbehälter. Verdünnen Sie den primären Anti-Paxillin-Antikörper (fokaler Adhäsionsmarker) bei 1:250 im Blockpuffer (1x PBS, 5% normales Pferdeserum, 5% normales Ziegenserum, 1% BSA, 0,005% Triton x-100). Inkubation mit 200 μL primärer Antikörperlösung pro Deckglas für 2 h bei 37 °C (Abbildung 3B).
HINWEIS: Lassen Sie die Oberflächen nicht austrocknen. - Waschen Sie die Deckgläser fünfmal mit 1x PBS im Abstand von 5 Minuten und bringen Sie sie in den Feuchtigkeitsbehälter zurück. Markierungszellen gleichzeitig mit einer Mischung aus farbstoffkonjugiertem Ziegen-Anti-Kaninchen-Sekundärantikörper bei 1:800-Verdünnung und farbstoffkonjugiertem Phalloidin (Aktin) bei 1:400-Verdünnung in 200 μL Blockpuffer pro Deckglas. 60 min bei 37 °C inkubieren (Abbildung 3B).
- Waschen Sie die Oberflächen fünfmal mit 1x PBS im Abstand von 5 Minuten und lagern Sie sie bei 4 °C, bis sie für die Bildgebung bereit sind (Abbildung 3B).
HINWEIS: Bildproben innerhalb von 3 Tagen nach der Oberflächenvorbereitung, um eine Signalverschlechterung zu vermeiden.
4. Bildaufnahme
- Verwenden Sie ein 60-faches Ölimmersionsobjektiv mit hoher numerischer Blende (1,49) auf einem invertierten Mikroskop mit 488-, 561- und 647-TIRF-Anregung, RICM-Anregung, einem perfekten Fokussystem und einer Digitalkamera.
- Fügen Sie Öl zum Objektiv hinzu, reinigen Sie den Deckglasboden der Probenkammer und legen Sie die Probe auf den Tisch. Konzentriere dich auf eine Zelle und interagiere den perfekten Fokus.
- Setzen Sie das Mikroskop in den RICM-Bildgebungsmodus mit Epifluoreszenzanregung und einem GFP-Filterwürfel mit entferntem Emissionsfilter. Richten Sie den RICM aus, indem Sie die Blende der Epiilluminationsblende schließen und zentrieren.
- Versetzen Sie das Mikroskop in den TIRF-Modus mit Laseranregung und einem Quad-Pass-TIRF-Filterwürfel. Fokussieren Sie den 488-nm-Laser auf einen kleinen Punkt an der Decke des Raumes und erhöhen Sie den Einfallswinkel bis über den kritischen Winkel hinaus, während Sie die Fluoreszenz an der Kamera im Live-Modus überwachen. Beobachten Sie eine starke Verringerung der Hintergrundfluoreszenz und eine einzelne In-Fokus-Ebene, wenn der kritische Winkel überschritten wird.
HINWEIS: TIRF regt eine dünne Region (~ 100 nm) an, die der Proben-Abdeckglas-Schnittstelle am nächsten ist, wodurch offene TGT-Sonden und fokale Adhäsionen hervorgehoben werden, während unscharfe Fluoreszenz aus dem Inneren der Zelle eliminiert wird. Wenn TIRF nicht verfügbar ist, kann Epifluoreszenz verwendet werden; Das Signal-Rausch-Verhältnis wird jedoch niedriger sein. - Identifizieren Sie Zellen für die Bildgebung mit dem "Live"-Modus der Kamera mit RICM.
- Erfassen Sie das RICM-Bild und die TIRF-Bilder von Aktin (640 nm ex), Integrinspannung (561 nm ex) und Paxillin (488 nm ex). Erhalten Sie Bilder nacheinander mit einer Belichtungszeit von 200 ms.
HINWEIS: Die Belichtungszeit hängt von vielen Faktoren ab, einschließlich des Objektivs, der Laserleistung, der Emissionsfilter und der Kameraempfindlichkeit. Das Signal sollte mindestens 2x größer sein als der Hintergrund. Der Hintergrund liegt bei etwa 1000 AE, so dass das Signal mindestens 2000-3000 AU betragen sollte. - Wiederholen Sie 4,4-4,5 für mindestens 30 Zellen. Ändern Sie Deckgläser, fokussieren Sie und wiederholen Sie 4.4-4.5.
5. Datenanalyse
HINWEIS: Führen Sie eine quantitative Bildanalyse mit der Fidschi-Software und die Analyse mit der Statistiksoftware durch.
- Öffnen Sie den Bildsatz für eine Zelle.
- Erstellen Sie eine Maske des Zellbereichs (RICM-Maske), indem Sie die Grenze der Zelle im RICM-Bild mit dem Auswahlwerkzeug ImageJ Freehand nachzeichnen. Speichern Sie die Region of Interest (ROI) im ROI-Manager (>Analysetools > ROI-Manager) (Abbildung 4A1,2).
- Wählen Sie einen repräsentativen Bereich außerhalb der Zelle im Integrinspannungsbild aus und erzielen Sie einen ROI von mindestens 200 x 200 Pixeln. Schließen Sie alle anderen Zellen oder fluoreszierenden Ablagerungen vom ROI aus. Messen Sie die Hintergrundfluoreszenz im ROI mit dem Messwerkzeug (Analyze > Measure) (Abbildung 4A3).
- Subtrahiert man die in Schritt 5.2 erhaltene mittlere Hintergrundfluoreszenz vom Spannungsbild (Prozess > Mathematik > Subtrahieren) (Abbildung 4A4).
- Verwenden Sie die in Schritt 5.2 festgelegte RICM-Maske, um das Spannungssignal innerhalb des Zell-Footprints zu definieren (ROI-Manager > Wählen Sie > Maske anwenden > Bearbeiten > Außerhalb löschen) (Abbildung 4A5).
- Erstellen Sie eine Schwellenwertmaske für das Spannungsbild mit der Huang-Methode zur automatischen Schwellenwertbestimmung (Bild > > Schwellenwert anpassen) (Abbildung 4A6). Stellen Sie sicher, dass die Schwellenwertmaske den Bereich für die erzeugte Integrinspannung am besten darstellt. Als Faustregel gilt, dass der Schwellenwert auf das 2-fache der mittleren Hintergrundfluoreszenz festgelegt wird.
- Erstellen Sie eine Auswahl der Schwellenspannungsmaske (Edit > Selection > Create) (Abbildung 4A7).
- Übertragen Sie die ausgewählte Maske auf das in Schritt 5.4 generierte Spannungsbild und messen Sie die integrierte Intensität der geöffneten Sonden (ROI Manager > Select (Tension Mask) > Analyze > Measure > RawIntDen) (Abbildung 4C).
- Messen Sie den Bereich der morphometrischen Eigenschaften der Zelle, die Zirkularität und das Seitenverhältnis über die RICM-Maske (ROI-Manager > Select (RICM-Maske) > Apply mask > Analyze > measure) (Abbildung 4B).
- Messen Sie die mechanische Bruchdichte, definiert als Prozentsatz des Zell-Footprints mit gerissenen Sonden, indem Sie das Spannungsmaskenbild auswählen und die RICM-Maske anwenden (ROI-Manager > Select (RICM-Maske) > Analyze > Measure > %Area) (Abbildung 4C).
- Exportieren Sie die Messungen zur weiteren Analyse und Visualisierung in eine Statistiksoftware.
- Wiederholen Sie 5.1-5.11 für jede Zelle.
Ergebnisse
Einschaltbare TGT-Sonden wurden verwendet, um die Wirkung des ligandenaktivierten epidermalen Wachstumsfaktorrezeptors (EGFR) auf die integrinvermittelte Zellmechanik und Adhäsionsbildung in Cos-7-Zellenzu untersuchen 21. Die Sonden präsentieren den liganden cyclischen Arg-Gly-Asp-Phe-Lys (cRGDfK)21,23,25,26, der selektiv für das Integrin-Heterodimer αVβ3 mit nur geringer Affinität für α5β1-Integrine27,28,29,30 ist. Die TGT-Sonde besteht aus einer Duplex-DNA, die über den unteren Strang mittels Biotin-Streptavidin-Bindung auf eine Glasdeckglasoberfläche funktionalisiert wird. Der obere Strang zeigt den Integrinliganden und steht zur Verfügung, um an den verwandten Integrinrezeptor auf der Zellmembran zu binden (Abbildung 5A). Der untere Strang ist mit einem Fluorophor und der obere Strang mit einem Quencher markiert, was zu einer minimalen Hintergrundfluoreszenz führt, wenn der Duplex-TGT intakt ist. Wenn ein Integrin den Liganden bindet und eine Kraft mit einer Größe anwendet, die größer ist als derT-Tol der Sonde, trennt sich der DNA-Duplex, was zu einer Fluoreszenz führt (Abbildung 5A). Jede TGT-Sonde, die nicht durch eine mechanische Kraft gerissen wurde, bleibt nicht fluoreszierend. Diese kraftselektive Einschaltfluoreszenz ermöglicht eine systematische und quantitative Abbildung der von Integrin erzeugten Kräfte auf pN-Skala bei beugungsbegrenzter Auflösung. TGT-Sonden modulieren zusätzlich die Spannungsschwelle des Substrats.
Hier ist ein repräsentatives Beispiel für eine TGT-Oberfläche mit einemT-Tol von 56 pN dargestellt. Cos-7-Zellen wurden auf dieser TGT-Oberfläche mit oder ohne EGF-Stimulation plattiert, um die Auswirkungen der EGFR-Aktivierung mit Ligandenstimulation auf die Zelladhäsion und die Integrinmechanik zu untersuchen (Abbildung 5A, B). Die Zellen wurden 60 Minuten lang mit oder ohne EGF auf den TGT-Oberflächen inkubiert, fixiert und immungefärbt, um die fokale Adhäsionsverteilung (Paxillin) und die Organisation des Zytoskeletts (F-Aktin) anzuzeigen (Abbildung 5B). Die Zellen wurden dann mit RICM- und TIRF-Mikroskopie abgebildet. Wie auf dem RICM-Bild deutlich zu sehen ist, wurde die Cos-7-Zellstreuung auf der 56 pN TGT-Oberfläche mit EGF-Stimulation im Vergleich zu ohne Stimulation signifikant verbessert. Dies wurde für 50 Zellen in jeder Bedingung quantifiziert, indem die Größe des Zell-Substrat-Kontaktbereichs aus dem RICM-Bild gemessen wurde (Abbildung 5C). Die Stimulation mit EGF führte zu einer zirkuläreren Morphologie, die repräsentativ für Cos-7-Zellen ist, die sich in ihrer natürlichen physiologischen Umgebung ausbreiten und wachsen (Abbildung 5D). Die Fluoreszenz von offenen Sonden ist auch bei der EGF-Stimulation höher, wie im Spannungsfluoreszenzbild beobachtet. Die integrierte Intensität der offenen Sonden, die proportional zur Anzahl der offenen Sonden ist, war bei der EGF-Stimulation viel höher als ohne (Abbildung 5B,E). Dies ist eine Darstellung aller Rezeptor-Liganden-Engagements, bei denen Integrine eine Kraft größer alsT-Tol (56 pN) ausüben.
Die Färbung mit Paxillin zeigte, dass die Verteilung, Anzahl, Reifung (Größe) und Organisation der fokalen Adhäsionen ebenfalls durch die EGF-Stimulation beeinflusst wurden. Fokale Adhäsionen in EGF-stimulierten Zellen erschienen reifer und radial orientierter als keine EGF-Kontrollen. Die F-Aktin-Zytoskelett-Organisation wurde ebenfalls mit EGF-Stimulation verstärkt, wie durch die Phalloidin-Färbung beurteilt (Abbildung 5B). Diese qualitativen Bewertungen erfolgten durch visuellen Vergleich von Bildern aus beiden Behandlungsgruppen. Eine quantitative Analyse der fokalen Adhäsion kann durchgeführt werden, sprengt jedoch den Rahmen dieses Protokolls. In diesem Experiment bot die TGT-Oberfläche eine Plattform, um die Wirkung der EGFR-Aktivierung auf die Zellausbreitung, die Integrinmechanik und die fokale Adhäsionsbildung systematisch zu beschreiben.
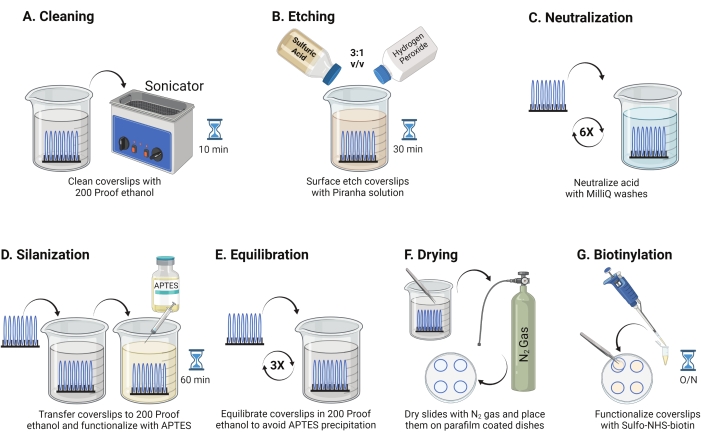
Abbildung 1: Schematische Darstellung für Tag 1 der TGT-Oberflächenvorbereitung. (A) Reinigen Sie die Deckgläser. (B) Ätzen Sie die Deckglasoberfläche. (C) Neutralisierung der Piranha-Lösung. (D) Silanisieren Sie die Oberfläche, um reaktive Amingruppen zu bilden. (E) Die Deckblätter mit der organischen Phase in Einklang bringen. (F) Trocknen Sie die Deckgläser mit einem Inertgas. (G) Biotinylieren Sie die Oberflächenamingruppen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
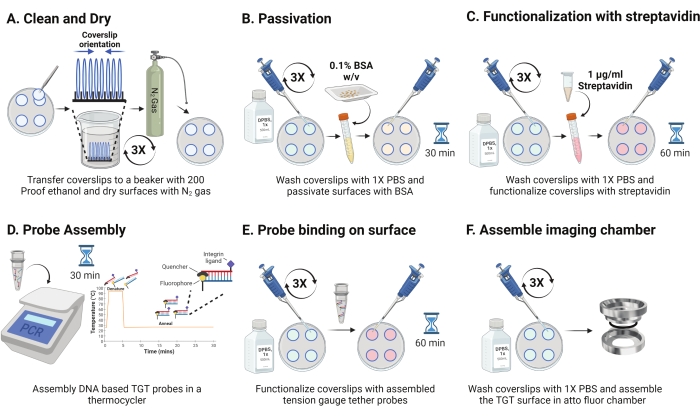
Abbildung 2: Schematische Darstellung für Tag 2 der TGT-Oberflächenvorbereitung. (A) Reinigen und trocknen Sie die Deckgläser, um das Restbiotin vom Vortag zu entfernen. (B) Passivieren mit BSA, um eine unspezifische Bindung des Reagenzes in nachfolgenden Schritten zu verhindern. (C) Funktionalisieren Sie die Deckgläser mit Streptavidin. (D) Hybridisieren Sie die Sonden in einem Thermocycler. (E) Tragen Sie die synthetisierten Sonden auf die Deckgläser auf (F) Montieren Sie das Deckglas in der Zellbildgebungskammer. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
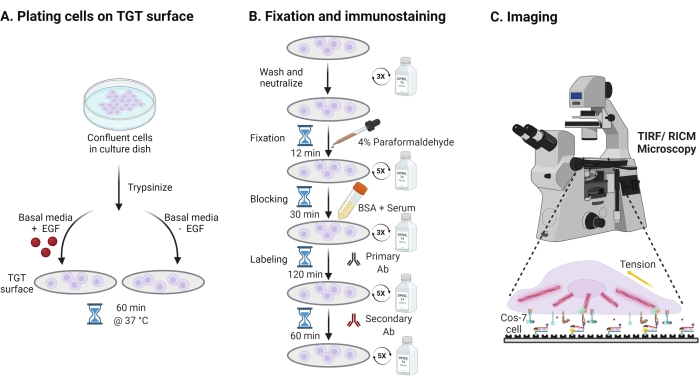
Abbildung 3: Allgemeiner Arbeitsablauf, der die breiten Schritte über den gesamten Versuchsaufbau hinweg hervorhebt . (A) Verfahren zur Zellablösung und -beschichtung auf der TGT-Oberfläche in basalen Medien (DMEM) mit oder ohne EGF-Stimulation. (B) Flussdiagramm der Schritte, die an der Fixierung und Immunfärbung nach der Befestigung und Ausbreitung auf der TGT-Oberfläche beteiligt sind. (C) Nach der Färbung werden die Zellen auf einem inversen Fluoreszenzmikroskop mit RICM- und TIRF-Mikroskopie abgebildet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
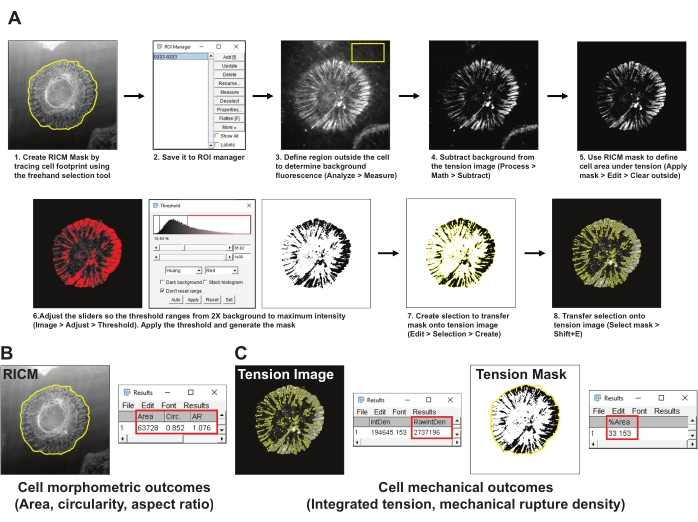
Abbildung 4: Beispiel für Datenverarbeitung und quantitative Analyse . (A) Schrittweise Aufschlüsselung der in Fidschi eingesetzten Analysepipeline (ImageJ) für die RICM- und Spannungsbildquantifizierung. (B) Ein repräsentatives Beispiel für zellmorphometrische Ergebnisse, die mit der obigen Pipeline analysiert wurden. (C) Repräsentative Beispiele für zellmechanische Ergebnisse, die mit der oben genannten Pipeline analysiert wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
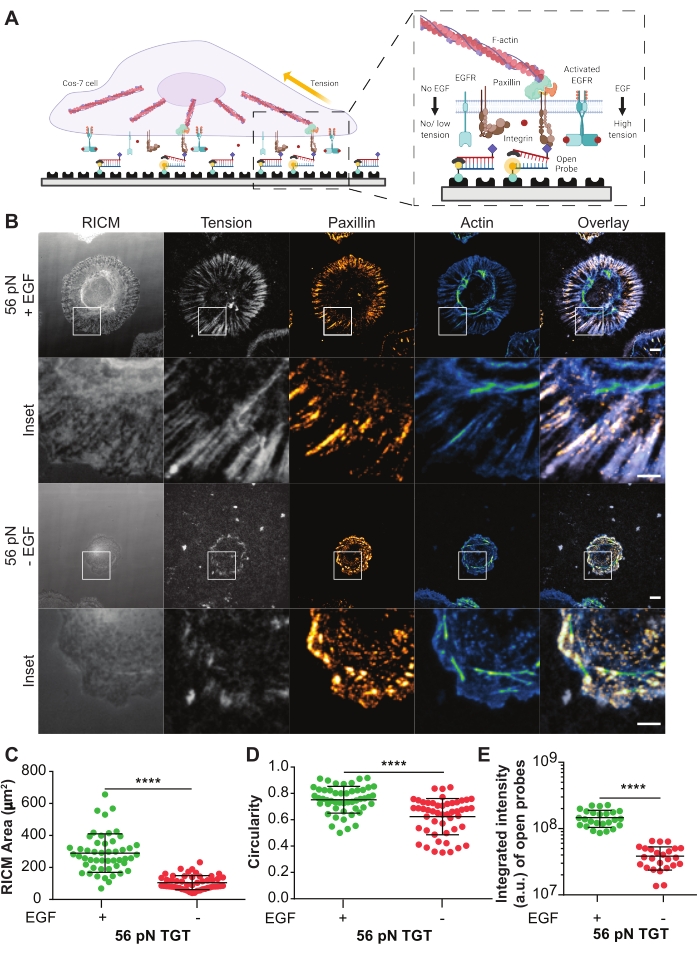
Abbildung 5: Beispieldaten aus einem TGT-Experiment. (A) Diagramm zur Hervorhebung der Kontaktzone an der Zellmembran-TGT-Oberflächenschnittstelle. Inset-Projekte integrieren die Interaktion mit seinem verwandten Liganden cRGDfK mit (rechts) oder ohne (links) EGF-Stimulation. (B) RICM- und TIRF-Bilder von Cos-7-Zellen, die sich auf der 56 pN TGT-Oberfläche ausbreiten. Die Bilder werden 60 Minuten nach der Beschichtung mit oder ohne EGF-Stimulation erhalten. Einzelne RICM (wie aufgenommen), Integrinspannung (Graustufen), Paxillin (orange heiß) und F-Aktin (blau-grün) Bilder werden mit Overlays für beide Stimulationsbedingungen gezeigt. Skalenbalken: 10 μm. Der Einschub hebt einen vergrößerten ROI (Region of Interest) hervor, der die Kolokalisation der erzeugten Integrinspannung an den durch Paxillin markierten Stellen der Adhäsionsbildung und die zugrunde liegende subzelluläre Zytoskelettorganisation, die durch Aktin markiert ist, detailliert beschreibt. Skalenbalken: 5 μm. (C-E) Streudiagramme für den Ausbreitungsbereich (RICM-Zell-Footprint) (C), die Zirkularität (D) und die integrierte Spannung (E) für Cos-7-Zellen mit oder ohne EGF-Stimulation. Balken geben den Mittelwert ± s.d. an. Die Unterschiede zwischen den Gruppen wurden statistisch mit dem t-Test des Schülers bewertet; P < 0,0001. n = 50 Zellen in drei unabhängigen Experimenten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
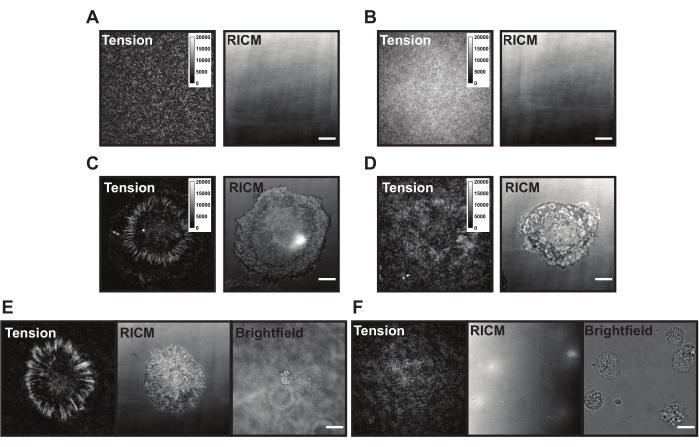
Abbildung 6: Beispiel TGT-Oberflächen mit unterschiedlichen möglichen Problemen. (A) Spannungs- und RICM-Bilder einer idealen TGT-Oberfläche mit montierter Sonde, die vor der Zelladhäsion abgeschreckt wird. (B) Spannungs- und RICM-Bilder einer TGT-Oberfläche, bei der der TGT-Sonde der obere Strang (Quencher) fehlt. Das Spannungsbild zeigt eine gleichmäßige Fluoreszenz aus offenem Fluorophor im unteren Strang. (C) Spannungs- und RICM-Bilder für Zellen, die sich auf einer idealen TGT-Oberfläche ausbreiten. (D) Spannungs- und RICM-Bilder für Zellen, die sich auf einer schlecht gemachten TGT-Oberfläche mit begrenzter Passivierung oder verschlechterter Sonde ausbreiten. (E) Spannungs-, RICM- und Hellfeldbilder für Zellen, die auf einer idealen Oberfläche mit cRGDfK-Liganden plattiert sind, die cRGDfK-Integrin-Wechselwirkungen anzeigen, sind für die Zellbindung und Spannungserzeugung von entscheidender Bedeutung. (F) Spannungs-, RICM- und Hellfeldbilder für Zellen, die auf einer Oberfläche ohne cRGDfK-Ligand auf dem TGT plattiert sind. Während die Zellen im Hellfeldbild sichtbar sind, wird keine Zellbindung oder erzeugte Integrinspannung beobachtet. Skalenbalken: 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Mit dem oben beschriebenen detaillierten Schritt-für-Schritt-Verfahren können TGT-Oberflächen hergestellt werden, um die Zellmorphologie und die Integrinspannung zu quantifizieren, die von adhärenten Zellen während der Zellanheftung und -ausbreitung nach der Behandlung mit EGF erzeugt werden. Das einfache Sondendesign und die Synthese und Oberflächenvorbereitung zusammen mit dem einfachen Versuchsaufbau boten eine stabile Plattform, um die Wechselwirkung von EGFR und Integrinen zu untersuchen. Insgesamt bestätigen die Ergebnisse, dass die ligandenabhängige Aktivierung von EGFR die Zellausbreitung verbessert, die krafttragenden Eigenschaften von Integrinrezeptoren abstimmt und die Organisation und Reifung der fokalen Adhäsion fördert. Die mit TGT-Sonden erzielten Ergebnisse unterstützen die übergeordnete Hypothese, dass Wachstumsfaktoren wie EGFR als "Mechano-Organisatoren" wirken, die Menge und räumliche Organisation der Integrinspannung erhöhen und die Orientierung und Mechanik fokaler Adhäsionen regulieren.
Beim Auftragen auf die TGT-Oberfläche landen, heften und verbreiten sich die Zellen, während die Integrinrezeptoren (αVβ3) den cRGDfK-Liganden spüren und binden. Dabei können die TGT-Sonden mechanisch gerissen werden, wodurch am Ort des Ligandeneingriffs Fluoreszenz erzeugt wird. Die Anzeige ist die kumulative "Kraftgeschichte" der Zelle, die mit der Oberfläche interagiert. Es gibt einige häufige Probleme mit den TGT-Oberflächen, die während dieser Experimente vorhanden sein können. Eine hohe Oberflächenfluoreszenz (Abbildung 6A,B), ein lückenhaftes Oberflächenaussehen, das Versagen der Zellen, ein Spannungssignal zu erzeugen (Abbildung 6C,D), und das Versagen von Zellen, sich auszubreiten (Abbildung 6E,F), können auf technische Mängel bei der TGT-Sonde oder der Oberflächensynthese zurückzuführen sein. Lösungen für diese gemeinsamen Probleme sind in Tabelle 1 dargestellt.
Das unkomplizierte Design von TGT-Sonden bietet Zellbiologen ein leistungsfähiges Werkzeug, um spezifische Wachstumsfaktor-Integrin-Signalergebnisse isoliert ohne Interferenz durch andere Zelloberflächenrezeptoren zu untersuchen, indem nur spezifische Liganden und Stimulationen bereitgestellt werden. Darüber hinaus ermöglichen TGT-Sonden die Untersuchung der Spannungsschwelle, die einzelne Integrinrezeptoren während der Zelladhäsion bei pN-Empfindlichkeit unterstreicht. Alternative Ansätze berichten nicht über Kräfte, die von einzelnen Rezeptoren mit hoher räumlicher Auflösung in festen Proben ausgeübt werden31. Die Zugkraftmikroskopie ist nur empfindlich gegenüber nN-Kräften, eine Größenordnung höher als die von einzelnen Integrinrezeptoren15 ausgeübten Kräfte, und molekulare Spannungssonden messen pN-Kräfte, aber da sie reversibel sind, widerstehen sie einer Fixierung nicht robust. Aus diesen Gründen sind TGT-Sonden ein attraktives Werkzeug, um die Mechanik von Wachstumsfaktor-Integrin-Wechselwirkungen zu untersuchen.
Es gibt mehrere technische Nuancen, die mit TGT-Sonden verbunden sind, die berücksichtigt werden sollten, bevor ein Experiment entworfen wird. Das Spannungsbild ist eine Momentaufnahme in der Zeit, die die Krafthistorie darstellt und kein Indikator für die Rezeptor-Ligand-Interaktionen zu einem bestimmten Zeitpunkt. Da die Signalerzeugung von der Sondentrennung abhängig ist, resultiert die TGT-Fluoreszenz aus offenen Sonden, die nicht unter aktiver Spannung durch Rezeptor-Ligand-Engagement stehen. Dies bedeutet, dass die auf der TGT-Oberfläche erhaltene Anzeige der Integrinspannung historischer und kumulativer Natur ist und darstellt, wo Kräfte vorhanden waren, die größer als Ttol waren; die Orte der aktuellen Rezeptor-Liganden-Kräfte kleiner als Ttol werden nicht berichtet19,32. Da eine TGT-Ruptur zu einer Beendigung des Rezeptor-Ligand-Engagements führt, ist die Zellausbreitung auf Integrin-Ligand-Wechselwirkungen zurückzuführen, die Kräfte erfahren, die niedriger sind alsT-Tol. Der Anwender muss daher bei der Definition der Zeit nach der Beschichtung vorsichtig sein, um die mechanischen Ergebnisse im Zusammenhang mit integrinbasierten Adhäsionen abzuschätzen. Schließlich muss die Bedeutung von Ttol berücksichtigt werden. Die hier verwendeten TGT-Sonden haben einenT-Tol von 56 pN, wobei Ttol die konstante Kraft ist, die benötigt wird, um 50% der Sonden zu brechen, wenn sie für 2 s angewendet werden. Bei der Betrachtung komplizierter biologischer Systeme erfahren TGTs wahrscheinlich eine heterogene und vielfältige Kraftabstufung mit unterschiedlichen Zeitabhängigkeiten. Wenn TGTs durch Kräfte gerissen werden, die größer als Ttol sind, wäre die Fluoreszenz eine Unterschätzung der Gesamtspannung. Alternativ können Kräfte unterhalb vonT-tol, die für längere Zeiträume angewendet werden, eine ähnliche Anzahl von Sonden reißen wie hohe Schwellenkräfte, die für kürzere Zeiten angewendet werden. Beide Szenarien können zu der gleichen Fluoreszenzintensitätsanzeige führen, was es schwierig macht, die genaue Spannungsgröße oder -dynamik mit TGT-Sonden 33,34 aufzulösen.
Insgesamt sollten die Bewertungen der Integrinspannung mit Wachstumsfaktorstimulation sorgfältig durchgeführt werden, indem Experimente mit internen Kontrollen entworfen, Spreizprofile auf anderen matrixbeschichteten Oberflächen verglichen, parallele Bewertungen der TGT-Fluoreszenz in Zellen bei Vorhandensein oder Fehlen einer Wachstumsfaktorstimulation vorgenommen und TGTs mit unterschiedlichenT-Tönen verwendet werden. . TGTs ermöglichen die Quantifizierung der Rolle der Wachstumsfaktorsignalisierung bei der Regulierung der Mechanik von Integrinrezeptoren, der fokalen Adhäsionsdynamik und der Zellausbreitung. Dieses Protokoll kann als Vorlage für viele TGT-basierte Experimente mit Sonden mit unterschiedlichemT-Tol, verschiedenen Liganden, verschiedenen Zelltypen oder unterschiedlichen Stimulationsbedingungen verwendet werden. Alle Proteine von Interesse können nach der Fixierung markiert werden, und jede Art von quantitativer Bildanalyse kann implementiert werden. Als solches präsentieren wir eine Vorlage für zahlreiche TGT-Experimente.
Die Verwendung von TGT-Sonden ist nicht auf die Untersuchung von Integrinen beschränkt, sondern kann durch Modifikation des Liganden auf eine Vielzahl von Zellmembranrezeptoren über verschiedene Zelltypen hinweg erweitert werden. TGT-Sonden wurden verwendet, um die Rolle der Kräfte bei der Regulierung verschiedener Rezeptorsignalkaskaden zu untersuchen, einschließlich der mechanischen Rolle der Notch-Rezeptormechanik in der Embryonalentwicklung und Neurogenese35, der Kräfte, die die Identifizierung und Internalisierung von Antigenen durch B-Zell-Rezeptorenvermitteln 36 und der mechanischen Korrekturlesefähigkeit von T-Zell-Oberflächenrezeptoren zur Erkennung von Kräfteänderungen zur Steigerung der Stärke und Spezifität des Signaltransfers37 . Zusammen verdeutlichen diese Ergebnisse das immense Potenzial von TGT-Sonden in einer Vielzahl von experimentellen Umgebungen.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Die Autoren möchten die Mitglieder des Mattheyses-Labors für fruchtbare Diskussionen und Kritiken auszeichnen. Wir bestätigen die Finanzierung von A.L.M. von NSF CAREER 1832100 und NIH R01GM131099.
Materialien
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane | Millipore Sigma | 440140 | Surface Preparation |
| 3-hydroxypicolinic acid (3-HPA) | Millipore Sigma | 56197 | Maldi-TOF-MS matrix |
| Acetic Acid, Glacial | Fisher Scientific | A38S | Diluting EGF |
| Acetonitrile (HPLC) | Fisher Scientific | A998SK | Oligonucleotide Preparation |
| Alexa Fluor 488 Phalloidin | Cell Signaling Technology | 8878S | Immunocytochemistry |
| Ammonium Chloride | Fisher Scientific | A687 | Immunocytochemistry |
| Anti-Paxillin antibody [Y113] | Abcam | ab32084 | Immunocytochemistry |
| BD Syringes only with Luer-Lok | BD bioscience | 309657 | Surface Preparation |
| Bio-Gel P-2 | Bio-Rad | 1504118 | Oligonucleotide Preparation |
| Bovine Serum Albumin (BSA) Protease-free Powder | Fisher Scientific | BP9703100 | Surface Preparation |
| Cos-7 cells | ATCC | CRL-1651 | Cell Culture, Passage numbers 11-20 |
| Coverslip Mini-Rack, for 8 coverslips | Fisher Scientific | C14784 | Surface Preparation |
| c(RGDfK(PEG-PEG)), PEG=8-amino-3,6-dioxaoctanoic acid | Vivitide | PCI-3696-PI | Oligonucleotide Preparation |
| Cy3B NHS ester | GE Healthcare | PA63101 | Oligonucleotide Preparation |
| Dimethylformamide | Millipore Sigma | PHR1553 | Oligonucleotide Preparation |
| DMEM with L-Glutamine, 4.5g/L Glucose and Sodium Pyruvate | Fisher Scientific | MT10013C | Cell Culture |
| Epidermal Growth Factor human EGF | Millipore Sigma | E9644 | Cell Culture |
| Ethanol, 200 proof (100%) | Fisher Scientific | 22032601 | Surface Preparation |
| Falcon Standard Tissue Culture Dishes | Fisher Scientific | 08-772E | Surface Preparation |
| Fetal Bovine Serum | Fisher Scientific | 10-438-026 | Cell Culture |
| Flurobrite DMEM | Fisher Scientific | A1896701 | Cell Culture |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 647 | Invitrogen | A-21244 | Immunocytochemistry |
| Goat Serum | Fisher Scientific | 16-210-064 | Immunocytochemistry |
| Hank’s balanced salts (HBSS) | Fisher Scientific | 14-170-161 | Cell Culture |
| Horse Serum | Fisher Scientific | 16050130 | Immunocytochemistry |
| Hydrogen Peroxide | Fisher Scientific | H325-500 | Surface Preparation |
| Nanosep MF centrifugal devices | Pall laboratory | ODM02C35 | Oligonucleotide Preparation |
| NHS-azide | Fisher Scientific | 88902 | Oligonucleotide Preparation |
| Nitrogen Gas Cylinder | Airgas | Surface Preparation | |
| No. 2 round glass coverslips - 25 mm | VWR | 48382-085 | Surface Preparation |
| Parafilm M Laboratory Film | Fisher Scientific | 13-374-10 | Surface Preparation |
| Paraformaldehyde 16% | Fisher Scientific | 50-980-487 | Immunocytochemistry |
| PBS, 1X | Fisher Scientific | 21-030-CV | Surface Preparation/Immunocytochemistry |
| Penicillin-Streptomycin (5,000 U/mL) | Fisher Scientific | 15-070-063 | Cell Culture |
| PYREX Low Form Griffin Beakers | Fisher Scientific | 02-540G | Surface Preparation |
| Sodium Ascorbate | Fisher Scientific | 18-606-310 | Oligonucleotide Preparation |
| Sodium Bicarbonate | Fisher Scientific | S233 | Oligonucleotide Preparation |
| Sodium Chloride | Fisher Scientific | BP358 | Surface Preparation |
| Streptavidin | Fisher Scientific | 434301 | Surface Preparation |
| Sulfo-NHS-LC-Biotin | Fisher Scientific | 21335 | Surface Preparation |
| Sulfuric Acid | Fisher Scientific | A300-500 | Surface Preparation |
| TEAA | Fisher Scientific | NC0322726 | Oligonucleotide Preparation |
| Triethylamine | Millipore Sigma | 471283 | Oligonucleotide Preparation |
| Trifluoroacetic Acid (TFA) | Fisher Scientific | PI28901 | Oligonucleotide Preparation |
| THPTA | Fisher Scientific | NC1296293 | Oligonucleotide Preparation |
| Triton X 100 Detergent Surfact Ams Solution | Fisher Scientific | 85111 | Immunocytochemistry |
| Water, DNA Grade, DNASE, Protease free | Fisher Scientific | BP24701 | Oligonucleotide Preparation |
| Equipment | |||
| Agilent AdvanceBio Oligonucleotide C18 column, 4.6 x 150 mm, 2.7 μm | Agilent | 653950-702 | Oligonucleotide Preparation |
| High-performance liquid chromatography | Agilent | 1100 | Oligonucleotide Preparation |
| Low Speed Orbital Shaker | Fisher Scientific | 10-320-813 | Immunocytochemistry |
| Matrix-assisted laser desorption/ ionization time-of-flight mass spectrometer (MALDI-TOF-MS) | Voyager STR | Oligonucleotide Preparation | |
| Molecular Probes Attofluor Cell Chamber | Fisher Scientific | A7816 | Surface Preparation |
| Nanodrop 2000 UV-Vis Spectrophotometer | Thermo Fisher | Oligonucleotide Preparation | |
| Nikon Eclipse Ti inverted microscope | pe Nikon | Microscopy | |
| Nikon Perfect Focus System | Nikon | Microscopy | |
| NIS Elements software | Nikon | Microscopy | |
| ORCA-Flash4.0 V3 Digital CMOS camera | Hamamatsu | Microscopy | |
| Quad band TIRF 405/488/561/647 cube | CHROMA | Microscopy | |
| RICM Cube | CHROMA | Microscopy | |
| SOLA v-nIR Light Engine | Lumencor | Microscopy | |
| Thermo Forma Steri Cycle 370 CO2 Incubator | Fisher Scientific | Cell Culture | |
| VWR 75D Ultrasonic Cleaner | VWR | 13710 | Surface Preparation |
| Data Analysis | Use | ||
| Fiji (Image J) | https://imagej.net/software/fiji/downloads | Quantitative Analysis | |
| Graph Pad Prism | Graph Pad | Statistical Analysis | |
| Oligo name | 5'modification/ 3' modification | Sequence (5' to 3') | Use |
| Alkyne-21-BHQ2 | 5' Hexynyl/ 3' BHQ_2 | GTGAAATACCGCACAGATGCG | Top strand TGT probe |
| 56 pN TGT | 5' Biosg/TTTTTT/iUniAmM | CGCATCTGTGCGGTATTTCACTTT | Bottom strand TGT probe |
| 12 pN TGT | 5' AmMC6/ 3' BioTEG | CGCATCTGTGCGGTATTTCACTTT | Bottom strand TGT probe |
Referenzen
- Lim, C. -. G., Jang, J., Kim, C. Cellular machinery for sensing mechanical force. BMB Reports. 51 (12), 623-629 (2018).
- Moraes, C., Sun, Y., Simmons, C. A. (Micro)managing the mechanical microenvironment. Integrative Biology. 3 (10), 959-971 (2011).
- Vogel, V., Sheetz, M. P. Mechanical forces matter in health and disease. From Cancer to Tissue Engineering. Nanotechnology. , 233-303 (2010).
- Wang, J. H. C., Li, B. Mechanics rules cell biology. BMC Sports Science, Medicine and Rehabilitation. 2 (1), 16 (2010).
- Moeendarbary, E., Harris, A. R. Cell mechanics: principles, practices, and prospects. Wiley Interdisciplinary Reviews: Systems Biology and Medicine. 6 (5), 371-388 (2014).
- Streuli, C. H., Akhtar, N. Signal co-operation between integrins and other receptor systems. Biochemical Journal. 418 (3), 491-506 (2009).
- Chiasson-MacKenzie, C., McClatchey, A. I. EGFR-induced cytoskeletal changes drive complex cell behaviors: The tip of the iceberg. Science Signaling. 11 (515), (2018).
- Kechagia, J. Z., Ivaska, J., Roca-Cusachs, P. Integrins as biomechanical sensors of the microenvironment. Nature Reviews Molecular Cell Biology. 20 (8), 457-473 (2019).
- De Luca, A., et al. The role of the EGFR signaling in tumor microenvironment. Journal of Cellular Physiology. 214 (3), 559-567 (2008).
- Javadi, S., Zhiani, M., Mousavi, M. A., Fathi, M. Crosstalk between Epidermal Growth Factor Receptors (EGFR) and integrins in resistance to EGFR tyrosine kinase inhibitors (TKIs) in solid tumors. European Journal of Cell Biology. 99 (4), 151083 (2020).
- Eliceiri, B. P. Integrin and growth factor receptor crosstalk. Circulation Research. 89 (12), 1104-1110 (2001).
- Dan, L., Jian, D., Na, L., Xiaozhong, W. Crosstalk between EGFR and integrin affects invasion and proliferation of gastric cancer cell line, SGC7901. OncoTargets and Therapy. 5, 271-277 (2012).
- Giancotti, F. G., Tarone, G. Positional control of cell fate through joint integrin/receptor protein kinase signaling. Annual Reviews: Cell and Developmental Biology. 19, 173-206 (2003).
- Ricono, J. M., et al. Specific cross-talk between epidermal growth factor receptor and integrin alphavbeta5 promotes carcinoma cell invasion and metastasis. Cancer Research. 69 (4), 1383-1391 (2009).
- Polacheck, W. J., Chen, C. S. Measuring cell-generated forces: a guide to the available tools. Nature Methods. 13 (5), 415-423 (2016).
- Hang, X., et al. Nanosensors for single cell mechanical interrogation. Biosensors and Bioelectronics. 179, 113086 (2021).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Schoen, I., Hu, W., Klotzsch, E., Vogel, V. Probing cellular traction forces by micropillar arrays: contribution of substrate warping to pillar deflection. Nano Letters. 10 (5), 1823-1830 (2010).
- Ma, V. P. -. Y., Salaita, K. DNA Nanotechnology as an Emerging Tool to Study Mechanotransduction in Living Systems. Small. 15 (26), 1900961 (2019).
- Kim, Y., Kim, K. A., Kim, B. C. Double-stranded DNA force sensors to study the molecular level forces required to activate signaling pathways. Journal of the Korean Physical Society. 78 (5), 386-392 (2021).
- Rao, T. C., et al. EGFR activation attenuates the mechanical threshold for integrin tension and focal adhesion formation. Journal of Cell Sciences. 133 (13), (2020).
- Zhang, Y., Ge, C., Zhu, C., Salaita, K. DNA-based digital tension probes reveal integrin forces during early cell adhesion. Nature Communications. 5, 5167 (2014).
- Liu, Y., et al. DNA-based nanoparticle tension sensors reveal that T-cell receptors transmit defined pN forces to their antigens for enhanced fidelity. Proceedings of the National Academy of Sciences of the United States of America. 113 (20), 5610-5615 (2016).
- Zhang, Y., et al. Platelet integrins exhibit anisotropic mechanosensing and harness piconewton forces to mediate platelet aggregation. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 325-330 (2018).
- Ma, V. P. -. Y., et al. Mechanically induced catalytic amplification reaction for readout of receptor-mediated cellular forces. Angewandte Chemie International Edition. 55 (18), 5488-5492 (2016).
- Wang, X., Ha, T. Defining single molecular forces required to activate integrin and notch signaling. Science. 340 (6135), 991-994 (2013).
- Chen, Y., Lee, H., Tong, H., Schwartz, M., Zhu, C. Force regulated conformational change of integrin αVβ3. Matrix Biology. 60-61, 70-85 (2017).
- Kantlehner, M., et al. Surface coating with cyclic RGD peptides stimulates osteoblast adhesion and proliferation as well as bone formation. ChemBioChem. 1 (2), 107-114 (2000).
- Kapp, T. G., et al. A comprehensive evaluation of the activity and selectivity profile of ligands for RGD-binding integrins. Scientific Reports. 7, 39805 (2017).
- Kok, R. J., et al. Preparation and functional evaluation of RGD-modified proteins as alpha(v)beta(3) integrin directed therapeutics. Bioconjugate Chemistry. 13 (3), 128-135 (2002).
- Li, I. T. S., Ha, T., Chemla, Y. R. Mapping cell surface adhesion by rotation tracking and adhesion footprinting. Scientific Reports. 7 (1), 44502 (2017).
- Wang, Y., et al. Force-activatable biosensor enables single platelet force mapping directly by fluorescence imaging. Biosensors and Bioelectronics. 100, 192-200 (2018).
- Murad, Y., Li, I. T. S. Quantifying molecular forces with serially connected force sensors. Biophysical Journal. 116 (7), 1282-1291 (2019).
- Yasunaga, A., Murad, Y., Li, I. T. S. Quantifying molecular tension-classifications, interpretations and limitations of force sensors. Physical Biology. 17 (1), 011001 (2019).
- Luca, V. C., et al. Notch-Jagged complex structure implicates a catch bond in tuning ligand sensitivity. Science. 355 (6331), 1320-1324 (2017).
- Spillane, K. M., Tolar, P. B cell antigen extraction is regulated by physical properties of antigen-presenting cells. The Journal of Cell Biology. 216 (1), 217-230 (2017).
- Brockman, J. M., Salaita, K. Mechanical proofreading: a general mechanism to enhance the fidelity of information transfer between cells. Frontiers in Physics. 7, 14 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten