Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Multi-Stream-Perfusionsbioreaktor integriert mit Auslassfraktionierung für dynamische Zellkultur
In diesem Artikel
Zusammenfassung
Dieses Papier stellt eine Methode zum Aufbau und Betrieb eines kostengünstigen, mehrkanaligen Perfusionszellkultursystems zur Messung der Dynamik der Sekretions- und Absorptionsraten von gelösten Stoffen in zellulären Prozessen vor. Das System kann Zellen auch dynamischen Reizprofilen aussetzen.
Zusammenfassung
Bestimmte Zell- und Gewebefunktionen arbeiten innerhalb der dynamischen Zeitskala von Minuten bis Stunden, die von herkömmlichen Kultursystemen schlecht aufgelöst werden. Diese Arbeit hat ein kostengünstiges Perfusionsbioreaktorsystem entwickelt, mit dem Kulturmedium kontinuierlich in ein Zellkulturmodul perfundiert und in einem nachgeschalteten Modul fraktioniert werden kann, um die Dynamik auf dieser Skala zu messen. Das System besteht fast ausschließlich aus kommerziell erhältlichen Teilen und kann parallelisiert werden, um unabhängige Experimente in herkömmlichen Multi-Well-Zellkulturplatten gleichzeitig durchzuführen. Dieser Videoartikel zeigt, wie Sie das Basis-Setup zusammenbauen, das nur eine einzige Mehrkanal-Spritzenpumpe und einen modifizierten Fraktionskollektor benötigt, um bis zu sechs Kulturen parallel zu perfusionieren. Es werden auch nützliche Varianten des modularen Aufbaus vorgestellt, die eine kontrollierte Stimulationsdynamik ermöglichen, wie z.B. gelöste Impulse oder pharmakokinetische Profile. Wichtig ist, dass die Signale des gelösten Stoffes, wenn sie durch das System wandern, aufgrund der Dispersion des gelösten Stoffes verzerrt sind. Weiterhin wird ein Verfahren zur Messung der Verweilzeitverteilungen (RTDs) der Komponenten des Perfusionsaufbaus mit einem Tracer unter Verwendung von MATLAB beschrieben. RTDs sind nützlich, um zu berechnen, wie gelöste Signale durch den Durchfluss im Multikompartimentsystem verzerrt werden. Dieses System ist sehr robust und reproduzierbar, so dass Grundlagenforscher es leicht übernehmen können, ohne dass spezielle Fertigungsanlagen erforderlich sind.
Einleitung
Viele wichtige biologische Prozesse laufen in Zell- und Gewebekulturen auf der Zeitskala von Minuten bis Stundenab 1,2,3. Während einige dieser Phänomene automatisiert mit Zeitraffermikroskopie4, Biolumineszenz1 oder anderen Methoden beobachtet und aufgezeichnet werden können, werden Experimente mit der Sammlung von Kulturüberstandsproben für die chemische Analyse häufig manuell in statischen Zellkulturen durchgeführt. Die manuelle Probenahme schränkt die Durchführbarkeit bestimmter Studien ein, da häufige oder außerbörsliche Probenahmezeitpunkte unbequem sind. Zu den weiteren Mängeln statischer Kulturmethoden gehören Experimente mit kontrollierten, vorübergehenden Expositionen gegenüber chemischen Reizen. In statischen Kulturen müssen Reize manuell hinzugefügt und entfernt werden, und Reizprofile sind auf Schrittänderungen im Laufe der Zeit beschränkt, während mittlere Änderungen auch andere Mediumskomponenten hinzufügen und entfernen, die Zellen auf unkontrollierte Weise beeinflussen können5. Fluidische Systeme können diese Herausforderungen meistern, aber bestehende Geräte stellen andere Herausforderungen dar. Mikrofluidische Geräte sind mit den unerschwinglichen Kosten für spezielle Ausrüstung und Schulungen zur Herstellung und Verwendung verbunden, erfordern mikroanalytische Methoden zur Verarbeitung von Proben und Zellen sind nach der Perfusion schwer aus den Geräten zu gewinnen6. Nur wenige makrofluidische Systeme wurden für die hier beschriebenen Arten von Experimenten entwickelt 7,8,9,10, und sie bestehen aus mehreren kundenspezifischen Teilen, die im eigenen Haus hergestellt werden und mehrere Pumpen oder Fraktionskollektoren erfordern. Darüber hinaus sind den Autoren keine kommerziell erhältlichen makrofluidischen Perfusionszellkultursysteme außer Rührkesselbioreaktoren für die Suspensionskultur bekannt, die für die Bioproduktion nützlich sind, jedoch nicht für die Modellierung und das Studium der Physiologie ausgelegt sind.
Die Autoren berichteten zuvor über das Design eines kostengünstigen Perfusionsbioreaktorsystems, das fast ausschließlich aus kommerziell erhältlichen Teilen11 besteht. Die Basisversion des Systems ermöglicht es, mehrere Kulturen in einer Bohrlochplatte in einem CO 2-Inkubator zu halten und kontinuierlich mit Medium aus einer Spritzenpumpe zu perfundieren, während die Abwassermittelströme aus den Kulturen im Laufe der Zeit automatisch zu Proben fraktioniert werden, wobei ein Fraktionskollektor mit einer kundenspezifischen Modifikation verwendet wird. Somit ermöglicht dieses System eine automatisierte Probenahme von Kulturmediumüberständen und kontinuierlichen gelösten Stoffen in die Kulturen im Laufe der Zeit. Das System ist makrofluidisch und modular aufgebaut und kann leicht modifiziert werden, um die Anforderungen neuartiger Versuchsdesigns zu erfüllen.
Das übergeordnete Ziel der hier vorgestellten Methode ist es, ein Perfusionszellkultursystem zu konstruieren, zu charakterisieren und zu verwenden, das Experimente ermöglicht, bei denen die Sekretions- oder Absorptionsraten von Substanzen durch Zellen im Laufe der Zeit gemessen werden und/oder Zellen präzisen, transienten gelösten Signalen ausgesetzt werden. Dieser Videoartikel erklärt, wie Sie das Basis-Setup zusammenbauen, das in der Lage ist, bis zu sechs Zellkulturen gleichzeitig mit einer einzigen Spritzenpumpe und einem modifizierten Fraktionssammler zu durchbluten. Zwei nützliche Varianten des Basissystems, die zusätzliche Pumpen und Teile verwenden, um Experimente zu ermöglichen, die Zellen transienten Konzentrationssignalen für gelöste Stoffe aussetzen, einschließlich kurzer Pulse und pharmakokinetischer ähnlicher Profile12, werden ebenfalls vorgestellt, wie in Abbildung 1 dargestellt.
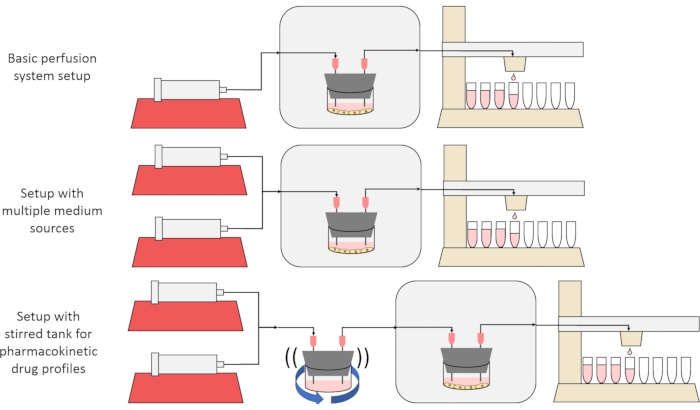
Abbildung 1: Drei Variationen des Perfusionssystemdesigns. (Top) Das grundlegende Perfusionssystem. (Mitte) Das Perfusionssystem mit einem Absperrhahn für mehrere mittlere Quellen. (Unten) Das Perfusionssystem mit einem gerührten Tank, um ein gut gemischtes Verteilungsvolumen nachzuahmen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Aufgrund der Dispersion und Diffusion innerhalb der Strömung werden die gelösten Signale verzerrt oder "verschmiert", wenn sie durch das Strömungssystem wandern. Diese Verzerrung kann durch die Verwendung von Verweilzeitverteilungen (RTDs)13 quantifiziert werden. In diesem Artikel wird erläutert, wie Tracer-Experimente an Komponenten des Perfusionssystems durchgeführt werden (Abbildung 2), und es werden MATLAB-Skripte zum Generieren von RTDs aus Messdaten bereitgestellt. Eine detaillierte Erläuterung dieser Analyse findet sich im vorherigen Paper11 der Autoren. Zusätzliche MATLAB-Skripte passen die entsprechenden Funktionen an die RTDs an, extrahieren physikalische Parameter und führen eine Signalfaltung mithilfe von RTDs durch, um vorherzusagen, wie sich der Benutzer durch das Perfusionssystem ausbreitet und verzerrt14.
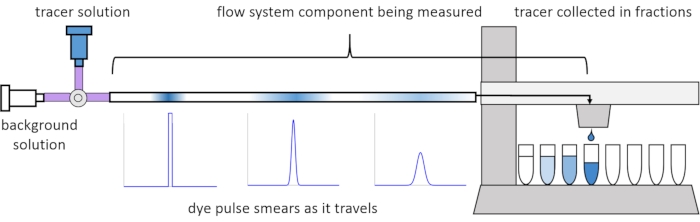
Abbildung 2: Verweilzeitverteilungen. Die RTDs von Strömungssystemkomponenten, wie diese Länge der Röhren, werden gemessen, indem ein Impuls des Tracers in das System eingegeben wird und gemessen wird, wie er "schmiert", wenn er in die gesammelten Fraktionen austritt. Diese Figur wurde von Erickson et al.11 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Bereiten Sie Teile für die Durchblutung der Bohrlochplatte vor
- Schläuche vorbereiten
- Schneiden Sie zwei Längen Silikonschläuche (1,6 mm Innendurchmesser) für jede zu durchblutende Zellkultur. Stellen Sie sicher, dass das Stück, das als vorgeschalteter Schlauch verwendet wird, lang genug ist, um von der Spritzenpumpe bis zur Zellkultur im Inkubator zu reichen, und dass das nachgeschaltete Stück von der Zellkultur bis zur am weitesten ausgedehnten Position des Fraktionssammlers reichen kann.
- Geben Sie jedem Schlauchstück ein einzigartiges Etikett an beiden Enden mit beschriftetem Klebeband.
- Stopper für die Bohrlochplatte vorbereiten
- Besorgen Sie sich einen Silikonstopfen für jede Vertiefung der zu durchblutenden Wellplatte mit einem geeigneten Durchmesser, um sich mit einer luftdichten Abdichtung eng in die Vertiefungen einzufügen.
- Schneiden Sie überschüssiges Material von den Unterseiten des Stopfens ab, damit es in die Vertiefungen passt, während im Inneren Platz für Luft über dem vorgesehenen Flüssigkeitsstand bleibt.
- Schieben Sie zwei stumpfe 18-G-Nadeln durch jeden Stopper, nach oben und von unten heraus, um als Ein- und Auslass für den Fluss durch den Brunnen zu dienen, diametral gegenüber, um den Abstand zwischen ihren Spitzen innerhalb des Brunnens zu maximieren.
- Stellen Sie die Höhen der Nadeln innerhalb der verstopften Vertiefung ein, da die Höhe der Auslassnadel die stabile Höhe des Flüssigkeitsstands im Bohrloch während der Perfusion bestimmt.
HINWEIS: Wenn die Perfusion mit der Auslassnadel über dem Flüssigkeitsstand begonnen wird, sammelt sich die Flüssigkeit im Vertiefungsraum an, bis der Füllstand die Nadel erreicht. Wenn die Perfusion mit der Auslassnadel unterhalb des Flüssigkeitsstands begonnen wird, bleibt der Flüssigkeitsstand konstant, es sei denn, Luftblasen strömen in den Brunnen, wodurch die Flüssigkeitshöhe sinkt, bis sie die gleiche Höhe wie die Auslassnadel hat.
- Sammeln zusätzlicher Teile
- Erhalten Sie für jede zu durchblutende Zellkultur eine sterile Spritze, die groß genug ist, um genügend Medium für die gesamte Perfusion zu enthalten, sowie eine zusätzliche Menge Medium, um den Schlauch zunächst zu füllen.
- Für jede Kultur, die durchblutet werden soll, erhalten Sie einen Buchsen-zu-Widerhaken- und zwei Stecker-zu-Widerhaken-Luer-Steckverbinder sowie zwei weibliche und zwei männliche Luer-Kappen.
- Teile reinigen und sterilisieren
- Wenn Teile zuvor verwendet wurden, reinigen Sie sie, indem Sie sie mit 0,1 N NaOH durchbluten, gefolgt von einer Spülung mit deionisiertem Wasser.
- Stellen Sie durch Autoklavieren oder auf andere Weise die Sterilität aller oben aufgeführten Teile sicher.
2. Laserschneiden Sie den Mehrkopfspender und befestigen Sie ihn an einem Fraktionssammler
- Erstellen Sie das Multi-Head-Dispenser-Modell aus Abbildung 3 in einem computergestützten Designprogramm neu, oder laden Sie die bereitgestellte DXF-Datei des Modells herunter (Supplemental File 1).
- Verwenden Sie einen Laserschneider, um das Design aus einer 1/8 in Acrylplatte zu schneiden.
- Entfernen Sie die drei Schrauben, die den Dosierkopf an der beweglichen Basis des Fraktionssammlers befestigen.
- Richten Sie die drei kleinsten Löcher im Mehrkopfspender mit den Schraubenlöchern in der beweglichen Basis aus und schrauben Sie die Schrauben durch die Löcher zurück, um sie zu befestigen.
- Stellen Sie die Dichtheit der drei Schrauben so ein, dass der Mehrkopfspender nach oben und unten geneigt ist, bis die Reihe der Dosierlöcher mit den darunter liegenden Auffangrohren ausgerichtet ist.
- Legen Sie vorsichtig 300 μL Pipettenspitzen durch die gewünschten Löcher, um als Dosierspitzen zu dienen.
HINWEIS: Der Fraktionssammler kann ohne den Mehrkopfspender verwendet werden, um eine einzelne Zellkultur zu perfundieren.
3. Messen Sie Komponenten-RTDs und führen Sie eine Signalfaltung durch
- Richten Sie Pumpen und Spritzen für den Tracerpuls ein, wie in Abbildung 2 dargestellt.
- Beziehen Sie zwei einkanalige oder mehrkanalige Spritzenpumpen.
- Wählen Sie eine Hintergrundlösung, um das Medium darzustellen, das während Zellkulturexperimenten im Durchflusssystem verwendet wird. Stellen Sie sicher, dass die Hintergrundlösung ähnliche Massenübertragungseigenschaften wie das Medium aufweist. In vielen Fällen ist deionisiertes Wasser eine geeignete Wahl.
- Wählen Sie eine Tracersubstanz, um den gelösten Stoff darzustellen, der während Zellkulturexperimenten von Interesse sein wird. Stellen Sie sicher, dass der Tracer ähnliche Stoffübertragungseigenschaften wie der interessierende gelöste Stoff aufweist, und seine Konzentration muss gemessen werden können. In vielen Fällen ist Lebensmittelfarbstoff eine geeignete Wahl.
- Lösen Sie die Tracersubstanz in der Hintergrundlösung auf, um die Tracerlösung herzustellen.
- Füllen Sie eine Spritze mit einer Hintergrundlösung und laden Sie sie in eine Spritzenpumpe. Füllen Sie eine andere Spritze mit Tracerlösung und laden Sie sie in die zweite Spritzenpumpe.
- Verbinden Sie beide Spritzen mit zwei der drei Anschlüsse eines Vier-Wege-Absperrhahns über Luer-Anschlüsse.
- Schließen Sie den Absperrhahn an die Hintergrundlösung und pumpen Sie die Tracerlösung in den Absperrhahn, bis sie beginnt, den offenen Anschluss herauszutropfen. Stoppen Sie die Pumpe und stellen Sie die Spritze nicht weiter ein.
HINWEIS: Es ist wichtig, dass die bewegliche Stange der Spritzenpumpe gegen die Spritzenkolben gedrückt wird, bevor die zeitgesteuerten Teile des Experiments beginnen. Dadurch kann der Durchfluss sofort beginnen, wenn die Pumpe gestartet wird. Andernfalls kann die Pumpe gestartet werden, aber der Durchfluss beginnt erst, wenn die bewegliche Stange die Kolbenposition einholt. - Schließen Sie den Absperrhahn mit der Tracerlösung und pumpen Sie die Hintergrundlösung in den Absperrhahn, bis alle verbleibenden Tracerlösungen aus dem offenen Port gespült wurden. Stoppen Sie die Pumpe und stellen Sie die Spritze nicht weiter ein.
- Richten Sie die interessierende Strömungssystemkomponente und den Fraktionssammler ein
- Richten Sie die für die FTE-Analyse gewünschte Strömungssystemkomponente ein. Stellen Sie sicher, dass das zu messende Bauteil mit einem Stück nachgeschaltetem Schlauch von geeigneter Länge und Flexibilität endet, um den Fraktionskollektor während des Betriebs zu erreichen.
- Setzen Sie das Ende des nachgeschalteten Schlauches in einen Pipettenspitzenspender im Mehrkopfspender ein, so dass er eng miteinander verbunden ist.
- Befestigen Sie den offenen Anschluss des Vier-Wege-Absperrhahns am Einlass des zu messenden Bauteils. Pumpen Sie die Hintergrundlösung durch die Komponente, bis sie vollständig gefüllt ist, wie es bei einem Zellkulturexperiment der Fall wäre, und sie beginnt aus der Dosierspitze des Fraktionssammlers zu tropfen. Stoppen Sie die Pumpe.
- Tracer-Puls injizieren, Fraktionen sammeln und Tracer messen
- Stellen Sie die Pumpe für die Tracerlösung auf den gewünschten Durchfluss ein. Schließen Sie den Absperrhahn zur Hintergrundlösung und starten Sie den Fluss der Tracerlösung. Starten Sie gleichzeitig den Fraktionssammler.
- Setzen Sie den Fluss der Tracerlösung für kurze Zeit fort, um sich einem Impulseintrag des Tracers anzunähern. Es wurde festgestellt, dass eine Pulsdauer von 10 Minuten für RTDs bei einer Durchflussrate von 1 ml/h gut funktioniert.
HINWEIS: Wenn der Tracer-Impuls zu kurz ist, tritt nicht genügend Tracer in den Fluss ein, um messbar zu sein. Wenn der Impuls zu lang ist, nähert er sich keinem Impuls mehr an und verändert die Form des RTD. - Stoppen Sie am Ende der Impulsperiode der Tracerlösung die Tracerlösungspumpe. Schließen Sie den Absperrhahn schnell mit der Tracerlösung und starten Sie den Fluss der Hintergrundlösung mit der gleichen Durchflussrate.
- Lassen Sie die Hintergrundlösung fließen und Fraktionen sammeln, bis der gesamte Tracer das System und die gesammelten Fraktionen durchlaufen hat.
- Stoppen Sie das System und messen Sie die Tracerkonzentration in den Fraktionen. Enthalten Sie nur Fraktionen, die vollständig abgegeben wurden. Wenn die Sammlung auf halbem Weg durch die Sammlung eines Bruchs gestoppt wird, schließen Sie diesen Bruchteil nicht ein.
- Berechnung der Verweilzeitverteilung (RTD) aus Messdaten in MATLAB
HINWEIS: Eine schriftliche Erläuterung der von diesem MATLAB-Skript durchgeführten Analyse finden Sie in der vorherigen Veröffentlichung11 der Autoren, und Diskussionen über die Theorie sind in der Literatur13 weit verbreitet.- Erstellen Sie eine .xlsx Datei mit den Konzentrationsdaten im Format der example_tracer_data.xlsx Kalkulationstabelle, die in der Zusatzdatei 2 bereitgestellt wird. Geben Sie die Konzentrationswerte des Tracers in den Brüchen (beliebige Einheiten) in chronologischer Reihenfolge von links nach rechts in Zeile 2 ein. Geben Sie die Zeit ein, die vom Beginn des Pulses bis zum Ende des letzten Bruchs in Zelle A5 verstrichen ist, und geben Sie die Länge des Tracer-Pulses in Minuten in Zelle A8 ein.
- Speichern Sie die .xlsx Datei im MATLAB-Verzeichnis.
- Öffnen Sie das Skript RTD_From_Data.m aus der Ergänzungsdatei 3 im MATLAB-Editor.
- Ersetzen Sie den Namen der .xlsx Datei in den Klammern in der ersten Zeile des Abschnitts Daten laden des Skripts durch den Namen der neuen .xlsx-Datendatei, indem Sie die Anweisungen in der Skriptdatei befolgen. Führen Sie das Skript aus.
- Stellen Sie sicher, dass das Skript die RTD-Analyse13 erfolgreich durchführt, ein Diagramm des RTD erstellt und den Wert des numerischen Integrals über den RTD gleich 1 zurückgibt. Suchen Sie den Zeitvektor (t) und den zugehörigen RTD-Wertevektor (Et), der vom Skript im MATLAB-Verzeichnis gespeichert wurde.
- Anpassen einer Modellfunktion an den RTD in MATLAB
- Öffnen Sie das Skript Fit_RTD_Function.m im MATLAB-Editor aus Supplementary File 4.
- Wählen Sie eine der drei auskommentierten Modellfunktionen, die an den RTD angepasst werden sollen: das axiale Dispersionsmodell13, das RTDs für den laminaren Fluss in zylindrischen Rohren enthält; das CSTR-Modell13, das gut gerührte Tanks passt; und das n-CSTR Modell15, das ungefähr auf größere Bohrlochplatten passt. Um ein anderes Modell anzupassen, das hier nicht enthalten ist, fügen Sie es dem Skript im gleichen Format hinzu.
- Entfernen Sie die Kommentare in dem Abschnitt des Skripts, der das für die Anpassung ausgewählte Modell enthält.
- Ändern Sie die Werte der anfänglichen Vermutungen für die Parameter in die für die FTE geeigneten Werte.
- Führen Sie das Skript aus, um ein Diagramm der Anpassungsfunktion zu erstellen, das den RTD-Daten überlagert ist, und um die Anpassungsparameterwerte für die Funktion auszugeben. Wenn die Anpassung sehr schlecht ist oder Fehler auftreten, ändern Sie die anfänglichen Raten des Parameters und führen Sie das Skript erneut aus.
- Signalfaltung in MATLAB durchführen
- Wählen Sie entweder ein Signal und einen RTD oder zwei RTDs, um sich zu konvolvieren.
- Öffnen Sie das Skript Signal_Convolution.m aus Supplemental File 5 im MATLAB-Editor.
- Für jedes der beiden zu konvolvierenden Signale (d. h. ein Signal und ein RTD oder zwei RTDs) definieren Sie einen Vektor von gleichmäßig verteilten Zeitpunkten in den gewünschten Einheiten und einen entsprechenden Vektor von Signalwerten zu diesen Zeiten.
HINWEIS: Die Vektoren der beiden Signale müssen die gleiche Anzahl von Elementen und die gleiche Größe von Zeitschritten haben. Aus diesem Grund ist es nützlich, die RTD als kontinuierliche Funktion zu haben, die für eine beliebige Anzahl von Punkten in einem beliebigen Zeitintervall abgetastet werden kann. - Geben Sie die beiden Signale in MATLAB ein und führen Sie das Skript aus, um die Zeit- und Signalvektoren des Ausgangssignals zu erhalten.
4. Richten Sie das grundlegende Perfusionssystem mit Zellen in einer Wellplatte ein
- Bereiten Sie die Bohrlochplatte vor
- Stellen Sie sicher, dass die Bohrlochplattenkultur die für das Perfusionsexperiment geeignete mittlere Tiefe aufweist. Führen Sie alle endgültigen Mediumswechsel, Stimulationen oder andere Schritte nach Belieben durch, bevor Sie mit der Perfusion beginnen. Wenn Suspensionszellen perfundiert werden, zentrifen Sie die Platte, um sicherzustellen, dass sie sich auf der Unterseite befinden.
- Unter sterilen Bedingungen die Stopfen mit Nadeln in die Well-Plate-Kulturen einführen, wobei die Nadeln hochgezogen werden. Nachdem der Stopfen an Ort und Stelle ist, senken Sie die Nadeln zur Durchblutung auf die gewünschte Höhe ab, da die Höhe der Auslassnadel den stabilen Flüssigkeitsstand bestimmt.
- Verschließen Sie die Nadeln mit männlichen Luer-Kappen und bewahren Sie die gesamte Brunnenplatte bis zum Gebrauch in einem Inkubator auf.
- Vorbereiten der Spritzen und der vorgeschalteten Schläuche
- Füllen Sie unter sterilen Bedingungen eine Spritze für jede zu durchblutende Kultur mit genügend Medium für die gewünschte Dauer der Perfusion sowie genügend zusätzlichem Medium, um den vorgeschalteten Schlauch zu füllen.
- Befestigen Sie den vorgeschalteten Schlauch mit einem Luer-Anschluss von Buchse zu Widerhaken an der Spritze. Setzen Sie am anderen Ende des Rohres einen Luer-Stecker von Stecker zu Widerhaken ein.
- Dosieren Sie das Medium aus der Spritze, bis das vorgeschaltete Rohr vollständig mit Medium gefüllt ist.
- Verschließen Sie das offene Ende des Rohres mit einer weiblichen Luer-Kappe.
HINWEIS: Alle Replikatspritzen müssen zu diesem Zeitpunkt genau das gleiche Volumen haben. Wenn ihr Volumen nicht gleich ist, befinden sich ihre Kolben in verschiedenen Positionen, und sie passen nicht alle gut in eine einzige Mehrkanal-Spritzenpumpe.
- Setzen Sie unter sterilen Bedingungen einen Luer-Stecker von Mann zu Widerhaken in ein Ende des nachgeschalteten Schlauchs ein und verschließen Sie ihn mit einer weiblichen Luer-Kappe.
- Bringen Sie vorsichtig alle vorbereiteten Schläuche, Spritzen und die Wellplatte zum Inkubator, der für die Perfusion verwendet wird.
- Stellen Sie die Spritzenpumpe und den Fraktionssammler an den gewünschten Stellen in der Nähe des Inkubators auf. Stellen Sie die Spritzenpumpe auf oder in der Nähe des Inkubators auf und platzieren Sie den Fraktionssammler neben dem Inkubator in der Nähe des Anschlusses.
- Bündeln Sie die verkappten Enden aller vor- und nachgeschalteten Rohre und schieben Sie sie von der Außenseite des Inkubators nach innen durch den Anschluss.
- Laden Sie die Spritzen in die Spritzenpumpe und stecken Sie die offenen Enden der nachgeschalteten Rohre in die Dosierpipettenspitzen des Mehrkopfspenders des Fraktionssammlers.
- Ziehen Sie im Inkubator so viel Puffer wie möglich der vorgeschalteten Rohre in den Inkubator, um die Länge der Schläuche zu maximieren, durch die das strömende Medium Wärme und CO2 aus der Inkubatorluft aufnehmen kann. Während Sie diese an Ort und Stelle halten, ziehen Sie die nachgeschalteten Rohre aus dem Inkubator, gerade genug, so dass sie in der Lage sind, den am weitesten ausgedehnten Punkt auf dem Fraktionskollektor zu erreichen, während die gekappten Enden immer noch im Inkubator bleiben.
- Lösen Sie für jeden verstopften Brunnen schnell die Nadeln und die vor- und nachgeschalteten Rohre für diesen Brunnen und befestigen Sie sie zusammen mit ihren Luer-Anschlüssen.
- Sobald alle Teile angeschlossen sind, lassen Sie die Spritzenpumpe kurz mit einer relativ hohen Geschwindigkeit laufen, um sicherzustellen, dass alle Ströme ordnungsgemäß fließen.
- An diesem Punkt, wenn es gewünscht ist, das Experiment mit den nachgeschalteten Rohren voller Medium zu beginnen, fahren Sie mit der Pumpe fort, bis alle gefüllt sind. Andernfalls stoppen Sie die Pumpe.
- Stellen Sie den Durchfluss der Spritzenpumpe und die Häufigkeit der Fraktionssammlung ein und starten Sie beide Maschinen gleichzeitig, um das Experiment zu beginnen. Sammeln Sie Brüche für die gewünschte Testdauer.
5. Richten Sie das Perfusionssystem mit einem Absperrhahn für mehrere mittlere Quellen ein
- Führen Sie alle Unterschritte von Schritt 4.1 oben aus.
- Bereiten Sie die beiden Medien vor, die in der Perfusion verwendet werden sollen, und kennzeichnen Sie das Medium, das zuerst abgegeben wird, als 1 und das andere als Medium 2.
- Damit jede Kultur durchblutet werden soll, füllen Sie eine Spritze mit genügend Medium 1 für die Dauer ihrer Abgabe plus genug Volumen, um das Perfusionssystem zunächst zu füllen. Füllen Sie eine zweite Spritze mit genügend Medium 2 für die Dauer ihrer Abgabe.
- Schließen Sie beide Spritzen an zwei der drei Anschlüsse eines Vier-Wege-Absperrhahns an.
HINWEIS: Möglicherweise ist eine Länge des Schlauches erforderlich, um die Spritzen mit den Absperrhähnen zu verbinden. - Bereiten Sie den Absperrhahn und die Spritzen ähnlich wie bei den Schritten 3.1.7-3.1.8 oben vor, indem Sie den Absperrhahn auf Medium 1 schließen und Medium 2 in den Absperrhahn dosieren, bis er gerade beginnt, den offenen Anschluss herauszutropfen.
- Schließen Sie den Absperrhahn auf Medium 2 und geben Sie Medium 1 in den Absperrhahn ab, bis alle verbleibenden Medium 2 aus dem offenen Port gespült sind.
- Befestigen Sie den vorgeschalteten Schlauch mit einem Luer-Anschluss von Buchse zu Widerhaken am offenen Absperrhahnanschluss. Setzen Sie am anderen Ende des Rohres einen Luer-Stecker von Stecker zu Widerhaken ein.
- Dosieren Sie Medium 1 aus der Spritze, bis das vorgeschaltete Rohr vollständig mit Medium gefüllt ist.
- Fahren Sie mit den obigen Schritten 4.3-4.11 fort, indem Sie beide Spritzen in separate Spritzenpumpen einlegen und nur Medium 1 dosieren.
- Stellen Sie die Durchflussrate der Spritzenpumpe für Medium 1 und die Häufigkeit der Fraktionssammlung ein und starten Sie beide Maschinen gleichzeitig, um das Experiment zu beginnen.
- Wenn die mittlere Quelle gewechselt werden soll, stoppen Sie schnell die Spritzenpumpe für Medium 1, drehen Sie den geschlossenen Absperrhahn auf Medium 1 und starten Sie die Spritzenpumpe für Medium 2. Falls gewünscht, schalten Sie die Quelle später auf ähnliche Weise wieder auf Mittel 1 um.
- Sammeln Sie Brüche für die gewünschte Testdauer.
6. Richten Sie das Perfusionssystem mit einem Rührbehälter ein, um die Pharmakokinetik nachzuahmen
- Erhalten Sie pharmakokinetische Daten für das Medikament von Interesse und stellen Sie sicher, dass es aus einem Konzentrationsgipfel besteht, gefolgt von einem exponentiellen Zerfall.
- Nachdem Sie den Peak auf Zeit 0 gesetzt und Datenpunkte vor dem Peak entfernt haben, verwenden Sie das Skript Stirred_Tank_Fit.m (Supplemental File 6), um die RTD-Gleichung des Rührbehälters an die Daten anzupassen. Eingabe v (die gewünschte Perfusionsflussrate) und die Daten, die als Vektorpaar direkt in das Skript angepasst werden sollen, zusammen mit t und C für Zeitwerte bzw. Konzentrationswerte. Führen Sie das Skript aus, um den Parameter V auszugeben, der das erforderliche Rührtankvolumen ist.
- Planen Sie ein Layout für das Perfusionssystem mit zwei Spritzenpumpen und einem Plattenschüttler vor dem Inkubator.
- Messen Sie die RTDs der Perfusionssystemkomponenten jenseits des Absperrhahns und führen Sie eine Signalfaltung der RTDs mit verschiedenen Medikamentenpulsdauern und -konzentrationen durch, um ein geeignetes pharmakokinetisches Profil zu finden. Verwenden Sie in dieser Berechnung die RTD-Gleichung für Rührkessel anpassen.
- Fahren Sie mit den obigen Schritten 5.1-5.8 fort.
- Verwenden Sie eine zusätzliche Brunnenplatte in geeigneter Größe als Rührbehälter für die Einrichtung. Jede Vertiefung kann als gerührter Tank für eine durchblutete Kultur dienen. Füllen Sie die Vertiefung mit dem erforderlichen Volumen von Medium, V, und stopfen Sie die Vertiefung mit den Nadeln, die zunächst nach oben gezogen wurden, dann auf den Boden des Brunnens gedrückt wurden, und schließen Sie die Nadeln ab.
- Laden Sie die Spritzen in die Spritzenpumpen und verbinden Sie die Schläuche von den Spritzen schnell mit den verschlossenen Einlassnadeln der Rührbehälter. Verbinden Sie dann die Zellkultur vorgeschaltete Rohreinlässe mit den Auslassnadeln der Rührbehälter.
- Fahren Sie mit den Schritten 5.9-5.10 fort.
- Wechseln Sie zum gewünschten Zeitpunkt zum Abgabemedium 2, das das Arzneimittel enthält, wie in Schritt 5.11 beschrieben. Wechseln Sie zurück zu Medium 1, wenn die Arzneimittelinfusion abgeschlossen ist.
- Fahren Sie mit Schritt 5.12 fort.
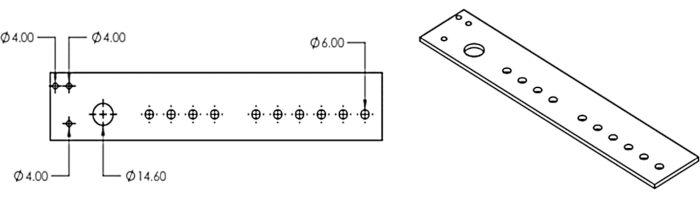
Abbildung 3: Der Mehrkopfspender. Design für den lasergeschnittenen Mehrkopfspender. Diese Figur wurde von Erickson et al.11 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Das Perfusionssystem mit mehreren Mediumquellen aus Abschnitt 5 des Protokolls wurde verwendet, um die Expressionsdynamik eines Reportergens zu messen, das durch den Kernfaktor kappa-light-chain-enhancer von aktivierten B-Zellen (NF-κB) Transkriptionsfaktor in menschlichen embryonalen Nierenzellen 293 (HEK293) als Reaktion auf einen 1,5 h Puls des Tumornekrosefaktors alpha (TNF-α) angetrieben wird. HEK293-Zellen wurden stabil unter Verwendung von lentiviralen Vektoren mit einem Genkonstrukt transduziert, das Gaussia lu...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Diese Arbeit beschreibt den Aufbau und Betrieb eines Perfusionszellkultursystems mit mehreren Medienquellen, demonstriert mit einem spezifischen Beispiel, in dem die Dynamik der NF-κB-gesteuerten Genexpression als Reaktion auf einen transienten Puls von TNF-α gemessen wurde. Die RTDs der Komponenten des Perfusionssystems wurden gemessen und modelliert, und die Signalfaltung wurde verwendet, um sowohl die Exposition der Zellen gegenüber dem TNF-α-Puls als auch die TNF-α-Verteilung in den gesammelten Abwassermediumfra...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären keine konkurrierenden Interessen.
Danksagungen
Diese Forschung wurde mit Unterstützung unter Grant Nos durchgeführt. R01EB012521, R01EB028782 und T32 GM008339 von den National Institutes of Health.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 18 Gauge 1 1/2- in Disposable Probe Needle For Use With Syringes and Dispensing Machines | Grainger | 5FVK2 | |
| 293T Cells | ATCC | CRL-3216 | HEK 293T cells used in the Representative Results experiment. |
| 96-Well Clear Bottom Plates, Corning | VWR | 89091-010 | Plates for measuring dye concentrations in RTD experiments and GLuc in representative results experiment. |
| BD Disposable Syringes with Luer-Lok Tips, 5 mL | Fisher Scientific | 14-829-45 | |
| BioFrac Fraction Collector | Bio-Rad | 7410002 | Fraction collector that can be used for a single stream, or modified using our method to enable collection from multiple streams. |
| Clear High-Strength UV-Resistant Acrylic 12" x 12" x 1/8" | McMaster-Carr | 4615T93 | This sheet is cut using a laser cutter according to the DXF file in the supplemental materials to produce the multi-head dispenser that can be attached to the BioFrac fraction collector. |
| Coelenterazine native | NanoLight Technology | 303 | Substrate used in Gaussia luciferase bioluminescence assay in representative results. |
| Corning Costar TC-Treated Multiple Well Plates, size 48 wells, polystyrene plate, flat bottom wells | Millipore Sigma | CLS3548 | Used to grow and perfuse 293T cells in representative results. |
| Corning Costar Flat Bottom Cell Culture Plates, size 12 wells | Fisher Scientific | 720081 | Can be plugged and used as a stirred tank to produce pharmacokinetic profiles in perfusion. Can also contain cells for perfusion. |
| DMEM, high glucose | ThermoFisher Scientific | 11965126 | |
| Epilog Zing 24 Laser | Cutting Edge Systems | Epilog Zing 24 | Laser cutter used to produce multi-head dispenser from acrylic sheet. Other laser cutters may be used. |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 20 mL | Fisher Scientific | 14-955-460 | |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 60 mL | Fisher Scientific | 14-955-461 | |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-129 | Microcentrifuge tubes for collecting fractions. |
| Fisherbrand Round Bottom Disposable Borosilicate Glass Tubes with Plain End | Fisher Scientific | 14-961-26 | Glass tubes for collecting fractions. |
| Fisherbrand SureOne Micropoint Pipette Tips, Universal Fit, Non-Filtered | Fisher Scientific | 2707410 | 300 ul pipette tips that best fit the multi-head dispenser and tubing to act as dispensing tips. |
| Gibco DPBS, powder, no calcium, no magnesium | Fisher Scientific | 21600010 | Phosphate buffered saline. |
| Labline 4625 Titer Shaker | Marshall Scientific | Labline 4625 Titer Shaker | Orbital shaker used to keep stirred tanks mixed. |
| Masterflex Fitting, Polycarbonate, Four-Way Stopcock, Male Luer Lock, Non-Sterile; 10/PK | Cole-Parmer | EW-30600-04 | Used to join multiple inlet streams for RTD experiments and cell culture experiments. |
| Masterflex Fitting, Polycarbonate, Straight, Female Luer x Cap; 25/PK | Masterflex | UX-45501-28 | |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hosebarb Adapters, 1/16" | Cole-Parmer | EW-45508-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Hosebarb Adapter, 1/16" ID | Cole-Parmer | EW-45518-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Plug Adapter; 25/PK | Masterflex | EW-30800-30 | |
| Masterflex L/S Precision Pump Tubing, Platinum-Cured Silicone, L/S 14; 25 ft | Masterflex | EW-96410-14 | |
| MATLAB | MathWorks | R2019b | Version R2019b. Newer versions may also be used. Some older versions may work. |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | |
| Rack Set F1 | Bio-Rad | 7410010 | Racks to hold collecting tubes in the fraction collector. |
| Recombinant Human TNF-alpha (HEK293-expressed) Protein, CF | Bio-Techne | 10291-TA-020 | Cytokine used to stimulate 293T cells in representative results. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 00, Bottom 10.5mm | Saint Gobain | DX263015-50 | Fits 48-well plates. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 4 Bottom 21mm | Saint Gobain | DX263027-10 | Fits 12-well plates. |
| Sodium Hydroxide, 10.0 N Aqueous Solution APHA; 1 L | Spectrum Chemicals | S-395-1LT | |
| SolidWorks | Dassault Systems | SolidWorks | CAD software used to create the multi-head dispenser DXF file. |
| Varioskan LUX multimode microplate reader | ThermoFisher Scientific | VL0000D0 | Plate reader. |
| Wilton Color Right Performance Color System Base Refill, Blue | Michaels | 10404779 | Blue food dye containing Brilliant Blue FCF, used as a tracer in RTD experiments. Absorbance spectrum peaks at 628 nm. |
Referenzen
- Welsh, D. K., Yoo, S. H., Liu, A. C., Takahashi, J. S., Kay, S. A. Bioluminescence imaging of individual fibroblasts reveals persistent, independently phased circadian rhythms of clock gene expression. Current Biology. 14 (24), 2289-2295 (2004).
- Talaei, K., et al. A mathematical model of the dynamics of cytokine expression and human immune cell activation in response to the pathogen Staphylococcus aureus. Frontiers in Cellular and Infection Microbiology. 11, 711153(2021).
- Kemas, A. M., Youhanna, S., Zandi Shafagh, R., Lauschke, V. M. Insulin-dependent glucose consumption dynamics in 3D primary human liver cultures measured by a sensitive and specific glucose sensor with nanoliter input volume. FASEB Journal. 35 (3), 21305(2021).
- Muzzey, D., van Oudenaarden, A. Quantitative time-lapse fluorescence microscopy in single cells. Annual Review of Cell and Developmental Biology. 25, 301-327 (2009).
- Calligaro, H., Kinane, C., Bennis, M., Coutanson, C., Dkhissi-Benyahya, O. A standardized method to assess the endogenous activity and the light-response of the retinal clock in mammals. Molecular Vision. 26, 106-116 (2020).
- Battat, S., Weitz, D. A., Whitesides, G. M. An outlook on microfluidics: the promise and the challenge. Lab on a Chip. 22 (3), 530-536 (2022).
- Petrenko, V., Saini, C., Perrin, L., Dibner, C. Parallel measurement of circadian clock gene expression and hormone secretion in human primary cell cultures. Journal of Visualized Experiments. (117), e54673(2016).
- Yamagishi, K., Enomoto, T., Ohmiya, Y. Perfusion-culture-based secreted bioluminescence reporter assay in living cells. Analytical Biochemistry. 354 (1), 15-21 (2006).
- Watanabe, T., et al. Multichannel perfusion culture bioluminescence reporter system for long-term detection in living cells. Analytical Biochemistry. 402 (1), 107-109 (2010).
- Murakami, N., Nakamura, H., Nishi, R., Marumoto, N., Nasu, T. Comparison of circadian oscillation of melatonin release in pineal cells of house sparrow, pigeon and Japanese quail, using cell perfusion systems. Brain Research. 651 (1-2), 209-214 (1994).
- Erickson, P., Houwayek, T., Burr, A., Teryek, M., Parekkadan, B. A continuous flow cell culture system for precision cell stimulation and time-resolved profiling of cell secretion. Analytical Biochemistry. 625, 114213(2021).
- Saltzman, W. M. Drug Delivery: Engineering Principles for Drug Therapy. , Oxford University Press. (2001).
- Fogler, H. S. Elements of Chemical Reaction Engineering. 4th edn. , Prentice Hall PTR. Boston. (2006).
- Conesa, J. A. Chemical Reactor Design: Mathematical Modeling and Applications. , Wiley. (2019).
- Toson, P., Doshi, P., Jajcevic, D. Explicit residence time distribution of a generalised cascade of continuous stirred tank reactors for a description of short recirculation time (bypassing). Processes. 7 (9), 615(2019).
- Tamayo, A. G., Shukor, S., Burr, A., Erickson, P., Parekkadan, B. Tracking leukemic T-cell transcriptional dynamics in vivo with a blood-based reporter assay. FEBS Open Biology. 10 (9), 1868-1879 (2020).
- Newell, B., Bailey, J., Islam, A., Hopkins, L., Lant, P. Characterising bioreactor mixing with residence time distribution (RTD) tests. Water Science and Technology. 37 (12), 43-47 (1998).
- Dubois, J., Tremblay, L., Lepage, M., Vermette, P. Flow dynamics within a bioreactor for tissue engineering by residence time distribution analysis combined with fluorescence and magnetic resonance imaging to investigate forced permeability and apparent diffusion coefficient in a perfusion cell culture chamber. Biotechnology and Bioengineering. 108 (10), 2488-2498 (2011).
- Gaida, L. B., et al. Liquid and gas residence time distribution in a two-stage bioreactor with cell recycle. HAL Open Science. , (2008).
- Rodrigues, M. E., Costa, A. R., Henriques, M., Azeredo, J., Oliveira, R. Wave characterization for mammalian cell culture: residence time distribution. New Biotechnology. 29 (3), 402-408 (2012).
- Olivet, D., Valls, J., Gordillo, M. A., Freixó, A., Sánchez, A. Application of residence time distribution technique to the study of the hydrodynamic behaviour of a full-scale wastewater treatment plant plug-flow bioreactor. Journal of Chemical Technology and Biotechnology. 80 (4), 425-432 (2005).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten