Method Article
Entwicklung von Drosophila melanogaster Modellen für die Bildgebung und optogenetische Kontrolle der Herzfunktion
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt die Erzeugung von Drosophila melanogaster , die eNpHR2.0 oder ReaChR-Opsine im Herzen exprimieren, für die OCT-Bildgebung und die optogenetische Herzschrittbildung. Detaillierte Anweisungen für die Drosophila OCT-Bildgebung und Herzschlagmodulation, einschließlich der Simulation von wiederherstellbarem Herzstillstand, Bradykardie und Tachykardie bei lebenden Tieren in verschiedenen Entwicklungsstadien, werden berichtet.
Zusammenfassung
Die Verwendung von Drosophila melanogaster (Fruchtfliege) als Modellorganismus hat in vielen Bereichen der biologischen Wissenschaft erhebliche Fortschritte erzielt, von zellulären Organisations- und genomischen Untersuchungen bis hin zu Verhaltensstudien. Aufgrund der gesammelten wissenschaftlichen Erkenntnisse wurde Drosophila in den letzten Jahren auf das Gebiet der Modellierung menschlicher Krankheiten, einschließlich Herzerkrankungen, gebracht. Die vorgestellte Arbeit beschreibt das experimentelle System zur Überwachung und Manipulation der Herzfunktion im Kontext eines ganzen lebenden Organismus mit rotem Licht (617 nm) und ohne invasive Verfahren. Die Kontrolle über das Herz wurde mit optogenetischen Werkzeugen erreicht. Die Optogenetik kombiniert die Expression lichtempfindlicher transgener Opsine und deren optische Aktivierung, um das interessierende biologische Gewebe zu regulieren. In dieser Arbeit wurde ein kundenspezifisches integriertes optisches Kohärenztomographie (OCT) Bildgebungs- und optogenetisches Stimulationssystem verwendet, um das funktionierende D. melanogaster Herz im 3. Larven- und frühen Puppenentwicklungsstadium zu visualisieren und zu modulieren. Das duale genetische System UAS/GAL4 wurde verwendet, um Halorhodopsin (eNpHR2.0) und rotverschobenes Kanalrhodopsin (ReaChR) zu exprimieren, speziell im Fliegenherzen. Einzelheiten zur Vorbereitung von D. melanogaster für die Live-OCT-Bildgebung und zur optogenetischen Stimulierung werden bereitgestellt. Eine im Labor entwickelte Integrationssoftware verarbeitete die Bilddaten, um visuelle Präsentationen und quantitative Merkmale der Drosophila-Herzfunktion zu erstellen. Die Ergebnisse zeigen die Machbarkeit der Einleitung von Herzstillstand und Bradykardie, die durch eNpHR2.0-Aktivierung verursacht werden, und der Durchführung von Herzschritten bei ReaChR-Aktivierung.
Einleitung
Ende 2010 wählte die Fachzeitschrift Nature Methods die Optogenetik zur Methode des Jahres1. Der Einsatz lichtregulierter genetischer Werkzeuge (transgener Opsine) zur Steuerung von biologischem Gewebe von Interesse mit bisher unerreichter Präzision und Geschwindigkeit öffnete eine Schleuse für neue Anwendungen. Bis heute gehört die Mehrheit der Errungenschaften den Neurowissenschaften. Die Technologie wurde als neue Methode zur präzisen Kontrolle einzelner Neuroneneingeführt 2 und hat Entdeckungen im Bereich der kognitiven Funktionen lebender Organismen3 gemacht. Neurowissenschaftler zeigten von Anfang an die Fähigkeit, das Verhalten des gesamten Organismus zu modulieren. Die Expression und Lichtaktivierung von ChR2-Opsin in dopaminergen Neuronen von Mäusen verursachte ihre Aktivierung und war ausreichend, um die Verhaltenskonditionierung voranzutreiben4. Die optogenetische Hemmung einer Untergruppe von Neuronen, die Halorhodopsin NpHR2.0 enthielten und an den epileptischen Fokus des Nagetiergehirns abgegeben wurden, führte zu einer Abschwächung elektroenzephalographischer Anfälle5.
Optogenetische Anwendungen in der Kardiologie entwickeln sich stetig6. ChR2 wurde erfolgreich in Kardiomyozyten-Zellkulturen und in Mäusen exprimiert; Die Herzfrequenz wurde durch blaue Lichtblitze durchgeführt (durchgeführt unter Verwendung einer implantierten Faser bei lebenden Tieren)7. Im Zebrafisch wurde ChR2 exprimiert und verwendet, um die Schrittmacher-Herzregion zu identifizieren; NpHR-Aktivierung induzierte Herzstillstand8. Die optogenetische kardiale Stimulation hat das einzigartige Potenzial für die Entwicklung neuer Pacing- und Resynchronisationstherapien9. Versuche, ein autogenes Arrhythmie-Abschlusssystem zu etablieren, wurden kürzlich ebenfalls berichtet10.
Umfangreiche Forschung und die Entwicklung neuer therapeutischer Therapien erfordern die Anwendung verschiedener Modellsysteme, von der Zellkultur bis hin zu Säugetieren. Das Herz eines Wirbeltieres ist ein sehr komplexes Organ. Kardiomyozyten (CM) machen ein Drittel aller Herzzellen aus; Andere Zellen umfassen Neuronen, vaskuläre glatte Muskelzellen und nicht erregbare Zellen (dh Endothelzellen, Fibroblasten und Immunzellen). Die Erforschung der CM-Zellkultur beschränkt die Translation der erhaltenen Ergebnisse auf humanmedizinische Anwendungen. Die genetischen Manipulationen von Säugetiermodellorganismen sind begrenzt und zeitaufwendig. Kleinere wirbellose Modelle haben viele Vorteile; Ihr Herz-Kreislauf-System trägt alle wesentlichen histologischen Elemente. Drosophila melanogaster (Fruchtfliege) ist ein einfaches und leistungsfähiges genetisches Modellsystem, um die Rolle von Genen zu untersuchen, die mit menschlichen Krankheiten, einschließlich Herzerkrankungen, assoziiert sind11,12,13. Als kurzlebige Tiere stellen Fruchtfliegen eine hervorragende Möglichkeit dar, alters- oder krankheitsabhängige Veränderungen der Herzfunktion zu modellieren, die lebenslang verfolgt werden können14,15,16,17. Die Herzröhre der Fruchtfliege befindet sich auf der dorsalen Seite ihres Körpers innerhalb von 200 μm von der Nagelhautoberfläche, so dass sichtbares bis nahinfrarotes Licht die Herzröhre erreichen kann. Dieses anatomische Merkmal ermöglicht eine nicht-invasive optische Stimulation des Drosophila-Herzens mit vorhandenen optogenetischen Werkzeugen.
Zur Überwachung des Drosophila-Herzens wurde ein kundenspezifisches optisches Kohärenztomographie (SD-OCT) im Spektralbereich mit einem integrierten Rotlicht-LED-Anregungsmodul entwickelt18. Morphologische und rhythmische Veränderungen in einem relativ einfachen Fruchtfliegenherz können mit dieser nicht-invasiven biomedizinischen Bildgebungstechnologie 12,19,20,21 leicht analysiert werden. Mit verbesserter optischer Schnittleistung und räumlicher Auflösung im Mikrometerbereich wurde OCT erfolgreich eingesetzt, um die Struktur des Drosophila-Herzens in verschiedenen Entwicklungsstadien zu untersuchen und zu überwachen, einschließlich der 3. Instar-Larve und der frühen Puppe18. Dieses System ermöglicht auch die gleichzeitige Überwachung und Stimulation des Herzzustandes der Drosophila im intakten Tier. Abbildung 1 zeigt eine schematische Darstellung des OAT-Systems. Das SD-OCT-System verwendet eine Superlumineszenzdiode (SLD) als Lichtquelle (Mittenwellenlänge: 850 nm ± 10 nm, FWHM: 165 nm, siehe Materialtabelle). Mit einem 10-fachen Objektiv kann das OCT-Bildgebungssystem eine axiale Auflösung von ~4,4 μm in Luft und ~3,3 μm im Gewebe und eine laterale Auflösung von ~2,8 μm erreichen, genug, um feine Details der Fliegenherzstrukturen aufzulösen18,22. Interferenzsignale des reflektierten Lichts vom Referenzarm und vom Probenarm werden mit einem Spektrometer mit einer 2048-Pixel-Zeilenkamera erfasst (max. Zeilenrate: 80 kHz, siehe Materialtabelle). Die gemessene Systemempfindlichkeit beträgt ~95,1 dB. Jeder B-Mode-OAT-Scan erzeugt ein Querschnittsbild in der xz-Bildebene. Wiederholte B-Mode-Bilder werden am selben Ort aufgenommen, um M-Mode-Bilder zu erstellen, die das schlagende Herz für über ~ 30 s 18,22,23 erfassen. Die Bildrate für die M-Mode-Bildgebung beträgt ~125 Bilder / s, genug, um die Herzschlagdynamik der Fruchtfliegen zu erfassen.
Zur optogenetischen Regulation der Drosophila-Herzfunktion ist ein Beleuchtungsmodul mit einer 617 nm LED-Lichtquelle in den Probenarm des SD-OCT-Systems integriert. Das Stimulationslicht wird auf einen Punkt mit einem Durchmesser von ~2,2 mm auf der Probenoberfläche fokussiert, an der gleichen Position wie der Bildfokuspunkt. Eine speziell geschriebene Software wird verwendet, um den Beleuchtungsmodus (Lichtintensität, Pulsbreite und Tastverhältnis) zu steuern, die Lichtimpulsstimulationsfrequenz anzupassen und die LED-Modulbeleuchtung und die M-Mode-OCT-Bildgebungserfassung zu synchronisieren22.
Neuere Publikationen beschrieben das transgene System Drosophila, bestehend aus raumzeitlich regulierten ChR2-, ReaChR- und eNpHR2.0-Opsinen unter Verwendung des UAS/GAL4-Gensystems. Die erhaltenen Ergebnisse haben die Fähigkeit gezeigt, Herzstillstand und Bradykardie zu initiieren, die durch Rotlichtaktivierung von eNpHR2.0 verursacht werden, und eine höhere Frequenz, die durch die Aktivierung von ChR2 mit blauem Licht verursacht wird. Ähnliche Stimulierungsexperimente wurden mit einem anderen Kanalrhodopsin, ReaChR, durchgeführt, das durch Rotlichtbeleuchtung22,23,24 induzierbar ist. Die Opsinexpression in allen beschriebenen Experimenten wurde durch 24B-GAL4 gesteuert, wobei die Opsinexpression in einem breiten Spektrum von Geweben, einschließlich Kardiomyozyten und umgebenden Muskelzellen, beobachtet wurde. In der aktuellen Studie wurde 24B-GAL4 durch einen Hand-GAL4-Treiber ersetzt, um eine herzspezifische eNpHR2.0- und ReaChR-Opsin-Expression zu erreichen.
Insgesamt zeigen die vorgestellten experimentellen Ergebnisse einen wiederherstellbaren Herzstillstand und induzierbare Bradykardie und Tachykardie-Herzerkrankungen. Ein detailliertes Protokoll mit Schritt-für-Schritt-Anleitungen zur Erstellung transgener Drosophila-Modelle und zur Durchführung simultaner OCT-Bildgebung und optogenetischer Stimuling-Experimente an lebenden Tieren wird bereitgestellt.
Protokoll
Für die vorliegende Studie wurde eNpHR2.0 transgene Linie w[*]; P{y[+t7.7] w[+mC]=UAS-eNpHR-YFP}attP2, ReaChR transgene Linie w[*]; P{y[+t7.7] w[+mC]=UAS-ReaChR}su(Hw)attP5/CyO, und herzspezifischer GAL4-Treiber, der das Handgen-regulatorische Fragment w[1118] enthält; P{y[+t7.7] w[+mC]=GMR88D05-GAL4}attP2/TM3 Sb[1] (dieser Treiberbestand wird als Hand-GAL4 angegeben) wurden verwendet. y[*] w[*]; P{w[+mC]=UAS-2xEGFP}AH3 wurde als GFP-Reporterzeile verwendet. Die erwähnten Drosophila-Bestände wurden vom Bloomington Drosophila Stock Center (BDSC, siehe Table of Materials) bezogen und bei Raumtemperatur oder bei 18 °C auf Standard-Maismehlmedien aufbewahrt. Die in dieser Studie entwickelten Drosophila-Modelle stehen auf Anfrage für kollaborative Arbeiten zur Verfügung.
1. Drosophila genetische Kreuzungen und Medienpräparation
- Ändern Sie den 3. Chromosomenbalancer TM3 Sb[1] in TM6 Sb Tb, wodurch w[1118]; P{y[+t7.7] w[+mC]=GMR88D05-GAL4}attP2/TM6 Sb Tb (Hand-GAL4/TM6 Sb Tb). Siehe ergänzende Abbildung 1 für das Kreuzungsschema. Kreuze in Fläschchen mit normalem Maismehlmedium setzen.
HINWEIS: Das Vorhandensein eines Tb-Markers ermöglicht es Benutzern, Larven und Puppen, die Opsin-Transgen und den GAL4-Treiber enthalten, von Tieren zu unterscheiden, die Opsin, aber keinen Treiber25 enthalten. - Bewahren Sie die genetischen Kreuzungen in einem Inkubator mit 25 °C und 70% Feuchtigkeit auf speziell formulierten all-trans RetinaI (ATR)-haltigen Medien (siehe Materialtabelle) für 5 Tage für die Larvensammlung und 6 Tage für die Puppensammlung im Dunkeln auf.
- Kombinieren Sie fünf Hand-GAL4 /TM6 Sb Tb jungfräuliche Weibchen und zwei bis drei Männchen aus UAS-opsin-Beständen (eNpHR2.0 oder ReaChR) pro Durchstechflasche. Siehe das Kreuzdiagramm für eNpHR2.0 und ReaChR-Opsin in Abbildung 2A bzw. Abbildung 2B.
- Bereiten Sie am nächsten Tag ATR-haltige Medienfläschchen vor.
- Bereiten Sie halbdefinierte Lebensmittel gemäß den Anweisungen von BDSC26 zu. Anstelle von Saccharose und Glukose nur Saccharose (5,14 g / 100 ml) hinzufügen. Unter ständigem Rühren auf ~60 °C abkühlen.
- Bereiten Sie schmale Fläschchen vor und fügen Sie 50 μL 100 mM ATR-Ethanollösung zu jeder Durchstechflasche hinzu.
- Entsorgen Sie das Fliegenfutter mit einer serologischen Pipette in schmale Fläschchen, 5 ml pro Durchstechflasche. Wirbel bei maximaler Geschwindigkeit für 10 s.
- Stecken Sie die Durchstechflaschen ein und wickeln Sie sie in den dunklen Stoff, um sie vor Licht zu schützen. Durchstechflaschen mindestens 12 h (über Nacht) trocknen lassen.
- Am nächsten Tag übertragen Sie die Fliegen stetig Eier aus Schritt 1.3. in die Durchstechflaschen mit ATR-haltigen Lebensmitteln (Schritt 1.4.4.). Schützen Sie die Racks mit Durchstechflaschen vor Licht.
- Nach 24-48 h (abhängig von der Anzahl der gelegten Eier) verwerfen Sie die Eltern, um eine Überbevölkerung der Durchstechflasche zu vermeiden.
- Sammeln Sie Nicht-Tb-Nachkommen und verwenden Sie sie für die Herzbildgebung.
HINWEIS: Die phänotypischen Unterschiede im Larven- und Puppenstadium sind in Abbildung 2C dargestellt. Die Zusammenfassung und der ungefähre Zeitplan der Probenvorbereitungsschritte sind in Abbildung 3 dargestellt.
2. Optogenetische Kontrolle des Drosophila-Herzens
- Nehmen Sie UAS-opsin/Hand-GAL4 Larve/Puppe aus der Durchstechflasche (Schritt 1.7.), legen Sie ein Taschentuch auf und wischen Sie das Medium vorsichtig mit einem Malpinsel von der Körperoberfläche ab.
- Bereiten Sie den Objektträger vor und legen Sie ein kleines Stück doppelseitiges Klebeband in die Mitte.
- Legen Sie die Larve / Puppe vorsichtig mit der Rückenseite nach oben und senkrecht zur langen Seite des Objektträgers mit einer Bürste oder einer feinen Pinzette auf die Bandoberfläche. Üben Sie leichten Druck aus, um die Larve/Puppe an der Bandoberfläche zu befestigen.
- Stellen Sie die Folie auf der Bildgebungsbühne auf, Larve / Puppe mit dem Gesicht nach unten.
- Schalten Sie die OAT-Lichtquelle mithilfe der Lasersteuerungssoftware ein (siehe Materialtabelle). Öffnen Sie die benutzerdefinierte SD-OCT-Steuerungssoftware, und klicken Sie dann auf das Vorschaufenster .
- Stellen Sie die Scanparameter in der SD-OAT-Software ein.
HINWEIS: Ziel ist es, die Probe für eine optimale Bildgebung des schlagenden Herzens auszurichten, so dass die Auswahl des X- und Y-Bereichs die Region des Herzens abdeckt. In diesem Schritt beträgt sowohl die Anzahl der A-Scans als auch die Anzahl der B-Scans 400. Der Bereich in x- und y-Richtung beträgt ~490 μm und ~537 μm und zeigt die beiden orthogonalen Querschnitte des Herzens (xz bzw. yz). - Verwenden Sie Mikromanipulatoren, um den Probentisch zu steuern, um das Fliegenherz in den Fokus zu bringen. Stellen Sie die Fokusposition ein, um die Lichtreflexion von der Oberfläche der Fliegenkutikula zu minimieren. Erwägen Sie, Mineralöl auf die Larven- / Puppenoberfläche aufzutragen, um die Reflexion zu minimieren.
HINWEIS: Öl kann das Risiko von Tierbewegungen erhöhen, indem es die Klebebandeigenschaften beeinträchtigt. - Stellen Sie sicher, dass das Fliegenherz im Bildfenster vollständig betrachtet werden kann, ohne Verzerrungen, die durch Gewebe und nicht zu vernachlässigende Schatten und Reflexionen blockiert werden. Andernfalls fahren Sie mit Schritt 2.7 fort.
- Legen Sie die Scanparameter für die M-Mode-OAT-Bildaufnahme fest.
HINWEIS: Die Anzahl der A-Scans ist im Vergleich zu Schritt 2.7 reduziert. für die schnellere Bildrate, um die Schlagdynamik des Fliegenherzens (mehrere Hz) zu erfassen. Die Anzahl der B-Scans gibt die Anzahl der wiederholten Bilder für die M-Mode-Bildgebung an, die basierend auf der Aufnahmezeit und dem verfügbaren Systemspeicher angepasst werden kann. In diesem Experiment können 128 A-Scans eine Geschwindigkeit von ~125 Bildern/s ermöglichen, und 4.000 wiederholte B-Scans werden aufgezeichnet, was eine kontinuierliche Aufzeichnung von ~32 s ermöglicht. - Erfassen Sie fünf Kontrolldatensätze ohne Rotlichtstimulationsimpulse, um die Ruheherzfrequenz (RHR) zu berechnen.
- Entwerfen Sie den Lichtimpuls für die Schrittmacherstimulation in der benutzerdefinierten OCT-Steuerungssoftware. Fügen Sie unter "Einstellungen" die entworfenen Lichtpulssequenzen hinzu, um Pulsfrequenz, Pulsbreite, Stimulationsdauer und Wartezeit nach verschiedenen Stimulationsprotokollen zu steuern.
ANMERKUNG: Der RHR wird aus dem Kontrollexperiment ohne Lichtbeleuchtung gemessen und zur Berechnung der Frequenz verwendet, mit der Licht für Tachypacing- und Bradypacing-Experimente gepulst werden sollte22. - Öffnen Sie die Lichtsteuerungssoftware (siehe Materialtabelle), um Rotlichtimpulse zu erzeugen. Wählen Sie unter "Modusauswahl" den Pulsmodus . Doppelklicken Sie auf die Abbildung für die Einstellungen "Pulsprofil" und wählen Sie Follower-Modus. Halten Sie die OFF-Intensität auf 0 und legen Sie den ON-Intensitätsprozentsatz bei der Berechnung der tatsächlichen Leistungsdichte fest.
HINWEIS: Stimulationslichtimpulse werden durch ein Signal der OCT-Steuerungssoftware gemäß den Einstellungen in Schritt 2.12 ausgelöst. - Erfassen Sie M-Mode-Videos des schlagenden Drosophila-Herzens mit Lichtstimulation, indem Sie in der OCT-Steuerungssoftware auf Acquire klicken. Wiederholen Sie die Messungen 5x.
3. Bildanalyse
- Öffnen Sie die speziell entwickelte Fliegenherz-Segmentierungssoftware.
- Klicken Sie auf Datei auswählen und wählen Sie dann die zu analysierende Datei in der angezeigten GUI aus.
- Geben Sie sowohl die vertikalen als auch die horizontalen Grenzen der Herzregion in Pixel in die oberen Textfelder ein. Klicken Sie auf Größe ändern. Stellen Sie mit dem Schieberegler unten sicher, dass die gesamte Herzregion sichtbar ist und die gesamte Box für die gesamte Kollektion ausgefüllt wird. Wenn dies nicht der Fall ist, wiederholen Sie diesen Vorgang und passen Sie die Grenzen an.
- Klicken Sie auf Vorhersagen , um die Herzregion vorherzusagen. Das Programm geht nun jede Scheibe in der Sammlung durch und wählt die Herzregion aus, was ungefähr 3 Minuten dauert.
- Klicken Sie auf HR Plot , sobald die Vorhersage abgeschlossen ist. Dadurch wird ein neues Fenster geöffnet, in dem ein Diagramm des Herzbereichs im Laufe der Zeit angezeigt wird. Stellen Sie sicher, dass die richtigen Gipfel- oder Talbereiche ausgewählt sind. Wählen Sie Pulse und dann HR , um eine endgültige Zahl zu generieren, und die Funktionsparameter werden gleichzeitig in den .csv Dateien gespeichert.
Ergebnisse
D. melanogaster Tiere, die rotlichtempfindliche Opsine eNpHR2.0 oder ReaChR in der Herzröhre exprimieren, wurden durch Nachkommen aus der Kreuzung zwischen jeder transgenen UAS-opsin-Linie und dem Hand-GAL4-Treiber erzeugt. Die Gewebespezifität des GAL4-Treibers wurde durch Bildgebung der GFP-Expression verifiziert (Abbildung 4). Drosophila 3rd instar Larve und frühe Puppenentwicklungsstadien wurden verwendet, um die Auswirkungen von eNpHR2.0 und ReaChR-Aktivierung durch rotes Licht zu demonstrieren. Entworfene ~617 nm Rotlichtimpulse, geliefert per LED, beleuchteten die Larve/Puppe und aktivierten den eNpHR2.0 und ReaChR im Herzen. Obwohl die berichtete maximale Ansprechwellenlänge von NpHR ~580 nm und von ReaChR ~600 nm beträgt, kann 617 nm Lichtbeleuchtung tiefer eindringen mit erhöhter Lichtenergieabgabe in Richtung des Opsin-exprimierenden Herzgewebes22.
Auf dem Objektträger mit der Rückenseite nach unten im inversen Mikroskopaufbau montiert, wurde die Larve/Puppe von einem LED-Lichtstrahl beleuchtet, der auf das A7-Körpersegment gerichtet war. Beispiele für die Körperquerschnittsbilder sind in Abbildung 5A und Abbildung 6A dargestellt. Das Herz erscheint als kontrahierende und sich erweiternde Kreisform in den Videoaufnahmen, die aus 4.000 Bildern bestehen (Ergänzende Videos 1-6). Um verschiedene Herzerkrankungen nachzuahmen, wurden vier Arten von Lichtimpulsen entwickelt. Ein einzelner Puls, der 10 s nach 5 s Wartezeit dauerte, erzeugte einen wiederherstellbaren Herzstillstand, der durch eNpHR2.0 induziert wurde, wie in Abbildung 5B dargestellt. Für die Herzfrequenz bei Frequenzen, die langsamer als die Ruheherzfrequenz (RHR) sind, vermittelt durch eNpHR2.0, wurden zwei Lichtpulssequenzen mit Schrittfrequenzen gleich RHR/2 und RHR/4 verwendet, die 8 s dauern und eine Wartezeit von 6 s dazwischen haben (Abbildung 5C). Das Tastverhältnis jeder Lichtimpulsfolge betrug 90%. Dieses Lichtstimulationsregime verursachte eine Herzerkrankung, die an Bradykardie erinnerte. Das Stimulationsmuster zur Erhöhung der Herzfrequenz aufgrund der ReaChR-Aktivierung bestand aus drei Sequenzen von Lichtimpulsen bei Frequenzen von RHR + 0,5 Hz, RHR + 1 Hz bzw. RHR + 1,5 Hz mit einer Pulsbreite von 20 ms (Abbildung 5D). Dieses Pulsregime zielte darauf ab, eine tachykarde Herzerkrankung zu verursachen. Die Lichtleistungsdichte betrug bei allen Experimenten 7,49 mW/mm2. Für Kontrollexperimente wurde keine Lichtbeleuchtung eingestellt.
Jede experimentelle Variante wurde fünfmal aufgenommen. M-Mode-Videos des Fliegenherzens wurden mit FlyNet 2.027 zu 2D-Masken verarbeitet. Diese Software segmentiert automatisch die Herzregion, um die Herzfunktionsdatensätze zu erstellen. Das Programm bietet eine Maske des Herzens in jedem Frame, die bei Bedarf manuell weiter korrigiert werden kann, um eine genaue Quantifizierung der funktionellen Parameter des schlagenden Herzens zu generieren, wie Herzfrequenz (HR), enddiastolische Dimension (EDD) und endsystolische Dimension (ESD), fraktionierte Verkürzung (FR), enddiastolischer Bereich (EDA), endsystolischer Bereich (ESA) usw. Die Herzfrequenz wird gemessen, indem der Herzbereich im Laufe der Zeit analysiert wird. Das Kontrollvideo ohne Lichtimpulse wird verwendet, um eine Basisherzfrequenz (z. B. RHR) für jedes Tier zu ermitteln.
Abbildung 5B und Abbildung 6B zeigen 10 s langen Herzstillstand, verursacht durch Hand>eNpHR2.0-Aktivierung mit rotem Licht (617 nm) in Larve bzw. Puppe. Als das rote Licht eingeschaltet wurde, hörte das Herz der Drosophila auf zu schlagen und blieb in diesem Zustand bis zum Ende der Lichtbeleuchtung. Die Herzfunktion wurde wiederhergestellt, nachdem das rote Licht ausgeschaltet wurde. Tiere, bei denen kein Opsin exprimiert wurde ("no opsin"-Kontrolle), reagierten nicht auf die Rotlichtbeleuchtung (ergänzende Abbildung 2A und ergänzende Abbildung 3A). Die Kontrollexperimente mit Hand>eNpHR2.0-Tieren, bei denen die 10 s Rotlichtbeleuchtung nicht eingeschaltet war ("no light"-Steuerung), zeigten einen normalen Herzschlag (Ergänzende Abbildung 4A und Ergänzende Abbildung 4C).
Bei Hand>eNpHR2.0-Tieren wurden Rotlichtimpulse mit Frequenzen unterhalb des RHR angewendet. Die Herzkontraktionsfrequenz wurde nach den Lichtsignalen reduziert; Diese langsamere Herzfrequenz ahmt eine Art von Herzrhythmusstörung nach, Bradykardie (Abbildung 5C bzw. Abbildung 6C für Larve bzw. Puppe). Das langsamere Herztempo wurde in Kontrollexperimenten "kein Opsin" (ergänzende Abbildung 2B und ergänzende Abbildung 3B) und "kein Licht" (ergänzende Abbildung 4A und ergänzende Abbildung 4C) nicht beobachtet.
Eine Erhöhung der Herzfrequenz kann erreicht werden, indem Hand>ReaChR-Opsin mit Rotlichtpulsfolgen bei einer Frequenz aktiviert wird, die höher ist als die RHR des jeweiligen Tieres. Eine Serie von drei Lichtpulsfolgen mit unterschiedlichen Stimulationsfrequenzen (z.B. RHR + 0,5 Hz, RHR + 1 Hz, RHR + 1,5 Hz) wurde auf Hand>ReaChR-Larven und Puppenherzen aufgetragen. Die erhaltenen Daten zeigen deutlich eine erhöhte Herzfrequenz nach den Lichtimpulsen (Abbildung 5D bzw. Abbildung 6D für Larve bzw. Puppe). Die in diesen Experimenten nachgewiesene Herzerkrankung ahmt Tachykardie nach. Negativkontrollexperimente sind in der ergänzenden Abbildung 2C, der ergänzenden Abbildung 3C und der ergänzenden Abbildung 4B,D dargestellt.
Insgesamt zeigen die Ergebnisse die Machbarkeit einer nicht-invasiven und spezifischen optogenetischen Steuerung des Herzrhythmus in verschiedenen Entwicklungsstadien in transgenen Tiermodellen von D. melanogaster.
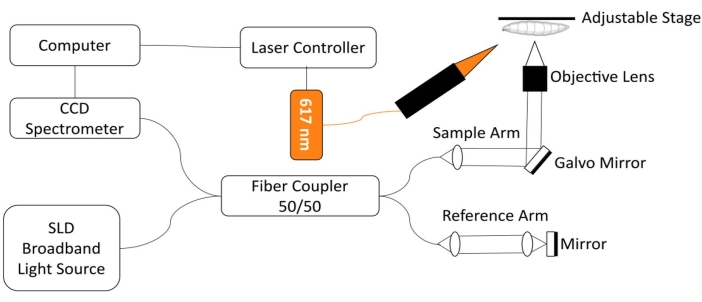
Abbildung 1: OCT-Bildgebungssystem integriert mit 617 nm LED-Modul zur optogenetischen Kontrolle der Drosophila-Herzfunktion. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
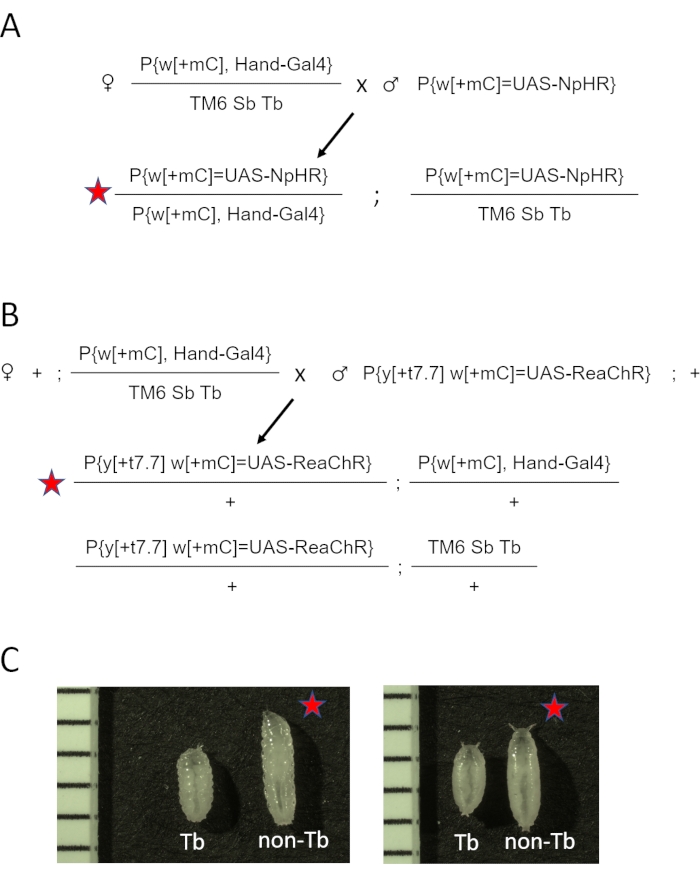
Abbildung 2: Erzeugung von D. melanogaster Tieren, die Opsin im Herzen exprimieren. (A) Genetisches Kreuzdiagramm. Weibchen Hand-GAL4/TM6 SbTb wurden mit Männchen gekreuzt, die eNpHR2.0 trugen. Die resultierenden Hand-GAL4/eNpHR2.0-Nachkommen (markiert durch den roten Stern) wurden für die OCT-Bildgebung gesammelt, und Hand-GAL4/TM6 Sb Tb wurden aufgrund ihres phänotypischen Aussehens verworfen. (B) Genetisches Kreuzdiagramm. Weibchen Hand-GAL4/TM6 SbTb wurden mit Männchen gekreuzt, die ReaChR trugen. Die resultierenden Hand-GAL4/ReaChR-Nachkommen (markiert durch den roten Stern) wurden für die OCT-Bildgebung gesammelt, und Hand-GAL4/TM6 Sb Tb wurden aufgrund ihres phänotypischen Aussehens verworfen. (C) Phänotypische Unterschiede zwischen Hand-GAL4/opsin (roter Stern) und Hand-GAL4/TM6 Tb-Nachkommen. Tiere, die die Tb-Genmutation auf dem TM6-Chromosom tragen, haben eine "tubby" Körperform im Vergleich zu normalen, nicht-Tb-Larven oder -Puppen. Das linke Bild zeigt Larven; Das rechte Feld zeigt frühe Puppen. Die Bilder enthalten auch ein Lineal mit 1 mm Markierungen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
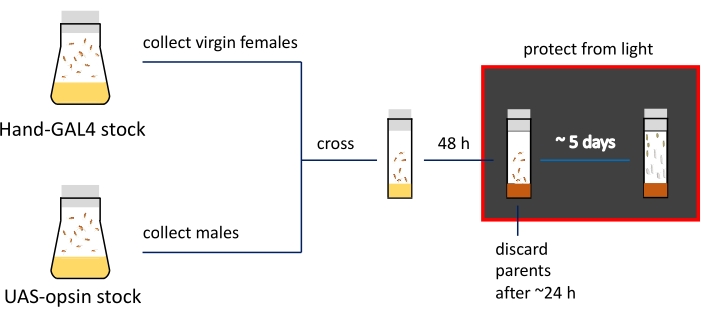
Abbildung 3: Schematische Darstellung und Zeitleiste der bildgebenden Präparationsverfahren. Elternbestände werden in Fliegenflaschen gehalten; Jungfrau Weibchen und Männchen werden in schmalen Fläschchen gekreuzt, die mit normaler Nahrung gefüllt sind (gekennzeichnet durch gelbe Farbe). Aktiv eierlegende Fliegen werden auf ATR-haltige Medien (braun dargestellt) Durchstechflaschen übertragen. Fläschchen mit sich entwickelnden Nachkommen müssen von diesem Schritt im Dunkeln gehalten werden. 3. Instar-Larven und frühe Puppen werden von den Fläschchenwänden für die Bildgebung gesammelt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
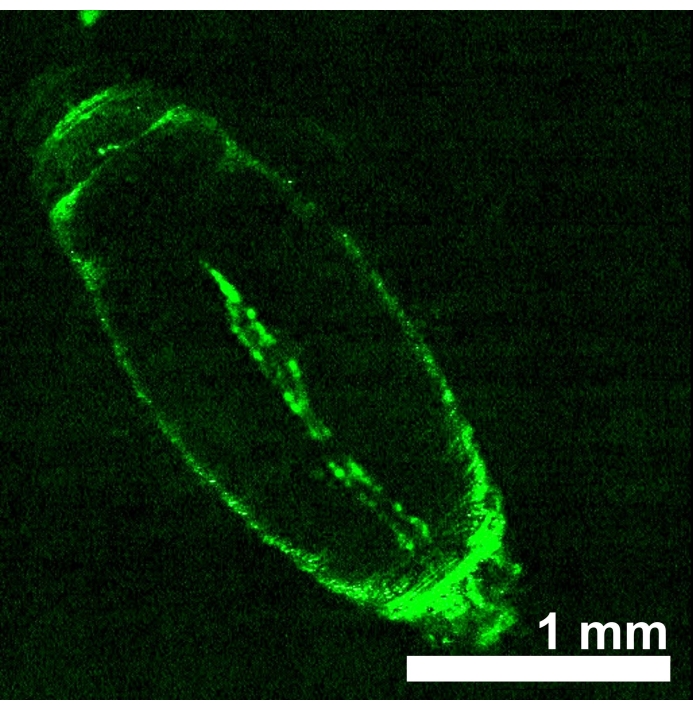
Abbildung 4: D. melanogaster frühe Puppe, die UAS-GFP (BDSC 6658) exprimiert, angetrieben von Hand-GAL4 (BDSC 48396). Das Fluoreszenzmuster bestätigt die Herzspezifität des Hand-GAL4-Treibers . Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
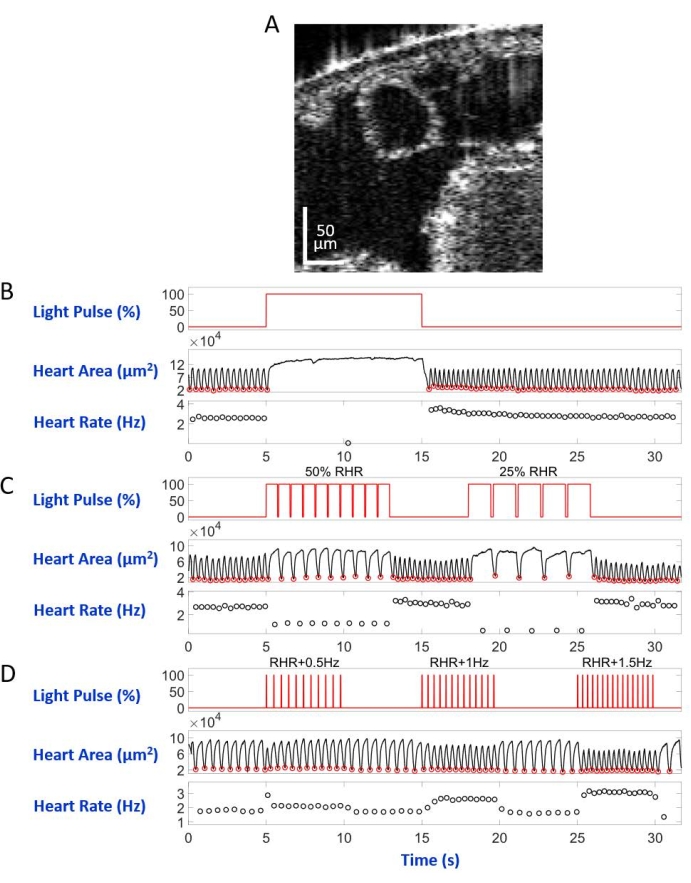
Abbildung 5: Simulation von Herzstillstand, Bradykardie und Tachykardie bei D. melanogaster Larve. (A) OCT-Aufnahme eines Larvenkörperquerschnitts. Das Herz erscheint als Kreis unter der Körperoberfläche. (B) Grafische Darstellung des wiederherstellbaren Herzstillstands. Das obere Feld zeigt das Timing (X-Achse) der Rotlichtbeleuchtung (Y-Achse, Prozentsatz der Lichtquellenleistung). Das mittlere Feld zeigt die Veränderung des Herzbereichs (Y-Achse, Quadratmikrometer) im Laufe der Zeit (X-Achse). Das untere Feld zeigt die Herzfrequenzänderung (Y-Achse, Hertz) im Zeitverlauf (X-Achse). (C) Grafische Darstellung der eNpHR2.0-vermittelten restaurierbaren Bradykardie. Das obere Feld zeigt Impulse der Rotlichtbeleuchtung, die zwei Bradykardieperioden auslösen: 50% der RHR und 25% der RHR. Herzbereichs- und Herzfrequenzänderungen sind auf dem mittleren bzw. unteren Feld dargestellt. (D) Grafische Darstellung des Herzschrittes durch aktiviertes ReaChR. Das obere Bild zeigt eine Reihe von 20 ms Rotlichtimpulsen, die bei den Frequenzen RHR + 0,5 Hz, RHR + 1 Hz und RHR + 1,5 Hz auftreten. Die Herzkontraktionen folgen den Lichtpulsfrequenzen, wie auf den mittleren und unteren Feldern gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
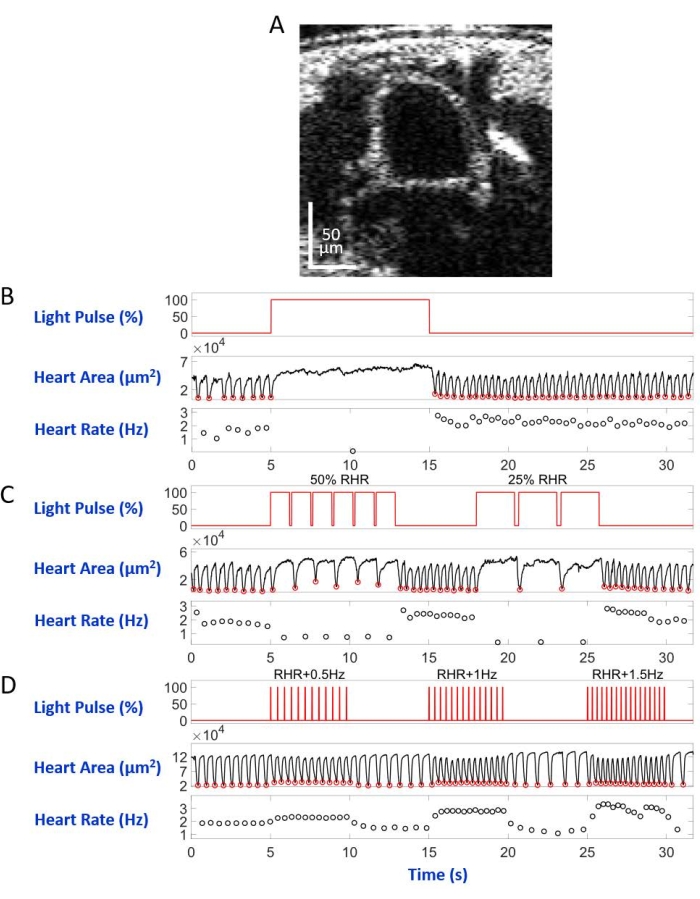
Abbildung 6: Simulation von Herzstillstand, Bradykardie und Tachykardie bei D. melanogaster Puppe . (A) OCT-Bild des Puppenkörperquerschnitts. Das Herz erscheint als Kreis unter der Körperoberfläche. (B) Grafische Darstellung des wiederherstellbaren Herzstillstands. Das obere Feld zeigt das Timing (X-Achse) der Rotlichtbeleuchtung (Y-Achse, Prozentsatz der Lichtquellenleistung). Das mittlere Feld zeigt die Veränderung des Herzbereichs (Y-Achse, Quadratmikrometer) im Laufe der Zeit (X-Achse). Das untere Feld zeigt die Herzfrequenzänderung (Y-Achse, Hertz) im Zeitverlauf (X-Achse). (C) Grafische Darstellung der eNpHR2.0-vermittelten restaurierbaren Bradykardie. Das obere Feld zeigt Impulse der Rotlichtbeleuchtung, die zwei Bradykardieperioden auslösen: 50% der RHR und 25% der RHR. Das mittlere und untere Feld zeigen Herzbereichs- bzw. Herzfrequenzänderungen. (D) Grafische Darstellung des Herzschrittes durch aktiviertes ReaChR. Das obere Bild zeigt eine Reihe von 20 ms Rotlichtimpulsen bei den Frequenzen RHR + 0,5 Hz, RHR + 1 Hz und RHR + 1,5 Hz. Die Herzkontraktionen folgen den Frequenzen des Lichtimpulses, wie auf den mittleren und unteren Feldern gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Abbildung 1: Genetische Kreuzungen ersetzen TM3 Sb Balancer Chromosom durch TM6 Sb Tb. Junge Weibchen Hand-GAL4 w+/ TM3 Sb wurden mit nub-GAL4NP3537 tub-GAL80ts w+/ TM6 Sb Tb Männchen gekreuzt. Hand-GAL4 w+/ TM6 Sb Tb Nachkommen, einschließlich jungfräulicher Weibchen und Männchen, wurden ausgewählt (Screening auf pigmentierte Augen kombiniert mit tubbyer Körperform). Ausgewählte Fliegen wurden selbst gekreuzt, um einen stabilen Bestand zu etablieren. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: In Kontrollexperimenten ändert sich der Herzrhythmus der Wildtyplarve bei Rotlichtbeleuchtung nicht. (A) Während der Rotlichtbeleuchtung in der Wattlarve wurde kein Herzstillstand beobachtet. Das obere Feld zeigt die M-Mode-Herzbilder. Die rote Linie zeigt den Beleuchtungszeitpunkt an. Das mittlere und untere Feld zeigen den Herzbereich und die Herzfrequenz während der 32 s Bildgebungszeit. (B,C) Rotlichtimpulse verändern die Herzfrequenz in der Larve nicht. Die oberen Felder zeigen die M-Mode-Herzbilder. Die rote Linie zeigt den Beleuchtungszeitpunkt an. Das mittlere und untere Feld zeigen den Herzbereich und die Herzfrequenz während der 32 s Bildgebungszeit. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 3: In Kontrollexperimenten ändert sich der Herzrhythmus der Wildtyppuppe bei Rotlichtbeleuchtung nicht. (A) Während der Rotlichtbeleuchtung in der Wattlarve wurde kein Herzstillstand beobachtet. Das obere Feld zeigt die M-Mode-Herzbilder. Die rote Linie zeigt den Beleuchtungszeitpunkt an. Das mittlere und untere Feld zeigen den Herzbereich und die Herzfrequenz während der 32 s Bildgebungszeit. (B,C) Rotlichtimpulse verändern die Herzfrequenz in der WT-Puppe nicht. Die oberen Felder zeigen die M-Mode-Herzbilder. Die rote Linie zeigt den Beleuchtungszeitpunkt an. Das mittlere und untere Feld zeigen den Herzbereich und die Herzfrequenz während der 32 s Bildgebungszeit. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 4: D. melanogaster Larven und Puppen, die Hand> eNpHR2.0 oder Hand>ReaChR exprimieren, zeigen keine signifikanten HR-Veränderungen während der OCT-Bildgebung ohne Rotlichtbeleuchtung. (A) Die Herzfrequenz der Hand>eNpHR2.0-Larve. (B) Die Herzfrequenz der Hand>ReaChR-Larve . (C) Die Herzfrequenz der Hand>eNpHR2.0-Puppe. (D) Die Herzfrequenz der Hand>ReaChR-Puppe . Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzendes Video 1: Aktiviertes eNpHR2.0 verursacht Herzstillstand bei D. melanogaster Larve. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video 2: Aktiviertes eNpHR2.0 verursacht Herzstillstand bei D. melanogaster Puppe. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video 3: eNpHR2.0-vermittelte restaurierbare Bradykardie in D. melanogaster Larve. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video 4: eNpHR2.0-vermittelte restaurierbare Bradykardie bei D. melanogaster Puppe. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video 5: Herzschrittbildung durch aktiviertes ReaChR bei D. melanogaster Larve. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video 6: Herzschrittbildung durch aktiviertes ReaChR bei D. melanogaster Puppe. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Diskussion
Im Vergleich zu unseren früheren Berichten, in denen die Expression von Opsinen nicht nur im Herzen, sondern auch im umgebenden Muskelgewebe gesteuert wurde, berichtet die vorliegende Arbeit über einen herzspezifischen Treiber, Hand-GAL4. Diese neue Hand> Opsin-Genkonfiguration , die für die optogenetische Herzregulation verwendet wird, bestätigt die zuvor berichteten Ergebnisse und etabliert ein besseres kardiovaskuläres Drosophila-Forschungsmodell .
Die Medienvorbereitung ist essentiell für den Erfolg der Experimente. Opsinproteine benötigen einen Liganden, all-trans retinal (ATR), um zu funktionieren28. Fliegen produzieren nicht genug ATR, daher muss ATR zu den Fliegenmedien ergänzt werden. In dieser Studie wurde das zuvor berichtete Instant-Food durch Semi-Defined media29 ersetzt. Die neue Rezeptur von ATR-haltigen Medien wurde eingeführt, um eine gleichmäßige Verteilung der ATR zu gewährleisten. ATR ist in Wasser nicht löslich; Wenn ethanolbasiertes 100 mM ATR-Material zu wasserbasierten Medien hinzugefügt wird, wird es durch Wirbeln der Fläschchen mit warmen halbdefinierten Medien dispergiert. Außerdem wurde die zuvor berichtete ATR-Konzentration von 10 mM für eNpHR2.0 und 3 mM für ReaChR22 auf eine Endkonzentration von 1 mM für beide reduziert. Diese Konzentration ist ausreichend, um eine ordnungsgemäße eNpHR2.0- und ReaChR-Funktion zu gewährleisten.
Ein wesentlicher Bestandteil des experimentellen Erfolgs ist die verbesserte Datenverarbeitung mit FlyNet 2.027. Das Labor hat diese Software weiterentwickelt, um sowohl die Recheneffizienz als auch die Genauigkeit des automatisierten Fliegenherz-Segmentierungsalgorithmus zu verbessern. Die von dieser Software erzeugten Querschnittsmasken werden verwendet, um physiologische Daten von Drosophila wie fraktionierte Verkürzung und Herzwandgeschwindigkeit abzuleiten. Dieser Ansatz hat eine effiziente Datenanalyse mit minimaler menschlicher Überwachung ermöglicht, wodurch es schneller und zuverlässiger wird, die Herzfunktion für große Fliegenherz-Bildgebungsdatensätze zu charakterisieren.
Myokardinfarkt bleibt die häufigste Todesursache, und Myokardischämie trägt zu zwei Dritteln aller Fälle von Herzinsuffizienz bei, die sich schnell zu den Hauptursachen für Mortalität und Morbidität in den Vereinigten Staaten entwickelt30. Die Entwicklung neuer Therapeutika und Medizinprodukte erfordert ein tiefes Wissen über die Mechanismen von Herzerkrankungen auf physiologischer und biochemischer Ebene. Diese Ziele können mit Hilfe von Modellorganismen erreicht werden. D. melanogaster hat sich als eines der zuverlässigsten und effizientesten Modelle 31,32,33,34,35 etabliert. Diese Arbeit hat die simulierten Drosophila-Herzerkrankungsmodelle hervorgebracht, die durch einen nicht-invasiven optogenetischen Ansatz induziert wurden. Die Entwicklung nicht-invasiver optischer Herzschrittmachertechnologien bildet die Grundlage für die Entwicklung einer Alternative zu herkömmlichen elektrischen Herzschrittmachern. Die Verwendung von OCT zur Beobachtung der Herzfunktion in Echtzeit ermöglicht es Studien, die relevante Herzphysiologie in Drosophila-Modellen für fortgeschrittene Untersuchungen, einschließlich des Screenings von Medikamentenkandidaten, genau zu charakterisieren. Die OCT-Bildgebung hat eine Eindringtiefe von ~ 1 mm, was für Drosophila-Herzstudien gut funktioniert, aber ihre Verwendung zur Charakterisierung der Herzfunktion in größeren Tiermodellen einschränkt. Darüber hinaus stellt die direkte Übertragung der Drosophila-Forschung auf Säugetiermodelle eine Herausforderung dar. Neue optogenetische Werkzeuge müssen entwickelt werden, um die Empfindlichkeit der Opsine zu verbessern und sie auf verschiedene Modellsysteme wie Zebrafische, Mäuse, Ratten und menschliche Herzorganoide für die kardiovaskuläre Forschung zu übertragen.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Die Autoren danken Andrey Komarov, Yuxuan Wang und Jiantao Zhu für ihre Unterstützung bei der Datenanalyse und den Mitgliedern des Zhou-Labors für ihre wertvollen Diskussionen. Die Arbeit in Dr. Zhous Labor wurde durch einen Start-up-Fonds der Washington University in St. Louis, die National Institutes of Health (NIH) Grants R01-EB025209 und R01-HL156265 sowie den Clayco Foundation Innovative Research Award unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| All-trans retinal | Cayman Chemicals | 18449 | |
| Bacto Peptone | Gibco | 02-10-2025 | |
| BioLED Light Source Control Module, 4-channel | Migtex Systems | BLS-SA04-US | Part of the optogenetic stimulation module |
| Broadband Light Source Module | Superlum | cBLMD-T-850-HP | Part of the SD-OCT imaging system |
| Cobra-S 800 OCT Spectrometers | Wasatch Photonics | CS800-840/180-80-OC2K-U3 | Part of the SD-OCT imaging system |
| Delicate Task Wipers | Kimberly-Clark Professtional | 34155 | tissues |
| Drosophila agar | Genesee Scientific | 66-103 | |
| Drosophila culture bottles | Genesee Scientific | 32-131 | |
| FlyNet 2.0 Software | Z-Lab | Custom software for fly heart segmentation and heart function analysis developed in the Zhou lab | |
| High-Power LED Collimator Sources | Migtex Systems | BLS-LCS-0617-03-22 | Part of the optogenetic stimulation module |
| Inactive dry yeast | Genesee Scientific | 62-106 | |
| Microscope slides | AmScope | BS-72P | |
| Narrow plugs for Drosophila culture | Genesee Scientific | 59-200 | |
| Narrow vials for Drosophila culture | Genesee Scientific | 32-116SB | |
| Permanent double-sided tape | Scotch | ||
| Plugs for Drosophila bottles | Genesee Scientific | 59-194 | |
| Propionic Acid | Sigma | P1386-1L | |
| SD-OCT control software | Z-Lab | Custom software for image acquisition and pacing control developed in the Zhou lab | |
| SD-OCT imaging and optogenetic pacing system | Z-Lab | Imaging and optogenetic pacing system developed in the Zhou lab (~$50k BOM) | |
| Sucrose | Carolina | 89-2871 | |
| w[*]; P{y[+t7.7] w[+mC]=UAS-eNpHR-YFP}attP2 | Bloomington Drosophila Stock Center (BDSC) | stock # 41752 | eNpHR2.0 transgenic line |
| w[*]; P{y[+t7.7] w[+mC]=UAS-ReaChR}su(Hw)attP5/CyO | Bloomington Drosophila Stock Center (BDSC) | stock # 53748 | ReaChR transgenic line |
| w[1118]; P{y[+t7.7] w[+mC]=GMR88D05-GAL4}attP2/TM3 Sb[1] | Bloomington Drosophila Stock Center (BDSC) | stock # 48396 | Heart specific GAL4 driver containing Hand gene regulatory fragment |
| y[*] w[*]; P{w[+mC]=UAS-2xEGFP}AH3 | Bloomington Drosophila Stock Center (BDSC) | stock #6658 | GFP reporter line |
| Yeast extract | Lab Scientific bioKEMIX | 978-907-4243 |
Referenzen
- Nature Methods. Method of the Year 2010. Nature Methods. 8, 1(2011).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Deisseroth, K. Optogenetics: 10 years of microbial opsins in neuroscience. Nature Neuroscience. 18 (9), 1213-1225 (2015).
- Tsai, H. -C. Phasic firing in dopaminergic neurons is sufficient for behavioral conditioning. Science. 324 (5930), 1080-1084 (2009).
- Wykes, R. C., et al. Optogenetic and potassium channel gene therapy in a rodent model of focal neocortical epilepsy. Science Translational Medicine. 4 (161), (2012).
- Entcheva, E., Kay, M. W. Cardiac optogenetics: a decade of enlightenment. Nature Reviews Cardiology. 18 (5), 349-367 (2021).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
- Arrenberg, A. B., Stainier, D. Y. R., Baier, H., Huisken, J. Optogenetic control of cardiac function. Science. 330 (6006), 971-974 (2010).
- Nussinovitch, U., Gepstein, L. Optogenetics for in vivo cardiac pacing and resynchronization therapies. Nature Biotechnology. 33 (7), 750-754 (2015).
- Nyns, E. C. A., et al. An automated hybrid bioelectronic system for autogenous restoration of sinus rhythm in atrial fibrillation. Science Translational Medicine. 11 (481), (2019).
- Bier, E., Bodmer, R. Drosophila, an emerging model for cardiac disease. Gene. 342 (1), 1-11 (2004).
- Wolf, M. J., Amrein, H., Izatt, J. A., Choma, M. A., Reedy, M. C., Rockman, H. A. Drosophila as a model for the identification of genes causing adult human heart disease. Proceedings of the National Academy of Sciences of the United States of America. 103 (5), 1394-1399 (2006).
- Yu, L., Lee, T., Lin, N., Wolf, M. J. Affecting rhomboid-3 function causes a dilated heart in adult Drosophila. PLOS Genetics. 6 (5), 1000969(2010).
- Cooper, A. S., Rymond, K. E., Ward, M. A., Bocook, E. L., Cooper, R. L. Monitoring heart function in larval Drosophila melanogaster for physiological studies. Journal of Visualized Experiments. (33), e1596(2009).
- Zhu, Y. C., Yocom, E., Sifers, J., Uradu, H., Cooper, R. L. Modulatory effects on Drosophila larva hearts: Room temperature, acute and chronic cold stress. Journal of Comparative Physiology. B, Biochemical, Systemic, and Environmental Physiology. 186 (7), 829-841 (2016).
- Zhu, Y. C., Uradu, H., Majeed, Z. R., Cooper, R. L. Optogenetic stimulation of Drosophila heart rate at different temperatures and Ca2+ concentrations. Physiological Reports. 4 (3), 12695(2016).
- Malloy, C., et al. Using optogenetics to assess neuroendocrine modulation of heart rate in Drosophila melanogaster larvae. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural, and Behavioral Physiology. 203 (10), 791-806 (2017).
- Men, J., et al. Drosophila preparation and longitudinal imaging of heart function in vivo using optical coherence microscopy (OCM). Journal of Visualized Experiments. (118), e55002(2016).
- Choma, M. A., Izatt, S. D., Wessells, R. J., Bodmer, R., Izatt, J. A. In vivo imaging of the adult Drosophila melanogaster heart with real-time optical coherence tomography. Circulation. 114 (2), 35-36 (2006).
- Li, A., et al. Changes in the expression of the Alzheimer's disease-associated presenilin gene in drosophila heart leads to cardiac dysfunction. Current Alzheimer Research. 8 (3), 313-322 (2011).
- Li, A., et al. Silencing of the Drosophila ortholog of SOX5 in heart leads to cardiac dysfunction as detected by optical coherence tomography. Human Molecular Genetics. 22 (18), 3798-3806 (2013).
- Men, J., Li, A., Jerwick, J., Li, Z., Tanzi, R. E., Zhou, C. Non-invasive red-light optogenetic control of Drosophila cardiac function. Communications Biology. 3 (1), 1-10 (2020).
- Alex, A., Li, A., Tanzi, R. E., Zhou, C. Optogenetic pacing in Drosophila melanogaster. Science Advances. 1 (9), 1500639(2015).
- Stanley, C. E., Mauss, A. S., Borst, A., Cooper, R. L. The effects of chloride flux on Drosophila heart rate. Methods and Protocols. 2 (3), 73(2019).
- Lindsley, D. L., Zimm, G. G. The Genome of Drosophila melanogaster. , Elsevier. (1992).
- Bloomington Drosophila Stock Center. , Available from: https://bdsc.indiana.edu/information/recipes/germanfood.html (2022).
- Dong, Z., et al. FlyNet 2.0: Drosophila heart 3D (2D + time) segmentation in optical coherence microscopy images using a convolutional long short-term memory neural network. Biomedical Optics Express. 11 (3), 1568-1579 (2020).
- Deisseroth, K. Optogenetics. Nature Methods. 8 (1), 26-29 (2011).
- Backhaus, B., Sulkowski, E., Schlote, F. W. A semi-synthetic, general-purpose medium for Drosophila melanogaster. Drosophila Information Service. 60, 210-212 (1984).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139 (10), 56(2019).
- Wolf, M. J., Rockman, H. A. Drosophila, genetic screens, and cardiac function. Circulation Research. 109 (7), 794-806 (2011).
- Choma, M. A., Suter, M. J., Vakoc, B. J., Bouma, B. E., Tearney, G. J. Physiological homology between Drosophila melanogaster and vertebrate cardiovascular systems. Disease Models & Mechanisms. 4 (3), 411-420 (2011).
- Ocorr, K., Vogler, G., Bodmer, R. Methods to assess Drosophila heart development, function and aging. Methods [Supplement to Methods in Enzymology]. 68 (1), 265-272 (2014).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Disease Models & Mechanisms. 9 (3), 235-244 (2016).
- Rotstein, B., Paululat, A. On the morphology of the Drosophila heart. Journal of Cardiovascular Development and Disease. 3 (2), 15(2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten