Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Keramisches omnidirektionales Bioprinting in zellbeladenen Suspensionen zur Erzeugung von Knochenanaloga
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine 3D-Drucktechnik zur Herstellung knochenähnlicher Strukturen durch Abscheiden einer Calciumphosphat-Tinte in einem körnigen Träger auf Gelatinebasis. Gedruckte Knochenanaloga werden in Freiform abgeschieden, mit Flexibilität für die direkte Ernte des Drucks oder die Vernetzung innerhalb einer lebenden Zellmatrix für mehrphasige Konstrukte.
Zusammenfassung
Strukturell ist Knochengewebe ein anorganisch-organisches Komposit mit metabolisch aktiven Zellen, die in eine hierarchische, hochmineralisierte Matrix eingebettet sind. Diese Organisation ist aufgrund der heterogenen Umgebung des Knochens schwierig zu replizieren. Ceramic omnidirectional Bioprinting in Cell-Suspensions (COBICS) ist eine Mikrogel-basierte Bioprinting-Technik, die die mineralische und zelluläre Struktur des Knochens auf einzigartige Weise repliziert. COBICS druckt komplexe, biologisch relevante Konstrukte ohne opfernde Trägermaterialien oder harte Nachbearbeitungsschritte (z.B. Bestrahlung und Hochtemperatursintern), die zwei der größten Herausforderungen bei der additiven Fertigung von knochenmimetischen Konstrukten darstellen. Diese Technik wird durch die Freiformextrusion einer neuartigen Tinte auf Calciumphosphatbasis in einer Mikrogelsuspension auf Gelatinebasis ermöglicht. Die Fließspannungseigenschaften der Suspension ermöglichen die Ablagerung und unterstützen die gedruckte Knochenstruktur. UV-Vernetzung und Nanopräzipitation "verriegeln" es dann. Die Fähigkeit, nanostrukturierte knochenmimetische Keramiken in zellbeladenen Biomaterialien zu drucken, bietet eine raumzeitliche Kontrolle über Makro- und Mikroarchitektur und erleichtert die Echtzeitherstellung komplexer Knochenkonstrukte in klinischen Umgebungen.
Einleitung
Knochen hat bemerkenswerte Regenerationsfähigkeiten als eine der wenigen Strukturen im Körper, die heilen können, indem sie ihre normale zelluläre Zusammensetzung, Orientierung und mechanische Stärke bis zu einer kritischen Defektgröße wiederherstellen, wenn die endogene Heilungskapazität beeinträchtigt ist1. Knochen unterstützt und erleichtert zusammen mit Knorpel und Band die Bewegung des Körpers, speichert Mineralien und Fette und produziert Blutzellen. Als hartes, dichtes Bindegewebe besteht Knochen hauptsächlich aus einer anorganischen Phase, Wasser und organischem Material, das hauptsächlich aus Kollagenfasernbesteht 2. Die Zellen sind in diese hochmineralisierte Matrix aus Kollagen-I-Fasern und Hydroxylapatit (HA)-Kristallen eingebettet und bilden eine hierarchische Struktur3.
Die komplexe Organisation dieses Gewebes macht die Herstellung synthetischer Alternativen zur Replikation der heterogenen Knochenmikro- und Nanoumgebungen außergewöhnlich schwierig3. Zu diesem Zweck wurde eine Vielzahl von Materialien, einschließlich Biokeramik, zellbeladene Hydrogele und synthetische Materialien, als Lösungen zur Herstellung von Knochenmatrizen vorgeschlagen. Unter den Gerüstherstellungstechniken sind in jüngster Zeit 3D-Druck-basierte Techniken aufgetaucht, die aufgrund ihrer bemerkenswerten Fähigkeit, die Herstellung hochentwickelter und präziser Strukturen mit großem Potenzial für eine patientenspezifische Behandlung zu ermöglichen, viel Aufmerksamkeit von der Tissue-Engineering-Community erhaltenhaben 4,5,6 . Hydrogele sind die beliebteste Wahl für Matrix-Mimik und Bio-Tinten, da sie zusammen mit Zellen und bioaktiven Molekülen gedruckt werden können, wodurch funktionelle Konstrukte erzeugtwerden 6. Hydrogelen fehlen jedoch die funktionellen Eigenschaften von Knochen, wie mechanische Festigkeit und eine stark verkalkte, anorganische Phase, die metabolisch aktive Zellen enthält.
3D-gedruckte Keramikgerüste erfordern in der Regel Nachbearbeitungsschritte, einschließlich Sintern, Hochtemperaturbehandlungen oder die Verwendung aggressiver Chemikalien, die vor In-vitro - oder In-vivo-Anwendungen gründlich gewaschen werden müssen5. Um diese Einschränkungen zu beheben, haben Lode et al.7 kürzlich eine α-Tricalciumphosphat-basierte Paste entwickelt, die aus Hydroxylapatit gebildet wird und unter physiologischen Bedingungen gedruckt und fixiert werden kann. Dieses Material kann jedoch immer noch nicht zusammen mit lebenden Zellen gedruckt werden, da es eine Nachbehandlung in einer feuchten Umgebung und ein anschließendes Eintauchen in wässrige Lösung über einen langen Zeitraum erfordert.
Alternativ wurden zellbeladene Hydrogele mit eingearbeiteten anorganischen Partikeln als Ersatz für die 3D-Knochenmatrix 8,9 vorgeschlagen. Trotz ihrer großen Fähigkeit, die Zelllebensfähigkeit zu unterstützen, sind sie nicht in der Lage, die dicht mineralisierte Knochengewebeumgebung zu rekapitulieren. Thrivikarman et al.10 verfolgten einen biomimetischen Ansatz, bei dem ein übersättigtes Calcium- und Phosphatmedium mit einem nicht-kollagenen Proteinanalogon verwendet wurde, um die nanoskalige Apatitablagerung besser nachzuahmen. Ihre Konstrukte können jedoch immer noch keine starren 3D-Konstrukte mit einer Architektur im Mikro- und Makromaßstab erzeugen, die einem Knochen ähnelt.
Die vorliegende Studie befasst sich mit diesen Mängeln durch die Entwicklung einer Druckstrategie zur Herstellung knochennachahmender Konstrukte in anorganischen und organischen Phasen, die in der Lage sind, sowohl Zellen als auch Wachstumsfaktoren zu integrieren11. COBICS rekapituliert auf einzigartige Weise die mineralische und zelluläre Struktur des Knochens mit einer Mikrogel-basierten Bioprinting-Technik. Das hierin enthaltene Protokoll beschreibt den Prozess der Synthese der keramischen Knochentinte und Mikrogele auf Gelatinebasis und der anschließenden Kombination von Zellen, die COBICS ermöglichen. Der Prozess beginnt mit der Synthese des Hauptvorläufermaterials der Knochentinte. Das vernetzbare Hydrogel wird dann synthetisiert und zu Mikrogelen geformt. Schließlich wird die Knochentinte omnidirektional in einem Stützbad der mit Zellen beladenen Mikrogele abgeschieden (Abbildung 1).
Die Knochentinte kann in eine beliebige Suspension von Mikrogelen gedruckt werden, die die entsprechenden Fließspannungseigenschaften aufweisen, d. h. die Fähigkeit, mit einer bestimmten Schergeschwindigkeit zu fluidisieren und anschließend die abgeschiedene Struktur zu unterstützen. Es wurden zwei flexible Ansätze demonstriert: eine Suspension aus Gelatine-Mikrogelen und eine Suspension aus Gelatinemethacrylat-Mikrogelen (GelMA). Die erste Suspension löst sich auf, wenn die Temperatur auf 37 °C erhöht wird, die Freiform-Reversible-Einbettung von suspendierten Hydrogelen (FRESH) Technik12, während letztere nach dem Drucken photovernetzt werden kann, wodurch die Mikrogele effektiv "zusammengenäht" werden und die gedruckte Knochentinte an Ort und Stelle fixiert wird. Die vorliegende Studie konzentriert sich auf die Verwendung von GelMA als Matrix, da es den einzigartigen Vorteil bietet, das Zellwachstum durch In-situ-Druck komplexer knochenmimetischer Strukturen unterstützen zu können. Letztendlich ermöglicht dieser Ansatz die Erzeugung komplexer Gewebemodelle mit einem hohen Maß an Biomimikry und weitreichenden Auswirkungen auf die Krankheitsmodellierung, die Wirkstoffforschung und das regenerative Engineering.
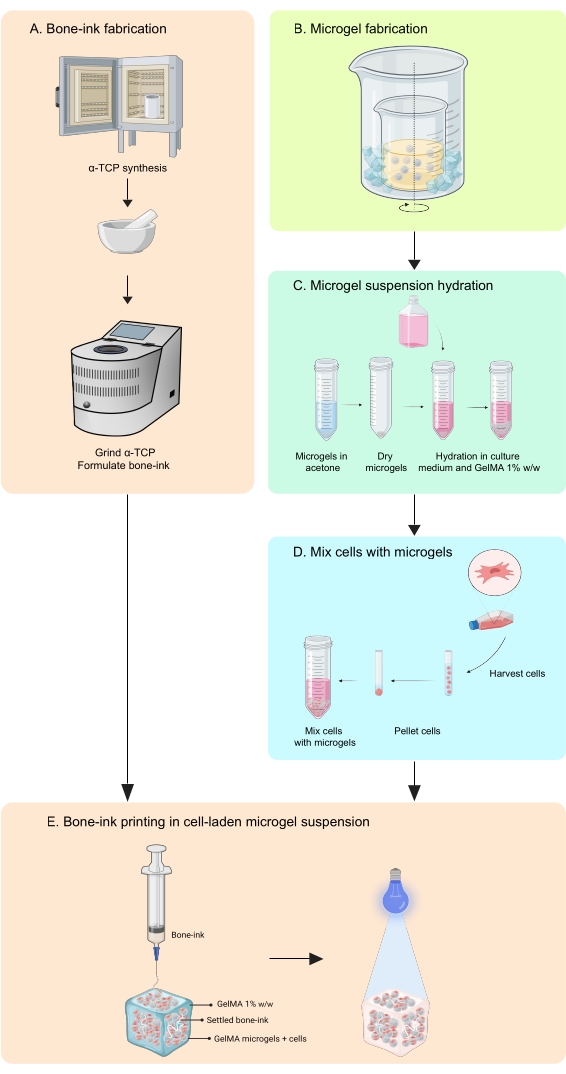
Abbildung 1: Schematische Darstellung des Arbeitsablaufs . (A) Die Knochentinte wird ausgehend von der α-Tricalciumphosphat-Synthese und ihrer anschließenden Kombination mit Glycerin, Polysorbat 80 und Ammoniumphosphat dibasisch synthetisiert. (B) GelMA-Mikrogele werden nach dem Wasser-in-Öl-Emulsionsverfahren hergestellt. Die erhaltenen Mikrogele werden dann (C) hydratisiert und (D) mit Zellen kombiniert. Zell-Mikrogel-Verbundwerkstoffe werden dann als körniges Bad verwendet, in dem die Knochentinte abgeschieden wird. (E) Das gesamte Konstrukt wird dann UV-vernetzt und in den Inkubator für Kultur überführt. Abkürzungen: α-TCP = α-Tricalciumphosphat; GelMA = Gelatinemethacrylat. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protokoll
1. Herstellung von Knochentinte
- Synthese von α-Tricalciumphosphat
- Calciumhydrogenphosphat (CaHPO4) und Calciumcarbonat (CaCO 3) Pulver werden in einem molaren Verhältnis von3:2 Ca:P abgewogen. Mit einem Spatel die beiden Pulver gründlich homogenisieren.
- Geben Sie das Calciumhydrogenphosphat-Calciumcarbonat-Pulvergemisch in einen Zirkonoxidtiegel, so dass es nicht mehr als 75% gefüllt ist.
HINWEIS: Um eine Kontamination zu vermeiden, verwenden Sie einen neuen Tiegel oder einen Tiegel, der zuvor zur Herstellung desselben Materials verwendet wurde. Zum Reinigen mit 100% Ethanol abspülen und in einem Abzug lufttrocknen, bis es vollständig trocken ist, bevor Sie die Pulver hinzufügen. - Den Tiegel in einen Ofen geben. Auf 1.400 °C mit einer Geschwindigkeit von 5 °C/min erhitzen und 3 h halten.
- Löschen Sie die Reaktion, indem Sie den Tiegel aus dem Ofen nehmen und auf einem feuerfesten Block belassen. Lassen Sie es vor der Handhabung vollständig abkühlen.
HINWEIS: Verwenden Sie Tiegelzangen in geeigneter Länge und sorgen Sie für einen ausreichenden Hitzeschutz. - Verwenden Sie einen Mörser und einen Stößel, um den α-TCP-Kuchen zu brechen und zu mahlen, so dass das resultierende Granulat eine maximale Größe von 200 μm hat.
HINWEIS: Verwenden Sie ein Standard-Edelstahlsieb, um die richtige Partikelgröße zu gewährleisten. - Das Granulat wird mit einer Planetenmühle in zwei Stufen weiter gemahlen. Fügen Sie zuerst 3 mm Yttrium-stabilisierte Zirkonoxidkugeln in einem Gewichtsverhältnis von 8:1 Kugeln:Pulver hinzu, dann 100% Ethanol in einem Gewichtsverhältnis von 3:1 Ethanol:Pulver. Den Deckel befestigen und 2 h bei 180 U/min schleifen.
- Sammeln Sie die Suspension und trennen Sie die Kugeln mit 100% Ethanol zum Waschen.
- Die Suspension im Backofen bei 120 °C 24 h trocknen.
- Geben Sie das getrocknete Pulver in Mahlgläser mit 1 mm Zirkoniakugeln und 100% Ethanol in den gleichen Gewichtsverhältnissen wie in der ersten Stufe. 2 h bei 180 U/min mahlen, trennen und trocknen.
ANMERKUNG: Der gesamte Syntheseprozess ist in Abbildung 1A dargestellt.
- Formulierung von Knochen-Tinte
- Um die Knochentinte herzustellen, geben Sie 2 g α-TCP-Pulver in ein Kugelmühlenglas, das 630 μL Glycerin und 130 μL Polysorbat 80 enthält, unter ständigem Rühren mit einem Spatel.
- 100 mg Ammoniumphosphat zweibasisch ((NH4)2HPO4, APD) zugeben und verrühren.
HINWEIS: Übermäßige Rückstände von flüssigen Phasen, die auf dem Spachtel verbleiben, führen zu einem Ungleichgewicht der Tintenbestandteile und damit zur Kinetik des Abbindens. - Fügen Sie eine 25-mm-Zirkonia-Kugel hinzu, befestigen Sie den Deckel und legen Sie ihn für 60 Minuten bei 180 U/min in eine Planetenmühle, wobei Sie auf halbem Weg anhalten, um die Seiten des Glases mit einem Spatel abzukratzen.
- Legen Sie die Tinte mit einem Spatel in eine 1-ml-Spritze. Wickeln Sie es ausreichend ein, um den Kontakt mit Feuchtigkeit zu vermeiden. Bei −20 °C lagern, wenn nicht sofort verwendet.
- Charakterisierung der Knochentinten-Mikrostruktur
- Die Knochentinte in entionisiertem Wasser ausdrucken und 5 min einwirken lassen.
- Waschen Sie die Probe 3x mit 100% Ethanol und lassen Sie sie vollständig trocknen.
- Schicht mit einer dünnen Schicht (15 nm Dicke) aus Gold überziehen.
- Aufnahme von Mikroaufnahmen mit einem Feldemissions-Rasterelektronenmikroskop bei einer Beschleunigungsspannung von 5 kV.
2. Herstellung von Mikrogel-Suspensionen für den Druck
- Synthese von GelMA
HINWEIS: Dieses Verfahren wurde für Chargengrößen getestet, die aus 10 g und 20 g Gelatine bestehen. Diese Methode beschreibt die Messungen für eine Charge mit 10 g.- Eine 10%ige Gew.-w-Lösung von Gelatine Typ A (Schwein, Bloomstrength 300) in 1x phosphatgepufferter Kochsalzlösung (PBS) wird durch Abwiegen von 10 g Gelatine und Zugabe in einen Erlenmeyerkolben mit 90 ml PBS hergestellt. Unter Rühren auf 50 °C erhitzen, bis sich die Gelatine vollständig aufgelöst hat.
- Fügen Sie 5,796 ml Methacrylsäureanhydrid hinzu. Setzen Sie eine Gummikappe auf den Erlenmeyerkolben und rühren Sie im Dunkeln bei 50 °C 90 min weiter.
ACHTUNG: Methacrylsäureanhydrid ist beim Einatmen oder Verschlucken giftig und reizt Haut und Augen. Greifen Sie nur in einen Abzug und verwenden Sie geeignete PSA. - Quen Sie die Reaktion ab, indem Sie den Inhalt des konischen Kolbens mit PBS verdünnen.
- In 50-ml-Röhrchen umfüllen und bei 3.000 × g bei Raumtemperatur für 3 min zentrifugieren, um nicht umgesetztes Methacrylanhydrid zu entfernen.
- Dialysieren Sie den Überstand in 14 kDa Zellulose-Dialyseröhrchen gegen deionisiertes Wasser bei 40 °C für 5 Tage unter vorsichtigem Rühren. Ersetzen Sie das deionisierte Wasser jeden Tag.
- Bereiten Sie sich auf die Lagerung vor, indem Sie in 50-ml-Röhrchen umfüllen, die Kappe befestigen und für 12 Stunden in den Kühlschrank stellen. Im Kühlschrank bis zu 7 Tage aufbewahren.
- Mit flüssigem Stickstoff einfrieren und sofort 5 Tage bei −54 °C und 0,4 mbar lyophilisieren.
HINWEIS: Stellen Sie sicher, dass die Röhrchen beim Einfrieren nicht mehr als 40 ml Flüssigkeit enthalten. Ersetzen Sie die Kappe nach dem Einfrieren durch eine Abdeckung, die den Gasaustausch ermöglicht, z. B. ein empfindliches Tuch, das mit einem elastischen Band gesichert ist. - Lagern Sie den resultierenden Schaum in einem Gefrierschrank bei −20 °C, bis er für die Synthese der Mikrogelsuspension benötigt wird.
- Synthese von GelMA-Mikrogelen
ANMERKUNG: Die Mikrogele werden unter Verwendung einer Wasser-in-Öl-Emulsionsmethode13 synthetisiert (Abbildung 2). Diese Methode wurde für GelMA-Lösungsvolumina von 1-10 ml getestet. Das gleiche Protokoll kann verwendet werden, um Gelatine-Mikrogele zu synthetisieren, die zum Drucken von eigenständigen Knochenabdrücken verwendet werden.- Stellen Sie eine 10%ige GelMA-Lösung in PBS her, indem Sie das lyophilisierte GelMA wiegen, es in ein Röhrchen mit PBS geben und in einem Wasserbad bei 50 °C erhitzen, bis es vollständig hydratisiert ist.
- Geben Sie 37 ml Öl pro 1 ml GelMA-Lösung in ein Becherglas und stellen Sie sicher, dass es nicht mehr als 65% gefüllt ist.
- Stellen Sie ein Doppelbechersystem auf einer Heizplatte mit Magnetrühren auf, indem Sie das Becherglas mit Öl in ein größeres Becherglas legen.
HINWEIS: Die Größe der beiden Becher sollte so sein, dass Eis leicht in den Raum zwischen den Wänden fallen kann. Der Aufbau ist in Abbildung 2 dargestellt. - Unter Rühren auf 40 °C erhitzen.
HINWEIS: Stellen Sie sicher, dass der Wirbel nicht turbulent ist und eine Tiefe von etwa 1/3 der Höhe des Öls im Becherglas aufweist. - Füllen Sie die GelMA-Lösung in eine Spritze und geben Sie sie durch einen 0,45-μm-Filter tropfenweise in das Rühröl. Lassen Sie die Emulsion 10 min einwirken.
- Die Temperatur der Emulsion wird auf 15 °C reduziert, um die Kugeln thermisch zu stabilisieren, indem man zerstoßenes Eis in den Zwischenraum zwischen den beiden Bechergläsern gibt.
- Fügen Sie der Spinnemulsion Aceton in einem Volumenverhältnis von 1:11 GelMA-Lösung zu Aceton hinzu.
HINWEIS: Geben Sie das Aceton vorsichtig durch einen Trichter, um eine Unterbrechung der Emulsion zu vermeiden. 60 Min. umrühren. - Dekantieren Sie den Inhalt des Becherglases in 50-ml-Röhrchen und achten Sie darauf, die Wände des Becherglases mit Aceton zu waschen. 20 Minuten einwirken lassen, damit sich die dehydrierten Mikrogele auf dem Boden absetzen können.
- Entsorgen Sie den Überstand und waschen Sie ihn mindestens 2x mit Aceton.
HINWEIS: Der Überstand sollte klar sein. - In einem Röhrchen konsolidieren, mit Aceton auffüllen und 10 s lang beschallen. 2x mit Aceton waschen.
- In Aceton bei Raumtemperatur aufbewahren, bis es für den Druck benötigt wird.
- Vorbereitung der GelMA Mikrogel-Suspension für den Druck
- Bereiten Sie eine 1%ige w/w-Lösung GelMA in Dulbecco's Modified Eagle Medium (DMEM) vor, indem Sie lyophilisiertes GelMA in ein Röhrchen wiegen, DMEM hinzufügen und in einem Wasserbad bei 50 °C erhitzen, bis es vollständig hydratisiert ist.
- Verdampfen Sie das Aceton aus den dehydrierten Mikrogelen und wiegen Sie das resultierende Pulver in ein Röhrchen. Fügen Sie Aceton hinzu und geben Sie es in eine sterile Umgebung.
- Um die Mikrogel-Suspension zu bilden, verdampfen Sie das Aceton und fügen Sie DMEM, 1% Gew.-% GelMA-Lösung in DMEM und 2,5% Gew.-% Lithiumphenyl-2,4,6-trimethylbenzoylphosphinat (LAP) -Initiatorlösung hinzu, um eine Endverpackungsfraktion von 30% zu erreichen. Mindestens 12 Stunden bei Raumtemperatur einwirken lassen. Im Kühlschrank bis zu 7 Tage aufbewahren. Vor Gebrauch auf Raumtemperatur kommen lassen.
ANMERKUNG: Die Volumina dieser Reagenzien basieren auf dem Trockengewicht der Mikrogele und können mit den Gleichungen in Tabelle 1 berechnet werden.
| Gleichung | |
| x = Gewicht der trockenen Mikrogele (mg) | |
| Volumen von 1% w/w GelMA in DMEM, a (μL) | a = 21,93x |
| DMEM-Volumen, b (μL) | b = 8,773x |
| Volumen von 2,5 Gew.-% LAP-Lösung, c (μL) | c = 0,6267x |
| Gesamtvolumen der produzierten Mikrogelsuspension (μL) | A + B + C |
Tabelle 1: Gleichungen zur Berechnung des Reagenzienvolumens, das zur Hydratisierung der GelMA-Mikrogelsuspensionen erforderlich ist. Abkürzungen: GelMA = Gelatinemethacrylat; LAP = Lithiumphenyl-2,4,6-trimethylbenzoylphosphinat.
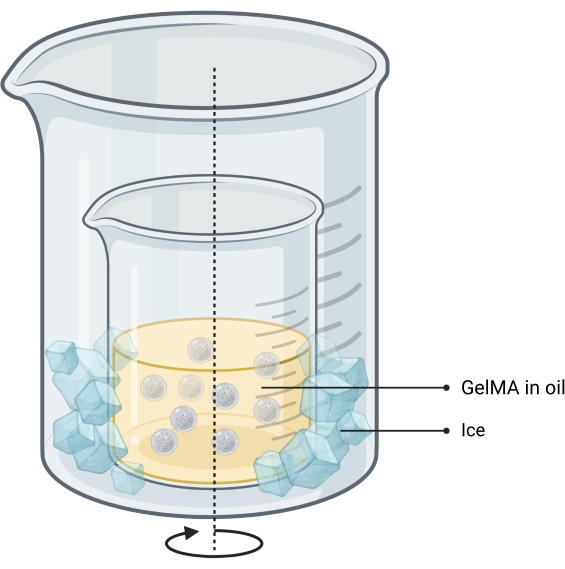
Abbildung 2: Schematische Darstellung der Öl-Emulsions-Methode für die Mikrogelsynthese. Der Doppelbecheraufbau zeigt ein Becherglas, das die Rühremulsion (durch Pfeil gekennzeichnet) enthält, die in einem größeren Becherglas platziert ist, um das Abkühlen zu ermöglichen. Abkürzung: GelMA = Gelatinemethacrylat Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Bedrucken von Knochentinte in Zellsuspensionen
HINWEIS: Mikrogele auf Gelatinebasis unterstützen die Adhäsion vieler verschiedener Zelltypen, was diesen Ansatz für einzelne und mehrere Zellen innerhalb der Mikrogelmatrix zugänglich macht. Dieses Protokoll beschreibt das Verfahren zur Verwendung von adipositas-abgeleiteten mesenchymalen Stammzellen (ADSCs), da dies ein beliebter und robuster Zelltyp für die muskuloskelettale Gewebezüchtung ist.
- Kultivieren Sie die ADSCs in DMEM mit niedrigem Glucosegehalt, ergänzt mit 10% fötalem Rinderserum und 1% Penicillin-Streptomycin bei 37 °C und 5%CO2 bis zum Konfluent.
- Die ADSCs werden aus dem Gewebekulturkolben gelöst, indem das Medium entfernt, mit sterilem PBS gewaschen und bei 37 °C und 5 %CO2 mit 0,25 % Trypsin 3 min inkubiert wird.
- Die Zellen werden durch Zentrifugieren bei 150 × g bei Raumtemperatur für 5 min pelletiert.
- Zählen Sie die Zellen und berechnen Sie 5 × 105 Zellen für jeweils 1 ml GelMA-Mikrogele. Verteilen Sie das erforderliche Volumen der Zellsuspension wie oben beschrieben auf ein separates Röhrchen und Pellet.
- Entfernen Sie vorsichtig so viel Überstand wie möglich mit einer Pipette, so dass nur das Zellpellet übrig bleibt. Geben Sie das erforderliche Volumen der Mikrogel-Suspension in das Pellet und saugen Sie es vorsichtig ab, um eine gleichmäßige Zellverteilung zu gewährleisten.
HINWEIS: Wenn sich überschüssige Luftblasen in der Suspension befinden, zentrifugieren Sie vorsichtig, um sie zu entfernen, und pipettieren Sie auf und ab, um die Zellen neu zu verteilen. - Laden Sie die zellbeladene Mikrogel-Suspension mit einer Pipette in einen Reaktor.
HINWEIS: In der vorliegenden Studie wurden 10 mm x 10 mm x 3 mm Reaktoren mit einer Volumenkapazität von 100 μL in 3D gedruckt. - Auftragen Sie die Knochentinte mit einer 1-ml-Spritze, die mit einer 23-G-Nadel ausgestattet ist.
HINWEIS: Dies kann mit einem 3D-Drucker entweder durch Nachrüstung eines Extrusionssystems, das das Drucken direkt aus der 1-ml-Spritze ermöglicht, oder durch Einlegen der Knochentinte direkt in die Extrusionspatrone des Druckers erfolgen (Abbildung 3). - Das mit Zell- und Knochentinte beladene GelMA-Mikrogel-Konstrukt wird mit einer UV-Vernetzerlampe (405 nm) für 90 s vernetzt. Sofort in eine entsprechend dimensionierte Wellplatte überführen und mit vollständigem DMEM abdecken.
HINWEIS: Die oben genannten 3D-gedruckten Reaktoren passen in 24-Well-Zellkulturplatten. - Inkubieren bei 37 °C und 5 %CO2. Tauschen Sie das Nährmedium nach 24 h aus, danach je nach Bedarf alle 48-72 h.
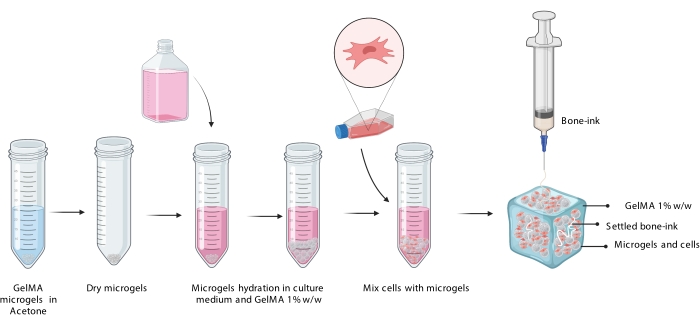
Abbildung 3: Schematische Darstellung des COBICS-Verfahrens, die die Hydratation von Mikrogelen, den Einbau von Zellen und das anschließende Drucken von Knochentinte in die zellbeladene Mikrogelsuspension zeigt. Abkürzung: COBICS = ceramic omnidirectional bioprinting in cell-suspensions; GelMA = Gelatinemethacrylat. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
4. Bewertung der Zelllebensfähigkeit und Proliferation
- Um die Zytotoxizität der Knochentinte zu beurteilen, halten Sie zellbeladene COBICS-Konstrukte in vollständigem Kulturmedium. Führen Sie einen Live Dead-Test bei 24 h, 72 h und 120 h (oder relevanten Zeitpunkten) durch.
- Zu jedem Zeitpunkt waschen Sie die Konstrukte mit PBS und fügen Sie dann eine Lösung von phenolfreiem DMEM hinzu, die 4 mM Calcein und 2 mM Ethidiumbromid enthält. 1 h bei 37 °C und 5%CO2 inkubieren.
- Mit PBS waschen und zur Bildgebung mit einem konfokalen Mikroskop bei Ex/Em-Spektren von 494/517 nm und 528/617 nm in eine Glasbodenschale geben.
Ergebnisse
COBICS druckt komplexe, biologisch relevante Konstrukte ohne Opfermaterialien oder harte Nachbearbeitungsschritte (z.B. Strahlungs- und Hochtemperatursintern), die zwei der größten Herausforderungen bei der additiven Fertigung von knochenmimetischen Konstrukten darstellen. Um die COBICS-Bildung komplexer Knochenstrukturen und den Co-Druck von Zellen in Mikrogelsuspensionen zu demonstrieren, wurden repräsentative Bilder von knochenartigen Kompositen aus der Knochentinte aufgenommen und eine semiquantitative Analyse der...
Diskussion
Die 3D-Drucktechnik COBICS wurde entwickelt, um die Herstellung mineralisierter knochenähnlicher Strukturen durch Extrusion zu einer vernetzbaren Mikrogel-Suspension mit lebenden Zellen zu ermöglichen. Die Technik wurde auf eine abbaubare Mikrogelsuspension angewendet, und die Zellen zeigen eine gute Lebensfähigkeit, Ausbreitung und osteogene Differenzierungsfähigkeit innerhalb des Systems11. Eine Schlüsseldeterminante für den Erfolg von Konstrukten, die mit dieser Technik erstellt werden, i...
Offenlegungen
Die Autoren erklären, dass sie keine Interessenkonflikte offenzulegen haben.
Danksagungen
Die Autoren danken dem National Health and Medical Research Council (Grant-Nr. GNT1111694 und GNT1141602) und dem Australian Research Council (Grant-Nr. FT180100417, FL150100060 und CE14100036). Die Autoren danken der Biomedical Imaging Facility an der University of New South Wales. Die Abbildungen wurden mit Biorender.com, Adobe Photoshop und Adobe Illustrator erstellt und im Rahmen eines kostenpflichtigen Abonnements exportiert.
Materialien
| Name | Company | Catalog Number | Comments |
| 3D Printer Extruder | Hyrel3D | EMO-25 | |
| 50 mL centrifuge tubes | Falcon | BDAA352070 | |
| Absolute Ethanol 100% Denatured | Chem-Supply | ||
| Acetone | Chem-Supply | 154871 | |
| Alumina crucible | Coors | ||
| Ammonium phosphate dibasic (NaHPO4) | Sigma | A5764 | |
| Autodesk Fusion 360 | Autodesk | ||
| Biosafety cabinet level 2 | |||
| Calcium carbonate | Sigma | 239216 | |
| Calcium hydrogen phosphate (CaHPO4) | Sigma | C7263 | |
| Cell culture flasks | Corning | various volumes used | |
| Cellulose Dialysis Tubes, 14 kDa cut-off | Sigma | D9777 | |
| Centrifuge | Eppendorf | 5430R | |
| Centrifuge | Sigma | 3-16KL | |
| Dispensing Tip, 23 G | Nordson | 7018302 | |
| DMEM, low glucose, pyruvate | Thermo FIsher | 11885084 | |
| DPBS, no calcium, no magnesium | Thermo FIsher | 14190144 | |
| Elevator furnace | Labec | ||
| Engine HR Multihead Printer | Hyrel3D | ||
| Fetal Bovine Serum | Bovogen | ||
| Gelatin type A, from porcine skin | Sigma | G2500 | |
| General Purpose Stainless Steel Tips | Nordson EF | ||
| Glycerol | Sigma | G9012 | |
| Human adipose derived stem cells | ATCC | PCS-500-011 | |
| LSM 800 Confocal Microscope | ZEISS | ||
| Lyophilizer (Alpha 1-4 LDplus) | Christ | 101541 | |
| Magnetic hot plate and stirrer | |||
| Methacrylic anhydride | Sigma | 276685 | |
| Mini 2 Desktop 3D Printer | LulzBot | ||
| Parafilm sealing film | Parafilm | PM996 | |
| Penicillin-Streptomycin | Thermo FIsher | 15140122 | |
| Planetary ball mill | |||
| Planetary ball mill jar | |||
| Polyoxyethylenesorbitan monooleate Tween-80 | Sigma | P6224 | |
| Scanning electron microscope | FEI Nova NanoSEM 450 FE-SEM | ||
| Science Kimwipes Delicate Task Wipers | Kimtech | 18813156 | |
| Stainless steel standard test sieve | |||
| Sunflower Oil | Community Co | ||
| Trypsin-EDTA 0.25% phenol red | Thermo FIsher | 25200056 | |
| ZEN Microscope Software | ZEISS | ||
| Live/Dead viability/ cytotoxicity kit for mammalian cells | Invitrogen | L3224 | |
| DMEM, low glucose, no phenol red | Thermo Fisher | 11054020 |
Referenzen
- Bates, P., Ramachandran, M. Bone injury, healing and grafting. Basic Orthopaedic Sciences. The Stanmore Guide. , 123-134 (2007).
- Lin, X., et al. The bone extracellular matrix in bone formation and regeneration. Frontiers in Pharmacology. 11, 757 (2020).
- Reznikov, N., et al. A materials science vision of extracellular matrix mineralization. Nature Reviews Materials. 1, 16041 (2016).
- Kang, H. W., et al. A 3D bioprinting system to produce human-scale tissue constructs with structural integrity. Nature Biotechnology. 34 (3), 312-319 (2016).
- Lin, K., et al. 3D printing of bioceramic scaffolds-Barriers to the clinical translation: From promise to reality, and future perspectives. Materials. 12 (17), 2660 (2019).
- Qu, M., et al. Multi-dimensional printing for bone tissue engineering. Advanced Healthcare Materials. 10 (11), 2001986 (2021).
- Lode, A., et al. Fabrication of porous scaffolds by three-dimensional plotting of a pasty calcium phosphate bone cement under mild conditions. Journal of Tissue Engineering and Regenerative Medicine. 8 (9), 682-693 (2014).
- Bernal, P. N., et al. Volumetric bioprinting of complex living-tissue constructs within seconds. Advanced Materials. 31 (42), 1904209 (2019).
- Diloksumpan, P., et al. Combining multi-scale 3D printing technologies to engineer reinforced hydrogel-ceramic interfaces. Biofabrication. 12 (2), 025014 (2020).
- Thrivikraman, G., et al. Rapid fabrication of vascularized and innervated cell-laden bone models with biomimetic intrafibrillar collagen mineralization. Nature Communications. 10 (1), 3520 (2019).
- Romanazzo, S., et al. Synthetic bone-like structures through omnidirectional ceramic bioprinting in cell suspensions. Advanced Functional Materials. 31 (13), 2008216 (2021).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), 1500758 (2015).
- Phromsopha, T., Baimark, Y. Preparation of starch/gelatin blend microparticles by a water-in-oil emulsion method for controlled release drug delivery. International Journal of Biomaterials. 2014, 829490 (2014).
- Moreno, D., et al. Solid-state synthesis of alpha tricalcium phosphate for cements used in biomedical applications. Boletín de la Sociedad Española de Cerámica y Vidrio. 59 (5), 193-200 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten