Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mikrotensiometer zur konfokalen Mikroskopie Visualisierung dynamischer Grenzflächen
In diesem Artikel
Zusammenfassung
Dieses Manuskript beschreibt das Design und den Betrieb eines Mikrotensiometers / Konfokalmikroskops zur gleichzeitigen Messung der Grenzflächenspannung und der Oberflächendilatationsrheologie bei gleichzeitiger Visualisierung der Grenzflächenmorphologie. Dies ermöglicht die Echtzeitkonstruktion von Struktur-Eigenschafts-Beziehungen von Schnittstellen, die für Technologie und Physiologie wichtig sind.
Zusammenfassung
Die Adsorption von oberflächenaktiven Molekülen an Fluid-Fluid-Grenzflächen ist in der Natur allgegenwärtig. Die Charakterisierung dieser Grenzflächen erfordert die Messung der Adsorptionsraten von Tensiden, die Bewertung der Gleichgewichtsoberflächenspannungen als Funktion der Massentensidkonzentration und die Beziehung, wie sich die Oberflächenspannung mit Änderungen im Grenzflächenbereich nach dem Gleichgewicht ändert. Die gleichzeitige Visualisierung der Grenzfläche mittels Fluoreszenzbildgebung mit einem Hochgeschwindigkeits-Konfokalmikroskop ermöglicht die direkte Auswertung von Struktur-Funktions-Beziehungen. Im Kapillardruck-Mikrotensiometer (CPM) wird eine halbkugelförmige Luftblase am Ende der Kapillare in einem 1 ml Volumenflüssigkeitsreservoir eingeklemmt. Der Kapillardruck über die Blasengrenzfläche wird über einen kommerziellen mikrofluidischen Durchflussregler gesteuert, der eine modellbasierte Druck-, Blasenkrümmungs- oder Blasenflächensteuerung auf der Grundlage der Laplace-Gleichung ermöglicht. Im Vergleich zu früheren Techniken wie dem Langmuir-Trog und dem Pendelfall werden die Mess- und Regelpräzision und die Reaktionszeit erheblich verbessert. Kapillardruckschwankungen können in Millisekunden angelegt und gesteuert werden. Die dynamische Reaktion der Blasenschnittstelle wird über eine zweite optische Linse visualisiert, wenn sich die Blase ausdehnt und zusammenzieht. Die Blasenkontur ist an ein kreisförmiges Profil angepasst, um den Blasenkrümmungsradius R sowie Abweichungen von der Zirkularität zu bestimmen, die die Ergebnisse ungültig machen würden. Die Laplace-Gleichung wird verwendet, um die dynamische Oberflächenspannung der Grenzfläche zu bestimmen. Nach dem Ausgleich können kleine Druckschwingungen von der computergesteuerten mikrofluidischen Pumpe auferlegt werden, um den Blasenradius (Frequenzen von 0,001-100 Zyklen/min) zu schwingen, um den Dilatationsmodul zu bestimmen Die Gesamtabmessungen des Systems sind so klein, dass das Mikrotensiometer unter die Linse eines konfokalen Hochgeschwindigkeitsmikroskops passt, so dass fluoreszierend markierte chemische Spezies quantitativ mit einer lateralen Auflösung von Submikrometern verfolgt werden können.
Einleitung
Luft-Wasser-Grenzflächen, die von Tensidfilmen bedeckt werden, sind im täglichen Leben allgegenwärtig. Tensid-Wasser-Injektionen werden verwendet, um die Ölgewinnung aus erschöpften Feldern zu verbessern und werden als hydraulische Fracturing-Lösungen für Schiefergas und -öl verwendet. Gas-Flüssig-Schäume und Flüssig-Flüssig-Emulsionen sind in vielen industriellen und wissenschaftlichen Prozessen als Schmier- und Reinigungsmittel üblich und in Lebensmitteln üblich. Tenside und Proteine an Grenzflächen stabilisieren Antikörperkonformationen während der Verpackung, Lagerung und Verabreichung 1,2,3,4,5, Tränenfilmstabilität im Auge 6,7,8 und Lungenmechanik 9,10,11,12,13,14, 15.
Die Untersuchung von grenzflächenaktiven Wirkstoffen oder grenzflächenadsorbierenden Tensiden und deren Eigenschaften hat eine lange Geschichte mit vielen verschiedenen experimentellen Techniken 16,17,18,19,20,21,22,23,24,25,26,27 . Eine neuere Entwicklung ist das Kapillardruck-Mikrotensiometer (CPM), das die Untersuchung von Grenzflächeneigenschaften an stark gekrümmten Grenzflächen auf viel kleineren Längenskalen ermöglicht, während deutlich weniger Materialien verwendet werden als andere gängige Methoden 9,23,24,25. Die konfokale Fluoreszenzmikroskopie (CFM) kann verwendet werden, um die Morphologie von Lipiden und Proteinen an den Luft-Wasser-Grenzflächen im CPM22 oder an Langmuir-Trögen20,26,27,28,29 zu untersuchen. Hier wurden CPM und CFM kombiniert, um morphologische Phänomene mit dynamischen und Gleichgewichtsgrenzflächeneigenschaften zu verbinden, um Struktur-Funktions-Beziehungen für biologische und technologische Grenzflächen zu entwickeln.
Es gibt zahlreiche wichtige Parameter in Grenzflächen-Tensidsystemen, die dem CPM-CFM zugänglich sind. Im CPM wird eine Luftblase mit einem Durchmesser von 30-200 μm an die Spitze eines Glaskapillarrohrs geheftet. In früheren Versionen des CPM wurde die Kapillardruckdifferenz zwischen der Innen- und Außenseite der Blase über eine Wassersäule und eine oszillierende Spritzenpumpegesteuert 9,30 ; Die hier beschriebene neue Version ersetzt diese durch eine präzisere, computergesteuerte Mikrofluidikpumpe. Die Oberflächenspannung (γ) wird über die Laplace-Gleichung, ΔP = 2γ/R, aus dem Druckabfall über die von der Pumpe, ΔP, eingestellte Grenzfläche und der optischen Analyse des Krümmungsradius der Blase, R, bestimmt. Die dynamische Oberflächenspannung der Grenzfläche kann mit einer Zeitauflösung von 10 ms nach der Erzeugung einer neuen Blase in Kontakt mit einer Schüttflüssigkeit, die ein lösliches Tensid enthält, bestimmt werden. Die Adsorptionsdynamik des Tensids kann durch die klassische Ward-Tordai-Gleichung10,31 beschrieben werden, um wesentliche Eigenschaften des Tensids zu bestimmen, einschließlich der Diffusivität, der Oberflächenbedeckung und der Beziehung zwischen Massenkonzentration und Gleichgewichtsoberflächenspannung. Sobald eine Gleichgewichtsoberflächenspannung erreicht ist, kann der Grenzflächenbereich oszilliert werden, um den Dilatationsmodul zu messen, indem die Änderungen der Oberflächenspannung aufgezeichnet werden, die durch kleine Änderungen der Blasenoberfläche induziert werden, 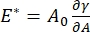 A32. Für komplexere Grenzflächen, die eigene innere Strukturen wie verschränkte Polymere oder Proteine entwickeln, wird die Oberflächenspannung, , durch eine allgemeinere Oberflächenspannungersetzt 4,33,
A32. Für komplexere Grenzflächen, die eigene innere Strukturen wie verschränkte Polymere oder Proteine entwickeln, wird die Oberflächenspannung, , durch eine allgemeinere Oberflächenspannungersetzt 4,33,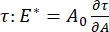 .
.
Die Lungenstabilität während der Atmung kann direkt an die Aufrechterhaltung einer niedrigen Oberflächenspannung und eines hohen Dilatationsmoduls an der alveolären Luft-Flüssigkeits-Grenzfläche 9,10 gebunden sein. Alle inneren Lungenoberflächen sind mit einem kontinuierlichen, mikrometerdicken Film aus Epithelauskleidungsflüssigkeit ausgekleidet, um die Hydratation des Gewebesaufrechtzuerhalten 34. Diese Epithelauskleidungsflüssigkeit besteht hauptsächlich aus Wasser, mit Salzen und verschiedenen anderen Proteinen, Enzymen, Zuckern und Lungentensid. Wie bei jeder gekrümmten Flüssigkeits-Dampf-Grenzfläche wird ein Kapillardruck induziert, wobei der Druck auf der Innenseite der Alveole (oder Blase) höher ist. Wenn die Oberflächenspannung jedoch überall in der Lunge konstant war, zeigt die Laplace-Gleichung, ΔP = 2γ / R, dass kleinere Alveolen einen höheren Innendruck im Vergleich zu größeren Alveolen haben würden, wodurch der Gasgehalt der kleineren Alveolen gezwungen würde, zu größeren, niedrigeren Druckalveolen zu fließen. Dies wird als "Laplace-Instabilität" bezeichnet9,35. Das Endergebnis ist, dass die kleinsten Alveolen kollabieren und mit Flüssigkeit gefüllt werden und schwer wieder aufzublasen sind, was dazu führt, dass ein Teil der Lunge kollabiert, und andere Teile würden sich überblähen, was beides typische Symptome des akuten Atemnotsyndroms (ARDS) sind. In einer gut funktionierenden Lunge ändert sich die Oberflächenspannung jedoch dynamisch, da sich die Luft-Epithel-Flüssigkeitsgrenzfläche im Grenzflächenbereich der Alveolus während der Atmung ausdehnt und zusammenzieht. Wenn 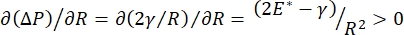 , oder
, oder 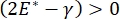 , nimmt der Laplace-Druck mit abnehmendem Radius ab und nimmt mit zunehmendem Radius zu, um die Laplace-Instabilität zu beseitigen und dadurch die Lunge zu stabilisieren9.
, nimmt der Laplace-Druck mit abnehmendem Radius ab und nimmt mit zunehmendem Radius zu, um die Laplace-Instabilität zu beseitigen und dadurch die Lunge zu stabilisieren9. 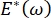 Daher und wie es von der Frequenz, der Monolayer-Morphologie und -Zusammensetzung und der Zusammensetzung der Alveolarflüssigkeit abhängt, kann für die Lungenstabilität unerlässlich sein. Das CPM-CFM hat auch die ersten Demonstrationen der Auswirkungen der Grenzflächenkrümmung auf die Tensidadsorption25, die Monolayer-Morphologie22 und den Dilatationsmodul9 geliefert. Das geringe Volumen (~1 ml) des Reservoirs im CPM ermöglicht die schnelle Einführung, Entfernung oder den Austausch der flüssigen Phase und minimiert die erforderliche Menge an teuren Proteinen oder Tensiden10.
Daher und wie es von der Frequenz, der Monolayer-Morphologie und -Zusammensetzung und der Zusammensetzung der Alveolarflüssigkeit abhängt, kann für die Lungenstabilität unerlässlich sein. Das CPM-CFM hat auch die ersten Demonstrationen der Auswirkungen der Grenzflächenkrümmung auf die Tensidadsorption25, die Monolayer-Morphologie22 und den Dilatationsmodul9 geliefert. Das geringe Volumen (~1 ml) des Reservoirs im CPM ermöglicht die schnelle Einführung, Entfernung oder den Austausch der flüssigen Phase und minimiert die erforderliche Menge an teuren Proteinen oder Tensiden10.
Der Kontrast in einem CPM-CFM-Bild ist auf die Verteilung kleiner Fraktionen fluoreszierend markierter Lipide oder Proteine an der Grenzfläche 16,27 zurückzuführen. Zweidimensionale Tensid-Monoschichten weisen häufig eine laterale Phasentrennung als Funktion der Oberflächenspannung oder des Oberflächendrucks auf, π die Differenz zwischen der Oberflächenspannung einer sauberen Fluid-Fluid-Grenzfläche, γ 0, und einer mit Tensiden bedeckten Grenzfläche, 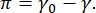 γ. π kann als der 2D-"Druck" angesehen werden, der durch die Wechselwirkungen von Tensidmolekülen an der Grenzfläche verursacht wird, die die Oberflächenspannung der reinen Flüssigkeit senken. Bei niedrigen Oberflächendrücken befinden sich Lipidmonoschichten in einem flüssigkeitsähnlichen, unorganisierten Zustand; Dies wird als flüssig expandierte (LE) Phase bezeichnet. Wenn der Oberflächendruck zunimmt und die Fläche pro Lipidmolekül abnimmt, orientieren sich die Lipide aneinander und können einen Phasenübergang erster Ordnung in die langreichweitig geordnete flüssig kondensierte (LC) Phase 16,20,27 durchlaufen. Die LE- und LC-Phasen können bei verschiedenen Oberflächendrücken koexistieren und können visualisiert werden, da fluoreszierend markierte Lipide aus der LC-Phase ausgeschlossen sind und sich in die LE-Phase trennen. Somit ist die LE-Phase hell und die LC-Phase ist dunkel, wenn sie mit CFM16 abgebildet wird.
γ. π kann als der 2D-"Druck" angesehen werden, der durch die Wechselwirkungen von Tensidmolekülen an der Grenzfläche verursacht wird, die die Oberflächenspannung der reinen Flüssigkeit senken. Bei niedrigen Oberflächendrücken befinden sich Lipidmonoschichten in einem flüssigkeitsähnlichen, unorganisierten Zustand; Dies wird als flüssig expandierte (LE) Phase bezeichnet. Wenn der Oberflächendruck zunimmt und die Fläche pro Lipidmolekül abnimmt, orientieren sich die Lipide aneinander und können einen Phasenübergang erster Ordnung in die langreichweitig geordnete flüssig kondensierte (LC) Phase 16,20,27 durchlaufen. Die LE- und LC-Phasen können bei verschiedenen Oberflächendrücken koexistieren und können visualisiert werden, da fluoreszierend markierte Lipide aus der LC-Phase ausgeschlossen sind und sich in die LE-Phase trennen. Somit ist die LE-Phase hell und die LC-Phase ist dunkel, wenn sie mit CFM16 abgebildet wird.
Das Ziel dieses Manuskripts ist es, die Schritte zu beschreiben, die notwendig sind, um das kombinierte konfokale Mikroskop-Mikrotensiometer zu bauen und zu betreiben. Dies ermöglicht es dem Leser, Adsorptionsstudien durchzuführen, die Oberflächenspannung und das rheologische Verhalten zu messen und gleichzeitig die Grenzflächenmorphologie an einer Luft-Wasser- oder Öl-Wasser-Grenzfläche im Mikrometerbereich zu untersuchen. Dazu gehört eine Diskussion darüber, wie die erforderlichen Kapillaren gezogen, geschnitten und hydrophobiziert werden können, Anweisungen für die Verwendung von Druck-, Krümmungs- und Oberflächensteuerungsmodi sowie die Grenzflächenübertragung von unlöslichem Tensid auf die gekrümmte Mikrotensiometergrenzfläche.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Vorbereitung der Kapillarröhrchen
- Legen Sie die Kapillare in einen Kapillarzieher und führen Sie das gewünschte Zugprogramm aus, um zwei sich verjüngende Kapillaren mit einem Außendurchmesser (OD) von ~ 1 μm an der Spitze herzustellen.
HINWEIS: Das OD der Kapillare vor dem Ziehen muss das OD sein, das angegeben wurde, um in den Kapillarhalter in der Mikrotensiometerzelle zu passen. Der Innendurchmesser (ID) der Kapillare kann variieren, beeinflusst aber den kritischen Radius der Kapillare nach dem Ziehen. Ein Zugprogramm wird so gewählt, dass die resultierende Verjüngung zunächst die Kapillar-OD und -ID schnell reduziert, dann einen Radius in der Nähe der gewünschten Kapillar-OD und ID erreicht und dann langsamer im Durchmesser abnimmt. Dadurch entsteht eine größere Kapillarlänge, die zu einer nutzbaren Kapillare von 30-100 μm in ID bewertet werden kann. - Ritzen Sie die Spitze der Kapillare an der gewünschten Stelle ab, um eine ID von 30-100 μm zu erhalten, und brechen Sie die Spitze ab. Die Kapillare hat nun eine OD und ID des gewünschten Radius an der Spitze (Abbildung 1A). Die Kapillaren können bis Schritt 2 gelagert werden.
HINWEIS: Die Schnittkante der Kapillare muss ein 90° sauberer Bruch sein. Jeder Defekt in der Schnittkante führt zu einem schlechten Pinning der Blase an die Kapillare und zu schlechten Oberflächeneigenschaftsmessungen. Verjüngte Kapillarspitzen sind sehr empfindlich. Sie werden zerstört, wenn sie mit etwas anderem als den Lösungen in Berührung kommen (z. B. Durchstechflaschenwände, Luftdüse).
2. Hydrophobierung von Kapillaren
- Sammeln Sie gezogene Glaskapillaren, saure Reinigungslösung, Kunststoffpinzetten, deionisiertes (DI) Wasser, Hydrophobierungslösung (2% Silan in Ethanol), Vakuumpumpe und Ethanollösung. Weitere Informationen finden Sie in der Materialtabelle .
ACHTUNG: Säurereinigungslösung ist akut giftig, verursacht Haut- und Augenkorrosion / -reizung, oxidiert. Hydrophobierungslösung ist ein Haut-/Augen-/Atemwegsreizmittel. Tragen Sie Augenschutz, Laborkittel und Handschuhe und arbeiten Sie mit Lösungen in einem Abzug. - Reinigen Sie die Kapillare mit Säure
HINWEIS: Die Säurereinigung der Kapillare entfernt alle organischen Rückstände in der Kapillare und bereitet die Glasoberfläche auf die Silanisierungsreaktion vor, die die Kapillare hydrophob macht.- Greifen Sie eine Kapillare fest in der Nähe ihres breiten Endes mit der Pinzette.
- Tauchen Sie die konische Spitze in die saure Reinigungslösung, während Sie den Schlauch von der Vakuumpumpe am breiten Ende der Kapillare befestigen. Dies saugt die Lösung in die Kapillare.
HINWEIS: Eine Pipettenspitze kann am Ende des Kapillarschlauchs befestigt werden, um eine bessere Passform mit dem Kapillarende zu ermöglichen. - Stoppen Sie, wenn die saure Reinigungslösung etwa die Hälfte der Kapillare gefüllt hat.
HINWEIS: Nach dem Entfernen der Kapillarspitze aus der sauren Reinigungslösung bildet die Lösung an der Außenseite der Kapillare oft eine Perle in der Nähe der Kapillarspitze. Berühren Sie vorsichtig die Kapillare am Hals der Durchstechflasche der Lösung, um überschüssige Lösung zu entfernen. - Lassen Sie die saure Reinigungslösung mindestens 30 Minuten in den Kapillaren verbleiben, um sicherzustellen, dass der Pfropfen der Flüssigkeit am sich verjüngenden Ende der Kapillare verbleibt.
- Entfernen Sie die saure Reinigungslösung aus der Kapillare, indem Sie die Kapillare mit der Pinzette fest halten und mit dem Vakuumschlauch die Flüssigkeit aus dem großen Ende der Kapillare herausziehen.
- Spülen Sie die Kapillare aus
- Tauchen Sie das sich verjüngende Ende der Kapillare in DI-Wasser, um sicherzustellen, dass es tief genug eingetaucht ist, um jedes Äußere abzudecken, das in die saure Reinigungslösung eingetaucht wurde. Während die Spitze untergetaucht ist, ziehen Sie mit dem Vakuumschlauch DI-Wasser durch die Kapillare. Entfernen Sie die Kapillare aus dem Wasser und entfernen Sie das restliche Wasser mit dem Vakuumschlauch.
- Wiederholen Sie den obigen Schritt mindestens 4x.
- Führen Sie Schritt 2.3 erneut aus, indem Sie DI-Wasser durch Ethanol ersetzen.
- Saugen Sie kontinuierlich an, bis das Ethanol vollständig aus dem Inneren der Kapillare verdampft. Die Kapillare wird trüber und kühl zu berühren, wenn das Ethanol zu verdampfen beginnt, sich aber nach 30 bis 45 s auflöst.
- Beschichten Sie die Kapillare mit der Hydrophobierungslösung
- Tauchen Sie kurz das breite Ende der Kapillare in das ~ 2% ige Silan in Ethanollösung. Die Kapillarwirkung führt dazu, dass die Beschichtungslösung innerhalb der Kapillare ansteigt. Entfernen Sie die Kapillare aus der Lösung, sobald ein ~ 1 cm großer Stecker in der Kapillare aufgestiegen ist.
- Richten Sie die Kapillare so aus, dass die sich verjüngende Spitze nach unten zeigt, so dass die Beschichtungslösung mit Schwerkraft auf die sich verjüngende Spitze fallen kann.
- Lassen Sie die Beschichtungslösung mindestens 3 min in der Kapillare verbleiben.
HINWEIS: Es dürfen keine Luftblasen im Plug der Beschichtungslösung vorhanden sein, die mit dem Inneren der sich verjüngenden Spitze in Berührung kommt. Wenn es eine Luftblase gibt, wurde das Kapillarinnere in Schritt 2.5 wahrscheinlich nicht ausreichend getrocknet. Um dieses Problem zu beheben, wiederholen Sie die Schritte 2.4-2.6 nach Bedarf.
- Spülen Sie die Kapillaren mit Ethanol 1x auf die gleiche Weise wie Schritt 2.3.
- Stellen Sie die hydrophobe Beschichtung auf die Kapillare ein
- Legen Sie saubere und trockene Szintillationsfläschchen in einen auf 120 °C eingestellten Vakuumofen. Legen Sie beschichtete Kapillaren in die Durchstechflaschen (idealerweise eine Kapillare pro Durchstechflasche), wobei breite Enden auf der Basis der Durchstechflasche ruhen. Lassen Sie die Kapillaren mindestens 6 h im Ofen verbleiben (über Nacht bevorzugt), um eine dauerhafte Bindung der hydrophoben Silanschicht an die Kapillaren zu erreichen. Die Kapillaren können bis Schritt 4 gelagert werden.
3. Probenvorbereitung und -lagerung
- Mischen und lagern Sie Tensid- und Fluorophorlösungen in sauberen, säuregewaschenen Durchstechflaschen, um eine Kontamination zu vermeiden.
HINWEIS: Kommerziell erhältliche Lipide müssen von höchster Reinheit sein und zwischen den Anwendungen bei - 20 °C gelagert werden. Alte oder kontaminierte Lipide führen oft dazu, dass die Ergebnisse schwer zu reproduzieren sind.
4. Einrichten des Mikrotensiometers
- Setzen Sie die CPM-Zelle wie in Abbildung 2 beschrieben zusammen.
- Legen Sie die große Seite der Kapillare in die Oberseite der CPM-Zelle, bis sie sich bis zur Unterseite der Zelle durchdrückt.
- Ziehen Sie den PEEK-Stecker vorsichtig an, um die Kapillare zu befestigen, und befestigen Sie dann den Schlauch von der Mikrofluidikpumpe an der großen Seite der Kapillare. Achten Sie darauf, die sich verjüngende Kapillarspitze nicht zu berühren.
- Befestigen Sie bei Bedarf die Behälteraustausch- und/oder Temperaturregelschläuche an den jeweiligen Ein- und Auslässen der CPM-Zelle (Abbildung 2); Andernfalls schließen Sie die nicht verwendeten Ein- und Ausgänge an.
- Befestigen Sie die CPM-Zelle an der konfokalen Mikroskopstufe und richten Sie sie grob auf das CFM-Objektiv, die CPM-Kamera und die CPM-Lichtquelle aus (Abbildung 3).
- Öffnen Sie den Gasstrom zur Mikrofluidikpumpe bei dem empfohlenen Betriebsdruck der Pumpe (150 mbar für die hier verwendete Mikrofluidikpumpe) und stellen Sie sicher, dass der Durchfluss zur Kapillare offen ist.
- Starten Sie die Ausführung der virtuellen CPM-Schnittstelle (Supplemental Coding File 1: Microtensiometer Virtual Interface.vi) im Druckregelungsmodus, wobei die Kapillardruckschwingungsfrequenz und -amplitude auf Null eingestellt ist (Abbildung 4-7). Abbildung 4 zeigt einen Screenshot der virtuellen Benutzeroberfläche. Bei DI-Wasser und einem Kapillarradius von ~35 μm sorgt ein Druck von ~20 mbar dafür, dass kein Wasser in die Kapillare gelangt.
- Füllen Sie die CPM-Zelle mit einer Pipette mit Wasser.
- Konzentrieren Sie sich mit der Mikrotensiometerkamera auf die Kapillarspitze.
- Konzentrieren Sie sich beim CFM auf die Kapillarspitze. Wenn es schwierig ist, die Kapillare zu finden, verwenden Sie die CPM-Kamera, um das CFM-Objektiv zu finden. Dies hilft, den Abstand zwischen dem CFM-Ziel und der Blase anzunähern und den richtigen Arbeitsabstand zu erreichen.
- Nachdem der Ring (grüne Sektorprojektion) auf der Blase zentriert ist, passen Sie den Fokus manuell an, so dass die Blasenkante deutlich zu sehen ist (Abbildung 4-3).
HINWEIS: Position, Start- und Endwinkel sowie Innen- und Außenradien des Rings können über das Menü unterhalb des Ansichtsfensters eingestellt werden. - Klicken Sie auf Blase zurücksetzen und stellen Sie sicher, dass eine neue Blase gebildet wird (man kann die alte Blase platzen hören, und die neue Blase wird aus dem Anzeigefenster des Bedienfelds beobachtbar sein; Abbildung 4-3). Wenn die Blase nicht platzt, erhöhen Sie den Reset-Druck oder erhöhen Sie die Reset-Verzögerungszeit auf der Registerkarte Bubble Reset unter dem Anzeigefenster. Prüfen Sie, ob die Oberflächenspannung bei etwa 73 mN/m liegt (bei Salz- oder Wasser-/Luftblasen) (Abbildung 4-9).
- Nehmen Sie das Wasser über die Direct-to-Cell-Spritze heraus (Abbildung 3-13), entleeren Sie es und bringen Sie es wieder an. Das Beispiel kann geladen werden, um das Experiment auszuführen.
5. Adsorptionsstudie
- Füllen Sie die Zelle mit der gewünschten Probe mit einer autoklavierten Pipette, die die CPM-Software im Druckregelmodus hält. Stellen Sie sicher, dass die anfängliche Oberflächenspannung bei etwa 73 mN/m liegt, wenn eine neue Blasenschnittstelle erstellt wird.
- Bestimmen Sie den Radius der neu gebildeten Blase, geben Sie diesen Wert in die Mittellinienbereichssteuerung ein (Abbildung 4-7), und ändern Sie den Steuerelementtyp in Bereichssteuerung, indem Sie auf die Registerkarte Bereichssteuerung klicken (Abbildung 4-8).
HINWEIS: Es kann auch eine konstante Druckregelung verwendet werden, die jedoch dazu führt, dass sich der Blasenradius kontinuierlich ändert, wenn sich die Oberflächenspannung der Grenzfläche ändert. Dieser sich ändernde Bereich kann die Analyse der Tensidadsorptionsraten erschweren und dazu führen, dass die Blase während der Studie platzt. - Starten Sie die Aufnahme des konfokalen Videos.
- Klicken Sie auf Reset Bubble (Abbildung 4-5) und dann sofort auf Collect Data (Abbildung 4-6). Die Signalleuchte auf der Taste leuchtet grün.
- Passen Sie die Datenaufzeichnungsrate entsprechend der Konzentration der Probe an, indem Sie den Balken in Abbildung 4-6 verschieben. Verwenden Sie für langsamere Adsorptions eine langsamere Aufzeichnungsrate. Dies kann mitten in einem Durchlauf angepasst werden, wenn eine höhere Aufzeichnungsrate früh gewünscht wird, aber eine langsamere Rate für lange Studien vorzuziehen ist, um die Dateigröße zu reduzieren.
- Speichern Sie die Datei nach dem Ende des Experiments (wenn ein endgültiges Oberflächenspannungsplateau erreicht wurde), indem Sie den richtigen Dateipfad auswählen (Abbildung 4-1) und auf die Schaltfläche Speichern klicken (Abbildung 4-2).
- Stoppen und speichern Sie die Aufnahme auch auf dem CFM.
6. Oszillations-/Entspannungsstudie
- Füllen Sie die Zelle mit der Probe mit einer autoklavierten Pipette, wobei die CPM-Software im Druckregelungsmodus bleibt. Stellen Sie sicher, dass die Oberflächenspannung bei etwa 73 mN/m liegt, wenn eine neue Blasenschnittstelle erstellt wird.
- Warten Sie, bis die Probe vollständig an die Grenzfläche adsorbiert ist. Dies kann direkt nach einer Adsorptionsstudie durchgeführt werden, anstatt mit einer neuen Blasenschnittstelle von vorne zu beginnen.
- Entscheiden Sie, ob es sich bei der Oszillation um eine Druckschwingung, eine Flächenschwingung oder eine Krümmungsoszillation handelt, indem Sie die entsprechende Registerkarte auswählen (Abbildung 4-8) und den gewünschten Basiswert, Oszillations% und die Schwingungsfrequenz eingeben (Abbildung 4-7).
HINWEIS: Auf Sägezahn-, Quadrat- und Dreieckswellenflächenschwingungen kann auch über das Dropdown-Menü auf der Registerkarte Andere Bereichsschwingungen zugegriffen werden. - Starten Sie die Aufzeichnung des konfokalen Videos und klicken Sie in der CPM-Software auf Daten sammeln (Abbildung 4-6).
- Starten Sie die Oszillation. Stellen Sie sicher, dass Sie mindestens sieben Zyklen aufzeichnen, um die besten Ergebnisse zu erzielen. Wählen Sie eine Datenerfassungsrate (Abbildung 4-6), um eine angemessene Anzahl von Datenpunkten für jeden Schwingungszyklus anzugeben.
- Wenn andere Schwingungsamplituden oder Frequenzen gewünscht werden, ändern Sie die Werte während des Experiments.
- Speichern Sie die Ergebnisse wie in den Schritten 5.6 und 5.7.
7. Studie zum Austausch von Lösungsmitteln
- Füllen Sie die Zelle mit der Probe mit einer autoklavierten Pipette, die die CPM-Software im Druckregelmodus hält. Stellen Sie sicher, dass die Oberflächenspannung bei etwa 73 mN/m liegt, wenn eine neue Blasenschnittstelle erstellt wird.
HINWEIS: Adsorptions- und/oder Oszillationsstudien können vor der Lösungsmittelaustauschstudie durchgeführt werden. - Schließen Sie das Einlassrohr mit der Flasche der gewünschten Austauschlösung (Abbildung 3-11) an die Peristaltikpumpe an (Abbildung 3-10).
- Starten Sie die Aufzeichnung des Videos in konfokaler Software und klicken Sie in der CPM-Software auf Daten sammeln (Abbildung 4-6).
- Stellen Sie die peristaltische Pumpendrehzahl ein. Dies steuert die Flüssigkeitsaustauschrate und muss basierend auf den Anforderungen für das Experiment ausgewählt werden, d.h. wie schnell das Lösungsmittel ausgetauscht werden muss.
- Wenn mehrere Flüssigkeiten ausgetauscht werden müssen, stoppen Sie die Peristaltikpumpe und schließen Sie den Einlass an eine andere Austauschlösung an.
- Nachdem der Austausch beendet ist (~20 min), speichern Sie die Ergebnisse wie in Schritt 5.6 und 5.7.
8. Adsorption von unlöslichen Tensiden
HINWEIS: Wenn das zu adsorbierende Tensid in der Reservoirflüssigkeit nicht löslich ist, kann diese Methode verwendet werden, um eine Monoschicht von der Luft/Wasser-Grenzfläche der Zelle auf die Blasenoberfläche zu übertragen. Viele zweischichtbildende Lipide sind in Salzlösung fast unlöslich und absorbieren nicht spontan in die Blase, wenn sie in der Reservoirlösung suspendiert sind.
- Füllen Sie die Zelle mit der Probe mit einer autoklavierten Pipette, wobei die CPM-Software im Druckregelungsmodus bleibt. Stellen Sie sicher, dass die Oberflächenspannung bei etwa 73 mN/m liegt, wenn eine neue Blasenschnittstelle erstellt wird.
- Deponieren Sie eine Monoschicht aus unlöslichem Tensid auf der Luft-Wasser-Grenzfläche der Zelle aus einer Lösung in einer flüchtigen organischen Lösung. Mit einer Spritze kleine Tröpfchen an der Grenzfläche abscheiden und das Lösungsmittel verdampfen lassen, wobei das Lipid als dünner Film zurückbleibt.
ACHTUNG: Chloroform wird als Lösungsmittel für Phospholipide wie Phosphatidylcholine und Fettsäuren verwendet. Streulösungen sind in der Regel 0,01-0,02 mg Lipid pro ml des Lösungsmittels. Chloroform ist akut toxisch, kann Haut- und Augenreizungen verursachen und ist krebserregend. Tragen Sie geeigneten Augenschutz, Laborkittel und Handschuhe und machen Sie die Lösung in einem Abzug. - Verringern Sie die Oberfläche über die Mittelliniendruckregelung (Abbildung 4-7) der Blase, bis sie fast flach ist. Dies verhindert, dass die Blase platzt, nachdem das Tensid adsorbiert wurde.
- Entfernen Sie die Reservoirflüssigkeit über die Direct-to-Cell-Spritze aus der Zelle, bis sich die Luft-Wasser-Grenzfläche an der Spitze der Kapillare vorbeibewegt. Während eine Spritzenpumpe verwendet werden kann, kann dieser Schritt durch manuelle Verwendung der Spritze erreicht werden.
- Erhöhen Sie die Höhe der Reservoirflüssigkeit auf ihr Ausgangsniveau.
HINWEIS: Nachdem die Spitze wieder eingetaucht wurde, ist die Blase aufgrund des Tensids, das jetzt an der Grenzfläche adsorbiert wird, größer. Die Monoschicht ist nun bereit für Oszillations- oder Lösungsmittelaustauschexperimente.
9. Aufräumen
- Schalten Sie das CFM aus.
- Wechseln Sie in den Druckregelungsmodus .
- Entfernen Sie die Probe mit einer Pipette aus der Zelle. Laden Sie die Zelle mit DI-Wasser und erhöhen Sie den Druck auf ~ 50 mbar, damit Blasen ständig aus der Kapillare entweichen und die Kapillarspitze reinigen. Wiederholen Sie diesen Vorgang 2x.
- Schließen Sie das Sicherheitsventil und schalten Sie das CPM aus, indem Sie auf die rote Schaltfläche in der oberen linken Ecke klicken, das helle und blaue Druckbedienfeld ausschalten und die Druckquelle schließen.
- Entfernen Sie die Zelle aus dem konfokalen Mikroskoptisch. Spülen Sie die Zelle mit Ethanol und DI-Wasser aus. Entfernen Sie den Kapillarschlauch aus der CPM-Zelle.
10. Reinigen der Zelle
- Zerlegen Sie die Zelle. Bürsten Sie die Innenwand mit einer Zahnbürste, während Sie unter DI-Wasser spülen. Tauchen Sie die Teile in Ethanol und beschallen Sie es für ~ 30 min.
- Spülen Sie alle Teile einige Male mit DI-Wasser ab. Trocknen Sie die Teile, indem Sie sie entweder mit Stickstoffgas blasen oder in einem Vakuumofen trocknen.
11. Oszillationsanalyse
- Führen Sie den Dilatational_Rheology_Analysis.m-Code (Supplemental Coding File 2) aus und wählen Sie die gewünschte Datei aus, die in der virtuellen CPM-Schnittstelle gespeichert ist. Beispieldaten sind in den ergänzenden Dateien enthalten.
- Das Druck-Zeit-Diagramm wird wie in Ergänzender Abbildung 1 dargestellt angezeigt. Klicken Sie mit der linken Maustaste auf den Punkt, an dem die Oszillation beginnt, und klicken Sie erneut mit der linken Maustaste auf die Stelle, an der die Oszillation endet. Wenn die Daten mehrere Schwingungen enthalten, wiederholen Sie diesen Vorgang für alle Schwingungen.
- Wenn mit der linken Maustaste auf alle Start- und Endpunkte geklickt wurde, klicken Sie mit der rechten Maustaste auf eine beliebige Stelle. Zum Beispiel, wie in Ergänzende Abbildung 1 gezeigt, kann man mit der linken Maustaste auf die Punkte 1, 2, 3 und 4 klicken, gefolgt von einem Rechtsklick.
HINWEIS: Der Code berechnet den Dilatationsmodul und den Phasenwinkel und die Ergebnisse werden in eine neue .csv Datei am ursprünglichen Dateispeicherort geschrieben. Die Ergebnisse für die Beispieldaten sind den Codeergebnissen in der Supplemental Coding File 2 zu entnehmen. MATLAB wird auch mehrere grafische Darstellungen der Daten generieren, wie in Ergänzende Abbildung 2 gezeigt.
- Wenn mit der linken Maustaste auf alle Start- und Endpunkte geklickt wurde, klicken Sie mit der rechten Maustaste auf eine beliebige Stelle. Zum Beispiel, wie in Ergänzende Abbildung 1 gezeigt, kann man mit der linken Maustaste auf die Punkte 1, 2, 3 und 4 klicken, gefolgt von einem Rechtsklick.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Eine Hauptquelle für Messfehler ergibt sich aus den Kapillaren, die entweder Defekte aus dem Schneidprozess (Abbildung 5A, B) oder dem Beschichtungsprozess (Abbildung 5D) aufweisen. Beide Arten von Defekten führen zu Fehlern bei der Bestimmung der Blasenform und -größe durch das optische Bildanalysesystem, was zu ungenauen Oberflächenspannungswerten führt. Es ist wichtig, jede neue Kapillare sorgfältig zu untersuchen, nachdem sie gezogen ...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Das kombinierte CPM/CFM ist ein leistungsfähiges Werkzeug zur Untersuchung von Grenzflächendynamik, Gleichgewichten und Morphologie. Dieses Protokoll beschreibt die Schritte, die zum Abrufen von Daten mit CPM/CFM erforderlich sind.
Abbildung 2 zeigt das Zelldesign mit Kanälen für den angegebenen Kapillar-, Lösungsmittel- und Wärmeaustausch. Der Einlass für den Lösungsmittelaustausch sollte sich an der Unterseite der Zelle befinden, während sich der Auslas...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Alle konfokalen Mikroskopiebilder wurden mit dem konfokalen Nikon-Multiphotonenmikroskop A1RHD aufgenommen. Wir danken den Hilfskräften, insbesondere Guillermo Marques, am University Imaging Center der University of Minnesota. Diese Arbeit wurde durch den NIH Grant HL51177 unterstützt. SI wurde durch ein Ruth L. Kirschstein NRSA Institutional Research Training Grant F32 HL151128 unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5 O.D. Tygon tubing | Fischer Scientific | Tubing | |
| A1RHD Multiphoton upright confocal microscope | Nikon | Confocal Microscope | |
| Acid Cleaning Solution | Sulfuric acid and Alnochromix diluted with water 50% by volume, wait until clear befor diluting | ||
| Alnochromix | Alconox | 2510 | Mixed with sulfuric acid to package instructionand diluted to make acid cleaning solution |
| Ceramic glass cutter | Sutter Instruments | ||
| Chloroform | Sigma-Aldrich | 650471 | HPLC Plus |
| Curosurf | Chiesi | Lung Surfactant | |
| Di Water | 18.5 MΩ - cm | ||
| Ethanol | any | 200 proof used for hydrophobization, denatured used for cleaning | |
| Fiber-Lite Model 190 fiber optic illuminator | Dolan-Jenner Industries Inc. | 281900100 | Light source; other light sources should work as well |
| Flow EZ F69 mbar w/Link Module | Fluigent | LU-FEZ-0069 | Microfluidic Pump |
| Fluigent SDK VIs | Fluigent | Required for CPM virtual Interface | |
| Fluoroelastomer gaskets | Machined from 1 mm thick Viton sheet, See figure 3 | ||
| Gas filter | Norgren | F07-100-A3TG | Put between microfluidic pump and pressure regulator |
| Gas regulator | Norgren | 10R0400R | Steps down pressure from sorce to range of pump, connected to gas filter range 2-120 psi |
| Glass Capilary | Sutter Instruments | B150-86-10 | Borosilicate glass O.D. 1.5 mm I.D. 0.86 mm |
| Glass Slide | any | 75 mm x 25 mm | |
| Glass Syringe | Hamilton | 84878 | 25 μL glass syringe |
| Hydrophobizing Agent | Sigma-Aldrich | 667420 | 1H,1H,2H,2H-Perfluoro-octyltriethoxysilane 98%, other hydrophobic triethoxysilane can be substituted |
| Insoluble surfactant | Avanti | 850355C-200mg | 16:0 DPPC in chloroform |
| LabVIEW Software | National Instruments | 2017 | |
| Longpass Filter | ThorLabs | FEL0650 | 650 nm Longpass filter, wavelength must remove excitation lazer frequence |
| Lyso-PC | Avanti | 855675P | 16:0 Lyso PC 1-palmitoyl-2-hydroxy-sn-glycero-3-phosphocholine |
| Masterflex L/S variable speed analog consol pump system w/ Easy-Load II pump head | Masterflex | HV-77916-20 | Peristaltic Pump |
| MATLAB | Mathworks | R2019 | |
| Micropipette Puller P-1000 | Sutter Instruments | Capillary Puller | |
| Microtensiometer Cell and Holder | Cell machined from PEEK, holder machined from aluminum, See Figure 3 and 4 | ||
| Microtensiometer Objective | Nikon | Fluor 20x/0.50W DIC M/N2 ∞/0 WD 2.0 mm | |
| NI Vision Development Module | National Instruments | Required for CPM virtual Interface | |
| PEEK finger tight fittings | IDEX | F-120x | 10-32 Coned Ports |
| PEEK plug | IDEX | P-551 | 10-31 Coned Ports |
| pippette tips | Eppendorf | 22492225 | 100 μL - 1000 μL, Autoclaved |
| Plastic Forceps | Thermo Scientific | 6320-0010 | |
| Plastic Syringe | Fischer Scientific | 14-955-459 | 10 mL |
| Plumbing parts | Fischer Scientific | 3-way valves and other plumbing parts to connect tubing. | |
| Research Plus 1-channel 100 μL–1000 μL | Eppendorf | 3123000063 | Micro pipetter |
| Sulfuric Acid | any | Used for acid cleaning solution | |
| T Plan SLWD 20x/0.30 OFN25 WD 30 mm | Nikon | Confocal Microscope Objective | |
| Texas Red DHPE triethylammonim salt | Thermo Fischer Scientific | 1395MP | Fluorophore |
| Vaccum Pump | Gast | DOA-P704-AA |
Referenzen
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Interfacial rheology of globular and flexible proteins at the hexadecane/water interface: Comparison of shear and dilatation deformation. Journal of Physical Chemistry B. 108 (12), 3835-3844 (2004).
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Shear and dilatational relaxation mechanisms of globular and flexible proteins at the hexadecane/water interface. Langmuir. 20 (23), 10159-10167 (2004).
- Kannan, A., Shieh, I. C., Fuller, G. G. Linking aggregation and interfacial properties in monoclonal antibody-surfactant formulations. Journal of Colloid and Interface Science. 550, 128-138 (2019).
- Kannan, A., Shieh, I. C., Leiske, D. L., Fuller, G. G. Monoclonal antibody interfaces: Dilatation mechanics and bubble coalescence. Langmuir. 34 (2), 630-638 (2018).
- Li, J. J., et al. Interfacial stress in the development of biologics: Fundamental understanding, current practice, and future perspective. The AAPS Journal. 21 (3), 44(2019).
- Bhamla, M. S., Giacomin, C. E., Balemans, C., Fuller, G. G. Influence of interfacial rheology on drainage from curved surfaces. Soft Matter. 10 (36), 6917-6925 (2014).
- Fuller, G. G., Vermant, J. Complex fluid-fluid interfaces: Rheology and structure. Annual Review of Chemical and Biomolecular Engineering. 3, 519-543 (2012).
- Rosenfeld, L., et al. Structural and rheological properties of meibomian lipid. Investigative Ophthalmology & Visual Science. 54 (4), 2720-2732 (2013).
- Barman, S., Davidson, M. L., Walker, L. M., Anna, S. L., Zasadzinski, J. A. Inflammation product effects on dilatational mechanics can trigger the Laplace instability and acute respiratory distress syndrome. Soft Matter. 16 (29), 6890-6901 (2020).
- Barman, S., et al. Recent Advances in Rheology: Theory, Biorheology, Suspension and Interfacial Rheology. Ramachadran, A., et al. , chap. 7 (2022).
- Alonso, C., Zasadzinski, J. A. A brief review of the relationship between monolayer viscosity, phase behavior, surface pressure and temperature using a simple monolayer viscometer. The Journal of Physical Chemistry B. 110 (44), 22185-22191 (2006).
- Alonso, C., et al. More than a monolayer: Relating lung surfactant structure and mechanics to composition. Biophysical Journal. 87 (6), 4188-4202 (2004).
- Alonso, C., Bringezu, F., Brezesinski, G., Waring, A. J., Zasadzinski, J. A. Modifying calf lung surfactant by hexadecanol. Langmuir. 21 (3), 1028-1035 (2005).
- Alonso, C., Waring, A. J., Zasadzinski, J. A. Keeping lung surfactant where it belongs: Protein regulation of two-dimensional viscosity. Biophysical Journal. 89 (1), 266-273 (2005).
- Zasadzinski, J. A., et al. Inhibition of pulmonary surfactant adsorption by serum and the mechanisms of reversal by hydrophilic polymers: Theory. Biophysical Journal. 89 (3), 1621-1629 (2005).
- McConnell, H. M. Structures and transitions in lipid monolayers at the air-water-interface. Annual Reviews of Physical Chemistry. 42, 171-195 (1991).
- McConnell, H. M., Moy, V. T. Shapes of finite two-dimensional lipid domains. Journal of Physical Chemistry. 92 (15), 4520-4525 (1988).
- Zasadzinski, J. A., Stenger, P., Shieh, I., Dhar, P. Overcoming rapid inactivation of lung surfactant: analogies between competitive adsorption and colloid stability. Biochemica et Biophysica Acta. 1798 (4), 801-828 (2010).
- Zasadzinski, J. A., et al. Surfactant Progress. Nag, K. , New York. (2008).
- Valtierrez-Gaytan, C., et al. Spontaneous evolution of equilibrium morphology in phospholipid-cholesterol monolayers. Science Advances. 8 (14), (2022).
- Williams, I., Zasadzinski, J. A., Squires, T. M. Interfacial rheology and direct imaging reveal domain-templated network formation in phospholipid monolayers penetrated by fibrinogen. Soft Matter. 15 (44), 9076-9084 (2019).
- Sachan, A. K., Zasadzinski, J. A. Interfacial curvature effects on the monolayer morphology and dynamics of a clinical lung surfactant. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 134-143 (2018).
- Alvarez, N. J., Anna, S. L., Saigal, T., Tilton, R. D., Walker, L. M. Intefacial dynamics and rheology of polymer grafter nanoparticles at air-water and xylene-water interfaces. Langmuir. 28 (21), 8052-8063 (2012).
- Alvarez, N. J., Vogus, D. R., Walker, L. M., Anna, S. L. Using bulk convection in a microtensiometer to approach kinetic-limited surfactant dynamics at fluid-fluid interfaces. Journal of Colloid and Interface Science. 372 (1), 183-191 (2012).
- Alvarez, N. J., Walker, L. M., Anna, S. L. Diffusion-limited adsorption to a spherical geometry: The impact of curvature and competitive time scales. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 82, 011604(2010).
- Shieh, I., Waring, A. J., Zasadzinski, J. A. Visualizing the analogy between competitive adsorption and colloid stability to restore lung surfactant function. Biophysical Journal. 102 (4), 777-786 (2012).
- Shieh, I., Zasadzinski, J. A. Visualizing monolayers with a water-soluble fluorophore to quantify adsorption, desorption and the double-layer. Proceedings of the National Academy of Sciences of the United States of America. 112 (8), 826-835 (2015).
- Lipp, M. M., Lee, K. Y. C., Takamoto, D. Y., Zasadzinski, J. A., Waring, A. J. Coexistence of buckled and flat monolayers. Physical Review Letters. 81, 1650-1653 (1998).
- Lipp, M. M., Lee, K. Y. C., Waring, A., Zasadzinski, J. A. Fluorescence, polarized fluorescence, and Brewster angle microscopy of palmitic acid and lung surfactant protein B monolayers. Biophysical Journal. 72 (6), 2783-2804 (1997).
- Alvarez, N. J., Walker, L. M., Anna, S. L. A microtensiometer to probe the effect of radius of curvature on surfactant transport to a spherical interface. Langmuir. 26 (16), 13310-13319 (2010).
- Ward, A. F. H., Tordai, L. Time dependents of boundary tensions of solutions. 1. The role of diffusion in time-effects. Journal of Chemical Physics. 14, 453-461 (1946).
- Lucassen, J., Vanden Tempel, M. Dynamic measurements of dilatational properties of a liquid interface. Chemical Engineering Science. 27 (6), 1283-1291 (1972).
- Lin, G. L., et al. Interfacial dilatational deformation accelerates particle formation in monoclonal antibody solutions. Soft Matter. 12 (14), 3293-3302 (2016).
- Bastacky, J., et al. Alveolar lining layer is thin and continuous: low temperature scanning electron microscopy of rat lung. Journal of Applied Physiology. 79 (5), 1615-1628 (1995).
- Adamson, A. W., Gast, A. P. Physical Chemistry of Surfaces, Sixth ed. , Wiley-Interscience. New York. 784(1997).
- del Rio, O. I., Kwok, D. Y., Wu, R., Alvarez, J. M., Neumann, A. W. Contact angle measurements by axisymmetric drop shape analysis and an automated polynomial fit program. Colloids and Surfaces A Physicochemical and Engineering Aspects. 143 (2-3), 197-210 (1998).
- Kanthe, A., et al. No ordinary proteins: Adsorption and molecular orientation of monoclonal antibodies. Science Advances. 7 (5), 14(2021).
- Manikantan, H., Squires, T. M. Surfactant dynamics: hidden variables controlling fluid flows. Journal of Fluid Mechanics. 892, 115(2020).
- Narayan, S., et al. Dilatational rheology of water-in-diesel fuel interfaces: effect of surfactant concentration and bulk-to-interface exchange. Soft Matter. 17 (18), 4751-4765 (2021).
- Meng, G. N., Paulose, J., Nelson, D. R., Manoharan, V. N. Elastic instability of a crystal growing on a curved surface. Science. 343 (6171), 634-637 (2014).
- Kotula, A. P., Anna, S. L. Insoluble layer deposition and dilatational rheology at a microscale spherical cap interface. Soft Matter. 12 (33), 7038-7055 (2016).
- Lipp, M. M., Lee, K. Y. C., Zasadzinski, J. A., Waring, A. J. Phase and morphology changes in lipid monolayers induced by SP-B protein and its amino-terminal peptide. Science. 273 (5279), 1196-1199 (1996).
- Pocivavsek, L., et al. Stress and fold localization in thin elastic membranes. Science. 320 (5878), 912-916 (2008).
- Pocivavsek, L., et al. Lateral stress relaxation and collapse in lipid monolayers. Soft Matter. 4 (10), 2019-2029 (2008).
- Kim, K., Choi, S. Q., Squires, T. M., Zasadzinski, J. A. Cholesterol nanodomains: their effect on monolayer morphology and dynamics. Proceedings of the National Academy of Sciences of the United States of America. 110 (33), 3054-3060 (2013).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Interfacial microrheology of DPPC monolayers at the air-water interface. Soft Matter. 7 (17), 7782-7789 (2011).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Nonlinear chiral rheology of phospholipid monolayers. Soft Matter. 14 (13), 2476-2483 (2018).
- Kotula, A. P., Anna, S. L. Regular perturbation analysis of small amplitude oscillatory dilatation of an interface in a capillary pressure tensiometer. Journal of Rheology. 59, 85-117 (2015).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten