Method Article
Im lebenden Organismus Weitfeld- und Zwei-Photonen-Kalzium-Bildgebung einer Maus mit einem großen Schädelfenster
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt die Herstellung eines großen (6 x 3 mm2) Schädelfensters mit Lebensmittelverpackung, transparentem Silikon und Deckglas. Dieses Schädelfenster ermöglicht in vivo Weitfeld- und Zwei-Photonen-Kalzium-Bildgebungsexperimente in derselben Maus.
Zusammenfassung
Die Weitfeld-Kalziumbildgebung aus dem Neokortex der Maus ermöglicht es, die kortexweite neuronale Aktivität im Zusammenhang mit verschiedenen Gehirnfunktionen zu beobachten. Auf der anderen Seite kann die Zwei-Photonen-Bildgebung die Aktivität lokaler neuronaler Schaltkreise auf Einzelzellebene auflösen. Es ist wichtig, ein großes Schädelfenster zu erstellen, um eine Analyse mit mehreren Skalen mit beiden bildgebenden Verfahren in derselben Maus durchzuführen. Um dies zu erreichen, muss man einen großen Teil des Schädels entfernen und die freiliegende kortikale Oberfläche mit transparenten Materialien abdecken. Bisher wurden zu diesem Zweck Glasschädel und Schädelfenster auf Polymerbasis entwickelt, die jedoch nicht einfach herzustellen sind. Das vorliegende Protokoll beschreibt ein einfaches Verfahren zur Herstellung eines großen Schädelfensters, bestehend aus handelsüblicher Polyvinylidenchlorid (PVDC)-Umhüllungsfolie, einem transparenten Silikonpfropfen und einem Deckglas. Für die Abbildung der dorsalen Oberfläche einer ganzen Hemisphäre betrug die Fenstergröße ca. 6 x 3 mm2. Starke Gehirnvibrationen wurden trotz eines so großen Fensters nicht beobachtet. Wichtig ist, dass sich der Zustand der Gehirnoberfläche nicht länger als einen Monat verschlechterte. Die Weitfeldbildgebung einer Maus, die einen genetisch kodierten Kalziumindikator (GECI), GCaMP6f, speziell in Astrozyten, exprimierte, zeigte synchronisierte Reaktionen in wenigen Millimetern. Zwei-Photonen-Bildgebung derselben Maus zeigte prominente Kalziumreaktionen in einzelnen Astrozyten über mehrere Sekunden. Darüber hinaus wurde eine dünne Schicht eines Adeno-assoziierten Virus auf den PVDC-Film aufgebracht und erfolgreich GECI in kortikalen Neuronen über das Schädelfenster exprimiert. Diese Technik ist zuverlässig und kostengünstig für die Herstellung eines großen Schädelfensters und erleichtert die Untersuchung der neuronalen und glialen Dynamik und ihrer Wechselwirkungen während des Verhaltens auf makroskopischer und mikroskopischer Ebene.
Einleitung
Die Weitfeld-Kalziumbildgebung untersucht effektiv das raumzeitliche Aktivitätsmuster über einen großen Bereich des tierischen Gehirns 1,2,3. Die Weitfeldbildgebung wurde ausgiebig verwendet, um die gesamte kortikale Oberfläche von Nagetieren zu beobachten, da ihr Kortex relativ flach ist 2,3,4,5,6,7,8,9,10. Transgene Mäuse oder Mäuse, denen Adeno-assoziierte Viren (AAV) injiziert wurden, die spezifisch GECIs in verschiedenen Zellen wie Neuronen und Gliazellen exprimieren, können für die Weitfeld-Kalziumbildgebungverwendet werden 11,12,13. Die räumliche Auflösung dieser Technik reicht jedoch in der Regel nicht aus, um die Aktivität einzelner Zellen in vivoaufzulösen 14. Es eignet sich auch nicht für die Bildgebung von Zellen, die sich in tieferen Schichten befinden.
Auf der anderen Seite kann die Zwei-Photonen-Kalziumbildgebung die Aktivität mehrerer Zellen gleichzeitig mit subzellulärer räumlicher Auflösung beobachten, was die Beobachtung der Aktivität einzelner Zellen auch in neuronalen Dendriten und Gliaprozessenermöglicht 15,16,17,18,19,20,21,22. Es kann auch Zellen in tieferen Schichten der Großhirnrindebeobachten 23,24. Obwohl jüngste technologische Fortschritte in der Zwei-Photonen-Mikroskopie die Bildgebung aus millimeterbreiten kortikalen Regionen ermöglichen 25,26,27,28,29, ist es immer noch schwierig, einen Bereich zu beobachten, der mit der Weitfeldbildgebung durch Zwei-Photonen-Bildgebung vergleichbar ist.
Um die physiologische Relevanz der Gehirnaktivität vom Einzelzell- bis zum Ganzhirn zu verstehen, ist es wichtig, die Lücke zwischen der Aktivität kortikaler Regionen über den gesamten Kortex und der Aktivität bei Einzelzellauflösung in lokalen neuronalen Schaltkreisen zu schließen. Daher ist eine Kombination aus Weitfeld- und Zwei-Photonen-Kalziumbildgebung, die in derselben Maus durchgeführt wird, besonders effektiv. Um dies zu realisieren, muss ein breites und stabiles Schädelfenster geschaffen werden, idealerweise über einen langen Zeitraum.
Zuvor wurden mehrere Techniken zur Herstellung von Schädelfenstern entwickelt, um Weitfeld- und Zwei-Photonen-Bildgebung in derselben Maus durchzuführen30,31. Trapezförmige Deckglasfenster (Kristallschädel), die in die Form der kortikalen Oberfläche geformt sind, um den entfernten Knochen zu ersetzen, ermöglichen einen optischen Zugang über den gesamten Kortex32. Alternativ können polymerbasierte Schädelfenster mit Polyethylenterephthalat (PET)33 oder Polyethylenoxid-beschichtetem amorphem Fluorpolymer-Nanoblatt34 hergestellt werden. Es hat sich gezeigt, dass jede Methode ein stabiles Fenster für mehr als 1 Monat aufrechterhält. Die Herstellung dieser Fenster ist jedoch nicht einfach, und die verwendeten Materialien und Geräte sind oft teuer.
Die vorliegende Studie beschreibt eine neue Methode zur Herstellung eines großen Schädelfensters mit der PVDC-Folie (Plastikfolie) (Abbildung 1). Mit diesem Fenster können in vivo Weitfeld- und Zwei-Photonen-Bildgebungsexperimente an denselben Mäusen durchgeführt werden. Es wurde auch gezeigt, dass GECIs in Neuronen über einen weiten Bereich des Kortex von Mäusen exprimiert werden können, indem eine dünne Filmschicht mit AAV-Partikeln auf der Hülle gebildet wird.
Protokoll
Die experimentellen Verfahren wurden vom Tierversuchskomitee der Universität Yamanashi genehmigt. In dieser Studie wurden Wildtyp- (C57BL/6J, Japan SLC) und transgene Mäuse verwendet, die membranverankertes GECI (Lck-GCaMP6f) in Astrozyten exprimieren. Die transgenen Mäuse wurden durch Kreuzung von AldH1l1-CreERT2-Mäusen gewonnen [B6N. FVB-Tg(Aldh1l1-cre/ERT2)1Khakh/J, kommerziell hergestellt, siehe Materialtabelle] und Flx-Lck-GCaMP6f-Mäuse [C57BL/6N-Gt(ROSA)26Sor/J, kommerziell gewonnene] Mäuse. Die transgenen Mäuse wurden 5 Tage lang mit Tamoxifen (20 mg/ml) (0,05 ml/10 g KG, i.p.) behandelt, um GCaMP6f zu exprimieren. Alle verwendeten Mäuse waren Männchen und Weibchen im Alter von mindestens 4 Wochen. Das Schema des Fensters ist in Abbildung 1A dargestellt, und der chirurgische Eingriff ist in Abbildung 1B zusammengefasst.
1. Vorbereitung auf die Schädelfensterchirurgie
- Betäuben Sie Mäuse mit Isofluran (Induktion: 3%, Operation: 1%-1,5%, Flussrate: 0,2-0,3 l/min). Bestätigen Sie die Tiefe der Anästhesie durch den Verlust des Schwanz- oder Zehenklemmreflexes. Halten Sie die Körpertemperatur mit einem Heizkissen (36-38 °C). Tragen Sie Augensalbe mit einem Wattestäbchen auf, um zu verhindern, dass die Augen von Mäusen unter Narkose austrocknen.
- Injizieren Sie 15%ige Mannitollösung (siehe Materialtabelle) intraperitoneal (3 ml/100 g Körpergewicht). Befestigen Sie den Kopf der Maus auf einem stereotaktischen Rahmen mit Ohrbügeln. Entfernen Sie Haare vom Kopf der Maus mit einem Rasierer und einer Haarentfernungscreme.
- Desinfizieren Sie die Hautoberfläche dreimal mit Povidon-Jod und Alkohol. Wenden Sie Lidocain topisch an, um eine präemptive Analgesie zu gewährleisten. Entfernen Sie die Haut über dem interessierenden Bereich mit einer chirurgischen Schere und legen Sie den Schädel frei (Größe: 15 x 15 mm). Wenn Blutungen vorhanden sind, verwenden Sie ein Wattestäbchen, um die Blutung zu stoppen.
HINWEIS: In dieser Studie wurde die Haut entfernt, um den präfrontalen Kortex zum visuellen Kortex zu beobachten. - Entfernen Sie die Knochenhaut über dem freiliegenden Schädel mit einer Mikrokürette und trocknen Sie die Schädeloberfläche, um die Kopfplatte mit Zahnzement fest am Schädel zu befestigen (siehe Materialtabelle) (Abbildung 2B).
HINWEIS: Die maßgeschneiderte Kopfplatte wird mit einem 3D-Drucker erstellt. Die Designdatei wird im Github-Repository abgelegt (https://github.com/Satoshi-Manita/Head-plates). - Befestigen Sie die Kopfplatte mit Zahnzement (Abbildung 2C). Warten Sie mindestens 20 Minuten, bis der Zement ausgehärtet ist. Befestigen Sie die Kopfplatte mit dem Kopfplattenhalter35.
2. Erstellen des Schädelfensters
- Entfernen Sie den zusätzlichen Zement über dem Schädel mit einem Zahnbohrer (siehe Materialtabelle). Achten Sie darauf, nicht durch den Knochen zu bohren und das Gehirn durch Bohren zu schädigen.
- Markieren Sie den zu schneidenden Bereich mit einem Stift und schneiden Sie mit einem Skalpell in den Knochen. Stumpfen Sie die Spitze des Skalpells, um sicherzustellen, dass die Spitze nicht in den Schädel eindringt (ergänzende Abbildung 1). Beziehen Sie sich auf den Gehirnatlas, um zu bestimmen, wo das Fenster erstellt werden soll.
HINWEIS: Für die vorliegende Studie wurde ein Fenster zwischen -2 mm und +4 mm aus Bregma in der anteroposterioren Achse und von der sagittalen Naht bis +3 mm in der mediolateralen Achse erstellt, einschließlich der motorischen, somatosensorischen und visuellen Kortike. - Schaben Sie den Knochen wiederholt mit einem Skalpell ab, um die Rille zu vertiefen, bis sich der Knochen im zu schneidenden Bereich bei leichter Berührung gut bewegt.
- Entfernen Sie den eingeschnittenen Knochen mit einer feinen Pinzette. Drücken Sie den Knochenlappen nicht in das Gehirn, da dies das Gehirn schädigen kann (Abbildung 1Ba).
HINWEIS: Wenn nach dem Entfernen des Knochens Blutungen beobachtet werden, wenden Sie sofort künstliche Zerebrospinalflüssigkeit (ACSF, siehe Materialtabelle) an und saugen Sie sie ab und wiederholen Sie diesen Vorgang, bis die Blutung aufhört. Alternativ legen Sie einen hämostatischen Gelatineschwamm (ca. 3 mm quadratische Würfel), der in der ACSF getränkt ist, auf die Blutungsstelle. - Wenn die Dura nicht entfernt wird, fahren Sie mit Schritt 2.7 fort.
- Entfernen Sie die Dura mater, indem Sie die folgenden Schritte ausführen.
- Entfernen Sie die Dura zum Beispiel in den folgenden Situationen; Transfektion unter Verwendung der Fibroin-AAV-Filmmethode36 und Beobachtung kleiner Strukturen wie dendritische Stacheln.
- Schneiden Sie die Dura mit einer gezogenen Glaspipette mit einer konischen Spitze von ca. 10 μm. Um diesen Schnitt über das gesamte Fenster zu erweitern, verwenden Sie eine U-förmige Nadel.
- Stellen Sie den Stereomikroskopzoom auf 60-100x ein und entfernen Sie die durchtrennte Dura mater mit einer ultrafeinen Pinzette. Wenn das Entfernen der Dura mater Blutungen verursacht, spülen Sie mit ACSF oder verwenden Sie einen Gelatineschwamm, um die Blutung zu stoppen.
- Schneiden Sie die PVDC-Folie aus.
- Sterilisieren Sie ein großes (z. B. 10 x 15 mm) Stück PVDC-Folie (ca. 11 μm, siehe Materialtabelle, Abbildung 2Aa) autoklavieren und mit 70% Ethanol.
- Verwenden Sie unter einem Stereomikroskop eine Pinzette und ein Skalpell, um eine Packung der erforderlichen Größe auszuschneiden.
HINWEIS: Die Wickelgröße muss ca. 10 mm größer sein als die Größe des Schädelfensters, aber kleiner als die Öffnung der Kopfplatte. Für ein 6 x 3 mm 2 Schädelfenster bereiten Sie eine 15 x 10 mm2 Wicklung vor.
- Platzieren Sie die Verpackung genau und befolgen Sie die folgenden Schritte.
- Legen Sie den Wickel auf die Gehirnoberfläche und lassen Sie den ACSF auf der Oberfläche. Saugen Sie die ACSF vom Rand der Packung ab, so dass die Hülle fest an der Gehirnoberfläche haften bleibt (Abbildung 1Bb,c).
HINWEIS: Die verwendete Packung ist faltenresistent, so dass nur das Platzieren auf der Gehirnoberfläche fast keine Falten erzeugt. - Schneiden Sie den Wickel mit einem Skalpell und einer Pinzette so ab, dass zwischen dem Rand des Schädelfensters und dem Wickel ein Rand von etwa 1 mm besteht (Abbildung 1Bd).
- Sobald der Wickel angebracht ist, kleben Sie den Rand des Wickels mit einem biologischen Klebstoff auf den Schädel (siehe Materialtabelle, Abbildung 2D). Lassen Sie den Klebstoff ca. 30 min trocknen.
- Legen Sie den Wickel auf die Gehirnoberfläche und lassen Sie den ACSF auf der Oberfläche. Saugen Sie die ACSF vom Rand der Packung ab, so dass die Hülle fest an der Gehirnoberfläche haften bleibt (Abbildung 1Bb,c).
- Tragen Sie das transparente Silikonelastomer auf.
- Tragen Sie das handelsübliche transparente Silikonelastomer (siehe Materialtabelle) mit einem Spender mit Mischspitze (Abbildung 1B e, 2Ab-d) auf die Verpackung auf und legen Sie das Deckglas (0,12-0,17 mm dick) darauf (Abbildung 2E).
- Versiegeln Sie den Umfang des Deckglases mit wasserdichter Folie, Sekundenkleber oder Dentalzement (Abbildung 1Bf).
- Überwachen Sie die Maus nach der Operation, bis sie das Bewusstsein wiedererlangt hat, um die sternale Liege aufrechtzuerhalten. Danach halten Sie die Mäuse einzeln und lassen Sie sie mindestens 7 Tage in ihrem Heimkäfig genesen.
- Um Stress und Schmerzen zu reduzieren, verabreichen Sie entzündungshemmende und schmerzstillende Mittel (z. B. Dexamethason und Ketoprofen, jeweils 5 mg/kg, i.p.).
- Überwachen Sie die Mäuse regelmäßig auf Infektionen. Wenn eine Infektion bestätigt wird, verabreichen Sie ein antimikrobielles Medikament (z. B. 10 % Enrofloxacin, 1,7 μl / ml) in das Trinkwasser, bis die Infektion beseitigt ist (typischerweise weniger als 4 Wochen).
3. Herstellung von AAV-Film auf Plastikfolie mit Fibroinlösung
HINWEIS: Schritt 3 ist optional.
- Fibroinlösung aus Seidenraupenkokons nach einer zuvor veröffentlichten Methode37 herstellen.
- Kurz gesagt, kochen Sie handelsübliche Seidenraupenkokons (5 g, siehe Materialtabelle) in Natriumcarbonatlösung (0,02 M, 2 L). Waschen Sie die Kokons in Reinstwasser und trocknen Sie sie über Nacht.
- Die getrockneten Kokons werden in Lithiumbromidlösung (9,3 M, 20 % w/v Fibroin) unter Erhitzen in einem Ofen bei 60 °C für 4 h gelöst. Dialysieren Sie die gelöste Kokonlösung, zentrifugieren Sie (zweimal bei 12.700 x g, bei 4 °C für 20 min)37 und sammeln Sie den Überstand.
- Bereiten Sie den Fibroin-AAV-Film vor, indem Sie die folgenden Schritte ausführen.
- Mischen Sie Fibroin- und AAV-Lösungen20 im Verhältnis 1:4 in einem kleinen Probenröhrchen unter Verwendung einer Mikropipette. Tropfen Sie ein Aliquot der gemischten Fibroin-AAV-Lösung auf die Plastikfolie für das Schädelfenster und trocknen Sie sie mindestens 3 h lang.
HINWEIS: Für die Expression in einem Bereich von 3 mm Durchmesser tragen Sie einen 5 μL Tropfen Fibroin-AAV-Lösung auf. Dieses Verhältnis bestimmt die Menge der Lösung für einen bestimmten Bereich. - Nach dem Trocknen schneiden Sie die Plastikfolie in die für das Fenster erforderliche Größe (z. B. 10 x 15 mm) und legen Sie sie auf die Gehirnoberfläche. Folgen Sie dann der oben genannten Methode ab Schritt 2.8.1.
HINWEIS: Bevor Sie den Wickel auf die Gehirnoberfläche legen, entfernen Sie die ACSF so weit wie möglich auf der Gehirnoberfläche. Dies liegt daran, dass die ACSF den Fibroin-AAV-Film auflösen und die Konzentration von AAV-Partikeln reduzieren soll. - Warten Sie etwa 2-4 Wochen nach dem Erstellen des AAV-behandelten Fensters, bis die GECIs ausreichend exprimiert sind. Überprüfen Sie während dieses Vorgangs regelmäßig den Zustand der Mäuse und Fenster.
- Mischen Sie Fibroin- und AAV-Lösungen20 im Verhältnis 1:4 in einem kleinen Probenröhrchen unter Verwendung einer Mikropipette. Tropfen Sie ein Aliquot der gemischten Fibroin-AAV-Lösung auf die Plastikfolie für das Schädelfenster und trocknen Sie sie mindestens 3 h lang.
4. Kalzium-Bildgebung und -Analyse
HINWEIS: Einzelheiten zur Bildgebung und Analyse finden Sie in den zuvor veröffentlichten Berichten 1,2,38.
- Führen Sie eine Weitfeldbildgebung durch, indem Sie die folgenden Schritte ausführen.
- Immobilisieren Sie die Maus mit einer Kopffixierungsvorrichtung unter einem Tandemlinsenfluoreszenzmakroskop (siehe Materialtabelle).
- Beleuchten Sie die Großhirnrinde von Mäusen mit Anregungslicht von einer 465-nm-LED-Lichtquelle durch einen Erregungsfilter, einen dichroitischen Spiegel und eine Objektivlinse.
- Sammeln Sie die Fluoreszenzbilder der Großhirnrinde mit einer CCD-Kamera durch eine Objektivlinse (1,0x), einen dichroitischen Spiegel, einen Emissionsfilter und eine bildgebende Linse (2,0x). Die Kombination dieser Linsen ergibt eine Gesamtvergrößerung von etwa 0,5x.
- Erfassen Sie Bilder mit einer Abtastfrequenz von 50 Hz. Nach der Datenerfassung analysieren Sie die Bilder mit der ImageJ-Software. Wählen Sie die Region of Interest (ROI) manuell aus. Berechnen Sie die Fluoreszenzänderung in jedem ROI als ΔF / F = (Ft - F0) / F0, wobei Ft der Rohfluoreszenzwert jedes Frames und F0 der mittlere Fluoreszenzwert ist, der aus einem durchschnittlichen Bild aller Frames erhalten wird.
HINWEIS: Ein Makroprogramm für ImageJ wird auf GitHub (https://github.com/Satoshi-Manita/ImageJ-macro) abgelegt, das ΔF/F-Bilder aus Kalzium-Bildgebungsdaten berechnet.
- Führen Sie eine Zwei-Photonen-Bildgebung durch, indem Sie die folgenden Schritte ausführen.
- Immobilisieren Sie die Maus unter einem Zwei-Photonen-Mikroskop mit einem Kopffixierungsgerät. Identifizieren Sie den abzubildenden Bereich mit dem Mikroskop im Hellfeldmodus mit einem Objektiv mit geringer Vergrößerung (5x).
- Wechseln Sie zur Zwei-Photonen-Bildgebung. Verwenden Sie eine Objektivlinse mit hoher Vergrößerung (16x oder 25x) und beleuchten Sie den Laser für die Zwei-Photonen-Anregung.
HINWEIS: Green Lck-GCaMP6f22 und Red XCaMP-R36 wurden von einem ultraschnellen Laser bei Anregungswellenlängen von 920 nm bzw. 1070 nm angeregt. - Nehmen Sie Fluoreszenzbilder bei 30 Hz auf. Nach der Datenerfassung korrigieren Sie Bewegungsartefakte durch die Registrierungsfunktion der suite2p-Software39. Erzielen Sie ROI und ΔF/F aus Bildern mit der gleichen Methode für die Weitfeldbildgebung.
- Plotten Sie die Daten mit Python mit den folgenden Bibliotheken: NumPy, Matplotlib und Pandas (siehe Materialtabelle).
Ergebnisse
Bewertung eines großen Schädelfensters mit den PVDC-Wickelmethoden
Unmittelbar nach der Operation kann Erfolg oder Misserfolg auf einen Blick anhand des Zustands der kortikalen Oberfläche, wie Blutungen und Farbveränderungen aufgrund von Schäden oder Ischämie, überprüft werden. Lange Zeit nach der Operation kann die kortikale Oberfläche aufgrund einer Infektion mit einer undurchsichtigen weißen Membran bedeckt sein, oder Blut kann das Fenster aufgrund von Blutungen bedecken (Abbildung 2G). In diesen Fällen ist der Kortex möglicherweise nicht in gesundem Zustand und eine Bildgebung ist möglicherweise nicht möglich. Diese können durch teilweise durchtrennte Wickel oder unzureichende Fixierung der Umhüllung durch den Klebstoff verursacht werden. Wenn die Infektion wiederholt beobachtet wird, kann es wirksam sein, Antibiotika, zum Beispiel Gentamicinsulfat (10 μL, 50 mg / ml), über die Gehirnoberfläche bei Fensterplatzierung aufzutragen. Die Regeneration von Hirnhäuten oder Knochen wird auch beobachtet, wenn der vertikale Spalt zwischen der kortikalen Oberfläche und dem Wickel groß ist. Um dies zu verhindern, ist es entscheidend, den Wickel während der Fenstervorbereitung so fest wie möglich auf die Gehirnoberfläche aufzutragen. Dies kann erreicht werden, indem Plastikfolie auf die Gehirnoberfläche gelegt und so viel ACSF wie möglich abgesaugt wird. In Abwesenheit von ACSF kann dies durch einfaches Legen der Plastikfolie auf die Gehirnoberfläche erfolgen. Das Gehirn und die Blutgefäße werden durch die Tatsache als unbeschädigt eingestuft, dass die Farbe des Gehirns nicht verfärbt ist und Blutgefäße nicht durchtrennt werden.
Die Langlebigkeit des Fensters hängt weitgehend von der Qualität der Operation ab. Wenn der Zustand gut ist, gibt es keine Anzeichen einer Infektion, Blutung oder Regeneration mehr als 1 Monat nach der Operation (Abbildung 2F und Abbildung 3B). Bei 8 von 10 Mäusen konnte das Fenster bis zu 10 Wochen oder länger frei gehalten werden. Fenster in zwei der Mäuse konnten aufgrund von Infektionen oder Blutungen nicht richtig aufrechterhalten werden. Obwohl das große Fenster anfällig für mechanische Beanspruchung oder Stöße sein kann, wurden gebrochene oder gesprungene Fenster nicht beobachtet.
Um die Abbildungsqualität des neuen Schädelfensters mit Wickel, Silikon und Glas zu bewerten, wurde die Punktspreizfunktion unter dem neuen Fenster mit der unter dem herkömmlichen Glasfenster verglichen, indem 0,1 μm fluoreszierende Perlen in Agar abgebildet wurden (siehe Ergänzungsdatei 1). Die Ergebnisse zeigten keinen Unterschied in der vollen Breite bei halbem Maximum (FWHM) für beide Bedingungen. [X-Achse (μm): nur Glas, 1,99 ± 0,07, Wickelung, 1,76 ± 0,13, Y-Achse (μm): nur Glas, 2,11 ± 0,27, Wickelung, 1,90 ± 0,15, Z-Achse (μm): nur Glas, 25,29 ± 0,71, Wickelung, 26,64 ± 1,02, N = 7 Perlen, p > 0,05, der Mann-Whitney-U-Test, ergänzende Abbildung 2A,B]. Daher haben die neu hinzugefügten Elemente (Folie und Silikon) die Bildqualität nicht verschlechtert.
Vibrationsartefakte, die durch Atmung, Herzschlag und Körperbewegung verursacht werden, sind in der Weitfeld- und Zwei-Photonen-Bildgebung vorhanden. Um zu bestimmen, wie stark das neue Schädelfenster vibriert, wurde ein kleines fluoreszierendes Partikel aus den in vivo Zwei-Photonen-Bilddaten ausgewählt und untersucht, wie stark sich sein Bild während 60 s bewegte. Es wurde festgestellt, dass die Standardabweichung des Schwerpunkts dieses fluoreszierenden Partikels etwa 0,3 μm betrug, was mit der unter einem herkömmlichen Glasfenster vergleichbar ist (ergänzende Abbildung 2C). Dies deutet darauf hin, dass, weil das Gehirn durch einen transparenten Silikonpfropfen und Deckglas gehalten wurde, die Vibrationen mit denen vergleichbar waren, die in herkömmlichen kleineren Fenstern beobachtet wurden, und die Offline-Bildregistrierung ausreichte, um Vibrationsartefakte zu eliminieren.
In der Weitfeld-Kalziumbildgebung konnte beobachtet werden, wie sich die kortikale Aktivität durch sensorische Stimulation über den Kortex ausbreitet (Abbildung 3A-D,K-N). Die Zwei-Photonen-Bildgebung ermöglichte die Beobachtung von Einzelzell-Fluoreszenzbildern, die spezifisch für Neuronen und Gliazellen sind (Abbildung 3E,O). Fluoreszenzänderungen, die durch sensorische Stimulation induziert wurden, konnten in einzelnen Zellen beobachtet werden (Abbildung 3E-J,O-T).
Expression von genetisch kodierten Kalziumindikatoren (GECIs) in einem weiten Bereich der Großhirnrinde unter Verwendung der PVDC-Umhüllung und AAV
Die PVDC-Umhüllung für das Fenster könnte angewendet werden, um funktionelle Proteine in einem weiten Bereich des Kortex zu exprimieren. Dies wird unter Verwendung von AAV und Fibroin erreicht, einem Komponentenprotein von Seidenraupenkokons, die als Biomaterialien weit verbreitet sind37. Eine frühere Studie zeigte, dass Fibroin mit AAVs gemischt werden kann, wodurch Filme gebildet werden, die in das Gehirn implantiert werden, um funktionelle Proteine wie photoaktivierbare Opsine oder GECIs zu exprimieren36. In der vorliegenden Studie wurden AAV-exprimierende GECI und Fibroin auf dem Wickel gemischt und getrocknet, und AAV-beschichteter Wickel wurde für das Schädelfenster verwendet. Dies führte 2-4 Wochen nach der Operation zur Expression von GECI über den breiten Bereich des Kortex (Abbildung 3K-M). Da das Fenster groß war, können verschiedene kortikale Bereiche derselben Maus abgebildet werden (Abbildung 3M-T).
Um die Expressionseffizienz dieser Methode zu bestätigen, wurde die Anzahl der Zellen, die GECI exprimieren, im festen Gehirn gezählt (ergänzende Abbildung 2D). Es wurde festgestellt, dass die vorliegende Strategie unter Verwendung der Umhüllung mit Fibroin-AAV zur Expression von GECI mit einer Effizienz von etwa 20% sowohl in oberflächlichen als auch in tieferen Schichten führte (L2/3: 20,78%, XCaMP-R-exprimierende Zelle: 32 Zellen, DAPI: 154 Stellen, L5: 20,08%, XCaMP-R-exprimierende Zelle: 51 Zellen, DAPI: 254 Stellen). Daher exprimierte diese Methode GECIs in Zellen nicht nur in Oberflächenschichten, sondern auch in tieferen Schichten.
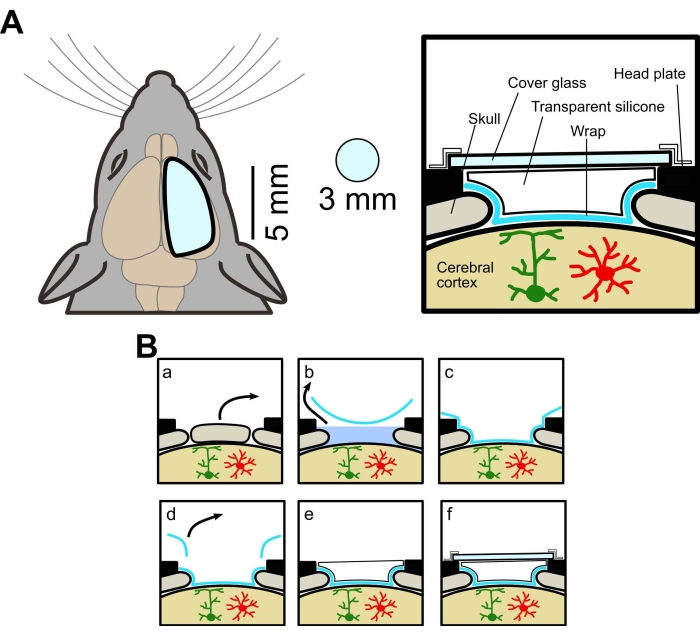
Abbildung 1: Konzeptuelles Diagramm des großen Schädelfensters. (A) Linke, schematische Zeichnung des neuen Schädelfensters. Es ist größer als das herkömmliche Fenster (3 mm Durchmesser). Rechts, Querschnittsansicht. Die Methode zur Herstellung eines großen Schädelfensters verwendet Lebensmittelverpackung, transparentes Silikonelastomer und Deckglas, was eine Weitfeld- und Zwei-Photonen-Bildgebung von derselben Maus ermöglicht. (B) Verfahren zur Herstellung von Schädelfenstern: (a) Knochenentfernung. b) Entfernung von ACSF unter der Umhüllung. (c) Anhaftung der Packung an der Gehirnoberfläche durch Entfernung von ACSF. d) Abschneiden der überschüssigen Umhüllung. e) Auftragen von transparentem Silikon. f) Anbringen von Deckglas. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
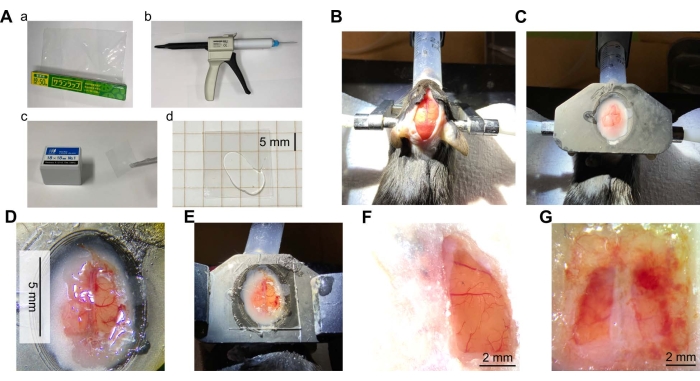
Abbildung 2: Überblick über die Schädelfensterchirurgie . (A) Für das Schädelfenster erforderliche Materialien und Ausrüstung. a) Polyvinylidenchlorid (PVDC)-Umhüllungsfolie. b) Ein Spender aus transparentem Silikonelastomer mit Mischspitze. c) Deckglas. d) Durchsichtiges Silikon zwischen zwei Teilen des Deckglases. (B) Foto der Mauskopfhaut, die eingeschnitten wurde, um den Schädel freizulegen. Die Maus wurde betäubt und der Kopf der Maus wurde mit Ohrbügeln ruhiggestellt. Der Kopf wurde dann enthaart, mit lokaler Analgesie behandelt und die Haut wurde eingeschnitten. (C) Foto nach dem Einbau einer Kopfplatte. Eine Kopfplatte (aus Harz aus einem 3D-Drucker) wurde mit Zahnzement am Kopf der Maus befestigt. (D) Foto eines Schädelfensters. Das Schädelfenster wurde im Kortex der rechten Hemisphäre des Mausgehirns geschaffen. Die Dura Mater wurde entfernt und der Wickel eingeklebt. (E) Ein Foto des Fensters aus der Verpackung mit dem transparenten Silikon und Deckglas auf der Oberseite. (F) Ein typisches Beispiel für ein erfolgreiches Fenster (rechte Hemisphäre, 7 Wochen nach der Operation). (G) Beispiel für ein fehlgeschlagenes Fenster (beide Hemisphären, 5 Wochen nach der Operation). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
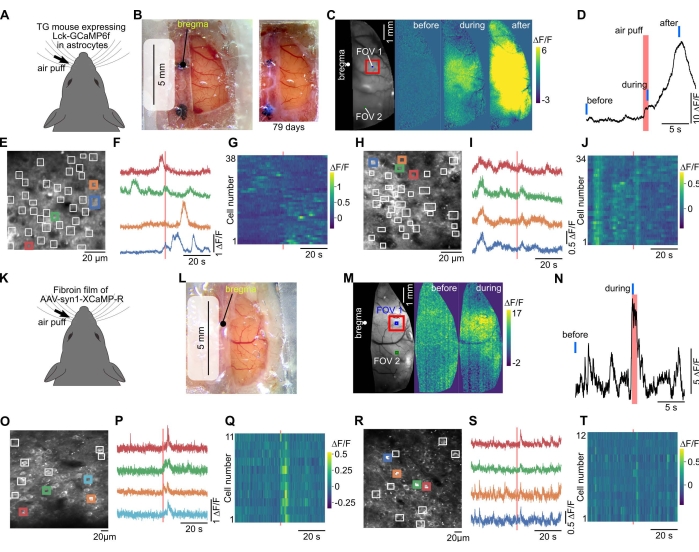
Abbildung 3: Das große Fenster ermöglicht Weitfeld- und Zwei-Photonen-Calcium-Aufnahmen von derselben Maus. (A) Die Calcium-Bildgebung wurde in einer transgenen Maus durchgeführt, die membranverankertes GECI (Lck-GCaMP6f) in Astrozytenexprimierte 40. (B) Links wurde ein großes Fenster mit Plastikfolie, transparentem Silikon und Deckglas geschaffen. Die Weitfeldbildgebung wurde über dieses Fenster durchgeführt. Rechts, ein Foto wurde 79 Tage nach der Installation des Schädelfensters aufgenommen. (C) Wenn die Luftblasenstimulation auf die kontralateralen Schnurrhaare angewendet wurde, wurden Fluoreszenzveränderungen beobachtet. (D) Der zeitliche Verlauf der Fluoreszenzänderung im somatosensorischen Kortex (rotes Quadrat in C) wurde aufgetragen. Rote und blaue Balken zeigen das Timing des Luftzuges bzw. "vor", "während" und "nach" in (C) an. (E) Das Sichtfeld (FOV 1 in C) der Zwei-Photonen-Kalziumbildgebung. Da GCaMP6f exprimiert wurde, um auf der Membran zu lokalisieren, wurden die interessierenden Regionen (weiße Quadrate) manuell platziert, um die lokale Reaktion in Astrozytenprozessen zu erkennen. (F) Die Fluoreszenzänderungen in den farbigen Quadraten in (E) werden aufgetragen. (G) Die Fluoreszenzänderungen in allen Quadraten von (E) werden aufgetragen. Horizontale und vertikale Achsen geben die Zeit bzw. die Zellenzahl an. (H-J) Daten für FOV 2 (im visuellen Kortex) in (C) werden gezeigt. Das FOV 2 wurde nach der Bildgebung im FOV 1 abgebildet. (K) Rotes GECI, XCaMP-R, wurde in Neuronen durch die Fibroin-AAV-Methode in der Wildtyp-Maus exprimiert. (L) Foto, aufgenommen zwei Wochen nach der Operation, bei der das Fenster mit dem Fibroinfilm erstellt wurde. (M) An dieser Maus wurde eine Weitfeld-Kalziumbildgebung durchgeführt. (N) Die durch die Stimulation der Schnurrhaare hervorgerufene Fluoreszenzänderung wurde von der prominentesten Stelle (somatosensorischer Kortex, rotes Quadrat in (M)) aufgetragen. Rote und blaue Linien zeigen das Timing des Luftstoßes bzw. "vor" und "während" in (M) an. (O) Sichtfeld (somatosensorischer Kortex, FOV 1 in (M)) der Zwei-Photonen-Kalziumbildgebung in 300 μm Tiefe. ROIs wurden manuell bei neuronalen Somata platziert. (P) Die Fluoreszenzänderungen in den farbigen Quadraten in (O) werden aufgetragen. (Q) Die Fluoreszenzänderungen in allen Quadraten von (O) werden farbig dargestellt. (R-T) Es werden Daten für FOV 2 in (M) im parietalen Kortex gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Abbildung 1: Tipps für Skalpelle. Die Spitze des neuen Skalpells (oben) im Vergleich zum Skalpell, mit dem der Schädel mit einer abgestumpften Spitze geschnitten wurde (unten). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Validierung des neuen Schädelfensters und der Fibroin-AAV-Expressionsmethode. (A) Fluoreszenzintensitätsprofil der 0,1 μm fluoreszierenden Perlen in Agar. Die obere Zeile zeigt Daten aus einem Zustand, in dem nur Deckglas über fluoreszierende Perlen gelegt wurde, die in Agar gemischt wurden, und die untere Zeile zeigt Daten aus einem Zustand, in dem Wickel, transparentes Silikon und Deckglas platziert wurden. Die grauen Spuren zeigen die Gaußsche Anpassung an das Fluoreszenzintensitätsprofil für jede Perle, und die roten Spuren zeigen ihre Durchschnittswerte (n = 7). (B) Zusammenfassung der Daten unter Buchstabe A. Jedes Diagramm zeigt die volle Breite bei halbem Maximum (FWHM) der Punktspreizfunktion auf der XYZ-Achse. Das graue Diagramm zeigt die Daten für jede Perle, und das Rot zeigt ihren Mittelwert und Standardfehler. (C) Aus den 2.000 Bildern (60 s Aufnahme) von In-vivo-Bilddaten wurde ein kleines fluoreszierendes Partikel ausgewählt und untersucht, wie stark sich das Bild während der 60 s bewegte. Das fluoreszierende Bild in der Mitte entspricht dem Durchschnitt von 2.000 Bildern. Die Bilder wurden durch Mittelwertbildung in X- und Y-Achsenrichtung projiziert. Die Histogramme zeigen die Verteilung des Schwerpunkts in jedem Bild. Die Standardabweichungen des Schwerpunkts betrugen X: 0,36 und Y: 0,315 μm. (D) Beispiel für GECI-Expression nach der Fibroin-AAV-Methode. Links: Eine Scheibe der Großhirnrinde wendete die Fibroin-AAV-Expressionsmethode an. Rot und Blau zeigen Fluoreszenz von XCaMP-R bzw. DAPI an; XCaMP-R wurde nicht nur in Schicht 2/3 Zellen, sondern auch in Schicht 5 Zellen exprimiert. Mitte und rechts. Vergrößerte Ansichten der Ebenen 2/3 bzw. 5 in der linken Abbildung (Cyan-Quadrate). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 1: (A) Expressionseffizienz des Wraps mit der Fibroin-AAV-Filmmethode und (B) Bewertung der Punktverteilungsfunktion während der Zwei-Photonen-Bildgebung. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Dieser Artikel stellt eine kostengünstige Methode zur Erstellung eines großen Schädelfensters mit einer PVDC-Plastikfolie, transparentem Silikon und Deckglas vor. Mit dieser Methode konnten wir zeigen, dass eine Weitfeld-Kalziumbildgebung über einen weiten Bereich der Großhirnrinde durchgeführt werden kann. Die Zwei-Photonen-Kalziumbildgebung kann von mehreren verschiedenen kortikalen Regionen in derselben Maus durchgeführt werden, die einer Weitfeldbildgebung unterzogen wurde. Darüber hinaus wurde gezeigt, dass ein Fibroin-AAV-Film auf der für das Fenster verwendeten Plastikfolie GECI über einen weiten Bereich des Kortex exprimieren kann.
Kritische Schritte
Es ist wichtig, Infektionen und Schäden am Gehirn zu vermeiden, wenn Schädelfenster mit Plastikfolie hergestellt werden. Unter diesen Bedingungen kann die neuronale und gliale Aktivität nicht beobachtet werden, und die Bildgebung tieferer Bereiche ist unmöglich. Verletzungen der Blutgefäße führen auch zu Blutungen, was die Bildgebung aufgrund von Blut unmöglich macht. Um eine Infektion zu vermeiden, ist es wichtig, die Gehirnoberfläche und den Wickel so fest wie möglich zu befestigen, indem die ACSF abgesaugt wird. Die Verabreichung von Mannitol ist wichtig, um Hirn- und Blutgefäßschäden zu vermeiden, indem ein erhöhter Hirndruck während der Operation verhindert wird. Dies erhält den Raum zwischen der Oberfläche des Gehirns und der Dura mater und verhindert, dass das Gehirn und die Blutgefäße während der Entfernung des Schädels und der Dura mater berührt werden. Ein Stereomikroskop mit hoher Vergrößerung und eine Pinzette mit scharfen Spitzen sind ebenfalls für eine genaue Operation geeignet.
Bei der Fibroin-AAV-Methode ist es wichtig, Fleischseidenraupenkokons zu verwenden, um Fibroinlösung nicht einzufrieren, die Fibroin-AAV-Lösung ausreichend zu trocknen und genügend Lösungsvolumen (5 μL pro 3 mm Durchmesser) aufzutragen. Wenn ältere Kokons verwendet wurden, war die Expressionseffizienz geringer. Dies liegt daran, dass Fibroin aus alten Kokons leicht denaturiert werden kann. Wenn Fibroinlösung bei -80 °C eingefroren und zum Zeitpunkt der Anwendung aufgetaut wurde, war die Expressionseffizienz schlecht. Dies kann auf die Denaturierung des Proteins durch Einfrieren und Auftauen zurückzuführen sein. Da Fibroinlösungen, die bei 4 °C gelagert werden, bis zur Gelierung effektiv verwendet werden können, wird empfohlen, Fibroinlösungen nach der Gelierung gekühlt und aus Kokons wieder gereinigt zu halten. Die Fibroin-AAV-Lösung sollte mindestens 3 h getrocknet werden, da die Expression nach weniger als 3 h schlecht ist. Schließlich hängt der Expressionsbereich von der Menge der verwendeten Fibroin-AAV-Lösung ab. Im Beispiel in Abbildung 3M war die Menge klein (5 μL); so bedeckte der Fibroin-AAV-Film nur die obere Hälfte des Fensters, was zu einer ungleichmäßigen Expression über dem Fenster führte. Wenn eine ausreichende Menge an Fibroin-AAV verwendet wird, ist die Expression über das gesamte Fenster einheitlich.
Modifikationen der Technik
Die neuartige Schädelfenstertechnik ermöglicht es, die makroskopische Aktivität kortikaler Schaltkreise und ihre zugrunde liegende Aktivität auf Einzelzellebene in derselben Maus zu untersuchen. Somit kann die Methode auf eine Vielzahl von neurowissenschaftlichen Studien angewendet werden. Zum Beispiel kann es verwendet werden, um kortikale Aktivität während Entscheidungsfindungsaufgaben, motorischem Lernen und in Mausmodellen von Hirnverletzungen und Krankheiten zu beobachten. Wir glauben auch, dass die Methode nicht nur auf Nagetiere, sondern auch auf nichtmenschliche Primaten angewendet werden kann.
Diese Arbeit zeigt, dass das große Schädelfenster für die Bildgebung transgener Mäuse und Mäuse, denen AAV exprimierende funktionelle Proteine injiziert wurde, wirksam ist. Insbesondere wird gezeigt, dass der Fibroin-AAV-Film auf der Umhüllung viel einfacher ist als eine herkömmliche AAV-Injektionsmethode, um GECIs über den weiten Bereich des Kortex zu exprimieren. Unter Verwendung einer Mischung aus zwei AAVs, die GECIs unterschiedlicher Farbenkodieren 41, kann die Korrelation zwischen Neuronen- und Gliazellaktivität gleichzeitig über einen weiten Bereich des Kortex abgebildet werden. Darüber hinaus kann die Fibroin-AAV-Filmmethode auch auf andere genetisch kodierte Biosensoren 42,43,44,45,46,47 angewendet werden.
Das größere Schädelfenster, das beide Hemisphären abbilden kann, ist ebenfalls möglich. Zwei-Photonen-Mikroskope mit einem viel breiteren Sichtfeld (~25 mm2) wurden kürzlich entwickelt 25,26,27,28,29. Die Kombination dieser Zwei-Photonen-Bildgebungstechnik mit der Ein-Photonen-Weitfeld-Bildgebung unter Verwendung des hier beschriebenen breiten Schädelfensters wird es uns ermöglichen, die Beziehung zwischen Populationsaktivität und Einzelzellaktivität aus beispiellosen Skalen zu untersuchen.
Begrenzungen
Die Lebensmittelverpackung lässt keine Substanzen durch. Dies macht es schwierig, die Methode für pharmakologische Experimente zu verwenden. Es ist auch schwierig, die Folie zu entfernen, so dass es unmöglich ist, eine Glaspipette oder Elektrode einzuführen. Daher ist es schwierig, Experimente in Kombination mit anderen Methoden wie gleichzeitiger Kalziumbildgebung und elektrophysiologischen Aufzeichnungen sowie der lokalen Verabreichung von Medikamenten mit einer Glaspipette durchzuführen. Eine mögliche Lösung für diese Einschränkungen ist die Verwendung der Folie und des Glasfensters mit einem Loch. Dies ermöglicht den Zugang zum Gehirn über eine Glaspipette oder eine Aufzeichnungselektrode, während das Schädelfenster über einen langen Zeitraum steril gehaltenwird 48.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde unterstützt durch Grant-in-Aid for Transformative Research Areas (A) 'Glial Decoding' (JP21H05621 an SM), JSPS KAKENHI (JP19K06883 an SM, 15KK0340 an ES, JP22H00432, JP22H05160, JP17H06312 an HB und JP17H06313 an KK), Grant-in-Aid for Brain Mapping by Integrated Neurotechnologies for Disease Studies (Brain/MINDS) (JP19dm0207079h0002 an SM, JP19dm0207079 an HB und JP19dm0207080 an KK), Narishige Neuroscience Research Foundation (an SM), Stipendium für junge Forscher aus der Präfektur Yamanashi (an SM) und Takeda Science Foundation (an SM) und teilweise unterstützt durch The Frontier Brain Research Grant von Univ. Yamanashi.
Wir danken N. Yaguchi und K. Okazaki für die Tierpflege und technische Unterstützung und den Mitgliedern des Kitamura-Labors für hilfreiche Gespräche.
Materialien
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde phosphate buffer solution | NACALAI TESQUE, Kyoto, Japan | TritonX | Expression efficiency of the wrap with the fibroin-AAV film method |
| 50 mL beaker | |||
| Acquisition software | Brain vision | BV_Ana | For wide-field calcium imaging of GCaMP6f |
| Acquisition software | Hamamatsu photonics | High speed recording software: HSR | For wide-field calcium imaging of XCaMP-R |
| Acquisition software | Vibrio Technologies | scanImage | For two-photon calcium imaging |
| ACSF (artificial cerebrospinal fluid) | 150 mM NaCl, 2.5 mM KCl, 10 mM HEPES, 2 mM CaCl2, 1 mM MgCl2, pH = 7.4 with 1M NaOH | ||
| ACSF aspiration needle | |||
| Adeno-associated virus | VectorBuilder | custom-made | AAV-DJ/8-Syn1-XCaMP-R |
| Adhesives for biological use | Daiichi Sankyo | Aron Alpha-A | |
| Anesthesia machine | Shinano seisakusho | SN-487 | |
| Anesthetic | Kyoritsu Seiyaku Corporation | pentobarbital | Expression efficiency of the wrap with the fibroin-AAV film method |
| Auxiliary ear bar | Narishige | EB-5N | |
| CCD camera | Brain vision | MiCAM02-HR | For wide-field calcium imaging of GCaMP6f |
| Clear vinyl polysiloxane | GC | Exaclear | |
| CMOS camera | Hamamatsu photonics | ORCA-spark | For wide-field calcium imaging of XCaMP-R |
| Cotton swab | |||
| Cover glass | Matsunami | 18 x 18 NO.1 | Size: 18 x 18 mm, Thickness: 0.13-0.17 mm, Borosilicate glass |
| DAPI | Thermo Fisher | D1306 | Expression efficiency of the wrap with the fibroin-AAV film method |
| Ddialysis cassette | 3.5K MWCO, Slide-A-Lyzer | ThermoFisher | |
| Dental adhesive resin cement | SUN MEDICAL | Super-Bond | |
| Dental drill | Nakanishi | VOLVERE Vmax | |
| Digital scale | Dretec | KS-243 | |
| Filters | Brain vision | EM: BP466/40-25, DM: DM506, EX: BP520/36-50 | |
| Filters | Olympus | U-MRFPHQ, EM: BP535-555HQ, DM: DM565HQ, Ex: BA570-625HQ | |
| Fluorescence microscope | Keyence | BZ-X810 | Expression efficiency of the wrap with the fibroin-AAV film method |
| Fluorescent beads | Fluoresbrite YG Carboxylate Microspheres | 0.1 µm | Evaluation of the point spread function under the conventional and the new cranial windows in two-photon imaging |
| Forceps | FST | No. 11252-20 | thin-tipped, for removal of dura mater |
| Forceps | KFI | K-7, No.J 18-8 | for general use |
| Gelatin for hemostasis | Johnson & Johnson | Spongostan | |
| Gentamicin sulfate | Iwaki seiyaku | ||
| Glass pipette | custom-made | ||
| Hair remover | Reckitt Japan | Veet | |
| Head fixing device | custom-made | Craniotomy for Cortical Voltage-sensitive Dye Imaging in Mice. Suzuki, T., and Murayama, M. Bio-protocol 2016 6:e1722. | |
| Head plate | custom-made | aluminum or resin, size: 40 x 25 mm, thickness: 1.5 mm or 2 mm, hole in the center: 15 x 10 mm (head_plate_06 v3.f3d) | |
| Heating pad | |||
| Image processing software (for calcium imaging data analysis) | ImageJ | https://imagej.net | |
| Isoflurane | Pfizer | ||
| Light source | Hayashi-repic | LA-HDF108AA | |
| Light source | Brain vision | LEX2-LZ4-B | For wide-field calcium imaging of GCaMP6f |
| Light source | Olympus | U-HGLGPS | For wide-field calcium imaging of XCaMP-R |
| Mannitol solution (15% with saline) | Sigma-Aldrich (Merck) | M4125 | |
| Micro curette | FST | No. 10080-05 | |
| Microscope | Brain vision | For wide-field calcium imaging of GCaMP6f | |
| Microscope | Olympus | MVX10 | For wide-field calcium imaging of XCaMP-R |
| Microscope | Sutter Instruments | MOM | For two-photon calcium imaging |
| Microslicer | Dosaka EM | DTK-1000N | Expression efficiency of the wrap with the fibroin-AAV film method |
| Mixing tip | GC | ||
| Needle (30 G) | |||
| Polyethylens spoids | AS ONE | 1-4656-01 | |
| Polyvinylidene chloride (PVDC) film | Asahi Kasei | Asahi Wrap (or Saran Wrap) | |
| Povidone-iodine | Mundipharma | Isodine | |
| Python libralies | NumPy | package for scientific computing, https://numpy.org/doc/stable/index.html# | |
| Matplotlib | library for visualizations, https://matplotlib.org/stable/index.html# | ||
| pandas | data analysis and manipulation tool, https://pandas.pydata.org | ||
| Scalpel | Kai | No. 11 | |
| Shaver for animal | |||
| Silicone dispensers | GC | ||
| Silkworm cocoon | Satoyama Craft News | https://sato-yama.jp/ | |
| Stereomicroscope | LEICA | MZ6 | objective lens: 0.63x, eyepiece: 25x |
| Surfactant | NACALAI TESQUE | TritonX | Expression efficiency of the wrap with the fibroin-AAV film method |
| Surgical Scissors | FST | No. 91460-11 | |
| Syringe for mannitol injection | Terumo | 1mL | |
| Transdermal anesthetic | AstraZeneca | Lidocaine | |
| Transgenic mice used for calcium imaging of astrocytes | The mice were obtained by the following method. AldH1l1-CreERT2 mice: B6N.FVB-Tg(Aldh1l1-cre/ERT2)1Khakh/J (The Jackson laboratory, strain #: 031008) Tamoxifen-inducible Cre recombinase expression directed at high levels to the vast majority of astrocytes Flx-Lck-GCaMP6f mice: C57BL/6N-Gt(ROSA)26Sor[tm1(CAG-GCaMP6f)Khak]/J (The Jackson laboratory, strain #: 029626) Cre-dependent expression of a plasma membrane-targeted GCaMP6f. A mouse born from crossbreeding these mice were treated with tamoxifen (20 mg/mL) for 5 days (0.05 mL/10g bw, i.p.) to express GCaMP6f. | ||
| Tunable ultrafast lasers | Spectra-Physics | InSight X3 | For two-photon calcium imaging |
| Waterproof film | Nichiban | BFR5 | |
| Wild-type mice | Japan SLC | C57BL/6J | Male and femalek, >4 weeks old |
Referenzen
- Ren, C., Komiyama, T. Wide-field calcium imaging of cortex-wide activity in awake, head-fixed mice. STAR Protocols. 2 (4), 100973(2021).
- Couto, J., et al. Chronic, cortex-wide imaging of specific cell populations during behavior. Nature Protocols. 16 (7), 3241-3263 (2021).
- Kauvar, I. V., et al. Cortical Observation by Synchronous Multifocal Optical Sampling Reveals Widespread Population Encoding of Actions. Neuron. 107 (2), 351-367 (2020).
- Clancy, K. B., Orsolic, I., Mrsic-Flogel, T. D. Locomotion-dependent remapping of distributed cortical networks. Nature Neuroscience. 22 (5), 778-786 (2019).
- MacDowell, C. J., Buschman, T. J. Low-dimensional spatiotemporal dynamics underlie cortex-wide neural activity. Current Biology. 30 (14), 2665-2680 (2020).
- Makino, H., et al. Transformation of cortex-wide emergent properties during motor learning. Neuron. 94 (4), 880-890 (2017).
- Murphy, T. H., et al. Automated task training and longitudinal monitoring of mouse mesoscale cortical circuits using home cages. eLife. 9, 559654(2020).
- Rynes, M. L., et al. Miniaturized head-mounted microscope for whole-cortex mesoscale imaging in freely behaving mice. Nature Methods. 18 (4), 417-425 (2021).
- Cardin, J. A., Crair, M. C., Higley, M. J. Mesoscopic imaging: Shining a wide light on large-scale neural dynamics. Neuron. 108 (1), 33-43 (2020).
- Ren, C., Komiyama, T. Characterizing cortex-wide dynamics with wide-field calcium imaging. The Journal of Neuroscience. 41 (19), 4160-4168 (2021).
- Hamodi, A. S., Martinez Sabino, A., Fitzgerald, N. D., Moschou, D., Crair, M. C. Transverse sinus injections drive robust whole-brain expression of transgenes. eLife. 9, 53639(2020).
- Michelson, N. J., Vanni, M. P., Murphy, T. H. Comparison between transgenic and AAV-PHP.eB-mediated expression of GCaMP6s using in vivo wide-field functional imaging of brain activity. Neurophotonics. 6 (2), 025014(2019).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007(2021).
- Fan, J. T., et al. Video-rate imaging of biological dynamics at centimetre scale and micrometre resolution. Nature Photonics. 13 (11), 809-816 (2019).
- Stuart, G. J., Spruston, N. Dendritic integration: 60 years of progress. Nature Neuroscience. 18 (12), 1713-1721 (2015).
- Grienberger, C., Chen, X., Konnerth, A. Dendritic function in vivo. Trends in Neurosciences. 38 (1), 45-54 (2015).
- Takahashi, N., et al. Locally synchronized synaptic inputs. Science. 335 (6066), 353-356 (2012).
- Kitamura, K., Hausser, M. Dendritic calcium signaling triggered by spontaneous and sensory-evoked climbing fiber input to cerebellar Purkinje cells in vivo. The Journal of Neuroscience. 31 (30), 10847-10858 (2011).
- Manita, S., et al. A top-down cortical circuit for accurate sensory perception. Neuron. 86 (5), 1304-1316 (2015).
- Stobart, J. L., et al. Cortical circuit activity evokes rapid astrocyte calcium signals on a similar timescale to neurons. Neuron. 98 (4), 726-735 (2018).
- Srinivasan, R., et al. Ca(2+) signaling in astrocytes from Ip3r2(-/-) mice in brain slices and during startle responses in vivo. Nature Neuroscience. 18 (5), 708-717 (2015).
- Shigetomi, E., Patel, S., Khakh, B. S. Probing the complexities of astrocyte calcium signaling. Trends in Cell Biology. 26 (4), 300-312 (2016).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proceedings of the National Academy of Sciences of the United States of America. 112 (36), 11377-11382 (2015).
- Kondo, M., Kobayashi, K., Ohkura, M., Nakai, J., Matsuzaki, M. Two-photon calcium imaging of the medial prefrontal cortex and hippocampus without cortical invasion. eLife. 6, 26839(2017).
- Demas, J., et al. cortex-wide volumetric recording of neuroactivity at cellular resolution using light beads microscopy. Nature Methods. 18 (9), 1103-1111 (2021).
- Ota, K., et al. cell-resolution, contiguous-wide two-photon imaging to reveal functional network architectures across multi-modal cortical areas. Neuron. 109 (11), 1810-1824 (2021).
- Sofroniew, N. J., Flickinger, D., King, J., Svoboda, K. A large field of view two-photon mesoscope with subcellular resolution for in vivo imaging. eLife. 5, 14472(2016).
- Stirman, J. N., Smith, I. T., Kudenov, M. W., Smith, S. L. Wide field-of-view, multi-region, two-photon imaging of neuronal activity in the mammalian brain. Nature Biotechnology. 34 (8), 857-862 (2016).
- Yu, C. H., Stirman, J. N., Yu, Y., Hira, R., Smith, S. L. Diesel2p mesoscope with dual independent scan engines for flexible capture of dynamics in distributed neural circuitry. Nature Communications. 12 (1), 6639(2021).
- Barson, D., et al. Simultaneous mesoscopic and two-photon imaging of neuronal activity in cortical circuits. Nature Methods. 17 (1), 107-113 (2020).
- Wekselblatt, J. B., Flister, E. D., Piscopo, D. M., Niell, C. M. Large-scale imaging of cortical dynamics during sensory perception and behavior. Journal of Neurophysiology. 115 (6), 2852-2866 (2016).
- Kim, T. H., et al. Long-term optical access to an estimated one million neurons in the live mouse cortex. Cell Reports. 17 (12), 3385-3394 (2016).
- Ghanbari, L., et al. Cortex-wide neural interfacing via transparent polymer skulls. Nature Communications. 10 (1), 1500(2019).
- Takahashi, T., Zhang, H., Otomo, K., Okamura, Y., Nemoto, T. Protocol for constructing an extensive cranial window utilizing a PEO-CYTOP nanosheet for in vivo wide-field imaging of the mouse brain. STAR Protocols. 2 (2), 100542(2021).
- Suzuki, T., Murayama, M. Craniotomy for cortical voltage-sensitive dye imaging in mice. Bio-Protocol. 6 (3), 1722(2016).
- Jackman, S. L., et al. Silk fibroin films facilitate single-step targeted expression of optogenetic proteins. Cell Reports. 22 (12), 3351-3361 (2018).
- Rockwood, D. N., et al. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols. 6 (10), 1612-1631 (2011).
- Jia, H., Rochefort, N. L., Chen, X., Konnerth, A. In vivo two-photon imaging of sensory-evoked dendritic calcium signals in cortical neurons. Nature Protocols. 6 (1), 28-35 (2011).
- Pachitariu, M., et al. Suite2p: beyond 10,000 neurons with standard two-photon microscopy. bioRxiv. , 061507(2017).
- Srinivasan, R., et al. New transgenic mouse lines for selectively targeting astrocytes and studying calcium signals in astrocyte processes in situ and in vivo. Neuron. 92 (6), 1181-1195 (2016).
- Inoue, M., et al. Rational engineering of XCaMPs, a multicolor GECI suite for in vivo imaging of complex brain circuit dynamics. Cell. 177 (5), 1346-1360 (2019).
- Patriarchi, T., et al. Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors. Science. 360 (6396), (2018).
- Sun, F., et al. A genetically encoded fluorescent sensor enables rapid and specific detection of dopamine in flies, fish, and mice. Cell. 174 (2), 481-496 (2018).
- Marvin, J. S., et al. An optimized fluorescent probe for visualizing glutamate neurotransmission. Nature Methods. 10 (2), 162-170 (2013).
- Feng, J., et al. A genetically encoded fluorescent sensor for rapid and specific in vivo detection of norepinephrine. Neuron. 102 (4), 745-761 (2019).
- Piatkevich, K. D., et al. Population imaging of neural activity in awake behaving mice. Nature. 574 (7778), 413-417 (2019).
- Sabatini, B. L., Tian, L. Imaging neurotransmitter and neuromodulator dynamics in vivo with genetically encoded indicators. Neuron. 108 (1), 17-32 (2020).
- Roome, C. J., Kuhn, B. Chronic cranial window with access port for repeated cellular manipulations, drug application, and electrophysiology. Frontiers in Cellular Neuroscience. 8, 379(2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten