Method Article
Verwendung von In-vivo-Bildgebung zum Screening auf Morphogenese-Phänotypen in Candida albicans mutierten Stämmen während einer aktiven Infektion in einem Säugetierwirt
In diesem Artikel
Zusammenfassung
Dieses Manuskript beschreibt eine Methode zum Screening mittelgroßer Candida albicans-Mutantenbibliotheken auf Morphogenesephänotypen während einer aktiven Infektion in einem Säugetierwirt mittels nicht-invasiver konfokaler Mikroskopie.
Zusammenfassung
Candida albicans ist ein wichtiger humanpathogener Erreger. Seine Fähigkeit, zwischen morphologischen Formen zu wechseln, ist von zentraler Bedeutung für seine Pathogenese; Diese morphologischen Veränderungen werden durch ein komplexes Signalnetzwerk reguliert, das als Reaktion auf Umweltreize gesteuert wird. Diese regulatorischen Komponenten wurden intensiv untersucht, aber fast alle Studien verwenden eine Vielzahl von In-vitro-Stimuli, um die Filamentation auszulösen. Um zu bestimmen, wie die Morphogenese während des Pathogeneseprozesses reguliert wird, entwickelten wir ein In-vivo-Mikroskopiesystem, um hochauflösende Bilder von Organismen zu erhalten, die sich im Säugetierwirt hyphalisch bilden. Das hier vorgestellte Protokoll beschreibt die Verwendung dieses Systems zum Screening kleiner Sammlungen von C. albicans-Mutantenstämmen, so dass wir die wichtigsten Regulatoren der Morphogenese identifizieren können, wie sie am Ort der Infektion auftreten. Es werden repräsentative Ergebnisse vorgestellt, die zeigen, dass einige Regulatoren der Morphogenese, wie der Transkriptionsregulator Efg1, konsistente Phänotypen in vitro und in vivo haben, während andere Regulatoren, wie die Adenylzyklase (Cyr1), signifikant unterschiedliche Phänotypen in vivo im Vergleich zu in vitro aufweisen.
Einleitung
Candida albicans ist ein häufiger humaner Pilzerreger, der mukokutane Erkrankungen, disseminierte Erkrankungen und lokalisierte Gewebeinfektionen verursacht1. Ein wesentliches Merkmal der Physiologie von C. albicans ist ihr komplexes polymorphes Wachstum, das mit seiner Rolle als Kommensal- und Krankheitserreger verbunden ist 2,3,4. Unter nährstoffreichen Bedingungen in vitro bei 30 °C wächst sie typischerweise als eiförmige Knospungshefe. Eine Vielzahl von Umweltauslösern, einschließlich Nährstoffentzug, pH-Änderungen, Wachstum bei 37 ° C, Exposition gegenüber Serum und Wachstum bei Einbettung in Agar, führen zum Übergang zu einem polarisierten Wachstumsmuster, was zur Bildung echter Hyphen und / oder Pseudohyphen führt5. Die Initiierung des polarisierten Wachstums und das daraus resultierende Wachstum filamentöser Organismen wird als Morphogenese bezeichnet.
Aufgrund der Bedeutung der Morphogenese für die Virulenz des Organismus wurde die Regulation der Hyphenbildung umfassend untersucht 6,7. Es gibt ein komplexes Netzwerk von Signalwegen und transkriptioneller Regulation, das die Morphogenese auslöst. Trotz der Beziehung der Morphogenese von C. albicans mit der Pathogenese haben die meisten Studien, die die Morphogenese untersuchen, In-vitro-Stimuli verwendet, um die Hyphenbildung auszulösen. Es wird immer deutlicher, dass die verschiedenen in vitro Modelle der Filamentation hinsichtlich der einzelnen stimulierten Regulationswege nicht identisch sind. Darüber hinaus korrespondieren keine In-vitro-Wachstumsbedingungen eng mit der komplexen Umgebung des Wirts. Angesichts der Bedeutung von C. albicans als menschlicher Krankheitserreger besteht das Ziel dieses Protokolls darin, seine Morphogenese während der aktiven Infektion in einem Säugetierwirt mit einem System mit moderatem Durchsatz zu untersuchen, so dass ein Forscher C. albicans mutierte Bibliotheken untersuchen kann.
Um diese Untersuchungen zu erleichtern, wurde ein in vivo Bildgebungssystem entwickelt, das es uns ermöglicht, hochauflösende Bilder von C. albicans-Zellen während der Infektion der Ohrmuschel einer anästhesierten Maus mit einem inversen konfokalen Mikroskop8,9,10 zu erhalten. Da die Haut der Ohrmuschel ziemlich dünn ist, können diese Bilder ohne Gewebedissektion erhalten werden. So können quantitative Phänotypdaten am Ort aktiver Infektionen im Wirtsgewebe gemessen werden. Das hier beschriebene Protokoll beinhaltet die Transformation eines Referenzstamms und eines oder mehrerer mutierter Stämme mit unterschiedlichen fluoreszierenden Proteinexpressionskassetten11,12. Die fluoreszierenden proteinexprimierenden Stämme werden dann gemischt und intradermal co-injiziert. Nachdem die Infektion festgestellt wurde, wird die konfokale Bildgebung verwendet, um sowohl die Häufigkeit der Filamentation als auch die Länge der gebildeten Filamente zu quantifizieren. Die von den mutierten Stämmen erhaltenen Daten werden auf die des Referenzstamms normalisiert, der in derselben Geweberegion vorhanden ist, wodurch eine interne Kontrolle gewährleistet ist. Dieses System hat es uns ermöglicht, mehrere Serien von C. albicans-Mutantenstämmen, von denen viele Morphogenesedefekte in vitro9,10 aufweisen, erfolgreich zu screenen. Viele dieser Stämme filamentieren leicht in vivo, was die Bedeutung von In-vivo-Modellen für die Untersuchung der Morphogenese unterstreicht.
Protokoll
Die Studien in diesem Protokoll wurden vom University of Iowa Institutional Animal Care and Use Committee (IACUC) genehmigt. Siehe die CDC-Richtlinien für Geräte und Verfahren für die Arbeit mit BSL2-Organismen13.
1. Zubereitung von Candida albicans Stämmen
- Identifizieren Sie einen geeigneten Referenzstamm zur Verwendung als Positivkontrolle. Stellen Sie sicher, dass dieser Stamm in Bezug auf seine Abstammung und genetische Manipulationen genau mit den experimentellen Stämmen übereinstimmt.
ANMERKUNG: Für die hier vorgestellten repräsentativen Experimente wurden die Mutanten aus den in Homann, et al.14 beschriebenen Stämmen erzeugt, die aus SN152 konstruiert wurden. Diese Mutanten sind Arg-. Daher wurde als Referenzstamm SN250 ausgewählt, der ebenfalls aus SN152 erstellt wurde und ebenfalls Arg- ist. Ernährungsstressoren sind entscheidend für die Regulation des polarisierten Wachstums in der Hefe Saccharomyces cerevisiae15; sie wurden auch mit der Filamentation in C. albicans und anderen Pilzen in Verbindung gebracht16,17,18. Daher sollte der Referenzstamm für Auxotrophien nach Möglichkeit mit den experimentellen Stämmen abgeglichen werden, um mögliche Störeffekte durch Ernährungsstress zu vermeiden. - Wählen Sie fluoreszierende Proteinexpressionskonstrukte. Erstellen Sie beim Screening einer Vielzahl von experimentellen Stämmen einen Referenzstamm, der ein fluoreszierendes Protein exprimiert, und verwenden Sie andere fluoreszierende Proteine, um die mutierten Stämme zu markieren.
HINWEIS: Die hier dargestellten repräsentativen Daten verwenden NEON für den Referenzstamm und iRFP für die mutierten Stämme. Jedes fluoreszierende Protein kann verwendet werden, wenn es stark exprimiert, relativ hell und durch das verwendete Mikroskop angeregt / detektiert werden kann. Kontrollexperimente, die Referenzstämme vergleichen, die verschiedene fluoreszierende Proteine exprimieren, haben keinen Einfluss der fluoreszierenden Proteinexpression auf die Morphogenese gezeigt. - Transformieren Sie die Stämme mit fluoreszierenden Proteinexpressionskonstrukten.
HINWEIS: Viele Institutionen verlangen für die Arbeit mit C. albicans die Verwendung von Vorsichtsmaßnahmen der biologischen Sicherheitsstufe 2. Alle Arbeiten sollten den örtlichen Sicherheitsvorschriften entsprechen. Unabhängig von den lokalen Vorschriften müssen Forscher, die mit C. albicans arbeiten, im sicheren Umgang mit dem Organismus geschult werden.- Transformation der Referenz- und experimentellen Stämme unter Verwendung von Standard-Lithiumacetat-Protokollen19.
ANMERKUNG: Die hier beschriebenen Experimente verwenden die pENO1-NEON-NAT R- und pENO1-iRFP-NATR-Plasmide, die großzügigerweise von Dr. Robert Wheeler 11,12 zur Verfügung gestellt wurden. Plasmide wurden mit NotI9 linearisiert. - Wählen Sie die Transformanten basierend auf dem Wachstum auf Nourseothricin oder einem anderen relevanten Auswahlmedium aus.
- Identifizieren Sie erfolgreiche Transformanten. Nehmen Sie einen kleinen Klecks Zellen aus jeder Kolonie mit einem Zahnstocher und mischen Sie sie dann zu einem 2,5 μL Wassertropfen auf einem Objektträger. Tragen Sie ein Deckglas auf und untersuchen Sie es bei 10-40-facher Vergrößerung. Untersuchen Sie mit einem konfokalen Bildgebungssystem (das für den Rest des Protokolls verwendet wird) oder einem Standard-Weitfeld-Fluoreszenzmikroskop. Geeignete Transformanten haben ein helles Signal mit geeigneten Anregungs- und Emissionswellenlängen.
HINWEIS: Für die repräsentativen Ergebnisse wurden NEON-exprimierende Stämme mit einem aufrechten Fluoreszenzmikroskop mit einem Langpassfilterset mit einem 472/30 nm Bandpass-Anregungsfilter, einem 520/35 nm Bandpass-Emissionsfilter und einem 495 nm einschneidigen dichroitischen Strahlteiler visualisiert. Da iRFP mit dem Auge nicht sichtbar ist, wurden iRFP-exprimierende Stämme mit dem konfokalen Mikroskopiesystem visualisiert, das für die In-vivo-Bildgebung verwendet wird, wobei ein 638-nm-Laser zur Anregung und Detektion von Emissionslicht von 655-755 nm verwendet wurde.- Alternativ können Sie die makroskopische Koloniefluoreszenz mit Fluoreszenzstereomikroskopie, tragbaren Fluoreszenzanregungssystemen oder Fluoreszenzdetektionssystemen bewerten, die typischerweise für Gele und Western Blots verwendet werden.
- Erstellen Sie Tiefkühlbestände ausgewählter Transformanten.
- Transformation der Referenz- und experimentellen Stämme unter Verwendung von Standard-Lithiumacetat-Protokollen19.
- Beimpfen Sie YPD (Hefeextrakt Peptondextrose) feste Medien mit einer fluoreszierenden proteinexprimierenden Referenz und experimentellen Stämmen aus Gefrierbeständen 3 Tage vor der Injektion, wobei Sie einen Zahnstocher verwenden, um einen Klecks Organismen aus dem Gefrierbestand auf die YPD-Festmedien zu übertragen. 2 Tage bei 30 °C inkubieren.
- Für jeden Stamm ist ein Kolben mit 25 ml YPD mit C. albicans-Zellen aus mehreren Kolonien 1 Tag vor der Injektion zu impfen. Tun Sie dies, indem Sie einen Zahnstocher verwenden, um einen Klecks von Organismen von einer Kolonie in die YPD zu übertragen; Wiederholen Sie mehrmals, um Zellen aus mehreren verschiedenen Kolonien zu erhalten. Über Nacht bei 30 °C in einem Orbital-Shaker-Inkubator bei 175 U/min inkubieren.
HINWEIS: Es ist wichtig, mehrere Kolonien als Quelle für das Inokulum zu verwenden, da C. albicans eine hohe Häufigkeit spontaner genetischer Veränderungen aufweist. Die Verwendung mehrerer Kolonien beim Start der Inokulumkultur minimiert die Wahrscheinlichkeit, dass alle Organismen im Inokulum von einem Elternteil mit signifikanten spontanen Veränderungen stammen. - Am Tag der Injektion:
- Zentrifugieren Sie 1 mL der Kultur für 2 min bei 500 x g.
- Waschen Sie die Kultur dreimal mit 1 ml steriler phosphatgepufferter Kochsalzlösung (dPBS) von Dulbecco. Nach dem letzten Waschen das Pellet in 1 ml sterilem dPBS resuspendieren.
- Eine Probe der gewaschenen Kultur wird bei 1:100 verdünnt und mit einem Hämozytometer gezählt.
- Die Dichte der gewaschenen Kultur wird mit dPBS auf 1 x 108 Organismen pro ml eingestellt.
- Erstellen Sie für jeden zu injizierenden Satz von Stämmen das Inokulum, indem Sie gleiche Volumina des Referenzstamms und des experimentellen Stamms mischen. Dadurch bleibt die Dichte des Inokulums bei 1 x 108 Organismen pro ml.
HINWEIS: Die Anzahl der Stämme, die pro Ohr ausgewertet werden können, ist durch die Fähigkeit des verwendeten Mikroskopiesystems begrenzt, das Signal von jedem fluoreszierenden Protein eindeutig zu unterscheiden. - Sobald das Inokulum vorbereitet ist, fahren Sie direkt mit den Tierinjektionen fort. Lagern Sie das Inokulum vor Gebrauch nicht.
2. Tierische Zubereitung
- Holen Sie die Genehmigung des lokalen Institutional Animal Care and Use Committee oder des zuständigen lokalen Leitungsgremiums ein.
- Erhalten Sie 6-12 Wochen alte Mäuse von einem Anbieter oder Zuchtprogramm. Beherbergen Sie Mäuse in der Einrichtung, in der sie während des gesamten Experiments mindestens 1 Woche vor der Impfung leben werden.
HINWEIS: Für die repräsentativen Ergebnisse wurden 6 Wochen alte weibliche DBA2/N-Mäuse verwendet. - Füttern Sie Tiere mindestens 7 Tage vor der Impfung mit chlorophyllfreiem Chow.
3. Haarentfernung und Impfung
- Induzieren Sie eine chirurgische Anästhesieebene (Abbildung 1).
ACHTUNG: Inhalierte Anästhetika sind gefährliche Stoffe und können Augen- oder Hautreizungen sowie Toxizität des Nervensystems verursachen. Alle institutionellen Richtlinien und Verfahren sowie allgemeinen Laborsicherheitspraktiken für die Verwendung von inhalativen Anästhetika müssen befolgt werden. Nur Personen, die in der Verwendung von inhalativen Anästhetika geschult sind, können diese Schritte durchführen. Zu den Standardpraktiken gehören das Tragen von Handschuhen, ein Laborkittel, Augenschutz, die Verwendung eines Anästhesie-Schnitzelsystems und eine sorgfältige Aufzeichnung gemäß den institutionellen Richtlinien.- Legen Sie eine Maus in eine vorgewärmte Anästhesie-Induktionskammer. Halten Sie das Tier während der Vollnarkose in einer warmen Umgebung. Erreichen Sie dies mit dafür entwickelten Wärmekissen und einem erwärmten Mikroskoptisch. Verwenden Sie kein rezeptfreies Heizkissen, da es überhitzen und Verbrennungen verursachen kann.
- Geben Sie 2% -3% Isofluran in die Induktionskammer, bis die Maus ihren Aufrichtreflex verloren hat und die Atmung langsam und gleichmäßig ist. Reinigen Sie die Induktionskammer von der Anästhesie und übertragen Sie das Tier in einen Nasenkegel ohne Rebreather, der 1% -2% Isofluran liefert.
- Validieren Sie die Ebene der Anästhesie mit dem Zehenklemmreflex oder anderen Verifizierungsmechanismen. Überwachen Sie während des gesamten Experiments das Atemmuster und die Anästhesieebene des Tieres und passen Sie die Anästhesiekonzentration nach Bedarf an.
- Tragen Sie Augengleitmittel auf, um das Austrocknen der Hornhaut zu verhindern.
- Haarentfernung (Abbildung 1C,D)
- Tragen Sie eine rezeptfreie Enthaarungscreme mit einem Wattestäbchen großzügig auf die Innen- und Außenfläche beider Ohren auf.
- Nach 2-3 Minuten (oder gemäß den Anweisungen des Herstellers) wischen Sie das Ohr vorsichtig mit einem trockenen Mullkissen ab, um alle Cremes und Haare zu entfernen. Wischen Sie zweimal mit Mullbinden, die in sterilem Wasser gesättigt sind, um die Rückstände der Enthaarungscreme vollständig zu entfernen. Wenn die gesamte Enthaarungscreme nicht entfernt wird, führt dies zu Hautreizungen / Entzündungen.
- Injektion (Abbildung 1E, F)
- Wischen Sie die Oberfläche des zu injizierenden Ohres mit einem Mullkissen ab, das mit 70% Ethanol gesättigt ist, und lassen Sie es an der Luft trocknen.
- Mischen Sie das Inokulum gut, indem Sie mehrmals umkehren oder wirbeln.
- Ziehen Sie 20-30 μL Inokulum in eine Insulinspritze. Halten Sie die Nadel nach oben und klopfen Sie vorsichtig auf die Spritze, um sicherzustellen, dass sich die Luft im Zylinder oben befindet. Werfen Sie vorsichtig Luft und überschüssiges Inokulum zurück in das Inokulumröhrchen oder ein Abwasserrohr, so dass der Kolben die 10-μL-Marke erreicht hat.
- Tragen Sie einen Fingerhut an einem Finger oder Daumen der nicht dominanten Hand, stabilisieren Sie das Ohr, indem Sie es über den Fingerhut wickeln. Alternativ können Sie ein rezeptfreies doppelseitiges Hautband (Modeband) auf einen kleinen konischen oder runden Kunststoffschlauch auftragen und das Ohr über das Band drapieren. Achten Sie darauf, den Nasenzapfen der Anästhesie dabei nicht zu entfernen. Es kann hilfreich sein, den Nasenkonus auf die Arbeitsfläche zu kleben.
HINWEIS: Entweder die Innen- oder Außenseite des Ohres kann je nach körperlichem Wohlbefinden des Prüfers injiziert werden. Achten Sie bei der Mikroskopie darauf, die Maus so zu platzieren, dass die injizierte Ohrseite zur Objektivlinse zeigt. - Halten Sie die Spritzennadel fast vollständig parallel zur Haut und vermeiden Sie große Venen, führen Sie die Spitze der Nadel in die äußerste Hautschicht ein, bis die Fase gerade noch bedeckt ist.
- Injizieren Sie das Inokulum langsam intradermal. Eine gute intradermale Injektion wird eine kleine Blase in der Haut aufwirbeln. Halten Sie die Nadel für 15-20 s an Ort und Stelle, bevor Sie sie aus dem Ohr entfernen, um ein Auslaufen zu minimieren.
- Wenn die Unterseite des Ohres des Tieres feucht wird, war die Nadel zu tief und ging vollständig durch das Ohr. Wiederholen Sie in diesem Fall die Injektion in einem anderen Bereich des Ohres.
- Wiederholen Sie den Vorgang mit dem anderen Ohr des Tieres. Dies kann mit den gleichen C. albicans-Stämmen für eine Replikation oder mit einem anderen Satz von C. albicans-Stämmen erfolgen.
- Wenn Sie nicht sofort fotografieren, legen Sie das Tier in eine erwärmte Erholungskammer. Beobachten Sie das Tier, bis es sich von der Narkose erholt hat, und bringen Sie es dann in seinen Stallkäfig zurück.
- Kennzeichnen Sie den Käfig gemäß den institutionellen Protokollen deutlich mit Biohazard-Etiketten und weisen Sie darauf hin, dass Tiere im Käfig mit Candida albicans infiziert sind.
- Führen Sie alle erforderlichen Aufzeichnungen in Bezug auf die Tieranästhesie und andere erforderliche institutionelle Praktiken aus.
- Unterbringung des Tieres in Tierhaltungsbedingungen unter Verwendung von Vorsichtsmaßnahmen der biologischen Sicherheitsstufe 2.
4. Quantifizierung der In-vitro-Morphogenese zum Vergleich mit In-vivo-Ergebnissen
- Unter Verwendung der gleichen gewaschenen Kulturen, die zur Herstellung des Inokulums verwendet wurden, eine 1:50-Verdünnung von Organismen in RPMI1640 + 10% hitzeinaktiviertem fetalem Rinderserum erzeugen und bei 37 ° C mit Taumeln für 4 h inkubieren. Alternativ können andere Medien verwendet werden, die die Morphogenese in vitro stimulieren.
- Zentrifugieren Sie die Probe für 5 min bei 500 x g und resuspendieren Sie sie in 0,5 mL dPBS.
- Verdünnen Sie die Probe im Verhältnis 1:10, geben Sie 2,5 μL der verdünnten Probe auf einen Objektträger und decken Sie sie mit einem Deckglas ab.
- Untersuchen Sie die Probe mit einem Fluoreszenzmikroskop. Zählen Sie mindestens 100 Zellen und notieren Sie die Anzahl der Hefe- und Fadenzellen für jeden Stamm. In den hier vorgestellten repräsentativen Ergebnissen wird eine filamentöse Zelle als jede Zelle definiert, deren Länge mehr als doppelt so lang ist wie die Mutterzelle.
HINWEIS: Die Quantifizierung der In-vitro-Morphogenese kann am selben Tag wie die Impfung der Tiere erfolgen. Es ist möglich, den In-vitro-Morphogenese-Assay während der Vorbereitung des Inokulums für die Injektion zu initiieren und die Inokulation der Tiere während der 4-stündigen Inkubationszeit durchzuführen. Wenn alle Tierbehandlungen vor Ablauf der 4-stündigen Inkubationszeit abgeschlossen sind, fahren Sie direkt mit der Untersuchung der in vitro stimulierten Zellen fort. Alternativ können die Zellen in 3,7% Formaldehyd in dPBS (in Schritt 4.2) resuspendiert und mehrere Tage bei 4 °C gelagert werden. Die fixierten Organismen können dann quantifiziert werden, wenn es die Zeit erlaubt. Die Beimpfung der Tiere darf für den In-vitro-Quantifizierungstest nicht verzögert werden.
5. Vorbereitung für die In-vivo-Bildgebung
- Bereiten Sie das Mikroskop vor (Abbildung 2A).
- Schalten Sie alle Mikroskopiegeräte ein und starten Sie die Bildgebungssoftware.
- Falls verfügbar, laden Sie alle vordefinierten Imaging-Einstellungen.
- Aktivieren Sie die Laser und Detektoren, die zum Nachweis der verwendeten fluoreszierenden Proteine benötigt werden.
- Schalten Sie den beheizten Mikroskoptisch ein und lassen Sie ihn auf 37 °C erwärmen.
HINWEIS: Es ist möglich, ein Mikroskop mit einer vollständig geschlossenen Klimakammer anstelle eines beheizten Tisches zu verwenden. - Legen Sie einen z-Achsen-Referenzpunkt fest, wobei sich die Fokusebene an der oberen Oberfläche des Deckglases befindet. Dies kann erreicht werden, indem ein Deckglas über die Bühnenöffnung geklebt und ein Wassertropfen auf den Deckschein gegeben wird. Verwenden Sie ein "trockenes" Objektiv mit geringerer Vergrößerung (10x), um auf den Rand des Wassertropfens zu fokussieren, und stellen Sie dann den Referenzpunkt der z-Achse ein. Verwenden Sie ein Stück Handtuch, um das Wasser aus dem Deckglas aufzunehmen, bevor Sie es von der Bühne entfernen.
- Drehen Sie das Objektiv mit sehr langem Arbeitsabstand und legen Sie einen Tropfen Tauchflüssigkeit auf das Objektiv. Senken Sie die Linse, um mögliche Schäden beim Platzieren des Deckglases zu vermeiden.
- Legen Sie ein # 1.5 Deckglas über die Bühnenöffnung und kleben Sie es an Ort und Stelle. Stellen Sie sicher, dass das Klebeband alle Kanten des Deckglases vollständig bedeckt, um zu verhindern, dass Flüssigkeit unter dem Deckglas in das Mikroskop gelangt. Heben Sie das Objektiv auf den Referenzpunkt der z-Achse an, sodass die Tauchflüssigkeit sowohl mit der Objektivlinse als auch mit dem Deckglas in Kontakt kommt.
- Bereiten Sie mehrere Stücke druckempfindliches Klebeband vor, damit sie beim Positionieren des Nasenkonus und der Maus einsatzbereit sind.
- Schalten Sie alle Mikroskopiegeräte ein und starten Sie die Bildgebungssoftware.
- Induzieren Sie eine Vollnarkose in der Maus, die wie oben abgebildet werden soll (Schritt 3.1).
- Positionieren Sie die Maus (Abbildung 2B-D).
- Befestigen Sie einen Anästhesie-Nasenkegel auf dem Mikroskoptisch, wobei der Nasenkegel so positioniert ist, dass er die Nase des Tieres vollständig bedeckt, wenn das Tier für die Bildgebung in Position ist. Dies lässt sich leichter mit zwei Ermittlern bewerkstelligen. Lassen Sie den ersten Ermittler die Nase der anästhesierten Maus in den Nasenzapfen einsetzen und die Maus für die Bildgebung in Position bringen, während Sie den Nasenzapfen weiterhin über die Nase des Tieres halten. Lassen Sie den anderen Ermittler den Nasenkegel und den Schlauch so einkleben, dass er stabil über der Nase der Maus sitzt. Sobald der Nasenkegel an Ort und Stelle geklebt ist, lassen Sie ihn für den Rest der Bildgebungssitzung dort.
- Nachdem Sie den besten Ort für die Platzierung des Nasenkegels festgelegt haben, notieren Sie seine Position. Für nachfolgende Bildgebungssitzungen kann der Nasenzapfen auf der Bühne befestigt werden, bevor ein Tier zum Mikroskop gebracht wird.
- Legen Sie einen Tropfen steriles Wasser auf das Deckglas über der Objektivlinse.
- Positionieren Sie die Maus auf dem Mikroskoptisch. Stellen Sie sicher, dass sich das Ohr auf dem Wassertropfen befindet und flach gegen das Deckglas liegt.
- Verwenden Sie ein zweites (oberes) Deckglas, um das Ohr flach zu machen.
- Platzieren Sie den Rand des Deckglases parallel zum Körper der Maus, wobei der Rand die Maus dort berührt, wo das Ohr auf den Kopf trifft.
- Senken Sie den freien Rand des Deckglases mit einer Scharnierbewegung auf den Mikroskoptisch. Wenn das Deckglas gegen den Mikroskoptisch kommt, wird es das Ohr abflachen. Achten Sie darauf, keine Falten oder Grate im Ohr zu bilden.
- Kleben Sie das obere Deckglas sicher an Ort und Stelle, so dass es gerade genug Druck hält, um das Ohr flach zu halten. Achten Sie darauf, die Haare oder Schnurrhaare der Maus nicht im Band zu erwischen.
- Sofern kein Mikroskop mit einer Klimakammer verwendet wird, bedecken Sie den Körper der Maus locker mit einem sterilen Vorhang, um eine normotherme Umgebung aufrechtzuerhalten.
- Identifizieren Sie ein Interessengebiet.
- Stellen Sie sicher, dass sich das Ziel am Referenzpunkt der z-Achse befindet.
- Passen Sie die Fokusebene mit Weißlicht-/Weitfeldbildgebung in das Ohrgewebe ein. Eine gute Strategie ist es, sich auf die Blutgefäße zu konzentrieren - wenn man rote Blutkörperchen sehen kann, die sich in den Blutgefäßen bewegen, ist die Fokusebene innerhalb des Gewebes.
- Wenn das Mikroskop mit einer Weitfeldfluoreszenzfähigkeit ausgestattet ist, verwenden Sie es, um ein Interessengebiet zu identifizieren. Wenn nicht, verwenden Sie konfokale Bildgebung. Im Allgemeinen ist die Verwendung der Weitfeldmikroskopie zur Identifizierung von Interessengebieten schneller und erfordert weniger Bestrahlung des Ohrgewebes.
- Verwenden Sie einen Filterwürfel zum Nachweis des im Referenzstamm exprimierten fluoreszierenden Proteins, um ein Sichtfeld zu identifizieren, das ein fluoreszierendes Signal vom Referenzstamm hat. Denken Sie daran, dass unscharfes Licht wahrscheinlich die Fähigkeit verhindert, sich auf einzelne Organismen zu konzentrieren. Ziel dieses Schritts ist es, ein Interessengebiet für die konfokale Bildgebung zu identifizieren.
- Wechseln Sie zu einem Filterwürfel, der das fluoreszierende Protein detektiert, das von dem/den experimentellen Stamm(en) exprimiert wird, und ihre Anwesenheit im ausgewählten Sichtfeld überprüft.
6. Bildgebung
- Legen Sie die Einstellungen fest.
- Während sich die Bildgebungssoftware im konfokalen Live-Modus befindet, untersuchen Sie das Interessenfeld, während die Fokusebene durch die z-Achse bewegt wird. Wählen Sie eine z-Achsenebene mit einem starken Signal von allen verwendeten fluoreszierenden Proteinen.
- Passen Sie die Laserleistung und/oder Bildgebungsgeschwindigkeit an, um ein ausreichend starkes Signal zu erhalten, so dass die Morphologie für alle Zellen im Sichtfeld bestimmt werden kann. Um Gewebeschäden zu vermeiden, verwenden Sie die geringstmögliche Laserleistung.
HINWEIS: Wie bei jeder Bildgebung gibt es ein Gleichgewicht zwischen Laserleistung, Aufnahmegeschwindigkeit und Auflösung. Identifizieren Sie Einstellungen, die die Morphologie des Organismus eindeutig identifizieren und gleichzeitig Geschwindigkeit und Laserleistung ausgleichen, um die Bestrahlung des Ohrgewebes zu minimieren. Da die Bildgebung durch die äußere Dermis erfolgt, ist für die Anregung eine höhere Laserleistung erforderlich, als dies normalerweise für die konfokale Bildgebung herkömmlicher Proben auf Objektträgern erforderlich ist. Glücklicherweise ist die räumliche Auflösung, die für die Analyse der Morphologie erforderlich ist, nicht extrem. So ist es leicht möglich, Bilder mit einem ausreichenden Signal zu erhalten, um die Morphologie des Organismus zu bestimmen, ohne Gewebeschäden zu verursachen. - Sobald diese Parameter festgelegt sind, verwenden Sie sie während der gesamten Imaging-Sitzung, um als Ausgangspunkt für nachfolgende Imaging-Sitzungen zu dienen. Es ist daher hilfreich, die Imaging-Einstellungen zu speichern.
HINWEIS: Einzelne Infektionsbereiche können flacher oder tiefer im Gewebe sein. Tiefere Bereiche können eine Erhöhung der Laserleistung erfordern. Da dieser Assay auf der räumlichen Verteilung des Signals und nicht auf seiner Intensität beruht, ist es akzeptabel, die Bildeinstellungen zwischen den Feldern nach Bedarf zu ändern.
- Besorgen Sie sich die Bilder.
- Wählen Sie ein Sichtfeld, das eine klare Filamentbildung im Referenzstamm aufweist und in dem die meisten Organismen so weit verteilt sind, dass ihre Morphologie bestimmt werden kann.
- Legen Sie die obere und untere Fokusebene für einen Z-Stack fest. Es ist nicht notwendig, die gesamte Tiefe des infizierten Bereichs abzudecken, aber beachten Sie, dass Organismen oben oder unten im abgebildeten Volumen typischerweise von der Analyse ausgeschlossen sind.
- Erfassen Sie Z-Stack-Bilder, färben Sie jeden Kanal pseudo, um jede Dehnung zu unterscheiden, und überlagern Sie die Kanäle. Speichern Sie die Bilder.
- Wiederholen Sie diesen Vorgang für andere Sichtfelder. Die Morphogenese kann von Ort zu Ort variieren; Daher ist es wichtig, mindestens drei Felder von jedem Ohr zu erfassen und zu analysieren.
7. Manuelle zweidimensionale Analyse: Häufigkeit der Filamentation
- Verwenden Sie eine Imaging-Software, um eine maximale Projektion des Z-Stacks in ein zweidimensionales Bild durchzuführen. Die hier bereitgestellten Anweisungen gelten für FIJI / Image J.
- Öffnen Sie Mikroskopiebilder mit der ImageJ-Software.
- Wenden Sie bei Bedarf eine Pseudofarbe auf jeden Kanal an, um eine einfache Identifizierung jedes C. albicans-Stammes zu ermöglichen. Klicken Sie dazu auf Bild > Nachschlagetabelle > LUT-Farbe und wählen Sie die gewählte Pseudofarbe aus.
- Konvertieren Sie die Stapeldatei in ein zweidimensionales Bild mit maximaler Projektion:
- Wählen Sie die Z-Stack-Datei aus. Klicken Sie auf Bild > Stapel > Z-Projektion.
- Wählen Sie die obere und untere Ebene und wählen Sie den Projektionstyp Max. Intensität.
- Zählen Sie jeden Organismus, der in den maximalen Projektionsbildern zu sehen ist, nach Stammtyp (unterschieden durch Kanalfarbe) und Morphologie.
- Organismen, die sich signifikant überlappen oder Gebiete mit sehr hoher Organismendichte aufweisen, sind schwer genau zu zählen. Schließen Sie diese von der Zählung aus, aber achten Sie darauf, keine Verzerrungen gegen filamentöse Formen einzuführen, die sich eher überlappen.
- Fadenförmige Formen, die direkt in den Z-Stack hinein oder aus ihm herausragen, erscheinen als kleine runde Objekte in einer maximalen Projektion. Ebenso können Organismen, die durch den Rand des Bildes abgeschnitten sind, als Hefe erscheinen, weil sich das Filament außerhalb des Sichtfeldes befindet. Daher wird die zweidimensionale Analyse den Prozentsatz der Hefeformen immer überschätzen. Da dies bei dem Referenz- und dem experimentellen Stamm gleichermaßen der Fall ist, vergleichen Sie die experimentellen Ergebnisse immer mit denen eines Referenzstamms.
- Führen Sie statistische Vergleiche der Ergebnisse durch, wie es das experimentelle Design vorschreibt.
8. Manuelle zweidimensionale Analyse: Filamentlänge
- Bei C. albicans kann es zu einer aberranten Filamentbildung kommen, weil: a) weniger "Mutter"-Hefezellen eine Morphogenese durchlaufen, b) Filamente langsamer wachsen oder c) filamentöses Wachstum initiiert, aber nicht aufrechterhalten wird. Um diese Möglichkeiten zu bewerten, quantifizieren Sie die Kurvenweglänge jedes Filaments im maximalen Projektionsbild als Ersatz für die wahre dreidimensionale Länge (siehe unten).
- Wenn sich eine Knospe auf einer Mutterzelle entwickelt, ist es nicht möglich zu sagen, ob sie zu einem Filament oder einer Hefe wird. Um sicherzustellen, dass nur filamentöse Zellen in diese Analyse einbezogen werden, messen Sie nur Organismen, bei denen die Tochterzelle mindestens doppelt so lang ist wie die Mutterzelle.
- Öffnen Sie das in Schritt 7 erstellte Max-Projektionsbild.
- Klicken Sie im Toolset ImageJ mit der rechten Maustaste auf das Werkzeug Geradlinige/ Segmentierte Linie und wählen Sie die Option Segmentierte Linie. Die Option für segmentierte Linien ermöglicht es dem Benutzer, die Filamentlänge entlang eines gekrümmten Pfades zu messen, was angesichts der Plastizität von C. albicans-Filamenten erforderlich ist.
- Messen Sie die Filamentlänge vom Knospenhals bis zum wachsenden Ende des Filaments. Klicken Sie mit der linken Maustaste auf den Knospenhals; Der Mauszeiger ändert sich in ein kleines Quadrat. Zeichnen Sie das Filament entlang seiner Länge nach und klicken Sie jedes Mal auf die Mitte des Filaments, wenn es eine Kurve, Drehung oder Änderung der Längsachse des Filaments gibt. Doppelklicken Sie auf die wachsende Spitze des Filaments.
- Drücken Sie Strg + M. Dadurch wird ein Popup-Fenster geöffnet, in dem die Flächen-, Mittelwert-, Min-, Max- und Längenmessungen tabellarisch dargestellt werden. Nachdem Sie jedes Filament gemessen haben, drücken Sie erneut Strg + M, um die aktuelle Messung zur Messtabelle hinzuzufügen.
- Wenn alle Filamente gemessen wurden, kopieren Sie die Längenmessungen und fügen Sie sie in eine Datenanalysedatei ein.
- Führen Sie statistische Analysen durch, um die Verteilung der Filamentlängen in der Referenzdehnung und der mutierten Dehnung zu bewerten.
9. Manuelle dreidimensionale Analyse
- Um eine genauere Messung der Morphogenese zu erhalten, die die Überschätzung von Hefeformen vermeidet und eine Unterscheidung zwischen Pseudohyphen und Hyphen ermöglichen kann, scrollen Sie manuell durch den Z-Stack auf und ab, während Sie die Morphologie jedes Organismus in drei Dimensionen bewerten.
- Alternativ können Sie ein dreidimensionales Bild von jedem Z-Stack erstellen und die Form jedes Organismus analysieren, während Sie das Bild drehen.
10. Automatisierte Analyse
- Mit der Bildgebungssoftware automatisieren Sie die Zählung von Organismen und deren Morphologie in zwei oder drei Dimensionen.
HINWEIS: Einige Algorithmen zur Unterscheidung von Morphologietypen können zu Verzerrungen führen. Daher müssen Automatisierungsstrategien in Bezug auf das experimentelle Design sorgfältig validiert werden. Eine gut konzipierte und validierte automatisierte Bildanalyse kann den Durchsatz des Analyseschritts erhöhen.
Ergebnisse
Die hier vorgestellten Ergebnisse basieren auf den bereits veröffentlichten Berichten 9.10. Das Ziel dieser Analyse ist es, die Fähigkeit mutierter C. albicans-Stämme, während aktiver Infektionen eine Morphogenese zu durchlaufen, quantitativ zu bewerten. Die typischen Parameter, die Pseudohyphen von Hyphen unterscheiden, können bei Organismen, die in einer komplexen in vivo-Umgebung dreidimensional wachsen, schwer zu bewerten sein. Dies gilt insbesondere für die zweidimensionalen Querschnitte, die durch konfokale Bildgebung erzeugt werden. Daher konzentriert sich diese Screening-Analyse auf die Identifizierung von Organismen, die als filamentös gegenüber Hefe wachsen. Für Folgestudien mit einer tiefergehenden Analyse, einschließlich dreidimensionaler Rekonstruktionen, könnte diese Methode angepasst werden, um Hefe, Hyphen und Pseudohyphen zu unterscheiden.
Die Expression eines fluoreszierenden Proteins in einem Referenz- oder mutierten Stamm von C. albicans ermöglicht einen einfachen Nachweis der Stammmorphologie in vivo (Abbildung 3 und Abbildung 4). Im Allgemeinen wird die quantitative lichtmikroskopische Analyse am besten durchgeführt, wenn nur wenige bis keine Pixel im Bild gesättigt sind. Bei diesem Protokoll vereinfacht jedoch oft eine Sättigung des Bildes die Analyse. Die Lokalisierung fluoreszierender Proteine ist nicht gleichmäßig in der gesamten Zelle und ist in der Mutterhefe oft höher als in Filamenten. Glücklicherweise bestimmt für die Untersuchung der Morphogenese die räumliche Verteilung des Signals und nicht seine Intensität das Ergebnis. Daher verbessert die Gewinnung von Bildern, in denen viele Pixel gesättigt sind, die Fähigkeit, die Morphogenese in diesem Assay zu quantifizieren.
Um die Bedeutung der Bewertung der Morphogenese in vivo zu veranschaulichen, werden repräsentative Ergebnisse für den Referenzstamm (SN250) und zwei Mutanten präsentiert: einer ohne den Transkriptionsfaktor Efg1 und der andere ohne Adenylylcyclase Cyr1. In vitro wächst keiner dieser Stämme als Filamente20,21. Wenn in vitro in RPMI-Medium gezüchtet wird, das mit 10% Serum ergänzt wird, bildet der Referenzstamm schnell Filamente, während die efg1ΔΔ- und cyr1ΔΔ-Stämme dies nicht tun (Abbildung 3 und Abbildung 4). Unter diesen Bedingungen zeigt die efg1ΔΔ-Mutante ein etwas polarisiertes Wachstum, wobei die Tochterzellen im Vergleich zu den Mutterzellen leicht verlängert sind. Dies unterstreicht, wie wichtig es ist, eine klare Definition der Filamentation zu verwenden. Eine solche Definition ist standardmäßig willkürlich, aber sie ist für eine konsistente Bewertung des Phänotyps notwendig. Für diese Studien wird ein filamentöses Wachstumsmuster als ein Organismus mit der längsten Dimension einer Tochterzelle definiert, die mehr als doppelt so groß ist wie die der Mutterzelle. Nach dieser Definition sind die länglichen efg1ΔΔ-Zellen nicht filamentös.
In Übereinstimmung mit seinem In-vitro-Phänotyp weist das efg1 ΔΔ in vivo einen signifikanten Filamentationsdefekt auf: Etwa 9% der efg1ΔΔ-Zellen wuchsen in vivo als Filamente (Abbildung 3). Im Gegensatz dazu wuchsen 53% der cyr1ΔΔ-mutierten Zellen als Filamente in vivo (Abbildung 4). Obwohl die Anzahl der Cyr1 ΔΔ-mutierten Zellen, die in vivo einer Filamentation unterzogen wurden, signifikant geringer war als der Referenzstamm, stellt die Fähigkeit der Cyr1ΔΔ-Mutante, Filamente in vivo zu bilden, eine wesentliche Veränderung gegenüber ihrem völligen Fehlen von Morphogenese in vitro dar. Optisch schienen die von der cyr1ΔΔ-Mutante gebildeten Filamente kürzer zu sein als der Referenzstamm. Um dies quantitativ auszuwerten, wurde die Kurvenweglänge der filamentösen Zellen mittels einer zweidimensionalen Projektion der in vivo Bilder gemessen (Abbildung 4E). Die mediane Länge von Cyr1ΔΔ-Filamenten war 29% kürzer als die von Filamenten des Referenzstamms.
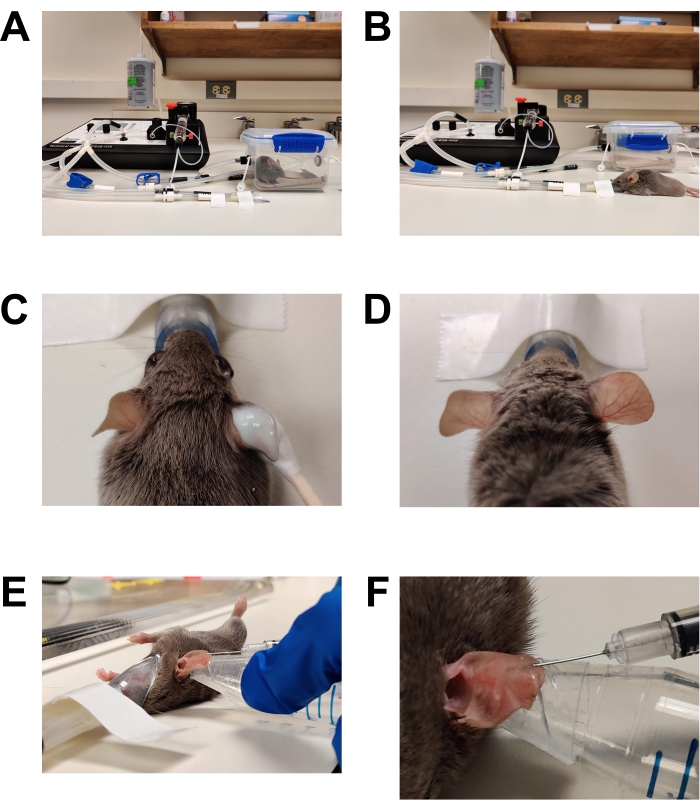
Abbildung 1: Anästhesie und Impfung . (A) Einleitung der Anästhesie unter Verwendung einer Induktionskammer. (B) Die Anästhesie wird mit einem Nasenkegel aufrechterhalten, so dass die Maus bei Bedarf neu positioniert werden kann. (C) Die Haarentfernungscreme wird mit einem Applikator mit Baumwollspitze aufgetragen. Augenschmiergel wurde aufgetragen, um die Augen während der Anästhesie zu schützen. (D) Effektive Haarentfernung des rechten Ohres. Vergleichen Sie mit dem unbehandelten linken Ohr. (E) Intradermale Injektion von C. albicans in das Mausohr. Das Ohr wird mit der Spitze eines konischen Röhrchens gehalten, das mit doppelseitigem Hautband (Modeband) umwickelt ist. (F) Nahaufnahme der intradermalen Injektion. In der Haut bildet sich eine blasse Blase, die ein Zeichen für eine erfolgreiche intradermale Platzierung ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Vorbereitung für die Bildgebung . (A) Für die Bildgebung vorbereiteter Mikroskoptisch. Der Nasenkonus der Anästhesie ist fixiert. Ein Deckglas wird auf die Bühne geklebt, die die Linsenöffnung bedeckt. Zusätzliche Klebebänder sind erhältlich. Der Heiztisch wird auf 37 °C vorgewärmt (nicht abgebildet). (B) Einsetzen der anästhesierten Maus in den Nasenzapfen der Anästhesie. (C) Die Maus wird leicht gedreht, so dass die Seite des Ohres, die geimpft wurde, zum unteren Deckglas/Objektiv zeigt. Das Ohr wird dann gegen das untere Deckglas abgeflacht und fixiert, indem ein zweites Deckglas auf das Ohr gelegt wird. (D) Das obere Deckglas wird auf den Tisch geklebt, um das Ohr relativ zum Mikroskoptisch zu fixieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: In vitro und in vivo Morphologie des efg1ΔΔ mutierten Stammes. (A) Weitfeldaufnahme von WT- und efg1-ΔΔ-Mutantenstämmen nach in vitro-Induktion der Filamentation durch Wachstum von Zellen in RPMI + 10% Serum bei 37 °C für 4 h. Maßstabsbalken stellen 10 μm dar. Der Bildkontrast wurde mit einer Bildbearbeitungssoftware angepasst, um die Anzeige zu erleichtern. (B) Prozentsatz der Filamentation in vitro, beobachtet in den WT- und efg1ΔΔ-Mutantenstämmen. Und = nicht nachweisbar (es wurden keine Filamente detektiert). Die Balkenhöhe stellt den mittleren Prozentsatz filamentöser Zellen aus drei unabhängigen Experimenten dar, in denen mindestens 100 Zellen quantifiziert wurden. Die Fehlerbalken zeigen die Standardabweichung an (Ergebnisse verglichen mit dem t-Test des Schülers, p < 0,001). (C) Konfokalmikroskopische Aufnahme von WT (grün) und der efg1ΔΔ-Mutante (rot), die 24 h nach der Inokulation in vivo wächst. Pfeile zeigen Beispiele für efg1ΔΔ mutierte Zellen, die unserer Definition von "filamentös" entsprechen. Der Maßstabsbalken entspricht 50 μm. (D) Prozentsatz der Filamentation in vivo, beobachtet in den WT- und efg1ΔΔ-Mutantenstämmen. Die Balkenhöhe stellt den mittleren Prozentsatz filamentöser Zellen aus zwei unabhängigen Experimenten dar. Die Fehlerbalken zeigen die Standardabweichung an (Ergebnisse verglichen mit dem t-Test des Schülers, p < 0,001). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
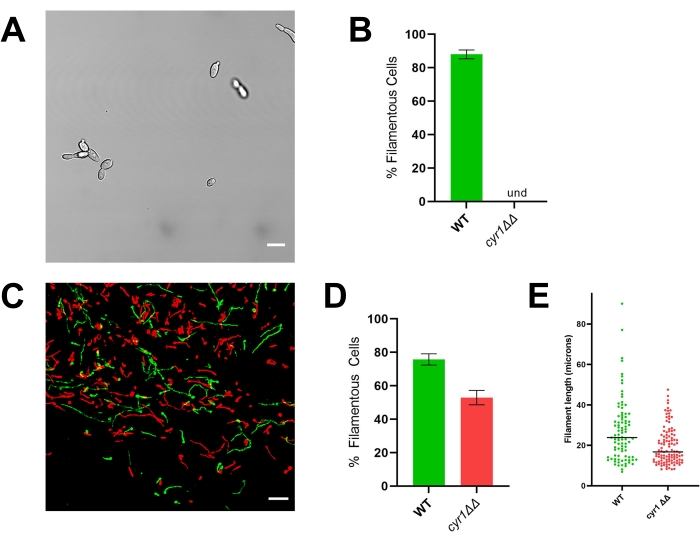
Abbildung 4: In vitro und in vivo Morphologie des cyr1 ΔΔ mutierten Stammes. (A) Weitfeldbild des cyr1ΔΔ-mutierten Stammes nach in vitro Induktion der Filamentation durch Wachstum von Zellen in RPMI + 10% Serum bei 37 °C für 4 h. Der Maßstabsbalken stellt 10 μm dar. Der Bildkontrast wurde mit einer Bildbearbeitungssoftware angepasst, um die Anzeige zu erleichtern. (B) Prozentsatz der in vitro beobachteten Filamentation in den WT- und cyr1-ΔΔ-Mutantenstämmen. Und = nicht nachweisbar (es wurden keine Filamente detektiert). Die Balkenhöhe stellt den mittleren Prozentsatz filamentöser Zellen aus drei unabhängigen Experimenten dar, in denen mindestens 100 Zellen quantifiziert wurden. Die Fehlerbalken zeigen die Standardabweichung an (Ergebnisse verglichen mit dem t-Test des Schülers, p < 0,001). (C) Konfokalmikroskopische Aufnahme von WT (grün) und der Cyr1ΔΔ-Mutante (rot), die 24 h nach der Inokulation in vivo wächst. Der Maßstabsbalken stellt 50 μm dar. (D) Prozentsatz der Filamentation in vivo, beobachtet in den WT- und cyr1ΔΔ-Mutantenstämmen. Die Balkenhöhe stellt den mittleren Prozentsatz filamentöser Zellen aus zwei unabhängigen Experimenten dar. Die Fehlerbalken zeigen die Standardabweichung an (Ergebnisse verglichen mit dem t-Test des Schülers, p < 0,001). (E) Verteilung der Filamentlänge in vivo, gemessen durch Kurvenweglänge in einer zweidimensionalen Projektion des z-Stacks. Jeder Punkt repräsentiert die Länge eines Filaments. Zellen, die als Hefe wachsen, wurden in diese Analyse nicht einbezogen. Bar gibt die mittlere Filamentlänge an. Die Verteilung der Längen ist signifikant unterschiedlich, wenn sie mit einem Mann-Whitney-U-Test analysiert wird (p < 0,001). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Dieses Modell verwendet konfokale Mikroskopie, um Bilder von C. albicans-Organismen zu erhalten, wie sie im Gewebe eines Säugetierwirts wachsen, so dass wir die Morphogenese-Phänotypen während der aktiven Infektion bewerten können. Der Prozess der Morphogenese ist von zentraler Bedeutung für die Pathogenese von C. albicans und wurde mit einer Vielzahl von In-vitro-Assays umfassend untersucht 2,3,4. Kein In-vitro-Assay kann jedoch die komplexe biochemische und strukturelle Umgebung des Wirts vollständig modellieren.
Das hier beschriebene Protokoll konzentriert sich auf die Verwendung dieses In-vivo-Bildgebungssystems, um eine Reihe / Bibliothek von C. albicans-Mutanten zu screenen, um die Gene zu identifizieren, die an der Morphogenese während der Infektion beteiligt sind. Die Verwendung von C. albicans-Stämmen, die verschiedene fluoreszierende Proteine exprimieren, ermöglicht es uns, die In-vivo-Morphogenese von C. albicans-Mutantenstämmen im Vergleich zu einem Referenzstamm zu quantifizieren. Der Vergleich der Morphogenese in der Mutante mit dem Referenzstamm innerhalb desselben Infektionsgebiets stellt sicher, dass die Organismen identischen Umgebungen ausgesetzt sind. Dies ermöglicht eine quantitative Messung des Prozentsatzes der Zellen, die einer Filamentation unterzogen werden, sowie des Ausmaßes der Filamentation. Die Normalisierung der Messungen des/der mutierten Stammes/e auf die des Referenzstamms ermöglicht es uns, die Leistung einer Mutante besser mit einer anderen zu vergleichen.
Die hier vorgestellten repräsentativen Ergebnisse zeigen das Potenzial für eine signifikante Diskrepanz zwischen in vitro und in vivo Phänotypen. Der C. albicans efg1ΔΔ mutierte Stamm wird häufig als Negativkontrolle für Morphogenese-Assays verwendet, da er unter fast allen In-vitro-Bedingungen nicht filamentieren kann20. Obwohl die In-vivo-Ergebnisse den In-vitro-Ergebnissen sehr ähnlich waren, bildete selbst dieser stark behinderte Stamm gelegentlich Filamente in der Umgebung des Wirtsgewebes (Abbildung 3). Dies unterstreicht die Stärke der Wirtsumgebung bei der Auslösung der Morphogenese.
Im Gegensatz dazu zeigt der cyr1ΔΔ-mutierte Stamm eine erhebliche Diskrepanz zwischen in vitro und in vivo Wachstum; Obwohl keine der mutierten Zellen in vitro einer Filamentation unterzogen wird, wächst etwa die Hälfte der Zellen in vivo als Filamente (Abbildung 4)10,21. Interessanterweise waren diese Filamente signifikant kürzer als diejenigen, die durch den Referenzstamm gebildet wurden, was darauf hindeutet, dass CYR1 entweder zur Wachstumsrate des Filaments oder zur Fähigkeit beiträgt, einen filamentösen Phänotyp aufrechtzuerhalten. Um die Analyse der Filamentlänge zu erleichtern, wurde die Kurvenweglänge der Filamente mit einer zweidimensionalen Projektion der Bilder gemessen. In zweidimensionalen Projektionen von Filamenten, die in drei Dimensionen wachsen, wird jedes Filament, das auf einer Achse wächst, die nicht parallel zur xy-Ebene ist, kürzer als seine wahre Länge projiziert. Da diese Verkürzung auch für den Referenzstamm auftritt, erlaubt die Auswertung der Verteilung der Filamentlängen in einer zweidimensionalen Projektion dennoch einen quantitativen Vergleich zwischen Referenz- und Mutantenstämmen. Die Analyse der Filamentlänge in zwei statt drei Dimensionen erfordert eine weniger intensive Bildanalyse; Somit kann es relativ schnell auf einem typischen Desktop-Computer durchgeführt werden. Die Verwendung dieser einfacheren Analyse ermöglicht die Einbeziehung der Filamentlängenverteilung als Teil eines Screening-Protokolls, was ein nuancierteres Verständnis der Fähigkeit jeder Mutante ermöglicht, eine Morphogenese zu durchlaufen, ohne wesentliche Verzögerungen beim Durchsatz zu verursachen.
Die hier vorgestellten repräsentativen Studien wurden mit DBA2/N-Mäusen durchgeführt, die einen Defekt in ihrem Komplementsystem aufweisen, der dazu führt, dass Neutrophile nicht an den Ort der C. albicans-Infektion rekrutiertwerden 22. Ziel dieser Studien war es, Mechanismen der Regulation der C. albicans-Filamentation im Wirtsgewebe zu untersuchen. Daher wurden DBA2/N-Mäuse verwendet, um zu vermeiden, dass die Ergebnisse aufgrund der Anfälligkeit oder Resistenz eines einzelnen Stammes gegen Neutrophile verfälscht werden. Da die neutrophile Anti-C. albicans-Antwort die Filamentation beeinflussen kann23, könnte die Rekrutierung von Neutrophilen an die Infektionsstelle die Ergebnisse eines Morphogenese-Assays beeinflussen. Wenn ein Stamm in der Lage ist, in vivo zu filamentieren, aber stark von der Filamentation gehemmt wird, wenn Neutrophile vorhanden sind, würde eine Filamentation bei DBA2 / N-Mäusen nachgewiesen, aber es wäre unwahrscheinlich, dass sie bei Mäusen mit intakter neutrophiler Chemotaxis beobachtet wird. Daher ist die Belastung der Maus, die als Host verwendet wird, ein wichtiger Faktor bei der Verwendung dieses Protokolls.
Die Beobachtung, dass der efg1ΔΔ-mutierte Stamm nicht in vivo filamentiert, ist unwahrscheinlich, dass er mit den Neutrophilenantworten des Wirts zusammenhängt, da dieser Stamm auch nicht in vitro filamentiert. Die in vivo beobachtete Filamentation mit dem Cyr1ΔΔ-Stamm ist diskordant mit dem Versagen der Filamentation in vitro. Daten aus dem Zebrafischmodell der C. albicans-Infektion deuten darauf hin, dass ansprechende Neutrophile wichtig für die Prävention der Morphogenese sind24. Daher ist es unwahrscheinlich, dass die Verwendung von DBA2/N-Mäusen, denen neutrophile Antworten fehlen, die Zunahme der Filamentation des Cyr1ΔΔ in vivo im Vergleich zu in vitro erklärt. Nichtsdestotrotz beeinflusst die In-vivo-Umgebung eindeutig die Morphogenese des Cyr1ΔΔ-Stammes; Daher kann die weitere Untersuchung dieses Stammes wichtige Informationen über die Regulation der Morphogenese von C. albicans während aktiver Infektionen liefern. Das hier beschriebene Protokoll ist als Screening-Assay konzipiert, um Stämme wie den cyr1ΔΔ-Stamm zu identifizieren, der in zukünftigen Studien verwendet werden soll.
Die Verwendung eines Low-Flow-Gasanästhesiesystems ist für dieses Protokoll sehr hilfreich (Abbildung 1A,B). Während der anfänglichen Entwicklung dieses Protokolls wurden Mäuse mit einem injizierbaren Anästhesiecocktail aus Ketamin gemischt mit Xylazin betäubt. Während es möglich war, eine begrenzte Bildgebung mit dieser Anästhesiemethode durchzuführen, war die Dauer der Anästhesie unvorhersehbar, so dass die Bildgebungssitzungen schnell beendet werden mussten, um zu vermeiden, dass sich die Maus während der Bildgebung von der Anästhesie erholte. Herkömmliche inhalative Anästhesiesysteme sind sperrig und erfordern hohe Durchflussraten von Anästhesiegasen, die oft in einem Abzug verwendet werden müssen. Daher wären herkömmliche inhalative Anästhesiesysteme mit den Platzbeschränkungen eines konfokalen Mikroskops sehr schwierig zu verwenden, ohne die Forscher versehentlich den Anästhetika auszusetzen. Die Verwendung eines Low-Flow-Inhalationsanästhesiesystems ermöglicht eine konsistente Anästhesie des Tieres bei gleichzeitiger Aufrechterhaltung einer sicheren Umgebung für den Ermittler. Der Low-Flow-Nasenkegel ermöglicht eine einfache Positionierung des Tieres sowohl für die Impfung als auch für die Mikroskopie. Der kleinkalibrige, kleinvolumige Verabreichungsschlauch ermöglicht die Verwendung relativ langer Schläuche, wodurch das Anästhesiegerät in ausreichendem Abstand platziert werden kann, um die Mikroskopie nicht zu stören.
Das in typischen Mäusesuppen vorhandene Chlorophyll führt zu einer signifikanten Gewebeautofluoreszenz25. Dies führt zu erheblichem Rauschen in den Bildern, was es schwierig macht, qualitativ hochwertige Bilder mit hoher räumlicher Auflösung zu erhalten. Wenn die Tiere vor der Bildgebung 7 Tage lang mit chlorophyllfreiem Chow gefüttert wurden, war der Hintergrund der Autofluoreszenz im Gewebe erheblich verringert, aber das im Haar abgelagerte Chlorophyll war weiterhin problematisch. Das Entfernen der Haare auf den Ohrmuscheln mit einer rezeptfreien chemischen Enthaarungscreme minimiert die Autofluoreszenz im Haar wirksam (Abbildung 1C, D). So verringerte die Kombination aus chlorophyllfreiem Chow und ausreichender Haarentfernung die Autofluoreszenz erheblich und verbesserte die Bildqualität dramatisch. Da die Haare vor der Bildgebung aus dem Ohr entfernt werden, hat die Farbe der Haare des Tieres keinen Einfluss auf dieses System. Dieses Protokoll wurde erfolgreich verwendet, um C. albicans-Infektionen bei BALB/c (weiß), C57BL/6 (schwarz) und DBA2/N (braun) Mäusen zu untersuchen. Das Protokoll kann auch mit C57BL/6-Knockout-Mäusen verwendet werden, denen verschiedene Wirtsgene fehlen; Dies wird zukünftige Untersuchungen ermöglichen, wie das Immunsystem des Säugetierwirts die Filamentation beeinflusst. Ein Merkmal dieses Modells, das in diesem Protokoll nicht diskutiert wird, ist, dass dasselbe Tier über mehrere Tage hinweg wiederholt abgebildet werden kann, da dieses Bildgebungssystem nicht-invasiv ist, so dass der Fortschritt der individuellen Infektion im Laufe der Zeit verfolgt werden kann. Dieses Merkmal wird wahrscheinlich eine Schlüsselrolle in zukünftigen Studien zur Wirt-Pathogen-Interaktion spielen.
Zusammenfassend führt dieses Protokoll zu hochauflösenden Bildern von C. albicans, die im Gewebe eines lebenden Säugetierwirts wachsen, was eine genaue Bewertung der Morphogenese in mutierten Stämmenermöglicht 8,9,10. Die hier vorgestellten Ergebnisse zeigen, wie dieses Protokoll verwendet werden kann, um eine Bibliothek von C. albicans-Mutanten zu screenen. Von den bisher getesteten C. albicans-Mutanten wird ein großer Teil der Mutanten mit bekannten Defekten in der Morphogenese in vitro leicht in vivo filamentiert 9,10. Dies unterstreicht, wie wichtig es ist, ein In-vivo-System wie dieses in Experimente einzubeziehen, die die Mechanismen der Pathogenese von C. albicans aufklären sollen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde durch den NIH-Zuschuss 1R01AI33409 und die Abteilung für Pädiatrie des Carver College of Medicine der University of Iowa unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| #1.5 coverslips | Thermo-Fisher | 20811 | large enough to cover the universal stage opening |
| 0.1 mL Insulin syringes | EXELint | 26018 | Can use syringes that are 5/16"–1/2" long and 29–32 G |
| 3.7% formaldehyde in dPBS | Sigma-Aldrich | SHBJ5734 | |
| 70% Ethanol/30% water | Decon Laboratories | A05061001A | |
| Alcohol prep pads | Covidien | 5110 | Alternative: gauze pads soaked in 70% isopropyl alcohol |
| C.albicans reference strain and experimental strains | SN250 | FGSC Online Catalog | The specific C. albicans strain varies with experiment and the investigators goals. We have used strains derived from SC5314 as well as other clinical isolates. |
| Chlorophyl free mouse chow | Envigo | 2920x | |
| Computer | Dell | Optiplex 7050 | Computer that can run imaging software for acquisition and for analysis of images. A variety of imaging software is available and varies with the specific microscope and user system. |
| Cotton tip applicator | Pro Advantage | 76200 | |
| DBA2/N (6-12 week old mice) | BALB/c and C57/BL6 mice can also be used. The latter allow for the use of widely available knockout mouse models as well as mouse models in which individual cell types, such as phagocytes, are identified by their expression of fluorescent proteins. | ||
| Double sided tape designed to hold fabric to skin (fashion tape) | local pharmacy or grocery store | Double sided adhesive tape designed for keeping clothing in place over human skin. This is typically available over the counter in pharmacies and variety stores. It is important to use this type of tape as it is designed for gentle adherence to skin. Examples: https://www.amazon.com/Womens-Fashion-Clothing-Transparent-Suitable/dp/B08S3TWR3H/ref=sr_1_40?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174406&sprefix= fashion+tape%2Caps%2C70&sr=8-40 https://www.amazon.com/Fearless-Tape-Sensitive-Clothing-Transparent/dp/B07QY8V5XT/ref=sr_1_26?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174320&sprefix= fashion+tape%2Caps%2C70&sr=8-26 https://www.amazon.com/Hollywood-Fashion-Secrets-Tape-Floral/dp/B009RX77MK/ref=sr_1_29?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174406&sprefix= fashion+tape%2Caps%2C70&sr=8-29 | |
| Dulbecco's phosphate buffered saline | Gibco / Thermo-Fisher | 14190-144 | Must be sterile; open a new container for every experiment |
| Fetal bovine serum | Gibco / Thermo-Fisher | 26140-079 | |
| Gauze pad | Pro Advantage | P157112 | |
| Gel eye lurbicant | local pharmacy or grocery store | ||
| ImageJ or FIJI analysis software | NIH | ImageJ (FIJI) | |
| Isoflurane | Akorn | J119005 | |
| Leica DMi8 (SP8 platform) with Leica 11506375 objective lens | Leica | DMi8 (SP8) | The objective lens (Leica 11506375) used here is a 25x water immersion lens to allow us to have a high NA (0.95) while approximating the refractive index of the ear tissue. The microscope (Leica DMi8 (SP8 platform) has 488 nm and 638 nm diode laser lines and is equipped with filter-free spectral detection with computer controlled adjustable bandwidth for detection of emission light. The stage must have enough clearance to allow the objective to reach the bottom coverslip without hitting the stage. |
| Low-flow anesthesia system or traditional anesthesia vaporizer | Kent Scientific International | SomnoSuite | |
| Nair hair remover lotion | local pharmacy or grocery store | Over the counter depilatory cream | |
| Nourseothricin | Jena Bioscience | AB-101L | |
| pENO1-NEON-NATR pENO1-iRFP-NATR plasmids | Fluorescent protein expression transformation constructs generously given to us by Dr. Robert Wheeler (Seman, et al., 2018, Infection and Immunity; Bergeron, et al., 2017, Infection and Immunity) | ||
| Pressure sensitive laboratory tape | Tape & Label Graphic Systems Inc | 1007910 | |
| RPMI1640 cell culture medium | Gibco / Thermo-Fisher | 11875-093 | |
| Thimble, plastic 15 mL conical tube, or Falcon 5 mL round bottom polystyrene tubes | Falcon | 352196 | To safely hold the animals ear during injectinos |
Referenzen
- Lopes, J. P., Lionakis, M. S. Pathogenesis and virulence of Candida albicans. Virulence. 13 (1), 89-121 (2022).
- Saville, S. P., Lazzell, A. L., Monteagudo, C., Lopez-Ribot, J. L. Engineered control of cell morphology in vivo reveals distinct roles for yeast and filamentous forms of Candida albicans during infection. Eukaryotic Cell. 2 (5), 1053-1060 (2003).
- Arita, G. S., et al. Cell wall associated proteins involved in filamentation with impact on the virulence of Candida albicans. Microbiological Research. 258, 126996(2022).
- Rai, L. S., Wijlick, L. V., Bougnoux, M. E., Bachellier-Bassi, S., d'Enfert, C. Regulators of commensal and pathogenic life-styles of an opportunistic fungus-Candida albicans. Yeast. 38 (4), 243-250 (2021).
- Sudbery, P. E. Growth of Candida albicans hyphae. Nature Reviews Microbiology. 9 (10), 737-748 (2011).
- Basso, V., d'Enfert, C., Znaidi, S., Bachellier-Bassi, S. From genes to networks: The regulatory circuitry controlling candida albicans morphogenesis. Current Topics in Microbiology and Immunology. 422, 61-99 (2019).
- Mancera, E., et al. Evolution of the complex transcription network controlling biofilm formation in Candida species. Elife. 10, 64682(2021).
- Mitra, S., Dolan, K., Foster, T. H., Wellington, M. Imaging morphogenesis of Candida albicans during infection in a live animal. Journal of Biomedical Optics. 15 (1), 010504(2010).
- Wakade, R. S., Huang, M., Mitchell, A. P., Wellington, M., Krysan, D. J. Intravital imaging of Candida albicans identifies differential in vitro and in vivo filamentation phenotypes for transcription factor deletion mutants. mSphere. 6 (3), 0043621(2021).
- Wakade, R. S., Kramara, J., Wellington, M., Krysan, D. J. Candida albicans filamentation does not require the cAMP-PKA pathway in vivo. mBio. 13 (3), 0085122(2022).
- Bergeron, A. C., et al. Candida albicans and Pseudomonas aeruginosa interact to enhance virulence of mucosal infection in transparent zebrafish. Infection and Immunity. 85 (11), 00475(2017).
- Seman, B. G., et al. Yeast and filaments have specialized, independent activities in a zebrafish model of Candida albicans infection. Infection and Immunity. 86 (10), 00415-00418 (2018).
- Centers for Disease Control and Prevention. Biosafety in Microbiological and Biomedical Laboratories (BMBL). 6th edition. , Available from: https://www.cdc.gov/labs/BMBL.html (2020).
- Homann, O. R., Dea, J., Noble, S. M., Johnson, A. D. A phenotypic profile of the Candida albicans regulatory network. Plos Genetics. 5 (12), 1000783(2009).
- Cullen, P. J., Sprague, G. F. The regulation of filamentous growth in yeast. Genetics. 190 (1), 23-49 (2012).
- Herrero, A. B., et al. Control of filament formation in Candida albicans by polyamine levels. Infection and Immunity. 67 (9), 4870-4878 (1999).
- Ahmad Hussin, N., et al. Biotin auxotrophy and biotin enhanced germ tube formation in Candida albicans. Microorganisms. 4 (3), 37(2016).
- Nantel, A., et al. Transcription profiling of Candida albicans cells undergoing the yeast-to-hyphal transition. Molecular Biology of the Cell. 13 (10), 3452-3465 (2002).
- Noble, S. M., Johnson, A. D. Strains and strategies for large-scale gene deletion studies of the diploid human fungal pathogen Candida albicans. Eukaryotic Cell. 4 (2), 298-309 (2005).
- Glazier, V. E. EFG1, Everyone's favorite gene in Candida albicans: A comprehensive literature review. Frontiers in Cellular Infection and Microbiology. 12, 855229(2022).
- Huang, G., Huang, Q., Wei, Y., Wang, Y., Du, H. Multiple roles and diverse regulation of the Ras/cAMP/protein kinase A pathway in Candida albicans. Molecular Microbiology. 111 (1), 6-16 (2019).
- Saville, S. P., Lazzell, A. L., Chaturvedi, A. K., Monteagudo, C., Lopez-Ribot, J. L. Use of a genetically engineered strain to evaluate the pathogenic potential of yeast cell and filamentous forms during Candida albicans systemic infection in immunodeficient mice. Infection and Immunity. 76 (1), 97-102 (2008).
- Brothers, K. M., Newman, Z. R., Wheeler, R. T. Live imaging of disseminated candidiasis in zebrafish reveals role of phagocyte oxidase in limiting filamentous growth. Eukaryotic Cell. 10 (7), 932-944 (2011).
- Brothers, K. M., et al. NADPH oxidase-driven phagocyte recruitment controls Candida albicans filamentous growth and prevents mortality. PLoS Pathogens. 9 (10), 1003634(2013).
- Holmes, H., Kennedy, J. C., Pottier, R., Rossi, R., Weagle, G. A recipe for the preparation of a rodent food that eliminates chlorophyll-based tissue fluorescence. Journal of Photochemistry and Photobiology. B: Biology. 29 (2-3), 199(1995).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten