Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Messung der Thermogenese der Skelettmuskulatur bei Mäusen und Ratten
In diesem Artikel
Zusammenfassung
Mäuse und Ratten werden chirurgisch mit Remote-Temperaturtranspondern implantiert und dann an die Testumgebung und das Testverfahren gewöhnt. Veränderungen der Muskeltemperatur werden als Reaktion auf pharmakologische oder kontextuelle Reize im häuslichen Käfig oder während vorgeschriebener körperlicher Aktivität (z. B. Laufbandlaufen mit konstanter Geschwindigkeit) gemessen.
Zusammenfassung
Die Thermogenese der Skelettmuskulatur bietet einen möglichen Weg, um die metabolische Homöostase und die Mechanismen, die dem Energieverbrauch zugrunde liegen, besser zu verstehen. Es gibt überraschend wenig Beweise, um die neuronalen, myozellulären und molekularen Mechanismen der Thermogenese direkt mit messbaren Veränderungen der Muskeltemperatur in Verbindung zu bringen. Dieser Artikel beschreibt eine Methode, bei der Temperaturtransponder verwendet werden, um direkte Messungen der Skelettmuskeltemperatur von Maus und Ratte abzurufen.
Remote-Transponder werden chirurgisch in den Muskel von Mäusen und Ratten implantiert, und die Tiere erhalten Zeit, sich zu erholen. Mäuse und Ratten müssen dann wiederholt an die Testumgebung und das Testverfahren gewöhnt werden. Veränderungen der Muskeltemperatur werden als Reaktion auf pharmakologische oder kontextuelle Reize im heimischen Käfig gemessen. Die Muskeltemperatur kann auch während der vorgeschriebenen körperlichen Aktivität (d. H. Laufbandlaufen mit konstanter Geschwindigkeit) gemessen werden, um Veränderungen der Aktivität als Beitrag zu den durch diese Reize induzierten Veränderungen der Muskeltemperatur auszuschließen.
Diese Methode wurde erfolgreich eingesetzt, um Mechanismen aufzuklären, die der thermogenen Muskelkontrolle auf der Ebene des Gehirns, des sympathischen Nervensystems und der Skelettmuskulatur zugrunde liegen. Bereitgestellt werden Demonstrationen dieses Erfolgs mit Raubtiergeruch (PO; Frettchengeruch) als kontextueller Stimulus und Injektionen von Oxytocin (Oxt) als pharmakologischer Stimulus, wobei Raubtiergeruch die Muskelthermogenese induziert und Oxt die Muskeltemperatur unterdrückt. Somit zeigen diese Datensätze die Wirksamkeit dieser Methode bei der Erkennung schneller Änderungen der Muskeltemperatur.
Einleitung
Innerhalb der Stoffwechselforschung ist die Untersuchung der Thermogenese der Skelettmuskulatur ein vielversprechender neuer Weg, um die Homöostase des Körpergewichts zu untersuchen. Die veröffentlichte Literatur unterstützt die Idee, dass die thermogenen Reaktionen eines der größten Organsysteme des Körpers - der Skelettmuskulatur - einen Weg zur Erhöhung des Energieverbrauchs und anderer metabolischer Effekte bieten, wodurch Systeme innerhalb von Krankheiten wie Fettleibigkeit effektiv wieder ins Gleichgewicht gebrachtwerden 1,2,3. Wenn der Muskel als thermogenes Organ betrachtet werden kann, müssen Studien eine praktische Methodik verwenden, um thermogene Veränderungen innerhalb dieses Organs zu untersuchen. Der Wunsch, die endothermen Auswirkungen der Skelettmuskulatur zu verstehen, und der Nutzen dieser Methodik zur Untersuchung der Thermogenese nicht zitternder Muskeln sind nicht spezifisch für metabolische Studien. Disziplinen wie Evolution4, vergleichende Physiologie5 und Ökophysiologie6,7 haben ein persönliches Interesse daran gezeigt, zu verstehen, wie die Muskelthermogenese zur Endothermie beitragen kann und wie sich dieser Mechanismus an die Umwelt anpasst. Das vorgestellte Protokoll bietet die kritischen Methoden, die zur Beantwortung dieser Fragen erforderlich sind.
Die bereitgestellte Methode kann bei der Bewertung der kontextuellen und pharmakologischen Stimulimodulation der Muskeltemperatur verwendet werden, einschließlich der einzigartigen Technik der Bereitstellung von Raubtiergeruch (PO), um den Kontext zu verschieben, um die Bedrohung durch Raubtiere zu replizieren. Frühere Berichte haben die Fähigkeit von PO gezeigt, schnell einen beträchtlichen Anstieg der Muskelthermogenese zu induzieren8. Darüber hinaus können pharmakologische Reize auch die Muskeltemperatur verändern. Dies wurde im Zusammenhang mit der PO-induzierten Muskelthermogenese gezeigt, bei der die pharmakologische Blockade peripherer β-adrenerger Rezeptoren unter Verwendung von Nadolol die Fähigkeit von PO hemmte, die Muskelthermogenese zu induzieren, ohne die kontraktile Thermogenese während des Laufbandgehens signifikant zu beeinflussen8. Die zentrale Verabreichung von Melanocortin-Rezeptor-Agonisten bei Ratten wurde auch verwendet, um Gehirnmechanismen zu erkennen, die die Thermogenese verändern 9,10.
Hier ist eine vorläufige Untersuchung der Fähigkeit des Neurohormons Oxytocin (Oxt), die Muskelthermogenese bei Mäusen zu verändern. Ähnlich wie bei der Bedrohung durch Raubtiere erhöhen soziale Begegnungen mit einem gleichgeschlechtlichen Artgenossen die Körpertemperatur, ein Phänomen, das als soziale Hyperthermie bezeichnetwird 11. Angesichts der Relevanz von Oxt für das Sozialverhalten12 wurde spekuliert, dass Oxt ein Vermittler der sozialen Hyperthermie bei Mäusen ist. Tatsächlich verringert ein Oxytocin-Rezeptor-Antagonist die soziale Hyperthermie bei Mäusen11, und Mäusewelpen, denen Oxt fehlt, zeigen Defizite in Verhaltens- und physiologischen Aspekten der Thermoregulation, einschließlich Thermogenese13. Angesichts der Tatsache, dass Harshaw et al. (2021) keine Beweise für die β3-adrenerge rezeptorabhängige Thermogenese des braunen Fettgewebes (BAT) mit sozialer Hyperthermie11 gefunden haben, wurde postuliert, dass soziale Hyperthermie durch Oxts Induktion der Muskelthermogenese angetrieben werden könnte.
Um die Thermogenese der Skelettmuskulatur zu messen, verwendet das folgende Protokoll die Implantation von vorprogrammierten IPTT-300-Transpondern neben dem interessierenden Muskel innerhalb einer Maus oder Ratte 8,10,14,15. Bei diesen Transpondern handelt es sich um glasgekapselte Mikrochips, die mit entsprechenden Transponderlesern ausgelesen werden. Wenig bis gar keine Forschung hat diese Technologie in dieser Eigenschaft eingesetzt, obwohl Studien auf die Notwendigkeit der Spezifität dieser Methode hindeuten16,17. Frühere Untersuchungen haben die Zuverlässigkeit dieses Verfahrens und eine Vielzahl von Möglichkeiten gezeigt, wie Temperaturtransponder im Vergleich zu anderen Temperaturprüfverfahren18 oder in Verbindung mit chirurgischen Verfahren (z. B. Kanülierung19) verwendet werden können. Studien dieser Art stützen sich jedoch auf verschiedene strategische Platzierungen, um die Gesamtkörpertemperatur20,21,22 oder spezifizierte Gewebe wie BAT23,24,25 zu messen.
Anstatt die Temperatur von diesen Stellen oder unter Verwendung von Ohr- oder Rektalthermometern26 zu messen, bietet das hier beschriebene Verfahren Spezifität für den interessierenden Muskel. Die Fähigkeit, eine Stelle durch direkte Implantation von Transpondern in der Nähe der interessierenden Muskeln anzugreifen, ist effektiver, um die Muskelthermogenese gezielt zu untersuchen. Es bietet einen neuen Weg zusätzlich zu denen, die die Oberflächeninfrarot-Thermometrie 27,28 oder die Hauttemperaturmessungen über Thermoelement 29 bieten. Darüber hinaus bieten die durch diese Methode gelieferten Daten eine Reihe von Forschungsmöglichkeiten, wodurch die Notwendigkeit großer, teurer High-Tech-Geräte und Software wie Infrarot-Thermografie 30,31,32 vermieden wird.
Diese Methode wurde erfolgreich verwendet, um die Temperatur im Quadrizeps und Gastrocnemius entweder einseitig oder bilateral zu messen. Diese Methode hat sich auch in Verbindung mit der stereotaktischen Chirurgie als wirksam erwiesen14,15. Innerhalb von ~7-10 cm des Transpondergliedes werden tragbare Transponderleser (DAS-8027/DAS-7007R) zum Scannen, Messen und Anzeigen der Temperatur verwendet. Dieser Abstand war für frühere Untersuchungen kritisch und wertvoll 8,9,10, da er potenzielle Stressoren und temperaturverändernde Variablen wie den Umgang mit Tieren während der Testverfahren minimiert. Mithilfe von Zeitschaltuhren können dann Messungen aufgezeichnet und über einen längeren Zeitraum ohne direkte Interaktion mit den Tieren gesammelt werden.
Um die Störung von Mäusen während des Tests weiter zu minimieren, beschreibt diese Methode die Montage und Verwendung von Steigleitungen aus PVC-Rohrleitungen, um dem Experimentator während der Prüfung Zugang zum Boden der Heimkäfige zu geben. Mit den Tragegurten in Verbindung mit dem digitalen Lesegerät können Temperaturmessungen der Transpondergliedmaße ohne tierische Interaktion nach dem Setzen des Stimulus durchgeführt werden. Zu minimalen Kosten kann diese Methode in Verbindung mit pharmakologischen und kontextuellen Stimuli verwendet werden, was sie für Forscher leicht zugänglich macht. Darüber hinaus kann diese Methode mit einer beträchtlichen Anzahl von Probanden (~ 16 Mäuse oder ~ 12 Ratten) gleichzeitig angewendet werden, was Zeit spart, um den Gesamtdurchsatz für jedes Forschungsprojekt zu erhöhen.
Bei dieser Methode wird ein handgefertigter Mechanismus zur Darstellung von Gerüchen an Mäuse mit Edelstahl-Mesh-Tee-Infuser-Bällen eingeführt, die von nun an als "Teekugeln" bezeichnet werden. Obwohl diese Teebällchen ideal sind, um Geruchsmaterial zu enthalten, werden in diesen Studien Handtücher, die über 2-3 Wochen als Einstreu im Käfig für Frettchen, ein natürliches Raubtier von Mäusen und Ratten, dienten, in jede Behandlung Teeball gelegt. Jedes Handtuch wird in Quadrate von 5 cm x 5 cm geschnitten. Diese Aliquotierung wiederholt sich auch bei ansonsten identischen geruchlosen Kontrolltüchern. Die Präsentation dieser Gerüche ohne Barriere (z. B. Teeball) führte dazu, dass Mäuse die Fasern in ihren Käfigen zerkleinerten und die körperliche Aktivität erhöhten. Dieses Verhalten war bei Ratten nicht so auffällig. Teekugeln bieten eine belüftete Hülle für das Handtuch, die vollen Zugang zum Geruch bietet, während sie für die gesamte experimentelle Studie geschützt bleiben. Diese Teebällchen können in Übereinstimmung mit den Tierverwendungsprotokollen desinfiziert, vorbereitet und direkt nach der Operation eingeführt werden, um die Tiere zusammen mit dem Kontrollreiz an die Struktur zu gewöhnen. Mäuse können dann mit der zusätzlichen Bereicherung leben, wodurch die Bedeutung der akuten Reizpräsentation verringert wird.
Die Gewöhnung an das Vorhandensein des Teeballs ist nur ein Aspekt der Gewöhnung, der für diese Methode entscheidend ist. Das beschriebene Gewöhnungsprotokoll besteht auch aus wiederholter Exposition gegenüber dem Testverfahren, um die Testumgebung zu normalisieren (d.h. Personal, Transport und Bewegung zum Testort, Exposition gegenüber Reizen). Diese erweiterte Gewöhnung minimiert nuancierte Reaktionen der Tiere und fokussiert die Messungen auf die gewünschten abhängigen Variablen (z. B. pharmakologische oder kontextuelle Reize). Frühere Bewertungen dieses Protokolls haben vier Studien als die Mindestanzahl von Gewöhnungen identifiziert, die vor Temperaturtests in Heimkäfigen bei Ratten erforderlich sind8. Wenn die Prüfung durch lange Zeiträume (mehr als 2-3 Wochen) getrennt ist, müssen die Tiere wieder gewöhnt werden. Bei wiederholter Gewöhnung sind mindestens ein bis zwei Versuche ausreichend. Wenn Temperaturtests jedoch durch längere Zeitabschnitte getrennt werden, kann eine Wiederholung weiterer Versuche erforderlich sein.
In den fortgesetzten Bemühungen, Mäuse und Ratten an das Testverfahren zu gewöhnen, sollte in jeder experimentellen Studie eine Akklimatisierungsphase vor der Präsentation des Stimulus enthalten sein. Diese Akklimatisierungszeit ist entscheidend, um Temperatur und Aktivität nach der Verlagerung an den Testort wieder ins Gleichgewicht zu bringen. Nagetiere neigen dazu, aufgrund von Translokation stark zu temperaturerhöhungen. Die Akklimatisierung sollte aus mindestens 1 h ohne Interaktion des Experimentators am Testtag bestehen, bevor ein pharmakologischer Wirkstoff oder kontextuelle Stimuli hinzugefügt werden. Dies ist an jedem Testtag notwendig.
In den skizzierten Hauskäfig-Temperaturtests haben Mäuse die freie Reichweite ihres Heimkäfigs, um sich als Reaktion auf den getesteten Reiz zu bewegen. Dies kann zu variablen Aktivitätsverschiebungen führen, die sich auf die Genauigkeit der Temperaturmessungen und damit auf die Analyse der thermogenen Effekte der unabhängigen Variablen (z. B. pharmakologischer oder kontextueller Stimulus) auswirken. In Anerkennung der möglichen Temperaturänderungen aufgrund des Aktivitätsniveaus ist unten ein Protokoll enthalten, das die Verwendung der Temperatur während des Laufbandgehens beschreibt. Die veröffentlichte Literatur beschreibt den erfolgreichen Einsatz dieses Verfahrens bei Ratten, und es wird derzeit mit Mäusen 8,10,14,15 angewendet. Das Laufband hält eine konstante Aktivitätsgeschwindigkeit für die Testperson aufrecht. Für diese Studie werden Laufbänder ausschließlich zur Kontrolle des Aktivitätsniveaus verwendet und daher auf die niedrigste verfügbare Geschwindigkeit auf dem Laufband eingestellt, um das Gehen für Mäuse und eine ähnlich niedrige Einstellung für Ratten zu fördern.
Das folgende Verfahren wird für die Temperaturmessung von einseitigem Gastrocnemius bei Mäusen und Raubtiergeruch beschrieben. Das Design kann in Verbindung mit pharmakologischen Wirkstoffen verwendet werden und ist auf Ratten und andere Skelettmuskelgruppen (z. B. Quadrizeps) in Mäusen übertragbar. Bei Ratten können Transponder bilateral im Gastrocnemius und im braunen Fettgewebe platziert werden. Aufgrund von Größen- und Entfernungsbeschränkungen kann nur ein Transponder pro Maus verwendet werden. Geringfügige Modifikationen (z. B. die Entfernung kontextueller Reize) können vorgenommen werden, um thermogene Reaktionen auf pharmakologische Wirkstoffe zu beurteilen.
Protokoll
Diese Methoden können sowohl auf Ratten- als auch auf Mausmodelle angewendet werden und wurden mit institutioneller Zulassung durchgeführt (Kent State University, IACUC Approval #359 und #340 CN 12-04). Vor der Umsetzung des Protokolls sollten die Tiere in Übereinstimmung mit dem Leitfaden für die Pflege und Verwendung von Labortieren untergebracht werden.
1. Vorbereitung des Transponderlesers
HINWEIS: Vor der Verwendung muss der Transponderleser eingestellt werden; Die folgenden Schritte umfassen nur die für diese Studie erforderlichen Einstellungsänderungen. Dieser Teil des Protokolls ist direkt mit den tragbaren Lesegeräten DAS-8027-IUS verbunden. Andere Lesermodelle sollten den Anweisungen des Handbuchs folgen, um Programmierergebnisse zu erzielen.
- Stellen Sie Audiosignalton auf AUS.
- Schalten Sie das Gerät ein, indem Sie die SCAN-Taste drücken, und warten Sie, bis die Beleuchtung auf dem OLED-Display erscheint. Halten Sie die Taste BACK/MENU gedrückt, um zum Menübildschirm zu gelangen.
- Scrollen Sie mit der Schaltfläche NEXT/ENTER durch die Optionen bis OPERATIONAL SETUP. Schalten Sie hier die Pfeile nach oben oder unten, um JA zu drehen und das operative Untermenü zu öffnen.
- Scrollen Sie mit der Taste NEXT/ENTER zu AUDIO BEEP. Wenn die Standardeinstellung ON ist, schalten Sie die Pfeile nach oben oder unten um, und ändern Sie die Einstellung in OFF.
- Drücken Sie die Taste NEXT/ENTER, um diese Einstellungsänderung zu speichern.
- Stellen Sie Vibrieren beim Lesen auf ON.
- Folgen Sie Schritt 1.1 bis Schritt 1.2 oder führen Sie den nächsten Schritt direkt nach Schritt 1.4 aus.
- Scrollen Sie mit der Taste NEXT/ENTER zu VIBRIEREN BEIM LESEN. Wenn die Standardeinstellung OFF ist, schalten Sie die Aufwärts- und Abwärtspfeile um und ändern Sie die Einstellung auf ON, um über Vibration zu fühlen, wenn der Messwert abgeschlossen ist, unabhängig davon, ob Sie den Bildschirm anzeigen können.
2. Programm-Transponder
HINWEIS: Jeder implantierte Transponder sollte zunächst mit einer Tieridentifikation (Tier-ID oder Transponder-ID) programmiert werden. Diese Nomenklatur kann als sekundäre Identifizierung für die Testperson verwendet werden (z. B. vier Ziffern für die Abkürzung des Mausstamms, Position des Transponders und zusätzliche drei bis vier Ziffern zur Angabe der Tiernummer). Die Programmierung kann Tage vor der Operation abgeschlossen werden, während die Transponder vor der Operation steril gehalten werden.
- Geben Sie den ID-Code auf dem Transponder ein.
- Bringen Sie eine Booster-Spule auf den Lesekopf an – ein spezielles Zubehör für das Modell DAS 8027-IUS, das den Programmiervorgang unterstützt.
- Legen Sie den Transponder (innerhalb des Applikators) mit einer behandschuhten Hand in die Booster-Spule.
- Schalten Sie das Gerät ein, indem Sie die SCAN-Taste drücken, und warten Sie, bis das OLED-Display aufleuchtet. Halten Sie die Taste BACK/MENU gedrückt, um zum Menübildschirm zu gelangen.
- Scrollen Sie mit der Schaltfläche NEXT/ENTER durch die Optionen, bis WRITE TRANSPONDER ID (TRANSPONDER-ID SCHREIBEN). Schalten Sie hier die Pfeile nach oben oder unten, um JA zu drehen.
- Wechseln Sie mit der Schaltfläche NEXT/ENTER zu ENTER ID CODE.
- Verwenden Sie die Nach-oben- und Nach-unten-Tasten, um durch Zahlen und Buchstaben zu blättern. Drücken Sie nach jeder Zeichenauswahl NEXT/ENTER , um zum folgenden Zeichen zu wechseln.
- Wenn der ID-Code vollständig ist, drücken Sie SCAN , um den Transponder zu schreiben.
- Entfernen Sie den Transponder von der Booster-Spule und wiederholen Sie den Vorgang bei Bedarf. Überprüfen Sie, ob der Transponder Temperaturänderungen liest, indem Sie die beiliegenden Transponder zwischen behandschuhten Händen erwärmen und mit dem Temperaturscanner messen.
HINWEIS: AUTO MULTI WRITE und Sequential COUNT Einstellungen können auf EIN gesetzt werden, um mehrere oder sequentielle Transponder-Programmierung während einer Sitzung zu ermöglichen. Jeder Transponder sollte während der Programmierung getestet werden.
3. Bereiten Sie "heimische Käfigbälle" vor
- Legen Sie 5 cm x 5 cm Geruchs-/Kontrolltuch in einen Teeball.
- Platzieren Sie diese heimischen Käfigkugeln nach der Operation in neuen Heimkäfigen, um das Tier an die Methode zu gewöhnen, bei der die kontextuellen Reize während des Tests präsentiert werden. Ersetzen Sie diese Heimkäfigbälle alle 2 Wochen.
4. Chirurgie und Nachsorge
- Wiegen und notieren Sie das Körpergewicht der Probanden vor der Operation. Verwenden Sie eine Induktionskammer, geben Sie dem Tier eine Anästhesie (z. B. 2-5% Isofluran).
- Rasieren Sie die Hinterbeine mit elektrischen Haarschneidern vollständig. Verabreichen Sie Analgesie (z. B. 5 mg/kg Ketoprofen, s.c.) in Übereinstimmung mit den institutionellen Richtlinien.
HINWEIS: Zusätzliche Analgesie kann erforderlich sein, wenn dieses Verfahren mit anderen chirurgischen Methoden kombiniert wird. - Reinigen Sie den Bereich mit 70% Alkohol (oder handelsüblichem sterilem Alkoholtuch) und Povidon-Jod-Waschen (oder handelsüblichen sterilen, einzeln verpackten Betadintupfern) mindestens dreimal abwechselnd und enden Sie mit Povidon-Jod.
- Bringen Sie das Tier in die Induktionskammer zurück und betäuben Sie das Tier auf chirurgisches Niveau. Stellen Sie dann die Maus in eine Gesichtsmaske ein, um weiterhin der Anästhesie ausgesetzt zu sein. Tragen Sie Neomycin-Augensalbe auf die Augen des Tieres auf, um Trockenheit während der Narkose zu verhindern.
HINWEIS: Der Eingriff sollte erst beginnen, wenn die Maus keine Anzeichen einer Schmerzaufnahme zeigt (z. B. Hornhautreflex, Schwanzklemmreaktion, Zehenklebereflex). - Machen Sie nur mit einer chirurgischen Schere einen flachen Schnitt durch die Haut an der rechten Hinterbeine.
- Parallel zum Gastrocnemius bewegen Sie die scharfe Kante eines vorprogrammierten und ungedeckelten sterilen Transponders in den Einschnitt. Stellen Sie sicher, dass der grüne Kolben nach oben zeigt und sichtbar ist. Schieben Sie den Transponderapplikator weiter in den Einschnitt, bis die Öffnung des Transponderapplikators nicht mehr sichtbar ist.
HINWEIS: Drücken Sie in Schritt 4.6 nicht versehentlich auf den grünen Kolben am Transponderapplikator. Eine vorzeitige Entladung des Transponders führt zu einer unsachgemäßen Platzierung. - Drehen Sie den Applikator um 180°, was dazu führt, dass der grüne Kolben nach unten zum Glied der Maus zeigt und für den Experimentator nicht mehr sichtbar ist. Schieben Sie den Transponderapplikator an die endgültige Stelle. Sobald Sie sich in idealer Platzierung befinden, neben oder teilweise eingeschlossen im Gastrocnemius, drücken Sie den grünen Kolben, so dass der Druck des Applikators die Hand des Ermittlers wieder von der Maus wegführen kann.
- Halten Sie die geöffnete Haut mit einer Pinzette zusammen und legen Sie einen Wundclip mit einem sterilen Autoclip oder einer sterilen Naht. Verwenden Sie bei Bedarf resorbierbare Nähte vor dem sterilen Autoclip, um die Faszienschicht zu schließen. Überprüfen Sie mit dem Transponder-Reader die Temperatur des Mausmuskels.
- Entfernen Sie die Maus aus der Anästhesie und legen Sie sie in einen sauberen Hauskäfig, der auf einem wasserzirkulierenden Heizkissen liegt, das zur Erholung auf niedrig eingestellt ist. Stellen Sie sicher, dass der Hauskäfig einen Teeball mit einem geruchlosen Handtuch enthält, um mit der Gewöhnung zu beginnen.
HINWEIS: Die Maus sollte innerhalb von 15 Minuten aus der Operation erwachen. Futter kann am Boden des Käfigs platziert werden, um während der Erholungstage leicht zugänglich zu sein. - Nachsorge
- Erfassen Sie täglich das Gewicht und die Temperaturen der Maus mit einem Transponder-Reader für mindestens 2 Tage nach der Operation oder bis die Mäuse ihr Körpergewicht wiedererlangt oder stabilisiert haben.
- Verabreichen Sie den Mäusen mindestens 2 Tage nach der Operation einmal täglich eine nicht-narkotische Analgesie (z. B. 5 mg/kg Ketoprofen, s.c.), wobei bei Bedarf zusätzliche Dosen verabreicht werden.
HINWEIS: Mäuse und Ratten sollten sich innerhalb von 5-8 Tagen nach der Operation vollständig erholen und können sich Gewöhnungs- und Testverfahren unterziehen.
5. Testvorbereitung - Heimkäfig
- Bau von Tragegurten
HINWEIS: Der folgende Schritt basiert auf 194 mm x 181 mm x 398 mm großen Mausfilterkäfigen. Für größere Käfige (z. B. einen Rattenkäfig) muss die Breite angepasst werden.- Schneiden Sie das PVC-Rohr mit einem Ratschenschneider aus PVC in acht Abschnitte und montieren Sie es gemäß Abbildung 1C. Dies ergibt eine offene Tischstruktur, die ungefähr vier Käfige aufnehmen kann. Stellen Sie die gewünschte Anzahl von Tragegurten her.
- Raumeinrichtung
- Weisen Sie jeder Riserkarte im Testraum eine Position zu. Trennen Sie die Steigleitungen, die verschiedene kontextuelle Reize (z. B. Gerüche) aufnehmen, um mindestens 2 m, um verwirrende Variablen zu vermeiden.
HINWEIS: Jeder Maus sollte so weit wie möglich ein zugewiesener Testort innerhalb des Testraums und auf den physischen Tragegurten zugewiesen werden, um Assoziationen zwischen verschiedenen Orten und thermogenen Reizen zu vermeiden. - Befestigen Sie mit Magnetstreifen chirurgische Folien oder Kittel über den Tragegurten, wodurch eine visuelle Barriere zwischen dem Forscher und den Testpersonen entsteht. Stellen Sie diese Barriere ein, um Temperaturänderungen zu minimieren, die sich aus der Mausaktivität ergeben, wenn Sie Experimentatoren beobachten, die sich in Richtung Käfig oder um den Testraum bewegen.
- (Optional) Platzieren Sie Spiegel auf der Oberfläche unter den Tragegurten, um die Sicht auf den Käfigboden während des Tests zu erleichtern.
HINWEIS: Tragegurte können durch ein Käfigwaschsystem desinfiziert werden. Tücher oder chirurgische Blätter sollten vor der Gewöhnung und Prüfung gewaschen werden.
- Weisen Sie jeder Riserkarte im Testraum eine Position zu. Trennen Sie die Steigleitungen, die verschiedene kontextuelle Reize (z. B. Gerüche) aufnehmen, um mindestens 2 m, um verwirrende Variablen zu vermeiden.
- Teeball-Zubereitung
- Bereiten Sie Teebällchen mit Kontroll- und PO-Handtüchern vor (ca. 5 cm x 5 cm). Um Kreuzkontaminationen zu vermeiden, bereiten Sie zuerst Kontrollgeruchs-Teebällchen vor.
HINWEIS: Raubtiergeruchstücher sollten vor Gebrauch auf Krankheitserreger getestet werden. Diese Handtücher sollten ebenfalls enthalten sein, und Materialien, die mit ihnen interagieren, sollten sofort desinfiziert werden (z. B. Käfigwaschung), um die Exposition des Geruchs gegenüber anderen Tieren zu verhindern.
- Bereiten Sie Teebällchen mit Kontroll- und PO-Handtüchern vor (ca. 5 cm x 5 cm). Um Kreuzkontaminationen zu vermeiden, bereiten Sie zuerst Kontrollgeruchs-Teebällchen vor.
6. Temperaturprüfung - Heimkäfig
HINWEIS: Die Tiere müssen sich an das gesamte Testverfahren gewöhnen, mit Ausnahme experimenteller kontextbezogener oder pharmakologischer Reize. Dies sollte mindestens 4x vor dem Testen abgeschlossen werden.
- Bringen Sie die Tiere in den vorbereiteten Testraum. Platzieren Sie die Tiere an einem vorher zugewiesenen Ort auf der Steigleitung. Dieser Ort sollte bei allen Gewöhnungs- und Testverfahren gleich sein.
- Entfernen Sie den "Heimkäfigball" aus dem Mauskäfig und decken Sie die Käfige mit einem Tuch oder einem OP-Blatt ab. Lassen Sie die Mäuse 1-2 h an den Testraum gewöhnen.
- Verwenden Sie nach Abschluss der Akklimatisierung den Scanner, um die Ausgangstemperatur jedes Probanden zu messen und aufzuzeichnen. Vermeiden Sie es, die Stoffbezüge während der Messungen zu manipulieren.
HINWEIS: Pharmakologische Wirkstoffe können hier angewendet werden. Die Wartezeit nach der Injektion oder Anwendung kann nach Bedarf vor dem Testen hinzugefügt werden. Die Aufzeichnung eines sekundären Ausgangswerts direkt vor dem Test wird nach der Zugabe eines pharmakologischen Wirkstoffs empfohlen, um die Reaktion auf pharmakologische Reize zu überwachen. Wenn die Geruchsreaktion nicht getestet wird, können die Temperaturmessungen der Mäuse direkt nach der Injektion beginnen. Bei der Bereitstellung von Stimuli sollte eine Randomisierung angewendet werden. - Decken Sie den Käfig auf und legen Sie den Teeball (Control oder PO) auf den Boden des Heimkäfigs. Ersetzen Sie den Käfigdeckel und die Stoffabdeckung.
- Starten Sie die Stoppuhr. Messen Sie die Temperaturen der Probanden in der gleichen Reihenfolge der Teeballplatzierung. Aufzeichnung von Temperaturen und Uhrzeit von Messungen nach den gewünschten Zeitpunkten.
- Wenn das Experiment abgeschlossen ist, entfernen Sie den Behandlungsball. Platzieren Sie die Mäuse, die PO erhalten haben, in einem neuen Heimkäfig mit dem ursprünglichen "Heimkäfigball". Bringen Sie den "Heimkäfigball" in den Käfig der Mäuse zurück, die Kontrollgeruch erhalten haben. Bringen Sie die Mäuse an den Stallstandort.
HINWEIS: Das obige Verfahren kann auf Rattenmodelle in entsprechend großen Käfigen übertragen werden. Anpassungen der in Abbildung 1C vorgeschlagenen Messungen können erforderlich sein, um einen besseren Zugang zum Boden des Heimkäfigs zu ermöglichen.

Abbildung 1: Prüfung der Transponder- und Hauskäfigtemperatur . (A) Schema der einseitigen Transponderplatzierung zur Messung der Temperatur in einem Maus-Gastrocnemius. Nach der Programmierung und Platzierung kann der Transponder-Reader (DAS-8027-IUS, abgebildet) zur Temperaturmessung verwendet werden. (B) Links Foto eines Teeballs aus Edelstahl mit offenem Netz und eines 5 cm x 5 cm großen Handtuchs. Rechts, geschlossener Teeball, der verwendet wird, um Gewöhnungs- und Geruchstücher in Heimkäfigtests zu halten. (C) Schematische Darstellung von Steigleitungen mit PVC-Rohrleitungen für die Prüfung von Hauskäfigen. (D) Arbeitsablauf des Prüfprotokolls für häusliche Käfige. (E) Anlagenbilder des häuslichen Käfigprüfbereichs. Links vier Mauskäfige auf einem Riser. Magnetstreifen befinden sich an der angrenzenden Wand und Magnete und OP-Tücher sind auf dem Tisch. Rechts, abgedeckte Mauskäfige auf Tragegurten. (A), (C) und (D) wurden mit Biorender.com erstellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
7. Temperaturprüfung - Laufband Gehen
- Weisen Sie jedem Tier ein Laufband als zugewiesenen Standort für Gewöhnungs- und Testverfahren zu.
- Bereiten Sie die Laufbänder für die Tests vor und stellen Sie sicher, dass die Schocker funktionsfähig sind.
HINWEIS: Für das Gehen auf dem Laufband sollten Laufbänder auf das niedrigste verfügbare Tempo eingestellt werden, das eine kontinuierliche Bewegung fördert, aber nicht sowohl zur Gewöhnung als auch zum Testen läuft. Für das 1012M-2 Modular Enclosed Metabolic Laufband sind dies 5,2 m/min für Mäuse und 7 m/min für Ratten. Dieses Tempo muss möglicherweise basierend auf der Fettleibigkeit des Subjekts angepasst werden. Schocker sollten auf eine Intensität und Wiederholungsrate von 5,0 eingestellt werden. - Gewöhnung
- Bringen Sie die Mäuse in den Testraum. Lassen Sie Mäuse 1-2 h sich an den Raumtransfer in ihren Heimkäfigen gewöhnen.
- Führen Sie die Mäuse nach der Akklimatisierung zur Öffnung ihres zugewiesenen Laufbandes und schließen Sie das Laufband. Starten Sie den Riemen, den Schocker und die Stoppuhr.
- Lassen Sie die Mäuse 15 Minuten lang auf den Laufbändern laufen und verwenden Sie den Schockreiz als Motivation für die Bewegung. Beenden Sie den Test sofort, wenn ein Tier über einen längeren Zeitraum auf einem aktiven Schocker verbleibt.
- Entfernen Sie nach dem Test die Mäuse und bringen Sie sie in die heimischen Käfige zurück.
- Reinigen Sie die Laufbänder mit flüssigem Reinigungsmittel und Wasser.
- Testen
- Bringen Sie die Mäuse in den Testraum. Lassen Sie die Mäuse 1-2 h an den Raumtransfer in ihren Heimkäfigen gewöhnen.
- Messen und notieren Sie die Ausgangstemperatur, bevor Sie die Maus zum Laufband bewegen.
HINWEIS: Für Tests, die pharmakologische Wirkstoffe enthalten, wenden Sie diese hier gemäß dem in Abbildung 2A gezeigten Schema an oder injizieren Sie sie. Die Wartezeit nach der Injektion kann bei Bedarf hinzugefügt werden, bevor die Mäuse auf das Laufband gelegt werden. Bei der Bereitstellung von Stimuli sollte eine Randomisierung angewendet werden. - Legen Sie 5 cm x 5 cm große Quadrate von Kontroll- oder PO-Handtüchern in das Laufband, das der Vorderseite des Laufbandes am nächsten ist. Kleben Sie die Handtücher an der Decke des Laufbandes oder darunter, um sie leicht zu platzieren und zu entfernen.
- Führen Sie die Mäuse in das zugewiesene Laufband. Schalten Sie den Laufbandgurt und den Schocker ein.
- Starten Sie die Stoppuhr. Messen Sie die Probanden in der gleichen Reihenfolge, in der die Mäuse in den Laufbändern aufgestellt wurden. Notieren Sie die Temperaturen und die Uhrzeit der Messungen nach den gewünschten Zeitpunkten.
HINWEIS: Die Temperatur kann zuverlässig von außerhalb des Laufbandes gemessen werden, während sich eine Maus während der Gehaktivität in einem geschlossenen Laufband befindet. Bei Ratten kann es erforderlich sein, dass ein Experimentator aufgrund der Größe des Laufbandes und des Transponder-Leser-Abstands die Rückseite des Laufbandes offen hält, um das Lesegerät näher am Motiv in das Laufband einzuführen. - Wenn der Test abgeschlossen ist, schalten Sie die Schocker und Laufbänder aus. Bringen Sie die Mäuse in ihre heimischen Käfige zurück. Bringen Sie die Mäuse an den Stallstandort.
- Reinigen Sie die Laufbänder mit Flüssigwaschmittel und Wasser und achten Sie besonders darauf, eventuelle PO-Reste zu entfernen.
- Wenn die Experimente abgeschlossen sind, euthanasieren Sie die Tiere (z. B. durch CO2 -Inhalation) und bestätigen Sie visuell den Transponderstandort.
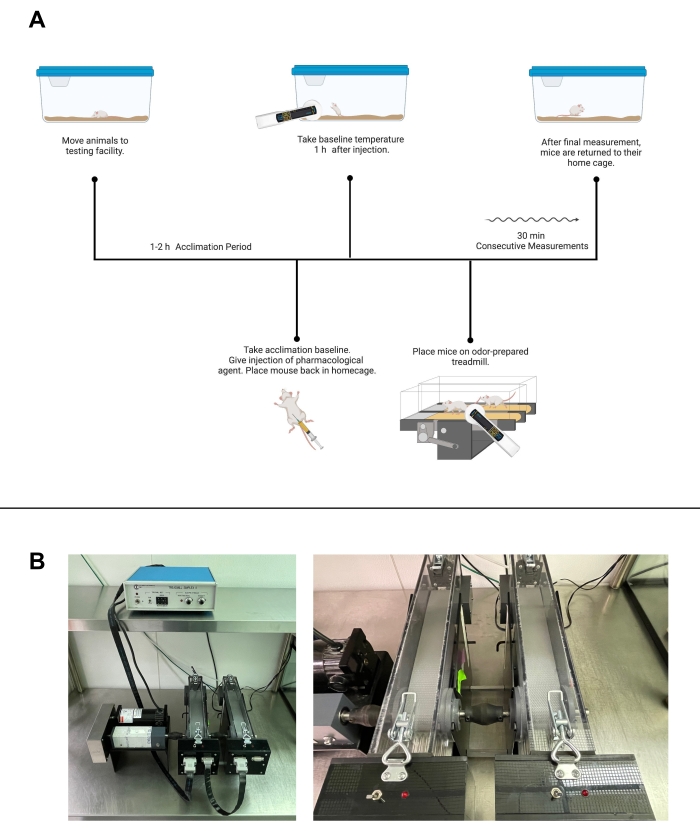
Abbildung 2: Aktivitätsgesteuerte Temperaturprüfung. (A) Arbeitsablauf der aktivitätskontrollierten Temperaturprüfung mit einem pharmakologischen Wirkstoff unter Verwendung von Laufbandgehen. (B) Einrichtungsbilder von Laufbändern. Links, ein Bild des kompletten Geräte-Setups. Rechts, ein genaueres Bild einzelner Laufbänder und Schocker. (A) wurde mit Biorender.com erstellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
Transponder wurden einseitig in den rechten Gastrocnemius von zehn 4-6 Monate alten Wildtyp-Mäusen (WT) implantiert, die aus dem SF1-Cre-Stamm gezüchtet wurden (Tg(Nr5a1-cre)7Lowl/J, Stamm #012462, C57BL/6J und FVB-Hintergrund; weiblich N = 5; männlich N = 5). Nach der Genesung wurden die Mäuse an ein Temperaturtestverfahren für den heimischen Käfig gewöhnt, das keinen kontextuellen Reiz (z. B. PO) beinhaltete. Temperaturmessungen mit einem Transponderstab wurden in ihrem Wohnraum und nach der Übergabe an den Pr?...
Diskussion
Dieses Temperaturtestprotokoll bietet dem Feld eine Möglichkeit, die Thermogenese der Skelettmuskulatur direkt zu messen. Dies ist von entscheidender Bedeutung, da sich die Forschung mit der Identifizierung der Mechanismen befasst, die der Muskelthermogenese zugrunde liegen33. Die Methode bietet zwei kostengünstige Protokolle zur Messung der Thermogenese der Skelettmuskulatur unter kontextuellen und pharmakologischen Bedingungen. Dieses Protokoll betont die Bedeutung sowohl der Gewöhnung als au...
Offenlegungen
Die Autoren erklären, dass sie keine Interessenkonflikte haben.
Danksagungen
Diese Arbeit wird von R15 DK097644 und R15 DK108668 unterstützt. Wir danken Dr. Chaitanya K Gavini und Dr. Megan Rich für frühere Beiträge und Dr. Stanley Dannemiller für die Sicherstellung der Einhaltung der institutionellen Tierverwendungsrichtlinien. Ein besonderer Dank geht an Dr. Tim Bartness für die Bereitstellung der Grundlagenforschung, die notwendig ist, um diese Methode und die damit verbundenen Studien zu entwickeln. Die Abbildungen 1A, C, D und Abbildung 2A wurden mit Biorender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1012M-2 Modular Enclosed Metabolic Treadmill for Mice, 2 Lanes w/ Shock | Columbus Instruments | ||
| 1012R-2 Modular Enclosed Metabolic Treadmill for Rats, 2 Lanes w/ Shock | Columbus Instruments | ||
| 1-1/4 in. Ratcheting PVC Cutter | BrassCraft | ||
| 1 mL Syringes | Fisher Scientific | BD 309659 | |
| Betadine Swabs | Fisher Scientific | 19-898-945 | |
| Booster Coil | BioMedic Data Systems | Transponder Accessory | |
| Electric Clippers | Andis | 40 Ultraedge Clipper Blade | |
| Flexible Mirror Sheets | Amazon | Self Adhesive Non Glass Mirror Tiles | |
| Forceps | Fisher Scientific | 89259-940 | |
| Heating Pad | |||
| Induction Chamber (isoflurane) | Kent Scientific | VetFlo-0730 | 3.0 L Low Cost Chambers for Traditional Vaporizers |
| Ketoprophen | Med-Vet Intl. | RXKETO-50 | |
| Magnetic Strips | Amazon | ||
| Magnets | Amazon | DIYMAG Magnetic Hooks 40lbs | |
| Needles | Med-Vet Intl. | 26400 | |
| Neomycin/Polymixin/Bacitracin with Hydrocortisone Ophthalmic Ointment, 3.5 g | Med-Vet Intl. | RXNPB-HC | |
| Oasis Absorbable Suture | Med-Vet Intl. | MV-H821-V | |
| Predator (Ferret) Odor Towels | Marshall BioResources | ||
| PVC pipe | |||
| Reflex Wound Clip Remover | CellPoint Scientific | ||
| Reflex Wound Clip, 7 mm (mouse) | CellPoint Scientific | ||
| Reflex Wound Clip, 9 mm (rat) | CellPoint Scientific | ||
| Srerile Autoclip, 7 mm (mouse) | CellPoint Scientific | Wound Clip Applier (mouse) | |
| Stainless Strainers Interval Seasonings Tea Infuser | Amazon | ||
| Sterile Autoclip, 9 mm (rat) | CellPoint Scientific | Wound Clip Applier (rat) | |
| Sterile Saline | Med-Vet Intl. | RX0.9NACL-10 | |
| Surgical Scissors | Fisher Scientific | 08-951-5 | |
| Surgical Sheets | |||
| Towels (Control/Habituation) | Amazon | 100% Cotton Towels, white | |
| Transponders | BioMedic Data Systems | Model: IPTT-300 | |
| Transponders Reader | BioMedic Data Systems | Model: DAS-8027-IUS/ DAS-7007R | |
| Versaclean | Fisher Scientific | 18-200-700 | liquid detergent |
| Webcol Alcohol Preps | Covidien | 22-246-073 | |
| Wedge pieces for PVC pipe |
Referenzen
- Periasamy, M., Herrera, J. L., Reis, F. C. G. Skeletal muscle thermogenesis and its role in whole body energy metabolism. Diabetes Metabolism Journal. 41 (5), 327-336 (2017).
- Rowland, L. A., Bal, N. C., Periasamy, M. The role of skeletal-muscle-based thermogenic mechanisms in vertebrate endothermy. Biological Reviews of the Cambridge Philosophical Society. 90 (4), 1279-1297 (2015).
- Maurya, S. K., et al. Sarcolipin is a key determinant of the basal metabolic rate, and its overexpression enhances energy expenditure and resistance against diet-induced obesity. Journal of Biological Chemistry. 290 (17), 10840-10849 (2015).
- Grigg, G., et al. Whole-body endothermy: Ancient, homologous and widespread among the ancestors of mammals, birds and crocodylians. Biological Reviews of the Cambridge Philosophical Society. 97 (2), 766-801 (2022).
- Franck, J. P. C., Slight-Simcoe, E., Wegner, N. C. Endothermy in the smalleye opah (Lampris incognitus): A potential role for the uncoupling protein sarcolipin. Comparative Biochemistry and Physiology - Part A: Molecular & Integrative Physiology. 233, 48-52 (2019).
- Nowack, J., et al. Muscle nonshivering thermogenesis in a feral mammal. Scientific Reports. 9, 6378 (2019).
- Oliver, S. R., Anderson, K. J., Hunstiger, M. M., Andrews, M. T. Turning down the heat: Down-regulation of sarcolipin in a hibernating mammal. Neuroscience Letters. 696, 13-19 (2019).
- Gorrell, E., et al. Skeletal muscle thermogenesis induction by exposure to predator odor. The Journal of Experimental Biology. 223, (2020).
- Gavini, C. K., et al. Leanness and heightened nonresting energy expenditure: Role of skeletal muscle activity thermogenesis. The American Journal of Physiology - Endocrinology and Metabolism. 306 (6), 635-647 (2014).
- Almundarij, T. I., Gavini, C. K., Novak, C. M. Suppressed sympathetic outflow to skeletal muscle, muscle thermogenesis, and activity energy expenditure with calorie restriction. Physiological Reports. 5 (4), 13171 (2017).
- Harshaw, C., Lanzkowsky, J., Tran, A. D., Bradley, A. R., Jaime, M. Oxytocin and 'social hyperthermia': Interaction with beta3-adrenergic receptor-mediated thermogenesis and significance for the expression of social behavior in male and female mice. Hormones and Behavior. 131, 104981 (2021).
- Caldwell, H. K. Oxytocin and vasopressin: Powerful regulators of social behavior. The Neuroscientist. 23 (5), 517-528 (2017).
- Harshaw, C., Leffel, J. K., Alberts, J. R. Oxytocin and the warm outer glow: Thermoregulatory deficits cause huddling abnormalities in oxytocin-deficient mouse pups. Hormones and Behavior. 98, 145-158 (2018).
- Gavini, C. K., Britton, S. L., Koch, L. G., Novak, C. M. Inherently lean rats have enhanced activity and skeletal muscle response to central melanocortin receptors. Obesity. 26 (5), 885-894 (2018).
- Gavini, C. K., Jones, W. C., Novak, C. M. Ventromedial hypothalamic melanocortin receptor activation: regulation of activity energy expenditure and skeletal muscle thermogenesis. The Journal of Physiology. 594 (18), 5285-5301 (2016).
- Zaretsky, D. V., Romanovsky, A. A., Zaretskaia, M. V., Molkov, Y. I. Tissue oxidative metabolism can increase the difference between local temperature and arterial blood temperature by up to 1.3(o)C: Implications for brain, brown adipose tissue, and muscle physiology. Temperature. 5 (1), 22-35 (2018).
- Yoo, Y., et al. Exercise activates compensatory thermoregulatory reaction in rats: A modeling study. Journal of Applied Physiology. 119 (12), 1400-1410 (2015).
- Langer, F., Fietz, J. Ways to measure body temperature in the field. Journal of Thermal Biology. 42, 46-51 (2014).
- Pence, S., et al. Central apolipoprotein A-IV stimulates thermogenesis in brown adipose tissue. International Journal of Molecular Sciences. 22 (3), 1221 (2021).
- Li, D., et al. Homeostatic disturbance of thermoregulatory functions in rats with chronic fatigue. Journal of Neuroscience Research. 165, 45-50 (2021).
- Carlier, J., et al. Pharmacodynamic effects, pharmacokinetics, and metabolism of the synthetic cannabinoid AM-2201 in male rats. Journal of Pharmacology and Experimental Therapeutics. 367 (3), 543-550 (2018).
- Pato, A. M., Romero, D. M., Sosa Holt, C. S., Nemirovsky, S. I., Wolansky, M. J. Use of subcutaneous transponders to monitor body temperature in laboratory rats. Journal of Pharmacological and Toxicological Methods. 114, 107145 (2022).
- Almeida, D. L., et al. Lean in one way, in obesity another: Effects of moderate exercise in brown adipose tissue of early overfed male Wistar rats. International Journal of Obesity. 46 (1), 137-143 (2022).
- Brito, M. N., Brito, N. A., Baro, D. J., Song, C. K., Bartness, T. J. Differential activation of the sympathetic innervation of adipose tissues by melanocortin receptor stimulation. Endocrinology. 148 (11), 5339-5347 (2007).
- Vaughan, C. H., Shrestha, Y. B., Bartness, T. J. Characterization of a novel melanocortin receptor-containing node in the SNS outflow circuitry to brown adipose tissue involved in thermogenesis. Brain Research. 1411, 17-27 (2011).
- Kort, W. J., Hekking-Weijma, J. M., TenKate, M. T., Sorm, V., VanStrik, R. A microchip implant system as a method to determine body temperature of terminally ill rats and mice. Laboratory Animals. 32 (3), 260-269 (1998).
- Mei, J., et al. Body temperature measurement in mice during acute illness: Implantable temperature transponder versus surface infrared thermometry. Scientific Reports. 8, 3526 (2018).
- Warn, P. A., et al. Infrared body temperature measurement of mice as an early predictor of death in experimental fungal infections. Laboratory Animals. 37 (2), 126-131 (2003).
- Hargreaves, K., Dubner, R., Brown, F., Flores, C., Joris, J. A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia. Pain. 32 (1), 77-88 (1988).
- Fiebig, K., Jourdan, T., Kock, M. H., Merle, R., Thone-Reineke, C. Evaluation of infrared thermography for temperature measurement in adult male NMRI nude mice. Journal of the American Association for Laboratory Animal Science. 57 (6), 715-724 (2018).
- Franco, N. H., Geros, A., Oliveira, L., Olsson, I. A. S., Aguiar, P. ThermoLabAnimal - A high-throughput analysis software for non-invasive thermal assessment of laboratory mice. Physiology & Behavior. 207, 113-121 (2019).
- Koganti, S. R., et al. Disruption of KATP channel expression in skeletal muscle by targeted oligonucleotide delivery promotes activity-linked thermogenesis. Molecular Therapy. 23 (4), 707-716 (2015).
- Bal, N. C., Periasamy, M. Uncoupling of sarcoendoplasmic reticulum calcium ATPase pump activity by sarcolipin as the basis for muscle non-shivering thermogenesis. Philosophical Transactions of the Royal Society B. 375 (1793), 20190135 (2020).
- Hicks, C., et al. Body temperature and cardiac changes induced by peripherally administered oxytocin, vasopressin and the non-peptide oxytocin receptor agonist WAY 267,464: a biotelemetry study in rats. British Journal of Pharmacology. 171 (11), 2868-2887 (2014).
- Kasahara, Y., et al. Oxytocin receptor in the hypothalamus is sufficient to rescue normal thermoregulatory function in male oxytocin receptor knockout mice. Endocrinology. 154 (11), 4305-4315 (2013).
- Kasahara, Y., et al. Role of the oxytocin receptor expressed in the rostral medullary raphe in thermoregulation during cold conditions. Frontiers in Endocrinology. 6, 180 (2015).
- Yuan, J., Zhang, R., Wu, R., Gu, Y., Lu, Y. The effects of oxytocin to rectify metabolic dysfunction in obese mice are associated with increased thermogenesis. Molecular and Cellular Endocrinology. 514, 110903 (2020).
- Scholl, J. L., Afzal, A., Fox, L. C., Watt, M. J., Forster, G. L. Sex differences in anxiety-like behaviors in rats. Physiology & Behavior. 211, 112670 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten