Method Article
Multiparametrisches Tumor-Organoid-Wirkstoff-Screening mit Weitfeld-Live-Cell-Imaging für die Bulk- und Einzelorganoid-Analyse
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine halbautomatische Methode für Organoid-Wirkstoff-Screenings mit mittlerem bis hohem Durchsatz und mikroskopunabhängige, automatisierte Bildanalysesoftware zur Quantifizierung und Visualisierung multiparametrischer, einzelorganoider Arzneimittelreaktionen zur Erfassung der intratumoralen Heterogenität.
Zusammenfassung
Patienten-abgeleitete Tumor-Organoide (PDTOs) sind vielversprechend für die präklinische und translationale Forschung und die Vorhersage des Therapieansprechens von Patienten aus Ex-vivo-Medikamentenscreenings . Aktuelle Adenosintriphosphat (ATP)-basierte Wirkstoff-Screening-Assays erfassen jedoch nicht die Komplexität einer Arzneimittelreaktion (zytostatisch oder zytotoxisch) und die intratumorale Heterogenität, die nachweislich in PDTOs aufgrund einer Massenauslesung erhalten bleibt. Live-Cell-Imaging ist ein leistungsfähiges Werkzeug, um dieses Problem zu überwinden und Arzneimittelreaktionen detaillierter zu visualisieren. Bildanalysesoftware ist jedoch oft nicht an die Dreidimensionalität von PDTOs angepasst, erfordert fluoreszierende Viabilitätsfarbstoffe oder ist nicht mit einem 384-Well-Mikrotiterplattenformat kompatibel. Dieser Artikel beschreibt eine halbautomatische Methodik zum Aussäen, Behandeln und Abbilden von PDTOs in einem Hochdurchsatz-Format mit 384 Vertiefungen unter Verwendung herkömmlicher Breitfeld-Live-Cell-Bildgebungssysteme. Darüber hinaus haben wir eine Bildanalysesoftware ohne Lebensfähigkeitsmarker entwickelt, um wachstumsratenbasierte Metriken für das Ansprechen auf Medikamente zu quantifizieren, die die Reproduzierbarkeit verbessern und Wachstumsratenschwankungen zwischen verschiedenen PDTO-Linien korrigieren. Unter Verwendung der normalisierten Medikamentenreaktionsmetrik, die das Arzneimittelansprechen basierend auf der Wachstumsrate bewertet, die auf einen positiven und negativen Kontrollzustand normalisiert wurde, und einem fluoreszierenden Zelltodfarbstoff können zytotoxische und zytostatische Arzneimittelreaktionen leicht unterschieden werden, was die Klassifizierung von Respondern und Non-Respondern erheblich verbessert. Darüber hinaus kann die Heterogenität der Arzneimittelreaktion anhand der Analyse der Arzneimittelantwort auf einzelne Organoide quantifiziert werden, um potenzielle, resistente Klone zu identifizieren. Letztendlich zielt diese Methode darauf ab, die Vorhersage des klinischen Therapieansprechens zu verbessern, indem eine multiparametrische Signatur des Arzneimittelansprechens erfasst wird, die den kinetischen Wachstumsstillstand und die Quantifizierung des Zelltods umfasst.
Einleitung
In den letzten Jahren haben sich die In-vitro-Entdeckung von Krebsmedikamenten, das Screening von Medikamenten und die Grundlagenforschung von der Verwendung traditioneller zweidimensionaler (2D) Krebsmodelle mit immortalisierten Zelllinien zu physiologisch relevanteren dreidimensionalen (3D) Krebsmodellen entwickelt. Dies hat die Einführung von Tumor-Sphäroiden mit etablierten Krebszelllinien vorangetrieben, die komplexere Zell-zu-Zell-Interaktionen und Strukturen in soliden Tumoren nachbilden. Derzeit sind patientenabgeleitete Tumor-Organoide (PDTOs) das fortschrittlichste und physiologisch relevanteste 3D-Krebsmodell, das für die In-vitro-Krebsforschung zur Verfügung steht, da sie zusätzliche Vorteile gegenüber Tumor-Sphäroiden bieten, nämlich die Heterogenität bei Krebspatienten1. PDTOs werden aus Tumorgewebe von Krebspatienten etabliert und behalten daher sowohl den Tumorphänotyp als auch den Genotyp bei. Daher werden PDTOs für die Grundlagen- und translationale Krebsforschung von unschätzbarem Wert und haben das Potenzial, die Präzisionsonkologie erheblich zu verbessern2.
Trotz ihres vielversprechenden Potenzials werden diese ausgefeilten 3D-In-vitro-Krebsmodelle aufgrund fehlender fortschrittlicher Analysemethoden oft nicht ausreichend genutzt. Der am häufigsten verwendete Assay bestimmt die Anzahl der lebensfähigen Zellen in der PDTO über die Quantifizierung von intrazellulärem ATP3. Bei diesen Assays handelt es sich in der Regel um Einzelzeitpunkt-Massenanalysen, wodurch kritische zeitabhängige Reaktionen übersehen und klonale Reaktionen vernachlässigt werden. Insbesondere die Fähigkeit, das Wachstum von PDTOs (Wachstumsrate) und ihr Ansprechen auf bestimmte Therapien zu überwachen, ist von großem Interesse 4,5. Die normalisierte Arzneimittelreaktion (NDR), die die Arzneimittelreaktion auf der Grundlage der Wachstumsrate bewertet, die auf einen positiven (Strg +) und negativen Kontrollzustand (Strg-) normalisiert wurde, wurde kürzlich auch als eine entscheidende Metrik für die Bewertung der Empfindlichkeit von Krebsmedikamenten mit zellbasiertem Screening beschrieben, obwohl dies hauptsächlich für 2D-Zelllinien6 durchgeführt wurde. Daher sind ausgefeiltere Analysemethoden erforderlich, um diese klinisch repräsentativeren und komplexeren 3D-Krebsmodelle voll auszuschöpfen. Die Mikroskopie gilt als leistungsfähiger Ansatz, um die Komplexität dieser Organoidmodelle zu untersuchen7.
Dieser Artikel beschreibt eine Methode zur Überwachung kinetischer Arzneimittelreaktionen in 3D-Krebsmodellen unter Verwendung herkömmlicher Weitfeldmikroskope und Live-Cell-Imaging-Systeme. Das von Driehuis et al.4 beschriebene Protokoll wurde so angepasst, dass es mit der Automatisierung unter Verwendung eines Pipettierroboters, eines digitalen Medikamentenspenders und eines Live-Cell-Imaging-Systems kompatibel ist, um die Reproduzierbarkeit zu erhöhen und die Anzahl der "praktischen" Arbeitsstunden zu reduzieren. Diese Methode ermöglicht ein Mittel- bis Hochdurchsatz-Wirkstoff-Screening sowohl von Tumor-Sphäroiden mit etablierten Krebszelllinien (siehe Ergänzungstabelle S1 für getestete Zelllinien) als auch der PDTOs in einem 384-Well-Mikrotiterplatten- und Multi-Organoid-Format. Durch die Verwendung eines Convolutional Network Machine Learning-Verfahrens konnte die automatisierte Identifizierung und Verfolgung einzelner Tumor-Sphäroide oder PDTOs ausschließlich durch Hellfeld-Bildgebung und ohne die Verwendung von fluoreszierenden Lebendzell-Markierungsfarbstoffen durchgeführt werden8. Dies ist sehr vorteilhaft, da die meisten Identifikationen mit Hellfeld-Bildgebung eine manuelle Annotation erfordern (was mühsam und zeitaufwendig ist) oder die Zugabe von Fluoreszenzfarbstoffen erfordert, die Arzneimittelreaktionen im Zusammenhang mit Photoxizität-induziertem oxidativem Stress verwirren können9.
Die daraus resultierende eigens entwickelte Bildanalysesoftware erweitert die Funktionalität herkömmlicher Live-Cell-Imaging-Systeme, da 3D-Bildanalysemodule entweder nicht verfügbar, plattformbeschränkt oder nicht kompatibel mit 384-Well-Mikrotiterplatten und Whole-Well-Imaging sind. Darüber hinaus sind diese Module oft sehr preisgünstig und bieten begrenzte Organoid-Auslesungen. Daher ist diese Methode von großer Relevanz für Wissenschaftler, die Zugang zu weit verbreiteten Live-Cell-Imaging-Systemen haben und darauf abzielen, mehr Informationen über eine Arzneimittelreaktion im Vergleich zum Goldstandard, aber rudimentärem ATP-basierten Assay zu extrahieren. Durch die Hinzufügung spezifischer Zelltodindikatoren können zytostatische Arzneimittelreaktionen von zytotoxischen Reaktionen unterschieden werden, wodurch weitere Einblicke in mechanistische Arzneimittelwirkungen gewährt werden, die derzeit durch eine Einzelzeitpunktanalyse nicht erreicht werden können. Schließlich ermöglicht die Live-Cell-Bildgebung das Tracking einzelner Organoide, um Metriken für das Ansprechen einzelner Organoide zu erhalten, um die Heterogenität der Reaktion zu erfassen und potenziell resistente Subklone zu identifizieren.
Das Ziel dieser Methode und der zugehörigen Bildanalysesoftware ist es, eine kostengünstige Automatisierung im Organoid-Wirkstoff-Screening zu implementieren, um Benutzereingriffe zu begrenzen und die Variabilität in der Handhabung, Bildanalyse und Datenanalyse zu reduzieren. Um diese Software den Forschern zur Verfügung zu stellen, ist sie mikroskop- und plattformunabhängig und wird eine Cloud-basierte Anwendung zur Verfügung gestellt. Durch die Unterstützung herkömmlicher Live-Cell-Imaging-Systeme wollen wir daher auch deren Funktionalität für 3D-Kultivierungsanwendungen und -analysen verbessern.
Protokoll
Es wurden humane duktale Adenokarzinome (PDAC) verwendet, die von Patienten abgeleitet wurden. Geweberesektionsfragmente wurden von Patienten gewonnen, die sich einer kurativen Operation am Universitätsklinikum Antwerpen unterzogen. Von allen Patienten wurde eine schriftliche Einverständniserklärung eingeholt, und die Studie wurde von der UZA-Ethikkommission genehmigt (Ref. 14/47/480). Details zu allen Materialien, Reagenzien, Geräten und Software, die in diesem Protokoll verwendet werden, finden Sie in der Materialtabelle. Eine Übersicht über den Workflow ist in Abbildung 1 dargestellt. Beispieldaten finden Sie im ergänzenden Material zur Reproduktion des Protokolls.
1. Tag 0: Herstellung von 2- oder 3 Tage alten Organoiden
- Die Microplatten über Nacht bei 37 °C vorheizen und die extrazelluläre Matrix (EZM) bei 4 °C auftauen.
- Bereiten Sie ein vollständiges PDAC-Organoid-Kulturmedium vor: Ergänzung ADF+++ (Advanced DMEM/F12, 1% Glutamin-Supplement, 1% HEPES und 1% Penicillin/Streptomycin) mit 0,5 nM WNT-Surrogat-Fc-Fusionsprotein, 4% Noggin-Fc-Fusionsprotein-konditioniertes Medium, 4% Rpso3-Fc-Fusionsprotein-konditioniertes Medium, 1x B27, 1 mM N-Acetylcystein (NAC), 5 mM Nicotinamid, 500 nM A83-01, 100 ng/ml FGF10 und 10 nM Gastrin).
- Legen Sie die PDTOs nach der Methode Ihrer Wahl fest.
HINWEIS: Ein detailliertes Protokoll wird von Driehuis et al. zur Verfügung gestellt, das die konventionelle Methode zur Etablierung, Kultivierung und Passage von PDTOs in ECM-Kuppeln4 beschreibt. - Enzymatisch dissoziieren die Organoide in ECM-Kuppeln.
- Das Medium absaugen und 1x mit phosphatgepufferter Kochsalzlösung (PBS) waschen. Fügen Sie ein Dissoziationsenzym hinzu (z. B. 2 ml in einer 6-Well-Mikroplatte) und pipettieren Sie 10x mit einer 1-ml-Pipette auf und ab, um die Organoide und ECM-Domen mechanisch zu dissoziieren.
- 10 min bei 37 °C inkubieren, auf- und runterpipettieren und prüfen, ob die Organoide zu einzelnen Zellen dissoziiert sind. Wiederholen Sie diesen Schritt bei Bedarf.
- Die Zellsuspension wird in ein 15-ml-Röhrchen gegeben, ADF+++ in ein Volumen von 10 ml gegeben, 5 min bei 450 × g bei Raumtemperatur zentrifugiert und der Überstand mit einer Pasteur-Pipette und einer Absaugpumpe abgesaugt.
- Resuspendieren Sie das Pellet in 100-200 μL vollem Medium, abhängig von der Größe des Pellets, und zählen Sie die Anzahl der Zellen mit der Methode Ihrer Wahl. Zum Beispiel: Mischen Sie 10 μL der Zellsuspension + 10 μL Trypanblau und zählen Sie mit einem automatisierten Zellzähler.
- Platteneinzelzellen in ECM-Kuppeln.
- Die Zellsuspension wird verdünnt und 2/3 ECM gemäß Tabelle 1 zugegeben. Pipettieren Sie bis zu zehn 20-μL-Tröpfchen pro Vertiefung in einer vorgewärmten 6-Well-Platte. Die Platte umdrehen und 30 min bei 37 °C inkubieren.
- Überlagern Sie mit vollem Medium, ergänzt mit 10 μM Y-27632, und inkubieren Sie für 2-3 Tage in einem Inkubator.
HINWEIS: Zehn Kuppeln mit jeweils 75.000 Zellen reichen in der Regel aus, um eine Mikrotiterplatte mit 384 Vertiefungen bei einer Konzentration von 200 Organoiden pro Vertiefung zu füllen, ohne die Vertiefungen am Rand.
2. Tag 2 - 3: 2- oder 3 Tage alte Organoide ernten und aussäen
- Sammeln Sie intakte Organoide aus den ECM-Kuppeln.
HINWEIS: Organoide neigen dazu, an Kunststoffoberflächen (z. B. Schläuche, Pipettenspitzen) zu haften. Um dies zu vermeiden, können Kunststoffgeschirr mit einer 0,1%igen Rinderserumalbumin (BSA)/PBS-Lösung vorgespült werden.- Das Medium absaugen und 1x mit PBS waschen. Geben Sie 1-2 ml kalte (4 °C) Organoid-Erntelösung in eine 6-Well-Platte, abhängig von der Anzahl der ECM-Kuppeln, und inkubieren Sie auf Eis auf einer Schüttelplattform für 10 Minuten.
- Pipettieren Sie mit einer 1-ml-Pipette auf und ab, um die ECM-Doms zu dissoziieren, inkubieren Sie für weitere 10 Minuten auf Eis und überprüfen Sie visuell unter einem Mikroskop, ob die ECM dissoziiert ist.
- Optional: Wenn eine gleichmäßigere Größenverteilung bevorzugt wird, wird die Suspension vor dem Zentrifugieren durch ein 70-μm-Zellsieb filtriert.
- Die Organoide werden in einem mit 0,1 % BSA/PBS vorbeschichteten 15-ml-Röhrchen gesammelt, ADF+++ bis zu 10 ml zugegeben und 5 min bei 200 × g bei 4 °C zentrifugiert. Saugen Sie den Überstand ab und resuspendieren Sie das Pellet in Abhängigkeit von der Größe des Pellets in bis zu 1.000 μL vollem PDAC-Organoidmedium, um eine Konzentration von >6.000 Organoiden/ml zu erhalten.
- Zählen Sie die Organoide mit einer beliebigen Zählmethode, vorzugsweise einer bildbasierten.
3. Tag 4: Medikamentenbehandlung und Reagenzienabgabe mit digitalem Medikamentenspender
- Erstellen Sie das Abgabeprotokoll für Medikamente mithilfe der Steuerungssoftware für digitale Medikamentenspender.
- Bewegen Sie den Mauszeiger über Platte 1 über dem Plattenlayout, wählen Sie Plattenattribute bearbeiten aus und füllen Sie Plattentyp: 384 Well, zusätzliches Volumen (μL): 50 und DMSO-Grenzwert (%): 1 aus.
- Fügen Sie Flüssigkeiten hinzu, indem Sie auf die Schaltfläche + neben Flüssigkeiten klicken. Doppelklicken Sie auf das neu erstellte Fluid und benennen Sie es. Wählen Sie Klasse (DMSO-basiert oder wässrig + Tween 20) und Konzentration.
HINWEIS: Alle Arzneimittel und Reagenzien müssen in 100% DMSO oder 0,3% Tween-20 gelöst sein. Unter Berücksichtigung einer maximalen DMSO-Konzentration von <1% kann eine Stammlösung von 1-10 mM verwendet werden. Tabelle 2 enthält Beispiele für die erforderlichen Verdünnungen für gängige Fluoreszenzreagenzien und Therapien. - Platten-Layout
- Wählen Sie für die Medikamententitration Wells aus und klicken Sie auf Titration. Wählen Sie für Flüssigkeit das interessierende Medikament aus, wählen Sie die höchste Konzentration (z. B. 2.000 nM) und die niedrigste Konzentration (z. B. 10 nM). Wählen Sie für Replikate mindestens 2 und wählen Sie das gewünschte Titrationsmuster aus.
ANMERKUNG: Das Titrationsmuster hängt von vielen Faktoren ab, einschließlich der Frage, wie viel Verbindung in eine einzelne Platte passen soll, ob die Vertiefungen randomisiert werden sollen und wie viele Wiederholungen und Kontrollen durchgeführt werden sollen. - Wählen Sie für die Positivkontrolle drei Vertiefungen aus, klicken Sie auf Wert einstellen und füllen Sie 2 μM Staurosporin aus 10 mM Bestand in DMSO ein, was den maximalen Zelltod induziert.
- Wählen Sie für Cytotox Green alle verwendeten Vertiefungen aus, klicken Sie auf Wert einstellen und geben Sie 60 nM/well ein.
HINWEIS: Die Cytotox Green-Fluoreszenzfärbung zeigt Zellen an, die abgestorben sind, und beeinträchtigt daher nicht die Überwachung des Arzneimittelansprechens. Hier wird kein Fluoreszenzmarker für lebende Zellen benötigt. - Wählen Sie für die Negativkontrolle und die DMSO-Normalisierung alle Vertiefungen mit zusätzlichen vier Vertiefungen für die Fahrzeugsteuerung aus, klicken Sie mit der rechten Maustaste, wählen Sie Normalisierung, wählen Sie Flüssigkeitsklasse normalisieren: DMSO-basiert und normalisieren Sie auf das Volumen der höchsten Klasse, um eine gleiche DMSO-Konzentration in jedem Bohrloch zu erhalten.
HINWEIS: DMSO-Konzentrationen sollten <1% betragen. Ein Beispiel für eine TDD-Arzneimitteltitrationsdatei (Ergänzungsdatei 8) wird bereitgestellt. - Klicken Sie auf den Pfeil unter Ausführen in der oberen linken Ecke, wählen Sie Immer simulieren und klicken Sie auf Simulieren , um Fehler zu identifizieren und die Volumina jedes Medikaments zu erhalten, das zubereitet werden soll.
HINWEIS: Um eine Warnung zu umgehen, wenn das anfängliche Dosiervolumen zu niedrig ist, "Dosierwarnbrunnen von 30 nL oder mehr wird für jede Flüssigkeit auf jeder Platte empfohlen", wählen Sie zwei Vertiefungen am Rand aus, die mit Wasser gefüllt sind, wählen Sie Wert einstellen und geben Sie 10 μM des Arzneimittels ein, für das die Warnung auftritt. Dadurch wird die Medikamentenkartusche mit einem Volumen von mehr als 30 nL vorbereitet. Dieselben Vertiefungen können verwendet werden, um die DMSO-Kartusche zu grundieren, indem eine Normalisierung auf % des Gesamtvolumenwerts (z. B. 0,5%) eingestellt wird.
- Wählen Sie für die Medikamententitration Wells aus und klicken Sie auf Titration. Wählen Sie für Flüssigkeit das interessierende Medikament aus, wählen Sie die höchste Konzentration (z. B. 2.000 nM) und die niedrigste Konzentration (z. B. 10 nM). Wählen Sie für Replikate mindestens 2 und wählen Sie das gewünschte Titrationsmuster aus.
- Deaktivieren Sie unter der Schaltfläche "Ausführen" das Kontrollkästchen "Immer simulieren". Klicken Sie auf Ausführen, um das Medikamentenabgabeprotokoll zu starten, und folgen Sie den Anweisungen.
- Bringen Sie die Dichtungsmembran auf die Mikrotiterplatte auf, um eine Verdunstung zu verhindern.
- Inkubieren Sie den Farbstoff Cytotox Green 1-2 h bei 37 °C im Inkubator und fahren Sie mit Schritt 4 fort.
4. Erfassen Sie Bilder mit dem Live-Cell-Imager
HINWEIS: Für die Wachstumsrate und den NDR muss 1-2 Stunden nach der Zugabe von Cytotox Green ein Scan zum Zeitpunkt 0 (T0 = Beginn der Behandlung) durchgeführt werden.
- Öffnen Sie die Live-Cell-Imager-Steuerungssoftware, wählen Sie Methodeneditor Neu, gehen Sie > importieren Sie in die Datei und wählen Sie die XML-Beispieldatei für die Methode (Zusatzdatei 9) aus. Alternativ können Sie eine neue Datei erstellen und Platte auswählen: (CORE384fb_OpticalImaging) - Corning 384 Flat Black (Corning #4588), No Deckel and No moisture cassette; Anwendung: Nur Bilder; Ziel: 4x; Muster: Zentral; Überprüfen Sie die Kanäle Hellfeld und Grün (LED-Intensität (%) = 40; Belichtungszeit (ms) = 200).
HINWEIS: Die Grünkanaleinstellungen funktionieren gut für eine Konzentration von 60 nM Cytotox Green. Mit der Live-Viewer-Option können Sie den Fokus-Offset und/oder die LED-Einstellungen in Echtzeit anpassen. - Klicken Sie auf Start , um den Scanvorgang bei T0 zu starten.
- Wiederholen Sie den Scan alle 24 Stunden für bis zu 5 Tage mit der gleichen Methode. Alternativ können Sie die Zeitraffermessung automatisch ausführen, indem Sie die Methode in der Live-Cell-Imager-Steuerungssoftware auf ein kinetisches Experiment einstellen, indem Sie auf die Registerkarte Kinetic Loop klicken und diese in das Methodenfeld ziehen. In ähnlicher Weise müssen die Registerkarten Temperatur und Gas in das Methodenfeld gezogen werden, um das System auf 37 °C und 5%CO2 einzustellen, um die korrekten Bedingungen innerhalb des Lebendzell-Imagers während des Experiments zu gewährleisten.
5. Bild- und Datenanalyse
- Zusammenführen und Komprimieren von Daten
- Die Live-Cell-Imager-Control-Software generiert zu jedem Zeitpunkt einen Ordner für jeden Scan. Erstellen Sie einen neuen Ordner, kopieren Sie die einzelnen Testordner in diesen neuen übergeordneten Ordner, und fügen Sie _0h, _24h, _48h, _72h, _96h und _120h zu den entsprechenden Testordnernamen hinzu.
- Bereiten Sie eine XLSX-Plattenkarte aus der digitalen Medikamentenspender-Steuerungssoftware vor, indem Sie mit der rechten Maustaste auf das Plattenkarten-Layout aus dem Medikamentenabgabeprotokoll klicken und alle Vertiefungen kopieren. Fügen Sie die Daten in eine XLSX-Datei ein. Entfernen Sie die Daten von Cytotox Green und Staurosporin und fügen Sie eine Matrix für Zelllinie und Replikation hinzu. Geben Sie Strg- und Strg+ ein. Siehe Ergänzungsdatei 10 für eine Beispiel-Plattenkarte .
- Öffnen Sie das Datenkomprimierungstool, klicken Sie auf Durchsuchen, wählen Sie den übergeordneten Ordner aus und klicken Sie auf Ausführen , um die Bilddatenkomprimierung zu starten. Alle TIFF-Bilddateien für die verschiedenen Zeitpunkte werden in einem neuen Datensatzordner innerhalb des Elternordners zu einem einzigen HDF5 für jede Vertiefung komprimiert.
- Bildanalyse
- Gehen Sie zur Webapp-Plattform für die Bildanalyse, melden Sie sich an und klicken Sie auf der Registerkarte "Startseite" auf "Neues Projekt hinzufügen". Geben Sie den Projektnamen ein, fahren Sie fort, wählen Sie Neues Experiment hinzufügen und laden Sie den Datensatzordner hoch, der die HDF5-Dateien enthält.
- Gehen Sie nach dem Hochladen in den Projekt- und Experimentordner und klicken Sie auf Hochladen der Platemap, um weitere Funktionen zu erhalten. Klicken Sie auf Analyse ausführen, wählen Sie Multi-Organoid-Analyse, Standardparameter und klicken Sie auf Analysieren, um die Bildanalyse zu starten.
- Klicken Sie auf Ergebnisse herunterladen , um die Rohdatentabellen herunterzuladen, die die Messungen für jedes Bohrloch (z. B. gesamte Hellfeldfläche, gesamte Fluoreszenzgrünfläche usw.) und die segmentierten Bilder/Videos enthalten, um die Genauigkeit der Analyse und der weiteren Datenverarbeitung zu bestätigen.
- Auf Wachstumsraten basierende Metriken für das Ansprechen auf Medikamente und normalisiertes Ansprechen auf Medikamente
- Wählen Sie die Raw_NDR.xlsx-Datei aus dem Ergebnisordner (Plattenkarte erforderlich) (Ergänzungsdatei 11) und laden Sie diese in das Official_NDR_7point R-Skript (Ergänzungsdatei 12), um automatisch GR- (normalisiert auf Strg-) und NDR- (normalisiert auf Strg- und Strg+) Wertetabellen (Ergänzungsdatei 13, Ergänzungsdatei 14, Ergänzungsdatei 15 und Ergänzungsdatei 16) zu erzeugen ). GR- und NDR-Werte werden aus dem in Gleichung (1) gezeigten Parameter unter Verwendung des R-Skripts (Zusatzdatei 12) berechnet.
Gesamtüberlebensfläche = Gesamthellfeldfläche - Gesamte Grünfläche (1)
Dabei < NDR <1 = zytostatische Wirkung (Wachstumsstillstand) und NDR < 0 = zytotoxische Reaktion (Zelltod).
ANMERKUNG: Das R-Skript wurde von Gupta et al.6 übernommen. - Rufen Sie aus der clonal_data.xlsx Tabelle Einzelorganoid-Antwortdaten ab, und stellen Sie sie als Blasendiagramm dar.
- Verwenden Sie den Z-Faktor10 , um die Qualität des Drogenscreenings eines Laufs zu beurteilen (siehe Gleichung (2)). Verwerfen Sie ein Experiment mit einem Z-Faktor < 0,5.
 (2)
(2)
- Wählen Sie die Raw_NDR.xlsx-Datei aus dem Ergebnisordner (Plattenkarte erforderlich) (Ergänzungsdatei 11) und laden Sie diese in das Official_NDR_7point R-Skript (Ergänzungsdatei 12), um automatisch GR- (normalisiert auf Strg-) und NDR- (normalisiert auf Strg- und Strg+) Wertetabellen (Ergänzungsdatei 13, Ergänzungsdatei 14, Ergänzungsdatei 15 und Ergänzungsdatei 16) zu erzeugen ). GR- und NDR-Werte werden aus dem in Gleichung (1) gezeigten Parameter unter Verwendung des R-Skripts (Zusatzdatei 12) berechnet.
Ergebnisse
Das automatisierte Pipettierprotokoll sorgt für eine gleichmäßige Verteilung der PDAC_060 PDTOs in allen Säulen der 384-Well-Mikrotiterplatte (Abbildung 2A). Wie erwartet, wurde eine Variation in der Anzahl und der mittleren Fläche der PDTOs zwischen den Bohrlöchern beobachtet (Abbildung 2A, B). Die Gesamtüberlebensfläche (Gesamthellfeldfläche - Gesamtgrünfläche) kombiniert die markierungsfreie Organoidsegmentierung mit dem fluoreszenzbasierten Zelltodsignal und ist unserer Erfahrung nach der robusteste Parameter, um Arzneimittelreaktionen über die Zeit zu untersuchen (Abbildung 2C)8. Um Variationen in der Zellaussaat und der Organoidgröße zu berücksichtigen, sollten wachstumsratenbasierte Metriken verwendet werden, um Variationen zwischen Replikaten zu reduzieren, wie die reduzierten Fehlerbalken in Abbildung 2D im Vergleich zu Abbildung 2C und ein höherer Z-Faktor zeigen, der auf eine stark verbesserte Wirkstoff-Screening-Qualität hinweist (Abbildung 2E).
Die NDR-Dosis-Wirkungs-Kurve (Abbildung 2G), normiert auf Strg- und Strg+, ist der auf Strg- und Strg- normierten Dosis-Wirkungs-Kurve (Abbildung 2F) deutlich überlegen, da sie den Abstand der Arzneimittel-Wirkungskurven erhöht und die zytotoxischen Arzneimittelreaktionen genauer darstellt. Ein Beispiel für die zugehörigen Bilder für ctrl-, ctrl+- und 400 nM Gemcitabin/80 nM Paclitaxel-behandeltes PDTO ist in Abbildung 3 dargestellt. Eine interessante Beobachtung ist, dass die zytotoxische Wirkung von Gemcitabin in der Kombinationstherapie dominant war, da kein Mehrwert von Paclitaxel beobachtet wurde.
Als nächstes wurden zwei zusätzliche PDTO-Leitungen, PDAC_052 und PDAC_087, verwendet. Es wurde ein deutlicher Unterschied in der Wachstumsrate zwischen diesen Linien beobachtet (Abbildung 4A), was die Verwendung von GR-Metriken unterstützt. Auch hier führten die NDR-Dosis-Wirkungs-Kurven (Abbildung 4C) zu einem erhöhten Dynamikbereich und einer erhöhten Trennung zwischen den drei verschiedenen Patienten im Vergleich zu den GR-Kurven (Abbildung 4B). Darüber hinaus ermöglicht das Protokoll die Bestimmung des NDR über die Zeit und zeigt, dass PDAC_052 und PDAC_060 eine sehr ähnliche zytostatische Arzneimittelreaktion auf eine niedrige Dosis von gem-pac hatten (Abbildung 4D), während eine deutliche differentielle zytostatische versus zytotoxische Reaktion für die mittleren (Abbildung 4E) und hohen Dosen (Abbildung 4F) von gem-pac beobachtet werden konnte. Diese Arzneimittelreaktionen stimmten mit dem klinischen Ansprechen überein, das bei den Patienten beobachtet wurde (Abbildung 4G).
Schließlich besteht ein großer Vorteil des Ansatzes und der Software darin, dass einzelorganoide Arzneimittelreaktionen quantifiziert werden können, um die Heterogenität der Reaktionen zu untersuchen und potenziell resistente Subklone zu identifizieren. Abbildung 5 gibt einen klaren Überblick über die klonale Dynamik der verschiedenen Patienten und zeigt, dass PDAC-087 nach der Behandlung die resistentesten Subklone aufwies, was mit der aggressiven und hochresistenten Erkrankung des Patienten übereinstimmt. Interessanterweise reagierte dieser Patient auch am wenigsten empfindlich auf das ctrl+ Staurosporin.
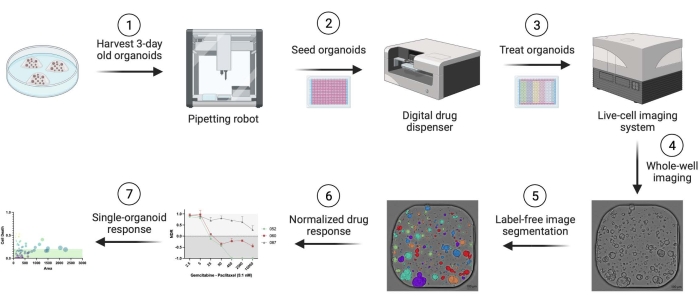
Abbildung 1: Workflow-Übersicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
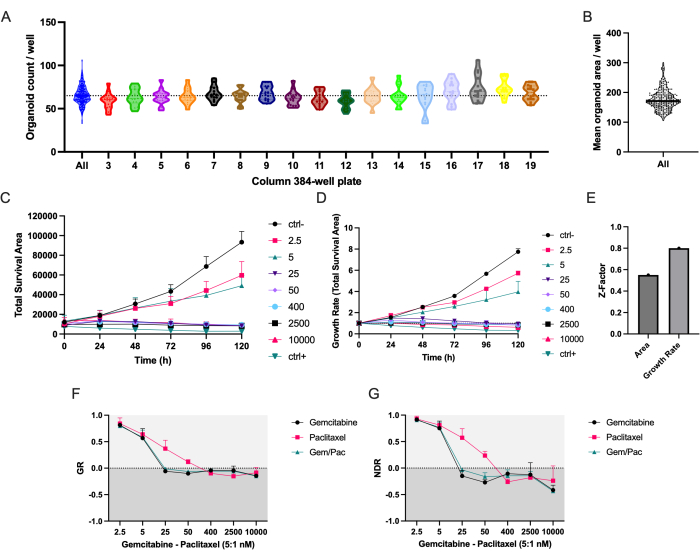
Abbildung 2: Seeding-Genauigkeit und Metriken zum Ansprechen von Medikamenten . (A) Organoidanzahl/Well von PDAC_060 PDTOs, die in einer 384-Well-Mikrotiterplatte unter Verwendung des Pipettierroboters ausgesät wurden. Jeder Punkt stellt die Anzahl in einer einzelnen Vertiefung dar, und die Diagramme sind durch die Mikrotiterplattensäulen mit 384 Vertiefungen getrennt. (B) Mittlere PDTO-Fläche/Bohrloch. (C) Gesamtüberlebensfläche (Gesamthellfeldfläche - Gesamtgrünfläche) und (D) Wachstumsrate (Gesamtüberlebensfläche normalisiert auf T0 = 1) von PDAC_060 PDTOs, die mit einem Verhältnis von 5:1 von Gemcitabin/Paclitaxel behandelt wurden. (E) Z-Faktor als Metrik für die Assay-Qualität. (F) Wachstumsrate-Dosis-Wirkungs-Kurve normalisiert auf Strg- und (G) normalisierte Arzneimittel-Wirkungskurve normalisiert auf Strg- und Strg+. Fehlerbalken zeigen den mittleren ± SD von zwei Bohrlöchern an. Abkürzungen: PDAC = duktales Adenokarzinom der Bauchspeicheldrüse; PDTO = patientenabgeleitetes Tumor-Organoid; GR = Wachstumsrate; NDR = normalisiertes Ansprechen auf Medikamente. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
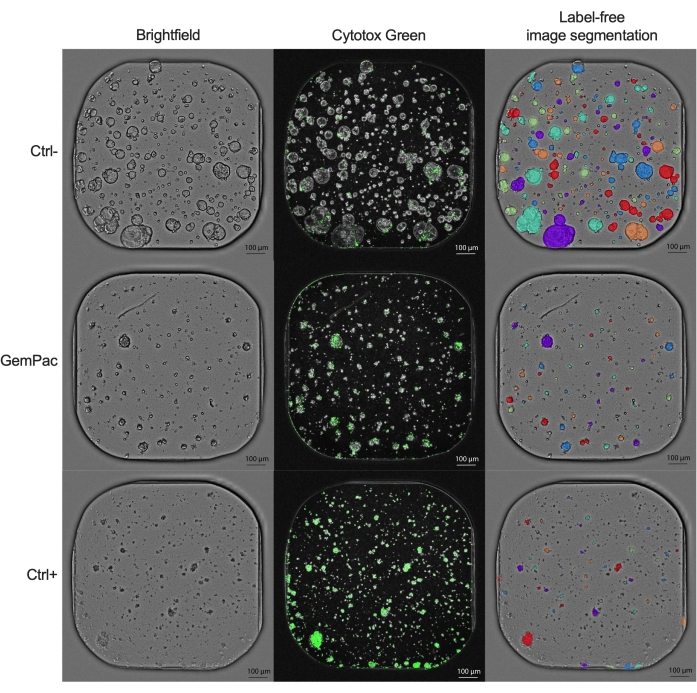
Abbildung 3: Beispielbilder. Repräsentative Bilder von PDAC_060 PDTO, die mit Vehikel (ctrl-), 400 nM Gemcitabin/80 nM Paclitaxel und 2 μM Staurosporin (ctrl+) behandelt wurden. Die linke Spalte zeigt Hellfeldbilder, die mittlere Spalte zeigt das Cytotox Green Fluoreszenzsignal und die rechte Spalte zeigt die markierungsfreien annotierten Hellfeldbilder mit dem Organoid-Analysemodul. Maßstabsbalken = 100 μm. Abkürzungen: PDAC = duktales Adenokarzinom der Bauchspeicheldrüse; PDTO = patientenabgeleitetes Tumor-Organoid; GemPac = Gemcitabin/Paclitaxel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
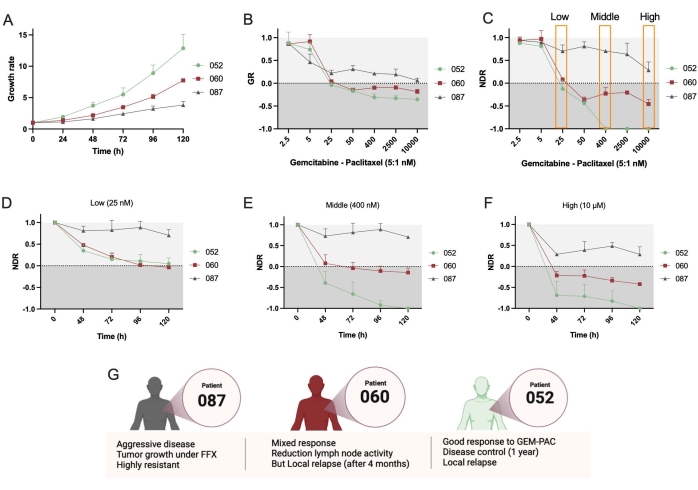
Abbildung 4: Vergleich des interstationären Arzneimittelansprechens . (A) Vergleich der Wachstumsrate (basierend auf der Gesamtüberlebensfläche) von PDAC_052-, PDAC_060- und PDAC_087-PDTO-Linien. (B) Wachstumsrate-Dosis-Wirkungs-Kurve normalisiert auf Strg- und (C) normalisierte Medikamentenansprechkurve normalisiert auf Strg- und Strg+. Kinetischer NDR einer (D) niedrigen, (E) mittleren und (F) hohen Dosis von Gemcitabin/Paclitaxel (Verhältnis 5:1). (G) Klinische Merkmale von PDAC-Patienten. Fehlerbalken zeigen den mittleren ± SD von zwei Bohrlöchern an. Abkürzungen: PDAC = duktales Adenokarzinom der Bauchspeicheldrüse; PDTO = patientenabgeleitetes Tumor-Organoid; GR = Wachstumsrate; NDR = normalisiertes Ansprechen auf Medikamente; FFX = folfirinox. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
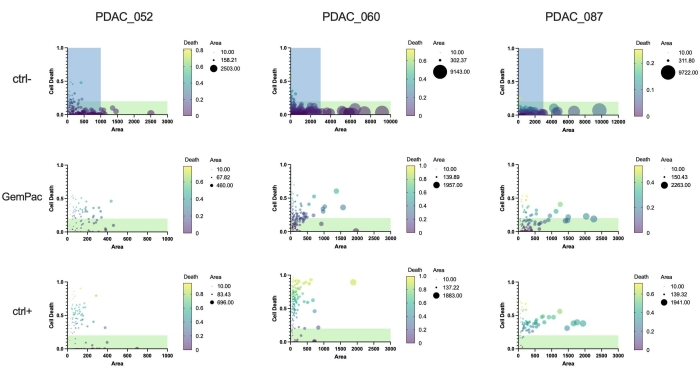
Abbildung 5: Einzelne Organoid-Metriken. Einzelne organoide Dosis-Wirkungs-Beziehung basierend auf dem Zelltod (grüner Bereich/Hellfeldbereich) und der Fläche (Hellfeld) von PDAC_052, PDAC_060 und PDAC_087 PDTOs, die mit Vehikel (ctrl-), 400 nM Gemcitabin/80 nM Paclitaxel und 2 μM Staurosporin (ctrl+) behandelt wurden. Grüne Bereiche weisen auf lebensfähige Organoide hin; blaue Bereiche zeigen den x-as-Bereich von GemPac- und ctrl+-Diagrammen an. Abkürzungen: PDAC = duktales Adenokarzinom der Bauchspeicheldrüse; PDTO = patientenabgeleitetes Tumor-Organoid; GemPac = Gemcitabin/Paclitaxel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Zellen-Suspensionsmaterial | Zellen/Ablage | # Tropfen (20 μL) | Bestand (1/3) | ECM (2/3) |
| 1,13 × 107 Zellen/ml | 75,000 | 10 | 75 μl | 150 μL |
| 1,13 × 107 Zellen/ml | 75,000 | 5 | 40 μl | 80 μL |
Tabelle 1: Verdünnung für die Beschichtung in ECM-Schnappscheiben. Abkürzung: ECM = extrazelluläre Matrix.
| Verbindung | Konzentration der Bestände | Verdünnung | Arbeitskonzentration | Lösungsmittel | Brunnenkonzentration | Kommentare |
| Cytotox Grün | 1 mM (DMSO) | 1/10 | 10 μM | DMSO | 60 nM | Zelltod-Marker |
| Cytotox Rot | 1 mM (DMSO) | 1/10 | 10 μM | DMSO | 250 nM | Zelltod-Marker |
| Caspase 3/7 Grün | 5 mM (DMSO) | 1/2 | 2,5 mM | DMSO | 2,5 μM | Apoptotischer Marker |
| Hoechst | | 20 mM (H2O) | 1/200 | 100 μM | 0,33 % Tween/PBS | 50 nM | Nuklearer Marker |
| Staurosporin | 10 mM (DMSO) | / | 1 - 10 mM | / | 2 – 5 μM | Positivkontrolle |
| Gemcitabin | 10 mM (DMSO) | / | 1 - 10 mM | / | Titration | Chemotherapie |
| Paclitaxel | 10 mM (DMSO) | / | 1 - 10 mM | / | Titration | Chemotherapie |
| Cisplatin | 5 mM (0,9% NaCl) | 1/2 | 2,5 mM | 0,6 % Tween/PBS | Titration | Chemotherapie |
Tabelle 2: Beispielverdünnungen von häufig verwendeten Arzneimitteln und fluoreszierenden Reagenzien. Jede Verbindung muss entweder in 100% DMSO oder 0,3% Tween/PBS gelöst werden.
Ergänzungstabelle S1: Übersicht der kompatiblen Krebszelllinien. Statisch: Sphäroide sind nicht wandernd. Verschmelzung: Sphäroide wandern aufeinander zu und verschmelzen miteinander. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 1: Berechnungstool für organoide Aussaatlösungen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 2: STL-Datei für den 3D-Druck von kundenspezifischen Laborgeräten 'Microplate Holder'. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 3: STL-Datei für den 3D-Druck von kundenspezifischen Laborgeräten "2 x 25 ml Reservoirhalter". Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 4: JSON-Datei für den Pipettierroboter "Microplate Holder" für kundenspezifische Laborgeräte. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 5: JSON-Datei für den Pipettierroboter "2 x 25 mL Reservoir Holder_WithCooler". Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 6: JSON-Datei zum Pipettieren des Roboterprotokolls 'Plating_ PDO_384well_Cooled_Row2-23'. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 7: Überblick über die Einrichtung des Pipettierroboter-Schreibtisches. (A) Kühlelemente und (B) Reservoir und Mikrotiterplatte. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 8: TDD-Datei für das Protokoll des digitalen Medikamentenspenders. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 9: XML-Datei für das Protokoll des Live-Cell-Imagers für die Hellfeld- und Fluoreszenzbildgebung. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 10: Beispiel-Plattenkarte. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 11: Beispieleingabedatei für ein NDR-R-Skript. Abkürzung: NDR = normalized drug response. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 12: Normalisiertes NDR-R-Skript für die Reaktion auf Medikamente. Abkürzung: NDR = normalized drug response. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 13: Beispielausgabedatei für NDR-R-Skript-GR-Werte. Abkürzungen: GR = Wachstumsrate; NDR = normalisiertes Ansprechen auf Medikamente. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 14: Beispielausgabedatei eines NDR-R-Skripts mit transponierten GR-Werten. Abkürzungen: GR = Wachstumsrate; NDR = normalisiertes Ansprechen auf Medikamente. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Supplementary File 15: Beispielausgabedatei für NDR R-Skript-NDR-Werte. Abkürzung: NDR = normalized drug response. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 16: Beispielausgabedatei eines NDR-R-Skripts mit transponierten NDR-Werten. Abkürzung: NDR = normalized drug response. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Das PDTO-Screening mit mittlerem bis hohem Durchsatz beruht häufig auf Messwerten, die nur einen Bruchteil der Informationen extrahieren, die Organoide potenziell liefern könnten. Es wurde immer deutlicher, dass fortschrittlichere 3D-Assays, Auslesungen und Analysemethoden von entscheidender Bedeutung sind, damit die sich schnell entwickelnde Organoidtechnologie ein größeres wissenschaftliches und klinisches Potenzial entfalten kann. Hier wird eine fortschrittliche Screening-Pipeline beschrieben, die nicht nur die Reproduzierbarkeit erhöht, sondern auch die klinische Übersetzbarkeit durch die Einbindung einer KI-gesteuerten Live-Cell-Bildgebung erheblich verbessert. Zusätzlich zu einer eigens entwickelten Analysesoftware wird die Normalized Drug Response Metric (NDR) eingesetzt, die ihre Fähigkeit, patientenspezifische Unterschiede im Behandlungsansprechen zu definieren, deutlich macht6.
Die Einbeziehung dieser Normalisierungsmetrik wird zweifellos von unschätzbarem Wert sein, wenn man bedenkt, dass zahlreiche Studien darauf abzielen, das Ansprechen auf die Behandlung auf der Grundlage geringfügiger Unterschiede in der Fläche unter der Kurve (AUC) oder der halbmaximalen Hemmkonzentration (IC50) abzugrenzen (da sich die meisten Dosis-Wirkungs-Kurven überlappen bzw. nahe beieinander liegen)11,12 . Wachstumsratenmetriken wurden bereits in Organoid-Screening-Protokollen unter Verwendung des ATP-basierten Assays implementiert, beruhen jedoch auf der Normalisierung von Referenzbohrungen, die zum Zeitpunkt 04 lysiert wurden. Im Gegensatz dazu ermöglicht diese Methode eine Normalisierung der Wachstumsrate innerhalb der Vertiefung, die nicht nur Unterschiede zwischen Patienten in der PDTO-Wachstumsrate berücksichtigt, sondern auch Unterschiede zwischen den Schichten, die sich aus Variationen der Seeding-Dichte und von Plattenstandort-abhängigen Effekten ergeben, um die Reproduzierbarkeit zu erhöhen. Darüber hinaus haben wir den NDR angepasst, um die Trennung der intermediären PDTO-Reaktion weiter zu erhöhen, indem wir eine Positivkontrolle für die Normalisierung 6,8 einbeziehen.
Darüber hinaus kann die Analyse, die mit Hochdurchsatz- und Automatisierungsformaten kompatibel ist, einzelne Organoidreaktionen genau erkennen, was die Quantifizierung der subklonalen Resistenz ermöglicht - die Hauptantriebskraft für Tumorrückfall und -progression13. Obwohl PDAC052 und PDAC060 beispielsweise ein gutes Ansprechen auf die Behandlung in vitro zeigten (basierend auf dem NDR), konnte die zusätzliche Einzelorganoid-Analyse eine kleine (größere Population mit PDAC060) Population von Subklonen nachweisen, die nicht auf die Behandlung ansprechen. Interessanterweise stimmte dies in hohem Maße mit der klinischen Beobachtung überein, da PDAC052 und PDAC060 ein dauerhaftes Ansprechen aufwiesen (keine Tumoraktivität nachgewiesen), aber schließlich beide mit einer lokalen Tumorprogression diagnostiziert wurden (aufgrund des Vorhandenseins resistenter Klone). Im Vergleich zu den herkömmlichen 3D-Auslesungen (ATP-basierter Assay und Größe/Zahlen) wird erwartet, dass diese fortschrittliche Screening-Pipeline die Vorhersageleistung erhöht, indem sie mehr klinisch relevante Informationen aus diesen "Patienten im Labor" extrahiert. Diese Hypothese wird nun getestet, indem klinische PDTO-Proben im Labor der Autoren mit dieser Methode untersucht werden, um ex vivo mit dem In-vivo-Ansprechen und dem klinischen Ergebnis zu korrelieren.
Um mehr Einblicke in die Mechanismen einer Medikamentenreaktion zu erhalten, sind konventionelle fluoreszierende Live-Cell-Imaging-Reagenzien neben Zytotoxizitätsfarbstoffen mit dieser Methode kompatibel, um die Mechanismen des Zelltods zu untersuchen. Wir haben bereits die Kompatibilität dieser Methode mit dem Sartorius Caspase 3/7 Green Reagenz gezeigt, um die Caspase-abhängige Induktion der Apoptose nach Cisplatin-Behandlungzu untersuchen 8. Die Verträglichkeit mit anderen Farbstoffen zur Untersuchung von oxidativem Stress (CellROX-Reagenzien) oder Hypoxie (Image-iT Hypoxia-Reagenzien) muss noch getestet werden. Diese Reagenzien wurden jedoch bereits erfolgreich in 3D-In-vitro-Modellen eingesetzt 14,15.
Die Bildanalysesoftware ist auch mit anderen Plattenformaten oder Kultivierungsmethoden (z. B. Mikrohohlraumplatten, ECM-Kuppeln) kompatibel, wenn klare, scharfe Bilder der Organoide aufgenommen werden können. Dies ist oft eine Herausforderung für Organoide, die in Kuppeln kultiviert werden, da sie in verschiedenen Z-Ebenen wachsen, was eine Z-Stacking-Funktionalität des Mikroskops erfordert, die nicht immer verfügbar ist. Daher empfehlen wir die Verwendung von ULA 384-Well-Mikrotiterplatten mit flachem Boden, um eine ausreichende Bildqualität zu gewährleisten.
Darüber hinaus ist die Analyse mit anderen Live-Cell-Bildgebungssystemen kompatibel, wie zuvor für Phasenkontrastbilder gezeigt wurde, die mit einem IncuCyte ZOOM-Systemaufgenommen wurden 8. Eine Einschränkung des Spark Cyto-Live-Cell-Imaging-Systems, das in diesem Manuskript verwendet wurde, ist die Ein-Platten-Kapazität für kinetische Messungen. Die Spark Motion-Erweiterung erhöht jedoch die Kapazität auf bis zu 40 Mikrotiterplatten, die in großen Mengen gesiebt werden können. Die Kompatibilität der selbst entwickelten Software wird auf diese und andere Systeme ausgeweitet, um eine plattformunabhängige Lösung anzubieten, mit dem Ziel, Bild- und Datenanalyse-Pipelines zu standardisieren und zu automatisieren. Die webbasierte Anwendung wird auch interaktive Grafikwerkzeuge und automatisierte Berechnungen der Arzneimittelmetrik enthalten, wie in diesem Artikel gezeigt, um die manuelle Analysezeit zu reduzieren.
Der markierungsfreie PDTO-Segmentierungsalgorithmus wurde an verschiedenen selbst gezüchteten Sphäroid- und PDTO-Modellen mit deutlichen morphologischen Unterschieden (fest, halbfest, zystisch) trainiert und getestet und kann diese daher mit hoher Genauigkeit erkennen8. Eine Einschränkung des Modells besteht darin, dass der Einschluss von zystischen PDTOs die unerwünschte Detektion von Blasen erhöht, die in der nach der Aussaat vorhandenen Blasen vorhanden sind. Die Inkubation über Nacht war jedoch ausreichend, um die meisten dieser Blasen zu entfernen, was einen qualitativen Zeitpunkt 0-Scan ermöglichte. Die Genauigkeit der organoiden Bildsegmentierung und der Methode muss von anderen Anwendern validiert werden, und basierend auf ihrem Feedback kann die Software weiter trainiert werden, um einen robusten und automatisierten Bildanalysealgorithmus zu erhalten. Darüber hinaus wollen wir mehr klinische Daten erhalten, um das mit dieser Methode quantifizierte ex vivo Arzneimittelansprechen mit dem klinischen Ansprechen beim Patienten zu korrelieren, um die besten Parameter zur Vorhersage des Therapieansprechens zu identifizieren und diese Methode für die funktionelle Präzisionskrebsmedizin weiterzuentwickeln16.
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
Ein Teil dieser Forschung wurde durch Spenden verschiedener Spender finanziert, darunter Dedert Schilde vzw und Willy Floren. Diese Arbeit wird teilweise von der Flämischen Forschungsstiftung, 12S9221N (A.L.), G044420N (S.V., A.L., E.G.), 1S27021N (M.L), und vom Industrial Research Fund der Universität Antwerpen, PS ID 45151 (S.V., A.L., C.D.), finanziert. Abbildung 1 wurde mit BioRender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 6-well plate | Greiner | 657160 | |
| 8-Channel p300 (GEN 2) pipette | Opentrons | ||
| 300 µL Tips | Opentrons | ||
| 384-well flat-bottom ULA microplate | Corning | 4588 | minimum volume 50 µL |
| 384-well flat-bottom ULA Phenoplate | Perkin Elmer | 6057802 | minimum volume 75 µL |
| A8301 | Tocris Bioscience | 2939 | |
| ADF+++ | Advanced DMEM/F12, 1% GlutaMAX, 1% HEPES, 1% penicillin/streptomycin | ||
| Advanced DMEM/F-12 | ThermoFisher Scientific | 12634 | |
| B27 | ThermoFisher Scientific | 17504044 | |
| Breathe easy sealing membrane | Sigma-Aldrich | Z380059 | |
| Caspase 3/7 Green | Sartorius | 4440 | |
| Cell Counting Slides for TC10/TC20 | Bio-Rad Laboratories | 1450017 | |
| CellTiter-Glo 3D | Promega | G9681 | ATP-assay |
| Cooler for 25 mL reservoir | VWR (Diversified Biotech) | 490006-908 | |
| Cooling element 12 x 8 x 3 cm | Bol.com | 9200000107744702 | For custom microplate holder OT-2 |
| Cultrex Organoid Harvesting Solution | R&D systems | 3700-100-01 | |
| Cultrex PathClear Reduced Growth Factor BME, Type 2 | R&D systems | 3533-010-02 | extracellular matrix (ECM) |
| Cytotox Green | Sartorius | 4633 | |
| Cytotox Red | Sartorius | 4632 | |
| D300e | Tecan | Digital drug dispenser | |
| D300e Control v3.3.5 | Tecan | Control software D300e | |
| FGF10 | Peprotech | 100-26 | |
| Full Medium | ADF+++ supplemented with 0.5 nM WNT surrogate-Fc-Fusion protein, 4% Noggin-Fc Fusion Protein conditioned medium, 4% Rpso3-Fc Fusion Protein conditioned medium, 1x B27, 1 mM N-acetyl cysteine (NAC), 5 mM nicotinamide, 500 nM A83-01, 100 ng/mL FGF10, and 10 nM Gastrin | ||
| Gastrin | Sigma-Aldrich | G9145 | |
| Gemcitabine | Selleck Chemicals | S1714 | |
| GlutaMAX | ThermoFisher Scientific | 35050 | |
| HEPES | ThermoFisher Scientific | 15630056 | |
| Hoechst 33342 Solution (20 mM) | ThermoFisher Scientific | 62259 | |
| Human pancreatic ductal adenocarcinoma (PDAC) patient-derived organoids | Biobank@uza (Antwerp, Belgium; ID: BE71030031000; Belgian Virtual Tumorbank funded by the National Cancer Plan) | ||
| N-acetyl-cysteine | Sigma-Aldrich | A9165-25G | |
| Nicotinamide | Sigma-Aldrich | N0636-100G | |
| Noggin-Fc Fusion Protein conditioned medium | Immunoprecise | N002 | |
| Opentrons App v6.0.1 | Opentrons | OT-2 control software | |
| Opentrons Protocol Designer Tool | Opentrons | https://designer.opentrons.com/ | |
| Orbits data compression tool | www.orbits-oncology.com or contact corresponding author | ||
| Orbits image analysis webapp | University of Antwerp | www.orbits-oncology.com or contact corresponding author | |
| OT-2 | Opentrons | Pipetting robot | |
| Paclitaxel | Selleck Chemicals | S1150 | |
| Pasteur Pipette 230 mm | Novolab | A33696 | |
| Peniciline-Streptomycin | ThermoFisher Scientific | 15140 | |
| Prism 9 | GraphPad | ||
| Rspo3-Fc Fusion Protein conditioned medium | Immunoprecise | N003 | |
| Spark Cyto 600 | Tecan | Live-cell imaging and multi-mode platereader | |
| SparkControl v3.1 | Tecan | Spark Cyto control software | |
| Staurosporine | Tocris Bioscience | 1285 | |
| Sterile 25 mL reservoir | VWR (Diversified Biotech) | 10141-922 | |
| T8 plus cassette | Tecan | ||
| TC20 | Bio-Rad Laboratories | automated cell counter | |
| TrypLE | ThermoFisher Scientific | 12604-021 | dissociation enzyme |
| Tween-20 | Acros Organics | 233360010 | |
| WNT Surrogate-Fc-Fusion protein | Immunoprecise | N001 | |
| Y-27632 | Selleck Chemicals | S1049 |
Referenzen
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Veninga, V., Voest, E. E. Tumor organoids: Opportunities and challenges to guide precision medicine. Cancer Cell. 39 (9), 1190-1201 (2021).
- Le Compte, M., et al. Patient-derived organoids as individual patient models for chemoradiation response prediction in gastrointestinal malignancies. Critical Reviews in Oncology/Hematology. 157, 103190 (2021).
- Driehuis, E., Kretzschmar, K., Clevers, H. Establishment of patient-derived cancer organoids for drug-screening applications. Nature Protocols. 15 (10), 3380-3409 (2020).
- Hafner, M., Niepel, M., Chung, M., Sorger, P. K. Growth rate inhibition metrics correct for confounders in measuring sensitivity to cancer drugs. Nature Methods. 13 (6), 521-527 (2016).
- Gupta, A., Gautam, P., Wennerberg, K., Aittokallio, T. A normalized drug response metric improves accuracy and consistency of anticancer drug sensitivity quantification in cell-based screening. Communications Biology. 3 (1), 42 (2020).
- Rios, A. C., Clevers, H. Imaging organoids: a bright future ahead. Nature Methods. 15 (1), 24-26 (2018).
- Deben, C., Cardenas, E., et al. OrBITS: label-free and time-lapse monitoring of patient derived organoids for advanced drug screening. Cellular Oncology. , (2022).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. Bioessays. 39 (8), (2017).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Engel, R. M., et al. Patient-derived colorectal cancer organoids upregulate revival stem cell marker genes following chemotherapeutic treatment. Journal of Clinical Medicine. 9 (1), 128 (2020).
- Hennig, A., et al. Detecting drug resistance in pancreatic cancer organoids guides optimized chemotherapy treatment. The Journal of Pathology. 257 (5), 607-619 (2022).
- D'Alterio, C., Scala, S., Sozzi, G., Roz, L., Bertolini, G. Paradoxical effects of chemotherapy on tumor relapse and metastasis promotion. Seminars in Cancer Biology. 60, 351-361 (2020).
- Njoroge, R. N., et al. Organoids model distinct Vitamin E effects at different stages of prostate cancer evolution. Scientific Reports. 7 (1), 16285 (2017).
- Godet, I., et al. Fate-mapping post-hypoxic tumor cells reveals a ROS-resistant phenotype that promotes metastasis. Nature Communications. 10 (1), 4862 (2019).
- Letai, A. Functional precision cancer medicine-moving beyond pure genomics. Nature Medicine. 23 (9), 1028-1035 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten