Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Kontrolle der Partikelfraktion in mikroporös geglühten Partikelgerüsten für die 3D-Zellkultur
In diesem Artikel
Zusammenfassung
Die Minimierung der Variabilität der Partikelfraktion innerhalb von Granulatgerüsten erleichtert reproduzierbare Experimente. Diese Arbeit beschreibt Methoden zur Erzeugung granularer Gerüste mit kontrollierten Partikelfraktionen für in vitro Tissue Engineering Anwendungen.
Zusammenfassung
Mikrogele sind die Bausteine von mikroporösen geglühten Partikeln (MAP)-Gerüsten, die als Plattform für die In-vitro-Zellkultur und die In-vivo-Gewebereparatur dienen. In diesen körnigen Gerüsten ermöglicht die angeborene Porosität, die durch den Hohlraum zwischen Mikrogelen erzeugt wird, die Zellinfiltration und -migration. Die Kontrolle der Hohlraumfraktion und der Partikelfraktion ist entscheidend für das MAP-Gerüstdesign, da die Porosität ein bioaktiver Hinweis für Zellen ist. Sphärische Mikrogele können auf einer mikrofluidischen Vorrichtung für kontrollierte Größe und Form erzeugt und anschließend gefriergetrocknet werden, wobei Methoden verwendet werden, die das Brechen des Polymernetzwerks verhindern. Bei der Rehydratation führen die lyophilisierten Mikrogele zu kontrollierten Partikelfraktionen in MAP-Gerüsten. Die Implementierung dieser Methoden zur Mikrogel-Lyophilisation hat zu reproduzierbaren Studien geführt, die den Einfluss der Partikelfraktion auf die Makromoleküldiffusion und Zellausbreitung zeigen. Das folgende Protokoll umfasst die Herstellung, Lyophilisierung und Rehydratation von Mikrogelen zur Kontrolle der Partikelfraktion in MAP-Gerüsten sowie das Glühen der Mikrogele durch bioorthogonale Vernetzung für die 3D-Zellkultur in vitro.
Einleitung
Mikroporöse geglühte Partikel (MAP)-Gerüste sind eine Unterklasse von körnigen Materialien, in denen die Mikrogel-Bausteine (μgel) miteinander verbunden sind, um ein poröses Gerüst zu bilden. Mit der einzigartigen Mikroarchitektur dieser körnigen Gerüste unterstützt die angeborene Porosität, die durch den Hohlraum zwischen vernetztem sphärischem Mikrogel erzeugt wird, eine beschleunigte Zellinfiltration und -migration1. Die Mikrogel-Bausteine von MAP-Gerüsten können sowohl aus synthetischen als auch aus natürlichen Polymeren mit chemischen Modifikationen hergestelltwerden 2. Die hier beschriebenen Methoden heben insbesondere die Verwendung von Mikrogelen hervor, die aus einem Hyaluronsäure (HA)-Rückgrat bestehen, das mit funktionellen Norbornen (NB)-Griffen modifiziert ist. Der funktionelle NB-Griff am HA-Polymer unterstützt Klickchemiereaktionen zur Bildung von Mikrogelen und deren Verknüpfung zu MAP-Gerüsten 3,4. Zahlreiche Verfahren wurden verwendet, um die Mikrogele miteinander zu verbinden (d.h. Glühen), wie enzymatische1, lichtbasierte5,6 und additivfreie Klickchemie 3,7 Reaktionen. In dieser Arbeit wird die additivfreie Klickchemie beschrieben, wobei die inverse Tetrazin-Norbornen-Elektronenbedarfs-Diels-Alder-Konjugation zur Verknüpfung der HA-NB-Mikrogele verwendet wird.
Zur Herstellung von MAP-Gerüsten erzeugen Anwender die Mikrogelbausteine zunächst unter Verwendung von Umkehremulsionen entweder in Batch-Systemen oder in mikrofluidischen Geräten sowie durch elektrohydrodynamisches Spritzen, Lithographie oder mechanische Fragmentierung2. Die Herstellung von sphärischen HA-NB-Mikrogelen wurde gut beschrieben und zuvor unter Verwendung von Batchemulsion2 und mikrofluidischen Tröpfchenerzeugungstechniken 8,9,10,11 berichtet. In dieser Arbeit wurden sphärische HA-NB-Mikrogele auf einer strömungsfokussierenden mikrofluidischen Plattform für kontrollierte Größe und Form erzeugt, wie zuvor beschrieben 8,9,10. Nach der Reinigung liegen die Mikrogele in einer wässrigen Suspension vor und müssen konzentriert werden, um einen verklemmten Zustand zu induzieren. Wenn sie verklemmt sind, weisen Mikrogele scherverdünnende Eigenschaften auf, die es ihnen ermöglichen, als injizierbare, raumfüllende Materialien zu fungieren1. Eine Methode zur Induktion eines gestauten Zustands besteht darin, die Mikrogele durch Lyophilisation oder Gefriertrocknung zu trocknen und anschließend das getrocknete Produkt in einem kontrollierten Volumen zu rehydrieren12. Alternativ kann überschüssiger Puffer aus der Mikrogelaufschlämmung durch Zentrifugieren über einem Sieb oder durch manuelles Entfernen des Puffers aus dem Mikrogelpellet entweder durch Absaugen oder unter Verwendung eines absorbierenden Materials entfernt werden. Die Verwendung von Zentrifugation zum Trocknen der Mikrogele kann jedoch bei der Herstellung von körnigen Gerüsten12 einen sehr variablen Bereich von Partikelfraktionen und Hohlraumfraktionen erzeugen. Techniken zur Lyophilisierung von Mikrogelen wurden unter Verwendung von 70% IPA für Polyethylenglykol (PEG)-Mikrogele13, fluorierten Ölen für Gelatinemethacryloyl (GelMa)-Mikrogele 14 und 70% Ethanol für HA-Mikrogele12 beschrieben. Dieses Protokoll hebt Methoden zur Gefriertrocknung kugelförmiger HA-Mikrogele unter Verwendung von 70% Ethanol, einem Standardlaborreagenz, hervor, um die ursprünglichen Mikrogeleigenschaften während des Trocknungsprozesses beizubehalten. Die gefriergetrockneten HA-Mikrogele können mit benutzerdefinierten Gewichtsprozentsätzen gewogen und rehydriert werden, um die endgültigen Partikelfraktionen in MAP-Gerüsten12 zu kontrollieren.
Der letzte Schritt bei der MAP-Gerüstbildung beruht auf dem Glühen der Mikrogele, um ein poröses Gerüst zu erzeugen1. Durch die Verwendung nativer extrazellulärer Matrixkomponenten und den Einsatz bioorthogonaler Glühschemata dienen MAP-Gerüste als biokompatible Plattform sowohl für die In-vitro-Zellkultur als auch für die In-vivo-Gewebereparatur 3. Durch diese Ansätze können MAP-Gerüste aus HA-NB-Bausteinen mit benutzerdefinierten Partikelfraktionen für ihren Einsatz in Tissue-Engineering-Anwendungen hergestellt werden12. Das folgende Protokoll beschreibt die mikrofluidische Produktion von HA-NB-Mikrogelen gefolgt von Lyophilisation und Rehydratation zur Kontrolle der Partikelfraktion in MAP-Gerüsten. Schließlich werden Schritte zum Glühen der Mikrogele unter Verwendung bioorthogonaler Chemie für in vitro 3D-Zellkulturexperimente beschrieben.
Protokoll
1. Herstellung mikrofluidischer Bauelemente
- Weiche Lithographie
HINWEIS: Dieses Protokoll beschreibt die Geräteherstellung eines strömungsfokussierenden mikrofluidischen Gerätedesigns von de Wilson et al.9. Dieses Protokoll kann jedoch mit jedem Gerätedesign auf einem SU-8-Wafer verwendet werden. Der Wafer kann auf eine Petrischale geklebt werden und muss dann silanisiert werden, um ein Anhaften des PDMS an den Wafermerkmalen15 zu verhindern.- Mischen Sie die Polydimethylsiloxan (PDMS)-Elastomerbasis mit dem Härter (siehe Materialtabelle) im Verhältnis 10:1. Bereiten Sie ca. 100 g vor, um den Wafer mit ~5 mm PDMS zu bedecken. Gießen Sie die PDMS-Mischung auf den Wafer und entgasen Sie in einem Exsikkator für ca. 30 min. Sobald alle Blasen verschwunden sind, für mindestens 2 h in einen Ofen bei 60 °C stellen, um das PDMS auszuhärten.
- Verwenden Sie ein Messer, um den Parameter des Geräts sanft zu verfolgen, ohne den Wafer zu knacken. Ziehen Sie dann das PDMS vorsichtig vom Wafer ab. Verwenden Sie einen 1-mm-Biopsiestempel (siehe Materialtabelle), um die Ein- und Auslasskanäle zu erstellen.
HINWEIS: Seien Sie vorsichtig, wenn Sie das mikrofluidische Gerät stanzen. Risse oder Risse um die Ein- oder Auslasskanäle können während der Mikrogelproduktion zu Leckagen führen. - Verwenden Sie Klebeband, um Staub vom Gerät auf der Funktionsseite zu entfernen. Legen Sie die Geräte und sauberen Glasobjektträger für mindestens 15 min auf eine Heizplatte bei 135 °C, um Feuchtigkeit zu entfernen.
- Verwenden Sie in einem Abzug eine Corona-Plasmapistole (siehe Materialtabelle) sowohl auf den Glasobjektträgern als auch auf den Geräten (Merkmalsseite freiliegend) für ca. 30 s und verbinden Sie sie dann schnell miteinander. Üben Sie vorsichtig Druck aus, um eine gute Abdichtung zwischen dem Gerät und dem Glasobjektträger zu gewährleisten. Stellen Sie die Geräte über Nacht in einen 60 °C heißen Ofen, um die Verbindung zu sichern.
2. Mikrofluidische Herstellung von Hyaluronsäure (HA) Mikrogelen mit Norbornen (NB) funktionellen Griffen
- HA-NB-Synthese
HINWEIS: Die HA-Norbornen-Synthese (HA-NB) wurde von Darling et al.3 unter Verwendung von 79 kDa Natrium-HA mit molaren Äquivalenten von 1:1,5:2,5 HA-Wiederholungseinheiten zu 4-(4,6-Dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholiniumchlorid (DMTMM) zu 5-Norbornen-2-methylamin (NMA) adaptiert.- Wiegen Sie die Reaktanten. Das HA wird bei 20 mg/ml in 200 mM MES-Puffer (pH ~6) durch Einrühren in einem Becherglas oder Kolben auf einer Rührplatte gelöst. Nach dem Auflösen das DMTMM in die HA-Lösung geben und ca. 20 min bei Raumtemperatur einwirken lassen. Beispielsweise können 1 g HA + 1,09 g DMTMM + 845 μL NMA verwendet werden.
- Fügen Sie NMA tropfenweise zur HA/DMTMM-Lösung hinzu. Fügen Sie Parafilm zur Öffnung des Reaktionsgefäßes hinzu, um die Verdunstung zu minimieren, und bedecken Sie das Reaktionsgefäß mit Folie. Rühren Sie weiter, während die Reaktion für ca. 24 h fortgesetzt wird.
- Nach 24 h 200 Proof Ethanol (ca. 10x des Reaktionsvolumens) kühlen. Auf einer Rührplatte die Reaktion tropfenweise auf das gekühlte Ethanol übertragen, um das HA-NB auszufällen, und 20 min bei 200-300 U/min weiterrühren.
- Die Lösung in 50 ml konische Röhrchen geben und dann bei 5.000 x g für 10 min zentrifugieren. Gießen Sie das überschüssige Ethanol ab, um es als Abfall zu entsorgen. Zu diesem Zeitpunkt sollte das HA-NB-Produkt weiße Pellets in den konischen Rohren sein. Ziehen Sie Vakuum auf dem HA-NB in einem Exsikkator, um über Nacht zu trocknen.
- Reinigen Sie das HA-NB mit einem 12-14 kDa Molekulargewicht-Cut-off-Zellulosedialyseschlauch (siehe Materialtabelle). HA-NB wird in 2 M NaCl-Lösung gelöst und in den Dialyseschlauch überführt. Binden Sie den Schlauch und sichern Sie ihn bei Bedarf mit Klemmen. Die gefüllten Dialyseschläuche werden in einen Eimer mit 5 L Reinstwasser umgefüllt und der HA-NB über Nacht gegen Wasser dialysiert.
- Am nächsten Tag das Wasser entfernen und für 30 min durch 1 M NaCl-Lösung ersetzen. Entfernen Sie die NaCl-Lösung und dialysieren Sie dann 3 Tage lang gegen Reinstwasser, wobei Sie das Wasser täglich ersetzen.
- Filtern Sie das dialysierte Produkt mit einem vakuumbetriebenen 0,2-μm-Filter und überführen Sie dann das gefilterte Produkt in 50-ml-konische Röhrchen.
- Fügen Sie flüssigen Stickstoff in einen kryogenen Behälter und frieren Sie die HA-NB-Röhrchen für 10 min ein. Entfernen Sie dann die konischen Röhrchen mit einer Pinzette und entfernen Sie schnell die Kappe und den Deckel mit einem Laborgewebe (siehe Materialtabelle). Sichern Sie das Gewebe mit einem Gummiband und geben Sie es in einen Gefriertrocknungsbehälter oder eine Gefrierkammer (siehe Materialtabelle) und lyophilisieren. Lagern Sie das lyophilisierte Produkt bei -20 °C.
ACHTUNG: Flüssiger Stickstoff ist ein gefährlicher Stoff. Tragen Sie die entsprechende persönliche Schutzausrüstung, wenn Sie mit flüssigem Stickstoff arbeiten. - Quantifizierung der Norbornenmodifikation durch Auflösen des HA-NB bei 10 mg/ml inD2Ound Analyse mittels Protonen-NMR (Abbildung 1A)16.
- Um den Grad der Funktionalisierung zu bestimmen, kalibrieren Sie zunächstden D2O-Lösungsmittelpeak auf 4,8 ppm. Integrieren Sie den Peak für die HA-Methylprotonen (δ2.05) und kalibrieren Sie die Integration auf 3.0. Als nächstes integrieren Sie die Peaks für die hängenden Norbornengruppen bei δ6,33 und δ6,02 (Vinylprotonen, Endo). Normalisieren Sie die Integration dieser Peaks auf die entsprechende Anzahl von Protonen, um den durchschnittlichen Grad der Modifikationzu bestimmen 3.
- Herstellung von HA-NB-Mikrogel-Vorläufer
- Bereiten Sie einen 50 mM HEPES-Puffer (pH 7,5) vor und filtern Sie den Puffer steril mit einem 0,2 μm vakuumbetriebenen Filter. Unter Verwendung des HEPES-Puffers werden jeweils 50 mM Lithiumphenyl(2,4,6,-trimethylbenzoyl)phosphinat (LAP)-Photoinitiator und Tris(2-carboxyethyl)phosphin (TCEP)-Reduktionsmittel hergestellt. Halten Sie die LAP-Lösung von Licht fern.
- Die anderen Mikrogel-Vorläuferkomponenten werden durch Herstellung der jeweiligen 50 mM-Bestände an Dithiollinker und RGD-Peptid in sterilem destilliertem Wasser hergestellt. HA-NB abwiegen und im HEPES-Puffer auflösen, um eine 10 mg/ml Brühe herzustellen.
HINWEIS: Verschiedene Di-Thiol-Linker können je nach Benutzerpräferenz für die interne Vernetzung der Mikrogele verwendet werden. Sowohl ein abbaubarer (d. h. MMP-spaltbarer) als auch ein nicht abbaubarer (Dithiothreitol oder DTT) Linker wurden in der Materialtabelle aufgeführt. Das RGD-Peptid ist in der Mikrogelformulierung enthalten, um die Zelladhäsion in MAP-Gerüsten zu fördern, aber diese Komponente könnte entfernt und durch ein gleiches Volumen an HEPES-Puffer ersetzt werden. - Kombinieren Sie die Vorläuferkomponenten mit Endkonzentrationen von 9,9 mM LAP, 0,9375 mM TCEP (4 Thiol/TCEP), 2,8 mM Dithiollinker, 1 mM RGD-Peptid und 3,5 Gew.% (w/v) HA-NB, indem Sie zusätzlichen HEPES-Puffer hinzufügen, um das gewünschte Endvolumen zu erreichen. Mischen Sie den Vorläufer gut mit einer Verdrängungspipette.
- Ziehen Sie die gesamte Mischung langsam mit einer P1000-Pipette hoch. Legen Sie die Spitze auf das Ende einer 1-ml-Spritze und werfen Sie die Spitze aus der Pipette. Ziehen Sie den Spritzenkolben, um die Mischung in die Spritze zu laden, und fügen Sie dann einen 0,2-μm-Filter am Ende der Spritze hinzu und filtern Sie in ein neues 1,5-ml-Mikrozentrifugenröhrchen. Zentrifugieren Sie die gefilterte Vorläuferlösung, um die beim Filtrieren entstehenden Blasen zu entfernen.
- Ziehen Sie den gefilterten Vorläufer mit einer P1000-Pipette langsam nach oben und achten Sie darauf, keine Blasen zu erzeugen. Wenn Blasen vorhanden sind, klopfen Sie vorsichtig auf die Spitze, damit sie sich lösen und nach oben schweben.
- Legen Sie die Spitze auf das Ende einer 1-ml-Spritze und werfen Sie die Spitze aus der Pipette. Halten Sie die Spritze senkrecht und ziehen Sie den Spritzenkolben langsam, bis sich die gesamte Vorläuferlösung in der Spritze befindet. Fügen Sie der Spritze eine stumpfe Nadel hinzu und drücken Sie den Vorläufer durch die Nadelspitze. Wickeln Sie die Spritze in Folie, um sie vor Licht zu schützen.
- Herstellung von Mikrogel-Kneiflösung
- 5% v/v Span-80 in schwerem weißem Mineralöl zubereiten und gut mischen. Austrocknen, um Blasen zu entfernen. Halten Sie das Tensid-Öl-Gemisch bei Raumtemperatur in Folie eingewickelt. Gut mischen und vor jedem Gebrauch austrocknen.
- Verwenden Sie eine 5-ml-Spritze, um das Öl-Tensid-Gemisch aufzuziehen (Blasen minimieren), bis der Abstand zwischen Kolben und Fingergriff ungefähr dem Abstand der Vorläuferspritze entspricht. Fügen Sie der Spritze eine stumpfe Nadel hinzu und drücken Sie das Öl durch die Nadelspitze.
- Aufbau mikrofluidischer Bauelemente
- Eine stumpfe Nadel in eine 1-ml-Spritze geben und mit einer synthetischen hydrophoben Behandlungslösung füllen (siehe Materialtabelle). Lassen Sie die Lösung vorsichtig durch das mikrofluidische Gerät, bis sie sich an jedem Einlass / Auslass sammelt. Lassen Sie die Lösung im Gerät auf dem Tischgerät ca. 30 Minuten trocknen und ziehen Sie dann Vakuum am Auslass, um überschüssige Lösung zu entfernen. Sichern Sie das Gerät mit Klemmen an einem Tischmikroskop.
- Wickeln Sie ein 15-ml-konisches Röhrchen mit Folie ein und legen Sie es in ein Tubengestell, das als Mikrogel-Sammelbehälter dient. Verwenden Sie einen Ringständer mit einer Klemme, um die UV-Lichtsonde in die Öffnung des Sammelrohrs zu platzieren. Verwenden Sie einen UV-Detektor (siehe Materialtabelle), um die UV-Intensität zu messen, und bewegen Sie die Sonde, bis 20 mW/cm2 erreicht sind. Schalten Sie das UV-Licht erst später aus.
- Schneiden Sie den Schlauch in einer Länge, die vom mikrofluidischen Gerät bis zum Auffangbehälter reicht. Schneiden Sie an einem Ende des Schlauchs einen Winkel von 45°. Führen Sie das abgewinkelte Ende des Schlauchs vorsichtig in den Auslasskanal ein.
HINWEIS: Seien Sie vorsichtig, wenn Sie den Schlauch in das mikrofluidische Gerät einführen. Risse oder Risse um die Ein- oder Auslasskanäle können während der Mikrogelproduktion zu Leckagen führen. - Befestigen Sie sowohl die Vorläufer- als auch die Ölphasenspritze an einer Doppelspritzenpumpe (siehe Materialtabelle). Schneiden Sie zwei weitere Schlauchstücke in einer Länge, die von den Spritzenspitzen bis zum mikrofluidischen Gerät reicht. Schneiden Sie an einem Ende jeder Röhre einen Winkel von 45°. Befestigen Sie den Schlauch (stumpfes Ende) vorsichtig an beiden Spritzenspitzen.
- Ändern Sie die Einstellungen an der Pumpe für die 1-ml-Spritze und geben Sie das ungefähre Vorläufervolumen an. Schieben Sie die Pumpe langsam nach vorne, bis genügend Druck auf die Spritzenkolben ausgeübt wurde, um sowohl das Öl als auch den Vorläufer an die Enden des Schlauchs zu drücken und jegliche Luft aus dem System zu entfernen. Lassen Sie den Druck 5-10 Minuten ausgleichen, bevor Sie mit Schritt 2.4.6 fortfahren.
- Führen Sie das abgewinkelte Ende des Schlauchs vorsichtig in die Einlasskanäle des mikrofluidischen Geräts mit der Mikrogel-Vorläuferlösung im vorderen Einlass und dem Quetschöl im hinteren Einlass ein. Bewegen Sie die Pumpe in kleinen Schritten vorwärts, bis die Strömung im Gerät beginnt und sich im strömungsfokussierenden Bereich kugelförmige Mikrogele bilden. Starten Sie die Pumpe mit einer Durchflussrate von 0,4 μL/min und lassen Sie das Gerät laufen, bis es sich stabilisiert hat. Passen Sie bei Bedarf die Durchflussrate ±0,1 μL/min in kleinen Schritten an, um die Mikrogelproduktion zu stabilisieren.
- Sobald sich die Mikrogelproduktion stabilisiert hat, wie in Abbildung 1B gezeigt, ersetzen Sie das Sammelröhrchen durch ein neues Röhrchen und schalten Sie das UV-Licht ein. Überprüfen Sie den Lauf regelmäßig, um sicherzustellen, dass die Mikrogelproduktion über die Dauer des Laufs stabil ist.
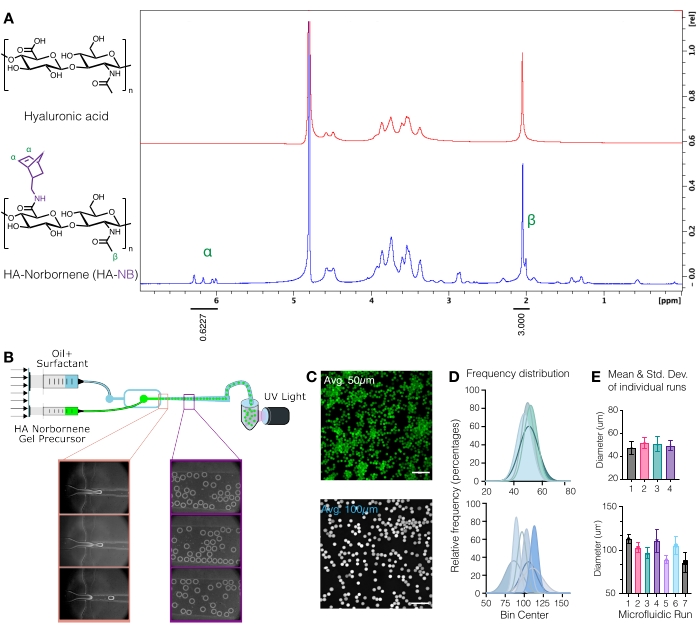
Abbildung 1: Mikrofluidische Herstellung von Hyaluronsäure (HA)-Mikrogelen mit Norbornen (NB)-Funktionsgriffen. (A) Etwa 31% der HA-Wiederholungseinheiten wurden erfolgreich mit NB modifiziert, wie durch Protonen-NMR-Analyse in Deuteriumoxid bestimmt. 1 H-NMR-Verschiebungen von abhängigen Norbornenen bei δ6,33 und δ6,02 (Vinylprotonen, Endo) und δ6,26 und δ6,23 ppm (Vinylprotonen, Exo) wurden mit der HA-Methylgruppe δ2,05 ppm verglichen, um die Funktionalisierung zu bestimmen. Nachdruck von Anderson et al.12 mit Genehmigung von Elsevier. (B) Schematische Darstellung der strömungsfokussierenden mikrofluidischen Vorrichtung, die zur Erzeugung von HA-NB-μgelen verwendet wird. (C) Maximalintensitätsprojektionen aus der konfokalen Mikroskopie wurden verwendet, um fluoreszierend markierte μgele sichtbar zu machen (Maßstabsbalken = 500 μm). (D) Häufigkeitsverteilungen des Mikrogeldurchmessers aus unabhängigen Durchläufen des mikrofluidischen Aufbaus zeigen die Kontrolle über die Mikrogelgröße ~ 50 μm oder ~ 100 μm je nach verwendetem Gerät. (E) Der Mikrogeldurchmesser wird als Mittelwert und Standardabweichung für jeden unabhängigen Durchlauf angegeben. Nachdruck von Wilson et al.9 mit Genehmigung von Wiley. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Reinigung und Trocknung von Mikrogelen
- Reinigung von Mikrogelen
- Bereiten Sie den Mikrogel-Waschpuffer (300 mM HEPES, 50 mM NaCl, 50 mM CaCl2) sowie die 2%ige (w/v) Pluronic F-127 Tensidlösung in Waschpuff vor. Sterilisieren Sie die Lösungen mit einem 0,2 μm vakuumbetriebenen Filter.
- Zentrifugieren Sie das Mikrogel-Sammelröhrchen (5.000 x g) für 5 min. In einer sterilen Haube die überstehende Ölphase vorsichtig absaugen. Kombinieren Sie die μgele 1:1 mit 2% Pluronic F-127 Tensidlösung und Wirbel, um gut zu mischen. Zentrifugieren (5.000 x g) für 5 min und Absaugen der überstehenden Waschlösung.
- Fügen Sie Waschpuffer bei 4x Mikrogelvolumen und Wirbel hinzu, um gut zu mischen. Zentrifugieren (5.000 x g) der Mischung für 5 min und Absaugen der Waschlösung. Komplette 4-8 Wäschen mit dem Waschpuffer, bis das Tensid aus dem System entfernt ist (d.h. es bleiben keine Blasen zurück).
- Fluoreszierende Markierung von HA-NB-Mikrogelen
HINWEIS:Die interne Synthese eines fluoreszenzmarkierten Tetrazins beruht auf zwei basenkatalysierten Thiol-Michael-Additionsreaktionen in Serie, die gut beschrieben und zuvor berichtet wurden3. Für diese Arbeit wurde Alexa Fluor-488 mit Tetrazin zur Markierung von Norbornen-modifizierten μgelen konjugiert. Das lyophilisierte Produkt (Alexa Flour 488-Tet) wurde in Dimethylformamid bei 1 mg/ml gelöst und bei -20 °C gelagert.- Um die μgele fluoreszierend zu markieren, bereiten Sie zunächst eine Arbeitslösung von Alexa Fluor 488-Tet vor, indem Sie die 1 mg/ml Brühe 1:14 in sterilem 1x PBS verdünnen. In einer sterilen Haube die μgele mit der Arbeitslösung (2:1 Vol.) vermischen.
- Verwenden Sie eine Verdrängungspipette und mischen Sie gut. Die Mischung 1 h bei Raumtemperatur oder über Nacht bei 4 °C inkubieren.
- Zentrifugieren (5.000 x g) und Absaugen der Färbelösung. Waschen Sie die μgels zweimal mit 1x PBS (1:1 nach Volumen), um das nicht reagierte Alexa Fluor 488-Tet zu entfernen.
HINWEIS: Zu diesem Zeitpunkt können die fluoreszierend markierten μgele auf einem konfokalen Mikroskop abgebildet werden, um die Mikrogelgröße zu quantifizieren (Abbildung 1C-E)9. Methoden zur Messung der Mikrogelgröße wurden von Roosa et al.17 ausführlich beschrieben.
- Trocknen von HA-NB-Mikrogelen
- Gereinigte μgele (Abbildung 2A) werden mit einer Verdrängerpipette in ein kryosicheres Schraubverschlussrohr überführt. Fügen Sie 70% Ethanol zu den gereinigten μgels 50% (v / v) hinzu und mischen Sie gut mit einer Verdrängungspipette. 5 min bei 5.000 x g zentrifugieren.
ACHTUNG: Ethanol ist ein leicht entzündlicher Stoff.
HINWEIS: Das kryosichere Schraubverschlussrohr kann vor der Zugabe von μgelen gewogen und nach der Lyophilisation erneut gewogen werden, um die Masse der μgele zu bestimmen. Dies wird empfohlen, um Fehler bei der Verwendung von Mengen unter 1 mg zu minimieren. Stellen Sie sicher, dass die Waage vor der Verwendung intern eingestellt oder kalibriert ist. - Die überstehende Flüssigkeit wird abgesaugt und durch 70 % Ethanol (50 % v/v) ersetzt (Abbildung 2B). Gut mit einer Verdrängerpipette mischen. Über Nacht bei 4 °C inkubieren.
HINWEIS: Mikrogele können vor der Lyophilisation in 70% Ethanol bei 4 °C gelagert werden, um sie bei Bedarf langfristig zu lagern. Lyophilisierte Mikrogele sind in Abbildung 2C dargestellt. Andere Lyophilisationsmedien können in diesem Schritt verwendet werden, wenn Kryogelbildung gewünscht wird (Abbildung 2D). - Zentrifugieren Sie kurz, um sicherzustellen, dass sich die μgele am Boden des Schraubverschlussröhrchens befinden. Fügen Sie flüssigen Stickstoff in einen kryogenen Behälter hinzu und fügen Sie dann die Tube μgels zum Einfrieren hinzu.
- Nach 5-10 min das μgel-Röhrchen mit einer Pinzette entfernen. Entfernen Sie schnell die Kappe und decken Sie sie mit einem Labortuch ab. Sichern Sie das Gewebe mit einem Gummiband und übertragen Sie es in einen Gefriertrocknungsbehälter oder eine Kammer.
- Laden Sie die Probe gemäß den Anweisungen des Herstellers auf den Gefriertrockner. Lyophilisieren bei 0,066 Torr und -63 °C. Lagern Sie die lyophilisierten μgele (Lyo-μgele) dicht verschlossen bei Raumtemperatur.
HINWEIS: Die Lyophilisierung ist abgeschlossen, wenn die gesamte Flüssigkeit aus dem Röhrchen entfernt wurde und ein getrocknetes Produkt zurückbleibt. Organische Lösungsmittel können die Langlebigkeit der Gummibefestigungen auf herkömmlichen Lyophilisationssystemen verringern.
- Gereinigte μgele (Abbildung 2A) werden mit einer Verdrängerpipette in ein kryosicheres Schraubverschlussrohr überführt. Fügen Sie 70% Ethanol zu den gereinigten μgels 50% (v / v) hinzu und mischen Sie gut mit einer Verdrängungspipette. 5 min bei 5.000 x g zentrifugieren.
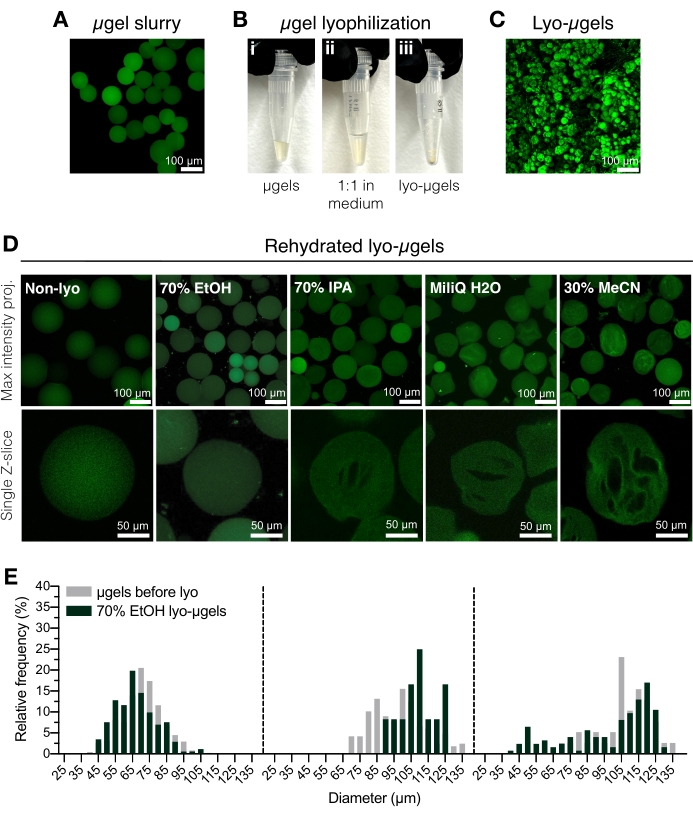
Abbildung 2: Trocknen von HA-NB-Mikrogelen. (A) Projektion der maximalen Intensität von μgelen in wässriger Lösung (Maßstabsbalken = 100 μm). (B) Gereinigte μgele können 1:1 Vol.-1 in dem Lyophilisationsmedium ihrer Wahl inkubiert und lyophilisiert werden. (C) Projektion mit maximaler Intensität von getrockneten Lyo-μgelen (Maßstabsbalken = 100 μm). (D) Mikrogele werden nach der Lyophilisation resuspendiert. EtOH (70%) wird empfohlen, um die ursprünglichen Eigenschaften der μgele während des gesamten Lyophilisierungsprozesses beizubehalten; andere Medien wie Isopropylalkohol (IPA), Wasser und Acetonitril (MeCN) können jedoch austauschbar verwendet werden, um die Kryogelbildung zu erleichtern (Skalenbalken = 100 oder 50 μm wie angegeben). (E) Messung des HA-NB-Mikrogeldurchmessers vor (grau) und nach Lyophilisation (grün) in 70% EtOH als Häufigkeitsverteilungen für drei Mikrogelpopulationen. Nachdruck von Anderson et al.12 mit Genehmigung von Elsevier. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
4. MAP-Gerüstherstellung
- Tetrazin-Linker-Synthese
HINWEIS: Tetrazin-Linker können verwendet werden, um μgele mit freien Norbornengruppen miteinander zu verbinden (Abbildung 3A). Das HA-Tetrazin (HA-Tet)-Syntheseverfahren wurde von Zhang et al.18 unter Verwendung von 79 kDa Natrium-HA mit molaren Äquivalenten von 1:1:0,25 HA-Wiederholungseinheiten zu DMTMM zu Tetrazinamin adaptiert (Abbildung 3B)12.- Wiegen Sie die Reaktanten. Das HA wird bei 20 mg/ml in 200 mM MES-Puffer (pH ~6) durch Einrühren in einem Becherglas oder Kolben auf einer Rührplatte gelöst. Nach dem Auflösen das DMTMM in die HA-Lösung geben und ca. 20 min bei Raumtemperatur einwirken lassen. Beispielsweise können 100 mg HA + 72,8 mg DMTMM + 14,14 mg Tetrazinamin verwendet werden.
- Das Tetrazinamin wird bei 15 mg/ml in 200 mM MES-Puffer gelöst und tropfenweise in die HA/DMTMM-Lösung gegeben. Siehe Abbildung 3C für den HA-Tet-Reaktionsaufbau.
- Fügen Sie Parafilm zur Öffnung des Reaktionsgefäßes hinzu, um die Verdunstung zu minimieren, und bedecken Sie das Reaktionsgefäß mit Folie. Rühren Sie weiter, während die Reaktion für ca. 24 h fortgesetzt wird.
- Nach 24 h 200 Proof Ethanol (ca. 10x des Reaktionsvolumens) kühlen. Auf einer Rührplatte die Reaktion tropfenweise auf das gekühlte Ethanol übertragen, um das HA-Tet auszufällen (Abbildung 3D), und 20 min weiter rühren.
- Die Lösung in 50 ml konische Röhrchen geben und dann bei 5.000 x g für 10 min zentrifugieren. Gießen Sie das überschüssige Ethanol ab, um es als Abfall zu entsorgen. Ziehen Sie Vakuum auf dem HA-Tet in einem Exsikkator, um über Nacht zu trocknen. Ein Beispiel für das getrocknete Produkt bei diesem Schritt im Protokoll ist in Abbildung 3E zu finden.
- Reinigen Sie das HA-Tet mittels Dialyse. HA-Tet wird in 2 M NaCl-Lösung gelöst und mit einem Molekulargewichtsschnitt von 12-14 kDa in einen Zellulosedialyseschlauch überführt. Füllen Sie den gefüllten Dialyseschlauch in einen Eimer mit 5 L Reinstwasser und dialysieren Sie das HA-Tet über Nacht gegen Wasser.
- Am nächsten Tag das Wasser entfernen und für 30 min durch 1 M NaCl-Lösung ersetzen. Entfernen Sie die NaCl-Lösung und dialysieren Sie dann 3 Tage lang gegen Reinstwasser, wobei Sie das Wasser täglich ersetzen.
- Filtern Sie das dialysierte Produkt mit einem 0,2 μm vakuumbetriebenen Filter und überführen Sie dann das gefilterte HA-Tet-Produkt in 50 ml konische Röhrchen.
- Die konischen Röhrchen 10 min lang in flüssigem Stickstoff einfrieren und dann die konischen Rohre mit einer Pinzette entfernen. Entfernen Sie schnell die Kappe und decken Sie sie mit einem Labortuch ab. Sichern Sie das Gewebe mit einem Gummiband und übertragen Sie es in einen Gefriertrocknungsbehälter oder eine Gefrierkammer und lyophilisieren. Lagern Sie das lyophilisierte Produkt (Abbildung 3F) bei -20 °C.
- Quantifizierung der Tetrazinmodifikation durch Auflösen des HA-Tet bei 10 mg/ml inD2Ound Analyse mittels Protonen-NMR (Abbildung 3G)16.
- Um den Grad der Funktionalisierung zu bestimmen, kalibrieren Sie zunächstden D2O-Lösungsmittelpeak auf 4,8 ppm. Integrieren Sie den Peak für die HA-Methylprotonen (δ2.05) und kalibrieren Sie die Integration auf 3.0. Als nächstes integrieren Sie die Peaks für die hängenden Tetrazingruppen bei δ8,5 (2H) und δ7,7 (2H) (aromatische Protonen). Normalisieren Sie die Integration dieser Peaks auf die entsprechende Anzahl von Protonen, um den durchschnittlichen Grad der Modifikationzu bestimmen 12.
- Verkettung von Lyo-μgelen zu MAP-Gerüsten zur Charakterisierung
- Bereiten Sie die MAP-Gerüstkomponenten vor (z. B. μgele, HA-Tet, Rehydratationsvolumen). Die Lyo-μgele werden gewogen (Abbildung 4A) und 84 % des endgültigen MAP-Volumens von 1x PBS rekonstituiert. Lassen Sie die Mikrogele ca. 20 min quellen (Abbildung 4B,C). Der für die Rehydratation verwendete Gew.-% MAP kann basierend auf der Präferenz des Benutzers für die endgültige Partikelfraktion gewählt werden (siehe Abbildung 4D, E).
- Lösen Sie das HA-Tet in 1x PBS bei der gewählten Konzentration auf (siehe HINWEIS unten).
HINWEIS: Die Änderung sowohl der Packungsfraktion (über Gew.-% MAP) als auch der Konzentration von HA-Tet verändert die mechanischen Eigenschaften des Gerüstes. Zum Beispiel erzeugt ein 3,4 Gew.-% MAP-Gerüst, vernetzt mit 0,02 mg/ml HA-Tet (Glühverhältnis von 2,6 mol Tet:mol HA-NB), MAP-Gerüste mit ca. 700 Pa Schubspeichermodul12. - Verwenden Sie eine Verdrängungspipette, um HA-Tet und Lyo-μgele zu kombinieren und gut zu mischen. An dieser Stelle kann das Gemisch per Verdrängungspipette auf Glasobjektträger, Vertiefungsplatten oder einen Behälter nach Wahl des Anwenders übertragen werden. Lassen Sie μgels 25 min bei 37 °C glühen und geben Sie dann die MAP-Gerüste mit einem Spatel auf mit 1x PBS gefüllte Vertiefungsplatten. Halten Sie MAP-Gerüste in 1x PBS, bis sie für die Charakterisierung bereit sind.
- Berechnung des MAP-Gerüstpartikelanteils
- Um die Bildqualität zu verbessern, übertragen Sie das MAP-Gerüst mit einem Spatel auf ein Glasdeckglas. Bild MAP-Gerüste auf einem konfokalen Mikroskop mit dem Laser für FITC-Anregung und Emission. Bild-MAP-Gerüste auf einem 20x-Objektiv und erhalten einen Z-Stack, der 250-300 μm in Z-Richtung mit einer Schrittweite von 2,5 μm durchläuft. Notieren Sie sich die μm/Pixel-Kalibrierung des Bildes.
- Importieren Sie das Z-Stack-Bild in die Analysesoftware (siehe Materialtabelle). Klicken Sie auf die Schaltfläche Neue Flächen hinzufügen . Aktivieren Sie das Kontrollkästchen Nur eine Region von Interesse segmentieren, und wählen Sie dann die blaue Pfeilschaltfläche Weiter: Region von Interesse aus.
- Definieren Sie einen Bereich von Interesse und verfolgen Sie die X-, Y- und Z-Dimensionen des analysierten Volumens. Wählen Sie die blaue Pfeilschaltfläche Weiter: Quellkanal aus.
HINWEIS: X- und Y-Dimensionen werden in Pixeleinheiten angegeben, während die Z-Dimension die Anzahl der Schritte ist. Eine empfohlene Z-Höhe für den interessierenden Bereich sollte mindestens zwei μgele enthalten. - Verwenden Sie die Dropdown-Liste Quellkanal , um den FITC-Kanal auszuwählen. Aktivieren Sie das Kontrollkästchen neben Glatt und geben Sie ein Oberflächendetail von 2,50 μm ein. Wählen Sie unter Schwellenwert die Option Absolute Intensität und dann die blaue Pfeilschaltfläche Weiter: Schwellenwert aus.
- Verwenden Sie den vorgeschlagenen Schwellenwert für den FITC-Kanal. Drehen Sie die 3D-Projektion, um die Rendering-Qualität zu beurteilen und nach Bedarf anzupassen. Wählen Sie Weiter: Flächen klassifizieren.
HINWEIS: Die Schaltfläche Zurück kann verwendet werden, um vorherige Schritte im Prozess, z. B. Z-Dimension, nach Bedarf zu bearbeiten. - Überprüfen Sie, ob Anzahl der Voxel 10,0 ist, und wählen Sie dann den grünen Doppelpfeil Fertig stellen: Führen Sie alle Erstellungsschritte aus und beenden Sie den Assistenten.
HINWEIS: Volume-Rendering-Parameter können für die Batch-Analyse gespeichert werden, sodass dieselben Einstellungen angewendet werden, um alle Gerüste zu analysieren. - Um die Daten zu exportieren, wählen Sie die Registerkarte Statistik und dann die Registerkarte Detailliert aus. Verwenden Sie das zweite Dropdown-Feld, um die Variable Volume auszuwählen. Wählen Sie die Diskettenschaltfläche Statistiken exportieren auf der Registerkarte Anzeige in Datei und speichern Sie sie als Tabellenkalkulationsdatei (.xls), wenn Sie dazu aufgefordert werden.
- Öffnen Sie die Datei und verwenden Sie die Funktion SUMME in Spalte A Volumen , um das Gesamtvolumen (μm3) der μgele im interessierenden Bereich zu bestimmen.
- Konvertieren Sie die Dimensionen des analysierten Bereichs von Pixel in μm. Verwenden Sie die μm/Pixel-Kalibrierung des Bildes aus Schritt 4.3.1, um die X- und Y-Dimensionen umzurechnen. Multiplizieren Sie die Z-Dimension (Anzahl der Schritte) mit der Schrittgröße für das Bild, um die Z-Dimension in μm umzuwandeln. Berechnen Sie das Volumen des interessierenden Bereichs (μm3), indem Sie die X-, Y- und Z-Dimensionen multiplizieren.
- Um den Partikelanteil des Gerüsts zu bestimmen, dividieren Sie das Gesamtvolumen der μgele im interessierenden Bereich (gefunden in Schritt 4.3.8) durch das Volumen des interessierenden Bereichs (gefunden in Schritt 4.3.9).
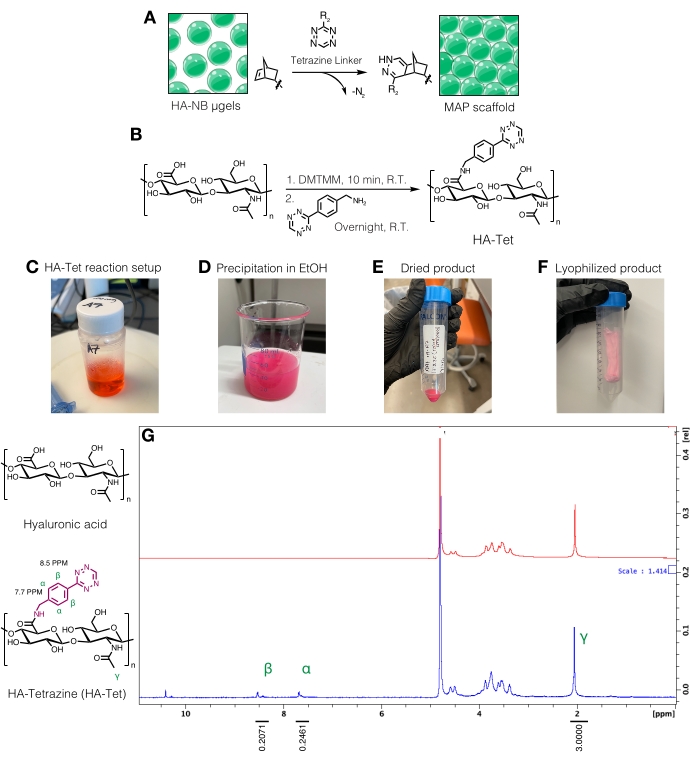
Abbildung 3: Synthese von Tetrazin-Linkern zur Herstellung von mikroporösen geglühten Partikeln (MAP)-Gerüsten. (A) Schematische Darstellung von HA-NB-μgelen, die mit einem Tetrazin-Linker zu MAP-Gerüsten verkettet werden. (B) Reaktionsschema für die HA-Tet-Synthese. (C) Die HA-Tet-Reaktion wurde aufgebaut und über Nacht reagieren gelassen, gefolgt von (D) Fällung von HA-Tet in Ethanol. (E) Nach der Reinigung und Trocknung wurde das HA-Tet rehydriert und lyophilisiert, um (F) ein getrocknetes, hellrosa Produkt zu erhalten. (G) Die Protonen-NMR-Analyse zeigt eine erfolgreiche Modifikation von 11% der HA-Wiederholungseinheiten. Nachdruck von Anderson et al.12 mit Genehmigung von Elsevier. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
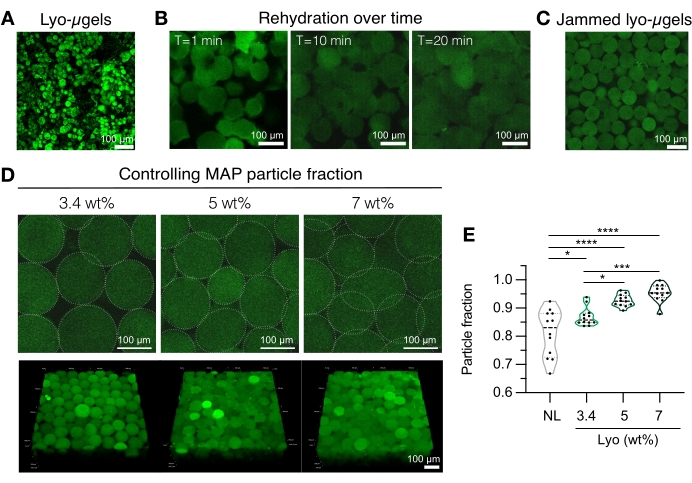
Abbildung 4: Rehydratation von lyophilisierten Mikrogelen für die Herstellung von MAP-Gerüsten. (A) Projektion mit maximaler Intensität von getrockneten Lyo-μgelen (Maßstabsbalken = 100 μm). (B) Nach der Gefriertrocknung dauert die Rehydratation von Lyo-μgelen ca. 20 min (Maßstabsbalken = 100 μm). (C) Lyo-μgele können bei variierendem Gew.-% MAP rehydriert werden, um verklemmte μgele herzustellen (Maßstabsbalken = 100 μm). (D) Die Erhöhung des Gew.-%-MAP beim Rehydratisieren von Lyo-μgelen verändert die Partikelfraktion in MAP-Gerüsten, wie einzelne Z-Scheiben von MAP-Gerüsten und Volumenprojektionen zeigen (Maßstabsbalken = 100 μm). (E) Mit diesen benutzerdefinierten wt% MAP-Gerüsten können eindeutige Partikelfraktionen erzielt werden (NL = non-lyophilized μgels). Eine Einweg-ANOVA mit Tukey HSD wurde an den Proben (n = 3) durchgeführt, wobei die Signifikanz bei p < 0,05 (*), p < 0,01 (**), p < 0,005 (***) und p < 0,001 (****) angegeben wurde. Nachdruck von Anderson et al.12 mit Genehmigung von Elsevier. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
5.3D Zellkultur in Kartengerüsten
- Zellkulturgeräte vorbereiten
- Um ein benutzerdefiniertes Zellkulturgerät für diese Experimente zu erstellen (Abbildung 5A-C), verwenden Sie einen 3D-Drucker, um eine Negativform mit der CAD-Datei in Supplemental Coding File 1 zu drucken.
HINWEIS: Die Abmessungen des Zellkulturgeräts sind wie folgt: 94,9 mm x 94,9 mm x 4,8 mm mit 2,6 mm Gesamtbrunnenhöhe. Der Durchmesser der inneren und äußeren Vertiefungen beträgt 4 mm bzw. 6 mm. - Mischen Sie Polydimethylsiloxan (PDMS)-Elastomerbasis mit dem Härter im Massenverhältnis 10:1. Gießen Sie die PDMS-Mischung in eine große Kunststoff-Petrischale und entgasen Sie in einem Exsikkator für ca. 30 min oder bis alle Blasen verschwunden sind.
- Sobald alle Blasen verschwunden sind, platzieren Sie die 3D-gedruckte Form vorsichtig in das PDMS, um die Bildung neuer Blasen zu minimieren. Für mindestens 2 h bei 60 °C in den Ofen stellen, um das PDMS auszuhärten.
- Verwenden Sie ein Messer oder eine Rasierklinge, um den Parameter des Kulturgeräts vorsichtig zu verfolgen, und entfernen Sie dann vorsichtig die Form. Verwenden Sie einen 4-mm-Biopsiestempel, um PDMS vom Boden der Vertiefungen zu entfernen. Schneiden Sie die Geräte so, dass sie auf ein Glasdeckglas passen.
HINWEIS: Zellkulturgeräte können auch mit Glasobjektträgern verbunden werden, aber Glasdeckgläser verbessern die Probenbildgebung. - Verwenden Sie Klebeband, um Staub von der Unterseite der Kulturgeräte zu entfernen. Die sauberen Glasdeckgläser und Kulturgeräte (von unten nach oben) für mindestens 15 min auf eine Heizplatte bei 135 °C stellen, um Feuchtigkeit zu entfernen.
- Verwenden Sie in einem Abzug eine Corona-Plasmapistole hoch oben auf dem Glasdeckglas und der Unterseite des Geräts für 30 s und verbinden Sie dann schnell die behandelten Oberflächen miteinander. Üben Sie vorsichtig Druck aus, um eine gute Abdichtung zwischen dem Kulturgerät und dem Glasdeckglas zu gewährleisten.
- Wiederholen Sie Schritt 5.1.6 für alle Geräte und legen Sie ihn über Nacht in einen 60-°C-Ofen, um die Verbindung zu sichern. Autoklavieren Sie die Geräte, um sie vor der Verwendung in vitro zu sterilisieren.
- Um ein benutzerdefiniertes Zellkulturgerät für diese Experimente zu erstellen (Abbildung 5A-C), verwenden Sie einen 3D-Drucker, um eine Negativform mit der CAD-Datei in Supplemental Coding File 1 zu drucken.
- Zellkultur in MAP-Gerüsten
- Bereiten Sie die MAP-Gerüstkomponenten (d. h. μgele, HA-Tet, Medienvolumen) basierend auf der gewünschten Partikelfraktion vor (siehe Abbildung 4D-E). Die Lyo-μgele werden in einer sterilen Haube gewogen und in 84% des endgültigen MAP-Volumens der Zellmedien basierend auf dem gewählten Gew.-% MAP rekonstituiert. Lassen Sie die μgele ca. 20 min aufquellen.
HINWEIS: Bei diesen Methoden muss der Benutzer das Lyo-Mikrogel-Produkt zur Rehydratation wiegen. Bei kleinen Massen (1 mg oder weniger) wird empfohlen, zuerst das Kryoröhrchen zu wiegen, bevor μgele hinzugefügt und lyophilisiert werden, und dann das Röhrchen nach der Lyophilisation erneut zu wiegen, um die Masse des Produkts zu bestimmen und Fehler zu minimieren. - Das HA-Tet wird in Zellmedien in 16% des endgültigen MAP-Volumens gelöst.
HINWEIS: Die folgenden Schritte zum Vorbereiten von Zellen für die Aussaat in MAP-Gerüsten können je nach verwendetem Zelltyp geändert werden. In diesem Protokoll wurden mesenchymale D1-Mauszellen in Dulbeccos modifiziertem Adlermedium (DMEM) gezüchtet, ergänzt mit 1% Penicillin-Streptomycin (Pen-Streptokokken) und 10% fetalem Rinderserum (FBS) (siehe Materialtabelle). Für diese Zellen sollten die standardmäßigen Zellkulturprotokolle befolgt werden, wobei die Kulturen bei 37 °C und 5%CO2 in mit Gewebekulturen behandelten Kulturgefäßen gehalten werden sollten. - Sobald die mesenchymalen Zellen der D1-Maus 70%-80% Konfluenz erreicht haben, saugen Sie die Medien ab und waschen Sie die Zellen mit 1x PBS. Heben Sie die Zellen an, indem Sie genügend Volumen von 1% Trypsin-EDTA hinzufügen, um die Oberfläche des Gewebekulturgefäßes zu bedecken. Inkubieren Sie bei 37 °C für 1-3 min und löschen Sie dann die Trypsinisierung durch Zugabe von DMEM-Medien, ergänzt mit 1% Pen-Streptokokken und 10% FBS bei 2x dem Volumen von Trypsin-EDTA.
- Zentrifugieren Sie die Zellsuspension bei 100 x g für 5 min bei Raumtemperatur, um die Zellen zu pelletieren. Asspirieren Sie das überstehende Medium und resuspendieren Sie die Zellen in 1 ml DMEM-Medien, ergänzt mit 1% Pen-Streptokokken und 10% FBS.
- Stellen Sie sicher, dass die Zellsuspension gut gemischt ist, und geben Sie dann 20 μL in ein neues Mikrozentrifugenröhrchen. Fügen Sie 20 μL Trypanblau-Lösung hinzu und mischen Sie gut. Verwenden Sie 20 μL dieser Mischung, um die Zellen entweder mit einem Hämozytometer oder einem automatisierten Zellzähler mit Zellzählkammerobjektträgern zu zählen.
- Übertragen Sie die Anzahl der Zellen, die für die Aussaat von 10.000 Zellen/μL MAP benötigt werden, in ein neues Mikrozentrifugenröhrchen. Zentrifugieren bei 100 x g für 5 min bei Raumtemperatur, um die Zellen zu pelletieren. Saugen Sie die überstehenden Medien vorsichtig aus dem Zellpellet ab, ohne die Zellen anzusaugen.
- Fügen Sie die μgele und den Vernetzer mit einer Verdrängungspipette zum Zellpellet hinzu. Gut mit einer Verdrängungspipette mischen und dann 10 μL der Mischung pro Vertiefung aussäen. Pipettieren Sie beim Galvanisieren in kreisenden Bewegungen, um die Mischung gleichmäßig im Vertiefung zu verteilen.
- Lassen Sie die μgele 25 Minuten lang bei 37 °C im Zellinkubator glühen, bevor Sie Zellmedien hinzufügen, um die Vertiefungen zu füllen (~ 50 μL Medien pro Vertiefung). Pflegen Sie die 3D-Kulturen bei 37 °C und wechseln Sie die Medien nach Bedarf. Um eine Ansaugung des Gerüsts beim Medienwechsel zu vermeiden, stabilisieren Sie die Pipettenspitze entlang des Kamms der oberen Vertiefung.
HINWEIS: Wenn Sie Flüssigkeit aus den Kulturmulden hinzufügen oder entfernen, legen Sie das Ende der Pipettenspitze auf den Sims über dem MAP-Gerüst, um die Wahrscheinlichkeit zu minimieren, dass das Gerüst aus dem Bohrloch gestört oder angesaugt wird. - Zu den gewünschten Zeitpunkten fixieren Sie Proben, indem Sie das Medium entfernen und 50 μL 4% Paraformaldehyd pro Vertiefung für 30 Minuten bei Raumtemperatur hinzufügen. Waschen Sie die Proben 3x mit 50 μL 1x PBS oder bevorzugtem Puffer. An diesem Punkt des Protokolls können Standardmethoden für Immunfluoreszenz oder Fluoreszenzfärbung befolgt werden, wobei 50 μL pro Arbeitsvolumen verwendet werden.
HINWEIS: Diese Methoden zur Fixierung und Zellfärbung beschreiben speziell die Verwendung von fluoreszierenden Färbungen; Eine Immunfärbung mit primären und/oder sekundären Antikörperkonjugationen kann jedoch auch in diesen Gerüsten durchgeführt werden, wobei die Anweisungen des Herstellers 50 μL als Arbeitsvolumen pro Vertiefung verwenden. - Bilden Sie Zellen in MAP-Gerüsten auf einem konfokalen Mikroskop mit einem 20x-Objektiv und erhalten Sie einen Z-Stack, der 200-250 μm in Z-Richtung mit einer Schrittweite von 2,5 μm durchläuft. Ein Beispiel für eine Fluoreszenzfärbung mit DAPI (Kernfärbung verdünnt 1:1000 in 0,15% Triton-X in 1x PBS) und Phalloidin-647 (F-Aktin-Färbung verdünnt 1:40 in 0,15% Triton-X in 1x PBS) ist in Abbildung 5E, F mit festen D1-Zellen gezeigt, die 3 Tage lang in MAP-Gerüsten kultiviert wurden.
HINWEIS: Die Plasmabehandlung von Glasoberflächen führt zu einer erhöhten Hydrophilie, die nachweislich die Zelladhäsion verbessert. Es wird wahrscheinlich beobachtet, dass sich Zellen entlang des Bodens der Zellkulturmulden ausbreiten, sollten jedoch nicht in die Zellzählung oder Zellvolumenquantifizierung zur Beurteilung der Zellantwort in MAP-Gerüsten einbezogen werden.
- Bereiten Sie die MAP-Gerüstkomponenten (d. h. μgele, HA-Tet, Medienvolumen) basierend auf der gewünschten Partikelfraktion vor (siehe Abbildung 4D-E). Die Lyo-μgele werden in einer sterilen Haube gewogen und in 84% des endgültigen MAP-Volumens der Zellmedien basierend auf dem gewählten Gew.-% MAP rekonstituiert. Lassen Sie die μgele ca. 20 min aufquellen.
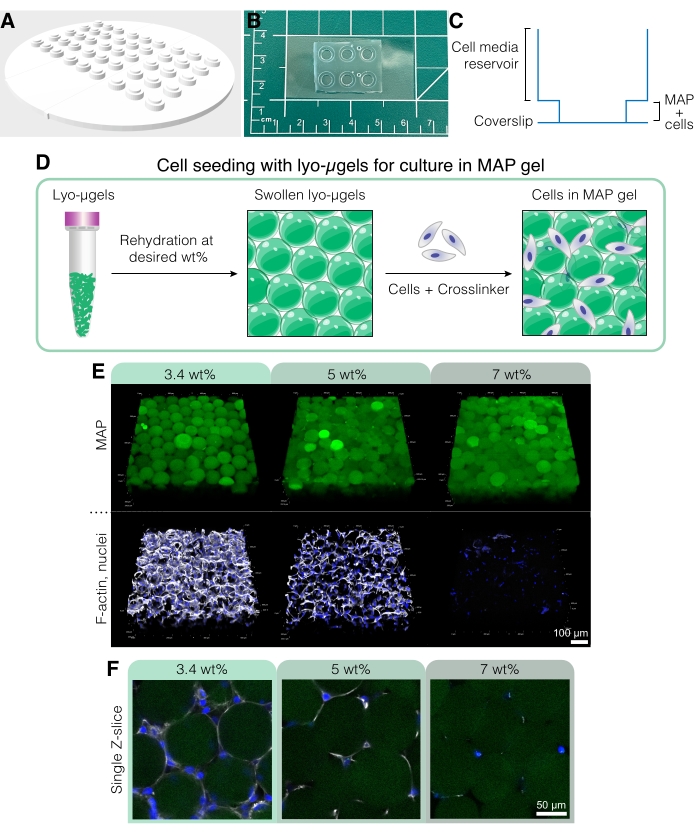
Abbildung 5: Zellkultur in MAP-Gerüsten. (A) Die Form zur Herstellung von Zellkulturtöpfen kann in 3D gedruckt und mit PDMS gegossen werden. Die gesamte Form hat einen Durchmesser von 95 mm, die großen Vertiefungen einen Durchmesser von 6 mm und die kleinen inneren Vertiefungen einen Durchmesser von 4 mm. (B) Nach dem Gießen mit PDMS werden die Zellkulturgeräte mit Deckgläsern plasmagebunden, um die Mikroskopiefähigkeiten zu verbessern. (C) Der Querschnitt einer Zellkulturmulde zeigt das Reservoir für Zellmedien (~50 μL) und ein kleineres Reservoir für die Aussaat von MAP-Gerüsten mit Zellen (~10 μL). (D) Der Prozess der Aussaat von Zellen in MAP-Gerüsten beruht zunächst auf der Rehydratation von Lyo-μgelen im gewünschten Gew.-%, gefolgt von der Mischung mit Zellen und dem Vernetzer zur Verkettung der μgele. (E) Zellen können in MAP-Gerüsten (grün) mit variiertem Gew.-% MAP verkapselt werden. Repräsentative Bilder stammen vom 5. Tag der D1-Zellkultur in MAP-Gerüsten (Maßstabsbalken = 100 μm). (F) Einzelne Z-Schnitte zeigen Unterschiede im Zellwachstum in Gerüsten mit unterschiedlichem Gew.-% MAP (Maßstabsbalken = 50 μm). Nachdruck von Anderson et al.12 mit Genehmigung von Elsevier. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
Ziel dieses Protokolls ist es, die Herstellung von mikroporösen geglühten Partikeln (MAP)-Gerüsten mit einem bioorthogonalen Vernetzungsschema sowie kontrollierten Partikelfraktionen für die 3D-Zellkultur zu demonstrieren. Zunächst wurde HA mit Norbornen-Anhängergruppen modifiziert, um sowohl bei der Mikrogelbildung als auch bei der Verkettung zu MAP-Gerüsten verwendet zu werden. Mit diesen Methoden wurden etwa 31% der HA-Wiederholungseinheiten erfolgreich mit einem Norbornen-Funktionsgriff modifiziert (
Diskussion
Die mikrofluidische Herstellung von HA-NB-Mikrogelen erzeugt nachweislich Mikrogele mit einem engeren Größenverteilungsbereich als dieEmulsionschargenproduktion 3,9. Die in diesem Protokoll beschriebenen Mikrogele wurden unter Verwendung eines MMP-spaltbaren Vernetzers (Ac-GCRDGPQGIWGQDRCG-NH2) formuliert, um den Materialabbau zu unterstützen. HA-NB-Mikrogele können jedoch auch mit einem alternativen Dithiol-Linker wie Dithiothreitol (DTT) vernetz...
Offenlegungen
ARA und TS haben ein vorläufiges Patent auf diese Technologie angemeldet.
Danksagungen
Die Autoren danken den National Institutes of Health, den National Institutes of Neurological Disorders and Stroke (1R01NS112940, 1R01NS079691, R01NS094599) und dem National Institute of Allergy and Infectious Disease (1R01AI152568). Diese Arbeit wurde zum Teil an der Duke University Shared Materials Instrumentation Facility (SMIF) durchgeführt, einem Mitglied des North Carolina Research Triangle Nanotechnology Network (RTNN), das von der National Science Foundation (Preisnummer ECCS-2025064) als Teil der National Nanotechnology Coordinated Infrastructure (NNCI) unterstützt wird. Die Autoren danken dem ehemaligen Postdoc des Labors, Dr. Lucas Schirmer, sowie Ethan Nicklow für ihre Unterstützung bei der Erstellung des 3D-gedruckten Geräts für Zellkulturexperimente.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL Luer-Lok syringe sterile, single use, polycarbonate | BD | 309628 | |
| 5 mL Luer-Lok syringe sterile, single use, polycarbonate | BD | 309646 | |
| Alexa Fluor 488 C5 maleimide | Invitrogen | A10254 | For synthesis of fluorescently-labeled tetrazine |
| Alexa Fluor 647 Phalloidin | Invitrogen | A22287 | For staining cell culture samples |
| Aluminum foil | VWR | 89107-726 | |
| Biopsy punch with plunger, 1.0 mm | Integra Miltex | 69031-01 | |
| Biopsy punch, 4 mm | Integra Miltex | 33-34 | |
| Blunt needle, 23 G 0.5", Non-Sterile, Capped | SAI Infusion Technologies | B23-50 | |
| Bottle-top vacuum filter, 0.22 μm | Corning | CLS430521 | |
| Calcium chloride | VWR | 1B1110 | For microgel washing buffer |
| Capillary-piston assemblies for positive-displacement pipettes, 1000 μL max. volume | Rainin | 17008609 | |
| Capillary-piston assemblies for positive-displacement pipettes, 25 μL max. volume | Rainin | 17008605 | |
| Capillary-piston assemblies for positive-displacement pipettes, 250 μL max. volume | Rainin | 17008608 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10228 | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | |
| Centrifuge tube, 15 mL | CELLTREAT | 667015B | |
| Centrifuge tube, 50 mL | CELLTREAT | 229421 | |
| Chloroform, ACS grade, Glass Bottle | Stellar Scientific | CP-C7304 | For synthesis of fluorescently-labeled tetrazine |
| Corona plasma gun, BD-10A High Frequency Generator | ETP | 11011 | |
| CryoTube Vials, Polypropylene, Internal Thread with Screw Cap | Nunc | 368632 | |
| D1 mouse mesenchymal cells | ATCC | CRL-12424 | Example cell line for culture in MAP gels |
| DAPI | Sigma-Aldrich | D9542 | For staining cell culture samples |
| Deuterium oxide, 99.9 atom% D | Sigma-Aldrich | 151882 | For NMR spectroscopy |
| Dialysis tubing, regenerated cellulose membrane, 12-14 kDa molecular weight cut-off | Spectra/Por | 132703 | For purifying HA-NB and HA-Tet |
| Diethyl ether | VWR | BDH1121-4LPC | For synthesis of fluorescently-labeled tetrazine |
| Dimethylformamide | Sigma-Aldrich | 277056 | For synthesis of fluorescently-labeled tetrazine |
| 4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride (DMTMM) | TCI-Chemicals | D2919 | For modifying HA |
| Dithiothreitol (DTT) | Thermo Scientific | R0861 | Non-degradable dithiol linker (substitute for MMP-cleavable peptide) |
| Dulbecco's Modified Eagle's Medium (DMEM), high glucose, w/ 4500 mg/L glucose, L-glutamine, sodium pyruvate, and sodium bicarbonate, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | D6429-500ML | For D1 cell culture |
| EMS Paraformaldehyde, Granular | VWR | 100504-162 | For making 4% PFA |
| Ethanol absolute (200 proof) | KOPTEC | 89234-850 | |
| Fetal bovine serum (FBS) | ATCC | 30-2020 | For D1 cell culture |
| Heating Plate | Kopf Instruments | HP-4M | |
| Hemacytometer with coverglass | Daigger Scientific | EF16034F | |
| 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375 | |
| Sodium hyaluronate, 79 kDa average molecular weight, produced in bacteria Streptococcus zooepidemicus, pharmaceutical grade, microbial contamination <100 CFU/g, bacterial endotoxins <0.050 IU/mg | Contipro | N/A | 79 kDa average molecular weight was used for HA-Tet synthesis, but these methods could be adapted for other molecular weights. |
| IMARIS Essentials software package | Oxford Instruments | N/A | Microscopy image analysis software |
| Infusion pump, dual syringe | Chemyx | N/A | |
| Kimwipe | Kimberly-Clark | 34120 | |
| Laboratory stand with support lab clamp | Geyer | 212100 | |
| Liquid nitrogen | Airgas | NI 180LT22 | |
| Lithium Phenyl(2,4,6-trimethylbenzoyl)phosphinate | TCI-Chemicals | L0290 | |
| Lyophilizer | Labconco | N/A | Labconco FreeZone 6 plus has been discontinued, but other lab grade console freeze dryers could be used for this protocol. |
| Methyltetrazine-PEG4-maleimide | Kerafast | FCC210 | For synthesis of fluorescently-labeled tetrazine |
| 2-(4-Morpholino)ethane Sulfonic Acid (MES) | Fisher Scientific | BP300-100 | For modifying HA |
| Micro cover glass, 24 x 60 mm No. 1 | VWR | 48393-106 | |
| Microfluidic device SU8 master wafer | FlowJem | Custom design made either in-house in clean room or outsourced | |
| Mineral oil, heavy | Sigma-Aldrich | 330760 | |
| MMP-cleavable dithiol crosslinker peptide (Ac-GCRDGPQGIWGQDRCG-NH2) | GenScript | N/A | |
| 5-Norbornene-2-methylamine | TCI-Chemicals | 95-10-3 | For HA-NB synthesis |
| Packing tape | Scotch | 3M 1426 | |
| Parafilm | Bemis | PM996 | |
| PEG(thiol)2 | JenKem Technology USA | A4001-1 | For synthesis of fluorescently-labeled tetrazine |
| Penicillin-Streptomycin, 10,000 units/mL | Thermo Fisher Scientific | 15140122 | For D1 cell culture |
| Petri dish, polystyrene, disposable, Dia. x H=150 x 15 mm | Corning | 351058 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | For washing HMPs |
| Phosphate buffered saline (PBS) 1x | Gibco | 10010023 | |
| RainX water repellent glass treatment | Grainger | 465D20 | Synthetic hydrophobic treatment solution for microfluidic device treatment |
| RGD peptide (Ac-RGDSPGERCG-NH2) | GenScript | N/A | |
| Rubber bands | Staples | 112417 | |
| Sodium chloride | Chem-Impex | 30070 | For dialysis |
| Span 80 for synthesis | Sigma-Aldrich | 1338-43-8 | |
| Sylgard 184 Silicone Elastomer | Electron Microscopy Science | 4019862 | polydimethylsiloxane (PDMS) elastomer for making microfluidic devices and tissue culture devices |
| Syringe filter, Whatman Uniflo, 0.2 μm PES, 13 mm diameter | Cytvia | 09-928-066 | |
| Tetraview LCD digital microscope | Celestron | 44347 | |
| Tetrazine-amine HCl salt | Chem-Impex | 35098 | For HA-Tet synthesis |
| Triethylamine | Sigma-Aldrich | 471283 | For synthesis of fluorescently-labeled tetrazine |
| Tris(2-carboxyethyl)phosphine (TCEP) | Millipore Sigma | 51805-45-9 | |
| Triton X-100 | VWR | 97063-864 | |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific | 15250061 | |
| Trypsin EDTA (0.25%), Phenol red | Fisher Scientific | 25-200-056 | For lifting adherent cells to seed in MAP gels |
| Tygon ND-100-80 Non-DEHP Medical Tubing, Needle Gauge=23, Wall Thickness=0.020 in, Internal diameter = 0.020, Outer diameter = 0.060 in | Thomas Scientific | 1204G82 | |
| UV curing system controller, LX500 LED | OmniCure | 010-00369R | |
| UV curing head, LED spot UV | OmniCure | N/A | |
| UV light meter, Traceable | VWR | 61161-386 | |
| Vacuum dessicator | Bel-Art | 08-594-15C | |
| X-Acto Z Series Precision Utility Knife | Elmer's | XZ3601W |
Referenzen
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. 5 (1), 20-43 (2020).
- Darling, N. J., et al. Click by click Microporous Annealed Particle (MAP) scaffolds. Advanced Healthcare Materials. 9 (10), 1901391 (2020).
- Truong, N. F., et al. Microporous annealed particle hydrogel stiffness, void space size, and adhesion properties impact cell proliferation, cell spreading, and gene transfer. Acta Biomaterialia. 94, 160-172 (2020).
- Pfaff, B. N., et al. Selective and improved photoannealing of Microporous Annealed Particle (MAP) scaffolds. ACS Biomaterials Science & Engineering. 7 (2), 422-427 (2021).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science & Engineering. 2 (11), 2034-2041 (2016).
- Caldwell, A. S., Campbell, G. T., Shekiro, K. M. T., Anseth, K. S. Clickable microgel scaffolds as platforms for 3D cell encapsulation. Advanced Healthcare Materials. 6 (15), 1700254 (2017).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Advanced Materials. 34 (12), 2109194 (2022).
- Wilson, K. L., et al. Stoichiometric post modification of hydrogel microparticles dictates neural stem cell fate in microporous annealed particle scaffolds. Advanced Materials. 34 (33), 2201921 (2022).
- Muir, V. G., Qazi, T. H., Shan, J., Groll, J., Burdick, J. A. Influence of microgel fabrication technique on granular hydrogel properties. ACS Biomaterials Science & Engineering. 7 (9), 4269-4281 (2021).
- Highley, C. B., Song, K. H., Daly, A. C., Burdick, J. A. Jammed microgel inks for 3D printing applications. Advanced Science. 6 (1), 1801076 (2018).
- Anderson, A. R., Nicklow, E., Segura, T. Particle fraction as a bioactive cue in granular scaffolds. Acta Biomaterialia. 150, 111-127 (2022).
- Pruett, L., Ellis, R., McDermott, M., Roosa, C., Griffin, D. R. Spatially heterogeneous epidermal growth factor release from microporous annealed particle (MAP) hydrogel for improved wound closure. Journal of Materials Chemistry B. 9 (35), 7132-7139 (2021).
- Sheikhi, A., et al. Microengineered emulsion-to-powder technology for the high-fidelity preservation of molecular, colloidal, and bulk properties of hydrogel suspensions. ACS Applied Polymer Materials. 1 (8), 1935-1941 (2019).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step variable height photolithography for valved multilayer microfluidic devices. Journal of Visualized Experiments. (119), e55276 (2017).
- JoVE. Nuclear Magnetic Resonance (NMR) Spectroscopy. JoVE Science Education Database. Organic Chemistry. JoVE. , (2022).
- Roosa, C., et al. Microfluidic synthesis of microgel building blocks for microporous annealed particle scaffold. Journal of Visualized Experiments. (184), e64119 (2022).
- Zhang, H., Dicker, K. T., Xu, X., Jia, X., Fox, J. M. Interfacial bioorthogonal crosslinking. ACS Macro Letters. 3 (8), 727-731 (2014).
- Welzel, P. B., et al. Cryogel micromechanics unraveled by atomic force microscopy-based nanoindentation. Advanced Healthcare Materials. 3 (11), 1849-1853 (2014).
- Plieva, F., Huiting, X., Galaev, I. Y., Bergenståhl, B., Mattiasson, B. Macroporous elastic polyacrylamide gels prepared at subzero temperatures: control of porous structure. Journal of Materials Chemistry. 16 (41), 4065-4073 (2006).
- Rommel, D., et al. Functionalized microgel rods interlinked into soft macroporous structures for 3D cell culture. Advanced Science. 9 (10), 2103554 (2022).
- Kurt, E., Segura, T. Nucleic acid delivery from granular hydrogels. Advanced Healthcare Materials. 11 (3), 2101867 (2021).
- Isaac, A., et al. Microporous bio-orthogonally annealed particle hydrogels for tissue engineering and regenerative medicine. ACS Biomaterials Science & Engineering. 5 (12), 6395-6404 (2019).
- Truong, N. F., Lesher-Pérez, S. C., Kurt, E., Segura, T. Pathways governing polyethylenimine polyplex transfection in Microporous Annealed Particle scaffolds. Bioconjugate Chemistry. 30 (2), 476-486 (2019).
- Koh, J., et al. Enhanced in vivo delivery of stem cells using microporous annealed particle scaffolds. Small. 15 (39), 1903147 (2019).
- Li, F., et al. Cartilage tissue formation through assembly of microgels containing mesenchymal stem cells. Acta Biomaterialia. 77, 48-62 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten