Quantifizierung globaler posttranslationaler Histonmodifikationen mittels intranukleärer Durchflusszytometrie in isolierten Mikroglia des Mausgehirns
In diesem Artikel
Zusammenfassung
Diese Arbeit beschreibt ein Protokoll zur Quantifizierung globaler Histonmodifikationen mittels intranukleärer Durchflusszytometrie in isolierten Hirnmikroglia. Die Arbeit enthält auch das Mikroglia-Isolationsprotokoll, das für die Datenerhebung verwendet wurde.
Zusammenfassung
Die Kontrolle der Genexpression erfolgt teilweise durch Modifikationen der Chromatinstruktur, einschließlich der Hinzufügung und Entfernung posttranslationaler Modifikationen an Histonschwänzen. Posttranslationale Histonmodifikationen (HPTMs) können entweder die Genexpression oder die Repression erleichtern. Zum Beispiel neutralisiert die Acetylierung von Histonschwanz-Lysinresten die positive Ladung und reduziert die Wechselwirkungen zwischen dem Schwanz und der negativ geladenen DNA. Die Abnahme der Histonschwanz-DNA-Wechselwirkungen führt zu einer erhöhten Zugänglichkeit der zugrunde liegenden DNA, was einen verbesserten Zugang zu Transkriptionsfaktoren ermöglicht. Die Acetylierungsmarkierung dient auch als Erkennungsstelle für Bromodomänen-haltige Transkriptionsaktivatoren, die zusammen zu einer erhöhten Genexpression führen. Histonmarkierungen können während der Zelldifferenzierung und als Reaktion auf verschiedene zelluläre Umgebungen und Reize dynamisch reguliert werden. Während Next-Generation-Sequencing-Ansätze begonnen haben, genomische Orte für einzelne Histonmodifikationen zu charakterisieren, kann nur eine Modifikation gleichzeitig untersucht werden. Angesichts der Tatsache, dass es Hunderte von verschiedenen HPTMs gibt, haben wir ein quantitatives Hochdurchsatzmaß für globale HPTMs entwickelt, das zum Screening von Histonmodifikationen verwendet werden kann, bevor umfangreichere Genomsequenzierungsansätze durchgeführt werden. Dieses Protokoll beschreibt eine auf Durchflusszytometrie basierende Methode zum Nachweis globaler HPTMs und kann mit Zellen in Kultur oder isolierten Zellen aus In-vivo-Geweben durchgeführt werden. Wir präsentieren Beispieldaten von isolierten Mikroglia des Mäusegehirns, um die Sensitivität des Assays zum Nachweis globaler Verschiebungen in HPTMs als Reaktion auf einen bakteriellen Immunstimulus (Lipopolysaccharid) zu demonstrieren. Dieses Protokoll ermöglicht die schnelle und quantitative Bewertung von HPTMs und kann auf jeden transkriptionellen oder epigenetischen Regulator angewendet werden, der von einem Antikörper nachgewiesen werden kann.
Einleitung
Epigenetik ist die Untersuchung der Mechanismen, die die Genexpression regulieren, ohne die zugrunde liegende DNA-Sequenz zu verändern. Die epigenetische Regulation der Genexpression ist innerhalb von Zellen dynamisch und kann schnelle und koordinierte Reaktionen auf verschiedene Umweltreize ermöglichen. Die dynamische Regulation erfolgt zum Teil aufgrund von Veränderungen in der Chromatinstruktur auf der Ebene des Nukleosoms, das aus Histonproteinen (H2A, H2B, H3, H4) besteht, die zu einem Oktamerkern zusammengesetzt sind, der von DNA1 eng umwickelt ist. Die Wechselwirkungen zwischen den Histonproteinen und der DNA können die Zugänglichkeit der DNA zur Transkriptionsmaschinerie steuern, die letztendlich die Genexpression und andere Aspekte der Chromatinbiologie kontrollieren kann2. Histonproteine haben unstrukturierte Schwänze, die positiv geladene Reste aufweisen, die elektrostatische Wechselwirkungen mit dem negativ geladenen DNA-Rückgrat eingehen. Diese Wechselwirkungen führen zu einer dichten Packung der DNA und einer verminderten Zugänglichkeit der DNA. Kovalente Modifikationen an den Histonschwänzen, sogenannte posttranslationale Histonmodifikationen (HPTMs), können diese Wechselwirkungen regulieren 3,4. Zu den am besten charakterisierten HPTMs gehören die Histonschwanz-Acetylierung und -Methylierung, die die Affinität der elektrostatischen Wechselwirkungen zwischen den Histonschwänzen und der DNA verändern kann, was zu einer unterschiedlichen Zugänglichkeit der zugrunde liegenden DNA und zur Rekrutierung von Transkriptionsfaktoren führt, die diese HPTMs an bestimmten Stellen erkennen. HPTMs werden durch drei wichtige Klassen von Enzymen reguliert, die als Reader bezeichnet werden: Reader, die erkennen, Schreiber, die sich ablagern, und Radierer, die HPTMs entfernen. Daher kann die Rekrutierung oder Auflösung von Lese-, Schreib- oder Löschenzymen letztendlich die Landschaft von HPTMs verändern und die Struktur und Funktion des Chromatins steuern, was ihre Regulation und ihr Auslesen für das Verständnis der Zellbiologie und -funktion unerlässlich macht 3,4.
Die Zellen im Zentralnervensystem (ZNS) sind epigenetisch flexibel, da sie ihr Transkriptom verändern, um sich an Umweltreize anzupassen. Immer mehr Hinweise deuten darauf hin, dass Veränderungen im Epigenom, wie DNA-Methylierung, nicht-kodierende RNAs und HPTMs, eine wesentliche Rolle bei der Gedächtnisbildung und der synaptischen Funktion spielen5. Die Störung der HPTM-Dynamik durch Manipulation der relevanten Lese-, Schreib- oder Radiergummier kann assoziatives Lernen und langfristige Potenzierung blockieren oder verstärken 6,7,8. Mikroglia, die residenten Immunzellen des ZNS, regulieren ihr Transkriptom als Reaktion auf Immunstimulation schnell durch dynamische Veränderungen in ihrem Epigenom 9,10,11. Dieses hohe Maß an Anpassung an ihre lokale Gehirnumgebung macht es schwierig, sie in einem isolierten Kontext zu untersuchen, da Studien gezeigt haben, dass das Epigenom und das Transkriptom von Mikroglia bereits nach wenigen Stunden in Nährmedien nach der Entfernung aus der Gehirnumgebung verändert werden11. Da Mikroglia nur 10 % der Gehirnzellen ausmachen, mangelt es den Messungen, die Veränderungen auf der Ebene des gesamten Gewebes untersuchen, an Sensitivität und Spezifität12,13. Daher müssen Mikroglia schnell isoliert werden, um die epigenetischen Veränderungen wie den HPTM-Spiegel ex vivo zu untersuchen.
Zu den Methoden, die üblicherweise zur Untersuchung von HPTMs verwendet werden, gehören die Chromatin-Immunpräzipitationssequenzierung (ChIP-seq) und die Spaltung unter Zielstrukturen und die Tagmentierungssequenzierung (CUT&Tag-seq)4. Obwohl diese Techniken sehr spezifisch für ein einzelnes HPTM sind und das Vorhandensein von HPTMs in einem bestimmten genomischen Kontext bestimmen können, können sie nur eines der vielen möglichen HPTMs innerhalb eines einzigen Experiments untersuchen11,14 Daher ist es sehr wertvoll, vor der Durchführung solcher Experimente, die einen erheblichen Zeit- und Geldaufwand erfordern, die Liste der potenziell interessanten HPTM für weitere Untersuchungen einzugrenzen, indem zunächst die Veränderungen in der globalen HPTM-Konzentrationen. Die beiden Hauptansätze zur Untersuchung der globalen HPTM-Spiegel sind die Immunhistochemie und die Western-Blot-Analyse, aber beide Ansätze sind nur semi-quantitativ, haben einen geringen Durchsatz und erfordern eine große Anzahl von Gewebeschnitten oder isolierten Zellen15,16. Unser Ziel war es daher, eine hochempfindliche, quantitative Methode zu entwickeln, mit der die globalen HPTM-Konzentrationen schnell und auf Einzelzellebene untersucht werden können.
Das vorgestellte Protokoll ermöglicht den schnellen Nachweis globaler HPTM-Spiegel mittels intranukleärer Durchflusszytometrie. Frühere Studien an Krebszellen haben die Bedeutung der Untersuchung globaler Ebenen aus klinischer Sicht gerechtfertigt17,18. Es ist auch üblich, dass Studien globale Konzentrationen als Screening-Methode verwenden, bevor die genomische Lokalisation bestimmter HPTMs von Interesse beurteiltwird 19,20. Für Mikroglia ist die Bestimmung der globalen Konzentrationen nach der Isolierung aufgrund der geringen Zellausbeute eine Herausforderung. Pan et al. präsentieren globale HPTM-Spiegel aus isolierten Mikroglia, in denen Mikroglia von drei Tieren gepoolt wurden, um den Nachweis des Proteinspiegels durch Western Blot19 zu ermöglichen. Mit unserem Protokoll sind wir in der Lage, globale Veränderungen mit viel geringerem Zelleintrag zu erkennen, was das Screening mehrerer Markierungen pro Tier ermöglicht und die Notwendigkeit eliminiert, Proben zu poolen.
Hier beschreiben wir ein Protokoll zum schnellen Nachweis von HPTM-Spiegeln mittels quantitativer intranukleärer Durchflusszytometrie in isolierten Mikroglia. Während wir uns der Kürze halber speziell auf die HPTM-Quantifizierung konzentrieren, kann dieses Protokoll auf die gleiche Weise verwendet werden, um die globalen Konzentrationen von Lese-, Schreib- und Radiergummi-Enzymen zu quantifizieren. Das Protokoll besteht aus zwei Teilen: erstens der Isolierungsmethode für Mikroglia und zweitens der auf Durchflusszytometrie basierenden Methode zur Bestimmung des HPTM-Spiegels. Die Isolierungsmethode liefert Zellen, die sowohl für die RNA-Isolierung als auch für die HPTM-Bewertung verwendet werden können, was die Bewertung der Genexpression und des HPTM-Spiegels aus derselben Probe ermöglicht. Darüber hinaus kann die Methode zur HPTM-Bewertung auf andere Zelltypen angewendet werden, wie im Protokoll angegeben.
Protokoll
Alle Tierpflegeprotokolle wurden vom Animal Care Committee der University of British Columbia in Übereinstimmung mit den Richtlinien des Canadian Council on Animal Care genehmigt.
1. Gehirnverdauung zur Isolierung von Mikroglia
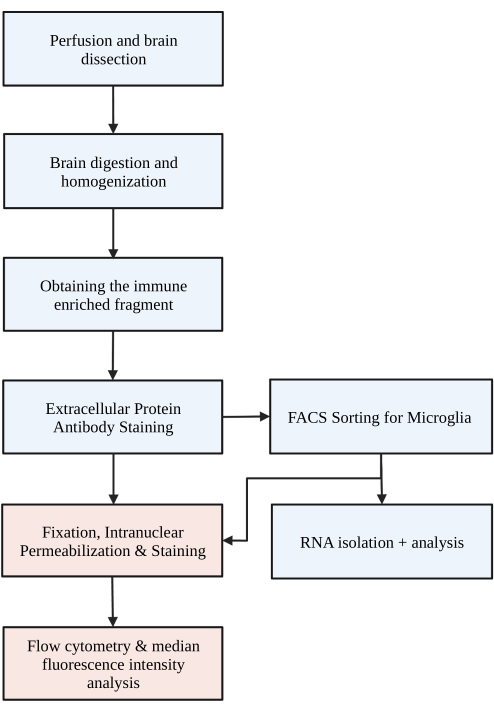
Abbildung 1: Einfaches Flussdiagramm des Protokolls. Die Mäuse werden zunächst transkardial mit HBSS perfundiert und das Gehirn präpariert. Das Gehirn wird dann durch chemischen Verdau und mechanischen Aufschluss dissoziiert, um ein einzelnes Zellhomogenat zu erhalten. Die immunangereicherte Fraktion wird über einen diskontinuierlichen Dichtegradienten gesammelt, woraufhin die Zellen für P2RY12 gefärbt werden. Die gefärbten Zellen werden entweder 1) mittels fluoreszierender aktivierter Zellsortierung (FACS) sortiert, um zur RNA-Analyse oder zur nachgeschalteten Proteinanalyse zu führen, und/oder 2) fixiert, permeabilisiert und für intranukleäre Proteine gefärbt. Der Proteingehalt wird durch die mediane Fluoreszenzintensität in dem durch Durchflusszytometrie bestimmten Kanal von Interesse quantifiziert. Blau gefärbte Kästchen sind Teil des Protokollschritts 1) Gehirnverdauung zur Isolierung von Mikroglia. Rot markierte Kästchen sind Teil des Protokollschritts 2) Intranukleäre Durchflussfärbung für die Proteinexpressionsanalyse. Erstellt mit BioRender.com. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Herstellung von Reagenzien
HINWEIS: Wenn Sie eine Extraktion planen, um sowohl RNA als auch Zellen für die HPTM-Analyse zu sammeln, lesen Sie Abschnitt 1.7.1 für Modifikationen, um Transkriptions- und Translationsinhibitoren einzubeziehen. Dies ist jedoch nicht erforderlich, wenn nur das Proteinsignal bewertet wird, da die Zellen weitgehend ruhen, wenn sie auf Eis gehalten werden.- FACS-Puffer (Fluoreszenz-aktivierte Zellsortierung) (20 ml pro Probe): Rinderserumalbumin (BSA) in 1x Hanks-Salzlösung (HBSS) auflösen, um eine 2%ige BSA-Lösung herzustellen. EDTA wird bis zu einer Endkonzentration von 1 mM in der 2%igen BSA-Lösung gelöst. Filter mit einem 0,2-μm-Filter sterilisieren und vor der Verwendung bis zu 1 Woche bei 4 °C lagern.
- Aufschlusspuffer (1 ml pro Probe): Rekonstituieren Sie eine Durchstechflasche mit Papain in HBSS auf eine Endkonzentration von 20 U/ml in 1 mM L-Cystein mit 0,5 mM EDTA. Bei 37 °C für mindestens 10 Minuten aktivieren oder bis das Gewebe verdaut werden kann. Kurz vor der Anwendung wird DNase I bis zu einer Endkonzentration von 200 U/ml in die aktivierte Papainlösung gegeben. Bereiten Sie diese am Tag des Experiments vor und lagern Sie sie nicht.
- Isotonische Dichtegradientenlösung (5,5 ml pro Probe): 10x HBSS in kaltes Dichtegradientenmedium bis zu einer Endkonzentration von 1x HBSS zugeben, was zu einer Enddichte von 1,117 g/ml führt. Vor Gebrauch mindestens 30 s lang mischen. Bis zur Verwendung auf Eis legen.
- 37%ige Dichtegradientenlösung (4 ml pro Probe): Fügen Sie 1x HBSS einen isotonischen Dichtegradienten hinzu, um eine Endkonzentration von 37 % mit einer Enddichte von 1,043 g/ml zu erhalten. Fügen Sie 20 μl Phenolrot für jeden ml mit einem Dichtegradienten von 37 % hinzu, um eine rosafarbene Lösung für die Visualisierung während des Schichtens herzustellen. Vor Gebrauch mindestens 30 s vortexen. Bis zur Verwendung auf Eis legen.
- 70%ige Dichtegradientenlösung (2 ml pro Probe): Fügen Sie 1x HBSS einen isotonischen Dichtegradienten hinzu, um eine Endkonzentration von 70 % mit einer Enddichte von 1,082 g/ml zu erhalten. Fügen Sie 5 μl Trypanblau für jeden ml eines Mediums mit 70%iger Dichte hinzu, um eine blaue Lösung für die Visualisierung während des Schichtens herzustellen. Vor Gebrauch mindestens 30 s vortexen. Bis zur Verwendung auf Eis legen.
- Perfusion und Hirndissektion
HINWEIS: Das Perfusionsprotokoll ähnelt dem von Posel et al., das eine Videodarstellung der Thorakotomie, der transkardialen Perfusion und der Gehirnentfernung der Maus enthält21. Hier verwenden wir adulte männliche und weibliche C57BL/6J-Mäuse (10-15 Wochen alt, 20-30 g), aber dieses Protokoll kann verwendet werden, um eine Thorakotomie für jede Maus durchzuführen. Alle tierexperimentellen Eingriffe müssen vor der Durchführung von Experimenten von der institutionellen Ethikkommission genehmigt werden.- Anästhesie der Maus: Betäuben Sie Mäuse mit 4 % Isofluran in 100 % Sauerstoff bis über die Ebene der chirurgischen Anästhesie, die durch ein Einklemmen der Zehen oder einen fehlenden Reflex beim festen Einklemmen des Mausfußes bestätigt werden kann. Legen Sie die Maus auf den Rücken und stecken Sie ihre vier Pfoten fest in das chirurgische Sezierbrett, das sich gekippt in einer Kunststoffschale befindet, um sicherzustellen, dass die Nase im Isofluoran-Nasenkonus befestigt ist. Stellen Sie nach dem Transfer sicher, dass sich das Tier noch hinter der chirurgischen Anästhesieebene befindet, bevor Sie fortfahren.
- Maus-Thorakotomie: Greifen und heben Sie die Bauchhaut mit einer Zange an und machen Sie einen flachen Schnitt durch die Haut und die Bauchdecke, um das Xyphoid freizulegen, ohne die absteigende Aorta oder darunter liegende Organe zu beschädigen.
- Greife das Xyphoid mit einer Pinzette und mache seitliche Schnitte unter dem Brustkorb, um das Zwerchfell und die Leber freizulegen. Machen Sie vorsichtige, flache Schnitte durch das Zwerchfell entlang der Länge des Brustkorbs mit einer feinen Schere und durch den Brustkorb mit einer Gewebeschere und stecken Sie das Brustbein an der chirurgischen Station in der Nähe des Kopfes der Maus fest, um das Herz und die Lunge für die transkardiale Perfusion freizulegen.
- Transkardiale Perfusion: Bereiten Sie eine peristaltische Perfusionspumpe vor und befestigen Sie eine 26,5-G-Nadel an einem Ende des Schlauchs. Bereiten Sie den Schlauch für den Eingriff vor, indem Sie ein Ende des Schlauchs in ein Fläschchen mit kaltem 1x HBSS einführen und die Pumpe einschalten, um den Schlauch vollständig mit 1x HBSS zu füllen.
- Während Sie das Herz mit einer stumpfen Zange halten, führen Sie die Spitze einer 26,5G-Nadel mit dem daran befestigten Perfusionsschlauch in die linke Herzkammer ein und machen Sie einen kleinen Schnitt im rechten Vorhof. Schalten Sie die Perfusionspumpe ein, um die Maus vorsichtig mit einer Rate von ~2-4 ml/min mit mindestens 15-20 ml kaltem 1x HBSS zu perfundieren.
HINWEIS: Eine vollständige Perfusion ist oft angezeigt, wenn die Leber beginnt, Blut zu klären und die gleiche Farbe wie das Herz annimmt. - Gehirnentfernung: Enthaupten Sie die Maus mit einer Gewebepräparierschere und machen Sie einen Mittellinienschnitt in der Kopfhaut vom Hals bis zur Nase. Schälen Sie die Hautlappen zu den Seiten, um den Schädel freizulegen, und entfernen Sie überschüssiges Gewebe und Knochen am kaudalen Ende des Schädels mit einer Präparierscheibe.
- Schieben Sie vorsichtig eine Klinge der Schere unter den Schädel in das Foramen magnum, wobei die scharfe Seite zum Knochen zeigt, und schneiden Sie vorsichtig die Mittellinie zur Nase hin auf. Mache seitliche Schnitte sowohl an der Schädelbasis als auch in der Nähe der Nase mit einer Präparierschere. Verwenden Sie eine feine Pinzette, um den Schädel von der Mittellinie nach außen zu führen, um die Schädelteile abzubrechen und das Gehirn freizulegen. Heben Sie das Gehirn vorsichtig mit einem Spatel an und legen Sie es auf Sezierkleckspapier.
- Gehirndissektion: Legen Sie das Gehirn auf ein mit 1x HBSS benetztes Stück Präparierpapier auf eine geschlossene, mit Eis gefüllte Petrischale. Entferne das Kleinhirn und halbiere die Gehirnhälften mit einer sauberen Rasierklinge.
- Entfernen Sie den Hirnstamm, das Striatum und die weiße Substanz aus jeder Hemisphäre, während der Hippocampus und der überlagernde Kortex intakt bleiben. Die Hemisphären, die isoliertes Kortex- und Hippocampusgewebe enthalten, in ein 15-ml-Röhrchen mit 5 ml kaltem 1x HBSS überführen und auf Eis lassen.
HINWEIS: Es ist wichtig, die Dissektionen so schnell wie möglich durchzuführen, damit das Gewebe kalt bleibt, mit nicht mehr als 2 Minuten zwischen der Enthauptung und dem endgültigen Einsetzen des präparierten Gewebes in 1x HBSS auf Eis. Wenn die Mikroglia von mehreren Tieren isoliert werden, können die Gehirne ~1 h lang in 1x HBSS auf Eis gelagert werden, bevor mit der Verarbeitung der gesamten Kohorte von Tieren für die Verdauung usw. fortgefahren wird.
- Verdauung und Homogenisierung des Gehirns
- Mechanische und chemische Dissoziation: Geben Sie das Hirngewebe jeder Maus und 1 ml Verdauungspuffer in einzelne Petrischalen auf Eis. Zerhacken Sie das Gehirn mit einer sauberen Skalpellklinge gründlich in kleine Stücke (<1 mm).
- Schneiden Sie die Spitze einer Plastik-Transferpipette ab und geben Sie jedes der gehackten Gehirne vorsichtig in separate Vertiefungen innerhalb einer 24-Well-Platte auf Eis. Die Platte mit transparenter Weichfolie abdecken und 30 Minuten auf Eis inkubieren.
HINWEIS: Wenn es richtig gehackt wird, ähnelt das Gehirngewebe gut gehacktem Knoblauch. - Dounce-Homogenisierung: Übertragen Sie die verdaute Gehirnlösung aus jedem Well in einzelne 7-ml-Glas-Dounce-Homogenisatoren auf Eis, die jeweils mit 5 ml kaltem FACS-Puffer gefüllt sind. Tupfen Sie jedes Gehirn vorsichtig mit dem losen Stößel (A), etwa 30-40 Mal, bis eine einzelne Zellsuspension erhalten ist. Nachdem Sie mit dem A-Stößel geklopft haben, klopfen Sie vorsichtig mit dem festen Stößel (B) 3-4 Mal, um eine Einzelzellsuspension zu gewährleisten.
HINWEIS: Drücken Sie den Stößel nicht mehr als 3/4 des Weges nach unten, um zu vermeiden, dass das Gewebe am Boden des Homogenisators zerquetscht wird. Die endgültige Lösung sollte undurchsichtig und milchig sein.
HINWEIS: Wenn Sie mehrere Gehirne in einem einzigen Experiment verdauen, planen Sie den Transfer des Gehirnverdaus in den FACS-Puffer so, dass sich jede Probe nur 30 Minuten lang im Aufschlusspuffer befindet. Eine Überverdauung kann zu einer Spaltung von Oberflächenproteinen führen, wodurch die nachgeschaltete Antikörperbindung und das Signal reduziert werden.
- Gewinnung eines immunangereicherten Fragments
- Etablierung des Dichtegradienten: Übertragen Sie das Homogenat aus jedem Gehirn in separate 15-ml-Polypropylenröhrchen und fügen Sie 2,125 ml isotonischen Dichtegradienten hinzu und geben Sie 8,5 ml mit FACS-Puffer für jedes auf, um eine Endkonzentration von 25 % Dichtegradient zu erhalten. Drehen Sie die 15-ml-Röhrchen vorsichtig 20x um, um sie gründlich zu mischen.
- Tragen Sie mit einer schmal abgestuften Transferpipette vorsichtig 4 ml mit einem Dichtegradienten von 37 % in jedes Röhrchen ein, wobei Sie sehr darauf achten müssen, saubere Schichten zu schaffen. Wechseln Sie die Transferpipetten und unterlegen Sie vorsichtig 2 ml mit einem Dichtegradienten von 70 % (Abbildung 2A). In eine auf 4 °C abgekühlte Zentrifuge überführen und 20 min lang bei 500 x g schleudern, wobei die Bremsrampe auf Null gestellt ist.
- Sammeln von immunangereicherten Fragmenten: Mit sauberen Transferpipetten das Myelin vorsichtig von der Oberseite des Volumens im 15-ml-Röhrchen mit einer sauberen Transferpipette absaugen und verwerfen. Das obere Fragment des Dichtegradienten wird vorsichtig mit einer Transferpipette in ein sauberes 15-ml-Polypropylenröhrchen aufgefangen.
- Das immunangereicherte Fragment (1,5 ml oberhalb und 1,5 ml unterhalb der Stelle, an der die 70%igen und 37%igen Dichtegradientenschichten aufeinandertreffen) wird vorsichtig in ein neues 15-ml-Polypropylenröhrchen aufgefangen (Abbildung 2B). Geben Sie 10 ml FACS-Puffer in die immunangereicherte Probe, um das Dichtegradientenmedium zu verdünnen, und drehen Sie das Röhrchen vorsichtig 20x um, um es gründlich zu mischen.
HINWEIS: Da Zellen dazu neigen, an den Seiten des Röhrchens zu kleben, stellen Sie sicher, dass alle Zellen in der Probe während der Entnahmeschritte gesammelt werden, indem Sie die Pipette langsam an den Seiten des Röhrchens kreisen, während Sie die Flüssigkeit auffangen. - Die Zellen in der immunangereicherten Probe werden pelletiert, indem die 15-ml-Röhrchen in einer 4 °C-Zentrifuge bei 500 x g 10 Minuten lang zentrifugiert werden, wobei die Downhill-Rampenbremse auf Null eingestellt ist. Entfernen Sie den Überstand sofort nach Beendigung des Schleuderns vorsichtig und lassen Sie ca. 300 μl Flüssigkeit im 15-ml-Röhrchen, wobei Sie darauf achten müssen, das Pellet nicht zu stören (das möglicherweise nicht sichtbar ist).
- Sammeln Sie den Überstand in einem weiteren 15-ml-Röhrchen, um sicherzustellen, dass die Zellen im Spin pelletiert wurden (verwerfen Sie diese Fraktion, sobald die Überprüfung mit der Zellzahl des resuspendierten Pellets abgeschlossen ist). Nach der Resuspension des Zellpellets im 300-μl-Volumen mit einer P1000-Pipette werden die Zellen mit einem Hämazytometer gezählt, um die Gesamtzellausbeute abzuschätzen.
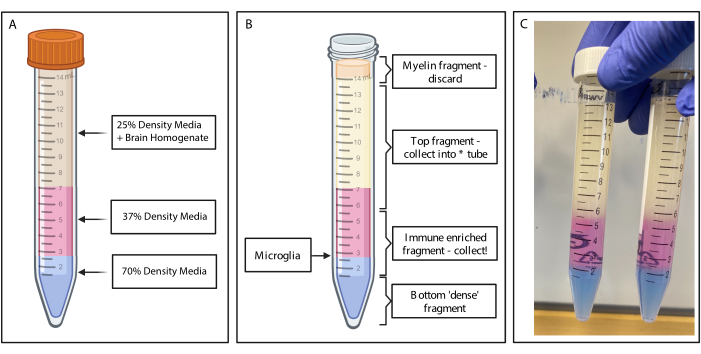
Abbildung 2: Gewinnung des immunangereicherten Fragments durch diskontinuierlichen Dichtegradienten. (A) Das Gehirnhomogenat wird zu 25 % Dichtemedium hergestellt, 4 ml mit 37 % Dichte mittelrosa über Phenolrot und 2 ml mit 70 % Dichte mittelblau über Trypanblau unterlegt. (B) Nach der Zentrifugation haben sich die Fraktionen getrennt. Mikroglia ruhen an der Grenzfläche von Medienfragmenten mit einer Dichte von 37 % und 70 %. Das Myelinfragment befindet sich an der Oberseite des 15-ml-Röhrchens und wird verworfen. Das oberste Fragment wird als Backup gesammelt, falls der Spin fehlschlägt und keine Zellen geborgen werden. In diesem Fall kann der Gradient mit diesem Bruch wiederholt werden. Die immunangereicherte Fraktion wird stromabwärts gesammelt. Die unterste Fraktion, die alle roten Blutkörperchen enthält, verbleibt im Röhrchen und wird verworfen. (C) Beispielabbildung, die komplette Schichten darstellt. Erstellt mit BioRender.com. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Färbung extrazellulärer Antikörper
- Blockierung: Die Zellen werden auf eine 96-Well-Platte mit rundem Boden auf Eis übertragen und bei 500 x g mit einer Bremse zentrifugiert, um die Zellen zu pelletieren. Entfernen Sie schnell den Überstand in der Spüle, indem Sie die Platte schnippen, um den Überstand zu entsorgen, und lassen Sie das Zellpellet intakt am Boden der Vertiefung.
- Resuspendieren Sie die Zellen in 50 μl FACS-Puffer mit einem Anti-Maus-CD16/32-FC-Rezeptor-Blockierungsreagenz unter Verwendung einer P200-Pipette (Endkonzentration 10 μg/ml, Verdünnungsfaktor 1:50), um eine unspezifische Bindung von Antikörpern an Monozyten oder andere FcR-tragende Zellen zu verhindern. 10 Minuten auf Eis inkubieren.
- Antikörper-Färbung: Bereiten Sie das entsprechende Volumen eines 2-fachen Mastermixes vor, der P2RY12-Allophycocyanin (APC; Verdünnungsfaktor 1:50, Konzentration 4 μg/ml für eine Endwell-Konzentration von 1:100, Konzentration 2 μg/ml) und violette 525-Lebendtotfärbung (Verdünnungsfaktor 1:50 für eine Endwell-Konzentration von 1:100) enthält. 50 μl der Färbe-Mastermischung werden in die Zellsuspension gegeben (erhalten nach dem Blockieren in Abschnitt 1.5.1) und die Platte 30 Minuten lang im Dunkeln auf Eis inkubiert.
HINWEIS: Für dieses Protokoll stellen wir die Färbung der Zellen mit P2RY12 vor. Erstens ist P2RY12 ein homöostatischer Marker für Mikroglia, der in bestimmten Krankheitskontexten herunterreguliert werden kann. Zum Beispiel haben 5XFAD-Alzheimer-Modellmäuse den P2RY12-Spiegel herunterreguliert, was die Identifizierung von22 erschweren könnte. Alternative Farbstoffe, die für die Isolierung verwendet werden können, sind Tmem119, Cd11b und CD4523. Zweitens kann das Konjugat Fluorochrom APC an das gewünschte Antikörperpanel angepasst werden. Die Wahl eines hellen Fluorochroms, wie z. B. APC oder PE, trägt jedoch dazu bei, dass die positiven und negativen Populationen leicht zu unterscheiden sind24. - Geben Sie nach dem Färben 200 μl FACS-Puffer direkt in jede Vertiefung, um die Zellen zu waschen. Bei 500 x g bei 4 °C schleudern, um den Überstand durch Schnippen zu entfernen. Resuspendieren Sie die Zellen mit einer P200-Pipette in 200 μl FACS-Puffer, schleudern Sie sie bei 500 x g bei 4 °C und drehen Sie die Platte, um den Puffer aus den Vertiefungen zu entfernen.
- Vorbereiten von Flusskontrollen: Trennen Sie vor der Färbung die erforderlichen Zellvolumina von jeder Probe nach der Blockierung in Schritt 1.5.1 für die erforderlichen Flusskontrollen.
HINWEIS: Für jedes Experiment sind Durchflusskontrollen erforderlich, um die Gates einzurichten. Die Durchflusskontrollen können von einem zusätzlichen Tier oder von einem Bruchteil jedes der Versuchsbrunnen entnommen werden. Stellen Sie beim Teilen von Zellen sicher, dass genügend Zellen pro Kontrolle zugewiesen werden, da 10.000-30.000 Zellen pro Kontrolle erforderlich sind, um Gatter mit hoher Zuverlässigkeit einzurichten.- Es gibt drei relevante Flusskontrollen: keine Färbung, lebend tot und P2RY12-Isotypkontrolle. Für die Fleckenkontrolle dürfen keine Antikörper hinzugefügt werden. In der P2RY12-Isotypkontrolle werden die Zellen mit dem Viabilitätsfarbstoff (1:100) und einem Isotyp-Kontrollantikörper behandelt, der an APC (1:100) konjugiert ist.
- Um die Lebendtotenkontrolle vorzubereiten, werden die Zellen aliquot in eine separate Vertiefung gegeben und die Hälfte des Zellvolumens in ein 500-μl-Röhrchen umgefüllt. Legen Sie das 500-μl-Röhrchen für 5 Minuten in den Gefrierschrank bei -80 °C und legen Sie es anschließend für 5 Minuten in einen 37 °C-Inkubator, um die Zellen abzutöten. Das Aliquot der toten Zellen wird in die Kontrollvertiefung für lebende Tote zurückgeführt und mit einem aminbindenden Viabilitätsfarbstoff auf violettes 525 (Verdünnungsfaktor 1:100) eingefärbt, um tote Zellen zu markieren.
HINWEIS: Das Protokoll ist für die Plattenfärbung mit einer Flick-Methode zur Entfernung von Überständen geschrieben. Dies setzt jedoch voraus, dass der Überstand unmittelbar nach Beendigung des Schleuderns entfernt wird, und der Flick muss mit genügend Kraft ausgeführt werden, um den Überstand schnell zu entfernen, ohne das Pellet zu stören. Alternativ können 1,5 mL RNAse/DNase-freie Röhrchen für die Färbung verwendet werden, mit den folgenden Modifikationen: Die Zellen werden in ein 1,5-ml-Mikrozentrifugenröhrchen und ein Pellet bei 800 x g für 5 min bei 4 °C überführt. Überstand mit Pipetten absaugen. Tipp: Für die Geschwindigkeit kann eine 5-ml-Transferpipette mit einer P200-Spitze den Überstand schnell und genau ansaugen. Beim Ansaugen auf das Pellet achten. Wenn das Pellet nicht sichtbar ist, lassen Sie 50 μl Überstand stehen und passen Sie die Berechnungen entsprechend an. Wenn Sie Antikörper auswaschen, fügen Sie zusätzliches FACS hinzu, um die Verdünnung der Antikörper zu erhöhen (1000 μl statt 200 μl), um die unvollständige Entfernung des Überstands zu berücksichtigen. Verwenden Sie je nach Zytometer die 1,5-ml-Röhrchen zum Sortieren, wodurch die Menge der erforderlichen Verbrauchsmaterialien reduziert wird.
- FACS-Sortierung für Mikroglia
- Zubereitung: Resuspendieren Sie jede Vertiefung in 200 μl FACS-Puffer mit einer P200-Pipette und füllen Sie sie in markierte Durchflusssortierröhrchen um und fügen Sie den FACS-Puffer zu insgesamt 500 μl hinzu, um eine Konzentration von ca. 5 x 105 Ereignissen pro ml zu erreichen. Bis zur Analyse im Dunkeln auf Eis lagern. Bereiten Sie die Röhrchen nach der Sortierung vor, indem Sie 100 μl FACS-Puffer als Polster für Zellen in 1,5-ml-RNAse-freien Röhrchen hinzufügen.
- Zytometereinstellungen: Sortieren Sie Zellen auf einem Durchflusszytometrie-Zellsortierer, der mit der 100-μm-Düse eingerichtet ist. Sortieren Sie Zellen mit 18-20 psi.
- Gating: Auf dem Zytometer wird das Gate für die Zellgröße mit der Side-Sclitter-Fläche (SSC) im Vergleich zur Vorwärtsstreuung (FSC)-Höhe unter Verwendung der No-Stain-Kontrolle zur Unterscheidung von Ablagerungen platziert, SSC-A auf eine logarithmische Achse gelegt, um eine Zellpopulation zu visualisieren, und das Gate für die Selektion nach Zellen (Gate S1; Abbildung 3). Um alle Dubletten zu entfernen, plotten Sie FSC-H vs. FSC-W und Gate dicht um die Zellpopulation herum, um alle Trümmer und Dubletten zu entfernen (Gate S2). Untersuchen Sie mit der P2RY12-Isotypkontrolle die Zellen im APC-Kanal und stellen Sie das Gate für die Autofluoreszenz ein, um P2RY12+-Zellen zu bestimmen. Mit den Kontrollen ohne Färbung und lebend tot werden die Zellen, die auf violetten 525 nm nicht fluoreszieren, als lebende Zellen markiert.
- Sortierung: Zeichnen Sie violett 525 nm vs. APC auf und bestimmen Sie die Population, die P2RY12+ ist und von FMOs (MG) lebt. Sortieren Sie diese Zellen in das beschriftete Post-Sort-Röhrchen (Abbildung 3). Der endgültige Sortierprozentsatz beträgt etwa 50 % der Gesamtereignisse, wobei der Großteil des Gesamtverlusts des Ereignisses Trümmer sind, die in Gate S1 entfernt wurden (~70 % der Ereignisse sind Zellen; Tabelle 1).
- RNA-Isolierung und -Analyse
- Transkriptions- und Translationsinhibitoren: Wenn Sie eine RNA-Extraktion planen, sollten Sie Translations- und Transkriptionsinhibitoren in die Pufferschritte einbeziehen, um das Risiko von isolationsassoziierten transkriptomischen Signaturen zu eliminieren. Bereiten Sie den Inhibitor-Cocktail wie von Marsh et al. beschrieben vor, einschließlich Actinomycin D, Anisomycin und Triptolid25.
- Inhibitor-Zubereitung: Inhibitor-Vorräte rekonstituieren und wie folgt lagern: Actinomycin D in Dimethylsulfoxid (DMSO) auf 5 mg/ml rekonstituieren und bei -20 °C lagern. Triptolid in DMSO auf 10 mM rekonstituieren und bei -20 °C lichtgeschützt lagern. Rekonstituieren Sie Anisomycin in DMSO auf 10 mg/ml und lagern Sie es bei 4 °C, geschützt vor Licht. Lagern Sie alle Hemmstoffvorräte nicht länger als 1 Monat nach der Rekonstitution.
- Puffermodifikationen: Fügen Sie Inhibitoren in vier verschiedenen Puffern im Protokoll wie folgt hinzu: Bei der Durchführung der transkardialen Perfusion HBSS mit Actinomycin D (5 μg/ml, 1:1000 ab Vorrat) und Triptolid (10 μM, 1:1000 ab Vorrat) herstellen. Nach der Perfusion werden die Gehirne in HBSS mit Actinomycin D (5 μg/ml, 1:1000 ab Lager), Triptolid (10 μM, 1:1000 ab Lager) und Anisomycin (27,1 μg/ml, 1:368,5 ab Lager) ins Labor transportiert. FACS-Puffer mit Actinomycin D (5 μg/ml, 1:1000 ab Lager), Triptolid (10 μM, 1:1000 ab Lager) und Anisomycin (27,1 μg/ml, 1:368,5 ab Lager) herstellen. Aufschlusspuffer mit Actinomycin D (5 μg/ml, 1:1000 ab Lager), Triptolid (10 μM, 1:1000 ab Lager) und Anisomycin (27,1 μg/ml, 1:368,5 ab Lager) vorbereiten. Bereiten Sie einen Waschpuffer nach der Sortierung vor, wobei HBSS Actinomycin D (5 μg/ml, 1:1000 ab Lager), Triptolid (10 μM, 1:1000 ab Lagerbestand) und Anisomycin (27,1 μg/ml, 1:368,5 ab Lager) enthält.
HINWEIS: Wenn Sie die Inhibitoren hinzufügen, stellen Sie sicher, dass Sie sie unmittelbar vor der Verwendung hinzufügen und alle vorbereiteten Puffer während des Gebrauchs vor Licht schützen. Vermeiden Sie das Einfrieren und Auftauen von Stammlösungen.
- Waschen nach dem Sortieren: Da die Zellen in 1,5-ml-RNase-freie Röhrchen in FACS-Puffer sortiert wurden, was die RNA-Isolierung stört, ist es notwendig, die Zellen zu waschen. Schleudern Sie die Zellen bei 1000 x g bei 4 °C für 5 Minuten und entfernen Sie den Überstand, wobei etwa 50 μl Flüssigkeit übrig bleiben.
- 200 μl 1x HBSS mit Actinomycin D (5 μg/ml, 1:1000 ab Vorrat), Triptolid (10 μM, 1:1000 ab Lager) und Anisomycin (27,1 μg/ml, 1:368,5 ab Vorrat) zugeben und gründlich mischen. Wiederholen Sie den Schleudergang und entfernen Sie den Überstand, so dass 50 μl Flüssigkeit übrig bleiben (Waschen 1). Fügen Sie 200 μl Waschpuffer nach der Sortierung hinzu, mischen Sie gründlich und wiederholen Sie den Schleudergang und entfernen Sie den Überstand, wobei 25 μl Flüssigkeit übrig bleiben (Waschgang 2).
- RNA-Extraktion: Verwenden Sie für die RNA-Isolierung aus Mikrogliazellen ein RNA-Isolierungskit mit geringem Input, um hohe und konsistente RNA-Ausbeuten und RIN-Werte über 9 zu erzielen (siehe unten und Materialtabelle für Produktempfehlungen). Fügen Sie dem Zellpellet 350 μl des Lysepuffers aus dem empfohlenen Kit + β-Mercaptoethanol (1:100) hinzu und mischen Sie es gut.
HINWEIS: Falls erforderlich, kann das Protokoll an dieser Stelle ausgesetzt werden. Die Proben können bis zur RNA-Extraktion im Lysepuffer bei -80 °C gelagert werden. Wenn Sie die RNA nach der Lagerung extrahieren, tauen Sie das Lysat auf Eis auf und fahren Sie mit den kitspezifischen Anweisungen für die Isolierung fort. - Lysat in einen säulenbasierten Zellzerkleinerer überführen (siehe Materialtabelle für Produktempfehlungen) und 2 Minuten lang bei maximaler Geschwindigkeit bei 4 °C zentrifugieren. In mindestens 14 μl RNase-freiem Wasser eluieren und die Konzentration entsprechend bestimmen. RNA kann nach diesem Zeitpunkt für jede Downstream-Anwendung verwendet werden.
- Transkriptions- und Translationsinhibitoren: Wenn Sie eine RNA-Extraktion planen, sollten Sie Translations- und Transkriptionsinhibitoren in die Pufferschritte einbeziehen, um das Risiko von isolationsassoziierten transkriptomischen Signaturen zu eliminieren. Bereiten Sie den Inhibitor-Cocktail wie von Marsh et al. beschrieben vor, einschließlich Actinomycin D, Anisomycin und Triptolid25.
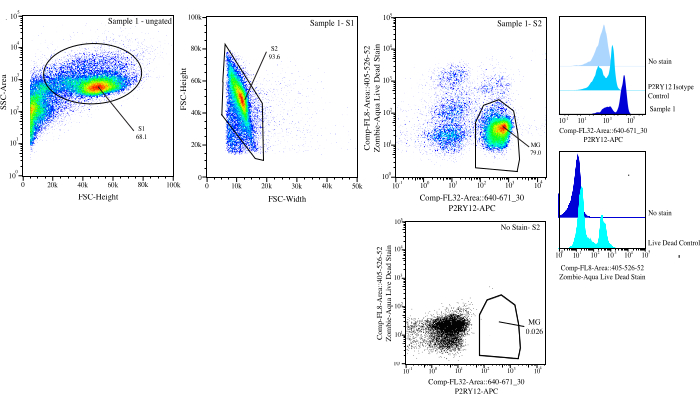
Abbildung 3: Anschnittstrategie für die Strömungssortierung. Ereignisse werden für die Zellengröße auf SSC-A im Vergleich zu FSC-H (S1) festgelegt. Dann werden die Zellen als Singuletts auf FSC-H vs. FSC-W (S2) bezeichnet. Singulett-Zellen werden unter Verwendung der P2RY12-Isotyp-Kontrolle als lebend sortiert, wenn sie auf Comp-FL8-A::405-526-52 negativ sind (violette 525 lebende tote Färbung) und als P2RY12+, wenn sie positiv auf Comp-FL32-A::640-671_30 (P2RY12-APC) sind. Die Zellen werden als MG markiert und sortiert, wenn sie sowohl lebend als auch P2RY12+ sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| GESCHLOSSENE BEVÖLKERUNG | Häufigkeit der übergeordneten | Häufigkeit der Gesamtanzahl | Zählen |
| S1 | 68.10% | 68.10% | 162186 |
| S2>S1 | 93.59% | 63.70% | 151707 |
| P2Ry12+ (670+) > S2 > S1 | 83.05% | 52.90% | 125986 |
| Live (525-) > S2 > S1 | 92.78% | 59.10% | 140752 |
| MG (P2RY12+ Live) >S2>S1 | 78.96% | 50.30% | 119794 |
Tabelle 1: Beispiel für eine Beispielherkunftstabelle mit Gating-Prozentsätzen und erwarteten Ereignisnummern.
2. Intranukleäre Durchflussfärbung für die Proteinexpressionsanalyse
HINWEIS: Andere Zelltypen können zu diesem Zeitpunkt gestartet werden, dieses Protokoll wird mit kultivierten Zellen getestet, einschließlich HEK293-Zellen, BV2-Mikroglia-ähnlichen Zellen und menschlichen IPSC-abgeleiteten Mikroglia.
- Fixierung und Färbung von Zellen
HINWEIS: Verwenden Sie für das folgende Protokoll ein intrazelluläres Färbekit, das für die Kernfärbung optimiert ist. Siehe Material-Tabelle für Produktempfehlungen.- Aliquot extrazellulär gefärbte Zellen aus Abschnitt 1.5.2 in 96-Well-Platten (5 x 104- 1 x 106 Zellen). Schleudern Sie die Zellen 5 Minuten lang bei 500 x g bei 4 °C und schnippen Sie, um den FACS-Puffer zu entfernen.
HINWEIS: Um Daten mit hoher Konfidenz der Medianwerte zu erhalten, sollten mindestens 10.000 Zellen pro Vertiefung verwendet werden. Es gibt zwar kein empfohlenes Maximum, aber es ist am besten, die Anzahl der Zellen während des gesamten Experiments konstant zu halten, um sicherzustellen, dass es keine signifikanten Auswirkungen unterschiedlicher Variationskoeffizienten (CV) gibt. - Fixierung und Permeabilisierung: Fügen Sie 200 μl 1x fixes Konzentrat hinzu und mischen Sie es vorsichtig mit der P200-Pipette, um die Zellen zu resuspendieren. 45-60 Minuten im Dunkeln inkubieren. Zentrifugieren Sie die Platte 5 Minuten lang bei 500 x g bei Raumtemperatur (RT) und schnippen Sie, um den Überstand zu entsorgen.
HINWEIS: Falls erforderlich, kann das Protokoll an dieser Stelle ausgesetzt werden. Nach dem Verwerfen des Überstandes werden die Zellen erneut in einen Langzeitspeicherpuffer für Immunzellen versetzt (siehe Materialtabelle für Produktempfehlungen). Die Proben können 12-18 h bei 4 °C gelagert, vor Licht geschützt und mit einer transparenten Folie abgedeckt werden, um die Pufferverdunstung zu schützen. - Geben Sie 200 μl 1x Permeabilisierungspuffer in jede Vertiefung und pipettieren Sie sie mit einem P200 zum Mischen. Zentrifugenplatte 5 min bei 500 x g bei RT zentrifugieren und schnippen, um den Überstand zu verwerfen. Permeabilisierungspufferwäsche insgesamt 3x wiederholen.
- Vorbereitung der Durchflusskontrollen: Teilen Sie das Zellvolumen aus jeder Probe auf, um die erforderlichen Durchflusskontrollen durchzuführen (10.000-30.000 Zellen pro Kontrollvertiefung sind ausreichend).
- Um die No-Färbe-Kontrolle vorzubereiten, fixieren Sie die No-Färbe-Zellen aus den ungefärbten Zellen der Sortierung oder Aliquote in einer separaten Vertiefung, die keine Antikörper erhält.
- Um die Fluoreszenz-Minus-Eins-Kontrolle (FMO) vorzubereiten, werden die Zellen für jeden der Antikörper auf dem Panel mit Ausnahme des Antikörpers in diesem Kanal aliquotiert.
- Fügen Sie für die relevanten Kanäle den Isotyp-Kontrollantikörper in die FMO für das Gating ein. Zum Beispiel sollte es in einem Panel, das P2RY12-APC und H3K27Ac-AlexaFluor568 enthält, zwei FMOS geben: (1) das APC-FMO, das nur H3K27Ac-AlexaFluor568 und den Isotyp-Kontrollantikörper P2RY12 enthält, und (2) das 568-FMO, das nur P2RY12-APC und die Isotyp-Kontrolle primär und 568 sekundär enthält.
HINWEIS: Dieses Protokoll wird vorgestellt, um ein einzelnes HPTM zu testen, es können jedoch Panels erstellt werden, die viele HPTMs enthalten, die mit verschiedenen Fluorophoren konjugiert sind.
- Färbung von Primärantikörpern: Geben Sie 50 μl 1x Permeabilisierungspuffer mit der entsprechenden Konzentration des Primärantikörpers in jede Vertiefung. 30 Minuten bei RT im Dunkeln inkubieren. 2x mit 200 μl 1x Permeabilisierungspuffer waschen.
HINWEIS: Die Konzentration der für jedes HPTM verwendeten Antikörper ist in der Materialtabelle enthalten. Die Konzentration wird bestimmt, indem verschiedene Konzentrationen der Antikörper an kultivierten Zellen getestet werden, die mit einem Stimulans behandelt wurden, das einen dramatischen Anstieg verursachen würde, z. B. einem HDAC-Inhibitor für Acetylierungsmarkierungen, und sichergestellt wird, dass sowohl unbehandelte als auch behandelte Zellen innerhalb des Nachweisbereichs liegen (oberhalb der Isotypkontrolle und unterhalb des maximalen Nachweisbereichs des Zytometers). Die optimale Antikörperkonzentration für HPTMs sollte eine durchschnittliche mediane Fluoreszenzintensität im Fluorophorkanal zwischen 5 x 104 und 1 x 105 aufweisen. - Sekundäre Antikörperfärbung: Mit 200 μl 1x Permeabilisierungspuffer mit 2 % normalem Eselsserum (NDS) für 10 min bei RT blockieren. 5 min bei 500 x g bei RT schleudern und schnippen, um den Überstand zu entfernen.
- 50 μl 1x Permeabilisierungspuffer mit 2 % NDS und der entsprechenden Konzentration des Sekundärantikörpers zugeben und 30 min bei RT im Dunkeln inkubieren. Geben Sie 200 μl 1x Permeabilisierungspuffer in Vertiefungen, um sie zu verdünnen, zentrifugieren Sie die Platte 5 Minuten lang bei 500 x g bei RT und schnippen Sie, um den Überstand zu verwerfen. Waschen Sie die Zellen 2x mit 200 μl 1x Permeabilisierungspuffer.
HINWEIS: Halten Sie das Protokoll an dieser Stelle ggf. an. Resuspendieren Sie die Zellen in 200 μl Langzeitspeicherpuffer für Immunzellen mit einer P200-Pipette (siehe Materialtabelle für Empfehlungen) und lagern Sie sie bei 4 °C für 12-24 Stunden lichtgeschützt. - Vorbereitung für die Durchflusszytometrie: Zentrifugieren Sie die Platte 5 Minuten lang bei 500 x g bei RT und schnippen Sie, um den Überstand zu verwerfen. Resuspendieren Sie die Zellen in 200 μl FACS-Puffer mit einer P200-Pipette für die Durchflusszytometrie. Versiegelung mit transparenter Folie für den Transport zum Zytometer.
- Aliquot extrazellulär gefärbte Zellen aus Abschnitt 1.5.2 in 96-Well-Platten (5 x 104- 1 x 106 Zellen). Schleudern Sie die Zellen 5 Minuten lang bei 500 x g bei 4 °C und schnippen Sie, um den FACS-Puffer zu entfernen.
- Durchflusszytometrie
- Um das vorgeschlagene Antikörperpanel zu analysieren, stellen Sie sicher, dass das Zytometer mit mindestens vier Lasern ausgestattet ist, darunter violett (405 nm), blau (488 nm), gelb (561 nm) und rot (633 nm). Das Zytometer benötigt Filter, um FITC (blau-525 nm), KRO (violett-525 nm), PE (gelb-585 nm) und APC (rot-660 nm) zu erkennen. Fügen Sie je nach gewähltem Zytometer zusätzliche Antikörper hinzu.
- Kalibrierung und Standardisierung: Lassen Sie zu Beginn jedes Experiments Regenbogenfluoreszenzperlen laufen und passen Sie die Spannung der Photomultiplierröhre (PMT) an, bis die Kügelchenspitzen mit den Zielwerten früherer Experimente vergleichbar sind. Diese Methode der Standardisierung ermöglicht es, die Drift der Ausrüstung im Laufe der Zeit auszugleichen.
- Kompensation: Nachdem die PMT-Spannung und -Verstärkung für das Experiment eingestellt wurden, verwenden Sie Antikörper-eingefangene Kompensationskügelchen, um die Kompensationsmatrix für das Antikörperpanel festzulegen. Diese Berechnung stellt sicher, dass die Fluorophore nicht zu den Signaländerungen in anderen Kanälen beitragen. Dies ist zunehmend notwendig, wenn mehrere Antikörper gemultiplext werden.
- Größen-Gating: Zeichnen Sie in einem Punktdiagramm SSC-A auf log im Vergleich zu FSC-H auf linear. Entfernen Sie Trümmer und wählen Sie die Zellengröße mit dem S1-Gate aus. Wählen Sie für Singulett-Zellen in einem Punktdiagramm von FSC-W vs. FSC-H und Gate als S2 aus. (Abbildung 4).
- Etablierung von Fluorophor-Gattern: Legen Sie unter Verwendung des relevanten FMO für jeden Fluorophorkanal die Gates fest, um anhand von Histogrammen mit einzelnen Parametern zu bestimmen, was ein positives Signal in jedem Kanal ist (Abbildung 4).
- Vermessung der Proben: Nehmen Sie die Proben sorgfältig mit der etablierten Anschnittstrategie auf. Identifizierung der Mikroglia mit Hilfe des P2RY12+-Signals, Bestimmung der Expression des Proteins in den jeweiligen Kanälen nur für die Mikroglia.
- Datenanalyse der Durchflusszytometrie
- Einrichten von Analyse-Gates: Verwenden Sie die obigen Schritte für das Zytometer auf der Benutzeroberfläche der Analysesoftware und verwenden Sie dieselben Gates, die für die Aufzeichnung für die Analyse verwendet werden.
- Ermitteln Sie MFI-Werte mit einer Durchflusszytometrie-Analysesoftware (siehe Materialtabelle für Empfehlungen): Rekapitulieren Sie die Zytometer-Gating-Strategie für die Durchflussanalyse. Wählen Sie mit der Funktion "Statistiken hinzufügen" den Median für die interessierende Grundgesamtheit (z. B. 568+) auf der kompensierten Kanalhöhe aus. Exportieren Sie mit dem Tabelleneditor die mittleren Werte für die Fluoreszenzintensität (MFI) für die jeweiligen Kanäle in eine Tabelle, um mit der statistischen Analyse fortzufahren (Tabelle 2).
ANMERKUNG: Die Zusatzdatei S1 enthält Beispieldaten von mit Lipopolysaccharid (LPS) und phosphatgepufferter Kochsalzlösung (PBS) injizierten Mäusen sowie eine Beispielanalysedatei mit der Gating-Strategie und den MFI-Werten. - Analyse der MFI-Werte zur Proteinfaltungsänderung: Berechnen Sie nach Erhalt der MFI-Werte die Faltungsänderung des MFI relativ zur Kontrollpopulation oder zur unbehandelten Population (Gleichung 1). Die MFI-Faltungsänderung spiegelt die Faltenänderung der Proteingehalte wider. Bewerten Sie anhand der Faltungsänderungswerte die Änderung der Ausprägung, und berechnen Sie die statistische Signifikanz mithilfe eines t-Tests oder einer ANOVA.
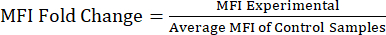 Gleichung 1
Gleichung 1
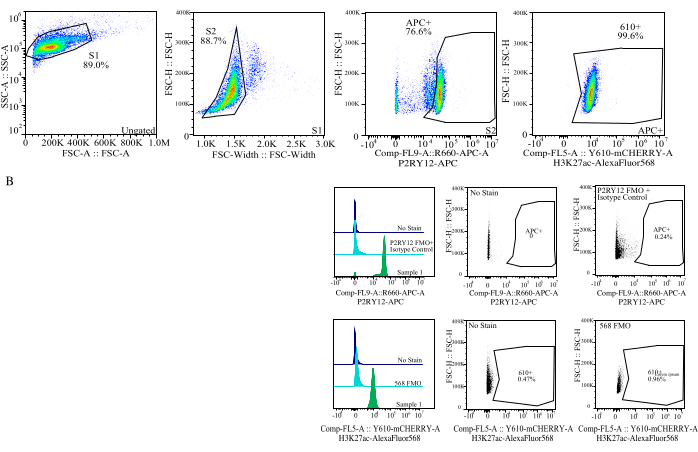
Abbildung 4: Gating-Strategie für die Bewertung von Protein-MFIs. Ereignisse werden zuerst für die Zellengröße auf SSC-A im Vergleich zu FSC-H (S1) festgelegt. Die Zellen werden dann für Singuletts auf FSC-H vs. FSC-W (S2) abgegrenzt. Singulettzellen werden dann durch das P2RY12-APC-Signal (APC+) als Mikroglia identifiziert, wobei das Gate auf der Grundlage der Fluoreszenz in einer APC-FMO-Kontrolle hergestellt wird, die einen Isotyp-Kontrollantikörper enthält. Die Zellen werden dann für das H3K27Ac-AlexaFluor568-Signal auf Comp-FL5-A::Y610-mCherry angesteuert. Die Fluoreszenzintensität der 610+ Zellen wird als Proxy für die Proteinexpression bestimmt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Repräsentative Ergebnisse
Adulte Mäuse wurden transkardial perfundiert und für die Mikroglia-Isolierung geopfert. Die Mikroglia wurden auf Eis isoliert und mit P2RY12-APC und violetten 525 lebend toten Antikörpern gefärbt. Zellen, die positiv für P2RY12 und negativ für violette 525 lebende tote Färbung waren, wurden als lebende Mikroglia sortiert. Die durchschnittliche Ausbeute an Mikroglia aus einem präparierten Mäusegehirn betrug 1,28 x 105 ± 0,05 (Mittelwert ± Standardfehler des Mittelwerts (REM), N=100). Es gibt keinen Unterschied in der Ausbeute von Mikroglia von weiblichen (1,25 x 105 ± 0,09 [Mittelwert ± SEM, N=46]) und männlichen (1,32 x 105 ± 0,07 [Mittelwert ± SEM, N=54]) Mäusen (t(98)=0,6365, p=0,526). Bei der Isolierung aus bestimmten Hirnregionen beträgt die durchschnittliche Ausbeute an Mikroglia aus Mauskortex 8,3 x 104 ± 0,08 (Mittelwert ± SEM, N=15) und aus dem Hippocampus der Maus beträgt 4,1 x 104 ± 0,02 (Mittelwert ± SEM, N=16). Wie erwartet, gibt es einen signifikanten Unterschied in der Ausbeute an Mikroglia aus jeder Hirnregion (F(2, 128)=25,25, P<0,0001). Nach der Isolierung der Mikroglia wurde die RNA aus den isolierten Zellen mit einem Low-Input-RNA-Isolationskit extrahiert. Konstant lag der RNA-Integritäts-Score (RIN) über 9,0 (9,62 ± 0,05) und die durchschnittliche Ausbeute an RNA pro Zelle betrug 0,25 ± 0,01 pg (Mittelwert ± SEM, N=32; Ergänzungsdatei S2).
Adulten Mäusen wurde 24 Stunden vor der Tötung 1 mg/kg Lipopolysaccharid (LPS) intraperitoneal injiziert. Die Mäuse wurden transkardial mit HBSS perfundiert und Mikroglia aus dem gesamten Gehirn gemäß dem beschriebenen Protokoll isoliert (Abbildung 5A). Für jede Färbung wurden 20.000-30.000 Zellen jedem Antikörperpanel zugeordnet. Die globalen Konzentrationen der Histon-3-Lysin-27-Acetylierung (H3K27Ac) wurden in isolierten Mikroglia mittels Durchflusszytometrie bestimmt. Bei männlichen und weiblichen Mäusen induzierte die LPS-Behandlung einen Anstieg von H3K27Ac, wenn der MFI innerhalb des Geschlechts normalisiert ist (t(6)=9,676, p<0,0001; Abbildung 5B). Bei der Untersuchung der Histogramme für die gefärbten Zellen bleiben die Populationen normalverteilt mit ähnlicher Variation; Die Zellen sind jedoch auf erhöhte Fluoreszenz umgestiegen, was zu einem Anstieg des MFI führt (Abbildung 5C). Bei der Untersuchung von H3K9Ac in der gleichen Behandlung kommt es zu einem ähnlichen Anstieg von H3K9Ac (t(6)=7,299, p=0,0003; Abbildung 5D,E) ist jedoch die Faltungsänderung des LPS relativ zum PBS des H3K9Ac-Signals geringer als das des H3K27Ac-Signals.
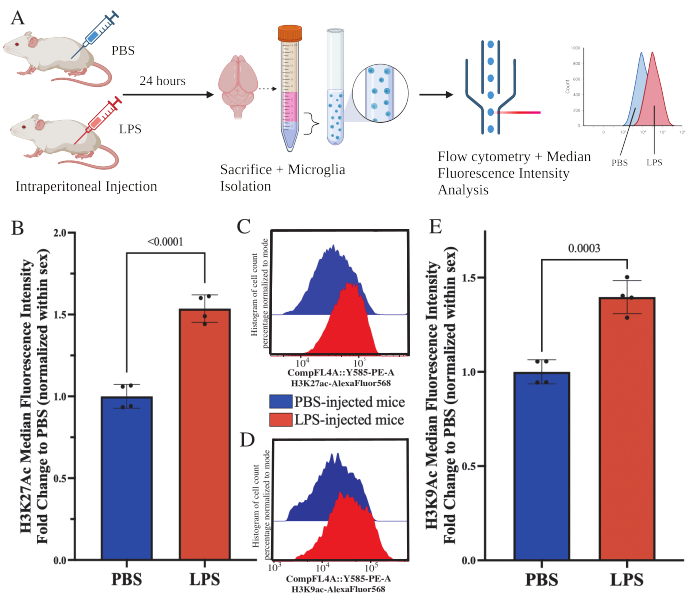
Abbildung 5: Globale Veränderungen der Histonacetylierung in isolierten Mikroglia. (A) Mäusen werden 24 Stunden vor der Tötung intraperitoneal phosphatgepufferte Kochsalzlösung (PBS) oder 1 mg/kg Lipopolysaccharid (LPS) injiziert. Die Mikroglia werden aus der immunangereicherten Fraktion entnommen und für die Durchflusszytometrie und die Bewertung der globalen Histonmodifikation nach translationaler Modifikation fixiert. Die mediane Fluoreszenzintensität wird als Proxy für die Proteinexpression bestimmt. Erstellt mit BioRender.com. (B) Die globalen Konzentrationen von H3K27Ac stiegen als Reaktion auf die LPS-Behandlung an. Faltenwechsel zu PBS normalisiert innerhalb von Experiment und Sex. Unpaarter zweischwänziger t-Test, t(6)=9,676, p<0,0001. Das Balkendiagramm zeigt den Mittelwert ± SEM. N=8 Tiere; 2 pro Bedingung in 2 unabhängigen Experimenten. (C) Beispielhistogramme, die die Verschiebung der H3K27Ac-Fluoreszenzintensität darstellen. Modal stellt Histogramme von PBS-injizierten im Vergleich zu LPS-injizierten Mäusen dar. (D) Beispielhistogramme, die die Verschiebung der H3K9Ac-Fluoreszenzintensität darstellen. Modal stellt Histogramme von PBS-injizierten im Vergleich zu LPS-injizierten Mäusen dar. (E) Die globalen Konzentrationen von H3K9Ac stiegen als Reaktion auf die LPS-Behandlung an. Faltenwechsel zu PBS normalisiert innerhalb von Experiment und Sex. Unpaarter zweischwänziger t-Test, t(6)=7,299, p=0,0003. Das Balkendiagramm zeigt den Mittelwert ± SEM. N=8 Tiere; 2 pro Bedingung in 2 unabhängigen Experimenten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Um zu bestätigen, dass die beschriebene Methode mit anderen bisher verwendeten Methoden zur Quantifizierung der globalen Histonmodifikation vergleichbar ist, haben wir versucht, Immunoblot als Vergleichswerkzeug zu verwenden. Die Ausbeute der isolierten Mikroglia ist jedoch schlichtweg zu gering, um eine vernünftige Beurteilung zu ermöglichen. Daher haben wir kultivierte BV2-Zellen verwendet, um die intrazelluläre Durchflusszytometrie-Methode mit einem Western Blot (WB) zu vergleichen. BV2-Zellen wurden in kompletten Medien (DMEMF12, 10% FBS, 1x Penicillin/Streptamycin und 1x L-Glutamin) bei 37 °C, 5% CO2 gezüchtet. Die Zellen wurden mit 0,25 % Trypsin-EDTA durchgelassen und mit einer Dichte von 250.000 Zellen/Well plattiert und in reduziertem Serummedium (DMEM F12, 2 % FBS, 1x Penicillin/Streptamycin und 1x L-Glutamin) behandelt und 12 h lang bei 37 °C, 5 %CO2 behandelt. Die Zellen wurden 24 h lang mit 25 ng/ml LPS behandelt, bevor sie wie oben beschrieben fixiert oder mit einem WB-Lysepuffer lysierten. Das Signal von H3K27Ac wurde mit beiden Methoden durchgeführt, wobei GAPDH als Ladekontrolle für WB verwendet wurde. Für jede Gruppe wurde eine Analyse der normalisierten Fluoreszenzintensität im Vergleich zur PBS-Kontrolle ermittelt (Abbildung 6A). Bei der Untersuchung der Änderung des normalisierten H3K27Ac-Signals durch WB gab es einen 1,527-fachen Anstieg des LPS-behandelten Zustands im Vergleich zurH2O-Kontrolle, der durch den ungepaarten t-Test als signifikant bestimmt wurde (t=3,024, df=5; p=0,0293). Bei der Untersuchung der Veränderung mittels Durchflusszytometrie zeigte sich eine 1,482-fache Zunahme des LPS-behandelten Zustandes, die als signifikant bestimmt wurde (t=7,843, df=10; p<0,0001). Mit Hilfe einer 2-Wege-ANOVA zum Vergleich der Methoden wurde ein signifikanter Effekt der Behandlung (F(1,15)=45,21,p<0,0001) festgestellt, nicht jedoch der Methode (F(1,15)=0,05545, p=0,8697) oder der Interaktion (F(1,15)=0,02785, p=0,8697). Darüber hinaus verifizieren wir hier, dass es sowohl durch Western Blot als auch durch Durchflusszytometrie keine Veränderung der Histon-H3-Spiegel gibt, da die 2-Wege-ANOVA keinen signifikanten Effekt der LPS-Behandlung (F(1,7)=0,02170,p=0,8870), der Methode (F(1,7)=0,01191, p=0,9162) oder der Interaktion (F(1,7=0,01191, p=0,9162; Abbildung 6B). Beispielhafte Blots und Histogrammverschiebungen für diese Daten sind ebenfalls dargestellt (Abbildung 6C,D).
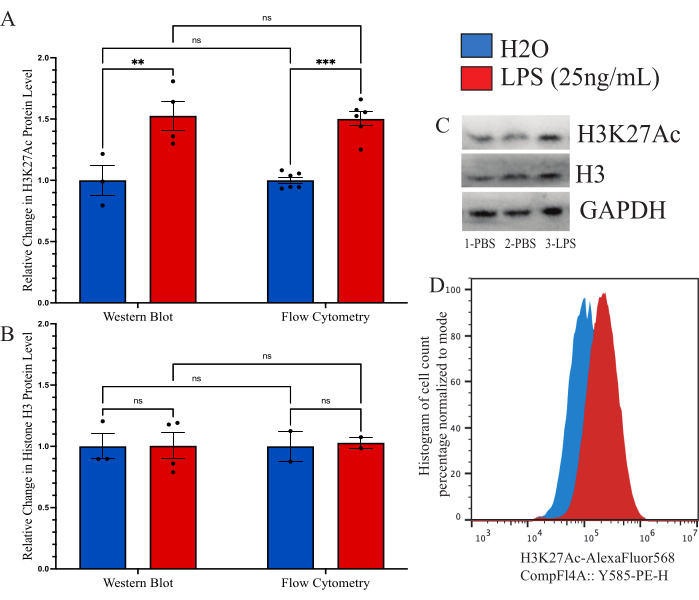
Abbildung 6: Methodenvergleich zur Quantifizierung der globalen Änderung der Histonmodifikation zwischen Durchflusszytometrie und Western Blot. (A) BV2-Zellen werden vor der Analyse 24 h lang mit 25 ng/ml Lipopolysaccharid (LPS) oderH2Obehandelt. Die Fluoreszenzintensität von H3K27Ac wird sowohl für die Durchflusszytometrie als auch für den Western Blot als Faltenänderung der Vehikelkontrolle, der phosphatgepufferten Kochsalzlösung (PBS), dargestellt. Die 2-Wege-ANOVA zeigte einen signifikanten Effekt der LPS-Behandlung (F(1,15)=45,21, p<0,0001), aber nicht die Methode (F(1,15)=0,05545, p=0,8697) oder die Interaktion (F(1,15)=0,02785, p=0,8697). Die Tukey-Korrektur für das Testen mehrerer Hypothesen wurde auf die Residuen angewendet. * präsentiert 0,0332, ** präsentiert 0,0021. (B) Die Fluoreszenzintensität für Histon H3 wird sowohl für die Durchflusszytometrie als auch für den Western Blot als Faltenänderung zu PBS dargestellt. Die 2-Wege-ANOVA ergab keinen signifikanten Effekt der LPS-Behandlung (F(1,7)=0,02170, p=0,8870) oder der Methode (F(1,7)=0,01191, p=0,9162) oder der Interaktion (F(1,7=0,01191, p=0,9162). (C) Beispielhafte Blots und (D) Durchflusszytometrie-Verschiebungen werden dargestellt. Die Größe des Histogramms wird basierend auf der Anzahl der Zellen, die bei der Fluoreszenzintensität des Modus vorhanden sind, auf Prozent normalisiert. Das Balkendiagramm stellt das mittlere SEM dar. n=2 unabhängige Experimente, 2 pro Bedingung pro Experiment. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Insgesamt zeigen diese Ergebnisse, dass diese Technik verwendet werden kann, um die globalen HPTM-Konzentrationen in isolierten Mikroglia quantitativ zu bestimmen. Darüber hinaus zeigte sich, dass die Methode mit früheren Techniken vergleichbar ist, jedoch viel geringere Zelleingaben erfordert. Darüber hinaus kann die vorliegende Technik, auch wenn sie nicht gezeigt wurde, mit einer angemessenen Kompensation mit mehreren Antikörpern auf demselben Panel verwendet werden, um verschiedene HPTMs zu bewerten.
Ergänzungsdatei S1: Beispiel-Analysedateien. Diese Datei enthält eine WSP-Analysedatei und 7 FCS-Dateien, darunter die keine Färbung, P2RY12FMO, 568FMO, zwei PBS-behandelte Tiere und zwei LPS-behandelte Tiere, die mit H3K27Ac gefärbt wurden. Der Zweck dieser Datei besteht darin, die Analyse und das Gating eines Experiments zu demonstrieren, das darstellen könnte, wie ein erfolgreiches Experiment aussieht. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei S2: Isolationsdaten. Die enthaltene Datei enthält die relevanten Daten nach der Mikroglia-Sortierung, die die Mikroglia- und RNA-Ausbeute aus dem beschriebenen Protokoll enthalten. Bitte klicken Sie hier, um diese Datei herunterzuladen.
| GESCHLOSSENE BEVÖLKERUNG | Häufigkeit der übergeordneten | Häufigkeit der Gesamtanzahl | Zählen |
| S1 | 89.00% | 89.00% | 25672 |
| S2>S1 | 88.73% | 78.97% | 22779 |
| APC+ > S2 > S1 | 76.61% | 60.50% | 17452 |
| 610+ > APC+ > S2 > S1 | 99.56% | 60.24% | 17376 |
Tabelle 2: Das Beispiel für ein Probenherkunftsdiagramm zeigt den Prozentsatz und die Ereigniszahlen, die für einen genauen Proteinnachweis erforderlich sind.
Diskussion
Das vorgestellte Protokoll ermöglicht die quantitative Bestimmung der globalen HPTM-Spiegel mittels Durchflusszytometrie. Obwohl dieses Protokoll eine neuartige Methode darstellt, haben frühere Studien die quantitative Bewertung von Proteinen mit einem ähnlichen Ansatz durchgeführt26. Zu den bisherigen Methoden, die zur Bestimmung des globalen HPTM-Niveaus verwendet wurden, gehören die Immunhistochemie und der Western Blot 16,17,19,20. Die vorgestellte auf Durchflusszytometrie basierende Methode ist eine leicht quantifizierbare Methode, während Western Blot und Immunhistochemie semi-quantitativ sind und einen geringeren Durchsatz aufweisen. Western Blot beruht auf Zelllyse und erfordert daher sowohl eine Proteinnormalisierung als auch ein Beladungskontrollprotein, von dem angenommen wird, dass es durch die experimentelle Bedingungunverändert bleibt 27. Die Immunhistochemie ist semiquantitativ und hat einen sehr geringen Durchsatz, da es schwierig ist, die Proteinmenge quantitativ zu bestimmen, ohne sie auf Einzelzellebene zu untersuchen16. In ähnlicher Weise ist die Verwendung der Durchflusszytometrie-Methode für die isolierten Mikroglia aufgrund der begrenzten Ausbeute von Vorteil, da Western Blot einen viel größeren Proteininput erfordert19. Die niedrigen Anforderungen an die Zellzahl ermöglichen es, mehrere Färbepanels vom selben Tier zu verwenden.
Wie bei jeder anderen Methode gibt es jedoch auch bei dieser Technik Einschränkungen, einschließlich der Kosten und der Verfügbarkeit von Antikörpern, da nicht alle Antikörper in einer Durchflusszytometrie gut funktionieren. Darüber hinaus ist die erforderliche Antikörperkonzentration im Vergleich zum Immunoblot viel höher. Während das Multiplexing die Verwendung mehrerer Antikörper auf derselben Zellgruppe ermöglicht, können die Zellen nach der Analyse nicht von dem Antikörper befreit werden, wodurch die Zellverwendung auf einen Antikörper pro Antikörperspezies beschränkt wird. Dies unterscheidet sich vom Immunoblot, bei dem derselbe Blot wiederholt verwendet werden kann. Abhängig von der Verfügbarkeit von Antikörpern und der Anzahl der Nachweiskanäle auf einem Zytometer wäre es jedoch möglich, bis zu einem Dutzend Markierungen gleichzeitig zu untersuchen.
Die derzeitige Methode erfasst nur globale Proteinexpressionsniveaus und nicht die spezifische genomische Lokalisation, und Änderungen der globalen Niveaus spiegeln möglicherweise keine Veränderungen an einzelnen genomischen Loci wider. In ähnlicher Weise bedeutet das Fehlen von Veränderungen in den globalen Konzentrationen nicht, dass keine genomischen Loci Veränderungen erfahren, sondern lediglich, dass die globalen Veränderungen in der Summe keine Unterschiede zwischen den Behandlungen ergeben. Daher soll diese Technik als Screening verwendet werden, um HPTMs zu identifizieren, die für die Genomanalyse von Interesse sind. Darüber hinaus erlaubt diese Methode keinen Vergleich zwischen verschiedenen Proteinmarkierungen, es sei denn, sie wird als Faltungsänderung zur Kontrolle bewertet. Daher ist dies im Vergleich zu einer standardmäßigen kurvenbasierten Methode wie dem ELISA zur Proteinbestimmung begrenzt.
Das vorgestellte Protokoll bietet eine Strategie zur Isolierung lebender Hirnmikroglia. Dieses Protokoll basiert auf der Expression des P2RY12-Proteins für die Isolierung von Mikroglia. P2RY12 ist jedoch ein homöostatischer Marker in Mikroglia und kann in Krankheitsmodellen wie 5XFAD22 herunterreguliert werden. Achten Sie daher bei der Verwendung eines Krankheitsmodelltieres darauf, andere Markerproteine wie TMEM119, CD11b oder CD45 zu wählen, um die Isolierung von Mikroglia23 zu unterstützen. In ähnlicher Weise stellen wir dieses Protokoll als Isolierung vom Hippocampus und/oder dem Kortex dar. Dieses Protokoll würde funktionieren, um Mikroglia aus anderen Gehirnregionen, einschließlich Regionen der weißen Substanz, zu isolieren, jedoch können mehrere Tiere erforderlich sein, um je nach Größe der interessierenden Regionen genügend Mikroglia zu erhalten.
Das vorgestellte Protokoll kann lebende Gehirnmikroglia robust isolieren, aber es gibt mehrere Schritte, die im Folgenden beschrieben werden, in der Isolationsphase, die die Zellausbeute verringern können, wenn sie falsch durchgeführt werden.
Perfusionen für dieses Protokoll führen zu einem höheren Prozentsatz an Mikroglia im immunangereicherten Fragment, was die Zeit am Sortierer verkürzt. Eine Perfusion ist jedoch nicht erforderlich, und bei Bedarf können andere Methoden der Euthanasie angewendet werden.
Bei der Isolierung von Mikroglia sollte das Myelin vollständig entfernt werden. Durchflusszytometer sind darauf angewiesen, dass Zellen in der Lage sind, sich in einem schnellen Tempo durch enge Schläuche zu bewegen. Aufgrund seiner Viskosität und seiner Neigung zum Verklumpen verursacht Myelin Probleme mit Zytometern, die oft zu Verstopfungen führen, die sowohl das Gerät beschädigen als auch die Probe zerstören können, was die Ausbeute drastisch reduziert. Seien Sie vorsichtig, um das gesamte Myelin während der Entnahme von immunangereicherten Fragmenten zu entfernen, um Probleme stromabwärts zu vermeiden.
Plattenfärbung versus Röhrchenfärbung: In diesem Protokoll haben wir zwei Optionen für die Färbung von Zellen in 1,5-ml-Röhrchen oder einer 96-Well-Platte beschrieben. Der Anwendungsfall hängt jeweils vom Experiment ab. Im Allgemeinen ist die Röhrchenfärbung jedoch ein geringeres Risiko, die Ausbeute zu beeinträchtigen, als die Plattenfärbung, da das Flicken bei falscher Durchführung den Verlust von Zellen riskiert. Die Plattenfärbung ist viel schneller, da das Absaugen des Überstandes für jedes Röhrchen zeitaufwändig ist. Verwenden Sie vor der Fixierung (zum Sortieren usw.) eine Röhrchenfärbung, um die Ausbeute zu maximieren und das Verlustrisiko zu verringern. Bei der HPTM-Analyse ist das Pellet jedoch stabiler, sobald die Zellen für die intranukleäre Färbung fixiert sind, und es besteht ein geringeres Verlustrisiko beim Schnippen.
Etablierung des diskontinuierlichen Dichtegradienten: Bei der Etablierung der Schichtung ist es wichtig, die Schichten richtig einzurichten, um die immunangereicherte Fraktion zu erhalten. Wenn die Schichten gestört oder vermischt sind und trüb erscheinen, sortieren sich die Zellen nicht an ihren gewünschten Ort, und es wird schwierig sein, die immunangereicherte Zellfraktion zu erhalten. Wenn dies der Fall ist, schleudern Sie mit dem Dichtemedium, um das Myelin zu entfernen, und sammeln Sie dann die gesamten verbleibenden Fraktionen, verdünnen Sie mit 3 ml FACS-Puffer auf 1 ml Dichtemedium und mischen Sie gut (dies erfordert mehrere Röhrchen). Bei 500 x g 10 min bei eingeschalteter Bremse schleudern. Verwerfen Sie den Überstand und lassen Sie nur ~300 μl Lösung übrig. Entnehmen Sie die gesamte Probe und färben Sie sie ein. Dies führt zu reduzierten Sortierprozentsätzen und einer höheren Zeit, die am Zytometer verbracht wird, aber die Ausbeute kann immer noch vergleichbar sein.
Bei der Verwendung der Isolationsmethode ist es von Vorteil, Zellen für RNA und für die HPTM-Auswertung aus demselben Mäusegehirn sammeln zu können. In dieser Situation können die Zellen nach dem Sortieren der lebenden Mikroglia geteilt werden, um einen Teil für die RNA-Bewertung (die Mindestanzahl der Zellen, um eine anständige RNA-Ausbeute zu erhalten, beträgt 75.000 Zellen) und einen Teil für die weitere Durchflusszytometrie-Analyse (mindestens 10.000 Zellen pro Vertiefung für eine gute Bestimmung des MFI) zuzuweisen. In diesem Fall ist eine Durchflusszytometer-Sortierung erforderlich. Wenn die Zellen jedoch nur für die HPTM-Analyse verwendet werden sollen, ist keine Sortierung erforderlich, und die Immunfraktion kann mit dem P2RY12-Antikörper und dem HPTM-Antikörper gefärbt werden. Das Gating am Zytometer kann dann für P2RY12+-Mikroglia eingestellt werden, wie es bei der Durchflusssortierung der Fall wäre, um nur das HPTM-Signal innerhalb der Mikroglia zu analysieren. Durch den Wegfall der Sortierung kann das Protokoll schneller und kostengünstiger werden. Darüber hinaus ist es bei der Bewertung von HPTMs aus kultivierten Zellen ausreichend, mit dem Färbeprotokoll zu beginnen, und es sind keine Zellmarker-Antikörper erforderlich, wie in Abbildung 6 gezeigt. Das HPTM-Evaluierungsprotokoll kann für viele Zelltypen verwendet werden, einschließlich kultivierter, primärer und IPSC-abgeleiteter Zellen.
Während wir nur zwei mögliche Anwendungen von Mikroglia nach der Isolierung vorgestellt haben, gibt es viele andere, darunter epigenetische Techniken wie ChIP, CUT&Tag und CUT&RUN. Im Falle genomischer epigenetischer Techniken, bei denen die Charakterisierung von Veränderungen an bestimmten Loci von Interesse ist, sind spezifische Inhibitoren für Schreiber und Radierer von Chromatinmarkierungen11 zu wählen, die auf die Experimente zugeschnitten sind, um sicherzustellen, dass alle mikrogliaartigen epigenetischen Modifikationen, die profiliert werden, keine technischen Artefakte aus irgendwelchen Schritten des Isolierungsverfahrens, wie z. B. der enzymatischen Verdauung, sind. Bei der Beurteilung von Veränderungen der globalen Niveaus epigenetischer Markierungen, wie z. B. mit Hilfe der quantitativen Durchflusszytometrie, ist nicht zu erwarten, dass verfahrensbedingte Veränderungen so groß sind, dass sie auf globaler Ebene erkannt werden.
Insgesamt stellen die diskutierten Methoden eine neuartige Einzelzellmethode zur Quantifizierung globaler Konzentrationen von Histonmodifikationen und anderen epigenetischen Veränderungen mittels Durchflusszytometrie dar. Wir konnten zeigen, dass diese Methode ausreichend sensitiv ist, um globale Veränderungen des Enhancer-Markers H3K27ac in Mikroglia als Reaktion auf LPS in vivo zu detektieren. Dies stimmt mit der früheren ChIP-Sequenzierung von H3K27ac nach LPS-Stimulation überein, die einen dramatischen Umbau von Enhancern zeigte, die auf LPS28 ansprechen. Die Anwendung dieser Methode wird es ermöglichen, globale epigenetische Veränderungen über verschiedene Gehirnzelltypen hinweg in Entwicklung und Krankheit zu untersuchen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Vielen Dank an Yanyang Bai für die Hilfe beim Immunoblot in Abbildung 5. Diese Arbeit wurde von den Canadian Institutes for Health Research [CRC-RS 950-232402 to AC] unterstützt; Kanadische Forschungsrat für Naturwissenschaften und Ingenieurwissenschaften [RGPIN-2019-04450, DGECR-2019-00069 bis AC]; Scottish Rite Charitable Foundation [21103 bis AC] und die Brain Canada Foundation [AWD-023132 bis AC]; Aborigine-Graduiertenstipendium der Universität von British Columbia (6481 bis MT); British Columbia Graduiertenstipendium (6768 bis MT); Kanadische Open Neuroscience Platform Student Scholar Award (10901 bis JK); Vierjähriges Promotionsstipendium der University of British Columbia (6569 für JK). Die Geldgeber spielten keine Rolle beim Studiendesign, bei der Datenerhebung und -analyse, bei der Entscheidung über die Veröffentlichung oder bei der Vorbereitung des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.5M EDTA | Invitrogen | AM9260G | |
| 15 mL Falcon Centrifuge Tubes, Polypropylene, Sterile | Falcon | 352196 | |
| 24-well Clear Not Treated Plates | Costar | 3738 | |
| 2-Mercaptoethanol | Gibco | 21985023 | |
| 96 Well Clear Polystyrene Microplate, clear round bottom, non treated surface | Corning | 3788 | |
| Acetyl Histone 3 K9 (C5B11) | Cell Signalling Technology | 9649S | Dilution: 1:100 |
| Acetyl Histone H4 K8 (2594) | Cell Signalling Technology | 2594S | Dilution: 1:100 |
| Acetyl-Histone H3 K27 (D5E4) | Cell Signalling Technology | 8173S | Dilution: 1:100 |
| Acetyl-Histone H3 Lys27 (MA523516) | Invitrogen | MA523516 | Dilution: 1:100 |
| Actinomycin D | New England Biolabs | 15021S | |
| Anisomycin | New England Biolabs | 2222S | |
| Anti-Histone H3 (tri methyl K4) | Abcam | ab213224 | Dilution: 1:100 |
| Anti-Lactyl-Histone H4 (Lys 12) Rabbit mAb | PTM Biolabs | PTM-1411RM | Dilution: 1:250 |
| Anti-L-Lactyllysine Rabbit pAb | PRM Biolabs | PTM-1401RM | Dilution: 1:250 |
| Apc anti-P2RY12 Antibody, Clone: S16007D | BioLegend | 848006 | |
| BSA | Tocris | 5217 | |
| Cyto-Last Buffer | BioLegend | 422501 | |
| dimethylsulfoxide, sterile | Cell Signalling Technology | 12611S | |
| DNAse I | STEMCELL Technologies | 07900 | |
| Donkey Anti Mouse AlexaFluor488 | Jackson ImmunoResearch | 715-546-150 | Dilution: 1:500 |
| Donkey Anti Rabbit AlexaFluor488 | ABclonal | AS035 | Dilution: 1:500 |
| Donkey Anti Rabbit AlexaFluor568 | Invitrogen | A10042 | Dilution: 1:500 |
| Donkey Anti Rabbit Brilliant Violet 421 | BioLegend | 406410 | Dilution: 1:500 |
| Fisherbrand Disposable Graduated Transfer Pipettes | Fisherbrand | 13-711-9AM | |
| Fisherbrand Disposable PES Filter Unit, 250mL | Fisherbrand | FB12566502 | |
| H3K18ac Polyclonal Antibody | Invitrogen | 720095 | Dilution: 1:100 |
| HBSS (10X), no calcium, no magnesium, no phenol red | Gibco | 14185052 | |
| HBSS, no calcium, no magnesium, no phenol red | Gibco | 14175103 | |
| Histone 3 Trimethyl K27 (ab6002) | Abcam | ab6002 | Dilution: 1:100 |
| KONTES Dounce Tissue Grinders 125mm 7mL | VWR | 885300-0007 | |
| Lactyl-Histone H3 (Lys 18) Rabbit mAb | PTM BIolabs | PTM-1406RM | Dilution: 1:250 |
| Lipopolysacharide | Sigma-Aldrich | L5418 | |
| Normal Donkey Serum | Jackson ImmunoResearch | 017-000-121 | |
| OneComp eBeads Compensation Beads | Invitrogen | 01-1111-41 | |
| PDS Kit, Papain Vial - Worthington Biochemical | Cedarlane | LK003178 | |
| Percoll | Sigma-Aldrich | GE17-0891-02 | |
| Phenol Red | VWR | RC57004 | |
| QIAshredder | Qiagen | 79656 | |
| Rainbow Fluorescent Particles, 1 peak (3.0-3.4 uM - Mid Range Intensity | BioLegend | 422905 | |
| RNase-free Microfuge Tubes, 1.5 mL | Invitrogen | AM12400 | |
| Rneasy Plus Micro Kit | Qiagen | 74034 | |
| Round Bottom Polypropylene Tubes with Caps, 5 mL | Corning | 352063 | |
| Triptolide | New England Biolabs | 97539 | |
| True Nuclear Transcription Factor Buffer Set | BioLegend | 424401 | |
| TruStain FcX PLUS (anti-mouse CD16/32) Antibody | BioLegend | 156604 | |
| Trypan Blue | VWR | 97063-702 | |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 |
Referenzen
- Miller, J. L., Grant, P. A. The Role of DNA Methylation and Histone Modifications in Transcriptional Regulation in Humans. Epigenetics: Development and Disease. 61, 289-317 (2013).
- Kouzarides, T. Chromatin Modifications and Their Function. Cell. 128 (4), 693-705 (2007).
- Bannister, A. J., Kouzarides, T. Regulation of chromatin by histone modifications. Cell Research. 21 (3), 381-395 (2011).
- Barski, A., et al. High-resolution profiling of histone methylations in the human genome. Cell. 129 (4), 823-837 (2007).
- Vogel Ciernia, A., LaSalle, J. The landscape of DNA methylation amid a perfect storm of autism aetiologies. Nature Reviews. Neuroscience. 17 (7), 411-423 (2016).
- Keiser, A. A., et al. Systemic HDAC3 inhibition ameliorates impairments in synaptic plasticity caused by simulated galactic cosmic radiation exposure in male mice. Neurobiology of Learning and Memory. 178, 107367 (2021).
- McQuown, S. C., et al. HDAC3 is a critical negative regulator of long-term memory formation. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 31 (2), 764-774 (2011).
- Barrett, R. M., et al. Hippocampal Focal Knockout of CBP Affects Specific Histone Modifications, Long-Term Potentiation, and Long-Term Memory. Neuropsychopharmacology. 36 (8), 1545-1556 (2011).
- Datta, M., et al. Histone Deacetylases 1 and 2 Regulate Microglia Function during Development, Homeostasis, and Neurodegeneration in a Context-Dependent Manner. Immunity. 48 (3), 514.e6-529.e6 (2018).
- Belhocine, S., et al. Context-dependent transcriptional regulation of microglial proliferation. Glia. 70 (3), 572-589 (2022).
- Gosselin, D., et al. An environment-dependent transcriptional network specifies human microglia identity. Science (New York, N.Y.). 356 (6344), eaal3222 (2017).
- Kettenmann, H., Hanisch, U. -. K., Noda, M., Verkhratsky, A. Physiology of Microglia. Physiological Reviews. 91 (2), 461-553 (2011).
- Sullivan, O., Ciernia, A. V. Work hard, play hard: how sexually differentiated microglia work to shape social play and reproductive behavior. Frontiers in Behavioral Neuroscience. 16, 989011 (2022).
- Das, P. M., Ramachandran, K., vanWert, J., Singal, R. Chromatin immunoprecipitation assay. BioTechniques. 37 (6), 961-969 (2004).
- Mahmood, T., Yang, P. C. Western blot: technique, theory, and trouble shooting. North American Journal of Medical Sciences. 4 (9), 429-434 (2012).
- Crowe, A., Yue, W. Semi-quantitative Determination of Protein Expression Using Immunohistochemistry Staining and Analysis: An Integrated Protocol. BIO-PROTOCOL. 9 (24), (2019).
- Seligson, D. B., et al. Global histone modification patterns predict risk of prostate cancer recurrence. Nature. 435 (7046), 1262-1266 (2005).
- Liu, B., et al. Global Histone Modification Patterns as Prognostic Markers to Classify Glioma Patients. Cancer Epidemiology, Biomarkers & Prevention. 19 (11), 2888-2896 (2010).
- Pan, R. Y., et al. Positive feedback regulation of microglial glucose metabolism by histone H4 lysine 12 lactylation in Alzheimer's disease. Cell Metabolism. 34 (4), 634.e6-648.e6 (2022).
- Zhang, D., et al. Metabolic regulation of gene expression by histone lactylation. Nature. 574 (7779), 575-580 (2019).
- Pösel, C., Möller, K., Boltze, J., Wagner, D. C., Weise, G. Isolation and Flow Cytometric Analysis of Immune Cells from the Ischemic Mouse Brain. Journal of Visualized Experiments. (108), 53658 (2016).
- Oblak, A. L., et al. Comprehensive Evaluation of the 5XFAD Mouse Model for Preclinical Testing Applications: A MODEL-AD Study. Frontiers in Aging Neuroscience. 13, 713726 (2021).
- Bohlen, C. J., Bennett, F. C., Bennett, M. L. Isolation and Culture of Microglia. Current Protocols in Immunology. 125 (1), e70 (2019).
- McKinnon, K. M. Multiparameter Conventional Flow Cytometry. Flow Cytometry Protocols. 1678, 139-150 (2018).
- Marsh, S. E., et al. Dissection of artifactual and confounding glial signatures by single-cell sequencing of mouse and human brain. Nature Neuroscience. 25 (3), 306-316 (2022).
- Wang, L., Gaigalas, A. K., Marti, G., Abbasi, F., Hoffman, R. A. Toward quantitative fluorescence measurements with multicolor flow cytometry. Cytometry Part A. 73A (4), 279-288 (2008).
- Rumbaugh, G., Miller, C. A. Epigenetic changes in the brain: measuring global histone modifications. Methods in Molecular Biology (Clifton, N.J). 670, 263-274 (2011).
- Xavier, A. M., et al. Systematic delineation of signaling and epigenomic mechanisms underlying microglia inflammatory activity in acute and chronic brain pathologies. BioRvix. , (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten