Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
[Platzierung von extrakraniellen Stimulationselektroden und Messung des zerebralen Blutflusses und intrakranieller elektrischer Felder bei anästhesierten Mäusen
In diesem Artikel
Zusammenfassung
Wir beschreiben ein Protokoll zur Beurteilung von Dosis-Wirkungs-Kurven für extrakranielle Stimulation in Bezug auf elektrische Feldmessungen des Gehirns und einen relevanten Biomarker-zerebralen Blutfluss. Da bei diesem Protokoll eine invasive Elektrode in das Gehirn eingeführt wird, ist eine Vollnarkose erforderlich, wobei die Spontanatmung der kontrollierten Atmung vorgezogen wird.
Zusammenfassung
Der Nachweis von zerebralen Blutflussreaktionen (CBF) auf verschiedene Formen der neuronalen Aktivierung ist entscheidend für das Verständnis der dynamischen Gehirnfunktion und der Variationen in der Substratversorgung des Gehirns. In dieser Arbeit wird ein Protokoll zur Messung von CBF-Reaktionen auf transkranielle Wechselstromstimulation (tACS) beschrieben. Die Dosis-Wirkungs-Kurven werden sowohl aus der CBF-Änderung, die mit tACS (mA) auftritt, als auch aus dem intrakraniellen elektrischen Feld (mV/mm) geschätzt. Wir schätzen das intrakranielle elektrische Feld basierend auf den verschiedenen Amplituden, die von Glasmikroelektroden in jeder Seite des Gehirns gemessen werden. In dieser Arbeit beschreiben wir den Versuchsaufbau, der entweder die Verwendung von bilateralen Laser-Doppler-Sonden (LD) oder Laser-Speckle-Imaging (LSI) zur Messung des CBF beinhaltet; Daher erfordert dieser Aufbau eine Anästhesie für die Elektrodenplatzierung und -stabilität. Wir zeigen eine Korrelation zwischen der CBF-Antwort und dem Strom in Abhängigkeit vom Alter, wobei eine signifikant größere Reaktion bei höheren Strömen (1,5 mA und 2,0 mA) bei jungen Kontrolltieren (12-14 Wochen) im Vergleich zu älteren Tieren (28-32 Wochen) gezeigt wird (p < 0,005 Differenz). Wir zeigen auch eine signifikante CBF-Reaktion bei elektrischen Feldstärken <5 mV/mm, was ein wichtiger Aspekt für eventuelle Studien am Menschen ist. Diese CBF-Reaktionen werden auch stark durch den Einsatz von Anästhesie im Vergleich zu wachen Tieren, die Atmungskontrolle (d. h. intubierte vs. spontane Atmung), systemische Faktoren (d. h. CO2) und die lokale Leitung innerhalb der Blutgefäße beeinflusst, die durch Perizyten und Endothelzellen vermittelt wird. Ebenso können detailliertere Bildgebungs-/Aufzeichnungstechniken die Feldgröße vom gesamten Gehirn auf nur eine kleine Region beschränken. Wir beschreiben die Verwendung von extrakraniellen Elektroden für die Anwendung der tACS-Stimulation, einschließlich sowohl hausgemachter als auch kommerzieller Elektrodendesigns für Nagetiere, die gleichzeitige Messung des CBF und des intrakraniellen elektrischen Feldes unter Verwendung bilateraler Glas-DC-Aufzeichnungselektroden und die bildgebenden Ansätze. Wir wenden diese Techniken derzeit an, um ein Closed-Loop-Format zur Augmentierung des CBF in Tiermodellen für Alzheimer und Schlaganfall zu implementieren.
Einleitung
Die transkranielle Elektrostimulation (tES; mit Sinuswellenstimulation, tACS) ist ein gängiger, externer, nicht-invasiver Ansatz zur Neuromodulation des Gehirns 1,2. Zuvor stellten wir die Hypothese auf, dass tES (und insbesondere tACS) bei bestimmten Dosen den zerebralen Blutfluss (CBF) in den darunter liegenden Hirnregionen erhöhen kann3. Ferner kann eine Dosis-Wirkungs-Beziehung zwischen entweder dem angelegten externen Strom oder dem intrakraniellen elektrischen Feld und den resultierenden CBF-Reaktionen bestehen. Die meisten klinischen Stimulationsprotokolle haben sich jedoch auf ein maximal angenehmes Stimulationsniveau der Haut (d. h. ~ 2 mA) für geplante Zeiträume (d. h. 30-45 Minuten) als Behandlungsprotokoll konzentriert 4,5. Bei Nagetieren ist es möglich, mit invasiven, extrakraniellen Hirnelektroden, die direkt auf den Schädel aufgebracht werden, die durch tES6 induzierten elektrischen Felder im Gehirn zu untersuchen. Das Ziel dieses Ansatzes ist es daher, die Auswirkungen der Intensität von tACS bei relevanten Frequenzen auf CBF-Veränderungen in Bezug auf die Dosis-Wirkungs-Beziehung zu bestimmen. Diese Dosis-Wirkungs-Kurve basiert auf einer kurzen physiologischen Biomarker-direkten Messung des CBF-in Bezug auf das elektrische Feld, das auf das Gehirn ausgeübt wird3. Wir haben bereits gezeigt, dass es bei größeren Amplituden, die typischerweise außerhalb des Bereichs der elektrischen Felder im Gehirn liegen, die klinisch durch tACS induziert werden, eine nahezu lineare Korrelation zwischen dem induzierten elektrischen Feld und dem CBF im Kortexgibt 3. Eine Stimulation mit geringerem Feld (d. h. 1-5 mV/mm Intensität) kann jedoch für den Einsatz beim Menschen relevanter und praktikabler sein. Daher haben wir unsere Techniken modifiziert, um kleinere CBF-Veränderungen zu erkennen.
In dieser Arbeit wird ein Protokoll zur Analyse der Auswirkungen von tES-Wechselströmen (tACS) mit geringerer Feldstärke auf CBF (d. h. 0,5-2,0 mA Strom, 1-5 mV/mm elektrisches Feld) beschrieben, die von wachen Nagetieren toleriert werden können5. Dieses Protokoll beinhaltet die Verwendung von neuartiger Laser-Speckle-Bildgebung während der tACS sowie von zwei intrakraniellen Glaselektroden, um sowohl die Ausbreitung des aktiven tACS im Gehirn (wie vom CBF überwacht) als auch die intrakranielle elektrische Feldintensität zu bestimmen, die sowohl als Diagramm als auch als tatsächliches experimentelles Foto gezeigt wird (Abbildung 1). Es gibt viele mögliche physiologische Wirkungen von tES im Gehirn, einschließlich direkter neuronaler Modulation, neuronaler Plastizität und Astrozytenaktivierung 7,8. Obwohl der CBF mit tDCS 9,10 gemessen wurde, waren diese Messungen langsam, indirekt und unzureichend, um die Dosis-Wirkungs-Funktion im Gehirn zu beurteilen. Daher können wir durch die Verwendung geeigneter Kurzzeit-Biomarker (d. h. CBF, elektrische Felder) und schneller Ein-/Aus-Sequenzen von tACS die Dosis-Wirkungs-Funktion genauer abschätzen. Darüber hinaus können wir verschiedene Techniken zur Messung des CBF anwenden, darunter sowohl fokale Laser-Doppler-Sonden (LD) als auch Laser-Speckle-Imaging (LSI) mit definierten Regionen von Interesse.
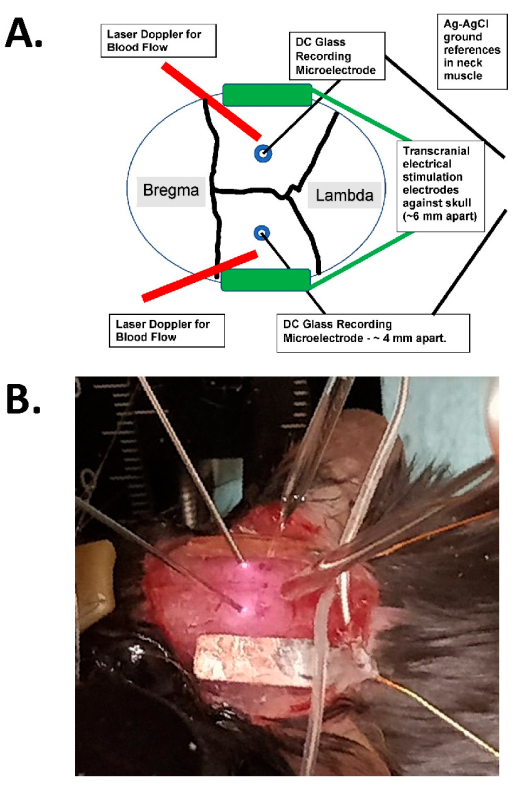
Abbildung 1: Diagramm der transkraniellen Stimulation und fotografisches Beispiel. (A) Diagramm des Aufbaus der transkraniellen Stimulation. Das Diagramm zeigt einen Mäuseschädel mit koronalen und sagittalen Nähten. Die transkraniellen Elektroden werden lateral und symmetrisch auf dem Schädel platziert und mit chirurgischem Kleber und leitfähiger Paste zwischen den Elektroden und dem Schädel befestigt. Diese Elektroden sind mit einem für den Menschen kompatiblen Konstantstrom-Stimulationsgerät verbunden, das die Frequenz, Amplitude und Dauer der Stimulation festlegen kann. Zur Beurteilung der intrakraniellen elektrischen Felder werden bilaterale Glaselektroden (~2 MΩ) in der Großhirnrinde (d.h. innerhalb von 1 mm des inneren Aspekts des Schädels durch kleine Gratlöcher) platziert, die mit Mineralöl versiegelt sind und AgCl-Gründe im Nackenmuskel aufweisen (dargestellt als größere Drähte in der Mitte, die in das subkutane Halsgewebe eingegraben sind). Diese Glaselektroden sind mit einem Gleichstromverstärker verbunden, und ihre Ausgänge werden über einen Digitizer mit mindestens vier Kanälen aufgezeichnet. Für Aufnahmen werden auch bilaterale Laser-Doppler-Sonden auf dem Schädel platziert. Der gesamte Schädel wird entweder mit einem Laser-Speckle-Imaging-Gerät oder einer hochauflösenden (mindestens 1.024 x 1.024 Pixel, 12-14 Bit Pixeltiefe) gekühlten Kamera zur intrinsischen optischen Signaldetektion abgebildet. Die Hämoglobin-Isosbestfrequenz wird typischerweise (d. h. 562 nm) für die Beleuchtung für die Blutflussbildgebung gewählt. (B) Eine Nahaufnahme eines tatsächlichen Experiments, das die bilateralen Laser-Doppler-Sonden (links), die (bilateralen) intrakraniellen Glasaufzeichnungs-Mikroelektroden, die durch die Bohrlöcher platziert sind, und die tACS-Stimulationselektroden seitlich zeigt. Abkürzung: tACS = transkranielle Wechselstromstimulation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Um die Mechanismen zu bewerten, können wir auch Wechselwirkungen mit anderen physiologischen Prozessen untersuchen, die den CBF ebenfalls verändern, wie z.B. die K+-induzierte Spreading-Depolarisation11. Darüber hinaus ist es auch möglich, anstelle von geplanten Sitzungen zu regelmäßigen Zeiten ein geschlossenes Kreislaufsystem zu entwickeln, das auf zusätzlichen Biomarkern für eine Vielzahl von Krankheiten basiert, wie es für die Epilepsiebehandlungvorgeschlagen wurde 12 (d. h. klinische Neuropace-Geräte). Zum Beispiel basiert die Closed-Loop-Hirnstimulation bei der Parkinson-Krankheit in der Regel auf den intrinsischen, abnormalen lokalen Feldpotentialen (LFPs), die dieser Krankheit innewohnen, wenn nicht genügend Dopamin (typischerweise β-Band-LFPs)13 vorhanden ist.
Protokoll
Alle Tierbehandlungen wurden vom Institutional Animal Care and Use Committee an der Duke University oder der entsprechenden lokalen Behörde, die die Forschung mit Tieren reguliert, genehmigt. In der Materialtabelle finden Sie Details zu allen Materialien, Instrumenten und Geräten, die in diesem Protokoll verwendet werden.
1. Vorbereitung des Instruments
- Stellen Sie sicher, dass alle erforderlichen Gegenstände und chirurgischen Instrumente vorhanden sind (Abbildung 2): Kopfhautreinigungslösung (Alkoholpads), Klebeband, Pinzette, Schere und einen Bohrer zum Platzieren der kleinen (0,5 mm) Gratlöcher.
- Bereiten Sie die extrakraniellen Oberflächenelektroden für die Anwendung am Schädel vor und stellen Sie sicher, dass sie von chirurgischem Kleber befreit wurden, falls sie zuvor verwendet wurden.
- Überprüfen Sie die Impedanz dieser tACS-Elektroden direkt, bevor Sie sie am Schädel anbringen. Nutzen Sie dazu die eingebaute Messfunktion des tACS-Stimulators, bei der beide Elektroden in ein Kochsalzbad gelegt werden.
HINWEIS: Die bevorzugte Impedanz beträgt <5 KΩ pro Elektrodenpaar, damit genügend Strom durch den Schädel geleitet werden kann. Das Stimulatorgerät prüft die Impedanz, bevor es Konstantstromimpulse abgibt, und gibt den Wert direkt an.
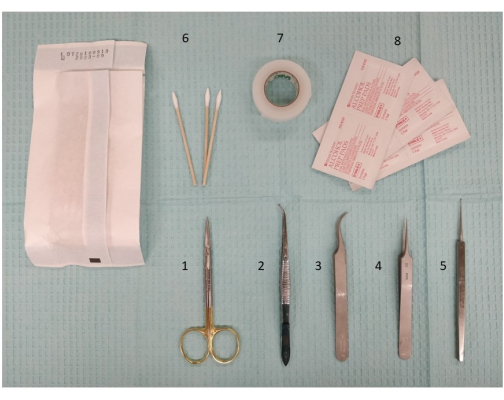
Abbildung 2: Ein Foto der erforderlichen Instrumente, einschließlich Präparierinstrumenten und Scheren, zur Vorbereitung der extrakraniellen Stimulation. 1. Mikropräparierschere, 11,5 cm; 2. Pinzette, 11,5 cm, leicht gekrümmt, gezackt; 3. Dumont #7 Pinzette, gebogen; 4. Dumont #5 Pinzette; 5. Mikrokürette, 13 cm; 6. Wattestäbchen; 7. Chirurgisches Klebeband; 8. Alkohol-Pads. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Vorbereitung des Tieres auf die Operation
HINWEIS: Für diese Experimente verwendeten wir 14 C57BL/6-Kontrollmäuse im Alter zwischen 12 Wochen und 33 Wochen, von denen fünf männlich und neun weiblich waren.
- Das Tier wird in einer Induktionskammer mit Isofluran in 30 %O2 bei ~1,5 l/min betäubt, wobei ~4 % anfänglich induziert und ~1,25 %-1,5 % auf einem Anästhesieniveau mit spontaner Atmung gehalten werden, das ausreicht, um die Schwanzklemmreaktion zu beseitigen.
- Übertragen Sie das Tier nach der Induktion in den stereotaktischen Rahmen und befestigen Sie dann den Kopf im Nasenkonus und in den Ohrstegen für die anschließende Elektrodenanwendung und das Bohrlochverfahren (Abbildung 1 und Abbildung 3).
- Verbinden Sie den Nasenkonus des stereotaktischen Rahmens über einen Einlass und einen Auslass mit dem Vaporizer, um Isofluran-Rückstände durch ein Scavenger-System (z. B. Holzkohle oder ein Vakuum) zu entfernen. Stellen Sie sicher, dass keine Luft aus dem Nasenkonus austritt, sowohl um das Anästhesieniveau mit dem Isofluoran aufrechtzuerhalten als auch um ein versehentliches Austreten in die Raumluft zu verhindern (Abbildung 3).
- Überprüfen Sie die Position der Maus im stereotaktischen Rahmen, einschließlich der Position des Nasenkegels, um eine spontane Atmung ohne Intubation sowie eine angemessene Anästhesiewiederherstellung und -spülung zum Schutz des Forschungspersonals zu ermöglichen (Abbildung 3).
- Platzieren Sie die Sonden zur Messung des Pulses, der Sauerstoffsättigung des Pulses (Puls OX), des Blutdrucks und der Temperatur auf dem Tier. Stellen Sie sicher, dass die minimale Sauerstoffversorgung des Impulses 90 % und der Impuls >450/min beträgt (die untere Grenze des Alarms wird mit 380 Impulsen/min angezeigt). Zeichnen Sie diese Parameter während des Eingriffs in regelmäßigen Abständen oder kontinuierlich auf, je nach Aufzeichnungssystem (Abbildung 3).
- Überprüfen Sie vor Beginn des Eingriffs den Grad der Sedierung des Tieres, indem Sie z. B. die Zehen einklemmen, um die Reflexe zu überprüfen. Wenn es keinen Reflex gibt, ist der Grad der Sedierung optimal, solange das Tier eine spontane Atmung und eine ausreichende Sauerstoffversorgung des Pulses aufrechterhält. Wenn ein Reflex vorliegt, erhöhen Sie die Abgabe von Isofluran, um das Niveau der Anästhesie zu vertiefen, und überprüfen Sie dann den Reflex erneut. Beobachten und überwachen Sie kontinuierlich die Atemfrequenz des Tieres und passen Sie die Isofluranabgabe entsprechend an.
- Rasieren Sie die Kopfhaare oder entfernen Sie die Haare mit Enthaarungscreme (reinigen Sie die restliche Creme mit Alkoholpad-Passagen).
- Tragen Sie Augensalbe auf und reinigen Sie die Kopfhaut dann aseptisch mit drei Passagen Jod und Alkohol, bevor Sie sie mit einer Schere entfernen.

Abbildung 3: Ein Bild des Tieres im stereotaktischen Rahmen, mit freiliegendem Schädel und nur den tACS-Stimulatorelektroden (vor dem Platzieren des Bohrlochs). Beachte das Blutdruckmessgerät um den Schwanz und das Pulsoximeter an der Pfote, mit dem Messwert auf der linken Seite. Um den Nasenkegel herum befinden sich Spülröhrchen für das Isofluran. Abkürzung: tACS = transkranielle Wechselstromstimulation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Chirurgischer Eingriff: Anlegen der Stimulationselektroden und Herstellen der Gratlöcher
- Für eine terminale Untersuchung entfernen Sie die Kopfhaut mit einer chirurgischen Schere und legen den Schädel ~3 mm von der Lambdoid-Naht kaudal und ~3 mm frontal zum Bregma frei, um einen Teil der hinteren Frontalnaht freizulegen. Schneiden Sie die Kopfhaut parietal heraus, um den ersten Teil des Schläfenmuskels auf beiden Seiten freizulegen (Abbildung 3).
- Entfernen Sie alle Reste des subkutanen Bindegewebes, damit der Schädel für die Anwendung der stimulierenden Elektroden sauber und trocken ist.
- Tragen Sie leitfähiges Gel oder eine leitfähige Paste auf die Seite der Elektroden auf, die mit dem Schädel in Kontakt kommen, und befestigen Sie die Elektroden an intermittierenden Stellen mit chirurgischem Sekundenkleber am Rand.
HINWEIS: Lassen Sie nicht zu, dass das leitfähige Gel mit dem chirurgischen Sekundenkleber interferiert, um eine bessere Verbindung zur Schädeloberfläche zu ermöglichen. Die Außenfläche der Elektroden kann auch mit chirurgischem Sekundenkleber isoliert werden (von der Kopfhaut, wenn diese während einer Überlebensoperation geschlossen wird). - Verwenden Sie entweder handelsübliche Flachelektroden oder stellen Sie interne Elektroden aus isoliertem Draht mit einem Durchmesser von 100 μm (auf die Platte gelötet) und einer 1 mm x 3 mm großen, flexiblen, isolierten (auf einer Oberfläche) Kupferplatte her, die entsprechend der Größe des Schädels zugeschnitten ist.
- Tragen Sie Lidocainpaste auf beiden Seiten auf den Schläfenmuskel und die Kopfhaut auf, ohne die Elektroden zu stören, um die Muskel- und periphere Nervenaktivierung zu reduzieren.
- Sobald die extrakraniellen Stimulationselektroden 4 mm seitlich zu jeder Seite des Schädels (zwischen Bregma und Lambda) angebracht sind, bohren Sie zwei 0,5-mm-Gratlöcher für die Glaselektroden 2 mm auf jeder Seite der Mittellinie, 4 mm voneinander entfernt, orthogonal zur sagittalen Naht (Abbildung 1). Füllen Sie diese Bohrlöcher mit sterilem Mineralöl, um das Eindringen von Strom in den Schädel von den extrakraniellen Elektroden zu verhindern.
- Falls gewünscht, wird für ein bestimmtes Experiment eine Spreizdepression (d. h. eine Kalium-induzierte Spreizdepression [K+-SD]) gewünscht, auf der rechten Seite des Schädels ein drittes 0,5 mm Bohrloch ~1,5 mm rostral zur koronalen Naht und ~1 mm lateral zur hinteren Frontalnaht hinzugefügt. Füllen Sie dieses Gratloch mit Kochsalzlösung für die spätere 1 M KCl-Anwendung, um K+-SD zu induzieren.
- Testen Sie die Impedanz der extrakraniellen stimulierenden Elektroden sowohl vor der Platzierung des Bohrlochs (und im Vergleich zu den gleichen Elektroden, die in einem Salzbad platziert werden) als auch nach dem Platzieren des Bohrlochs, um sicherzustellen, dass die Gratlöcher den Stromfluss in das Gehirn nicht stören (d. h. stellen Sie sicher, dass der Widerstand unverändert bleibt).
HINWEIS: Die Impedanzmessung erfolgt direkt durch das Stimulationsgerät. Im Allgemeinen haben wir festgestellt, dass die Gesamtsystemimpedanz (d. h. von den extrakraniellen Elektroden über die Schädel-Hirn-Bahn, typischerweise ~3 KΩ) unabhängig von den Bohrlöchern und Glasmikroelektroden relativ konstant ist, was darauf hindeutet, dass es einen minimalen Stromverlust direkt durch die Bohrlöcher in das Gehirn gibt. - Platzieren Sie die Elektroden für die chronische transkranielle Stimulation auf ähnliche Weise. Isolieren Sie in diesem Fall die Außenfläche der Elektroden, schließen Sie die Kopfhaut und tunneln Sie die isolierten Drähte entweder durch die Kopfhaut oder führen Sie sie in eine feste Kopfstufe, die am Schädel montiert ist.
4. Physiologischer Ablauf
- Beginnen Sie mit den physiologischen Aspekten des Experiments, sobald das Tier vollständig auf das physiologische Experiment vorbereitet ist, bei dem es nicht ums Überleben geht. Halten Sie das Anästhesieniveau aufrecht, das sowohl für die spontane Atmung als auch für ausreichende Pulsox-, Atem- und Pulswerte ausreicht.
- Messen Sie den CBF, der sich aus der extrakraniellen Stimulation ergibt, mit einer der beiden folgenden Methoden.
- Legen Sie die Maus unter ein Laser-Speckle-Imaging-Gerät mit oder ohne intrakranielle Aufzeichnungselektroden, um das intrakranielle elektrische Feld während der Stimulationsepisoden zu messen (Abbildung 3).
- Das Tier wird in ein physiologisches Präparat zur Platzierung von bilateralen Laser-Doppler-Sonden und intrakraniellen Elektroden überführt, um das intrakranielle elektrische Feld während der Stimulationsepisoden zu messen (Abbildung 1).
5. Platzierung von bilateralen Laser-Doppler- und Glaselektroden
- Übertragen Sie das Tier auf einen Mikroskoptisch für die Anwendung von bilateralen Laser-Doppler-Sonden. Platzieren Sie die Sonden auf der Oberseite der Schädeloberfläche zwischen den bilateralen Gratlöchern und der koronalen Naht (Abbildung 1).
- Füllen Sie gezogene Glasmikroelektroden (~0,1 μM, 2-6 MΩ Impedanz) mit 0,2 M NaCl und platzieren Sie sie mit einem Mikromanipulator in die beiden Gratlöcher, die seitlich der sagittalen Naht 3,14 platziert sind (Abbildung 1).
HINWEIS: Diese Gratlöcher befinden sich zwischen den beiden symmetrischen extrakraniellen Stimulationselektroden (Abbildung 1). - Stellen Sie nach dem Einsetzen in das Gehirn sicher, dass sich diese Glasmikroelektroden ~1 mm innerhalb der Großhirnrinde befinden. Führen Sie Tiefenprofile in verschiedenen symmetrischen Tiefen durch. Füllen Sie die Gratlöcher wieder mit sterilem Mineralöl, um diesen Weg für den Stromfluss zu isolieren.
6. Stimulationsverfahren und Messung der Intensität der transkraniellen Wechselstromstimulation (tACS) bzw. transkraniellen Gleichstromstimulation (tDCS)
- Kontinuierliche Daten von den dualen Laser-Doppler-Sonden am Schädel und den beiden intrakraniellen Mikroelektrodenausgängen (aufgezeichnet mit einem DC-Verstärker mit Kopfstufen) werden mit einem Digitalisierungssystem und einer Software mit mindestens vier Kanälen (bei einer Abtastrate von 1 KHz) aufgezeichnet. Sobald alle Werte über eine ausreichend stabile Ausgangsdauer (d. h. >10 Minuten) aufgezeichnet wurden, ist die extrakranielle Stimulation zu testen.
ANMERKUNG: Abbildung 4 zeigt ein Beispiel für die vier Kanäle mit den beiden intrakraniellen Aufzeichnungselektroden in den oberen Kanälen und der CBF-Antwort in den unteren Kanälen. - Wenden Sie kurze Zeiträume der Ein-/Aus-Stimulation bei verschiedenen Amplituden an (d. h. 20-30 s, 0,5-2,0 mA, im tolerierbaren Bereich), um eine klare Ausgangslinie vor und nach der Stimulation zu erhalten (Abbildung 4). Wenden Sie die Stimulation zwischen den beiden tACS-Elektroden des Schädels auf beiden Seiten an (Abbildung 1) mit einem handelsüblichen, für den Menschen geeigneten Stimulationsgerät, das einen konstanten Strom liefert.
- Beobachten Sie die Maus genau auf Muskelzuckungen oder andere Reaktionen auf das tACS, wie z. B. eine Veränderung des Pulses oder der Atmung, um eine obere Grenze der Verträglichkeit (im Allgemeinen ~2 mA) zu schaffen.
- Überwachen Sie weiterhin die Impedanz an den Elektroden mit Stimulationsepochen, um sicherzustellen, dass diese konstant ist.
- Eine kleine Menge (2-3 μl) von 1 M KCl wird in das vordere Bohrloch14 gegeben, um spontane K+-SD-Ereignisse zu induzieren. Diese erzeugen eine große CBF-Antwort und Wechselwirkungen zwischen der K+-SD-induzierten CBF-Antwort und der CBF-Antwort. Schätzen Sie die tACS-CBF-Reaktion, indem Sie die tACS-Stimulation sowohl vor als auch nach dem Auftreten der SD anwenden.
- Am Ende des Experiments Euthanasie durch eine Überdosis Isofluran (5%) durchführen und dann enthaupten, sobald die Atmung und der Herzschlag aufgehört haben.
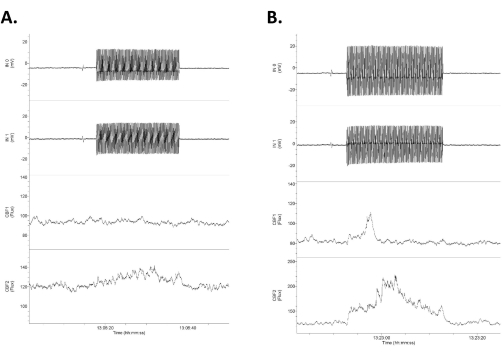
Abbildung 4: Daten, die vier Kanäle mit Rohdaten als Reaktion auf tACS niedriger Intensität zeigen. Die Daten sind so angeordnet, dass die oberen beiden Zeilen als intrakranielle, direkte elektrische DC-Aufzeichnungen (gekennzeichnet als Eingang 1 [IN0] und Eingang 2 [IN1]) und die unteren beiden Zeilen als bilaterale Laser-Doppler-Aufzeichnungen des zerebralen Blutflusses angeordnet sind. Beachten Sie, dass die Reaktionen asymmetrisch zwischen den rechten (oberen) und linken (unteren) elektrischen und zerebralen Blutflussspuren sind. (A) Eine kleine Reaktion (16% Erhöhung des Blutflusses) als Reaktion auf einen 1,2 mV/mm 20 s Stimulus (0,75 mA). (B) Eine stärkere Reaktion (21% Erhöhung des Blutflusses) als Reaktion auf einen Stimulus von 1,4 mV/mm (1,0 mA). Abkürzung: tACS = transkranielle Wechselstromstimulation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
7. Berechnung des elektrischen Feldes
- Messen Sie die Differenz in der Ausgangsleistung der beiden intrakraniellen Elektroden anhand der Differenz in der Halbwelle (ein Zyklus) der beiden aufgezeichneten Sinuswellen (die oberen beiden Kurven in Abbildung 4). Dividiert man diese Differenz (mV) durch den Abstand zwischen den beiden Elektroden (mm, hier ~4 mm, aber jeweils direkt gemessen), um die Feldstärke (mV/mm) zu erhalten3,6.
Ergebnisse
Repräsentative Ergebnisse sind in Abbildung 4, Abbildung 5 und Abbildung 6 dargestellt. Abbildung 4 zeigt ein Beispiel für die vier Kanäle mit den beiden intrakraniellen Aufzeichnungselektroden auf den oberen Kanälen und den CBF-Antworten auf den unteren Kanälen. Das tACS ist symmetrisch über den gesamten Schädel, aber im Allgemeinen ist die intrakranielle Feldantwort bei angelegten Wechselstroms...
Diskussion
Dieses Protokoll konzentriert sich auf die in vivo, anästhesierte Messung der CBF-Antwort als Biomarker zur Abschätzung der Gehirnantwort auf tES14. Zu den längerfristigen Biomarkern des tES-Ansprechens gehören histologische Behandlungseffekte, wie z. B. die Verhinderung oder Veränderung der Bildung von Amyloid-Plaques (d. h. mit Gamma-Stimulation bei 40 Hz in mehreren AD-Modellen)16,17,18,19,
Offenlegungen
Die Autoren haben keine Interessenkonflikte zu deklarieren.
Danksagungen
Diese Studie wurde durch die folgenden Zuschüsse (an D.A.T.) unterstützt: NIA RO1 AG074999, NIA R21AG051103, VA I21RX002223 und VA I21 BX003023.
Materialien
| Name | Company | Catalog Number | Comments |
| Alcohol pads | HenryShein | 112-6131 | |
| Baby mineral oil | Johnson & Johnson | ||
| BD 1 mL syringe | Becton Dikinson | REF 305699 | |
| C3 Flat Surface Electrodes | Neuronexus | ||
| C57BI mice | from NIH colonies | ||
| Copper skull electrods | In house preparation | ||
| Digidata 1440, Clampex | Axon Instruments | ||
| Dumont #5 forceps | FST | #5 | |
| Dumont #7 forceps curved | Dumont | RS-5047 | |
| Eye ointment | Major | LubiFresh P.M. NDC-0904-6488-38 | |
| Flaming/Brown micropipette puller | Sutter instrument Co. | Model P-87 | |
| Forceps 11.5 cm slight curve serrated | Roboz | RS-8254 | |
| Intramedic needle 23 G | Becton Dikinson | REF 427565 | |
| KCl 1 M | In house preparation | ||
| Laser Doppler Probes | Moor Instruments | 0.46 mm laser doppler probes | |
| Laser Speckle Imaging Device | RWD | RFLSI-ZW | |
| Micro curette 13 cm | FST | 10080-05 | |
| Micro Dissecting Scissors, 11.5 cm | Roboz | RS-5914 | |
| Mouse anesthesia fixation | Stoelting | ||
| Neuroconn-DS | Neurocare | DC-Stimulator Plus | |
| PhysioSuite Monitoring | Kent Scientific | ||
| Q-tips | Fisherbrand | 22363167 | |
| Saline 0.9% NaCl solution | Baxter | 281322 | |
| Sensicam QE | PCO Instruments | ||
| Software | Axon Instruments Clampex | ||
| Surgical glue | Covetrus | 31477 | |
| Surgical tape | 3M Transpore | T9784 |
Referenzen
- Bestmann, S., Walsh, V. Transcranial electrical stimulation. Current Biology. 27 (23), R1258-R1262 (2017).
- Bikson, M., et al. Rigor and reproducibility in research with transcranial electrical stimulation: An NIMH-sponsored workshop. Brain Stimulation. 11 (3), 465-480 (2018).
- Turner, D. A., Degan, S., Galeffi, F., Schmidt, S., Peterchev, A. V. Rapid, dose-dependent enhancement of cerebral blood flow by transcranial AC stimulation in mouse. Brain Stimulation. 14 (1), 80-87 (2020).
- Shah, S., Chhatbar, P. Y., Feld, J. A., Feng, W. Integrating tDCS into routine inpatient rehabilitation practice to boost post-stroke recovery. Brain Stimulation. 13 (4), 953-954 (2020).
- Voroslakos, M., et al. Direct effects of transcranial electric stimulation on brain circuits in rats and humans. Nature Communications. 9 (1), 483 (2018).
- Alekseichuk, I., Mantell, K., Shirinpour, S., Opitz, A. Comparative modeling of transcranial magnetic and electric stimulation in mouse, monkey, and human. Neuroimage. 194, 136-148 (2019).
- Tavakoli, A. V., Yun, K. Transcranial alternating current stimulation (tACS) mechanisms and protocols. Frontiers in Cellular Neuroscience. 11, 214 (2017).
- Yavari, F., Jamil, A., Mosayebi Samani, M., Vidor, L. P., Nitsche, M. A. Basic and functional effects of transcranial electrical stimulation (tES)-An introduction. Neuroscience and Biobehavioral Reviews. 85, 81-92 (2018).
- Wachter, D., et al. Transcranial direct current stimulation induces polarity-specific changes of cortical blood perfusion in the rat. Experimental Neurology. 227 (2), 322-327 (2011).
- Han, C. H., et al. Hemodynamic responses in rat brain during transcranial direct current stimulation: A functional near-infrared spectroscopy study. Biomedical Optics Express. 5 (6), 1812-1821 (2014).
- Ayata, C., Lauritzen, M. Spreading depression, spreading depolarizations, and the cerebral vasculature. Physiological Reviews. 95 (3), 953-993 (2015).
- Berenyi, A., Belluscio, M., Mao, D., Buzsaki, G. Closed-loop control of epilepsy by transcranial electrical stimulation. Science. 337 (6095), 735-737 (2012).
- Hoang, K. B., Cassar, I. R., Grill, W. M., Turner, D. A. Biomarkers and stimulation algorithms for adaptive brain stimulation. Frontiers in Neuroscience. 11, 564 (2017).
- Turner, D., A, D. S., Hoffmann, U., Galleffi, F., Colton, C. A. CVN-AD Alzheimer's mice show premature reduction in neurovascular coupling in response to spreading depression and anoxia compared to aged controls. Alzheimer's and Dementia. 17 (7), 1109-1120 (2021).
- Colton, C. A., et al. mNos2 deletion and human NOS2 replacement in Alzheimer disease models. Journal of Neuropathology and Experimental Neurology. 73 (8), 752-769 (2014).
- Castano-Prat, P., et al. Altered slow (<1 Hz) and fast (beta and gamma) neocortical oscillations in the 3xTg-AD mouse model of Alzheimer's disease under anesthesia. Neurobiology of Aging. 79, 142-151 (2019).
- Etter, G., et al. Optogenetic gamma stimulation rescues memory impairments in an Alzheimer's disease mouse model. Nature Communications. 10 (1), 5322 (2019).
- Iaccarino, H. F., et al. Gamma frequency entrainment attenuates amyloid load and modifies microglia. Nature. 540 (7632), 230-235 (2016).
- Martorell, A. J., et al. Multi-sensory gamma stimulation ameliorates Alzheimer's-associated pathology and improves cognition. Cell. 177 (2), 256-271 (2019).
- Dawson, J., et al. Vagus nerve stimulation paired with rehabilitation for upper limb motor function after ischaemic stroke (VNS-REHAB): A randomised, blinded, pivotal, device trial. Lancet. 397 (10284), 1545-1553 (2021).
- Hacker, M. L., et al. Deep brain stimulation in early-stage Parkinson disease: Five-year outcomes. Neurology. 95 (4), e393-e401 (2020).
- Duun-Henriksen, J., et al. A new era in electroencephalographic monitoring? Subscalp devices for ultra-long-term recordings. Epilepsia. 61 (9), 1805-1817 (2020).
- Haneef, Z., et al. Sub-scalp electroencephalography: A next-generation technique to study human neurophysiology. Clinical Neurophysiology. 141, 77-87 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten