Eine neuartige Zellinjektionsmethode mit minimaler Invasion
In diesem Artikel
Zusammenfassung
Diese Methode eliminiert jede größere Invasion während der Zellinjektionen, die durch die Zellsuspensionslösung verursacht wird.
Zusammenfassung
Die direkte Injektion von Zellen in Gewebe ist ein notwendiger Prozess bei der Zellverabreichung und/oder Ersatztherapie. Die Zellinjektion erfordert eine ausreichende Menge an Suspensionslösung, damit die Zellen in das Gewebe eindringen können. Das Volumen der Suspensionslösung wirkt sich auf das Gewebe aus, was zu schweren invasiven Verletzungen durch die Zellinjektion führen kann. Diese Arbeit berichtet über eine neuartige Zellinjektionsmethode, die als langsame Injektion bezeichnet wird und darauf abzielt, diese Verletzung zu vermeiden. Das Herausdrücken der Zellen aus der Nadelspitze erfordert jedoch eine ausreichend hohe Injektionsgeschwindigkeit nach dem Newtonschen Gesetz der Scherkraft. Um den obigen Widerspruch zu lösen, wurde in dieser Arbeit eine nicht-newtonsche Flüssigkeit, wie z. B. Gelatinelösung, als Zellsuspensionslösung verwendet. Gelatinelösung ist temperaturempfindlich, da sich ihre Form bei ca. 20 °C von Gel zu Sol ändert. Um die Zellsuspensionslösung in der Gelform zu halten, wurde die Spritze daher in diesem Protokoll gekühlt gehalten; Sobald die Lösung jedoch in den Körper injiziert wurde, wandelte die Körpertemperatur sie in ein Sol um. Der interstitielle Gewebeflüssigkeitsfluss kann überschüssige Lösung absorbieren. In dieser Arbeit ermöglichte die langsame Injektionstechnik den Kardiomyozytenkugeln, in das Wirtsmyokard einzudringen und sich ohne umgebende Fibrose einzunisten. In dieser Studie wurde eine langsame Injektionsmethode verwendet, um gereinigte und kugelförmige neonatale Rattenkardiomyozyten in einen abgelegenen Bereich des Myokardinfarkts im erwachsenen Rattenherzen zu injizieren. 2 Monate nach der Injektion zeigten die Herzen der transplantierten Gruppen eine signifikant verbesserte kontraktile Funktion. Darüber hinaus zeigten histologische Analysen der langsam injizierten Herzen nahtlose Verbindungen zwischen den Kardiomyozyten des Wirts und des Transplantats über interkalierte Bandscheiben, die Gap-Junction-Verbindungen enthalten. Diese Methode könnte zu Zelltherapien der nächsten Generation beitragen, insbesondere in der kardialen regenerativen Medizin.
Einleitung
Die Verabreichung und der Ersatz von Zellen sind vielversprechende neue therapeutische Strategien für stark geschädigte Organe. Unter diesen neuartigen therapeutischen Strategien hat die regenerative Medizin des Herzens große Aufmerksamkeit erregt. Die durch Verletzungen verursachte Entzündung vermittelt jedoch die Narbenbildung in mehreren Organen 1,2,3,4. Das menschliche Herz besteht aus etwa 1010 Kardiomyozyten; Daher muss es theoretisch 5,6 mit mehr als 109 Kardiomyozyten behandelt werden. Die Verabreichung einer großen Anzahl von Kardiomyozyten mit herkömmlichen Injektionsmethoden kann zu erheblichen Gewebeverletzungen führen7. Diese Methode bietet eine neuartige Zellinjektionsmethode mit minimaler Gewebeinvasion.
Die Verabreichung der Zellen in das Organparenchym erfordert eine oder mehrere Injektionen. Eine Diskrepanz besteht jedoch darin, dass die Injektion selbst zu einer Gewebeverletzung führen kann. Gewebeverletzungen verursachen lokale Entzündungen und unheilbare Vernarbungen in Organen und Geweben sowie eine Beeinträchtigung der Regenerationsfähigkeit 8,9,10. Das Säugetierherz hat eine extrem hohe Neigung, Narben zu entwickeln, anstatt sich zu regenerieren, da es eine sofortige Reparatur von Verletzungen erfordert, um den hohen Blutdruck zu ertragen, der durch seine kontinuierliche Pumpfunktion verursacht wird11. Die Ablationstherapie nutzt diese hohe Neigung zur Narbenbildung und blockiert den Kreislauf, der wahrscheinlich eine Narbenbildung mit Arrhythmie erfährt12. In einer früheren Studie wurde beobachtet, dass das Narbengewebe die injizierten Kardiomyozyten im Myokard des Wirts isoliert. Dies stellt somit das nächste Zielproblem dar, das überwunden werden muss, um eine verbesserte therapeutische Wirksamkeit in der kardialen regenerativen Medizin zu erreichen.
Der interstitielle Flüssigkeitsfluss des Gewebes spielt eine wichtige Rolle bei der Übertragung von Sauerstoff und Nährstoffen zu den Zellen und dem Abtransport der ausgeschiedenen Abfallstoffe aus den Zellen. Die physiologische Geschwindigkeit des interstitiellen Flüssigkeitsflusses ist in jedem Gewebe/Organ unterschiedlich (der Bereich beträgt 0,01-10 μm/s)13. Nach bestem Wissen des Autors gibt es keine Daten über die Fähigkeit einzelner Gewebe/Organe, zusätzliche Flüssigkeitsmengen ohne pathologische Ödeme zu tragen; In diesem Experiment wird jedoch versucht, eine langsame Injektionsgeschwindigkeit zu nutzen, um möglicherweise Gewebeverletzungen zu reduzieren, und die Ergebnisse können verwendet werden, um die Praktikabilität dieses Konzepts zu bestimmen.
Protokoll
Die Tierversuche wurden nach den ethischen Richtlinien für Tierversuche der Kansai-Medical University durchgeführt und von den Ethikkommissionen genehmigt (Zulassungsnummer: 23-104). Alle Tiere wurden unter einem konstanten Hell-Dunkel-Zyklus in einer spezifischen, pathogenfreien Umgebung aufgezogen. Alle sterilisierten chirurgischen Instrumente wie Scheren, Pinzetten und Retraktoren wurden autoklaviert und gründlich getrocknet.
1. Vorbereitung der Kardiomyozytenkugeln der neugeborenen Ratte
- Sammlung von Rattenherzen für Neugeborene
- Befolgen Sie für die Herzentnahme ein ähnliches Verfahren wie in einem früheren Bericht7.
- Neugeborene (0-2 Tage nach der Geburt) Sprague-Dawley (SD)-Ratten nacheinander in Povidon-Jod- und 70%ige Ethanollösungen eintauchen und dann zur Tiefenanästhesie in ein luftdichtes Gehäuse überführen, das mit verdampftem Isofluran gefüllt ist (die Konzentration sollte über 10 % v/v liegen).
- Nach der Bestätigung der Bewusstlosigkeit durch einen Verlust der Bewegungsaktivität enthaupten Sie die Ratte, während Sie den Körper von hinten mit der Hand halten, und schneiden dann 2-4 mm Gewebe von der vorderen Mitte des Brustkorbs bis zum Schwanz und dann in rostraler Richtung mit einer scharfen Schere.
- Fassen Sie die Rückenhaut an, um die Schnittwunde aufzureißen und das Herz aus dem Brustkorb herauszudrücken. Schneiden Sie die Ventrikel mit einer Schere ab und tauchen Sie sie in phosphatgepufferte Kochsalzlösung (PBS) ohne Kalzium oder Magnesium (PBS(−)).
- Ausbreitung der neonatalen Ratten-Kardiomyozyten
- Zerkleinern Sie die gesammelten Ventrikel dispergiert in einer minimalen Menge ADS-Puffer (ADS-Puffer: 116 mM NaCl, 20 mM HEPES, 12,5 mM NaH2PO 4, 5,6 mM Glukose, 5,4 mM KCl, 0,8 mM MgSO4, pH 7,35) in einem autoklavierten konkaven Glas mit einer gebogenen Schere in kleine Stücke (1 mm x 1 mm).
- Die zerkleinerten Gewebe und ein mikromagnetischer Rührer werden in ein 50-ml-Zentrifugationsröhrchen überführt und die Gewebe mit 0,1 % Kollagenase, 0,1 % Trypsin, 20 μg/ml DNase I und 50 nM Tetramethylrhodaminmethylester in Ads-Puffer bei 37 °C durch Rühren 30 Minuten lang in Einzelzellen dispergiert.
- Trennen Sie die Aggregate und dispergierten Zellen durch natürliche Sedimentation, sammeln Sie nur die dispergierten Zellen in einem Röhrchen und verdauen Sie die verbleibenden Zellaggregate erneut mit demselben Aufschlussmedium.
- Wiederholen Sie diesen Vorgang, bis alle Zellen vollständig dissoziiert sind. Um die vollständige Dispersion der Zellen zu bestätigen, werden die Röhren unter dem Mikroskop (4x Objektivlinse) beobachtet.
- Die dispergierten Zellen werden durch Zentrifugation bei 150 x g für 5 min gesammelt und in 1-2 ml ADS-Puffer dissoziiert.
- Fluoreszenz-aktivierte Zellsortierung von Kardiomyozyten
- Analysieren Sie die Zellen mit Hilfe von Fluoreszenz-aktivierter Zellsortierung (FACS) unter Verwendung von 556-601-nm-Bandpassfiltern, um rote Fluoreszenzsignale zu erkennen.
- Führen Sie die Vorbeugung sorgfältig durch, um Dublettenfraktionenzu eliminieren 14. Die Gate-Einstellungen für die Dubletten-Eliminierung sollten den Anweisungen des Herstellers entsprechen.
- Stellen Sie die Vorwärtsstreuung auf der x-Achse und das rote Fluoreszenzsignal auf der y-Achse ein. Es wurden drei Populationen beobachtet: eine unterste Population mit Erythrozyten und toten Zellen, eine mittlere Population mit Nicht-Kardiomyozyten, einschließlich Fibroblasten und Endothelzellen, und eine Top-Population mit reinen ventrikulären Kardiomyozyten7.
- Herstellung von rot fluoreszenzmarkierten Kardiomyozytenkugeln
- Die Kardiomyozyten werden selektiv sortiert und 5 Minuten lang bei 150 x g zentrifugiert. Lösen Sie die Zellpellets vollständig in 1 ml alpha-modifiziertem minimalem essentiellem Medium (alpha-MEM) auf, das 10 % hitzeinaktiviertes fötales Kälberserum (FBS) enthält.
- Messen Sie die Zellkonzentration mit einem Hämozytometer und verdünnen Sie die Zellsuspensionslösung mit Alpha-MEM 10% FBS auf 3.000 Zellen/ml.
- Verteilen Sie sie in nicht klebenden 96-Well-Platten (100 μl pro Well), zentrifugieren Sie sie 5 Minuten lang bei 100 x g und kultivieren Sie sie 2-3 Tage lang in einem Zellkulturinkubator mit 5 % CO2 bei 37 °C.
- Vor den Injektionsexperimenten wird aus jeder Vertiefung eine Kardiomyozytenkugel durch Aspiration mit dem Nährmedium mit einer 1.000-μl-Pipette entnommen und in einem 15-ml-Röhrchen gesammelt.
- Färben Sie mit PKH26 gemäß den Anweisungen des Herstellers zur Nachverfolgung nach der Transplantation.
2. Vorbereitungen für die Methode der langsamen Injektion
- Herstellung der Gelatine-Stammlösung
- Wiegen Sie die Gelatine, lösen Sie sie in Ads-Puffer auf, um eine 10%ige w/v-Lösung herzustellen, und autoklavieren Sie sie.
- Herstellung eines Zellinjektionsgeräts
- Gesamtauslegung des Geräts: Bereiten Sie das in Abbildung 1 gezeigte Gerät vor. Dieses System ist mit einer Spritzenkühlvorrichtung und einer Hauptinjektionsvorrichtung kombiniert.
- Bereiten Sie das unten beschriebene Hauptinjektionsgerät vor:
- Verwenden Sie für eine neonatale Kardiomyozytenkugel-Injektion eine 29 g lange, 50 mm lange Nadel, die mit einer Spritze ausgestattet ist.
- Schließen Sie eine Power-Transfer-Spritze (18 G, 1 ml) Rücken an Rücken mit einer Zellinjektionsspritze an (Abbildung 1). Verbinden Sie die Nadel der Kraftübertragungsspritze mit einem dünnen Polypropylenschlauch mit geringer Lumendehnbarkeit.
- Verbinden Sie dann die andere Seite des Kraftübertragungsschlauchs mit der Nadel derselben Spritze (18 G, 1 ml) und setzen Sie sie in eine Spritzenpumpe. Füllen Sie die beiden Power-Transfer-Spritzen und -Röhrchen mit Wasser ohne Luftblasen.
HINWEIS: Wenn ein Kolben der Kraftübertragungsspritze hineingedrückt wird, wird der Druck direkt auf die andere Spritze übertragen, und der Kolben ragt heraus.
- Richten Sie das Kühlsystem der Injektionsspritze wie unten beschrieben ein.
- Wickeln Sie ein Kupferrohr (Außendurchmesser = 1 mm; Innendurchmesser = 0,3 mm; Dicke = 0,35 mm) fest um den zellhaltigen Teil der Zellinjektionsspritze, wobei an beiden Enden 10 mm überschüssiges Rohr übrig bleiben.
- Verbinden Sie das Kupferrohr mit einem flexiblen Kunststoffschlauch. Schließen Sie außerdem die anderen Enden des Kunststoffschlauchs an eine externe Pumpe an, füllen Sie die Leitung mit Kühlwasser und kühlen Sie das Wasser, indem Sie das überschüssige Kupferrohr in Crushed Ice tauchen (Abbildung 1).
HINWEIS: Dieses Kühlsystem hält die Zellsuspensionslösung im Zylinder bei ca. 2 °C.
3. Entwicklung eines Ratten-Myokardinfarktmodells durch stumpfen Koronararterienverschluss
- Männliche immundefiziente Nacktratten (F344/Njcl-rnu/rnu) werden mit Luft anästhesiert, die 3% Isofluran enthält. Führen Sie eine Kanüle in die Luftröhre ein und schließen Sie sie an das Beatmungsgerät an.
- Schließen Sie eine Kanüle an einen Isofluran-Verdampfer mit einem Controller an, um eine Isofluran-Konzentration von 3 % aufrechtzuerhalten und somit eine ausreichende Anästhesie aufrechtzuerhalten. Bestätigen Sie, dass Sie nicht auf Schmerzreize reagieren. Tragen Sie Tiersalbe auf die Augen auf, um Trockenheit zu verhindern.
- Fixieren Sie die Gliedmaßen mit abgeschnittenen OP-Bändern auf einer 40 °C erwärmten OP-Platte. Drehen Sie den Körper der Ratte nach rechts von der Körperachse und nutzen Sie die linke Achselhöhle als Operationsfeld.
- Entfernen Sie die Haare im Operationsfeld mit einer Enthaarungscreme und wischen Sie die Haut mit Povidon-Jod ab. Schneiden Sie mit einer scharfen Schere einen 1,5 cm langen Schnitt in die Haut und den großen Brustmuskel.
- Bestätigen Sie den dritten Zwischenrippenraum und reißen Sie die Zwischenrippenmuskeln und das Rippenfell mit einer Mikropinzette mit stumpfen Spitzen auf. Halten Sie die Brust mit einem Retraktor offen. Entfernen Sie den dünnen Herzbeutel vorsichtig mit einer Pinzette.
- Um ein Infarktmodell der lateralen Wand des Herzens zu konstruieren, finden Sie die Position 1 mm kaudal zur Spitze des linken Vorhofs, um die stumpfe Koronararterie zu identifizieren, führen Sie eine 7-0-Seidennaht durch, schöpfen Sie 2,5 mm breites und 2,5 mm tiefes Gewebe von dorsal nach ventral und ligieren Sie das Gewebe fest.
- Bestätigen Sie die erfolgreiche Ligatur durch die schwache Kontraktion distal der Ligatur. Nachdem Sie den Retraktor vorsichtig entfernt haben, legen Sie eine 5-0-Seidennaht zwischen den zweiten und vierten Zwischenrippenraum und schließen Sie die Thorakotomie.
- Verringern Sie die Isoflurankonzentration auf 1%. Vernähen Sie den Muskel und die Haut sanft mit 5-0 Seide. Verringern Sie die Isoflurankonzentration auf 0 % und warten Sie ca. 5 Minuten, bis die Spontanatmung einsetzt.
- Tragen Sie topisch 2 mg/ml Lidocain in Kochsalzlösung auf den Einschnitt auf. Verabreichen Sie 1 ml Kochsalzlösung über eine subkutane Injektion. Tragen Sie die Tiersalbe topisch auf, um Infektionen vorzubeugen.
- Nehmen Sie die Ratte aus dem Intubationsschlauch und kehren Sie in den Tierkäfig zurück. Dann ziehen Sie die Ratten 1 Woche lang in einzelnen Käfigen auf.
- Analysieren Sie die Veränderungen der systolischen Pumpenfunktion des Herzens mittels Echokardiographie.
HINWEIS: Die Herzfunktion wird aufgrund eines lateralen Myokardinfarkts eingeschränkt.
4. Echogesteuerte perkutane Zelltransplantation mit der Methode der langsamen Injektion
- 10%ige Gelatinebrühe bei 37 °C vorwärmen, bis sie flüssig ist.
- Verdünnen Sie 10 % Gelatine mit vorgewärmtem ADS-Puffer, um die endgültige injizierbare 5%ige Gelatinelösung zu erhalten (100 μl sind pro Tier erforderlich).
- Suspendieren Sie 96 Kardiomyozytenkugeln (insgesamt: 28.800 Kardiomyozyten/Tier) in 100 μl vorgewärmter Injektionslösung.
- Die in Schritt 4.3 vorbereitete Suspension wird in die Zellinjektionsspritze gegeben, wobei das Ansaugen von überschüssiger Luft vermieden wird.
- Um Blasen in der Spritze zu beseitigen, halten Sie sie senkrecht mit der Nadel nach oben, klopfen Sie auf die Spritze und sammeln Sie alle Blasen am oberen Grat der Spritze.
HINWEIS: Beobachten Sie während dieses Schritts, wie sich die Kardiomyozytenkugeln allmählich auf der Gummidichtung des Kolbens absetzen. - Behalten Sie die vertikale Position der Spritze bei, drücken Sie den Kolben langsam nach oben und entsorgen Sie die Blasen und die überschüssige Zellsuspensionslösung, bis 20 μl der Zellsuspension in der Spritze verbleiben. Drücken Sie den Kolben vorsichtig mit konstanter Geschwindigkeit, so dass die Kardiomyozytenkugel auf der Gummidichtung des Kolbens aufliegt.
- Tauchen Sie die Spritze mit Verschluss 5 Minuten lang direkt in ein Eisbad.
- Legen Sie eine gekühlte Spritze in das Injektionsgerät. Fixieren Sie den Injektionsspritzenapparat auf einer feinen Bewegungsvorrichtung auf der Tierbühne mit einer X-Y-Z-Position, einer handgefertigten Klemme. Das Feinbewegungsgerät kann die Nadelposition mit den 20-mm-Schlittenbewegungen in x-Richtung, y-Richtung und z-Richtung bewegen.
- Betäuben Sie die Ratten in einem versiegelten Kasten, der mit Luft gefüllt ist, die 3% Isofluran enthält. Bestätigen Sie die Anästhesie, indem Sie nicht auf Schmerzreize reagieren. Tragen Sie Tiersalbe auf die Augen auf, um Trockenheit zu verhindern.
- Fixieren Sie die Gliedmaßen mit abgeschnittenen chirurgischen Klebebändern auf einer 40 °C erwärmten Echoplatte. Um eine ausreichende Anästhesie aufrechtzuerhalten, stellen Sie sicher, dass die eingeatmete Luft eine Konzentration von etwa 3 % Isofluran enthält.
- Entfernen Sie die Haare am Injektionsfeld (2 cm Durchmesser) und an der Brust mit Enthaarungscreme und wischen Sie die Haut mit Povidon-Jod ab.
- Tragen Sie Echo-Gel auf die Brust und die Echosonde auf. Platzieren Sie die Echosonde nahe an der Brust entlang der Schädel- und Schwanzachse und beginnen Sie mit der B-Mode-Echokardiographie gemäß der Bedienungsanleitung des Herstellers.
- Schieben Sie die Spitze der Injektionsnadel in der Frontalansicht in den Herzmuskel (Abbildung 2 und ergänzendes Video 1).
- Um die Hauptspritzenpumpe zu aktivieren, drücken Sie die Start-Taste und drehen Sie den Drehknopf, um eine vorgegebene Zahl für eine Injektionsgeschwindigkeit von ca. 0,02 μl/s einzustellen. Tragen Sie die Tiersalbe topisch um die Nadelposition herum auf, um Infektionen zu vermeiden.
HINWEIS: Es ist notwendig, die entsprechende Wählnummer für die vorgesehene Einspritzgeschwindigkeit mit einer Einspritzlösung zu bestimmen. Nach der Injektion entfernen Sie die Injektionsnadel mit einem vorbildlichen Bewegungssystem. - Verringern Sie die Isoflurankonzentration auf 0 % und warten Sie ca. 5 Minuten, bis das Tier wieder zu Bewusstsein kommt, um das Brustbein zu halten.
5. Beurteilung der Herzfunktion
- Betäuben Sie die Ratten in einem versiegelten Kasten, der mit Luft gefüllt ist, die 3% Isofluran enthält. Bestätigen Sie die Anästhesie, indem Sie nicht auf Schmerzreize reagieren. Tragen Sie Tiersalbe auf die Augen auf, um Trockenheit zu verhindern.
- Tragen Sie die elektrisierende Creme für die EKG-Erfassung auf die Gliedmaßenspitzen auf. Fixieren Sie die Gliedmaßen mit abgeschnittenen chirurgischen Klebebändern auf einer 40 °C erwärmten Echoplatte. Verwenden Sie ein physiologisches Überwachungssystem, um EKG und Herzfrequenz in Echtzeit zu erfassen.
- Bestimmen Sie gemäß den Anweisungen des Herstellers zunächst den Winkel der Längsachse anhand des B-Modus-Echobildes, das die linksventrikuläre Spitze zum Ausflusstrakt zeigt, und drehen Sie dann die Echosonde um 90°, um in die Kurzachsenansicht zu wechseln.
- Verwenden Sie nur das feine Bewegungssystem der kaudalen bis rostralen Achse des Tierstadiums und passen Sie die Kurzachsenansicht an die Höhe der Papillarmuskulatur an. Wechseln Sie dann den Bildmodus in den M-Modus, indem Sie die M-Modus-Taste drücken, und nehmen Sie 5 Sekunden lang ein Video auf, indem Sie die Cine-Loop-Taste drücken.
- Um die Fraktionsverkürzung mit der Software zu analysieren und zu berechnen, drücken Sie die Schaltfläche Messen und ein vertikales Linienwerkzeug, um die endsystolischen und enddiastolischen linksventrikulären Innenmaße zu definieren. Die Software berechnet automatisch die prozentuale Bruchverkürzung (FS).
- Verringern Sie die Isoflurankonzentration auf 0 % und warten Sie ca. 5 Minuten, bis das Tier wieder zu Bewusstsein kommt, um das Brustbein zu halten.
6. Immunhistochemie
- Fixieren Sie den euthanasierten Körper (Euthanasie wie in Schritt 1.1.3 beschrieben) auf dem Tisch mit den zerschnittenen chirurgischen Bändern, schneiden Sie die Herzen heraus, waschen Sie sie mit PBS und tauchen Sie das Herz in 4% Paraformaldehyd/PBS.
- Die Herzen werden in drei Abschnitte zerlegt, zum Kryoschutz in 40%ige Saccharose getaucht, in eine OCT-Verbindung (Optimal Cutting Temperature) eingebettet und bei −80 °C eingefroren.
- Befestigen Sie die kryosektionierten Gewebe (8 μm Dicke) auf mit Aminosilan beschichteten Objektträgern. Nach ausreichender Trocknung mit nicht erwärmtem Wind, der von einem allgemeinen Haartrockner erzeugt wird, tauchen Sie die Objektträger in Tris-gepufferte Kochsalzlösung mit 0,2 % Tween-20 (TBS-T).
- Tauchen Sie sie für 30 Minuten bei 25 °C in eine Blockierungslösung. Gießen Sie 100 μl der primären antikörperhaltigen Blockierungslösung auf den Objektträger und inkubieren Sie über Nacht bei 4 °C mit Paraffinversiegelung, um die Antikörperlösung auf dem Gewebe verteilt zu halten.
HINWEIS: Die Antikörperkonzentration ist in der Materialtabelle angegeben. - Legen Sie die Objektträger horizontal in eine handgefertigte Box mit hoher Luftfeuchtigkeit und nutzen Sie den natürlichen Dampf des nassen Papiers, um eine Verdunstung zu verhindern. Waschen Sie die Objektträger dreimal mit TBS-T.
- Mit dem Sekundärantikörper-haltigen Blocker 1 h bei 25 °C auf die gleiche Weise wie mit dem Primärantikörper behandeln. Beobachten Sie nach drei Waschgängen die Fluoreszenzsignale mit einem Fluoreszenzmikroskop und einem konfokalen Lasermikroskop.
HINWEIS: Die Antikörperkonzentration ist in der Materialtabelle angegeben. - Statistische Analyse: Führen Sie für den Vergleich des Zellvolumens, wie in Abbildung 3A dargestellt, einen nicht gepaarten t-Test durch. Um die Wiederherstellung der Herzfunktion nach Verabreichung von Kardiomyozyten mit der langsamen Injektionsmethode zu beurteilen, wie in Abbildung 4A dargestellt, ist ein gepaarter t-Test zu verwenden. In dieser Arbeit wurden die Unterschiede bei P < 0,01 als statistisch signifikant angesehen. Fehlerbalken stellen die Standardabweichung dar.
Repräsentative Ergebnisse
Auswirkungen der langsamen Injektion auf das Überleben der Zellen und die Kollagenablagerung
Mit PKH26 markierte Kardiomyozytenkugeln von neugeborenen Ratten wurden mit einer normalen oder langsamen Injektionsmethode in normales Nacktrattenmyokard injiziert. Die Ergebnisse zeigten, dass die langsame Injektionsmethode das transplantierte Zellvolumen signifikant erhöhte (Abbildung 3A) und die Typ-I-Kollagenablagerung vor Ort signifikant verringerte (Abbildung 3B).
Auswirkungen einer langsamen Injektion auf die Wirksamkeit der Behandlung in einem Ratteninfarktmodell
Die Echokardiographen-gesteuerte langsame Injektionsmethode wurde verwendet, um neonatale Ratten-Kardiomyozytenkugeln oder PBS(−) in die Infarktherzen von Modellratten zu injizieren. Die zellinjizierte Gruppe allein zeigte nach 2 Monaten eine signifikante Verbesserung der Herzkontraktionsfunktion (Abbildung 4A). Immunhistochemische Analysen zeigten eine nahtlose Verbindung zwischen den transplantierten Zellen und den Wirtsmyozyten über interkalierte Scheiben, die Gap Junctions enthalten (Abbildung 4B).
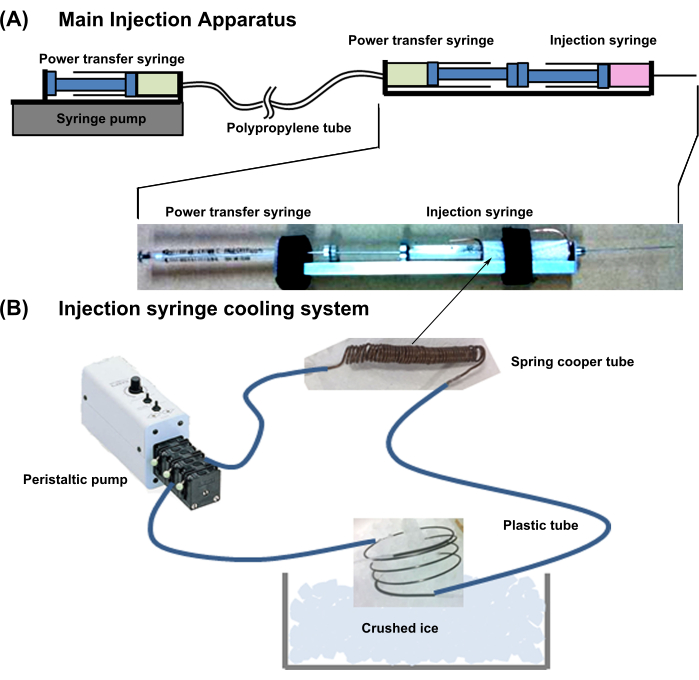
Abbildung 1: Schematische Darstellung des gesamten Einspritzsystems . (A) Haupteinspritzvorrichtung. (B) Kühlsystem der Injektionsspritze. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
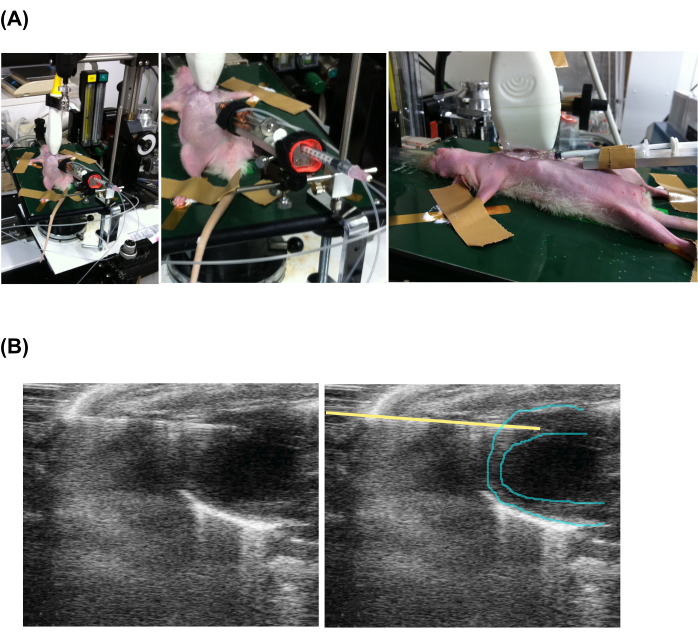
Abbildung 2: Echokardiographie-gesteuerte perkutane langsame Injektion . (A) Einstellung des Tieres, der Echosonde und des Injektionsgeräts. (B) Echokardiographische Ansicht der injizierenden Spritze und des Herzens. Beachten Sie, dass das linke und das rechte Bild identisch sind, aber eine gelbe Linie hinzugefügt wurde, um die Position der Nadel anzuzeigen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
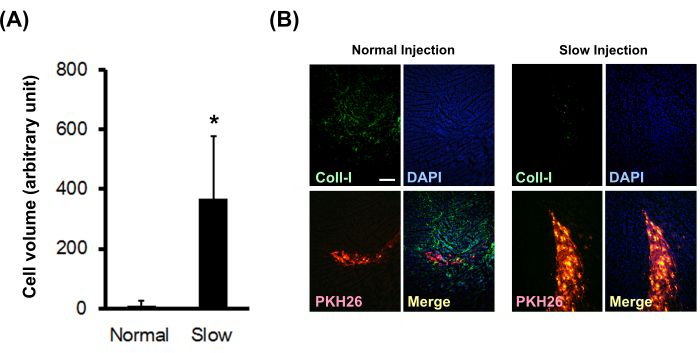
Abbildung 3: Einfluss der langsamen Injektionsmethode auf das transplantierte Zellvolumen und die Kollagenablagerung. (A) Die transplantierten Zellvolumina (N = 3) wurden aus Serienschnitten berechnet. Die Fehlerbalken zeigen Standardabweichungen an. *P < 0,01 in einem nicht gepaarten t-Test. (B) Immunhistochemische Färbung für Typ-I-Kollagen. Der Maßstabsbalken zeigt 200 μm an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
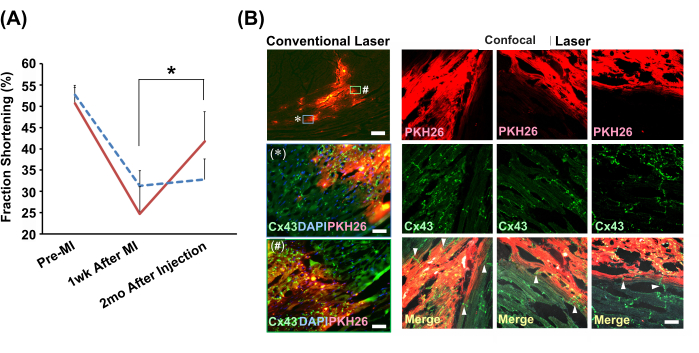
Abbildung 4: Verbesserungen der Herzfunktion und der histologischen Integration mit Kardiomyozytenkugeln, die durch die langsame Injektionsmethode transplantiert wurden . (A) Repräsentative Echokardiographen-M-Mode-Ansichten. Die Grafik zeigt den Übergang der Fraktionsverkürzungen in der Kardiomyozyten-Ball-transplantierten Gruppe (durchgezogene rote Linie; N = 4) und Fahrzeuggruppe (Zellsuspensionslösung für die langsame Injektionsmethode) (gestrichelte blaue Linie; N = 3). Abkürzungen: MI = Myokardinfarkt; Cx43 = Connexin 43; DAPI = 4',6-Diamidino-2-phenylindol; PKH26 = rot fluoreszierende Zellmembranmarkierung. Die Fehlerbalken zeigen die Standardabweichungen an. *P < 0,01 in einem gepaarten t-Test. (B) Immunhistochemische Analysen der Beziehung zwischen den transplantierten Kardiomyozytenkugeln und den Kardiomyozyten des Wirts. Die konventionellen lasermikroskopischen Beobachtungen mit einem 2-fach-Objektiv sind in der linken Spalte dargestellt. Vergrößerte Versionen (mit einem 20-fachen Objektiv) von zwei im Kasten gezeigten Bereichen, die mit * und # gekennzeichnet sind, sind unten dargestellt. Maßstabsleisten: oberes Bild = 300 μm; * und # = 30 μm. Konfokale lasermikroskopische Aufnahmen mit einem 20-fach-Objektiv werden zum Vergleich gezeigt. Es werden drei Positionen angezeigt. In den zusammengeführten Bildern zeigen die Pfeilspitzen das Vorhandensein von Gap Junctions (Cx43) an, die das Transplantat direkt mit den Kardiomyozyten des Wirts verbinden. Der Maßstabsbalken zeigt 30 μm an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzendes Video 1: Echogeführte langsame Injektionsmethode. Das B-Mode-Echokardiogramm in der Frontalansicht zeigt die Injektionsnadelspitze, die in das Myokard vorgeschoben ist. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Einer der kritischen Punkte für die erfolgreiche Durchführung der langsamen Injektionsmethode ist die Vorbereitung eines effektiven Injektionssystems mit einer leistungsstarken Spritzenpumpe und einem starken Druckübertragungsschlauch. Ein Hochdrucksystem ist erforderlich, um das Gel aus der Spitze einer feinen Nadel zu drücken. Der zweite kritische Punkt ist die Stabilisierung des Herzens. Das Schlagen des Herzens gegen eine Injektionsnadel, die in den Herzmuskel vorgeschoben wird, kann das Gewebe verletzen. In dieser Studie wurde eine echogesteuerte Injektion durchgeführt, um eine zweite Verletzung des offenen Brustkorbs zu vermeiden und die Zellinjektion in einem stabilisierten Herzen mit aufgeblasener Lunge zu verabreichen. Darüber hinaus sollten bei einigen Anwendungen für größere Tiere oder Menschen einige Injektionsgeräte, die am Herzen befestigt werden, als Teil der strategischen Gestaltung der Anwendung in Betracht gezogen werden. Für Injektionen in den offenen Brustkorb in das Herz von Kleintieren wird aufgrund der höheren Herzfrequenz die Verwendung einer langen, flexiblen Nadel empfohlen.
In dieser Arbeit erhöhte die langsame Injektionsmethode das überlebende Kardiomyozytenvolumen im Vergleich zur normalen Injektionsmethode signifikant. Die normale Injektion verursacht eine Zellschädigung durch Scherspannung15. Im Gegensatz dazu verursacht die langsame Injektionsmethode theoretisch keine solche Belastung, da sie zusätzlich zur langsamen Injektion eine nicht-newtonsche Lösung verwendet.
In Bezug auf die lokale Fibrose zeigte der interstitielle Raum um die normalerweise injizierten überlebenden Kardiomyozyten eine starke und weit verbreitete Typ-I-Kollagenablagerung. Im Gegensatz dazu waren die Typ-I-Kollagensignale um die transplantierten Kardiomyozyten, die mit der langsamen Injektionsmethode transplantiert wurden, viel schwächer und begrenzter. Dies deutet darauf hin, dass die langsame Injektionsmethode deutlich weniger Schäden verursachte. Die langsame Injektion von neonatalen Kardiomyozyten in das adulte Myokard verbesserte die kontraktile Funktion des infarktierten Herzens signifikant. Die histologischen Analysen deuteten darauf hin, dass die Transplantation der Kardiomyozyten mit der langsamen Injektionsmethode zu direkten Verbindungen und funktioneller Kopplung mit den Kardiomyozyten des Wirts führte. Dieses Phänomen erklärt den Mechanismus der funktionellen Erholung des Wirtsmyokards. Soweit wir wissen, ist dies der erste Bericht über transplantierte neonatale Kardiomyozyten mit großflächigen nahtlosen Verbindungen zu den adulten Kardiomyozyten des Wirts. Die funktionellen Verbindungen mit dem Wirtsmyokard über die elektrische und mechanische Kopplung können die transplantierten Kardiomyozyten reifen lassen und es ihnen ermöglichen, als funktionelle Myozyten zu fungieren, die zur Herzfunktion des Wirts beitragen. Langfristige physikalische Kraftwechselwirkungen zwischen den Kardiomyozyten des Wirts und des Transplantats sind entscheidend für die vollständige Reifung. Daher können nach der Injektion 2 Monate für die funktionelle Wiederherstellung des infarktierten Herzens erforderlich sein. Die zeitabhängige Wiederherstellung der Herzfunktion des Patienten kann ein erwartetes Phänomen in therapeutischen Anwendungen sein, und dies kann ein Kennzeichen für die erfolgreiche Etablierung einer de novo funktionellen Kopplung und Integration zwischen dem Wirt und den transplantierten Kardiomyozyten sein.
Die langsame Injektionsmethode kann während einer Operation am offenen Brustkorb durchgeführt werden. Darüber hinaus kann diese Methode auch auf Mäuse angewendet werden. Für zukünftige Anwendungen in der Humantherapie müssen wir noch einige Fragen klären. Die Injektionsgeschwindigkeit sollte unter Berücksichtigung der Pufferkapazität des interstitiellen Flüssigkeitsflusses in jedem menschlichen Zielorgan optimiert werden. Es sollten xenofreie Materialien wie menschliche Gelatine oder biologisch abbaubare synthetische Materialien verwendet werden. Es sollten langsame Injektionsgeräte in klinischer GMP-Qualität entwickelt werden, wie z. B. kompakte organspezifische Einwegwerkzeuge oder ein wiederverwendbares Gerät für breite Organe.
Offenlegungen
Der Autor hat nichts zu verraten.
Danksagungen
Diese Studie wurde durch einen Zuschuss von JSPS KAKENHI (Grant No. 23390072 und 19K07335) und AMED (Grant No. A-149) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 18-gauge needle & tuberculin, 1 mL | Terumo | NN1838R, SS-01T | |
| 29-gauge 50 mm-long needle | Ito Corporation, Tokyo, Japan | 14903 Type-A | |
| A copper tube | General Suppliers | outer diameter, 1 mm; inner diameter, 0.3 mm; thickness, 0.35 mm | |
| Ads Buffer | Each ingredient was purchased from Fuji Film Wako Chemical Inc., Miyazaki, Japan | Hand made, Composition: 116 mM NaCl, 20 mM HEPES, 12.5 mM NaH2PO4, 5.6 mM glucose, 5.4 mM KCl, 0.8 mM MgSO4, pH 7.35 | |
| alpha-MEM | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 051-07615 | |
| Anti-collagen type I rabbit polyclonal antibody (H+L) | Proteintech | 14695-1-AP | using dilution 1:100 |
| Anti-Connexin-43 rabbit polyclonal antibody (H+L) | Sigma Aldrich | C6219 | using dilution 1:100 |
| Anti-rabbit IgG (H+L) donley polyclonal antibody-AlexaFluo488 | Thermo Scientific | A21206 | using dilution 1:300 |
| blocking solution (Blocking One) | Nacalai Tesque, Kyoto, Japan | 03953-95 | |
| collagenase | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 034-22363 | |
| confocal laser microscope | Carl Zeiss Inc., Oberkochen, Germany | LSM510 META | |
| DNase I | Sigma-Aldrich | DN25 | |
| FACS Aria III | Becton Dickinson, Franklin Lakes, NJ, USA | ||
| fetal bovine serum | BioWest, FL, USA | S1820-500 | |
| fine movement device (Micromanipulator) | Narishige Co., Ltd., Tokyo, Japan | M-44 | |
| fluorescence microscope | Nikon Instruments, Tokyo, Japan | Eclipse Ti2 | |
| gelatin from bovine skin | Sigma-Aldrich | G9382 | dissolving in PBS (-) to 10%, and autoclaving it |
| Neonatal Sprague-Dawley (SD) rats | Japan SLC Inc., Shizuoka, Japan | 0–2 d after birth | |
| non-adhesive 96-well plates (spheloid plate) | Sumitomo Bakelite, Tokyo, Japan | MS-0096S | |
| Optimal Cutting Temperature (OCT) Compound | Sakura Finetek USA, Inc., CA, USA | Tissue-Tek OCT compound | |
| peristaltic pump (for cooling system) | As One Co., Osaka, Japan | SMP-23AS | |
| PKH26 | Sigma-Aldrich | PKH26GL | |
| Stir Bar, Micro, Magnetic, PTFE, Length x Dia. in mm: 5 x 2 | Chemglass life sciences LLC, NJ, USA | CG-2003-120 | |
| syringe | Ito Corporation, Tokyo, Japan | MS-N25 | |
| syringe pump with remote controller | As One Co., Osaka, Japan | MR-1, CT-10 | |
| tetramethylrhodamine methyl ester | Thermo Fisher Scientific, Waltham, MA, USA | T668 | |
| trypsin | DIFCO, Becton Dickinson, Franklin Lakes, NJ, USA | 215240 | |
| Tween-20 | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 167-11515 | |
| veterinarian ointment | Fujita Pharmaceutical Co., Ltd. | Hibikusu ointment #WAK-95832 | |
| Vevo 2100 Imaging System | Fujifilm VisualSonics, Inc., Toronto, Canada | Vevo 2100 | |
| Vevo 2100 Imaging System software version 1.0.0 | Fujifilm VisualSonics, Inc., Toronto, Canada | Vevo 2100 | |
| Weakly curved needle with ophthalmic thread | Natsume Seisakusho Co., Ltd., Tokyo, Japan | C7-70 |
Referenzen
- Chavkin, N. W., et al. The cell surface receptors Ror1/2 control cardiac myofibroblast differentiation. Journal of the American Heart Association. 10 (13), e019904 (2021).
- Li, H., et al. The cell membrane repair protein MG53 modulates transcription factor NF-κB signaling to control kidney fibrosis. Kidney International. 101 (1), 119-130 (2022).
- Liu, X., Liu, Y., Khodeiry, M. M., Lee, R. K. The role of monocytes in optic nerve injury. Neural Regeneration Research. 18 (8), 1666-1671 (2023).
- Weber, F., Treeck, O., Mester, P., Buechler, C. Expression and function of BMP and activin membrane-bound inhibitor (BAMBI) in chronic liver diseases and hepatocellular carcinoma. International Journal of Molecular Sciences. 24 (4), 3473 (2023).
- Tohyama, S., et al. Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell. 12 (1), 127-137 (2013).
- Hattori, F., Fukuda, K. Strategies for replacing myocytes with induced pluripotent stem in clinical protocols. Transplantation Reviews. 26 (3), 223-232 (2012).
- Hattori, F., et al. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature Methods. 7 (1), 61-66 (2010).
- Fernandes, S., et al. Human embryonic stem cell-derived cardiomyocytes engraft but do not alter cardiac remodeling after chronic infarction in rats. Journal of Molecular and Cellular Cardiology. 49 (6), 941-949 (2010).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Wendel, J. S., et al. Functional effects of a tissue-engineered cardiac patch from human induced pluripotent stem cell-derived cardiomyocytes in a rat infarct model. Stem Cells Translational Medicine. 4 (11), 1324-1332 (2015).
- Hattori, F. Technology Platforms for Heart Regenerative Therapy Using Pluripotent Stem Cells. Stem Cells and Cancer Stem Cells, Volume 7: Therapeutic Applications in Disease and Injury. , 33-45 (2012).
- Tao, S., et al. Ablation lesion characterization in scarred substrate assessed using cardiac magnetic resonance. JACC: Clinical Electrophysiology. 5 (1), 91-100 (2019).
- Rutkowski, J. M., Swartz, M. A. A driving force for change: interstitial flow as a morphoregulator. Trends in Cell Biology. 17 (1), 44-50 (2007).
- Hattori, F., Fukuda, K., Yuasa, S. How to purify cardiomyocytes for research and therapeutic purposes. Cardiac Regeneration using Stem Cells. , (2013).
- Li, M., Tian, X., Zhu, N., Schreyer, D. J., Chen, X. Modeling process-induced cell damage in the biodispensing process. Tissue Engineering. Part C, Methods. 16 (3), 533-542 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten