Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Robotergestützte vagussparende totale Gastrektomie zur Behandlung von CDH1-Genmutationen
In diesem Artikel
Zusammenfassung
Dieser Artikel konzentriert sich auf die robotergestützte vagussparende totale Gastrektomie. Es werden die Techniken und Fallstricke der Vaguserhaltung, der genähten Ösophagojejunostomie, der Jejunumbeutelbildung und der Roux-en-Y-Rekonstruktion mit einer klammergeklammerten Jejunojejunostomie diskutiert.
Zusammenfassung
Hereditärer diffuser Magenkrebs (HDGC), der durch die Mutation des CDH1-Gens verursacht wird, ist ein erbliches Krebssyndrom, das das Risiko für diffusen Magenkrebs erhöht und durch eine Magenspiegelung kaum zu erkennen ist. Die empfohlene vorbeugende Behandlung ist eine totale Gastrektomie. Die robotergestützte Chirurgie erleichtert den Einsatz minimal-invasiver chirurgischer (MIS) Techniken für Anastomosen und den Erhalt des hinteren Vagus, um möglicherweise nachteilige funktionelle Ergebnisse zu reduzieren. Ein asymptomatischer 24-jähriger Mann mit der CDH1-Genmutation, die durch Gentests nachgewiesen wurde, und einer Familienanamnese eines Bruders, der sich einer totalen Gastrektomie wegen HDGC unterzogen hatte, wurde mit dieser Technik behandelt. Dieser Video-Fallbericht zeigt die Techniken und Fallstricke der robotergestützten Chirurgie in Bezug auf die Patientenpositionierung und Portplatzierung, die posteriore vaguserhaltende Dissektion, die vernähte Ösophagojejunostomie, die Bildung von Jejunalbeuteln und die Roux-en-Y-Rekonstruktion mit einer klammergeklammerten Jejunojejunostomie. Während diese Techniken im Falle der prophylaktischen Gastrektomie demonstriert werden, können viele von ihnen auch auf andere gutartige und bariatrische Vorderdarm- und allgemeine Chirurgietypen angewendet werden. Die robotergestützte Chirurgie kann die MIS-Technik des Vorderdarms erleichtern, wie in diesem Fall eine vaguserhaltende totale Gastrektomie beschrieben.
Einleitung
Der hereditäre diffuse Magenkrebs (HDGC) ist gekennzeichnet durch eine genetische Mutation im Tumorsuppressorgen E-Cadherin (CDH1), das ein autosomal-dominantes Vererbungsmuster aufweist1. Dieses erbliche Krebssyndrom erhöht das Risiko für diffusen Magenkrebs und lobulären Brustkrebs (LBC). Aktuelle Leitlinien empfehlen, bei Patienten mit familiären Clustern von HDGC und LBC auf CDH1-Mutationen zu testen, insbesondere bei Patienten mit frühem Auftreten (vor dem 40. Lebensjahr)2. Laut der größten berichteten Serie von CDH1-Mutationsträgern beträgt die kumulative Lebenszeitinzidenz von Magenkrebs 70 % (95 % KI, 59 %-80 %) für Männer und 56 % (95 % KI, 44 %-69 %) für Frauen mit dieser Mutation3. Neuere Studien haben jedoch die Penetranz von Magenkrebs mit dieser Mutation auf 37 % bis 42 % bei Männern und 25 % bis 33 % bei Frauen geschätzt1.
Die endoskopische Überwachung mit Biopsien ist die empfohlene Überwachungsart für diejenigen, die sich für eine Verzögerung der prophylaktischen Gastrektomie entscheiden. Es ist jedoch nahezu unmöglich, Magenkrebs im Frühstadium in dieser Kohorte mit Hilfe der Screening-Gastroskopie2 zu erkennen. Auf eine umfangreiche endoskopische Weißlichtuntersuchung folgen mindestens 30 nicht-gezielte Magenbiopsien aus fünf verschiedenen Bereichen des Magens. Diese Überwachungsmethode hat jedoch eine hohe falsch-negative Rate und erkennt nur 20%-63% der okkulten Siegelringzellherde 4,5.
Die prophylaktische totale Gastrektomie (PTG) ist die empfohlene vorbeugende Behandlung für jeden pathogenen oder wahrscheinlich pathogenen Träger der CDH1-Variante ab dem Alter von 20 Jahren, wird jedoch nicht über das 70. Lebensjahr hinaus empfohlen 1,2. Perigastrische Lymphknotenmetastasen sind ein seltener Befund bei asymptomatischen Patienten, die typischerweise T1a- oder In-situ-Siegelringzellen haben. Die perioperative Morbidität ist im Allgemeinen niedrig und die Patientenzufriedenheit hoch6. Obwohl die Lebensqualität nach der Operation insgesamt hoch ist, wird eine Stammvagotomie in der Regel bei einer totalen Gastrektomie durchgeführt 7,8. Die Resektion des Vagusnervs oberhalb der Höhe der Zöliakie- und Leberäste führt zu einer parasympathischen Denervierung des hepatobiliären Baumes und des Dünn- und Dickdarms. Durchfall nach Vagotomie und das Dumping-Syndrom sind allgemein anerkannte Langzeitkomplikationen nach PTG8.
Die Roboterchirurgie ermöglicht dem Chirurgen eine 3-dimensionale, 10-fach vergrößerte Sicht auf das Operationsfeld und bietet mit beweglichen chirurgischen Instrumenten einen hohen Freiheitsgrad9. Das Ziel dieser Technik ist es, nachteilige funktionelle Ergebnisse durch den Erhalt des hinteren Vagus, der durch minimal-invasive chirurgische (MIS) Techniken erleichtert wird, potenziell zu reduzieren.
Protokoll
Der Patient gab seine Einverständniserklärung zur Veröffentlichung von anonymisierten Informationen, Bildern und Videodokumentationen. Associate Professor Dr. Michael Talbot (Co-Autor) ist ein Chirurg des oberen Magen-Darm-Trakts, der für die Durchführung von Gastrektomien an seiner Einrichtung akkreditiert ist. Aufgrund des vernachlässigbaren Risikos, das mit diesem Fallbericht und Protokoll verbunden ist, wurde er gemäß den Richtlinien des lokalen institutionellen Prüfungsausschusses von einer Ethikprüfung ausgenommen. Ethikanträge für Fallberichte sind gemäß den Richtlinien des lokalen institutionellen Prüfungsausschusses ausgenommen.
1. Positionierung des Patienten
- Bringen Sie den Patienten nach der Vollnarkose in die umgekehrte Trendelenburg-Position.
- Sichern Sie den Patienten mit einer Fußplatte, einem Körpergurt über den Knien und Knöchelgurten in Position. Abduktieren (<90°) der Arme und mit Krepp an den Armbrettern verbinden. Platzieren Sie eine Nathanson-Leberretraktorhalterung auf dem Operationstisch, kranial zum linken Armbrett.
2. Platzierung der Anschlüsse (Abbildung 1)
- Machen Sie einen 12 mm Hautschnitt über den vom Chirurgen bevorzugten Ansatz in der rechten Mittelklavikularposition auf oder unter der Höhe des Nabels. Führen Sie einen optischen Eintritt mit einem 8 mm, 0° Laparoskop und mit einem 12 mm Port durch diesen Schnitt durch. Beachten Sie, dass der Kameraanschluss 10-20 cm von der Zielanatomie entfernt sein sollte.
- Tauschen Sie den Anschluss gegen einen 12-mm-Roboteranschluss (Heftung) mit einem 12-8-mm-Reducer aus und tauschen Sie das Laparoskop gegen ein 8-mm-Laparoskop mit 30° aus. Etablieren Sie ein Pneumoperitoneum von 15 mmHg CO2 mit einem Fluss von 45 mmHg.
- Nehmen Sie drei weitere 8 mm Hautschnitte in der Transumbilikalebene vor und platzieren Sie drei 8 mm Roboterports. Platzieren Sie einen der Roboterports am Nabel und die beiden anderen Roboterports seitlich dazu auf der linken Seite. Stellen Sie sicher, dass zwischen den Anschlüssen ein Abstand von >8 cm und zwischen den Anschlüssen und der Zielanatomie ein Abstand von 10-20 cm besteht.
- Platzieren Sie einen weiteren 12-mm-Assistentenanschluss (Anschluss A) im oberen rechten Quadranten. Führen Sie einen Nathanson-Retraktor durch einen 5-mm-Schnitt in das Epigastrium ein und ziehen Sie den linken Leberlappen zurück.
- Platzieren Sie den Roboter-Patientenwagen von der rechten Seite des Patienten über den Patienten und achten Sie darauf, eine Kollision mit dem Leberretraktor zu vermeiden. Docken Sie zuerst den Kameraarm mit der lasergesteuerten Portplatzierung an. Führen Sie eine Inzessur auf den Magen mit einem 8 mm großen 30°-Roboterendoskop unter Verwendung von Port 3 durch.
- Docken Sie die verbleibenden Roboteranschlüsse an die Instrumentenarme an und stoßen Sie sie auf, und setzen Sie dann ein bipolares 8-mm-Instrument mit Kraft (Anschluss 1), eine Gefäßversiegelungsverlängerung (Anschluss 2) und einen hochklappbaren fenestrierten Greifer (Topf 4) ein. Stellen Sie den monopolaren und bipolaren Auto-Cut und die erzwungene Koagulation auf Effekt 3 ein und überprüfen Sie die Systemeinrichtung.
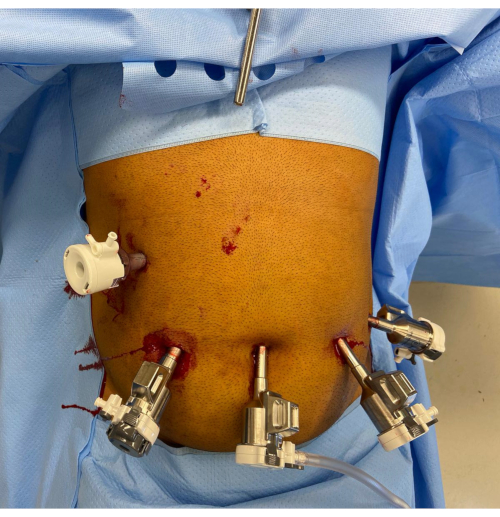
Abbildung 1: Platzierung des Roboteranschlusses. Der Griff des Nathanson-Retraktors ist im Epigastrium zu sehen. Im oberen rechten Quadranten befindet sich ein 12-mm-Assistentenanschluss. Die restlichen Ports von links nach rechts im Bild sind der 12-mm-Roboterport mit Reducer, der 8-mm-Kameraport und zwei weitere 8-mm-Roboterports. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Vaguserhaltende Dissektion
- Mobilisieren Sie die große Krümmung des Magens durch das gastrokolische Band vom Antrum bis zur Kardia und teilen Sie sie in fünf bis sieben kurze Magengefäße lateral des Arcade-Gefäßversiegelers auf, erstrecken Sie sich um die N1-Knoten. Mobilisieren Sie dann die linke Seite des Haatus der Speiseröhre.
- Treten Sie in das Band phrenoösophageus ein und mobilisieren Sie die linke Seite des distalen Ösophagus. Führen Sie eine distale Dissektion mit dem Gefäßversiegeler durch und fahren Sie mit der Mobilisierung des ersten Teils des Zwölffingerdarms fort. Folgen Sie dem supraduodenalen Fenster durch die Pars flaccida, um die rechtsseitige Ösophagusmobilisation abzuschließen, wobei die Dissektionsebene an die Speiseröhre angrenzt.
- Durchschneiden Sie den ersten Teil des Zwölffingerdarms mit dem Heftroboter mit einem 60 mm x 4,3 mm großen grünen Nachlader mit einer Stützverstärkung. Teilen Sie die linken Magengefäße mit dem Gefäßverschließer nahe der Magenwand. Damit soll sichergestellt werden, dass der hintere Vagus im Mesenterium um den linken Magenstiel ungeteilt bleibt.
- Ziehen Sie die Speiseröhre und den Magen in superolateraler Richtung zurück und identifizieren Sie den hinteren Vagusnerv. Streichen Sie den Nerv nach hinten und bewahren Sie ihn.
4. Naht der Ösophagojejunostomie mit einem Jejunalbeutel
- Rekonstruktion des phrenoösophagealen Bandes
- Führen Sie die Rekonstruktion des phrenoösophagealen Bandes in kontinuierlicher Richtung gegen den Uhrzeigersinn von der 5-Uhr- bis zur 9-Uhr-Position mit einer 2-0 nicht resorbierbaren Stachelnaht auf einer 26 mm 1/2-Kreis-Kegelnadel durch. Durchschneiden Sie die intraabdominale Speiseröhre mit dem Klammerroboter mit einem 60 mm x 4,3 mm grünen Nachlader. Verschieben Sie den abgelösten Magen in den oberen rechten Quadranten.
- Ösophagojejunale Anastomose
- Heben Sie das Omentum major kranial an, um die Beugung duodenojejunus zu identifizieren, und bringen Sie eine 50 cm lange Jejunalschleife (wodurch nach der Bildung des Jejunalbeutels ein 40-60 cm langer biliopankreatischer Schenkel entsteht) in die Speiseröhre.
- Naht eine 23 cm lange 3-0 resorbierbare Stachelnaht auf einer 26 mm 1/2 Kreisnadel mit konischer Spitze als laterale 3-Uhr-Ösophagojejunal-Pexie. Ziehen Sie die ungeschnittene Naht seitlich zurück. Legen Sie eine Ösophagostomie anterior der Klammerlinie an, indem Sie einen monopolaren Diathermiehaken mit einer 18Fr-Führung für eine nasogastrische Sonde verwenden. Legen Sie eine Jejunostomie an, die gleich groß oder etwas kleiner ist wie bei der Ösophagostomie.
- Vernähen Sie die hintere Wand der Ösophagojejunostomie mit der Stachelnaht in einer kontinuierlichen Weise im Uhrzeigersinn von der 3-Uhr- bis zur 9-Uhr-Position, wobei Sie die Klammerlinie einbeziehen. Vernähen Sie den vorderen Teil mit einer anderen der gleichen Naht, um die einschichtige Naht in voller Dicke für die Ösophagojejunalanastomose zu vervollständigen. Platzieren Sie einige mediale Nähte jenseits der Anastomose als mediale Pexie.
- Jejunal-Beutel
- Durchschneiden Sie die proximale Jejunallloop in 10 cm Entfernung von der Anastomose mit einem Roboterhefter unter Verwendung eines 60 mm x 2,5 mm großen weißen Nachladers. Erstellen Sie antimesenteriale Enterostomien 10 cm proximal und distal der Ösophagojejunalanastomose.
- Führen Sie zwei Schüsse des Heftroboters mit 60 mm x 2,5 mm weißen Nachladungen durch, um den Jejunalbeutel zu erstellen. Stellen Sie sicher, dass der zweite Brand nicht den ganzen Weg bis zur Ösophagojejunalanastomose geht, um die Blutversorgung der Anastomosen zu erhalten. Verschließen Sie die jejunale Enterotomie kontinuierlich mit einer 3-0 resorbierbaren Stachelnaht.
5. Geheftete Jejunojejunostomie
- Messen Sie eine 70 cm lange Verdauungsgliedmaße und platzieren Sie an dieser Stelle eine 2-0 seidenunterbrochene Naht und die distale biliopankreatische Extremität sowohl für die Markierung als auch für die Retraktion.
- Die Jejunojejunostomie wird mit einer reinen Klammertechnik durchgeführt, wie sie in der Dreifachhefttechnik für den laparoskopischen Magenbypass 10,11 beschrieben ist. Verwenden Sie ein 60 mm x 2,5 mm weißes Reload, um die Anastomose zu bilden und die Enterotomie zu schließen.
- Verschließen Sie sowohl die jejunalen als auch die retro-Roux-Mesenterialdefekte mit 2-0 nicht resorbierbaren Widerhakennähten, um das Risiko von Komplikationen aufgrund eines internen Hernius zu verringern.
6. Probenentnahme und -verschluss
- Entfernen Sie die Instrumente, den Nathanson-Retraktor und die Anschlüsse unter robotergestützter Sicht. Docken Sie den Roboter-Patientenwagen vom Patienten ab.
- Schaffen Sie eine 5 cm lange Mini-Laparotomie durch die Verlängerung des Nabelports. Führen Sie die Probe durch einen kleinen O-Ring-Wundschutz-Retraktor ab. Verschließen Sie die Laparotomie in gewohnter Weise mit muskelschonenden Nähten mit durchgehendem Faszienverschluss und mit einem Verhältnis von Naht zu Wundlänge von 1:4.
Ergebnisse
Die gesamte Operationszeit betrug 2 h 50 min, und der Patient hatte einen unauffälligen postoperativen Verlauf. Der Patient wurde am ersten Tag nach der Operation auf eine Diät mit freien Flüssigkeiten gesetzt und am 4. Tag aus dem Krankenhaus entlassen. Bei der 1-monatigen und 3-monatigen Nachbeobachtung ging es dem Patienten gut und er berichtete über keinen Durchfall oder Dumping-Symptome.
Die Probe wurde zur pathologischen Untersuchung geschickt und ze...
Diskussion
Es wurde ein asymptomatischer 24-jähriger Mann mit der CDH1-Genmutation ausgewählt, die durch Gentests und eine Familienanamnese eines Bruders nachgewiesen wurde, der sich einer totalen Gastrektomie wegen HDGC unterzogen hatte. Die präoperative Endoskopie verlief unauffällig. Der Fall wird als Plattform genutzt, um die Techniken und die Fallstricke der wichtigsten Aspekte zu diskutieren. Dazu gehören die Positionierung und Portplatzierung des Patienten, die posteriore vaguserhaltend...
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Die Autoren danken der Upper Gastrointestinal and Metabolic Research Foundation für die Finanzierung der Publikationsgebühren für die Zeitschriften. Die Autoren danken dem Patienten in diesem Fall auch für seine Zustimmung zur Veröffentlichung seiner anonymisierten Informationen und Bilder.
Materialien
| Name | Company | Catalog Number | Comments |
| Laparoscopic instruments | |||
| 5 mm optical entry port | Applied Medical | CFF03 | Kii Fios First entry access system. |
| Laparoscopic 5mm 0° camera | Olympus | ENDOEYE HD II | 5 mm, 0° |
| Laparoscopic needle holder | KARL STORZ | Laparoscopic needle holder | |
| Nasogastric tube | Cardinal Health | 8888264960E | 16Fr |
| Nathanson liver retractor | COOK Medical | NLRS-1001/ NLRS-1002 | Large/ Extra-large |
| Robotic instruments | |||
| 12 mm port | Intuitive Surgical | 470375 | |
| 8 mm port | Intuitive Surgical | 470380 | |
| 8 mm reducer | Intuitive Surgical | 470381 | |
| Da Vinci Xi/X Endoscope with Camera, 8 mm, 0° | Intuitive Surgical | 470026 | |
| Da Vinci Xi/X Endoscope with Camera, 8 mm, 30° | Intuitive Surgical | 470027 | |
| Force Bipolar 8 mm | Intuitive Surgical | 470405 | |
| Mega SutureCut Needle Driver | Intuitive Surgical | 470309 | |
| Monopolar hook diathermy | Intuitive Surgical | 470183 | |
| SureForm 60mm stapler | Intuitive Surgical | 480460 | |
| Tip-up fenetrated grasper 8 mm | Intuitive Surgical | 470347 | |
| Vessel Sealer Extend 8 mm | Intuitive Surgical | 480422 | |
| Stapler reloads | |||
| Seamguard buttress 60 mm | GORE | 1BSGXI60GB/12BSGXI60GB | |
| SureForm 60 mm green reload | Intuitive Surgical | 48360G | |
| SureForm 60 mm white reload | Intuitive Surgical | 48360W | |
| Sutures | |||
| 2-0 nonabsorbable barbed suture | Medtronic | VLOCN0644 | 23 cm V-Loc on a 26 mm ½ circle taper point needle |
| 3-0 absorbable barbed suture | Medtronic/ Ethicon (J&J) | VLOCM0644 | 23 cm V-Loc on a 26 mm ½ circle taper point needle (preferred), STRATAFIX (alternate). Catalogue number |
| 2-0 monocryl suture | Ethicon (J&J) | JJW3463 | Cut to 15 cm, taper point needle |
| 2-0 silk suture | Ethicon (J&J) | JJ423H | Cut to 15 cm, taper point needle |
| 1 PDS suture | Ethicon (J&J) | JJ75414 | Fascial closure |
| 3-0 monocryl suture | Ethicon (J&J) | JJY227H | Skin closure |
| Topical Skin Adhesive | Ethicon (J&J) | JJ79025 | Skin closure/ wound dressing |
| Specimen extraction | |||
| Alexis O-ring wound retractor | Applied Medical | C8402 | Medium. For specimen extraction |
| Handheld diathermy | Covidien/ Valleylab | VLE2515 | For specimen extraction |
Referenzen
- Gamble, L. A., Heller, T., Davis, J. L. Hereditary diffuse gastric cancer syndrome and the role of CDH1: A review. JAMA Surgery. 156 (4), 387-392 (2021).
- Shenoy, S. CDH1 (E-cadherin) mutation and gastric cancer: Genetics, molecular mechanisms and guidelines for management. Cancer Management and Research. 11, 10477-10486 (2019).
- Hansford, S., et al. Hereditary diffuse gastric cancer syndrome: CDH1 mutations and beyond. JAMA Oncology. 1 (1), 23-32 (2015).
- Friedman, M., et al. Surveillance endoscopy in the management of hereditary diffuse gastric cancer syndrome. Clincal Gastroenterology and Hepatology. 19 (1), 189-191 (2021).
- van der Post, R. S., et al. Hereditary diffuse gastric cancer: updated clinical guidelines with an emphasis on germline CDH1 mutation carriers. Journal of Medical Genetics. 52 (6), 361-374 (2015).
- Kaurah, P., et al. Hereditary diffuse gastric cancer: Cancer risk and the personal cost of preventive surgery. Familal Cancer. 18 (4), 429-438 (2019).
- Hejazi, R. A., Patil, H., McCallum, R. W. Dumping syndrome: Establishing criteria for diagnosis and identifying new etiolo gies. Digestive Diseases and Sciences. 55 (1), 117-123 (2010).
- Johnston, D. Operative mortality and postoperative morbidity of highly selective vagotomy. British Medical Journal. 4 (5996), 545-547 (1975).
- Nakauchi, M., et al. Robotic surgery for the upper gastrointestinal tract: Current status and future perspectives. Asian Journal of Endoscopic Surgery. 10 (4), 354-363 (2017).
- Frantzides, C. T., et al. Laparoscopic Roux-en-Y gastric bypass utilizing the triple stapling technique. Journal of the Society of Laparoendoscopic Surgeons. 10 (2), 176-179 (2006).
- Madan, A. K., Frantzides, C. T. Triple-stapling technique for jejunojejunostomy in laparoscopic gastric bypass. Archives of Surgery. 138 (9), 1029-1032 (2003).
- Forrester, J. D., et al. Surgery for hereditary diffuse gastric cancer: Long-term outcomes. Cancers. 14 (3), 728 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten