Method Article
Tägliche Transfers, Archivierung von Populationen und Fitnessmessung im Langzeit-Evolutionsexperiment mit Escherichia coli
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt, wie das Escherichia coli Long-Term Evolution Experiment (LTEE) durch die Durchführung seiner täglichen Transfers und regelmäßigen Einfrierungen aufrechterhalten werden kann und wie Wettbewerbstests durchgeführt werden, um Fitnessverbesserungen bei evolutionären Bakterien zu messen. Diese Verfahren können als Vorlage für Forscher dienen, die ihre eigenen Experimente zur mikrobiellen Evolution starten.
Zusammenfassung
Das Long-Term Evolution Experiment (LTEE) hat zwölf Populationen von Escherichia coli seit mehr als 35 Jahren und 77.000 Bakteriengenerationen bei der Anpassung an eine einfache Laborumgebung begleitet. Der Aufbau und die Verfahren, die im LTEE verwendet werden, verkörpern zuverlässige und reproduzierbare Methoden zur Untersuchung der mikrobiellen Evolution. In diesem Protokoll beschreiben wir zunächst, wie die LTEE-Populationen jeden Tag auf frisches Medium übertragen und kultiviert werden. Anschließend beschreiben wir, wie die LTEE-Populationen regelmäßig auf mögliche Anzeichen einer Kontamination überprüft und archiviert werden, um einen dauerhaft eingefrorenen "Fossilbericht" für spätere Untersuchungen bereitzustellen. Mehrere Sicherheitsvorkehrungen, die in diesen Verfahren enthalten sind, sind darauf ausgelegt, eine Kontamination zu verhindern, verschiedene Probleme zu erkennen, wenn sie auftreten, und sich von Störungen zu erholen, ohne den Fortschritt des Experiments spürbar zu beeinträchtigen. Eine Möglichkeit, das Gesamttempo und den Charakter evolutionärer Veränderungen im LTEE zu überwachen, ist die Messung der Wettbewerbsfähigkeit von Populationen und Stämmen aus dem Experiment. Wir beschreiben, wie Co-Culture-Competition-Assays durchgeführt werden, und stellen sowohl eine Tabellenkalkulation als auch ein R-Paket (fitnessR) zur Verfügung, um die relative Fitness aus den Ergebnissen zu berechnen. Im Laufe der LTEE hat sich das Verhalten einiger Populationen auf interessante Weise verändert, und neue Technologien wie die Sequenzierung des gesamten Genoms haben zusätzliche Möglichkeiten zur Untersuchung der Entwicklung der Populationen eröffnet. Abschließend erörtern wir, wie die ursprünglichen LTEE-Verfahren aktualisiert wurden, um diese Änderungen zu berücksichtigen oder zu nutzen. Dieses Protokoll wird für Forscher nützlich sein, die das LTEE als Modellsystem verwenden, um Verbindungen zwischen Evolution und Genetik, Molekularbiologie, Systembiologie und Ökologie zu untersuchen. Im weiteren Sinne bietet das LTEE eine bewährte Vorlage für diejenigen, die ihre eigenen Evolutionsexperimente mit neuen Mikroben, Umgebungen und Fragen beginnen.
Einleitung
Im Februar 1988 inokulierte Richard Lenski an der University of California, Irvine 1, zwölf Flaschen, die ein definiertes glukosebegrenztes Wachstumsmedium enthielten, mit klonalen Kulturen von Escherichia coli 1. Am nächsten Tag übertrug er 1 % der Kultur aus jedem Kolben in einen Satz neuer Kolben mit frischem Nährmedium. Diese Verdünnung von 1:100 ermöglichte es den Bakterienpopulationen, sich um das 100-fache zu vermehren, bevor die verfügbare Glukose erschöpft war, was etwa 62/3 Generationen von Zellteilungen entspricht. Diese Prozedur wurde am nächsten Tag wiederholt und wird seitdem mit einigen Unterbrechungen jeden Tag wiederholt. Diese täglichen Transfers wurden auch nach der Verlagerung des Experiments fortgesetzt, zunächst an die Michigan State University im Jahr 1992 und dann an die University of Texas in Austin im Jahr 2022. Währenddessen haben neue Mutationen kontinuierlich zu genetischer Variation in diesen E. coli-Populationen geführt, und die natürliche Selektion hat dazu geführt, dass evolutionäre Zellen ihre Vorfahren verdrängt haben.
Lenski entwarf dieses Experiment, das heute als Long-Term Evolution Experiment (LTEE) bekannt ist, um die Dynamik und Wiederholbarkeit der Evolution zu untersuchen. Um diese Fragen zu beantworten, hat er einige wichtige Merkmale in das Design des Versuchsaufbaus und seiner Protokolle einbezogen2. Eines dieser Merkmale war die sorgfältige Auswahl eines Modellorganismus. Die ursprünglichen zwölf Populationen stammten alle aus einzelnen Kolonien, die einen gemeinsamen Vorfahren hatten, den Escherichia coli B-Stamm REL606. Dieser Stamm wurde ausgewählt, weil er bereits häufig in Laborumgebungen verwendet wurde, sich vollständig asexuell fortpflanzte und keine Plasmide oder intakte Prophagen enthielt 3,4 – all dies erleichtert die Untersuchung seiner Evolution. Eine weitere Möglichkeit, das Experiment zu vereinfachen, bestand darin, eine sehr niedrige Glukosekonzentration im Wachstumsmedium zu verwenden, um die Dichte der Zellen in jedem Kolben nach dem Wachstum zu begrenzen. Die Verwendung einer niedrigen Zelldichte sollte die Analyse von Veränderungen in der Populationsfitness erleichtern, indem das Potenzial für die Evolution ökologischer Interaktionen innerhalb von Populationen (z. B. durch Kreuzfütterung) verringert wurde5.
REL606 ist aufgrund einer Punktmutation im araA-Gen nicht in der Lage, ʟ-Arabinose als Kohlenstoff- und Energiequelle (Ara−) zu verwenden. Vor dem Start des LTEE wurde eine spontane Mutante mit einer wiederhergestellten araA-Sequenz, die als REL607 bezeichnet wurde, aus REL6066 isoliert. REL607 ist in der Lage, auf ʟ-Arabinose (Ara+) zu wachsen. REL606 wurde verwendet, um sechs der LTEE-Populationen zu starten, und REL607 wurde verwendet, um die anderen sechs zu starten. Arabinose ist in dem während der LTEE verwendeten Nährmedium nicht vorhanden, so dass sich REL607 unter diesen Bedingungen genauso verhält wie REL606. Wenn sie jedoch auf Tetrazolium arabinose (TA)-Agar plattiert werden, bilden Ara−- und Ara+-Zellen rote bzw. weiße Kolonien. Diese Methode zur Unterscheidung zwischen den beiden angestammten E. coli-Stämmen und ihren Nachkommen ist sehr nützlich. Es kann verwendet werden, um Kreuzkontaminationen zwischen LTEE-Populationen zu erkennen. Es hilft auch bei der Messung der Fitness eines Ara−-Stammes oder einer Population im Vergleich zu einem Ara+-Stamm, wenn sie gegeneinander antreten. Die Fitness wird gemessen, indem eine Kokultur von gegenläufig markierten Konkurrenten aufgebaut wird und dann beobachtet wird, wie sich die Frequenzen von roten und weißen Kolonien (die durch das Verteilen von Verdünnungen der Kultur auf TA-Platten erhalten werden) zwischen dem Zeitpunkt, an dem die Konkurrenten anfänglich gemischt werden, und nach einem oder mehreren Wachstumszyklen unter den gleichen Bedingungen wie das LTEE ändern. Die Repräsentation des fitteren Zelltyps nimmt mit jedem Wachstumszyklus zu.
Ein weiteres wichtiges Merkmal von LTEE ist, dass Proben der sich entwickelnden Populationen regelmäßig archiviert werden. Wenn sie mit einem Kryoprotektivum wie Glycerin gemischt werden, können E. coli-Zellen eingefroren und später wiederbelebt werden7. Im Rahmen des LTEE-Protokolls wird an jedem 75. Tag (was etwa 500 Generationen entspricht) ein Teil jeder Population, der nicht in einen neuen Kolben umgefüllt wurde, mit Glycerin vermischt, auf mehrere Fläschchen aufgeteilt und in einem Gefrierschrank gelagert. Dieser eingefrorene "Fossilienbestand" ermöglichte es den Forschern, die ersten Studien des LTEE durchzuführen, in denen sie die entwickelten E. coli-Populationen zu verschiedenen Zeitpunkten wiederbelebten und sie mit den angestammten Stämmen verglichen, um zu verfolgen, wie schnell die Fitness zunahm1. Die Fitness-Evolution wurde in regelmäßigen Abständen neu gemessen, da mehr "Schichten" des eingefrorenen "Fossilberichts" erhalten geblieben sind. Die allgemeine Schlussfolgerung aus diesen Messungen ist, dass sich die Fitness im LTEE bis heute weiter verbessert, selbst nach so vielen Generationen der Evolution in derselben Umgebung 8,9,10.
Was hat dazu geführt, dass LTEE so lange bestehen konnte? Viele der gleichen Funktionen, die es ermöglichten, die ursprünglichen Fragen zu stellen und zu beantworten, dienten auch als Sicherheitsmaßnahmen und Ausfallsicherungen gegen unvermeidliche Störungen aufgrund von Pech, menschlichem Versagen und Weltereignissen. Jeden Tag, wenn die Kulturen in frisches Nährmedium überführt werden, wechselt der Forscher, der die Transfers durchführt, zwischen Ara−- und Ara+-Populationen. Wenn die Populationen dann eingefroren sind, können sie auf selektivem Agar und Indikator-Agar plattiert werden, um zu überprüfen, ob "benachbarte" Populationen versehentlich kreuzkontaminiert oder verwechselt wurden (z. B. weiße Kolonien befinden sich in einer Population, die nur rote Kolonien bilden sollte) oder mit fremden Mikroben kontaminiert wurden (z. B. unerwartete Koloniemorphologien oder Zelldichten). Für den Fall, dass eine Population kompromittiert wurde, kann ihr Vorläufer aus dem Gefrierschrank wiederbelebt und an seiner Stelle weitergetragen werden. Die Ara-Marker und das gefrorene Archiv dienen somit sowohl als experimentelle Ressourcen als auch als Sicherheitsmaßnahmen.
Da seine Geschichte so gut erhalten und leicht zugänglich ist, wurden LTEE-Proben mit Technologien untersucht, die es zu Beginn des Experiments noch nicht gab. Zum Beispiel wurde die Sequenzierung des gesamten Genoms verwendet, um die Dynamik von Mutationen in den LTEE-Populationen 11,12,13,14,15 zu untersuchen, und Transkriptomik und ribosomales Profiling wurden verwendet, um Veränderungen in der Genexpression zu untersuchen 16,17. Genetische Werkzeuge wurden verwendet, um Stämme zu rekonstruieren, die sich durch einzelne Mutationen oder Kombinationen mehrerer entwickelter Mutationen unterscheiden, um ihre Auswirkungen auf die Fitness und verschiedene Phänotypen zu verstehen 18,19,20,21. Proben aus dem gefrorenen "Fossilbericht" können leicht wieder aufgefüllt werden, so dass Teile oder ganze Kopien der Experimentgeschichte an andere Labore geschickt werden können. LTEE-Proben gibt es mittlerweile auf allen Kontinenten außer der Antarktis, und sie werden von Forschern untersucht, die jünger sind als das Experiment selbst. Die robusten Methoden des LTEE und der entwickelten E. coli-Proben und -Stämme aus seinen historischen Aufzeichnungen dienten auch als Ausgangspunkt für Evolutionsexperimente, die andere Fragen und Umgebungen untersuchten 22,23,24,25,26,27,28,29.
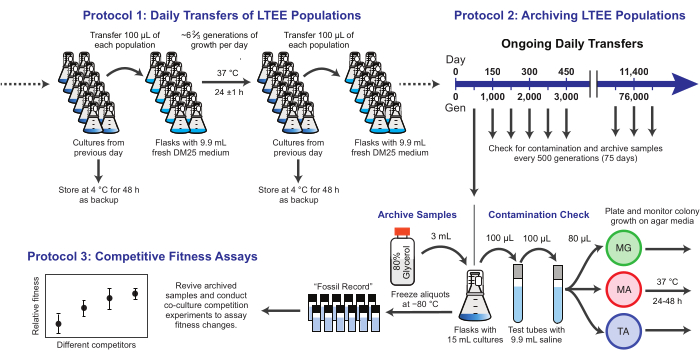
Abbildung 1: Überblick über die LTEE-Verfahren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Hier demonstrieren wir drei Kernprotokolle, die im E. coli Long-Term Evolution Experiment verwendet wurden (Abbildung 1). Wir beschreiben: (1) wie man die täglichen Transfers durchführt, (2) wie man Populationsproben und klonale Isolate archiviert, und (3) wie man Co-Culture-Konkurrenz-Assays durchführt und analysiert, um Fitnessunterschiede zu messen. Unsere Hoffnung ist, dass diese Protokolle die weitere Nutzung von LTEE-Ressourcen fördern und das Design neuer mikrobieller Evolutionsexperimente unterstützen.
Protokoll
1. Tägliche Übertragungen von LTEE-Populationen
HINWEIS: Die zwölf LTEE-Populationen werden täglich übertragen, indem frisches Medium mit 1 % der Kulturen aus den Kolben des Vortages geimpft wird. Die Schritte in diesem Prozess sind in Abbildung 1 zusammengefasst. Die sechs Ara− -Populationen, die aus dem Stamm REL606 hervorgegangen sind, werden mit A−1 bis A−6 bezeichnet, und die sechs Ara+- Populationen, die aus dem Stamm REL607 hervorgegangen sind, werden mit A+1 bis A+6 bezeichnet. Die strikte Einhaltung der aseptischen Technik und eines Zeitplans und einer Reihenfolge für den Transfer der Populationen minimiert das Risiko einer Kontamination und anderer Störungen.
- Desinfizieren Sie die Oberfläche, auf der die LTEE-Übertragungen durchgeführt werden, indem Sie sie entweder mit 70 % Ethanol oder einer 10 %igen Bleichlösung abwischen. Zünden Sie einen Bunsenbrenner an, um einen lokalen Aufwind zu erzeugen und das Abflammen von Glaswaren zu ermöglichen.
Anmerkungen: Tragen Sie Laborhandschuhe, um eine Kontamination zu vermeiden. Aus Sicherheitsgründen in der Nähe einer offenen Flamme ist es wichtig, nur Handschuhe zu verwenden, die aus einem Material wie Nitril bestehen, das nicht brennbar ist. - Bereiten Sie dreizehn 50-ml-Borosilikat-Erlenmeyerkolben vor, die mit 20-ml-Borosilikat- oder Polypropylen-Bechern verschlossen sind, die durch Autoklavieren gewaschen und sterilisiert wurden. Überprüfen Sie die Kolben auf sichtbaren Schmutz und ersetzen Sie diejenigen, die nicht perfekt sauber sind.
- Beschriften Sie sechs Kolben A−1 bis A−6 mit einem roten Marker und die anderen sechs Kolben A+1 bis A+6 mit einem schwarzen Marker. Beschriften Sie den letzten verbliebenen Kolben, der leer ist, mit dem Datum im Monats-/Tagesformat und dem Wochentag.
- Füllen Sie jeden der 13 Kolben mit einer sterilen serologischen 10-ml-Pipette mit 9,9 ml DM25-Medium. Entflammen Sie die Öffnung jedes Kolbens, nachdem Sie das als Deckel dienende Becherglas entfernt und das Becherglas wieder aufgesetzt haben. Entflammen Sie die Spitze der Pipette zwischen dem Befüllen der einzelnen Kolben.
HINWEIS: Eine Anleitung zur Herstellung von DM25 ist online verfügbar30. Wenn Sie eine serologische Kunststoffpipette verwenden, verzichten Sie auf das Abflammen der Spitze oder begrenzen Sie die Zeit in der Flamme, um ein Schmelzen des Kunststoffs zu vermeiden. - Nehmen Sie die LTEE-Kolben des Vortages aus dem Schüttel-Inkubator.
- Untersuchen Sie jeden Kolben, indem Sie ihn gegen das Licht halten, um seine Trübung und Farbe zu beurteilen, überprüfen Sie die Unversehrtheit des Kolbens und suchen Sie nach Fremdkörpern.
HINWEIS: Mit bloßem Auge sehen alle Ara−- und Ara+-Kulturen im Vergleich zum Rohling leicht trüb aus, mit Ausnahme von A−3, das aufgrund des Wachstums auf Citrat im Medium ~10-mal trüber ist als die anderen. Viele externe mikrobielle Verunreinigungen können auch auf Citrat wachsen, so dass eine erhöhte Trübung in anderen Populationen als A−3 wahrscheinlich auf eine Kontamination hinweist. Im Abschnitt "Repräsentative Ergebnisse" finden Sie Bilder der LTEE-Kulturen vor einer Übertragung. - OPTIONAL: Vergewissern Sie sich, dass jede LTEE-Kultur die erwartete Trübung aufweist, indem Sie 1 ml des Blindlings und 1 ml jeder Kultur in 1-cm-Kunststoffküvetten pipettieren und nach dem Ausblenden des Geräts optische Dichtemessungen bei 600 nm (OD600) mit einem Spektralphotometer durchführen.
HINWEIS: Dieser zusätzliche Schritt kann für Forscher nützlich sein, die neu in der Arbeit mit dem LTEE sind und sich nicht sicher sind, ob sie die Trübung mit dem Auge beurteilen können, sowie für die Dokumentation und Untersuchung vermuteter Anomalien. Proben zur Messung von OD600 aus den Kolben des Vortages erst nach Abschluss des normalen Transfers des Tages in neue Kolben (die folgenden Schritte) zu entnehmen, um das Risiko einer Kontamination der Zellpopulationen zu minimieren, die sich weiter vermehren, wenn die OD600-Werte den Erwartungen entsprechen. Im Abschnitt " Repräsentative Ergebnisse" finden Sie typische OD600-Werte für LTEE-Kulturen. - Übertragen Sie mit einer P200-Mikropipette mit steriler Filterspitze 100 μl Kultur aus jedem LTEE-Kolben in den entsprechenden Kolben mit frischem DM25. Beginnen Sie mit A−1 und übertragen Sie dann A+1. Danach wechseln Sie weiter zwischen den Populationen − und +. Um den Überblick zu behalten, welche Kulturen übertragen wurden, verschieben Sie die Kolben nach dem Pipettieren von oder zu ihnen nach links.
HINWEIS: Die strikte Reihenfolge der Transfers und der Wechsel zwischen Ara−- und Ara+-Populationen hilft bei der Vermeidung und Erkennung von Kreuzkontaminationen und Verwechslungen. Beachten Sie die strikte aseptische Technik: Verwenden Sie für jeden Transfer eine frische Pipettenspitze, entflammen Sie die Öffnungen der Kolben unmittelbar nach dem Öffnen und vor dem Umschließen und wischen Sie den Zylinder und den Auswerfer der Mikropipette mit einem fusselfreien Papiertuch ab, das zwischen jedem Transfer mit 70 % Ethanol angefeuchtet ist. Bleichmittel sollte niemals zur Desinfektion von Mikropipetten verwendet werden, da bereits Spuren die Kulturen abtöten können. - Inkubieren Sie die neu beimpften Kolben bei 37 °C für 24 ± 1 h unter Orbitalschütteln mit 120 U/min über einen Durchmesser von 1 Zoll.
- Lagern Sie die Kulturen des Vortages bei 4 °C. Bewahren Sie diese Sicherungskulturen zwei Tage lang auf. Entsorgen Sie ältere Kulturen, die drei Tage zuvor bei 4 °C gelagert wurden, zu diesem Zeitpunkt.
HINWEIS: Die Kulturen der letzten beiden Tage bieten zwei vollständige Backup-Sätze, mit denen das Experiment bei Bedarf neu gestartet werden kann, falls ein Problem oder ein Unfall auftritt oder wenn vor dem Transfer eine Kontamination der Kulturen des Vortages entdeckt wird (z. B. seltsame Färbung oder unerwartete Partikel). - Geben Sie die Uhrzeit, das Datum, die Transfernummer, den Namen oder die Initialen des Forschers, der die Transfers durchgeführt hat, ob die Kulturen in Ordnung waren oder nicht, und alle anderen relevanten Informationen in das Transferprotokoll-Notizbuch ein. Fahren Sie mit den Schritten 1.12 bis 1.14 fort, wenn eine der folgenden Situationen eintritt: (1) der Rohling vom Vortag ist kontaminiert, (2) ein Kolben oder sein Deckel ist gerissen oder zerbrochen, (3) ein Kolben enthält Fremdkörper, (4) ein Kolben wird während des Transfers umgekippt oder fallen gelassen oder (5) es gibt ein anderes Ereignis oder eine andere Beobachtung, die das Weiterfahren aus diesen Kolben fraglich macht.
- Wenn es Probleme, Unfälle oder den Verdacht einer Kontamination mit den LTEE-Kulturen des Vortages gibt, übertragen Sie nicht von diesen. Lagern Sie stattdessen den gesamten Satz von zwölf Kulturen bei 4 °C für eine spätere Untersuchung und weitere Charakterisierung.
- Entnehmen Sie die Kolben mit den Reservekulturen, die am Vortag übertragen und bei 4 °C gelagert wurden. Legen Sie sie auf die Tischplatte, um sie auf Raumtemperatur zu erwärmen. Schwenken Sie jeden Kolben vorsichtig, um die Zellen wieder zu suspendieren.
- Übertragen Sie die Reservekolben in den neuen Satz Kolben mit frischem Medium und setzen Sie den Versuch normal fort, wie in den Schritten 1.6-1.11 beschrieben. Vermerken Sie im Übertragungsprotokoll, dass die Sicherungskulturen verwendet wurden und notieren Sie die gleiche Übertragungsnummer wie am Vortag.
HINWEIS: Auch wenn ein Problem nur in der Flasche einer Population festgestellt wird, übertragen Sie alle zwölf Populationen aus den Reserveflaschen, so dass die Anzahl der Generationen, die in allen Populationen verstrichen sind, in Phase bleibt. Wenn in den bei 4 °C gelagerten Reserveflaschen eine Kontamination festgestellt wird, müssen die betroffenen LTEE-Populationen nach dem in den Schritten 3.1 bis 3.2 für Populationsproben beschriebenen Verfahren aus gefrorenen Beständen neu gestartet werden. Die Übertragungszahl für das LTEE sollte erst nach dem Wachstum der ersten Kulturen in DM25 nach der Wiederbelebung erhöht werden.
2. Archivierung der LTEE-Populationen
HINWEIS: Proben der LTEE-Populationen werden alle 75 Übertragungen eingefroren. Die Populationen wachsen nach der 100-fachen Transferverdünnung jeden Tag ~6 2/3 Generationen, so dass dieser Zeitraum ~500 Generationen entspricht. Während der Archivierung werden die LTEE-Populationen auch auf verschiedene Arten von Agarmedien plattiert, um sie auf Verunreinigungen zu überprüfen. Optional können repräsentative Klone aus diesen Platten ausgewählt und zu diesem Zeitpunkt archiviert werden. Diese Schritte sind in Abbildung 1 zusammengefasst.
- Bereiten Sie am Tag vor dem geplanten Einfrieren oder einige Tage vorher drei Arten von Agarplatten vor: Minimale Glukose (MG), minimale Arabinose (MA) und Tetrazolium-Arabinose (TA). Machen Sie zwölf Teller von jeder Art von Agar plus ein paar Extras. Bereiten Sie außerdem mindestens 250 ml sterile Kochsalzlösung mit 0,85 % (w/v) und 50 ml steriles Glycerin mit 80 % (v/v) vor.
HINWEIS: Rezepte für alle Medien und Lösungen sind online verfügbar30. Der Tag, bevor das LTEE eine Generation erreicht, die für den regulären Archivierungsplan ein Vielfaches von 500 ist, ist der 74. Tag seit dem letzten Freeze-Down zuzüglich etwaiger Tage, die aufgrund von Übertragungen aus den 4 °C-Backup-Kolben hinzukamen, als Probleme festgestellt oder vermutet wurden. - OPTIONAL: Wenn Sie klonale Isolate aus den LTEE-Populationen archivieren, bereiten Sie zusätzliche Vorräte vor: Für die Isolierung von drei Klonen aus jeder Population sind 72 MG-Platten, 80 ml 80% (v/v) Glycerin und 370 ml DM1000 erforderlich.
- Bereiten Sie einen zusätzlichen Satz von zwölf Kolben vor, wenn Sie Schritt 1.2 der täglichen LTEE-Übertragungen am Tag vor dem geplanten Einfrieren durchführen. Beschriften Sie sechs der zusätzlichen Kolben xA−1 bis xA−6 mit einem roten Marker und die anderen sechs xA+1 bis xA+6 mit einem schwarzen Marker.
HINWEIS: Das "x" zeigt an, dass der zusätzliche Satz von Kolben für die Archivierung verwendet wird, und unterscheidet sie von dem anderen Satz von Kolben, die verwendet werden, um die täglichen Übertragungen des LTEE parallel fortzusetzen. - Füllen Sie jeden der zusätzlichen Kolben, die für die Archivierung verwendet werden, mit 14,85 ml DM25 mit einer serologischen 25-ml-Pipette, wenn Sie Schritt 1.4 der täglichen LTEE-Übertragungen durchführen.
- Führen Sie die normale LTEE-Übertragung wie in den Schritten 1.5 bis 1.11 beschrieben durch. Wiederholen Sie dann die Anweisungen für Schritt 1.8, aber übertragen Sie diesmal 150 μl aus jeder LTEE-Kultur des Vortages in die zusätzlichen Kolben mit 14,85 ml frischem DM25, die für die Archivierung verwendet werden.
Anmerkungen: Vermeiden Sie in diesem und allen folgenden Schritten Verunreinigungen und Verwechslungen, indem Sie diese Richtlinien befolgen. Beginnen Sie mit der Grundgesamtheit A−1, übertragen Sie dann A+1 und fahren Sie dann abwechselnd mit den Grundgesamtheiten − und + fort. Wischen Sie den Zylinder und den Auswerfer der Mikropipette mit einem fusselfreien, mit 70%igem Ethanol angefeuchteten Papiertuch ab, wenn Sie die Population wechseln. Verschieben Sie Kolben und Reagenzgläser nach dem Pipettieren von oder zu ihnen in ihre Trays oder Racks, um den Überblick zu behalten, welche Transfers abgeschlossen wurden. - Inkubieren Sie den Satz von zwölf Kolben für die Archivierung bei 37 °C für 24 ± 1 h mit 120 U/min Orbitalschütteln über einen Durchmesser von 1 Zoll neben den zwölf LTEE-Kulturen und dem Leerling, wie in Schritt 1.9 beschrieben.
- Bereiten Sie die Vorräte für die Beschichtung der LTEE-Populationen mindestens eine Stunde vor der Durchführung der LTEE-Übertragungen am Tag des Einfrierens vor.
- Wählen Sie zwölf MG-, zwölf MA- und zwölf TA-Agarplatten aus. Untersuchen Sie jeden einzelnen visuell, um sicherzustellen, dass er keine offensichtliche Kontamination aufweist.
- Beschriften Sie für jede der zwölf LTEE-Populationen (A−1 bis A+6) jeweils eine Platte.
Anmerkungen: Wenn Sie Platten beschriften, schreiben Sie auf die Seiten des Bodens der Petrischale. Dies ist wichtig, um Kolonien nicht zu verdecken, wenn man sie von unterhalb des Agars untersuchen oder fotografieren möchte. Schreiben Sie nicht auf die Deckel, da diese verwechselt werden können. - Legen Sie die Agarplatten für mindestens 20 Minuten in einen 37 °C heißen Inkubator, um sie zu erwärmen, bevor Sie sie in Schritt 2.10 verwenden.
- Bereiten Sie 24 Reagenzgläser mit 9,9 ml Kochsalzlösung vor. Ordnen Sie sie in zwölf Sätzen zu je zwei Röhrchen an.
- Beschriften Sie jeden der beiden Sätze von zwölf Reagenzgläsern auf die gleiche Weise wie die Platten und fügen Sie eine "1" oder eine "2" unter der LTEE-Bevölkerungskennung hinzu, um die Reihenfolge anzugeben, in der sie für die Verdünnung dieser Population verwendet werden.
- Führen Sie die Schritte 1.1 bis 1.11 mit den Kolben aus, die die täglichen Übertragungen des LTEE wie gewohnt fortsetzen. In Schritt 1.5 entnehmen Sie auch die zwölf Kolben mit den zusätzlichen Kulturen für die Archivierung aus dem Schüttelinkubator.
- Pipettieren Sie 100 μl der Kultur aus jedem der zwölf zusätzlichen Kolben zur Archivierung in das erste Reagenzglas mit Kochsalzlösung im Paar für diese LTEE-Population. Vertexen Sie die Röhrchen mit diesen 100-fachen Verdünnungen gründlich. Pipettieren Sie dann jeweils 100 μl in das entsprechende zweite Röhrchen mit Kochsalzlösung. Die abschließenden 10.000-fachen Kulturverdünnungen gründlich vortexen.
- Pipettieren Sie 80 μl aus jedem der Röhrchen, die eine 10.000-fache Kulturverdünnung enthalten, auf die markierten TA-, MG- und MA-Platten für diese Population. Verteilen Sie die Flüssigkeit gleichmäßig auf der Oberfläche des Agar-Agars, je nach Belieben, entweder mit einem sterilen Spreizstab oder mit sterilen Spreizperlen. Wiederholen Sie den Vorgang, bis alle zwölf Populationen auf allen drei Arten von Medien plattiert wurden.
- Lassen Sie die Platten bei Bedarf trocknen, bis keine Flüssigkeit mehr auf dem Agar zu sehen ist. Legen Sie die Platten kopfüber (mit der Agarseite nach oben) in einen auf 37 °C eingestellten Schwerkraft-Konvektions-Inkubator.
Anmerkungen: Inkubationsplatten auf dem Kopf stehen vor dem Austrocknen des Agars und verhindern, dass Kondenswasser auf die Agaroberfläche tropft. Die Bewegung von Zellen in Flüssigkeit auf der Agaroberfläche während der Inkubation kann Kolonien verschmieren und zu falschen Koloniezahlen führen. - Fügen Sie 3 ml steriles 80%iges (v/v) Glycerin zu jedem der zwölf zusätzlichen Flaschen hinzu, die für die Archivierung vorgesehen sind. Gründlich mischen, indem Sie es schwenken und leicht wirbeln.
- Verteilen Sie das Gemisch aus jedem Kolben auf sterile Kryogefäße, die mit einer eindeutigen Kennung für die Probe, der LTEE-Population, zu der die Probe gehört, der Generation, in der sie eingefroren wurde, der Tatsache, dass es sich um eine gemischte (Populations-)Probe handelt, und dem Datum gekennzeichnet sind. Pipettieren Sie 6 ml in eine große Durchstechflasche und 1,25 ml in jede der sechs kleinen Durchstechflaschen.
Anmerkungen: Die große Durchstechflasche ist das Arbeitsmaterial. Ein kleines Fläschchen dient als Backup für den Fall, dass das Arbeitsmaterial erschöpft oder kontaminiert ist. Bei den anderen fünf kleinen Fläschchen handelt es sich um Kopien, die an andere Labore geschickt werden können. - Die gefüllten Durchstechflaschen bei −80 °C einfrieren.
- Untersuchen und dokumentieren Sie das Wachstum und die Morphologien von Kolonien auf den TA-, MG- und MA-Platten nach 24 h und 48 h Inkubation.
HINWEIS: Im Abschnitt "Repräsentative Ergebnisse " finden Sie Bilder und Beschreibungen von Kolonien, die von den Vorfahren REL606 und REL607 und jeder der zwölf LTEE-Populationen gebildet wurden, als sie mit 76.000 Generationen plattiert wurden. - OPTIONAL: Führen Sie bei der Archivierung klonaler Isolate die folgenden Schritte aus.
- Wählen Sie drei klonale Isolate (Kolonien) für jede LTEE-Population aus den MG-Platten aus, streifen Sie jedes einzeln auf eine neue MG-Platte und inkubieren Sie diese Platten für 16-24 h bei 37 °C.
HINWEIS: Wenn Kolonien mit unterschiedlichen Morphologien vorhanden sind, besteht die Standardpraxis im LTEE darin, Proben für maximale Vielfalt zu nehmen, indem zuerst der häufigste Typ ausgewählt und dann weitere Kolonien aus Minderheitentypen ausgewählt werden. Man kann auch eine Zufallsstichprobenstrategie anwenden, indem man Punkte auf der Unterseite des Bodens der Petrischale markiert, bevor man die Zellen ausbreitet, und dann nach dem Wachstum die isolierte Kolonie auswählt, die jeder Markierung am nächsten ist. - Am nächsten Tag wird von jeder Platte eine repräsentative Kolonie auf eine neue MG-Platte gestreift und diese Platten 16-24 h bei 37 °C inkubiert.
- Am nächsten Tag wird eine isolierte Kolonie von jeder MG-Platte in einen Kolben mit 10 ml frischem DM1000 geimpft. Füllen Sie außerdem einen zusätzlichen Kolben mit 10 ml DM1000, der als ungeimpfter Rohling dient, um auf Medienkontamination zu testen.
- Inkubieren Sie die Kolben bei 37 °C für 16-24 h mit 120 U/min Orbitalschütteln über einen Durchmesser von 1 Zoll.
- Nach der Inkubation werden 2 ml steriles 80%iges (v/v) Glycerin in jeden Kolben gegeben und zum Mischen geschwenkt.
- Verteilen Sie 1,25 ml Aliquots aus jedem Kolben in kleine, sterile Fläschchen, die mit einer eindeutigen Kennung für jeden Klon, seiner LTEE-Population und seiner Herkunftsgeneration, der Tatsache, dass es sich um eine klonale Probe handelt, und dem Datum gekennzeichnet sind.
- Die gefüllten Durchstechflaschen bei −80 °C einfrieren.
- Wählen Sie drei klonale Isolate (Kolonien) für jede LTEE-Population aus den MG-Platten aus, streifen Sie jedes einzeln auf eine neue MG-Platte und inkubieren Sie diese Platten für 16-24 h bei 37 °C.
3. Wettkampftauglichkeitstests
HINWEIS: Im LTEE wird die reproduktive Fitness anhand der relativen Anzahl der Verdopplungen quantifiziert, die verschiedene Bakterien über einen oder mehrere 24-Stunden-Kulturzyklen unter den gleichen Bedingungen wie die täglichen Transfers erreichen. Konkret ist die relative Fitness eines Konkurrenten zu einem anderen das Verhältnis ihrer realisierten Verdopplungsraten, wenn sie in einer Co-Kultur gegeneinander antreten. Jeder Konkurrent in einem Paar kann eine vollständige Population oder ein klonales Isolat sein, das zuvor als Teil des eingefrorenen "Fossilberichts" des LTEE archiviert wurde. Alternativ kann es sich bei einem oder beiden Konkurrenten um einen Klon handeln, der genetisch verändert wurde, um bestimmte Mutationen hinzuzufügen oder zu entfernen, um ihre Auswirkungen zu testen. Die beiden Konkurrenten müssen entgegengesetzte Ara+/Ara− -Zustände haben, da dieser genetische Marker verwendet wird, um sie während dieses Assays zu unterscheiden. Der gesamte Arbeitsablauf für einen Wettbewerbsassay ist in Abbildung 2 dargestellt. Die Dauer der Co-Kultivierungsphase kann von einem auf drei (oder mehr) Tage verlängert werden, um die Genauigkeit der Fitnessschätzungen zu verbessern, wenn auf Unterschiede zwischen Wettbewerbern getestet wird, die nahezu gleich sind. Siehe die Diskussion für weitere kritische Überlegungen und mögliche Änderungen dieses Protokolls.
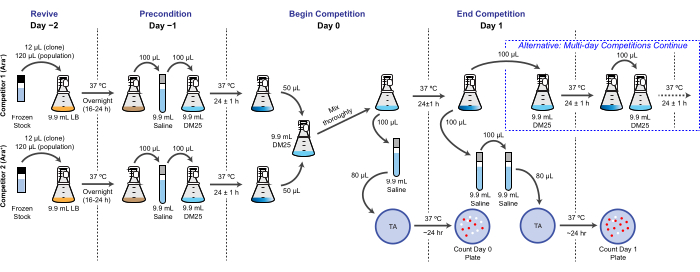
Abbildung 2: Flussdiagramm des Wettbewerbsassays. Das vollständige Verfahren für einen eintägigen Wettkampftest wird gezeigt. Das dreitägige Verfahren wird mit dem alternativen Weg an Tag 1 und Tag 2 fortgesetzt, bis an Tag 3 auf die gleiche Weise beschichtet wird, wie es für Tag 1 des eintägigen Wettbewerbs dargestellt ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Vorräte vorbereiten
- Entscheiden Sie, wie viele LTEE-Stämme und/oder -Populationen von Mitbewerbern verwendet werden sollen und wie viele Replikations-Wettbewerbsassays für jedes Mitbewerberpaar durchgeführt werden. Bereiten Sie die erforderlichen Vorräte vor, wie in den folgenden Schritten beschrieben.
HINWEIS: Rezepte für alle Medien und Lösungen sind online verfügbar30. Die für alle Tage eines Wettkampfversuchs benötigten Kolben und Reagenzgläser können im Voraus oder nach Bedarf an den Tagen, an denen sie verwendet werden, befüllt werden. Wenn Kolben und Reagenzgläser vorzeitig befüllt werden, lagern Sie sie bei Raumtemperatur im Dunkeln, um die Verdunstung zu minimieren. TA-Platten müssen mindestens zwei Tage vor der Verwendung vorbereitet werden, damit sie nach dem Gießen ausreichend trocknen können, um die Ausbreitung von Kulturverdünnungen zu ermöglichen. Bereiten Sie immer ein paar zusätzliche Flaschen, Reagenzgläser und TA-Platten vor, damit ein Experiment fortgesetzt werden kann, wenn es zu Pipettierfehlern, kontaminierten Platten oder anderen kleineren Missgeschicken kommt. - Füllen Sie für den Erweckungstag (Tag −2) einen sterilen 50-ml-Erlenmeyerkolben, der mit einem 20-ml-Becherglas verschlossen ist, mit 9,9 ml DM1000 oder Lysogeniebrühe (LB) pro Stamm oder Population von E. coli , die als Konkurrent verwendet wird. Füllen Sie einen weiteren Kolben mit 9,9 ml desselben Mediums, um als ungeimpfter Rohling zu dienen.
- Füllen Sie für den Vorkonditionierungstag (Tag −1) ein Reagenzglas mit 9,9 ml steriler Kochsalzlösung von 0,85 % (w/v) pro Wettbewerber, zwei Kolben mit 9,9 ml DM25 pro Wiederholungsassay zwischen zwei Wettbewerbern und einen weiteren Kolben mit 9,9 ml DM25 für einen Leerling.
- Füllen Sie für den Tag, an dem der Wettbewerb beginnt (Tag 0), einen Kolben mit 9,9 ml DM25, füllen Sie ein Reagenzglas mit 9,9 ml steriler Kochsalzlösung von 0,85 % (w/v) und bereiten Sie eine TA-Platte pro Wiederholung des Wettbewerbsassays vor. Füllen Sie einen weiteren Kolben mit 9,9 ml DM25, um als Rohling zu dienen.
- ALTERNATIVE: Füllen Sie für jeden Tag eines mehrtägigen Wettbewerbs nach dem ersten einen Kolben mit 9,9 ml DM25 pro Wettbewerbsreplikat und füllen Sie einen weiteren Kolben mit 9,9 ml DM25 für einen Rohling.
- Füllen Sie für den letzten Tag des Wettbewerbs (z. B . Tag 1 oder Tag 3) zwei Reagenzgläser mit 9,9 ml steriler Kochsalzlösung von 0,85 % (w/v) und bereiten Sie eine TA-Platte pro Wettbewerbsreplikat vor.
- Entscheiden Sie, wie viele LTEE-Stämme und/oder -Populationen von Mitbewerbern verwendet werden sollen und wie viele Replikations-Wettbewerbsassays für jedes Mitbewerberpaar durchgeführt werden. Bereiten Sie die erforderlichen Vorräte vor, wie in den folgenden Schritten beschrieben.
- Tag −2: Wiederbelebung der Teilnehmer separat in DM1000 oder LB
- Beschriften Sie für jeden Teilnehmer einen Kolben mit 9,9 ml DM1000 oder LB. Beschriften Sie einen zusätzlichen Kolben mit 9,9 ml aus derselben Charge des Mediums, der als ungeimpfter Rohling dient, um auf Verunreinigungen zu testen.
HINWEIS: Gefrorene Bestände werden in LB oder DM1000 wiederbelebt, um eine gleichmäßigere und vorhersehbarere Rückgewinnung von kryokonservierten Zellen zu erzielen. Das als Kryoprotektivum verwendete Glycerin kann von E. coli verstoffwechselt werden, was zu höheren Zelldichten führt als erwartet, wenn Proben in DM25 wiederbelebt werden. LB und DM1000 unterstützen das Wachstum auf so hohe Zelldichten, dass diese Komplikation vernachlässigbar wird. - Nehmen Sie die Kryogefäße, die die gefrorenen Bestände der Konkurrenzstämme enthalten, aus dem Gefrierschrank von −80 °C. Bewahren Sie die Durchstechflaschen während der Verwendung gekühlt in einem Eiskübel auf.
- Nachdem jede gefrorene Brühe aufgetaut ist, wirbeln Sie sie gründlich vor, um die E. coli-Zellen zu resuspendieren. Wenn Sie einen Klon wiederbeleben, beimpfen Sie den Kolben mit frischem Medium mit 12 μl der gefrorenen Brühe. Wenn eine Population wiederbelebt wird, beimpfen Sie den Kolben mit 120 μl der gefrorenen Brühe.
HINWEIS: Das Volumen von 120 μl des gefrorenen Bestandes wird für Populationen verwendet, so dass die Anzahl der wiederbelebten Zellen ungefähr dem täglichen Engpass entspricht, wenn 1 % der LTEE-Population in einen neuen Kolben übertragen wird. Das mehrmalige Auftauen und Verwirbeln von gefrorenen Beständen kann die Zellen belasten und die Lebensfähigkeit der Bestände. Wenn eine bestimmte LTEE-Population oder ein bestimmter Klon mehrmals in Wettbewerben verwendet wird, empfiehlt es sich, mehrere Kopien des Bestands nachzuwachsen und einzufrieren, damit keine einzelne mehrmals aufgetaut und wieder eingefroren wird. - Inkubieren Sie die Wiederbelebungskolben und den Rohling bei 37 °C über Nacht (16-24 h) mit 120 U/min Orbitalschütteln über einen Durchmesser von 1 Zoll.
- Beschriften Sie für jeden Teilnehmer einen Kolben mit 9,9 ml DM1000 oder LB. Beschriften Sie einen zusätzlichen Kolben mit 9,9 ml aus derselben Charge des Mediums, der als ungeimpfter Rohling dient, um auf Verunreinigungen zu testen.
- Tag −1: Teilnehmer separat in DM25 vorkonditionieren
- Beschriften Sie für jeden Teilnehmer ein Reagenzglas mit 9,9 ml Kochsalzlösung. Beschriften Sie für jeden Wiederholungswettbewerbstest zwischen zwei Wettbewerbern zwei 50-ml-Kolben mit 9,9 ml DM25, die jeweils mit der Replikatnummer und dem Namen eines der Wettbewerber gefüllt sind. Beschriften Sie einen zusätzlichen Kolben, der mit 9,9 ml DM25 gefüllt ist, um als Leerling zu dienen.
- Nehmen Sie die Fläschchen mit den Kulturen wiederbelebter Konkurrenten aus dem Inkubator. Untersuchen Sie ihre Trübung mit dem Auge, um sicherzustellen, dass sie gewachsen sind und dass keine offensichtliche Kontamination vorliegt.
- Pipettieren Sie 100 μl aus jedem Kolben in das Reagenzglas mit Kochsalzlösung für diesen Wettbewerber.
HINWEIS: In diesem Schritt wird die Kultur um das 100-fache verdünnt, was notwendig ist, da die Zelldichte in LB und DM1000 viel höher ist als in der DM25-Umgebung, die im LTEE verwendet wird (siehe Repräsentative Ergebnisse). - Jedes Verdünnungsröhrchen vor dem Pipettieren von 100 μl aus der verdünnten Kultur in einen Kolben mit frischem DM25 gründlich vortexen. Impfen Sie zwei dieser Vorkonditionierungskolben für jeden Replikatassay, einen für jeden der Wettbewerber.
- Inkubieren Sie die Vorkonditionierungskolben und den Rohling bei 37 °C für 24 ± 1 h unter Orbitalschütteln mit 120 U/min über einen Durchmesser von 1 Zoll.
- Tag 0: Beginnen Sie den Wettbewerb, indem Sie die Teilnehmer mischen und für die ersten Zählungen anbringen
- Beschriften Sie für jede Competition Assay-Replik einen Kolben mit 9,9 ml DM25 und ein Reagenzglas mit 9,9 ml Kochsalzlösung. Beschriften Sie die Kolben und Röhrchen so, dass jedes Teilnehmerpaar und die Wiederholungsnummer des Wettbewerbsassays eindeutig identifiziert werden können. Beschriften Sie einen zusätzlichen Kolben, der mit 9,9 ml DM25 gefüllt ist, um als Leerling zu dienen.
- Nehmen Sie die Vorkonditionierungsflaschen aus dem Inkubator. Untersuchen Sie ihre Trübung mit dem Auge, um sicherzustellen, dass sie gewachsen sind und dass keine offensichtliche Kontamination vorliegt.
- 50 μl des Ara− -Konkurrenten werden in den ersten mit frischem DM25 gefüllten Replikationskolben überführt. Geben Sie sofort 50 μl des Ara+ Konkurrenten in denselben Wettkampfkolben und mischen Sie ihn durch leichtes Schwenken.
- Wiederholen Sie Schritt 3.4.3 für alle Replikate aller Mitbewerberpaare.
HINWEIS: Die Wettkampfflaschen haben jetzt eine insgesamt 100-fache Verdünnung von E. coli-Kulturen, die in DM25 gezüchtet wurden, den gleichen Zustand Zellen in der LTEE-Erfahrung nach jeder täglichen Übertragung. Die Reihenfolge der Transfers und des Mischens ist wichtig. Geben Sie beide Konkurrenten sofort nacheinander in jede Flasche, damit keiner von ihnen einen Vorsprung im frischen Medium hat. Füge zum Beispiel nicht die Ara−-Kulturen zu allen Wettkampfflaschen hinzu und gehe dann zurück und füge alle Ara+-Stämme hinzu. - Pipettieren Sie 100 μl aus jedem neu inokulierten Wettkampfkolben in das Reagenzglas mit Kochsalzlösung, das für diesen Wettbewerbsassay markiert ist, so dass jedes dieser Röhrchen eine insgesamt 10.000-fache Verdünnung der vorkonditionierten DM25-Kulturen enthält, die kombiniert wurden.
- Legen Sie die Wettkampfkolben und den Rohling in den Schüttelinkubator. Inkubieren Sie die Wettkampfkolben bei 37 °C für 24 ± 1 h mit 120 U/min Orbitalschütteln über einen Durchmesser von 1 Zoll.
- Am selben Tag, unmittelbar nach dem Einsetzen der Wettkampfkolben in den Inkubator, wird jedes Reagenzglas aus Schritt 3.4.5 gründlich gewirbelt und 80 μl dieser 10.000-fachen Verdünnungen wie in Schritt 2.10 beschrieben auf TA-Platten verteilt. Beschriften Sie die Seite des Bodens jeder Platte mit dem gemischten Sortenpaar, der Wiederholungsnummer und "Tag 0", um anzuzeigen, dass es verwendet wird, um die anfängliche Repräsentation jedes Teilnehmers zu bestimmen.
- Inkubieren Sie die TA-Platten kopfüber in einem Schwerkraft-Konvektions-Inkubator bei 37 °C, bis die Kolonien der Ara−- und Ara+-Konkurrenten sichtbar und unterscheidbar sind. Im Allgemeinen geschieht dies innerhalb von 16-24 Stunden, aber bei einigen entwickelten Stämmen kann es länger dauern. Zählen Sie die Anzahl der Ara− (rot) und Ara+ (weiß) Kolonien auf jeder Platte undnotieren Sie die Ergebnisse.
HINWEIS: Die Unterschiede zwischen den Farben von Ara- und Ara+-Kolonien auf TA-Platten werden mit der Zeit weniger deutlich, selbst wenn die Platten bei 4 °C gelagert werden, so dass sie nach der Entnahme aus dem Inkubator so schnell wie möglich gezählt werden müssen. Bilder von TA-Platten, die das typische Erscheinungsbild von Kolonien zeigen, die von Ara−- und Ara+-Zellen gebildet werden, sind in den repräsentativen Ergebnissen enthalten. Dieser Abschnitt enthält auch Bilder von häufigen "Grenzfall"-Kolonien (z. B. Überlappung oder Auswuchs verschiedener Kolonietypen) und erklärt, wie man sie zählt. Wenn die Wachstumsraten und Morphologien von Kolonien, die von einem der Wettbewerber auf TA-Platten gebildet wurden, bisher nicht charakterisiert wurden, verteilen Sie 80 μl einer 10.000-fachen Verdünnung in Kochsalzlösung aus den Vorkonditionierungskolben an Tag 0, wenn die Wettbewerber noch voneinander getrennt sind. Untersuchen Sie dann die Kolonien auf diesen Kontrollplatten nach der Inkubation bei 37 °C für 16-24 h oder länger.
- ALTERNATIVE: Tag 1 und 2: Fortsetzung des dreitägigen Wettbewerbs
- Beschriften Sie für jede Competition Assay-Replikate einen Kolben mit 9,9 ml DM25. Beschriften Sie die Kolben so, dass jedes Teilnehmerpaar, die Wiederholungsnummer und der Tag des Wettbewerbstests eindeutig identifiziert werden können. Beschriften Sie einen zusätzlichen Kolben, der mit 9,9 ml DM25 gefüllt ist, um als Leerling zu dienen.
- Nehmen Sie die Wettkampfflaschen vom Vortag aus dem Brutkasten. Untersuchen Sie ihre Trübung mit dem Auge, um das erwartete Wachstum zu überprüfen und Verunreinigungen zu erkennen.
- Übertragen Sie 100 μl aus jedem Wettkampfkolben in den entsprechenden Kolben mit frischem Medium für den nächsten Wettkampftag.
- Legen Sie die neuen Wettkampfflaschen und den Rohling in den Schüttelbrutkasten. Inkubieren Sie sie bei 37 °C für 24 ± 1 h mit 120 U/min Orbitalschütteln über einen Durchmesser von 1 Zoll.
- Wiederholen Sie die Schritte 3.5.1-3.5.4 an Tag 2 des Wettbewerbs, bevor Sie fortfahren.
- Tag 1 oder 3: Beenden Sie den Wettbewerb und stellen Sie sich die endgültige Zählung vor
- Bereiten Sie für jeden Wettkampfkolben zwei Reagenzgläser vor, die mit 9,9 ml Kochsalzlösung gefüllt sind. Beschriften Sie sie so, dass jedes Paar von Wettbewerbern, die Replikatnummer und ob sie für die erste oder zweite Verdünnung bestimmt sind, eindeutig identifiziert werden kann.
- Nehmen Sie die Wettkampfflaschen aus dem Brutkasten. Untersuchen Sie ihre Trübung mit dem Auge, um festzustellen, dass sie gewachsen sind und keine offensichtliche Kontamination vorliegt.
- Pipettieren Sie 100 μl aus jedem Wettkampfkolben in das erste Röhrchen mit Kochsalzlösung für dieses Replikat. Die resultierenden Röhrchen enthalten 100-fache Verdünnungen der DM25-Kulturen.
- Wirbeln Sie jedes 100-fache Verdünnungsröhrchen vor, um es gründlich zu mischen, und pipettieren Sie 100 μl in das zweite Röhrchen Kochsalzlösung für dieses Replikat. Die resultierenden Röhrchen enthalten 10.000-fache Verdünnungen der DM25-Kulturen.
- Jedes Reagenzglas mit einer 10.000-fachen Verdünnung wird gründlich vorgetext und 80 μl davon auf einer TA-Platte verteilt, wie in Schritt 2.10 beschrieben. Beschriften Sie die Seite des Bodens jeder Platte mit dem gemischten Sortenpaar, der Wiederholungsnummer und "Tag 1" für einen eintägigen Wettbewerb oder "Tag 3" für einen dreitägigen Wettbewerb, um anzuzeigen, dass es verwendet wird, um die endgültige Darstellung jedes Teilnehmers zu bestimmen.
- Inkubieren Sie die TA-Platten bei 37 °C und zählen Sie die Ara−- und Ara+ -Kolonien nach dem Wachstum, wie in Schritt 3.4.8 beschrieben.
HINWEIS: Behalten Sie die Wiederholungszahl jedes Wettbewerbsassays während aller Transfer- und Beschichtungsschritte im Auge. Wenn Sie verwechseln, welche endgültigen und anfänglichen Zählungen zwischen verschiedenen Replikatassays übereinstimmen – selbst wenn dieselben beiden Wettbewerber jeweils gemischt wurden – führt dies zu falschen Fitnessschätzungen.
- Berechnung und Plottauglichkeit
- Wenn Sie Excel zum Berechnen und Zeichnen der relativen Fitness verwenden, laden Sie die XLS-Tabelle (Ergänzungsdatei 1) herunter. Wenn Sie R verwenden, installieren Sie das fitnessR-Paket31 und laden Sie die CSV-Vorlage (Supplemental File 2) herunter, oder generieren Sie eine neue Kopie dieser Datei, indem Sie den Anweisungen in der Vignette folgen.
- Geben Sie eine "Transferverdünnung" von 100 für die Wettbewerbstests ein, die in der dafür vorgesehenen Zelle oder Spalte in der heruntergeladenen Datei durchgeführt wurden. Geben Sie die Gesamtzahl der täglichen Wachstumszyklen, in denen die Teilnehmer kokultiviert wurden, als "Anzahl der Transfers" ein (z. B. 3 für einen dreitägigen Wettbewerb).
- Geben Sie die Namen der einzelnen Wettbewerberpaare in die dafür vorgesehenen Zellen oder Spalten ein, wobei der Referenzstamm als "Wettbewerber1" und der Teststamm oder die Testpopulation als "Wettbewerber2" bezeichnet wird.
- Geben Sie für jede Wiederholung des Wettbewerbsassays die jeweilige anfängliche und endgültige Anzahl der Kolonien in die dafür vorgesehenen Spalten der heruntergeladenen Datei ein.
- Wenn Sie die Excel-Tabelle verwenden, werden jetzt der mittlere relative Fitnesswert und die 95%-Konfidenzgrenzen für diesen Schätzwert angezeigt. Kopieren Sie die Ergebnisse für verschiedene Kombinationen von Mitbewerbern in ein anderes Blatt und erstellen Sie ein Diagramm, das die Ergebnisse zusammenfasst. Wenn Sie R zum Analysieren der Daten verwenden, befolgen Sie die Anweisungen in der Vignette für das fitnessR-Paket, um diese Berechnungen durchzuführen, eine CSV-Datei mit den berechneten Werten auszugeben und die Ergebnisse darzustellen.
Ergebnisse
Aussehen und Trübung von LTEE-Kulturen
Aufgrund der niedrigen Glukosekonzentration in DM25 ist die Trübung ausgewachsener LTEE-Populationen nur in elf der zwölf Kolben kaum sichtbar. Bei der Untersuchung der LTEE-Kulturen mit dem Auge auf normales Wachstum und Anzeichen einer Kontamination (Schritt 1.6) sollte jeder Kolben, der eine LTEE-Population enthält, Seite an Seite mit dem Rohling verglichen werden (Abbildung 3A). Eine Ausnahme bildet die Population A−3, die sich entwickelt hat, um Citrat als zusätzliche Kohlenstoff- und Energiequelle zu nutzen und daher eine höhere Zelldichte erreicht32. Die Trübung der DM25-Kulturen der Vorläuferstämme REL606 und REL607 ähnelt der einer typischen evolutionären Population (Abbildung 3B). LTEE-Stämme und -Populationen wachsen in DM1000 aufgrund der höheren Glukosekonzentration zu einer höheren Dichte und in LB zu einer viel höheren Dichte (Abbildung 3B). Die Dichte der DM25-Kulturen der A−3 LTEE-Population liegt zwischen den Dichten der Kulturen von REL606 in DM25 und DM1000 (Abbildung 3C).

Abbildung 3: Erscheinungsbild von LTEE-Kulturen. (A) Kolben mit den zwölf LTEE-Populationen nach 24 h Wachstum in DM25 an dem Tag, an dem das Experiment 76.253 1/3 Generationen erreichte, sind neben dem Leerzeichen abgebildet. (B) Kolben mit Kulturen der Vorfahren REL606 und REL607, die 24 Stunden lang in DM25, DM1000 und LB gezüchtet wurden, sind neben Rohlingen abgebildet. (C) Vergrößerte Bilder derselben Kolben nebeneinander, die zeigen, wie sich die Trübung des A−3-Populationskolbens in DM25 im Vergleich zum REL606-Vorläufer in DM25 und DM1000 verhält. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Die Spektralphotometermessungen der optischen Dichten bei 600 nm (OD600) von Kulturen, die in DM25 (Schritt 1.7) gezüchtet wurden, stimmen mit diesen visuellen Beobachtungen sowohl für die LTEE-Populationen (Abbildung 4A) als auch für ihre Vorfahren (Abbildung 4B) überein. Diese Messwerte können verwendet werden, um das Wachstum quantitativ zu vergleichen und zu dokumentieren, wenn eine Kontamination oder ein Fehler vermutet wird. Für Messungen der LTEE-Populationen zwischen 76.000 und 76.500 Generationen fanden wir heraus, dass der OD600 von A−3, der Population, die sich entwickelt hat, um mit Citrat zu wachsen, im Durchschnitt 0,223 betrug (0,218-0,227, 95%-Konfidenzintervall). Die OD600 der anderen elf Populationen betrug im Durchschnitt 0,0252 (0,0239-0,0265, 95%-Konfidenzintervall). Es gab leichte, aber signifikante Unterschiede in den OD600-Messwerten zwischen den elf Normalpopulationen (F 10,88 = 5,1035, p = 7,5×10−6). Die LTEE-Populationen erreichen nach etwa 5-6 Stunden Inkubationszeit die stationäre Phase. Wenn sie am Morgen übertragen werden, ist das Wachstum am mittleren bis späten Nachmittag desselben Tages sichtbar. Viele Arten von Mikroben sind in der Lage, aerob auf Citrat zu wachsen. Daher ist eine erhöhte Trübung in anderen Populationen als A−3 wahrscheinlich ein Zeichen für eine Kontamination von außen.
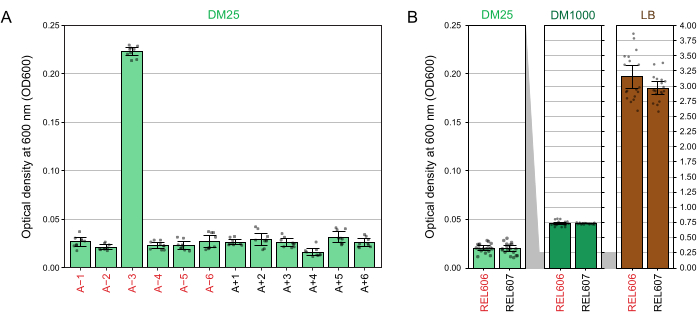
Abbildung 4: Trübung von LTEE-Kulturen. (A) Optische Dichte bei 600 nm (OD600) der zwölf LTEE-Populationen nach dem 24-stündigen Wachstumszyklus an drei verschiedenen Tagen zwischen 76.000 und 76.500 Generationen des Experiments. Die OD600-Werte von drei 1-ml-Aliquoten an jedem der drei verschiedenen Tage werden als Punkte aufgetragen. Von diesen Werten wurde der mittlere OD600-Wert von drei verschiedenen Aliquoten des Leerraums vom selben Tag subtrahiert. Gefüllte Balken zeigen Durchschnittswerte an. Fehlerindikatoren sind 95%-Konfidenzgrenzen. (B) OD600 von Kulturen der Vorfahren REL606 und REL607 in DM25, DM1000 und LB. Die OD600-Werte von drei 1-ml-Aliquoten an drei verschiedenen Tagen von zwei separaten Kulturen für jede Erkrankung und jeden Stamm werden als Punkte dargestellt. Von diesen Werten wurde der mittlere OD600-Wert von drei verschiedenen Aliquoten des Leerraums vom selben Tag subtrahiert. Gefüllte Balken zeigen Durchschnittswerte und Fehlerbalken sind 95%-Konfidenzgrenzen. Grau schattierte Bereiche zwischen den Bedienfeldern zeigen, wie die OD600-Achse zwischen dem DM25-Bedienfeld und den DM1000- und LB-Bedienfeldern neu skaliert wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Wachstum und Morphologie von LTEE-Kolonien
Bei der Überprüfung der Populationen auf Kontamination durch Plattierung auf verschiedenen Medien (Schritt 2.15) bilden die Vorfahren von REL606 und REL607 und alle evolutionären Populationen weiße Kolonien mit durchscheinenden und etwas unregelmäßigen Rändern auf Minimalglukose (MG)-Agarplatten (Abbildung 5A). Die Zusammensetzung des MG-Agars ist die gleiche wie die des DM25, das bei den täglichen LTEE-Übertragungen verwendet wird, nur mit einer höheren Glukosekonzentration, so dass die entwickelten LTEE-Populationen oft größere Kolonien auf MG bilden als die Vorfahren. Aufgrund der höheren Zelldichte in DM25 wird die A−3-Population bei gleichem Volumen wie bei den anderen Populationen um ein Vielfaches mehr Kolonien haben, was die Größe der Kolonien einschränken kann. Die häufigsten Arten von kontaminierenden Mikroben bilden auf MG strahlend weiße, undurchsichtige und perfekt kreisförmige Kolonien.
Auf minimalem Arabinose (MA)-Agar bilden der REL607-Vorfahre und die Ara+- Populationen typischerweise alle leicht durchscheinende weiße Kolonien. Dieses typische Wachstumsmuster hat sich für die Ara+- Populationen über 76.000 Generationen hinweg erhalten, mit Ausnahme von A+6, das einen Wachstumsdefekt auf Arabinose entwickelt hat und auf MA keine Kolonien mehr bildet (Abbildung 5B). Es gibt keine Selektion, um das Wachstum auf Arabinose während der LTEE-Übertragungen in DM25 aufrechtzuerhalten, so dass auch andere Ara+- Populationen im Laufe des Experiments aufhören könnten, Kolonien auf MA-Agarplatten zu bilden. Mit Ausnahme von A−3 bilden die Ara−-Populationen keine Kolonien auf MA-Agar , obwohl eine genaue Untersuchung Mikrokolonien aufgrund von Spurennährstoffen im Agar aufdecken kann. Die A−3-Population bildet auf MA zahlreiche kleine Kolonien, da diese Zellen auf dem Citrat wachsen können, das auch in diesem Medium vorhanden ist. Schadstoffkolonien auf MA sind selten.
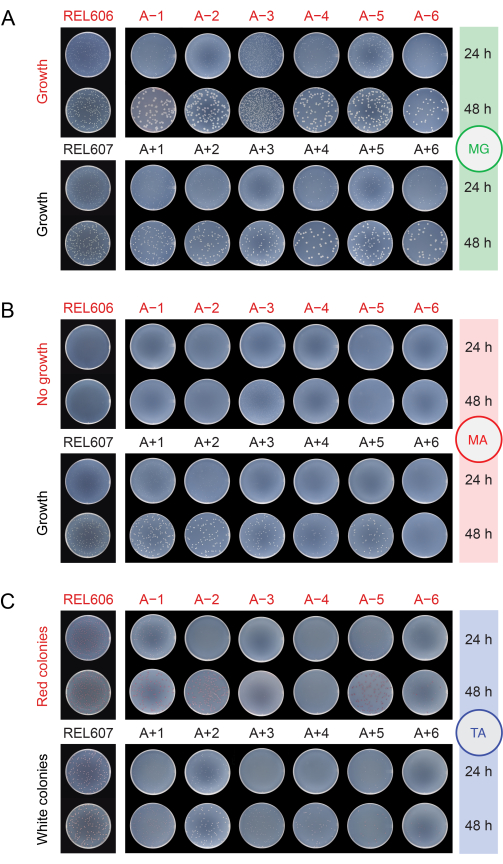
Abbildung 5: Plattierung von LTEE-Populationen zur Erkennung von Kontaminationen. Verdünnungen der REL606- und REL607-Vorfahren und der zwölf LTEE-Populationen an dem Tag, an dem das Experiment 76.026 2/3 Generationen erreichte, wurden auf (A) MG-, (B) MA- und (C) TA-Agarplatten plattiert und nach 24 h und 48 h fotografiert. Für alle Kulturen wurden die gleichen Verdünnungen vorgenommen, aber für die Vorfahren wurde halb so viel Volumen aufgewendet, wie im Protokoll für die LTEE-Populationen beschrieben ist, um ihre höheren Zelldichten etwas zu berücksichtigen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Auf Tetrazolium arabinose (TA)-Agar wird erwartet, dass der REL606-Vorfahre und alle Ara−-Populationen rote Kolonien bilden, während der REL607-Vorfahre und alle Ara+-Populationen im Allgemeinen weiße Kolonien bilden sollten (die hellrosa oder pfirsichfarbene Farbtöne enthalten können) (Abbildung 5C). Die LTEE-Vorfahren bilden robuste Kolonien, die innerhalb von 16-24 Stunden leicht als Ara− und Ara+ auf TA-Agar identifiziert werden können. Ursprünglich konnte dieser Unterschied genutzt werden, um Kreuzkontaminationen zwischen Ara−- und Ara+-Populationen nachzuweisen. TA-Agar hat jedoch eine komplexere Nährstoffzusammensetzung als das chemisch definierte DM25-Medium, das für die täglichen Transfers verwendet wird, und es gab keinen evolutionären Druck für E. coli im LTEE, unter diesen Bedingungen robust zu wachsen. Infolgedessen zeigen einige entwickelte LTEE-Populationen jetzt ein schlechtes Wachstum auf TA-Platten, es dauert 48 Stunden, um Kolonien zu bilden, oder sie wachsen überhaupt nicht zuverlässig. Die Farben und Morphologien der Kolonien, die von den evolutionären LTEE-Populationen auf TA gebildet wurden, haben sich ebenfalls im Vergleich zu den Vorfahren verändert und voneinander abgewichen. Das Vorhandensein einiger abweichender Kolonien ist nicht immer ein Hinweis auf eine Kontamination. Es können spontane Mutationen auftreten, die den Ara-Marker-Zustand von LTEE-Stämmen verändern, insbesondere von Ara+ zu Ara−, da die Wahrscheinlichkeit von Funktionsverlustmutationen, die die Arabinosennutzung beeinträchtigen, höher ist als bei Reversionsmutationen, die die araA-Aktivität wiederherstellen. Mutationen, die Ara-Markerzustände wechseln, treten häufiger in Populationen auf, die eine Hypermutation entwickelt haben (A−1, A−2, A−3, A−4, A+3 und A+6)13. Auf TA-Agar bilden kontaminierende Mikroben anderer Arten oft (aber nicht immer) kleine, perfekt kreisförmige Kolonien mit roten Zentren, die von deutlichen weißen Grenzen umgeben sind, die sich von denen unterscheiden, die von LTEE-Stämmen oder -Populationen gebildet werden.
Ergebnisse des Co-Culture-Wettbewerbs
Wettbewerbe zwischen allen Ara−- und Ara+-Paaren der beiden LTEE-Vorfahren (REL606 bzw. REL607) und den bei 20.000 Generationen archivierten A−5- und A+5-Populationsproben (REL8597 bzw. REL8604) zeigen, wie Kolonien mit unterschiedlichen Ara-Markerzuständen differenziert und auf TA-Agar gezählt werden können (Schritte 3.4.8 und 3.6.6) (Abbildung 6). Die Kolonien wurden vor und nach ein- und dreitägigen Assays, die mit der Wiederbelebung in DM1000 begannen, für sechs Replikatkolben für jedes Paar von Wettbewerbern gezählt (Tabelle 1). Die Gesamtzahl der Kolonien, die bei gleicher Verdünnung und gleichem Volumen beobachtet wurden, variiert, mit welchen Konkurrenten sie gemischt wurden, da Kulturen von entwickelten LTEE-Populationen niedrigere Zelldichten erreichen als Kulturen der Vorläuferstämme in DM25. Dieser Unterschied ist eine Folge der Evolution der zunehmenden Zellgröße, die in allen LTEE-Populationen während der ersten paar tausend Generationen des Experiments auftrat 8,33.
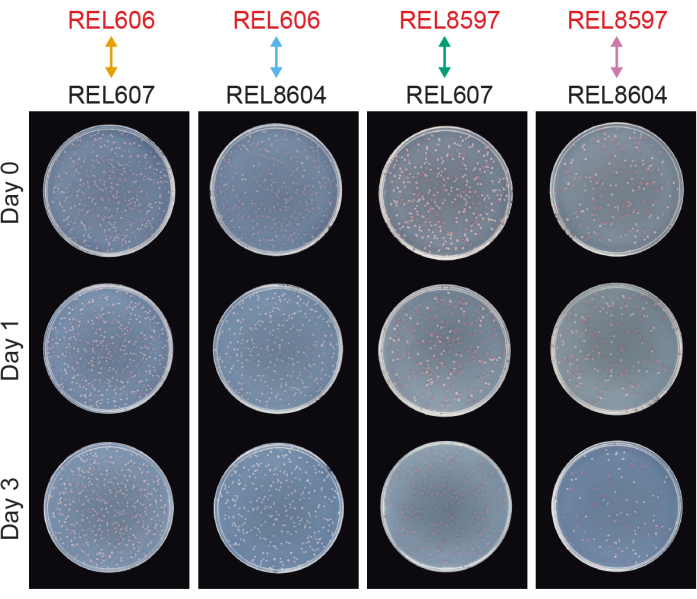
Abbildung 6: Wettbewerbsassays, plattiert auf TA-Agarplatten. Beispiele für TA-Agarplatten aus Wettbewerbsassays. REL606 und REL607 sind die Vorfahren von Ara− bzw. Ara+ des LTEE. REL8597 und REL8604 sind die 20.000 Populationen der Generation A−5 bzw. A+5 aus dem eingefrorenen "Fossilbericht" des LTEE. TA-Platten, die einem Wiederholungsassay zwischen jedem Stammpaar entsprechen, werden für Tag 0, Tag 1 und Tag 3 des Wettbewerbs angezeigt. Die Platten wurden nach 24 Stunden Wachstum bei 37°C fotografiert. Zellen der Konkurrenten REL606 und REL8597 sind Ara− und bilden rote Kolonien. Zellen der Konkurrenten REL607 und REL8604 sind Ara+ und bilden weiße Kolonien. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Die meisten Kolonien auf einer typischen konkurrierenden TA-Platte sind gut voneinander getrennt oder überlappen sich auf eine Weise, bei der es leicht zu zählen ist, wie viele anfänglich kreisförmige Kolonien verschiedener Typen zusammengewachsen sind (Abbildung 7A). Es können jedoch einige Situationen auftreten, in denen es nicht offensichtlich ist, wie eine atypische Kolonie oder ein Wachstum, das eine Mischung aus den beiden Farben ist, zu zählen ist. Erstens, wenn sich eine weiße Ara+-Kolonie und eine rote Ara−-Kolonie überlappen, neigt die Ara+-Kolonie dazu, die Ara−-Kolonie zu überwuchern und zu umhüllen. In dieser Situation sollte man einen kleinen roten Fleck oder eine durchscheinende "Lücke" in der größeren Ara+-Kolonie als Ara−-Kolonie zählen (Abbildung 7B). Zweitens treten gelegentlich spontane Ara+-Mutanten in Ara−-Kolonien auf. Diese Mutanten treten typischerweise als weiße Sektoren (Papillen) auf, die sich schneller aus dem Inneren einer roten Kolonie ausbreiten, da sie schneller wachsen, sobald sie Zugang zu Arabinose als zusätzlichem Nährstoff erhalten (Abbildung 7C). Diese Kolonien mit weißem Sektor werden als eine Ara−-Kolonie und keine Ara+-Kolonien gezählt. Diese Situation tritt häufiger auf, wenn die Platten 48 Stunden oder länger inkubiert werden. Drittens werden manchmal durchscheinende rosafarbene Kolonien beobachtet (Abbildung 7D). Diese werden vom Ara-Konkurrenten gebildet. Schließlich wächst auf TA-Platten manchmal eine kleine Anzahl kreisförmiger Kolonien mit einem leicht unterschiedlichen Rotton im Inneren, wenn sie bei der Herstellung des Agars oder beim Verteilen von Kulturverdünnungen auf ihren Oberflächen von einigen externen mikrobiellen Zellen kontaminiert werden (Abbildung 7E). Diese Schadstoffkolonien sollten nicht gezählt werden. Besteht der Verdacht auf eine Kontamination einer Konkurrenzkultur, weil sich auf einer ihrer TA-Platten viele atypische Kolonien befinden, sollte diese Replikation ausgeschlossen werden.
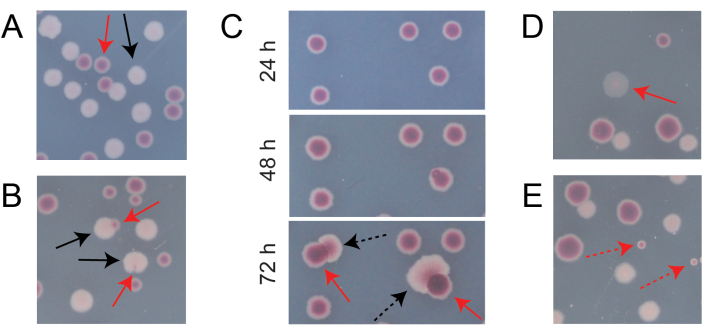
Abbildung 7: Grenzfälle bei der Zählung von Ara−- und Ara+-Kolonien auf TA-Agar. In jedem Feld sind einige Ara− und Ara+ Kolonien, die gezählt werden sollen, mit durchgehenden roten bzw. schwarzen Pfeilen markiert. Kolonien, die nicht gezählt werden sollen, werden mit gestrichelten Pfeilen angezeigt, die dem Typ entsprechen, um den sie sich zu handeln scheinen. Alle Fotos wurden nach 24 Stunden Inkubation aufgenommen, mit Ausnahme von Panel C. (A) Beispiele für normale Ara− und Ara+ Kolonien. (B) Beispiele von Ara+-Kolonien, die nahe gelegene Ara−-Kolonien überwuchern, darunter eine, die nur als transparenter Spalt in der Außenseite der weißen Kolonie kaum sichtbar ist. Zähle jeden dieser Fälle als zwei Kolonien, eine von jeder Art. (C) Beispiele für Ara−−-Kolonien, aus denen Ara+−Mutantensektoren hervorgehen. Zähle jeden Fall nur als eine einzige Ara−-Kolonie. Der weiße Sektor (Papille), der entsteht, ist auf eine Ara+-Mutante zurückzuführen, die innerhalb der Kolonie entsteht. Das gleiche Feld von Kolonien ist nach 24 h, 48 h und 72 h Wachstum dargestellt. (D) Beispiel einer durchscheinenden rosa Kolonie. Zähle es als Ara−. (E) Beispiele für Kolonien, die durch äußere Kontamination durch eine Mikrobe gebildet wurden, bei der es sich nicht um E. coli handelt. Diese sind rot, aber kleiner und perfekt kreisförmig mit einer deutlichen weißen Grenze. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Die Analyse der Koloniezählungen aus diesen Wettbewerben unter Verwendung der Excel-Tabelle (Supplemental File 1) oder durch Ausführen der fitnessR-Paketfunktionen in R für Koloniezählungen, die in die CSV-Vorlage (Supplemental File 2) eingegeben wurden, zeigt, dass die beiden Vorfahren in Bezug auf ihre Fitness innerhalb der Präzision des Assays nicht unterscheidbar sind, dass sowohl die A−5- als auch die A+5-Populationen der 20.000 Generationen signifikant fitter sind als die Vorfahren. und dass keine der beiden entwickelten Populationen signifikant fitter ist als die andere (Welchs t-Tests, S. > 0,05) (Abbildung 8). Die Präzision der relativen Fitnesseinschätzung verbessert sich bei den dreitägigen Wettkämpfen im Vergleich zu den eintägigen Wettkämpfen für eines der eng beieinander liegenden Paare (REL606 vs. REL607). Die Präzision dieser Messungen könnte auf Wunsch durch die Durchführung längerer Wettkämpfe mit mehr Wachstumszyklen weiter erhöht werden. Die Ergebnisse von mehrtägigen Wettkämpfen sind jedoch nicht aussagekräftig, wenn ein Konkurrent nach den zusätzlichen Wettkampftagen im Vergleich zum anderen so zahlreich ist, dass das Verhältnis der beiden Stämme nicht genau bestimmt werden kann, da es nur sehr wenige bis gar keine Kolonien des weniger fitten Typs gibt, die gezählt werden müssen. Dies ist der Fall bei den dreitägigen Wettkämpfen der Vorfahren gegen die entwickelten Populationen der 20.000 Generationen (REL606 vs. REL8604 und REL607 vs. REL8597) (Abbildung 6 und Tabelle 1).
Tabelle 1: Koloniezählungen aus kompetitiven Fitness-Assays. Ein- und dreitägige Konkurrenzassays mit sechs Replikaten wurden für alle paarweisen Kombinationen von zwei Ara− und den beiden Ara+ -Konkurrenten durchgeführt. REL606 und REL607 sind die Vorfahren von Ara− bzw. Ara+ des LTEE. REL8597 und REL8604 sind die A−5- bzw. A+5-Populationen der 20.000 Generationen aus dem eingefrorenen "Fossilbericht" des LTEE. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
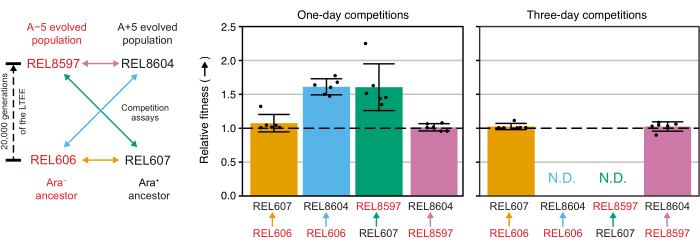
Abbildung 8: Relative Fitness, gemessen mit Wettbewerbsassays. Ergebnisse von ein- und dreitägigen Wettbewerbstests zwischen LTEE-Vorfahren und den 20.000 LTEE-Populationen der Generationen A−5 und A+5. Das Diagramm auf der linken Seite zeigt die vier paarweisen Wettbewerbe als farbcodierte Doppelpfeile. Jede Kombination der beiden Wettbewerber Ara− (rote Etiketten) und der beiden Ara+ (schwarze Etiketten) wurde mit sechsfacher Replikation getestet. Die Anzahl der Kolonien aus Tabelle 1 wurde in R mit dem PaketfitnessR 31 analysiert, und die Ergebnisse wurden mit dem Paket ggplot2 (Version 3.4.0)34 dargestellt. Die Fitness wird als der Wettbewerber angezeigt, auf den der Pfeil in der Beschriftung relativ zu dem Wettbewerber zugeht, von dem der Pfeil stammt (z. B. REL8604 relativ zu REL606). Relative Fitnesswerte, die aus den Koloniezählungen für jede Konkurrenz-Assay-Replik geschätzt werden (Punkte), mittlere relative Fitnesswerte für das Konkurrenzpaar (Balken, die mit der gleichen Farbcodierung wie im Diagramm gefüllt sind) und 95%-Konfidenzintervalle (Fehlerbalken) werden angezeigt. Für die dreitägigen Wettkämpfe zwischen den Vorfahren und den entwickelten Populationen konnten keine relativen Fitnesswerte ermittelt werden (N.D.), da es auf den Tag-3-Platten keine oder nur sehr wenige Kolonien der Vorfahren gab (siehe Tabelle 1). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Datei 1. Excel-Tabellendatei zur Berechnung der relativen Fitness. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 2. Eingabedateivorlage für durch Trennzeichen getrennte Werte zum Berechnen der relativen Eignung in R mithilfe des fitnessR-Pakets. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Langfristige Resilienz des LTEE und seiner Methoden
Das E. coli Long-Term Evolution Experiment (LTEE) befindet sich nun im vierten Jahrzehnt. Für ein Experiment zur mikrobiellen Evolution von beliebiger Dauer ist es entscheidend, eine reproduzierbare Umgebung aufrechtzuerhalten, Kontaminationen zu vermeiden, Proben zu archivieren und die Fitness genau zu messen. Das LTEE demonstriert mehrere bewährte Strategien zur Erreichung dieser Ziele, darunter die Verwendung von gut geschüttelten Kolben, die eine homogene Umgebung schaffen, und ein chemisch definiertes Wachstumsmedium, das eine geringe Zelldichte unterstützt. Darüber hinaus verwendet das LTEE Vorfahrenstämme, die sich in einem genetischen Marker unterscheiden, der einen Phänotyp (Koloniefarbe) ergibt, der sowohl leicht zu screenen als auch in der Evolutionsumgebung selektiv neutral ist. Dieses experimentelle Designmerkmal bietet die Möglichkeit, interne und externe Verunreinigungen zu identifizieren und die Messung der Fitness zu erleichtern. Allerdings haben sich nicht alle Verfahren und Schutzmaßnahmen, die seit 1988 von LTEE verwendet werden, als gleich robust erwiesen. Einige Methoden, die zu Beginn von LTEE zuverlässig waren, sind mit der Entwicklung der E. coli-Populationen weniger effektiv geworden . Glücklicherweise können diese problematischen Methoden nun mit Hilfe von Technologien, die seit Beginn des Experiments entwickelt wurden, ergänzt oder ersetzt werden.
Erkennung von Verunreinigungen
Die Erkennung von Verunreinigungen ist für das LTEE von entscheidender Bedeutung. Es kann zwei Arten von Kontamination geben: zwischen LTEE-Populationen (Kreuzkontamination) und mit Mikroben aus der Umwelt (Kontamination von außen). In den meisten Fällen werden durch den sorgfältigen Einsatz aseptischer Techniken und die genaue Aufmerksamkeit bei der Medienvorbereitung und den täglichen Transfers beide Arten von Kontaminationen verhindert, aber sie kommen vor. Zu Beginn des Experiments konnte die Beschichtung von TA-Agar verwendet werden, um Fälle von Kreuzkontamination zu erkennen, da die Transfers immer zwischen Ara−- und Ara+-Populationen gewechselt sind. Der Fingerabdruck der Empfindlichkeit und Resistenz dieser E. coli gegenüber bestimmten Bakteriophagen sollte auch ein Designmerkmal sein, das die LTEE-Populationen von häufig verwendeten E. coli-Laborstämmen unterscheiden könnte, die sie kontaminieren könnten4. Diese genetischen Marker sind jedoch im Laufe des Experiments unzuverlässig geworden (z. B. bilden einige Populationen keine Kolonien mehr auf TA-Agar)10,35. Glücklicherweise haben sich die Populationen genetisch voneinander getrennt, da sie während des Experiments unterschiedliche Evolutionsgeschichten erlebt haben, was neue genetische Marker geschaffen hat, die nun zum Nachweis von Kreuzkontaminationen verwendet werden können. Zum Beispiel hat jede Population eine einzigartige Kombination von Mutationen in den pykF- und nadR-Genen 14,36,37 entwickelt. Manchmal amplifizieren und sequenzieren wir diese beiden Gene mittels PCR, um zu testen, ob Kolonien mit ungewöhnlichen Morphologien oder Farben auf Kreuzkontamination zurückzuführen sind. Da die Kosten für die Sequenzierung des gesamten Genoms und der gesamten Population weiter sinken, könnte eine routinemäßige Sequenzierung der LTEE-Populationen bald möglich sein, was neue Möglichkeiten bietet, sie auf Anzeichen einer Kontamination zu überwachen.
Messung der Wettkampftauglichkeit
Ein weiterer Fall, in dem das LTEE über seine ursprünglichen Methoden hinausgewachsen ist, ist, dass die Fitness der entwickelten E. coli in der Versuchsumgebung so stark zugenommen hat, dass man die Fitness der heutigen Populationen im Verhältnis zu ihren Vorfahren mit dem hier beschriebenen Protokoll nicht mehr direkt messen kann. Die entwickelten Populationen verdrängen die Vorfahren in einem solchen Ausmaß, dass nach einem eintägigen Wettkampf nur noch wenige bis gar keine Ahnenkolonien mehr übrig sind, um zu zählen. Ein Ansatz, um mit diesem großen Fitnessunterschied umzugehen, besteht darin, ungleiche Startverhältnisse der Stämme zu verwenden und die anfänglichen Volumina, die gemischt werden, zugunsten des weniger fitten Konkurrenten (z. B. 90 μl Vorläufer und 10 μl entwickelter Konkurrent) zu gewichten. Ein zweiter Ansatz besteht darin, einen weiterentwickelten Ara−-Klon zu identifizieren, der eine höhere Fitness als der LTEE-Vorfahre aufweist, eine spontane Ara+−-Revertantenmutante durch Selektion auf MA-Agar zu isolieren und dann zu überprüfen, ob der Revertantenstamm die gleiche Fitness wie sein Elternteil aufweist, indem ein Konkurrenz-Assay 6,38 verwendet wird. Dieses neue Ara−/Ara+-Paar kann dann als eine Reihe gängiger Konkurrenzstämme anstelle von REL606/REL607 verwendet werden. Im Idealfall hat der weiterentwickelte Ara−-Klon, der als gemeinsamer Konkurrent ausgewählt wurde (und sein Ara+-Revertant), eine mittlere Fitness im Vergleich zu allen Stämmen, die in einem Experiment von Interesse sind. In den ersten 50.000 Generationen des LTEE führten diese beiden Ansätze (unter Verwendung ungleicher Startverhältnisse oder eines gemeinsamen Konkurrenten) nicht zu signifikant unterschiedlichen Fitnessmessungen im Vergleich zum typischen Ansatz39.
Diese Änderungen des Wettbewerbsprotokolls machen bestimmte vereinfachende Annahmen, die möglicherweise nicht immer zutreffen. Einer davon ist, dass Fitnessmessungen transitiv sind. Das heißt, wenn wir jeweils zwei Populationen gegen einen gemeinsamen Konkurrenzstamm separat konkurrieren lassen, können wir auf die relative Eignung der beiden Populationen zueinander schließen. Dieser Zusammenhang gilt zum größten Teil für LTEE40, nicht aber für andere Experimente41. Ein Grund für diese Diskrepanz kann die Entwicklung negativer frequenzabhängiger Fitnesseffekte sein. Diese Situation tritt auf, wenn Stämme, die aus zwei unterschiedlichen Abstammungslinien der Population A−2 des LTEE isoliert wurden, gegeneinander antreten19,42. Jeder hat einen Vorteil, wenn er selten ist, aufgrund der Kreuzfütterung, die ihre Koexistenz stabilisiert. Sequenzierungsdaten, die eine langfristige Koexistenz von Abstammungslinien mit unterschiedlichen Mutationssätzen zeigen, deuten darauf hin, dass ähnliche Interaktionen auch in anderen LTEE-Populationen aufgetreten sein könnten14,43, obwohl nicht klar ist, ob sie stark genug sind, um die Fitnessschätzungen merklich zu verändern. Schließlich bedeutet die Evolution des aeroben Wachstums auf Citrat in der Population A−3 des LTEE32, dass die Fitness dieser Zellen nun die Nutzung einer "privaten" Ressource beinhaltet, wenn sie mit Zellen konkurrieren, die kein Citrat verwenden können, was die Interpretation dieser Ergebnisse erschwert. Trotz dieser Ausnahmen hat die Verwendung einer niedrigen Glukosekonzentration und einer gut erschütterten Umgebung zweifellos die Durchführung von Fitnessvergleichen zwischen LTEE-Stämmen und Populationen vereinfacht.
Bei späteren Generationen bilden einige der LTEE-Populationen keine Kolonien mehr auf TA-Agar, was die Durchführung von Konkurrenzexperimenten mit selbst modifizierten Protokollen erschwert oder unmöglich macht10. Alternative Methoden, die kein Koloniewachstum erfordern, können potenziell verwendet werden, um die relative Repräsentation zweier Konkurrenten zu bestimmen, wie z. B. FREQ-seq, das Next-Generation-Sequencing verwendet, um den Anteil der Reads zu zählen, die zwei alternative Allele in einem Amplikon44 enthalten. Diese oder eine ähnliche Methode könnte möglicherweise mit den Ara-Allelen oder mit neu entwickelten Mutationen, wie denen in pykF und nadR, im Vergleich zur Ahnensequenz verwendet werden. Die Durchführung genetischer Modifikationen, die andere Arten von neutralen Markern einführen, kann auch zur Messung der relativen Fitness verwendet werden. So wurden beispielsweise in LTEE-Ablegern fluoreszierende Proteingene in die Chromosomen von Zellen eingefügt, so dass Konkurrenten mit Hilfe der Durchflusszytometrie gezählt werden können45. Ein weiterer Ansatz, der die Möglichkeit eröffnet, mehr als zwei Stämme in einem Wettbewerbskolben miteinander zu mischen, besteht darin, Barcodes einzufügen, die PCR-amplifiziert und sequenziert werden können, in die Genome verschiedener Wettbewerber. Dieser Ansatz wurde für die Abstammungsverfolgung in Evolutionsexperimentenverwendet 46. Sowohl die Durchflusszytometrie als auch die Barcode-Sequenzierung können viel extremere Verhältnisse zweier Stämme im Vergleich zur Koloniezählung genau messen (da sie > 10.000 Zellen/Genome im Vergleich zu den < 500 abfragen können, die auf einer Agarplatte gezählt werden können), so dass die Verwendung dieser Methoden auch verspricht, den Dynamikbereich in Bezug auf Fitnessunterschiede zu erhöhen, die relativ zu einem gemeinsamen Konkurrenten gemessen werden können.
Alternative Designs für Langzeitexperimente zur mikrobiellen Evolution
Trotz all seiner Vorzüge ist das LTEE nicht perfekt. Bestimmte Aspekte seines Designs machen es arbeitsintensiv und anfällig für menschliche Fehler. Zum Beispiel muss jeden Tag ein Forscher ins Labor kommen und zwischen Erlenmeyerkolben pipettieren, um das Experiment fortzusetzen. Wettbewerbsexperimente können auch gewaltige logistische Hürden darstellen, da die Anforderungen an sterile Glaswaren, Medien, Inkubatorraum und Koloniezählung schnell eskalieren, wenn auch nur eine kleine Anzahl von Wettbewerbern mit bescheidener Replikation getestet wird. Wir werden oft gefragt, warum wir keine Laborautomatisierungssysteme nutzen, wie z. B. Pipettierroboter, die mit 96-Well-Mikrotiterplatten arbeiten, oder kontinuierliche Kultursysteme wie Chemostaten oder Turbidostaten. Die Antwort ist einfach: Das LTEE ist in gewisser Weise ein Gefangener seiner eigenen langen Geschichte. Wir wagen es nicht, von 10-ml-Kulturen abzuweichen, die mit einer bestimmten Geschwindigkeit in 50-ml-Erlenmeyerkolben geschüttelt werden, da dies das Experiment grundlegend verändern würde. Subtile Aspekte der Umwelt, an die sich diese Populationen seit Jahrzehnten angepasst haben (z. B. die Menge der Belüftung), würden in Mikrotiterplatten oder kontinuierlichen Kultursystemen verändert werden. Der Populationsengpass bei jedem Transfer kann auch unterschiedlich sein (z. B. kleiner in Mikrotiterplatten), was die evolutionäre Dynamik verändert. Kurz gesagt, eine Abweichung von den hier beschriebenen Methoden würde das LTEE zu einem anderen Experiment machen oder zumindest eine Diskontinuität riskieren, die die evolutionären Bahnen stören würde.
Forscher, die neue Evolutionsexperimente planen, sollten diese anderen Möglichkeiten der Vermehrung mikrobieller Populationen in Betracht ziehen und sich ihrer potenziellen Vor- und Nachteile bewusst sein. Die Verwendung von Pipettierrobotern zum Transfer von Populationen in Mikrotiterplatten ist in gewisser Weise logistisch einfacher und kann sich aufgrund der hohen Anzahl von Replikatpopulationen, die auf diese Weise vermehrt werden können, als sehr leistungsfähig erweisen 47,48,49. Automatisierte Transfers finden jedoch in den meisten aktuellen Setups nicht unter vollständig sterilen Bedingungen statt, was die Wahrscheinlichkeit einer Kontamination von außen erhöht. Um eine Kontamination zu verhindern, wird das Nährmedium oft mit Antibiotika ergänzt, die zu einem Merkmal der Umwelt werden, das die Evolution beeinflusst. Transfers in Mikrotiterplatten sind auch anfälliger für Kreuzkontaminationen. Schließlich neigt die Umgebung von Mikrotiterplatten – insbesondere wenn sie nicht geschüttelt werden – dazu, nach Wandwachstum, Aggregation und anderen Phänomenen zu selektieren, die die Evolution erschweren können, indem sie mehrere Nischen in einem Well schaffen. Die Verwendung von reichhaltigen Medien oder hohen Konzentrationen von Nährstoffen, um die Populationsgröße in kleinen Brunnen groß zu halten, wird diese Komplexität wahrscheinlich noch verschärfen. Ergeben sich solche Wechselwirkungen, können sie die Messung und Interpretation der Fitness erheblich erschweren.
Zu den kontinuierlichen Kultursystemen für die mikrobielle Evolution gehören Chemostaten, bei denen ständig frisches Medium hineingepumpt und Kultur abgepumpt wird, und Turbidostaten, bei denen Kulturen regelmäßig durch automatisierte Sensorik und Pumpung verdünnt werden, um die Zellen in einem Zustand konstanten Wachstums zu halten. Diese Systeme sind sehr nützlich, wenn man die mikrobielle Physiologie und Evolution modellieren möchte, da sie verhindern, dass Mikroben zwischen Wachstum und Hunger wechseln, indem sie in einer Umgebung gehalten werden, die immer Nährstoffeenthält 50. Man kann sogar Sensoren hinzufügen, die Echtzeitmessungen der optischen Dichte, desO2-Verbrauchs, des pH-Werts und anderer Aspekte der Umgebung und des Wachstums einer Kultur durchführen. Aktuelle kontinuierliche Kultursysteme erfordern jedoch entweder teure Geräteanschaffungen oder spezielles Fachwissen, um kundenspezifische Setups zu erstellen51,52,53,54. Auch das Wandwachstum, bei dem Zellen der Verdünnung entgehen, indem sie an der Kulturkammer haften, beeinträchtigt die evolutionäre Dynamik in kontinuierlichen Kultursystemen, es sei denn, sie werden regelmäßig sterilisiert. Aufgrund dieser Einschränkungen waren die meisten Chemostat- und Turbidostat-Evolutionsexperimente bisher von begrenzter Dauer und/oder umfassten im Vergleich zu seriellen Transfer-Evolutionsexperimenten relativ wenige unabhängig voneinander entwickelnde Populationen.
Schlussfolgerung
Die Methoden, die wir hier für das LTEE demonstrieren, sind entscheidend für die Untersuchung seiner einzigartigen historischen Aufzeichnungen und die Fortsetzung der offenen Evolution dieser E. coli-Populationen. Sie bieten auch einen Ausgangspunkt für andere, die neue Evolutionsexperimente in Betracht ziehen, die die Vorteile der Laborautomatisierung nutzen oder verschiedene Elemente der Komplexität in natürlichen Umgebungen wiederherstellen könnten, die absichtlich im LTEE weggelassen wurden. Seit 1988 blüht die experimentelle Evolution als Feld. In dieser Zeit haben Forscher in Laboratorien auf der ganzen Welt die immense Flexibilität dieses Ansatzes für die Erforschung der Evolution unter Beweis gestellt, indem sie kreative Versuchsdesigns eingeführt und die Ergebnisse mit neuen Technologien überwacht haben. Die Methoden des LTEE stellen keinen Endpunkt dar, aber wir hoffen, dass sie auch in Zukunft inspirieren und eine Grundlage für das Feld bilden werden.
Offenlegungen
Es wurden keine Interessenkonflikte erklärt.
Danksagungen
Wir danken Richard Lenski und den vielen Forschern, die das Langzeit-Evolutionsexperiment mit E. coli untersucht und zur Aufrechterhaltung beigetragen haben , darunter insbesondere Neerja Hajela. LTEE wird derzeit von der National Science Foundation (DEB-1951307) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium chloride (TTC) | Sigma-Aldrich | T8877 | |
| 20 mL Glass Beaker | Sigma-Aldrich | CLS100020 | |
| 50 mL Erlenmeyer Flasks | Sigma-Aldrich | CLS498050 | |
| Agar | Sigma-Aldrich | A1296 | |
| Ammonium Sulfate | Sigma-Aldrich | AX1385 | |
| Antifoam | Sigma-Aldrich | A5757 | |
| Arabinose | Sigma-Aldrich | A3256 | |
| Freezer Box (2") | VWR | 82007-142 | |
| Freezer Box (3") | VWR | 82007-144 | |
| Freezer Box Cell Divider (49-place) | VWR | 82007-150 | |
| Freezer Box Cell Divider (81-place) | VWR | 82007-154 | |
| Freezer Vials (1/2-Dram) | VWR | 66009-816 | |
| Freezer Vials (2-Dram) | VWR | 66010-560 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Glycerol | Fisher Scientific | G33 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Metal Tray | Winco | SPJP-202 | |
| Petri Dish | Fisher Scientific | FB0875712 | |
| Potassium Phosphate Dibasic Trihydrate | Sigma-Aldrich | P5504 | |
| Potassium Phosphate Monobasic | Sigma-Aldrich | P5379 | |
| Sodium Chloride | Sigma-Aldrich | M7506 | |
| Sodium Citrate Tribasic Dihydrate | Sigma-Aldrich | C7254 | |
| Test Tube Cap (18mm) | VWR | 10200-142 | |
| Test Tube Rack (18mm, steel) | Adamas-Beta | N/A | Test Tube Racks Stainless Steel Grid Arrangement 72 Holes (17-19 mm) |
| Test Tubes (18 x 150 mm) | VWR | 47729-583 | |
| Thiamine, Hydrochloride | Millipore | 5871 | |
| Tryptone | Gibco | 211705 | |
| Yeast Extract | Gibco | 212750 |
Referenzen
- Lenski, R. E., Rose, M. R., Simpson, S. C., Tadler, S. C. Long-term experimental evolution in Escherichia coli. I. Adaptation and divergence during 2,000 generations. The American Naturalist. 138 (6), 1315-1341 (1991).
- Fox, J. W., Lenski, R. E. From here to eternity-the theory and practice of a really long experiment. PLoS Biology. 13 (6), e1002185(2015).
- Daegelen, P., Studier, F. W., Lenski, R. E., Cure, S., Kim, J. F. Tracing ancestors and relatives of Escherichia coli B, and the derivation of B strains REL606 and BL21(DE3). Journal of Molecular Biology. 394 (4), 634-643 (2009).
- Studier, F. W., Daegelen, P., Lenski, R. E., Maslov, S., Kim, J. F. Understanding the differences between genome sequences of Escherichia coli B strains REL606 and BL21(DE3) and comparison of the E. coli B and K-12 genomes. Journal of Molecular Biology. 394 (4), 653-680 (2009).
- Barrick, J. E., Lenski, R. E. Genome dynamics during experimental evolution. Nature Reviews Genetics. 14 (12), 827-839 (2013).
- Lenski, R. E. Experimental studies of pleiotropy and epistasis in Escherichia coli. II. Compensation for maladaptive pleiotropic effects associated with resistance to virus T4. Evolution. 42 (3), 425-432 (1988).
- Calcott, P. H., Gargett, A. M. Mutagenicity of freezing and thawing. FEMS Microbiology Letters. 10 (2), 151-155 (1981).
- Lenski, R. E., Travisano, M. Dynamics of adaptation and diversification: a 10,000-generation experiment with bacterial populations. Proceedings of the National Academy of Sciences of the United States of America. 91 (15), 6808-6814 (1994).
- Wiser, M. J., Ribeck, N., Lenski, R. E. Long-term dynamics of adaptation in asexual populations. Science. 342 (6164), New York, N.Y. 1364-1367 (2013).
- Lenski, R. E., et al. Sustained fitness gains and variability in fitness trajectories in the long-term evolution experiment with Escherichia coli. Proceedings of the Royal Society B: Biological Sciences. 282 (1821), 20152292(2015).
- Barrick, J. E., et al. Genome evolution and adaptation in a long-term experiment with Escherichia coli. Nature. 461 (7268), 1243-1247 (2009).
- Blount, Z. D., Barrick, J. E., Davidson, C. J., Lenski, R. E. Genomic analysis of a key innovation in an experimental Escherichia coli population. Nature. 489 (7417), 513-518 (2012).
- Tenaillon, O., et al. Tempo and mode of genome evolution in a 50,000-generation experiment. Nature. 536 (7615), 165-170 (2016).
- Good, B. H., McDonald, M. J., Barrick, J. E., Lenski, R. E., Desai, M. M. The dynamics of molecular evolution over 60,000 generations. Nature. 551 (7678), 45-50 (2017).
- Consuegra, J., et al. Insertion-sequence-mediated mutations both promote and constrain evolvability during a long-term experiment with bacteria. Nature Communications. 12 (1), 980-980 (2021).
- Cooper, T. F., Rozen, D. E., Lenski, R. E. Parallel changes in gene expression after 20,000 generations of evolution in Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 100 (3), 1072-1077 (2003).
- Favate, J. S., Liang, S., Cope, A. L., Yadavalli, S. S., Shah, P. The landscape of transcriptional and translational changes over 22 years of bacterial adaptation. eLife. 11, e81979(2022).
- Khan, A. I., Dinh, D. M., Schneider, D., Lenski, R. E., Cooper, T. F. Negative epistasis between beneficial mutations in an evolving bacterial population. Science. 332 (6034), 1193-1196 (2011).
- Plucain, J., et al. Epistasis and allele specificity in the emergence of a stable polymorphism in Escherichia coli. Science. 343 (6177), 1366-1369 (2014).
- Quandt, E. M., Deatherage, D. E., Ellington, A. D., Georgiou, G., Barrick, J. E. Recursive genomewide recombination and sequencing reveals a key refinement step in the evolution of a metabolic innovation in Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 111 (6), 2217-2222 (2014).
- Leon, D., D'Alton, S., Quandt, E. M., Barrick, J. E. Innovation in an E. coli evolution experiment is contingent on maintaining adaptive potential until competition subsides. PLoS Genetics. 14 (4), e1007348(2018).
- Bennett, A. F., Lenski, R. E., Mittler, J. E. Evolutionary adaptation to temperature. I. Fitness responses of Escherichia coli to changes in its thermal environment. Evolution. 46 (1), 16-30 (1992).
- Kibota, T. T., Lynch, M. Estimate of the genomic mutation rate deleterious to overall fitness in E. coli. Nature. 381 (6584), 694-696 (1996).
- Friesen, M. L., Saxer, G., Travisano, M., Doebeli, M. Experimental evidence for sympatric ecological diversification due to frequency-dependent competition in Escherichia coli. Evolution. 58 (2), 245-260 (2004).
- Cooper, T. F. Recombination speeds adaptation by reducing competition between beneficial mutations in populations of Escherichia coli. PLoS Biology. 5 (9), e225(2007).
- Cooper, T. F., Lenski, R. E. Experimental evolution with E. coli in diverse resource environments. I. Fluctuating environments promote divergence of replicate populations. BMC Evolutionary Biology. 10, 11(2010).
- Quan, S., et al. Adaptive evolution of the lactose utilization network in experimentally evolved populations of Escherichia coli. PLoS Genetics. 8 (1), e1002444(2012).
- Deatherage, D. E., Kepner, J. L., Bennett, A. F., Lenski, R. E., Barrick, J. E. Specificity of genome evolution in experimental populations of Escherichia coli evolved at different temperatures. Proceedings of the National Academy of Sciences of the United States of America. 114 (10), E1904-E1912 (2017).
- Izutsu, M., Lake, D. M., Matson, Z. W. D., Dodson, J. P., Lenski, R. E. Effects of periodic bottlenecks on the dynamics of adaptive evolution in microbial populations. BioRixv. , 4457(2021).
- Chavarria-Palma, J. E., Blount, Z. D., Barrick, J. E. LTEE Media Recipes. , (2022).
- Barrick, J. E., Lake, D. M. fitnessR: fitnessR-v1.0.0. barricklab. , (2023).
- Blount, Z. D., Borland, C. Z., Lenski, R. E. Historical contingency and the evolution of a key innovation in an experimental population of Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 105 (23), 7899-7906 (2008).
- Grant, N. A., Magid, A. A., Franklin, J., Dufour, Y., Lenski, R. E. Changes in cell size and shape during 50,000 generations of experimental evolution with Escherichia coli. Journal of Bacteriology. 203 (10), 22(2021).
- Wickham, H. ggplot2: Elegant Graphics for Data Analysis. , Springer-Verlag. New York. (2016).
- Meyer, J. R., et al. Parallel changes in host resistance to viral infection during 45,000 generations of relaxed selection. Evolution. 64 (10), 3024-3034 (2010).
- Woods, R., Schneider, D., Winkworth, C. L., Riley, M. A., Lenski, R. E. Tests of parallel molecular evolution in a long-term experiment with Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 103 (24), 9107-9712 (2006).
- Barrick, J. E., Deatherage, D. E., D'Alton, S. LTEE-Ecoli: genomics resources for the Long-Term Evolution Experiment with Escherichia coli. , Available from: https://github.com/barricklab/LTEE-Ecoli (2022).
- Izutsu, M., Lenski, R. E. Experimental test of the contributions of initial variation and new mutations to adaptive evolution in a novel environment. Frontiers in Ecology and Evolution. 10, 958406(2022).
- Wiser, M. J., Lenski, R. E. A comparison of methods to measure fitness in Escherichia coli. PLoS One. 10 (5), 0126210(2015).
- de Visser, J. A. G. M., Lenski, R. E. Long-term experimental evolution in Escherichia coli. XI. Rejection of non-transitive interactions as cause of declining rate of adaptation. BMC Evolutionary Biology. 2 (1), 19(2002).
- Paquin, C. E., Adams, J. Relative fitness can decrease in evolving asexual populations of S. cerevisiae. Nature. 306 (5941), 368-371 (1983).
- Rozen, D. E., Lenski, R. E. Long-Term Experimental Evolution in Escherichia coli. VIII. Dynamics of a balanced polymorphism. The American Naturalist. 155 (1), 24-35 (2000).
- Quandt, E. M., Gollihar, J., Blount, Z. D., Ellington, A. D., Georgiou, G., Barrick, J. E. Fine-tuning citrate synthase flux potentiates and refines metabolic innovation in the Lenski evolution experiment. eLife. 4, e09696(2015).
- Chubiz, L. M., Lee, M. -C., Delaney, N. F., Marx, C. J. FREQ-Seq: a rapid, cost-effective, sequencing-based method to determine allele frequencies directly from mixed populations. PLoS One. 7 (10), e47959(2012).
- Gallet, R., Cooper, T. F., Elena, S. F., Lenormand, T. Measuring selection coefficients below 10-3: method, questions, and prospects. Genetics. 190 (1), 175-186 (2012).
- Levy, S. F., et al. Quantitative evolutionary dynamics using high-resolution lineage tracking. Nature. 519 (7542), 181-186 (2015).
- Lang, G. I., Botstein, D., Desai, M. M. Genetic variation and the fate of beneficial mutations in asexual populations. Genetics. 188 (3), 647-661 (2011).
- Frenkel, E. M., et al. Crowded growth leads to the spontaneous evolution of semistable coexistence in laboratory yeast populations. Proceedings of the National Academy of Sciences. 112 (36), 11306-11311 (2015).
- Jordt, H., et al. Coevolution of host-plasmid pairs facilitates the emergence of novel multidrug resistance. Nature Ecology and Evolution. 4 (6), 863-869 (2020).
- Gresham, D., Dunham, M. J. The enduring utility of continuous culturing in experimental evolution. Genomics. 104 (6), 399-405 (2014).
- Miller, A. W., Befort, C., Kerr, E. O., Dunham, M. J. Design and use of multiplexed chemostat arrays). Journal of Visualized Experiments. (72), e50262(2013).
- Toprak, E., et al. Building a morbidostat: an automated continuous-culture device for studying bacterial drug resistance under dynamically sustained drug inhibition. Nature Protocols. 8 (3), 555-567 (2013).
- Wong, B. G., Mancuso, C. P., Kiriakov, S., Bashor, C. J., Khalil, A. S. Precise, automated control of conditions for high-throughput growth of yeast and bacteria with eVOLVER. Nature Biotechnology. 36 (7), 614-623 (2018).
- Ekkers, D. M., Branco Dos Santos, F., Mallon, C. A., Bruggeman, F., Van Doorn, G. S. The omnistat: A flexible continuous-culture system for prolonged experimental evolution. Methods in Ecology and Evolution. 11 (8), 932-942 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten