Ein stabiles Phantommaterial für die optische und akustische Bildgebung
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Herstellung eines stabilen, biologisch relevanten Phantommaterials für optische und akustische biomedizinische Bildgebungsanwendungen, das unabhängig voneinander einstellbare akustische und optische Eigenschaften aufweist.
Zusammenfassung
Die Etablierung gewebenachahmender biophotonischer Phantommaterialien, die Langzeitstabilität bieten, ist unerlässlich, um den Vergleich von biomedizinischen Bildgebungsgeräten zwischen Anbietern und Institutionen zu ermöglichen, die Entwicklung international anerkannter Standards zu unterstützen und die klinische Umsetzung neuartiger Technologien zu unterstützen. Hier wird ein Herstellungsprozess vorgestellt, der zu einem stabilen, kostengünstigen, gewebenachahmenden Copolymer-in-Öl-Material für den Einsatz in photoakustischen, optischen und Ultraschall-Standardisierungsbemühungen führt.
Das Grundmaterial besteht aus Mineralöl und einem Copolymer mit definierten CAS-Nummern (Chemical Abstract Service). Das hier vorgestellte Protokoll liefert ein repräsentatives Material mit einer Schallgeschwindigkeit c(f) = 1.481 ± 0,4 m·s-1 bei 5 MHz (entspricht der Schallgeschwindigkeit von Wasser bei 20 °C), akustischer Dämpfung α(f) = 6,1 ± 0,06 dB·cm-1 bei 5 MHz, optischer Absorption μa(λ) = 0,05 ± 0,005 mm-1 bei 800 nm, und optische Streuung μs'(λ) = 1 ± 0,1 mm-1 bei 800 nm. Das Material ermöglicht eine unabhängige Abstimmung der akustischen und optischen Eigenschaften durch Variation der Polymerkonzentration bzw. der Lichtstreuung (Titandioxid) und der Absorptionsmittel (öllöslicher Farbstoff). Die Herstellung unterschiedlicher Phantomdesigns wird dargestellt und die Homogenität der resultierenden Prüfobjekte mittels photoakustischer Bildgebung bestätigt.
Aufgrund seines einfachen, wiederholbaren Herstellungsprozesses und seiner Langlebigkeit sowie seiner biologisch relevanten Eigenschaften ist die Materialrezeptur vielversprechend für multimodale akustisch-optische Standardisierungsinitiativen.
Einleitung
Die Feststellung der Präzision und Genauigkeit neuartiger Biomarker für die optische Bildgebung durch technische Validierung1,2 ist von größter Bedeutung, um ihre erfolgreiche Implementierung in der klinischen Praxis zu gewährleisten. Um dies zu erreichen, werden in technischen Validierungsstudien häufig langlebige physikalische Phantome verwendet, die die Leistungsbewertung zwischen den Geräten und die routinemäßige Qualitätskontrolle erleichtern. Für den breiten Einsatz eines Phantommaterials in der Forschung und klinischen Translation ist ein einfaches, hochgradig reproduzierbares Herstellungsprotokoll erforderlich. Ein ideales biophotonisches Phantommaterial sollte die folgenden Eigenschaftenaufweisen 3: (1) unabhängig einstellbare Eigenschaften innerhalb biologisch relevanter Bereiche; (2) mechanische Robustheit; (3) Langzeitstabilität; (4) Flexibilität in Geometrie und Architektur; (5) sichere Handhabung; (6) weit verbreitete Inhaltsstoffe, die von wissenschaftlichen Standardlieferanten bezogen werden können; und (7) niedrige Kosten. Gegenwärtig fehlt für biophotonische Anwendungen ein standardisiertes Protokoll für ein weithin akzeptiertes Phantommaterial, das die skizzierten Anforderungen erfüllt und auch abstimmbare akustische Eigenschaften für Hybridanwendungen, wie z. B. die photoakustische Bildgebung (PAI), enthält.
Zu den biologisch relevanten Phantommaterialien, die für kombinierte optische und akustische Anwendungen vorgesehen sind, gehören Hydrogele 4,5, Polyvinylalkohol (PVA)6,7,8,9 und Polyvinylchlorid-Plastisol (PVCP)10,11,12,13,14,15,16 . Diese Materialien sind jedoch durch bestimmte Einschränkungen gekennzeichnet, die ihre Anwendung als stabiles Phantommaterial einschränken. Hydrogele zum Beispiel sind anfällig für Austrocknung, mechanische Beschädigungen und bakterielles Einwachsen, was ihre Haltbarkeit einschränkt17,18,19. Die Zugabe von Chemikalien kann die Langlebigkeit erhöhen, aber gängige Konservierungsstoffe wie Formaldehyd20 oder Benzalkoniumchlorid21 sind gefährlich und erfordern Vorsichtsmaßnahmen bei der Handhabung. Darüber hinaus können Targets, die wasserlösliche Farbstoffe enthalten, im Grundmaterial diffundieren, wenn sie nicht eingekapselt sind. PVA-Kryogele zeichnen sich durch eine höhere Langlebigkeit und strukturelle Robustheit aus, ihr Herstellungsprozess umfasst jedoch lange Gefrier-Tau-Zyklen22. Dies kann die unabhängige Abstimmbarkeit von akustischen und optischen Parametern23 einschränken und - wenn sie geringfügig variiert werden - zu Inhomogenitäten6 führen, wodurch die Reproduzierbarkeit beeinträchtigt wird. Darüber hinaus wurde die Diffusion von Farbstoffen aus Einschlüssen nach 1 Jahrbeobachtet 13. PVCP hat einen komplexen Herstellungsprozess, der hohe Temperaturen von bis zu 180-220 °C umfasst 13,14,24,25. PVCP leidet auch unter dem Fehlen einer Lieferkette mit wissenschaftlichen Lieferanten26 und kann Weichmacher auf der Basis von Phthalaten enthalten, die Fortpflanzungs- und Entwicklungsschäden verursachen können27, was sie in einigen Ländern zu kontrollierten Substanzen macht.
Copolymer-in-Öl-Zusammensetzungen, wie z. B. Gelwachs 28,29,30,31 oder Mischungen auf der Basis der thermoplastischen Styrolelastomere 32,33,34,35,36, weisen eine gute Längsstabilität auf und weisen gewebeähnliche akustische und optische Eigenschaften auf 31,35,36,37 und hat damit ein hohes Potenzial als dauerhafter Phantomkandidat in multimodalen Anwendungen. Darüber hinaus ist diese Materialklasse kostengünstig, nicht wasserabsorbierend, ungiftig und biologisch inert35,38. Die Schallgeschwindigkeit c(f) und der Schalldämpfungskoeffizient α(f) können in einem biologisch relevanten Bereich (Tabelle 1) durch Variation der Polymerkonzentration 33,35,39 eingestellt werden, während die optische Absorption μa(λ) und die reduzierte Streuung μs'(λ)-Koeffizienten in erster Linie durch die Zugabe von öllöslichen Farbstoffen oder Titandioxid (TiO2)39 variiert werden können. beziehungsweise.
Hier wird ein einfaches, leicht verständliches Protokoll für die Herstellung langlebiger Copolymer-in-Öl-Phantome vorgestellt, die für den Einsatz bei der optischen, Ultraschall- oder photoakustischen Gerätekalibrierung geeignet sind. Alle Inhaltsstoffe haben definierte CAS-Nummern (Chemical Abstract Service) und sind bei wissenschaftlichen Standardlieferanten erhältlich. Mögliche Schwierigkeiten im Herstellungsprozess werden aufgezeigt und Wege zu deren Überwindung aufgezeigt. Während das Protokoll die Herstellung von Materialien mit einer Reihe von akustischen und optischen Eigenschaften ermöglicht, liefert das vorgestellte Protokoll ein Material mit einer Schallgeschwindigkeit von ~1.481 m·s-1, das der Schallgeschwindigkeit von Wasser bei Raumtemperatur (20 °C) entspricht40. Dieser Wert wurde als neutraler Standard für die Darstellung des breiten Spektrums der vorhandenen Gewebeeigenschaften gewählt (Tabelle 1), wodurch ein konsistenter und zuverlässiger Referenzpunkt für den Vergleich festgelegt werden konnte. Durch die Bereitstellung dieses detaillierten Protokolls wollen wir die Akzeptanz und Reproduzierbarkeit der Herstellung dieses vielversprechenden Phantommaterialtyps erweitern, wodurch biophotonische, akustische und photoakustische Validierungsstudien erleichtert und die routinemäßige Qualitätskontrolle in präklinischen und klinischen Bildgebungsanwendungen unterstützt werden.
Protokoll
Tabelle 1: Überblick über die akustischen und optischen Eigenschaften von Weichteilen. Die optischen Eigenschaften decken ein Spektrum von 600 bis 900 nm ab. Es ist zu beachten, dass es sich hierbei nur um repräsentative Werte handelt, die als allgemeine Orientierungshilfe dienen sollen. Die genauen Werte können je nach Versuchsbedingung (z. B. Temperatur) und Frequenz/Wellenlänge variieren. In der Literatur werden spezifischere Werte angegeben. *Keine spezifische Referenz gefunden. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Das angegebene Protokoll wurde für die Herstellung von ~120 ml Phantommaterial entwickelt. Die Massen der Bauteile können skaliert werden, um unterschiedliche Volumina an Phantommaterial herzustellen. Bitte beachten Sie, dass bei größeren Volumina (>500 ml) das vorgeschlagene Gerät möglicherweise nicht in der Lage ist, das Phantomgemisch ausreichend homogen zu erhitzen. Zu diesem Zweck sollten Heizgeräte entsprechend angepasst werden.
VORSICHT: Stellen Sie immer sicher, dass während des gesamten Herstellungsprozesses geeignete persönliche Schutzausrüstung (PSA) getragen wird. Dies kann die Verwendung von Laborkitteln, Schutzbrillen und Schutzhandschuhen umfassen. Beziehen Sie sich auf die örtlichen Sicherheitsrichtlinien und halten Sie diese ein. Das Verfahren ist adaptiert von Hacker et al.39; Eine Zusammenfassung der Schritte ist in Abbildung 1 dargestellt.
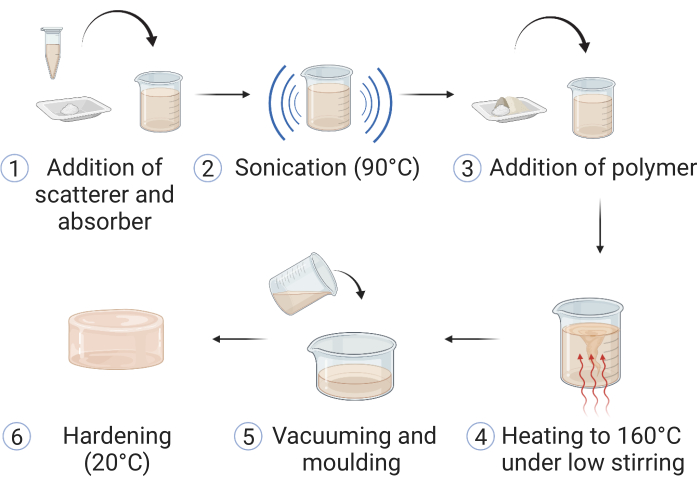
Abbildung 1: Herstellung des Copolymer-in-Öl-Materials. (1) Materialien für die optische Streuung und Absorption werden dem Mineralöl zugesetzt und (2) bei 90 °C beschallt, bis sie sich aufgelöst haben. (3) Polymer(e) und Stabilisator werden zugegeben, und (4) das Gemisch wird in einem Ölbad unter schwachem Rühren auf 160 °C erhitzt. (5) Nach dem Auflösen aller Komponenten wird die Probe in eine geeignete Phantomform gegossen und (6) bei Raumtemperatur aushärten gelassen. Diese Abbildung stammt von Hacker et al.39. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
1. Zubereitung der Mischung
- Bereiten Sie die Nigrosin-Stammlösung vor, indem Sie 0,4 g Nigrosin zu 40 ml Mineralöl hinzufügen. Stellen Sie eine homogene Durchmischung durch Beschallung und gründliches Vortexen der Probe sicher. Lagern Sie die Stammlösung bei Raumtemperatur.
Anmerkungen: Die Stammlösung sollte vor der Wiederverwendung immer gründlich gemischt werden. Wenn ein Phantommaterial ohne optischen Streuer (TiO 2) oder Absorber (Farbstoff) bevorzugt wird, können Schritt 1 und2 übersprungen werden. Fahren Sie mit Schritt 3 fort. - Beschallen Sie 0,15 gTiO2 und 1 ml der Farbstoffbrühlösung in 100 ml (83,8 g) Mineralöl, bis sich alle Komponenten vollständig aufgelöst haben (~60 min) (Abbildung 1: Schritte 1 und 2). Stellen Sie das Ultraschallgerät auf erhöhte Temperaturen (90 °C) ein, wenn das Gerät dies zulässt, da dies den Mischvorgang erleichtert. Fahren Sie während der Beschallungszeit mit den Schritten 3-5 fort.
Anmerkungen: Wenn ein Phantom mit höheren Absorptions- und Streueigenschaften bevorzugt wird, muss die Beschallungszeit möglicherweise verlängert werden. - Polystyrol-Block-Poly(ethylen-ran-butylen)-Block-Polystyrol (SEBS) und Polyethylen niedriger Dichte (LDPE) in den gewünschten Konzentrationen (z. B. SEBS = 25,14 g; LDPE = 6,70 g) (Abbildung 1: Schritt 3).
- Optional: Zur Erhöhung der Stabilität kann ein Antioxidans zugesetzt werden, das jedoch nicht zwingend erforderlich ist, wenn die Heiztemperaturen 180°C nicht überschreiten.
Anmerkungen: Falls in einem späteren Stadium des Herstellungsprozesses Probleme mit der Löslichkeit oder Viskosität auftreten, ist es ratsam, das LDPE auszuschließen. LDPE wird eingearbeitet, um die Schallgeschwindigkeit im Material zu erhöhen (Tabelle 3); Es ist jedoch nicht zwingend erforderlich, um ein stabiles Phantom zu erstellen. Durch den Verzicht auf LDPE kann der Herstellungs- und Formprozess vereinfacht werden, was jedoch zu einer Verringerung der späteren Schallgeschwindigkeit des Endprodukts führt (Tabelle 3).
- Optional: Zur Erhöhung der Stabilität kann ein Antioxidans zugesetzt werden, das jedoch nicht zwingend erforderlich ist, wenn die Heiztemperaturen 180°C nicht überschreiten.
- Erzeugen Sie ein Ölbad mit geeigneten Glaswaren und Silikonöl. Befestigen Sie es vorsichtig auf der Kochstelle. Stellen Sie sicher, dass das Thermoelement im Silikonölbad verbleibt und während des gesamten Vorgangs die Kanten der Glaswaren nicht berührt (Abbildung 2).
Anmerkungen: Stellen Sie sicher, dass das thermoregulatorische Zubehör sorgfältig gemäß den Anweisungen des Geräteherstellers montiert wird. - Legen Sie einen Magnetrührstab von ausreichender Länge in das Ölbad, um eine gleichmäßige Wärmeverteilung zu gewährleisten.
- Schalten Sie die Kochstelle ein, stellen Sie die Heiztemperatur auf 160 °C und die Umdrehungen pro Minute (U/min) des Rührers auf 50 ein.
- LDPE und SEBS werden in das Glasbecherglas mit dem beschallten Mineralöl (mit TiO2 und Nigrosin) überführt. Führen Sie einen Magnetrührstab von ausreichender Länge in das Glasbecherglas ein und führen Sie ihn zur Erwärmung der gemessenen Komponenten in die Mitte des Ölbades. Achten Sie darauf, dass der Ölstand im Bad über dem Mineralölstand im Becherglas bleibt (Abbildung 1: Schritt 4).
2. Erhitzen der Mischung
- Wenn das zugesetzte Polymer zu irgendeinem Zeitpunkt über dem Mineralöl zu schwimmen scheint, rühren Sie die Mineralöllösung manuell mit einem Metallspatel um, so dass sich das schwimmende Polymer im Mineralöl verteilt. Tragen Sie hitzebeständige Handschuhe.
- Lassen Sie die Mischung bei 160 °C, bis sich das gesamte Polymer aufgelöst hat und die Lösung gleichmäßig gemischt mit einer glatten und homogenen Textur erscheint (~1,5 h).
3. Staubsaugen
Anmerkungen: Befolgen Sie zum Entfernen von Luftblasen je nach verfügbarer Ausrüstung die folgenden Schritte.
- Stellen Sie das heiße Becherglas vorsichtig in die Vakuumkammer und vakuumieren Sie die Proben für 2-3 min auf höchster Stufe (niedrigstes Vakuum). Verwenden Sie einen Metallspatel, um Luftblasen, die sich auf der Oberfläche ansammeln, vorsichtig zu entfernen. Wenn nach diesem Schritt noch Luftblasen vorhanden sind, erhitzen Sie die Mischung erneut und wiederholen Sie den Vakuumschritt, bis alle Luftblasen entfernt sind.
- Schalten Sie den Vakuumofen ein und erhitzen Sie ihn auf 160 °C. Sobald die gewünschte Temperatur erreicht ist, füllen Sie das Becherglas mit der Lösung in den Vakuumofen.
Anmerkungen: Fassen Sie das Becherglas immer mit Hitzeschutzhandschuhen an.- Schalten Sie den Staubsauger auf die höchste verfügbare Stufe (niedrigstes Vakuum) ein. Wenn sich auf der Lösung eine Schaumschicht gebildet hat, schalten Sie das Vakuum aus und entfernen Sie die Blasen mit einem Spatel von der Oberfläche (wiederholen Sie diesen Schritt, bis alle Luftblasen entfernt sind).
- Lassen Sie das Becherglas 1 h im Vakuumschrank auf höchster Vakuumstufe.
Anmerkungen: Um den Vakuumofen sauber zu halten, reinigen Sie die Außenfläche des Becherglases mit einem Papiertuch von Silikonöl.
4. Gießen der Proben in die Form
- Bevor Sie die Proben in Probenformen füllen, entfernen Sie ggf. verbleibende Luftblasen auf der Oberfläche des Gemischs mit einem Spatel.
- Gießen Sie die Lösung vorsichtig in eine geeignete Form, tragen Sie hitzebeständige Handschuhe oder verwenden Sie eine geeignete Schutzausrüstung. Sorgen Sie für ein gleichmäßiges und gleichmäßiges Ausgießen aus geringer Höhe, um die Wahrscheinlichkeit der Bildung von Luftblasen zu verringern (Abbildung 1: Schritt 5). Bei Formen mit komplexen Formen ist die Form vor dem Gießen mit einer dünnen Schicht Öl (außer Mineralöl [z. B. Rizinus- oder Silikonöl]) zu beschichten, um die Entnahme der ausgehärteten Probe zu erleichtern.
Anmerkungen: Das Vorheizen der Formen in einem Ofen kann dazu beitragen, eine höhere Probenhomogenität zu erreichen. - Entfernen Sie nach dem Gießen schnell alle Luftblasen von der Oberseite der Proben mit einem Metallspatel. Wenn sich zahlreiche Luftblasen in der Mischung angesammelt haben, wiederholen Sie den Vakuumschritt, sofern die Art und Form der Form dies zulässt.
- Lassen Sie die Lösung bei Raumtemperatur aushärten. Obwohl kleinere Proben in weniger als 2 Stunden aushärten können, lassen Sie die Proben über Nacht, um das Risiko einer unvollständigen Aushärtung auszuschließen. Lagern Sie die Proben bei Raumtemperatur (Abbildung 1: Schritt 6).
5. Bildaufnahme
- Platzieren Sie das Phantom für die Bildaufnahme im Sichtfeld des Bildgebungsgeräts.
- Führen Sie bei PAI- oder Ultraschallsystemen eine akustische Kopplung der Phantomoberfläche an den Ultraschallwandler durch, z. B. mit Ultraschallgel oder Wasser.
HINWEIS: Wenn das Protokoll korrekt befolgt wurde, sollten keine Inhomogenitäten das Sichtfeld stören. Benutzerdefinierte Phantomhalter können bei der wiederholbaren Probenpositionierung zwischen den Messungen helfen. - Wenn die Erfassungstemperatur von der Lagertemperatur des Phantoms abweicht, lassen Sie die Phantomtemperatur mit der Umgebung stabilisieren.
- Erfassen Sie ein Bild.
6. Messungen zur Materialcharakterisierung
HINWEIS: Der Zweck von Materialcharakterisierungsmessungen ist die Überprüfung der optischen und akustischen Eigenschaften des Materials. Es sei darauf hingewiesen, dass das Protokoll zur Herstellung von Phantomen eine hohe Reproduzierbarkeit gezeigt hat39, so dass die folgenden allgemeinen Messprotokolle nur als Orientierungshilfe dienen, wenn weitere Verifikationsstudien gewünscht werden. Die einzelnen Schritte der Messungen hängen von den verwendeten Charakterisierungsgeräten ab. In dieser Arbeit wurde ein System, das auf einer breitbandigen Durchgangsübertragungs-Substitutionsmethode41 (erhältlich am National Physical Laboratory (NPL), UK) basiert, zur akustischen Charakterisierung und ein hauseigenes Doppel-Integrating-Sphere-System (DIS) (basierend auf 42) zur optischen Charakterisierung verwendet. Der Aufbau der Charakterisierungssysteme ist in der ergänzenden Abbildung 1 dargestellt. Weitere Details zu den Messaufbauten (akustisch43; optisch42,44) und zum Messverfahren39 finden Sie an anderer Stelle. Das Messverfahren sollte entsprechend an das jeweilige Charakterisierungssystem angepasst werden.
- Akustische Charakterisierung
HINWEIS: Die akustischen Charakterisierungsmessungen basieren auf einem System, das einen 10-MHz-Mittenfrequenz-Ultraschallwandler (aktiver Elementdurchmesser von 10 mm) zur Impulserzeugung und ein Breitband-Hydrophon (30 mm aktives Elementdurchmesser bilaminares Membranhydrophon) zur Pulserkennung verwendet (beide in einem mit deionisiertem Wasser gefüllten Wassertank; Abmessungen von 112 cm x 38 cm x 30 cm3). Der Wandler wird von einem Impulsempfänger angetrieben. Die Signale werden mit einem Oszilloskop erfasst. Weitere Details zum Aufbau und Messablauf (inkl. systemspezifischer Typ-B-Einflüsse auf die Messungen) finden Sie in 43.- Bereiten Sie Proben vor, die für den Messaufbau geeignet sind (z. B. in diesem Fall kreisförmige Proben mit einem Durchmesser von 7-8 cm und einer Dicke von 6-9 mm). Stellen Sie sicher, dass die Proben eine homogene Zusammensetzung haben und frei von Verunreinigungen, Luftblasen oder Oberflächenunregelmäßigkeiten sind.
- Messen Sie die Dicke des Prüflings mit Messschiebern und zeichnen Sie die Temperatur des Wassertanks mit einem kalibrierten Thermometer auf.
- Legen Sie die Probe in das System. Stellen Sie sicher, dass die Probe korrekt auf die Komponenten des Systems ausgerichtet ist.
ANMERKUNG: Ein automatisch gesteuerter Probenhalter, der auf einer kardanischen Halterung43 basiert, kann bei der präzisen Steuerung der Drehung und Neigung der Probe helfen. - Erfassen Sie vier akustische Impulse für jeden Messsatz: einen Referenzimpuls durch das Wasser, bei dem keine Probe im akustischen Pfad vorhanden ist; eine Through-Sample-Transmission; und akustische Reflexionen, die am Sender von der Vorder- und Rückseite der Probe empfangen werden.
- Leiten Sie aus den Messungen die akustischen Eigenschaften der Probe ab. Berechnen Sie die Schallgeschwindigkeit c(f ) (in m·s−1) mit der Gleichung (1)43.
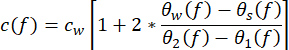 (1)
(1)
c w stellt die temperaturabhängige Schallgeschwindigkeit von Wasser dar, und θ1 (f), θ2 (f), θ w (f) und θs(f) sind die entsprechenden ungewickelten Phasenspektren der frontreflektierten, rückreflektierten, durch Wasser bzw. durch die Abtastung gerichteten Spannungsimpulse. Der frequenzabhängige Dämpfungskoeffizient (αi(f)) des Materials kann mit Hilfe der in Gleichung (2)43 gezeigten Zwei-Proben-Substitutionstechnik abgeleitet werden.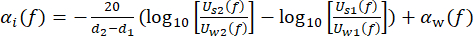 (2)
(2)
U w(f) und Us(f) sind die jeweiligen Spannungsmagnitudenspektren des Durchwasser- und Durchgangsimpulses, αw(f) ist der Dämpfungskoeffizient von Ultraschall (in dB·cm-1) von reinem Wasser bei der spezifischen Wassertanktemperatur45, und d1 und d2 (d2 >d1) sind zwei Probendicken.
ANMERKUNG: Für das vorliegende Protokoll wurde die Dämpfung unter Berücksichtigung der Grenzflächenverluste bewertet, wobei festgestellt wurde, dass ihre Auswirkungen vernachlässigbar sind. - Wiederholen Sie die Messung mehr als dreimal an verschiedenen Stellen des Prüflings. Berechnen Sie den Mittelwert und die Standardabweichung der Messungen, um einen endgültigen Stichprobenwert abzuleiten.
- Optische Charakterisierung
HINWEIS: Für die optische Prüfung wurde ein Doppelulbricht-Kugelsystem (basierend auf 42) verwendet, bei dem zwei Ulbrichtsche Kugeln (50 mm Innendurchmesser) verwendet werden, die über zwei optische Fasern mit zwei Spektrometern verbunden sind. Die Reflexionskugel ist über einen dritten Lichtwellenleiter mit einer Lichtquelle verbunden.- Bereiten Sie Proben vor, die für den Messaufbau geeignet sind (z. B. in diesem Fall rechteckige Proben mit einer Breite von 5,9 cm, einer Höhe von 1,8 cm und einer Dicke zwischen 2 und 3 mm). Stellen Sie sicher, dass die Proben eine homogene Zusammensetzung haben und frei von Verunreinigungen, Luftblasen oder Oberflächenunregelmäßigkeiten sind.
- Schalten Sie die Lichtquelle ein und lassen Sie sie gemäß den Anweisungen des Herstellers stabilisieren (z. B. 15 Minuten).
- Bestimmen Sie die Dicke der Probe mit Nonius-Messschiebern. Geben Sie ggf. den Wellenlängenbereich und die Schrittweite für die Messung an (z. B. 450-900 nm bei einer Schrittweite von 1 nm).
- Notieren Sie die Referenzmessungen für die Transmissions- und Reflexionskugel.
- Führen Sie für die Reflexionskugel zunächst eine Messung mit offenem Anschluss durch, indem Sie den Reflexionswert R0 bei entfernter Transmissionskugel und eingeschalteter Lichtquelle aufzeichnen. Erfassen Sie dann den Reflexionswert R1 mit einem Referenznormal, das vor die Reflexionskugel gehalten wird (Lichtquelle eingeschaltet).
- Führen Sie für die Transmissionskugel zunächst eine Sperrstrahlmessung durch, indem Sie den Transmissionswert T0 bei ausgeschalteter Reflexions- und Transmissionskugel und Lichtquelle aufzeichnen. Führen Sie dann eine Messung des einfallenden Strahls durch, indem Sie den Transmissionswert T1 bei eingeschalteten ausgerichteten Reflexions- und Transmissionskugeln und Lichtquelle aufzeichnen.
ANMERKUNG: Für die Messungen muss auf eine saubere Oberfläche der Kugeln und des Referenzstandards geachtet werden, da das Anhaften von Staub oder anderen Verunreinigungen die Leistung der Komponenten46 beeinträchtigen kann.
- Platzieren Sie die Probe zwischen den Kugeln. Messen Sie die Werte für den Reflexionsgrad Rs und den Transmissionsgrad Ts. Stellen Sie sicher, dass die Probe nicht komprimiert wird, da dies die Messgenauigkeit beeinträchtigen kann. Das Platzieren einer Kugel auf einem motorisierten Tisch kann helfen, den Abstand zwischen den Kugeln genau zu steuern, indem er an die gemessene Probendicke angepasst wird.
- Berechnen Sie die normierten Werte für den Reflexionsgrad M R und den Transmissionsgrad MT mithilfe der Gleichungen (3) und (4)42.
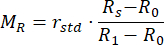 (3)
(3)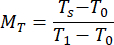 (4)
(4)
RSTD stellt die Intensität dar, die vom 99%-Reflexionsstandard reflektiert wird. - Geben Sie die Messwerte in ein Programm zur inversen Verdopplung (IAD) ein (Quellcode: http://omlc.org/software/iad/)44 , um die optischen Eigenschaften des Materials abzuschätzen.
HINWEIS: Basierend auf früheren Berichten kann der Streuanisotropiefaktor (g) mit g = 0,7 und der Brechungsindex mit n = 1,4 30 angenommen werden. - Wiederholen Sie die Messung mindestens dreimal an verschiedenen Positionen entlang des Prüflings. Berechnen Sie den Mittelwert und die Standardabweichung der Messungen, um einen endgültigen Stichprobenwert abzuleiten.
Repräsentative Ergebnisse
Nach diesem Rezept wurden drei repräsentative Phantomdesigns für den Zweck der photoakustischen Bildgebung erstellt, die auf verschiedene Systemdesigns mit unterschiedlichen optischen Beleuchtungs- und akustischen Detektionsgeometrien abzielen (Abbildung 3A). Wenn die Phantompräparation erfolgreich durchgeführt wird, erscheint das Phantommaterial glatt und homogen ohne eingeschlossene Luftblasen oder Verunreinigungen, und im resultierenden Bild sind keine Artefakte zu sehen (hier visualisiert mit photoakustischer Bildgebung; Abbildung 3B,C). Das Protokoll liefert ein repräsentatives Material mit einer Schallgeschwindigkeit c(f) = 1481 ± 0,4 m·s-1 (entsprechend der Schallgeschwindigkeit von Wasser bei 20 °C40), einer akustischen Dämpfung α(f) = 6,1 ± 0,06 dB·cm-1 (beide bei 5 MHz), optischer Absorption μa(λ) = 0,05 ± 0,005 mm-1 und optischer Streuung μs'(λ) = 1 ± 0,1 mm-1 (beide bei 800 nm) (Die Unsicherheit stellt die Standardabweichung von n = 3 unabhängig voneinander hergestellten Chargen von verschiedenen Bedienern dar; alle Messungen wurden bei Raumtemperatur [20 °C] durchgeführt).
Der optische Streukoeffizient kann durch die Variation vonTiO2 eingestellt werden, während der optische Absorptionskoeffizient durch die Zugabe eines beliebigen öllöslichen Farbstoffs eingestellt werden kann, hier mit Nigrosin demonstriert (Tabelle 2 und Abbildung 3D). Während sich die Werte in Tabelle 2 auf Gewebe mit geringerer Absorption und Streuung konzentrieren, wie z. B. Muskeln oder Brust (Tabelle 1), sind wir bei der Zugabe von Absorbern und Streuern in höheren Konzentrationen auf keine Schwierigkeiten gestoßen. Die Zugabe von optischen Streuern/Absorbern in höheren Konzentrationen kann jedoch längere Beschallungszeiten erfordern, um eine homogene Durchmischung der Lösung zu erreichen.
Die akustische Dämpfung und Schallgeschwindigkeit kann durch Variation der Polymerkonzentration eingestellt werden (Tabelle 3). Hier ist die Abstimmung bisher auf einen Schallgeschwindigkeitsbereich von ~1.450-1.516 m·s-1 beschränkt. Niedrigere Polymerkonzentrationen können zu einer geringen physikalischen Stabilität der Probe führen, was zu einer plastischen Verformung im Laufe der Zeit führt34. Höhere Polymerkonzentrationen führen zu Sprödigkeit und einer ungleichmäßigen Textur des Materials. Die Bandbreite der akustischen Eigenschaften kann dazu beitragen, Gewebe wie Brust oder Fett nachzuahmen (c = 1.450-1.480 m·s−1), kann aber für Gewebe wie Muskeln oder Nieren unzureichend sein (c > 1.520 m·s−1; Tabelle 1).
Häufige Fehlerquellen bei der Phantompräparation sind eine unzureichende Entfernung von Luftblasen und eine inhomogene Durchmischung der Basiskomponenten (Abbildung 4). Dies kann durch Vakuumieren und vorsichtiges Gießen bzw. Rühren/Vortexen minimiert werden.
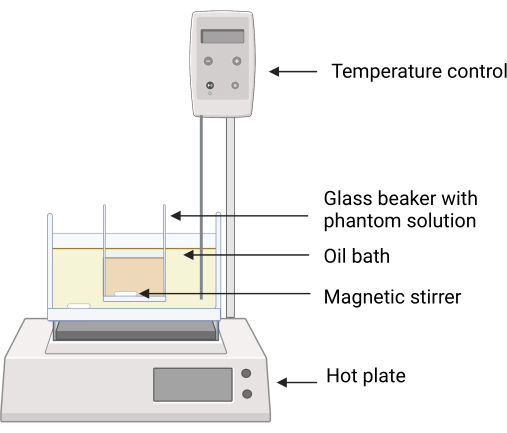
Abbildung 2: Versuchsaufbau für die Phantomherstellung. Der Glasbecher mit den Phantominhaltsstoffen wird mit einer Klemme in das Silikonölbad gestellt, um einen direkten Kontakt zwischen den Oberflächen des Ölbades und dem Glasbecher zu vermeiden. Die Temperaturrückmeldung auf der Heizplatte sorgt für eine sorgfältige Temperaturregelung. Magnetrührer ermöglichen das Mischen sowohl der Silikonöl- als auch der Phantombestandteile. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
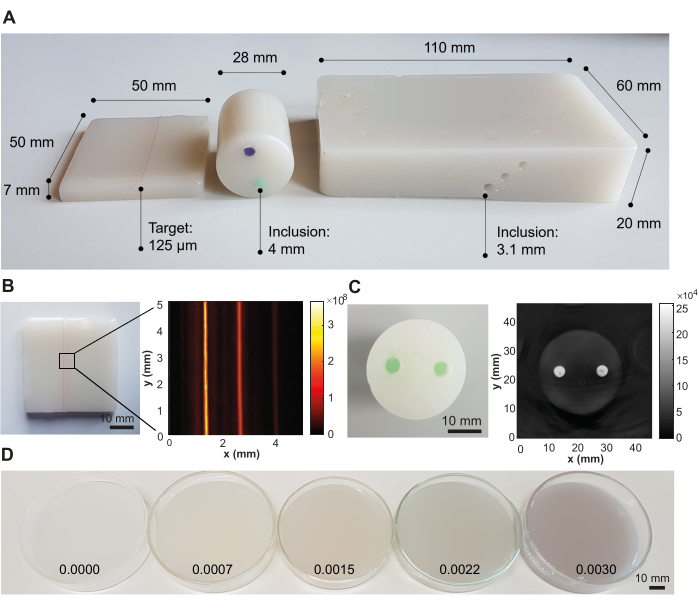
Abbildung 3: Repräsentative Ergebnisse des Phantomherstellungsverfahrens. (A) Verschiedene Phantomdesigns, die Vielseitigkeit für den Einsatz in verschiedenen photoakustischen Bildgebungssystemen zeigen. Links: kleines rechteckiges Phantom mit Strings, die in verschiedenen Tiefen (0,5, 1,5 und 2,5 mm; Abstand zwischen den Targets 1,25 mm) eingebettet sind, um hochauflösende Bildgebungssysteme zu testen; Mitte: zylindrisches Phantom mit zwei Einschlüssen (Abstand zwischen den Einschlüssen von 12 mm) unter Verwendung eines grünen und violetten öllöslichen Farbstoffs, der für die Prüfung von Tomographiesystemen entwickelt wurde; Rechts: Großes rechteckiges Phantom mit Kanälen in verschiedenen Tiefen (6 mm, 10 mm und 14 mm; Einschlussabstand von 3,5 mm), das für die Prüfung eines Handheld-Systems entwickelt wurde. (B) Beispiel für ein photoakustisches Bild des rechteckigen Phantoms mit eingebetteten Strings, aufgenommen bei 532 nm mit einem kommerziellen photoakustischen Bildgebungssystem. (C) Beispiel einer photoakustischen Aufnahme des zylindrischen tomographischen Phantoms, aufgenommen bei 800 nm mit einem kommerziellen photoakustischen Bildgebungssystem. (D) Phantome mit steigenden optischen Absorptionskonzentrationen durch steigende Nigrosinkonzentrationen (Konzentrationen in Gewichtsprozent des Gesamtvolumens des Mineralöls auf dem Bild). Abbildung 3B,C ist von Hacker et al.39 wiedergegeben. Maßstabsbalken = 10 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
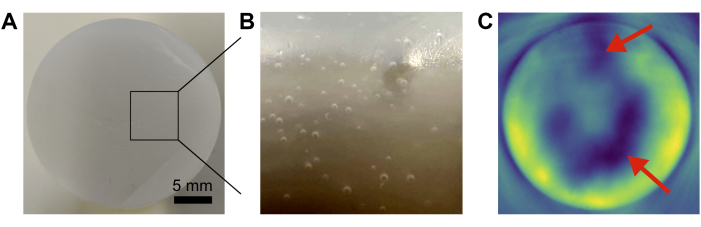
Abbildung 4: Häufige Phantomausfälle . (A,B) Fotos, die Luftblasen zeigen, die in der Basismatrix eingeschlossen sind. (C) Eine unzureichende Durchmischung der Grundkomponenten führt zu Inhomogenitäten (rote Pfeile) im resultierenden photoakustischen Bild. Maßstabsbalken = 5 mm (A). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Tabelle 2: Tabellarische Übersicht über die Abstimmung der optischen Absorptions- (μa) und Streuwerte (μs'). Prozentwerte werden als Gewichtsprozent auf das Gesamtvolumen der Basislösung (Mineralöl, Spalte 1) und auf das Gesamtgewicht des Phantommaterials (Spalte 2) angegeben. Die Nigrosin-Konzentrationen stellen die Gesamtmenge an absolutem Nigrosin (nicht Stammlösung) dar. Alle Proben enthielten 5 % butyliertes Hydroxytoluol als Antioxidans (optional). n = 3 Messungen pro Probe. Eine visuelle Darstellung der Tabelle findet sich in Hacker et al.39. Abkürzung: neg = vernachlässigbar. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 3: Tabellarische Übersicht über die Abstimmung der Werte für die akustische Dämpfung (α) und die Schallgeschwindigkeit (c). Beschrieben durch das Potenzgesetz α 0 f n mit α0und n Parametern, die aus einer nichtlinearen Anpassung der kleinsten Quadrate erhalten werden (n = 4 Messungen pro Stichprobe). F stellt die Frequenz in MHz dar. Prozentwerte werden als Gewichtsprozent zum Gesamtgewicht der Basislösung (Mineralöl) angegeben. Alle Proben enthielten 5 % butyliertes Hydroxytoluol als Antioxidans (optional). Eine visuelle Darstellung der Tabelle findet sich in Hacker et al.39. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Abbildung S1: Aufbau der akustischen und optischen Charakterisierungssysteme, die für die Verifikation verwendet werden. Ein Foto (A) und ein Schema (B) des akustischen Charakterisierungssystems zur Bestimmung des akustischen Dämpfungskoeffizienten und der Schallgeschwindigkeit werden angezeigt. Die einzelnen Systemkomponenten sind auf dem Foto und im Schaltplan mit den Anmerkungen HP (HydroPhone), S (Sample) und T (Transducer) gekennzeichnet. Gezeigt werden ein Foto (C) und ein Schema (D) des doppelt ulbrichten Kugelsystems zur Bewertung des optischen Absorptionskoeffizienten und des reduzierten Streukoeffizienten. Die einzelnen Systemkomponenten sind auf dem Foto und im Schaltplan mit den Anmerkungen S (Sample), RS (Reflectance Sphere), TS (Transmission Sphere), OF (Optical Fiber) und MS (Motorized Stage) gekennzeichnet. Diese Abbildung ist von Hacker et al. 39 übernommen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Hier wird ein Protokoll vorgestellt, das darauf abzielt, ein vielseitiges Rezept für ein stabiles, biologisch relevantes Material bereitzustellen, das zur Herstellung von Phantomen für Kalibrierungsmessungen und Standardisierung in multimodalen akustischen und optischen biomedizinischen Bildgebungsanwendungen verwendet werden kann. Es hat sich bereits gezeigt, dass das Material über die Zeitstabil ist 39, eine hohe Reproduzierbarkeit von Charge zu Charge aufweist, sicher in der Anwendung ist und aus leicht verfügbaren, kostengünstigen Inhaltsstoffen von wissenschaftlichen Standardlieferanten besteht. Die Materialeigenschaften sind unabhängig voneinander über relevante akustische und optische Bereiche einstellbar. Darüber hinaus ist es mechanisch robust und unlöslich in Wasser, wodurch es einer rauen Behandlung standhält, und es ist inert gegenüber wässrigen Haftvermittlern, die in der Ultraschall-/Photoakustikforschung verwendet werden. Es wurde hervorgehoben, dass verschiedene Phantomdesigns mit unterschiedlichen Arten von Einschlüssen erstellt werden können, die aus demselben oder aus unterschiedlichen Materialtypen bestehen. Angesichts dieser Eigenschaften erfüllt das Material die oben genannten Schlüsselkriterien für ein ideales biophotonisches Phantom und weist entscheidende Vorteile im Vergleich zu anderen bestehenden gewebeähnlichen Materialien auf3. Durch die detaillierte Beschreibung des genauen Herstellungsprozesses hoffen wir, Abweichungen, die sich aus dem Herstellungsverfahren ergeben, zu minimieren und so seine Verwendung für die Kalibrierung, Validierung und Verfolgung der Leistung von Bildgebungssystemen zu optimieren.
Es wurden zwei wichtige Schritte identifiziert, die für den Herstellungsprozess entscheidend sind. Zunächst müssen die Zutaten gründlich gemischt und gleichmäßig erhitzt werden, um ein homogenes Material zu erhalten. Die Verwendung eines Ultraschallgeräts und eines Magnetrührers zum Mischen und eines Ölbades zum Erhitzen sorgt für eine gleichmäßige Verteilung der Materialkomponenten innerhalb der Basismatrix. Es ist darauf zu achten, dass das Ölbad keine sehr hohen Temperaturen (>180 °C) erreicht, da dies zu einer Oxidation der Materialbestandteile und damit zu gelblichen Verfärbungen führt. Manuelles Rühren kann den Mischprozess unterstützen und eine unzureichende Erwärmung durch die Material-Luft-Grenzfläche ausgleichen. Die Zeit für die Beschallung und das Mischen muss möglicherweise verlängert werden, wenn eine höhere Konzentration vonTiO2 und/oder Polymeren verwendet wird, um eine homogene Zusammensetzung des Materials zu gewährleisten. Zweitens müssen Luftblasen entfernt werden, um die Bildung von Heterogenitäten innerhalb der Basismatrix zu verhindern. Während dies mit einer Vakuumpumpe oder einem Ofen erreicht werden kann, sollte auch ein vorsichtiges Gießen aus geringer Höhe geübt werden, um Lufteinschlüsse im Material zu minimieren.
Ein wesentlicher Vorteil des Materials sind seine thermoplastischen Eigenschaften (abgeleitet vom SEBS-Polymer), die es ermöglichen, es wieder zu erhitzen und umzuformen, ohne dass seine akustischen und optischen Eigenschaften wesentlich beeinträchtigt werden39. Das Nachheizen muss jedoch schrittweise und vorsichtig erfolgen, da das Material bei zu schneller Erwärmung leicht verbrennen und oxidieren kann. Auch das Nachheizen wird schwieriger, wenn höhere LDPE-Konzentrationen verwendet werden, da LDPE nicht das gleiche thermoplastische Verhalten wie SEBS aufweist.
Einige Einschränkungen des Protokolls bleiben bestehen. Aufgrund der hohen Schmelztemperatur der Polymere (150 °C) müssen Phantomformen aus einem hitzebeständigen Material wie Glas oder Edelstahl hergestellt werden. Darüber hinaus ist das Material im flüssigen Zustand ziemlich viskos, wenn eine hohe Polymerkonzentration zur Abstimmung der akustischen Eigenschaften verwendet wird, was das Füllen kleiner Abbildungsziele erschwert. Schließlich ist die Abstimmung der akustischen Eigenschaften bisher auf einen Schallgeschwindigkeitsbereich von ~1450-1.516 m·s-1 beschränkt, der die Nachahmung von Geweben wie Brust oder Fett unterstützt (c = 1.450-1.480 m·s−1), aber für Gewebe wie Muskeln oder Nieren unzureichend sein kann (c > 1.520 m·s−1). Die damit einhergehende Änderung der akustischen Dämpfung sollte ebenfalls berücksichtigt werden.
Hier haben wir die Anwendung des Materials als stabiles Phantom für Ultraschall- und optische Bildgebungsanwendungen hervorgehoben. Copolymer-in-Öl-Materialien haben sich jedoch auch in Elastographie-Anwendungen als wertvoll erwiesen35 und könnten möglicherweise eine Kompatibilität mit weiteren Bildgebungsmodalitäten wie der Magnetresonanztomographie ermöglichen. Ein erhöhter anatomischer Realismus der Phantome kann mit 3D-gedruckten Formen erreicht werden, wie in ähnlichen Studien gezeigt wurde 29,47,48,49. Frühe Studien haben auch die 3D-Druckbarkeit des Materials selbst nachgewiesen, was seine Flexibilität in Bezug auf Verarbeitung und Herstellung weiter erhöht. Diese Entwicklungen unterstreichen das spannende Zukunftspotenzial des Materials als weit verbreitetes, stabiles Phantommedium für multimodale Bildgebungsanwendungen.
Offenlegungen
Sarah Bohndiek hat zuvor Forschungsunterstützung von CYBERDYNE INC und iThera Medical GmbH, Anbietern von photoakustischen Bildgebungsinstrumenten, erhalten. Die anderen Autoren haben keinen Interessenkonflikt in Bezug auf das vorliegende Manuskript offenzulegen.
Danksagungen
LH wurde durch das MedAccel-Programm von NPL finanziert, das vom Industrial Strategy Challenge Fund des Ministeriums für Wirtschaft, Energie und Industriestrategie finanziert wurde. JMG wurde von der Deutschen Forschungsgemeinschaft (DFG) im Rahmen des Projekts GR 5824/1 gefördert. JJ bedankt sich für die finanzielle Unterstützung durch den Preis der Academy of Medical Sciences Springboard (REF: SBF007\100007). SEB bedankt sich für die Unterstützung durch Cancer Research UK unter der Fördernummer C9545/A29580. AMI, BZ und SR wurden vom britischen Ministerium für Wirtschaft, Energie und Industriestrategie durch die Finanzierung des Nationalen Messsystems unterstützt. Abbildung 1 und Abbildung 2 wurden mit BioRender erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Low-density Polyethylene (LDPE) | Alfa Aesar | 43949.30 CAS: 9002-88-4 | 6.70 g 5.8% w/w |
| Mineral oil | Sigma Aldrich | 330779-1L CAS: 8042-47-5 | 83.80 g 72.5% w/w |
| Nigrosin | Sigma Aldrich | 211680-100G CAS: 11099-03-9 | 0.4 g |
| Polystyrene-block-poly(ethylene-ran-butylene)-block-polystyrene (SEBS) | Sigma Aldrich | 200557-250G CAS: 66070-58-4 | 25.14 g 21.7% w/w |
| Silicone oil for oil bath | Sigma Aldrich | 85409-1L CAS: 63148-62-9 ~1 L (depending on size of oil bath) | |
| Titanium(IV) oxide, anatase (TiO2) | Sigma Aldrich | 232033 CAS: 1317-70-0 | 0.15 g |
| Antioxidant (optional; e.g., butylated hydroxytoluene) | Sigma Aldrich | W218405-1KG-K CAS: 128-37-0 | may be added to prevent discolouration if higher fabrication temperatures are used |
| Oil-solule dyes for inclusions (optional) | e.g., Caligo safe wash relief inks, Cranfield Colours, Cwmbran, UK* | may be added depending on preferred absorption | |
| Bath Sonicator | Ultrawave Ltd, UK* | U500H Ultrasonic Cleaning Bath* | ideally with temperature control; recommended operating frequencies between 30-50 kHz) |
| Crystallising dish for silicone oil bath (up to +200 °C) | any suitable supplier | (ext. diameter ~140 mm for 250 mL glass beaker) | |
| Glass beaker (~250 mL); glass sample dishes/phantom mould | any suitable supplier | ||
| Hot plate with magnetic stirrer and thermoregulator (external probe thermocouple) with maximum temperature of > 200 °C | Thermo Fisher Scientific, UK* | Velp Scientifica AREC.X Digital Ceramic Hot Plate Stirrer* | |
| Laboratory scales / scientific balances accurate to 0.01 g | any suitable supplier | ||
| Metallic spatula | any suitable supplier | ||
| Vaccuum oven or vaccum chamber | Memmert, Germany (Vacuum oven)* Cole-Parmer Instrument Company, UK (Vaccum chamber)* | VO29 (Vacuum oven) DWK Life Sciences (Kimble) Glass Vacuum Desiccator with Collar (Vaccum chamber)* | |
| 1. Acoustic characterization system* | |||
| Hydrophone | GEC Marconi | 30 mm active element diameter bilaminar membrane hydrophone | |
| Oscilloscope | Tektronix UK, Bracknell, UK | DPO 7254 | |
| Pulser–receiver | Olympus NDT, Waltham, MA, USA | Olympus 5073PR | |
| Sample holder | Newport Spectra-Physics, Didcot, UK | Newport 605-4 Series Low-Distortion Axial Clamping Gimbal Optic Mount | may require additional adaptor for sample holding |
| Thermometer | G. H. Zeal, London, UK | UKAS-calibrated IP 39C spirit-in-glass thermometer | |
| Ultrasound transducer | Force Technology, Brondby, Denmark | Transducer of active element diameter 10 mm | |
| Vernier callipers | any suitable supplier | ||
| Water tank filled with deionized water | any suitable supplier | requires sufficent size (e.g., dimensions 112 × 38 × 30 cm3) | |
| 2.Optical characterization system* | |||
| Integrating sphere (two) | Avantes, Apeldoorn, the Netherlands | AvaSphere-50, 50 cm internal diameter | |
| Light source | Avantes, Apeldoorn, the Netherlands | Avalight-HAL-s-mini | |
| Motorized stage (optional) | Thorlabs, | Thorlabs MTS50 | |
| Optical fibres (three) | any suitable supplier | ||
| Reflectance standard | Labsphere, North Sutton, USA | 99%, white, 1.25" diameter, USRS-99-010, AS-01158-060 | |
| Spectrometer | Avantes, Apeldoorn, the Netherlands | Starline Avaspec-2048 | |
| Software | |||
| Data acqusition software (e.g., Labview) | National Instruments, Austin, TX, USA | ||
| Data analysis software (e.g., Matlab) | Mathworks, Natick, USA | ||
| Inverse adding doubling (IAD) program | Source code: http://omlc.org/software/iad/ | ||
| *Please note that similar equipment may also be used. |
Referenzen
- Waterhouse, D. Translation of optical imaging biomarkers: opportunities and challenges. Nature Biomedical Engineering. 3 (5), 339-353 (2019).
- O'Connor, J. P. B., et al. Imaging biomarker roadmap for cancer studies. Nature Reviews Clinical Oncology. 14 (3), 169-186 (2017).
- Hacker, L., et al. Criteria for the design of tissue-mimicking phantoms for the standardization of biophotonic instrumentation. Nature Biomedical Engineering. 6 (5), 541-558 (2022).
- Laufer, J., Zhang, E., Beard, P. Evaluation of absorbing chromophores used in tissue phantoms for quantitative photoacoustic spectroscopy and imaging. IEEE Journal of Selected Topics in Quantum Electronics. 16 (3), 600-607 (2010).
- Cook, J. R., Bouchard, R. R., Emelianov, S. Y. Tissue-mimicking phantoms for photoacoustic and ultrasonic imaging. Biomedical Optics Express. 2 (11), 3193-3206 (2011).
- Xia, W., et al. Poly(vinyl alcohol) gels as photoacoustic breast phantoms revisited. Journal of Biomedical Optics. 16 (7), 075002 (2011).
- Manohar, S., et al. Photoacoustic mammography laboratory prototype: imaging of breast tissue phantoms. J Biomed Opt. 9, 1172 (2004).
- Blumenröther, E., Melchert, O., Wollweber, M., Roth, B. Detection, numerical simulation and approximate inversion of optoacoustic signals generated in multi-layered PVA hydrogel based tissue phantoms. Photoacoustics. 4 (4), 125-132 (2016).
- Kharine, A., et al. Poly(vinyl alcohol) gels for use as tissue phantoms in photoacoustic mammography. Physics in Medicine and Biology. 48 (3), 357-370 (2003).
- Spirou, G. M., Oraevsky, A. A., Vitkin, I. A., Whelan, W. M. Optical and acoustic properties at 1064 nm of polyvinyl chloride-plastisol for use as a tissue phantom in biomedical optoacoustics. Physics in Medicine and Biology. 50 (14), N141-N153 (2005).
- Bohndiek, S. E., Bodapati, S., Van De Sompel, D., Kothapalli, S. -. R., Gambhir, S. S. Development and application of stable phantoms for the evaluation of photoacoustic imaging instruments. PLoS One. 8 (9), e75533 (2013).
- Fonseca, M., Zeqiri, B., Beard, P. C., Cox, B. T. Characterisation of a phantom for multiwavelength quantitative photoacoustic imaging. Physics in Medicine and Biology. 61 (13), 4950-4973 (2016).
- Vogt, W. C., Jia, C., Wear, K. A., Garra, B. S., Joshua Pfefer, T. Biologically relevant photoacoustic imaging phantoms with tunable optical and acoustic properties. Journal of Biomedical Optics. 21 (10), 101405 (2016).
- Dantuma, M., van Dommelen, R., Manohar, S. Semi-anthropomorphic photoacoustic breast phantom. Biomedical Optics Express. 10 (11), 5921-5939 (2019).
- Jeong, E., et al. Fabrication and characterization of PVCP human breast tissue-mimicking phantom for photoacoustic imaging. BioChip Journal. 11, 67-75 (2017).
- Jia, C., Vogt, W. C., Wear, K. A., Pfefer, T. J., Garra, B. S. Two-layer heterogeneous breast phantom for photoacoustic imaging. Journal of Biomedical Optics. 22 (10), 1-14 (2017).
- Madsen, E. L., Hobson, M. A., Shi, H., Varghese, T., Frank, G. R. Stability of heterogeneous elastography phantoms made from oil dispersions in aqueous gels. Ultrasound in Medicine & Biology. 32 (2), 261-270 (2006).
- Culjat, M. O., Goldenberg, D., Tewari, P., Singh, R. S. A review of tissue substitutes for ultrasound imaging. Ultrasound in Medicine & Biology. 36 (6), 861-873 (2010).
- Zell, K., Sperl, J. I., Vogel, M. W., Niessner, R., Haisch, C. Acoustical properties of selected tissue phantom materials for ultrasound imaging. Physics in Medicine and Biology. 52 (20), N475-N484 (2007).
- Lazebnik, M., Madsen, E. L., Frank, G. R., Hagness, S. C. Tissue-mimicking phantom materials for narrowband and ultrawideband microwave applications. Physics in Medicine and Biology. 50 (18), 4245-4258 (2005).
- Ramnarine, K. V., Anderson, T., Hoskins, P. R. Construction and geometric stability of physiological flow rate wall-less stenosis phantoms. Ultrasound in Medicine & Biology. 27 (2), 245-250 (2001).
- Pogue, B. W., Patterson, M. S. Review of tissue simulating phantoms for optical spectroscopy, imaging and dosimetry. Journal of Biomedical Optics. 11 (4), 041102 (2006).
- Lamouche, G., et al. Review of tissue simulating phantoms with controllable optical, mechanical and structural properties for use in optical coherence tomography. Biomedical Optics Express. 3 (6), 1381-1398 (2012).
- Bohndiek, S. E., Van de Sompel, D., Bodapati, S., Kothapalli, S. R., Gambhir, S. S. Stable phantoms for characterization of photoacoustic tomography (PAT) systems. Design and Performance Validation of Phantoms Used in Conjunction with Optical Measurement of Tissue V. 858308, 30-35 (2013).
- Fenollar, O., Sanchez-Nacher, L., Garcia-Sanoguera, D., López, J., Balart, R. The effect of the curing time and temperature on final properties of flexible PVC with an epoxidized fatty acid ester as natural-based plasticizer. Journal of Materials Science. 44, 3702-3711 (2009).
- Fonseca, M., Zeqiri, B., Beard, P., Cox, B. Characterisation of a PVCP-based tissue-mimicking phantom for quantitative photoacoustic imaging. European Conference on Biomedical Optics. , 953911 (2015).
- Heudorf, U., Mersch-Sundermann, V., Angerer, J. Phthalates: toxicology and exposure. International Journal of Hygiene and Environmental Health. 210 (5), 623-634 (2007).
- Maneas, E., et al. Gel wax-based tissue-mimicking phantoms for multispectral photoacoustic imaging. Biomed. Opt. Express. 9 (3), 1151-1163 (2018).
- Maneas, E., et al. Anatomically realistic ultrasound phantoms using gel wax with 3D printed molds. Physics in Medicine and Biology. 63 (1), 015033 (2018).
- Jones, C. J. M., Munro, P. R. T. Stability of gel wax based optical scattering phantoms. Biomedical Optics Express. 9 (8), 3495-3502 (2018).
- Ivory, A. M., Shah, A., Rajagopal, S., Zeqiri, B. Development and investigation of the acoustic properties of tissue-mimicking materials for photoacoustic imaging techniques. IEEE International Ultrasonics Symposium. IEEE. , 1489-1492 (2019).
- Grillo, F. W., Cabrelli, L. C., Sampaio, D. R. T., Carneiro, A. A. O., Pavan, T. Z. Glycerol in oil-based phantom with improved performance for photoacoustic imaging. 2017 IEEE International Ultrasonics Symposium. IEEE. , 1-4 (2017).
- Cabrelli, L. C., et al. Oil-based gel phantom for ultrasound and optical imaging. Biophotonics South America. SPIE. 9531, 40-46 (2015).
- Cabrelli, L. C., et al. Stable phantom materials for ultrasound and optical imaging. Physics in Medicine and Biology. 62 (2), 432-447 (2017).
- Oudry, J., Bastard, C., Miette, V., Willinger, R., Sandrin, L. Copolymer-in-oil phantom materials for elastography. Ultrasound in Medicine & Biology. 35 (7), 1185-1197 (2009).
- Suzuki, A., et al. Oil gel-based phantom for evaluating quantitative accuracy of speed of sound measured in ultrasound computed tomography. Ultrasound in Medicine & Biology. 45 (9), 2554-2567 (2019).
- Cabrelli, L. C., Grillo, F. W., Carneiro, A. A. O., Pavan, T. Z. Copolymer-in-oil tissue-mimicking material with tunable acoustic properties. 2016 IEEE International Ultrasonics Symposium. IEEE. , 1-4 (2016).
- Cabrelli, L. C., et al. Copolymer-in-oil phantoms for photoacoustic imaging. 2015 IEEE International Ultrasonics Symposium. IEEE. , 1-4 (2015).
- Hacker, L., et al. A copolymer-in-oil tissue-mimicking material with tuneable acoustic and optical characteristics for photoacoustic imaging phantoms. IEEE Transactions on Medical Imaging. 40 (12), 3593-3603 (2021).
- Greenspan, M., Tschiegg, C. E. Speed of sound in water by a direct method. Journal of Research of the National Bureau of Standards. 59 (4), 249-254 (1957).
- Zeqiri, B., Scholl, W., Robinson, S. P. Measurement and testing of the acoustic properties of materials: a review. Metrologia. 47 (2), S156-S171 (2010).
- Pickering, J. W., et al. Double-integrating-sphere system for measuring the optical properties of tissue. Applied Optics. 32 (4), 399-410 (1993).
- Rajagopal, S., Sadhoo, N., Zeqiri, B. Reference characterisation of sound speed and attenuation of the IEC agar-based tissue-mimicking material up to a frequency of 60 MHz. Ultrasound in Medicine & Biology. 41 (1), 317-333 (2015).
- Prahl, S. A. Everything I think you should know about Inverse Adding-Doubling. Oregon Medical Laser Center, St. Vincent Hospital. 1344, 1-74 (2011).
- Pinkerton, J. M. M. The absorption of ultrasonic waves in liquids and its relation to molecular constitution. Proceedings of the Physical Society. Section B. 62 (2), 129-141 (1949).
- Hu, D., Lu, R., Huang, Y., Ying, Y., Fu, X. Effects of optical variables in a single integrating sphere system on estimation of scattering properties of turbid media. Biosystems Engineering. 194, 82-98 (2020).
- Grillo, F. W., et al. Patient-specific neurosurgical phantom: assessment of visual quality, accuracy, and scaling effects. 3D Printing in Medicine. 4 (1), 3 (2018).
- Nikitichev, D. I., et al. Construction of 3-dimensional printed ultrasound phantoms with wall-less vessels. Journal of Ultrasound in Medicine. 35 (6), 1333-1339 (2016).
- West, S. J., et al. Development of an ultrasound phantom for spinal injections with 3-dimensional printing. Regional Anesthesia and Pain Medicine. 39 (5), 429-433 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten