Ein angepasster optischer Dichte-basierter Mikrotiterplatten-Assay zur Charakterisierung der Actinobacteriophagen-Infektion
In diesem Artikel
Zusammenfassung
Zur Quantifizierung des langfristigen Bakterienwachstums in Gegenwart von Bakteriophagen wird eine auf optischer Dichte basierende Mikrotiterplattenmethode beschrieben, die für Actinomyceten und andere langsam wachsende Bakterien geeignet ist. Diese Methode umfasst Modifikationen zur Reduzierung der Verdunstung und Deckelkondensation sowie R-Code zur Berechnung von Virusinfektionsmetriken, einschließlich der Fläche unter der Kurve, des Wachstumsmaximums und der relativen Virulenz.
Zusammenfassung
Bakteriophagen sind ein wichtiger Bestandteil der natürlichen Umwelt und haben eine starke Fähigkeit, Bakterienpopulationen zu formen. Um zu verstehen, wie einzelne Phagen mit langsam wachsenden bakteriellen Wirten wie Actinomyceten interagieren, wird eine einfache und zuverlässige Methode zur Quantifizierung des langfristigen Bakterienwachstums in Gegenwart von Phagen benötigt. Spektralphotometrische Mikroplatten-Reader ermöglichen wiederholte Messungen mit hohem Durchsatz, aber die Inkubation eines kleinen Volumens über einen längeren Zeitraum kann technische Herausforderungen mit sich bringen. Bei diesem Verfahren wird eine Standard-Mikrotiterplatte mit 96 Wells so angepasst, dass Phagen und Bakterien 96 Stunden lang ohne Sub-Sampling kultiviert werden können, wobei das Bakterienwachstum alle 8 Stunden mit spektrophotometrischen Absorptionswerten aufgezeichnet wird. Diese optischen Dichtewerte werden mit R analysiert, um Infektionsmetriken zu erhalten, einschließlich der prozentualen Wachstumshemmung, der relativen Virulenz und des Stacy-Ceballos-Index. Die hier beschriebenen Methoden bieten eine effektive Möglichkeit zur Durchführung und Analyse von Experimenten mit Mikrotiterplatten-Wachstumskurven über einen längeren Zeitraum und beinhalten Modifikationen zur Reduzierung der Verdunstung und Deckelkondensation. Diese Protokolle ermöglichen mikrotiterplattenbasierte Assays von Interaktionen zwischen langsam wachsenden bakteriellen Wirten und ihren Bakteriophagen.
Einleitung
Bakteriophagen oder Phagen sind Viren, die Bakterien infizieren. Sie sind die zahlreichsten biologischen Einheiten auf dem Planeten1, und es ist allgemein anerkannt, dass Bakteriophagen die bakterielle Evolution und die Ökosystemprozesse beeinflussen 2,3,4. Es gibt mehrere Methoden zur Beschreibung, Messung und Analyse des Bakteriophagen-Wirtsbereichs 8 und der Infektionsdynamik5,6, darunter Agar-basierte Methoden wie die Doppelschicht-Agar-Methode7 und optische Dichte-basierte Mikrotiterplattenmethoden8,9,10,11,12. Jede Methode hat ihre eigenen Vor- und Nachteile. Aufgrund ihrer Effizienz sind Beschichtungstests mit der Doppelschicht-Agar-Methode der "Goldstandard" für Host-Range-Assays, aber diese Methode ist zeit- und arbeitsintensiv9. Schnelle Mikrotiterplatten-Methoden, die Ergebnisse innerhalb von 24 Stunden oder weniger liefern, liefern hervorragende Ergebnisse für schnell wachsende bakterielle Wirte wie Escherichia coli 9,10,11,12, sind aber zu kurz, um das Fortschreiten der Bakteriophageninfektion in langsamer wachsenden bakteriellen Wirten wie Actinomyceten7,13,14,15 zu zeigen.
Ein auf optischer Dichte basierender Mikrotiterplatten-Assay, der für schnell wachsende Bakterien entwickelt wurde, kann nicht über mehrere Tage hinweg durchgeführt werden, um die Infektionsdynamik in einem langsam wachsenden Wirtsbakterium zu charakterisieren, ohne dass eine Verdunstung stattfindet und künstlich hohe Bakteriendichten entstehen. Um vergleichbare Hochdurchsatzdaten über die Infektionsdynamik von Bakteriophagen für langsam wachsende Bakterienarten zu erhalten, sind daher spezielle Techniken erforderlich, die für diese Bakterien angepasst sind.
Die hier vorgestellte Mikrotiterplattenmethode reduziert die Verdunstung, so dass langsam wachsende Bakterien über einen längeren Zeitraum von 96 h mit einem Phagen kokultiviert werden können und Untersuchungen der Phageninfektionsdynamik und des Wirtsspektrums möglich sind. Diese Methode zeigt auch den Stacy-Ceballos-Index16, eine auf optischer Dichte basierende Metrik, die Virulenzvergleiche zwischen unterschiedlichen Wirtsvirussystemen ermöglicht.
Protokoll
Während dieses Protokoll für Gordonia terrae geschrieben wurde, wurde es auch erfolgreich für Gordonia lacunae, Gordonia rubripertincta und Gordonia westfalica verwendet.
1. Vorbereitung der Bakterien
- In einer Biosicherheitswerkbank wird eine einzelne Kolonie von Gordonia terrae CAG3 nach der guten mikrobiologischen Praxis17 in einen sterilen 1-Liter-Prallkolben mit 200 ml Pepton-Hefe-Calcium-Bouillon18 (PYCa) mit 0,01 mg/ml Cycloheximid beimpft (siehe Materialtabelle).
- Inkubieren Sie den Kolben bei 30 °C unter Schütteln bei 250 U/min, bis die Kultur gesättigt ist, oder 3 Tage lang7.
- Die gesättigte G. terrae-Kultur wird seriell in PYCa-Brühe verdünnt und jeweils 100 μl der 10−4-, 10−5- und 10−6-Verdünnungen auf den PYCa-Platten 19,20 verteilt. Kühlen Sie die unverdünnte gesättigte Kultur bei 4 °C.
- Inkubieren Sie die ausgebreiteten Platten invertiert für 3 Tage bei 30 °C.
- Bestimmen Sie nach der Inkubation eine "zählbare Platte", eine Platte mit 20-200 Kolonien. Zählen Sie die Anzahl der Kolonien auf dieser Platte und berechnen Sie die koloniebildenden Einheiten pro Milliliter (KBE/ml)19,20.
- Verdünnen Sie die gesättigte Kultur mit PYCa-Brühe auf 4,0 x 106 KBE/ml Bakterien.
2. Phagenvorbereitung
ANMERKUNG: Die berichteten repräsentativen Ergebnisse wurden mit dem Gordonia-Phagen DelRio21 erzielt, einem gemäßigten Bakteriophagen, der auf G. terrae isoliert wurde. Diese Methoden wurden auch bei anderen Gordonia-Phagen erfolgreich eingesetzt.
- Ausgehend von einem isolierten Bakteriophagen wird die Phagenprobe in Phagenpuffer7 nacheinander auf eine Verdünnung von 1 x 10−8 verdünnt. Führen Sie einen doppellagigen Agar-Phagentiter-Assay7 durch, indem 0,3 ml der gesättigten G. terrae-Kultur mit 10 μl jeder Phagenverdünnung infiziert werden. Nach einer 5-10-minütigen Inkubation bei Raumtemperatur wird die Bakterien-Phagen-Mischung mit 3 ml PYCa Top Agar kombiniert und auf PYCa Agarplatten gegossen.
- Inkubieren Sie die Platten invertiert bei 30 °C für 3 Tage oder bis sich Plaques bilden7.
- Identifizieren Sie nach der Inkubation eine "zählbare Platte", eine Platte mit 20-200 Plaques. Zählen Sie die Anzahl der Plaques auf dieser Platte und berechnen Sie die plaquebildenden Einheiten pro Milliliter (pfu/ml)7.
3. Mikrotiterplatten-Präparation
HINWEIS: Für diese Methode sollten 96-Well-Mikrotiterplatten mit flachem Boden (siehe Materialtabelle) verwendet werden. Die gesamte Plattenvorbereitung und -beladung muss in einer Biosicherheitswerkbank durchgeführt werden, und es sollte eine gute mikrobiologische Praxis17angewendet werden.
- Bereiten Sie die Anti-Beschlag-Deckelbeschichtungslösung vor, indem Sie 100 μl Triton-X 100, 40 ml 100 % Isopropanol und 160 ml deionisiertes Wasser22 kombinieren. Zum Mischen umrühren und bei Raumtemperatur lagern.
- Geben Sie in einer Biosicherheitswerkbank 6 ml Deckelbeschichtungslösung auf die Innenfläche eines sterilen 96-Well-Mikrotiterplattendeckels, halten Sie den Deckel an den Rändern fest und drehen Sie ihn, um sicherzustellen, dass er von der Lösung bedeckt ist. Lassen Sie die Lösung 20 Sekunden lang auf dem Deckel einwirken, gießen Sie dann die Lösung ab und drehen Sie den Deckel schräg auf ein autoklaviertes Papiertuch, bis der Deckel vollständig trocken ist, was normalerweise 35-45 Minuten dauert. Achten Sie darauf, den Deckel an den Rändern festzuhalten.
- Bereiten Sie 20 ml 0,1%ige Agarose in Wasser für jede 96-Well-Mikrotiterplatte vor und erhitzen Sie sie in der Mikrowelle, um die Agarose zu schmelzen.
- Sobald die Agarose auf 50-60 °C abgekühlt ist, pipettieren Sie 100 μl der 0,1%igen Agarose in alle Zwischenräume zwischen den Vertiefungen der Platte und 200 μl Agarose in die Vertiefungen in Reihe A und Reihe H sowie Spalte 1, Spalte 2, Spalte 11 und Spalte 1223 (Abbildung 1).
4. Beladen der Platte mit Bakterien und Phagen
Anmerkungen: Die gesamte Plattenvorbereitung und -beladung muss in einer Biosicherheitswerkbank durchgeführt werden, und es sollte eine gute mikrobiologische Praxis17 angewendet werden.
- Die 96-Well-Platte enthält 75 μl 2,0 x 106 KBE/ml Bakterien in jeder Vertiefung9. Verdünnen Sie die 4,0 x 106 KbE/ml Bakterienkultur 1:1 mit 2x PYCa-Brühe auf 2,0 x 106 KbE/ml. Bereiten Sie 5 ml pro 96-Well-Platte vor.
- Das Phagenlysat wird mit Phagenpuffer7 verdünnt, um jeweils 1 ml mit den Konzentrationen 2,0 x 106 pfu/ml, 2,0 x 105 pfu/ml und 2,0 x 104 pfu/ml herzustellen. Dies ermöglicht eine Vielzahl von Infektionen (MOI) von 1, 0,1 und 0,01 innerhalb der Mikrotiterplatte9.
- Um die Mikrotiterplatte zu laden, nehmen Sie eine Platte, die mit Antibeschlaglösung und Agarose präpariert wurde, und pipettieren Sie 75 μl der 2,0 x 106 KBE/ml Bakterien in die Säulen 3-10 (siehe Abbildung 1).
- Geben Sie in Spalte 3 und Spalte 4 75 μl sterilen Phagenpuffer in jede Vertiefung, um als No-Phagen-Positivkontrolle zu dienen, gemäß Abbildung 1, und pipettieren Sie nach jeder Zugabe auf und ab, um zu mischen. Geben Sie 75 μl des 2,0 x 10 6 pfu/ml Phagen in die Säule 5 und Spalte 6, 75 μl des 2,0 x 105 pfu/ml Phagen in die Spalten 7 und 8 und 75 μl des 2,0 x 104 pfu/ml Phagen in die Spalten 9 und 10 und pipettieren Sie nach oben und unten, um nach jeder Zugabe zu mischen.
- Kleben Sie beide kurzen Seiten der Platte mit 0,5-Zoll-Beschriftungsband ab, um die Platte teilweise abzudichten und gleichzeitig einen Gasaustausch zu ermöglichen.
5. Inkubations- und Absorptionsmessung
- Sobald die Platten mit Bakterien und Phagen beladen sind, legen Sie sie bei 250 U/min auf einen Mikroplattenschüttler und inkubieren Sie sie bei 30 °C.
- Inkubieren Sie die Platten 96 h lang und führen Sie ab Stunde 16 alle 8 Stunden eine optische Dichtemessung bei 600 nm auf einem Mikroplatten-Reader durch. Legen Sie die Platten zwischen den Messungen wieder in den Shaker.
HINWEIS: Es wurden Messzeiträume von 4, h 6 h, 8 h und 12 h ausgewertet, beginnend bei Stunde 0, und es wurde festgestellt, dass ein Probenahmezeitraum von 8 Stunden, der 16 h nach der Infektion beginnt, die Gordonia-Phagen-Interaktionen am besten erfasst. - Überwachen Sie den Deckel während des gesamten Experiments auf Kondensation. Wenn Kondensation beobachtet wird, ersetzen Sie den Deckel durch einen anderen, gemäß Schritt 3.2 beschichteten Deckel.
- Generieren Sie Kontroll- und Infektionswachstumskurven gemäß Protokollabschnitt 6.
6. Datenanalyse
- Verwenden Sie ein Tabellenkalkulationsprogramm, um den Durchschnitt und die Standardabweichung für jede Phagenverdünnung zu berechnen, indem Sie dem Tabellenlayout im GitHub-Repository (https://github.com/eichristenson/Stacy-Ceballos-Index Stacy-Ceballos-Index folgen.
- Erstellen Sie Kontroll- und Infektionswachstumskurven und berechnen Sie Infektionsmetriken mithilfe von R (siehe Materialtabelle) mit den Paketen DescTools 24, dplyr25, ggplot2 26 und readxl27 und befolgen Sie das R-Skript im GitHub-Repository Stacy-Ceballos-Index (https://github.com/eichristenson/Stacy-Ceballos-Index).
- AUCcon ist der Bereich unter der nicht infizierten Kontrollkurve, während AUCinf der Bereich unter der infizierten Kurve16 ist. Berechnen Sie die AUC, und berechnen Sie dann die prozentuale Wachstumshemmung basierend auf der Fläche unter den Kurvenwerten, PIAUC16, mit der folgenden Gleichung:
(1 - [AUCinf/AUCcon]) × 100 - Die gestrichelten horizontalen Linien auf jeder Kurve zeigen das Spitzenwachstum, wobei der nicht infizierte Wachstumspeak mit N asymptote(con) und der infizierte Wachstumspeak mit Nasymptote(inf) gekennzeichnet ist. Identifizieren Sie die NAsymptotenwerte , und berechnen Sie dann die prozentuale Wachstumshemmung basierend auf diesen Spitzenwachstumswerten, PImax16, mit der folgenden Gleichung:
(1 - [N Asymptote(inf)/ NAsymptote(con)]) × 100 - Berechnen Sie den Stacy-Ceballos-Index, ISC16, aus den Werten PIAUC und PImax wie folgt:
(PIAUC × PImax) 0,5
Berechnen Sie die relative Virulenz, indem Sie den Stacy-Ceballos-Index über die Zeitintegrieren 16.
- AUCcon ist der Bereich unter der nicht infizierten Kontrollkurve, während AUCinf der Bereich unter der infizierten Kurve16 ist. Berechnen Sie die AUC, und berechnen Sie dann die prozentuale Wachstumshemmung basierend auf der Fläche unter den Kurvenwerten, PIAUC16, mit der folgenden Gleichung:
Repräsentative Ergebnisse
Ein Experiment ist erfolgreich, wenn die resultierende Wachstumskurve eine Zunahme der Positivkontrollbakterienpopulation im Laufe der Zeit ohne plötzliche Schwankungen in der Absorption zeigt. Beispiele für ein erfolgreiches Experiment bei einem MOI von 1 mit und ohne produktive Phageninfektion sind in Abbildung 2 bzw. Abbildung 3 dargestellt. Eine produktive Infektion mit einem MOI von 0,01 ist in Abbildung 4 dargestellt. Das in allen drei Abbildungen zu sehende Wachstumsmuster der Positivkontrolle (grüne Kurve) zeigt an, dass die Bakterien wachsen, während des Wachstums nicht verklumpen und keine Verunreinigungen vorhanden sind. Verklumpungen und Verunreinigungen werden durch eine ungewöhnlich hohe Absorption zu einem einzigen Zeitpunkt angezeigt. Die Standardabweichungen nehmen in der Regel im Laufe eines Experiments zu. Ein drastischer Anstieg oder Standardabweichungen, die sich zwischen der Kontroll- und der infizierten Kurve überlappen, können jedoch auf eine Kontamination oder Verklumpung in einer oder mehreren Vertiefungen hinweisen.
Die Wachstumskurve, die eine produktive Phageninfektion darstellt, dargestellt in Abbildung 2, zeigt eine reduzierte bakterielle Absorption im Laufe der Zeit in Vertiefungen mit dem Phagenzusatz. Diese Verringerung der Bakteriendichte ist nicht zu beobachten, wenn sich das Bakterium außerhalb des Wirtsbereichs des Phagen befindet, wie in Abbildung 3 dargestellt.
Die Infektionsmetriken sind für alle repräsentativen Experimente dargestellt, mit einem relativ großen ISC für die produktiven Infektionen in Abbildung 2 und Abbildung 4 und einem sehr kleinen ISC in Abbildung 3 für den Phagen, der das Wirtsbakterium nicht effizient infiziert hat.
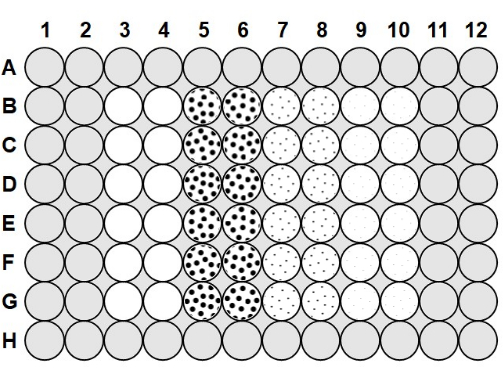
Abbildung 1: Mikrotiterplatten-Layout. Die grauen Bereiche werden mit 0,1% Agarose gefüllt. Bei den Leervertiefungen in Spalte 3 und Spalte 4 handelt es sich um No-Phagen-Positivkontrollvertiefungen, die nur Phagenpuffer und 2,0 x 106 KBE/ml Bakterien enthalten. Die gepunkteten Vertiefungen enthalten Phagen und 2,0 x 106 KBE/ml Bakterien; die großen Punkte in Spalte 5 und Spalte 6 zeigen ein MOI von 1 mit 2,0 x 106 pfu/ml Phagen an; die mittleren Punkte in Spalte 7 und Spalte 8 zeigen ein Trägheitsmoment von 0,1 mit 2,0 x 105 pfu/ml Phagen an; und die kleinen Punkte in Spalte 9 und Spalte 10 zeigen ein MOI von 0,01 mit 2,0 x 104 pfu/ml Phagen an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
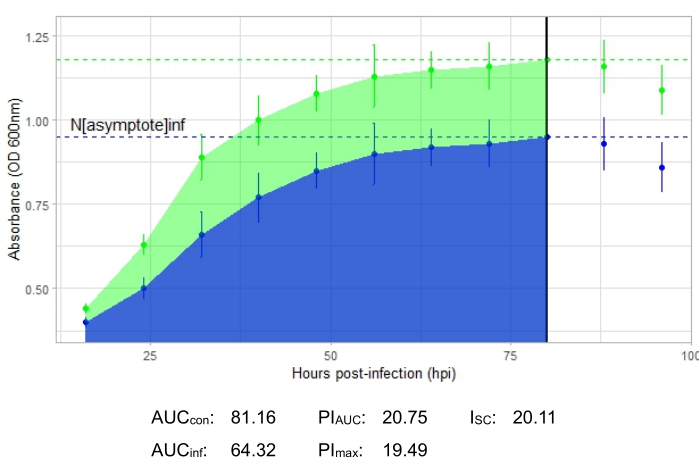
Abbildung 2: Ein erfolgreiches Wachstumskurvenexperiment mit einem Phagen mit einem MOI von 1, der das Wirtsbakterium produktiv infiziert. Die durchschnittlichen Absorptionswerte (± Standardabweichung) werden für nicht infizierte Bakterien (grün) und Bakterien mit dem Zusatz des Phagen (blau) angezeigt. Abkürzungen: AUC = Fläche unter der Kurve; PIAUC = prozentuale Wachstumshemmung, berechnet aus der Fläche unter der Kurve; NAsymptote = maximaler Wachstumswert; PImax = prozentuale Wachstumshemmung, berechnet aus den Spitzenwachstumswerten; ISC = Stacy-Ceballos-Index. Diese Grafik zeigt den gemäßigten Gordonia-Phagen DelRio, der G. terrae infiziert, das Bakterium, auf dem er isoliert wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
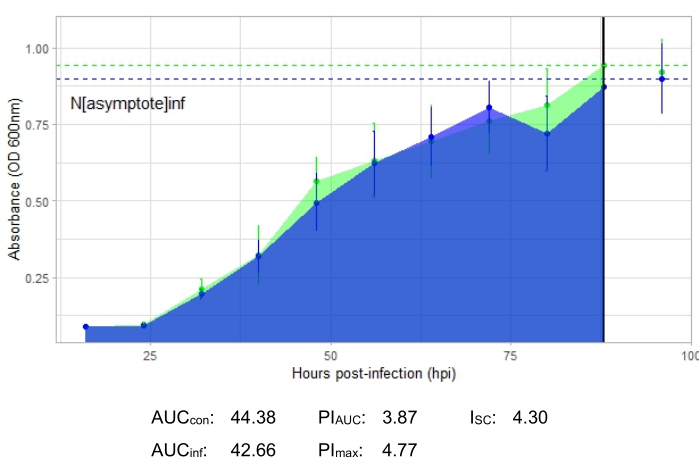
Abbildung 3: Ein erfolgreiches Wachstumskurvenexperiment mit einem Phagen mit einem MOI von 1, der das Wirtsbakterium nicht effizient infiziert. Die durchschnittlichen Absorptionswerte (± Standardabweichung) werden für nicht infizierte Bakterien (grün) und Bakterien mit dem Zusatz des Phagen (blau) angezeigt. Abkürzungen: AUC = Fläche unter der Kurve; PIAUC = prozentuale Wachstumshemmung, berechnet aus der Fläche unter der Kurve; NAsymptote = maximaler Wachstumswert; PImax = prozentuale Wachstumshemmung, berechnet aus den Spitzenwachstumswerten; ISC = Stacy-Ceballos-Index. Diese Grafik zeigt die Infektion mit G. rubripertincta durch DelRio. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
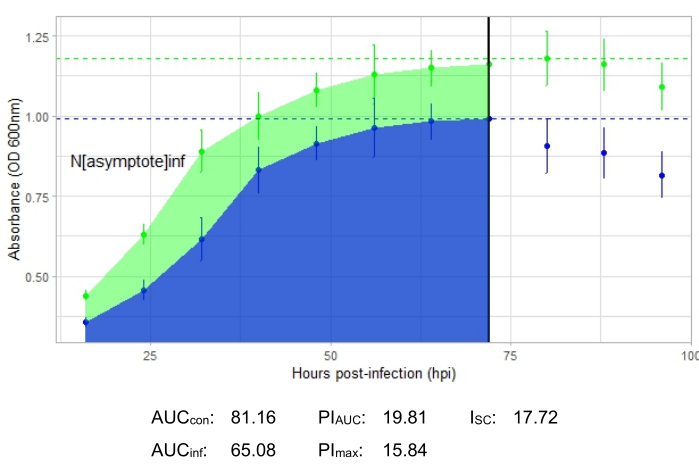
Abbildung 4: Ein erfolgreiches Wachstumskurvenexperiment mit einem Phagen bei einem MOI von 0,01. Die durchschnittlichen Absorptionswerte (± Standardabweichung) werden für nicht infizierte Bakterien (grün) und Bakterien mit dem Zusatz des Phagen (blau) angezeigt. Abkürzungen: AUC = Fläche unter der Kurve; PIAUC = prozentuale Wachstumshemmung, berechnet aus der Fläche unter der Kurve; NAsymptote = maximaler Wachstumswert; PImax = prozentuale Wachstumshemmung, berechnet aus den Spitzenwachstumswerten; ISC = Stacy-Ceballos-Index. Diese Grafik zeigt die G. terrae-Infektion durch DelRio. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Diese auf optischer Dichte basierende Mikrotiterplattenmethode ermöglicht die Untersuchung des Wirtsspektrums und der Infektionsdynamik von Bakteriophagen11 und zeigt die Nützlichkeit des Stacy-Ceballos-Index16 als Maß für die Virulenz von Bakteriophagen. Obwohl diese Methode mit jedem Bakteriophagen-Wirts-System verwendet werden kann, wurde sie speziell entwickelt, um die Assays für schnelles Mikroplattenwachstum 9,10,11für die Verwendung mit langsamer wachsenden Bakterien wie Actinomyceten anzupassen. Schnelle Mikrotiterplatten-Assays können nicht für langsam wachsende Bakterien ohne Modifikationen verwendet werden, um die Verdunstung und Deckelkondensation zu verhindern. Diese Methode beschreibt diese notwendigen Modifikationen und demonstriert zum ersten Mal die Verwendung des Stacy-Ceballos-Index und verwandter Metriken16 zur Beschreibung der Bakteriophageninfektion.
Die Verdunstung kann bei mehrtägigen 96-Well-Plattenwachstumskurven-Assays eine erhebliche Herausforderung darstellen. Diese Methode löst dieses Problem, indem Agarose zu den Randvertiefungen und den Zwischenräumen zwischen den Vertiefungen hinzugefügt wird. Der Agaroserand sorgt in Kombination mit der Anti-Beschlag-Deckelbehandlung22 für die notwendige Feuchtigkeit innerhalb der Mikrotiterplatte und ermöglicht zuverlässige optische Dichtemessungen. Ohne die zusätzliche Luftfeuchtigkeit kommt es während der langen Inkubationszeit zu einer erheblichen Verdunstung mit Kanteneffekt23 , was zu künstlich hohen optischen Dichtemessungen führt. Die Anti-Beschlag-Deckelbehandlung ist eine notwendige Modifikation, da Deckelkondensation auch die optischen Dichtewerte künstlich erhöhen kann. Das Schütteln der Platten während der Inkubationszeit wird empfohlen, da Actinomyceten-Bakterien während des Wachstums verklumpen können, was zu künstlich hohen optischen Dichtewerten führt und die Infektionsvielfalt effektiv verringert.
Das Verhältnis von Bakterien zu Phagen in Experimenten, die die Infektionsdynamik charakterisieren, ist entscheidend, da genügend Phagen vorhanden sein muss, um einen Infektionseffekt zu zeigen, aber nicht so viele, dass die Bakterienpopulation des Wirts sofort abstürzt9 oder die Häufigkeit der Lysogenie dramatisch erhöht wird28. Bei dieser Methode war das Verhältnis, das sich als am effektivsten für die Erzielung konsistenter Ergebnisse erwies, ein MOI von 1, aber auch mit MOIs von 0,1 und 0,01 wurden brauchbare Ergebnisse erzielt. Bei der Implementierung dieser Methode wird empfohlen, eine Bakterienkonzentration zu wählen und mehrere Phagenkonzentrationen im MOI-Bereich von 0,01-1 9,10,11 zu testen.
Diese hier beschriebene Technik ermöglicht es, Bakteriophagen-Wirt-Interaktionen für langsam wachsende Bakterien in Hochdurchsatz-Mikrotiterplatten-Assays zu bewerten, anstatt mit einer Unterprobenahme aus einem größeren Kulturkolben in jedem Messintervall29. Darüber hinaus erhöht diese Technik durch die Demonstration, wie Mikrotiterplatten-Wachstumsassays 9,10,11 angepasst werden können, den Nutzen anderer Mikrotiterplatten-basierter Bakteriophagen-Assays für langsamer wachsende Bakterien, einschließlich der Phagencharakterisierung 5,6,12 und der Evolutionsstudien 30,31. Schließlich demonstriert diese Methode die Verwendung des Stacy-Ceballos-Index16 zur Beschreibung der Bakteriophageninfektion. Diese Metrik wurde ursprünglich mit Daten aus einem archaealen Virusmodellsystem entwickelt und wird aus optischen Dichtewerten berechnet, wodurch sie über verschiedene Virensysteme hinweg von großem Nutzen ist.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde durch ein Stipendium des NSF DBI Biology Integration Institute (BII) unterstützt (Auszeichnung Nr. 2119968; PI-Ceballos) und durch das Arkansas INBRE-Programm mit einem Stipendium des National Institute of General Medical Sciences (NIGMS), P20 GM103429 der National Institutes of Health. Die Autoren schätzen auch die Unterstützung des Patterson Summer Undergraduate Research Program an der Ouachita Baptist University.
Materialien
| Name | Company | Catalog Number | Comments |
| Agarose | Omni-Pur | 2090 | for filling border wells of microplate |
| Costar 96 Well Lid Low Evaporation Corner Notch | Corning | 3931 | replacement microplate lid |
| Isopropanol | Fisher Chemical | A461-4 | for lid coating |
| Microplate reader | Tecan Spark 20M | ||
| Microplate Shaker with 4-Place Platform | Thermo Fisher Scientific | 88-861-023 | to shake plates during incubation |
| Non-Tissue Culture-Treated Plate 96 well | Falcon (a Corning Brand) | 351172 | microplate for growth curve assay |
| Peptone yeast calcium (PYCa) agar | Homemade | 1 g peptone 15 g yeast extract 15 g agar 990 mL dd H2O 4.5 mL 1 M CaCl2 2.5 mL 40% dextrose 1 mL 10 mg/mL cycloheximide | |
| Peptone yeast calcium (PYCa) broth | Homemade, from Reference 16 | 1 g peptone 15 g yeast extract 990 mL dd H2O 4.5 ml 1 M CaCl2 2.5 mL 40% dextrose 1 mL 10 mg/mL cycloheximide | |
| Peptone yeast calcium (PYCa) top agar | Homemade | 1 g peptone 15 g yeast extract 4 g agar 990 mL dd H2O 4.5 mL 1M CaCl2 2.5 mL 40% dextrose | |
| Petri plates | Thermo Fisher Scientific | FB0875713 | for determination of bacterial concentration and phage titer assay |
| Phage Buffer | Homemade, from Reference 7 | 10 mL 1 M Tris, pH 7.5 10 mL 1 M MgSO4 4 g NaCl 980 ml dd H2O | |
| R software | https://www.r-project.org/ | version 4.3.0 | |
| Sterile Disposable PETG Flask Baffled Bottom w/Vented Closure | Thermo Fisher Scientific | 4116-1000 | for bacterial culture |
| Triton X-100 | Sigma Aldrich | 9036-19-5 | for lid coating |
Referenzen
- Mushegian, A. R. Are there 1031 virus particles on Earth, or more, or fewer. Journal of Bacteriology. 202 (9), e00052-e00020 (2020).
- Chevallereau, A., Pons, B. J., van Houte, S., Westra, E. R. Interactions between bacterial and phage communities in natural environments. Nature Reviews Microbiology. 20 (1), 49-62 (2022).
- Olszak, T., Latka, A., Roszniowski, B., Valvano, M. A., Drulis-Kawa, Z. Phage life cycles behind bacterial biodiversity. Current Medicinal Chemistry. 24 (36), 3987-4001 (2017).
- Weitz, J. S., et al. Phage-bacteria infection networks. Trends in Microbiology. 21 (2), 82-91 (2013).
- Turner, P. E., Draghi, J. A., Wilpiszeski, R. High-throughput analysis of growth differences among phage strains. Journal of Microbiological Methods. 88 (1), 117-121 (2012).
- Storms, Z. J., Teel, M. R., Mercurio, K., Sauvageau, D. The virulence index: A metric for quantitative analysis of phage virulence. PHAGE. 1 (1), 27-36 (2020).
- . Phage Discovery Guide Available from: https://seaphagesphagediscoveryguide.helpdocsonline.com/home (2012)
- Martinez-Soto, C. E., et al. PHIDA: A high throughput turbidimetric data analytic tool to compare host range profiles of bacteriophages isolated using different enrichment methods. Viruses. 13 (11), 2120-2137 (2021).
- Rajnovic, D., Muñoz-Berbel, X., Mas, J. Fast phage detection and quantification: An optical density-based approach. PLoS One. 14 (5), e0216292 (2019).
- Xie, Y., Wahab, L., Gill, J. J. Development and validation of a microtiter plate-based assay for determination of bacteriophage host range and virulence. Viruses. 10 (4), 189-204 (2018).
- Sørensen, P. E., et al. Classification of in vitro phage-host population growth dynamics. Microorganisms. 9 (12), 2470-2486 (2021).
- Konopacki, M., Grygorcewicz, B., Dołęgowska, B., Kordas, M., Rakoczy, R. PhageScore: A simple method for comparative evaluation of bacteriophages lytic activity. Biochemical Engineering Journal. 161, 107652 (2020).
- Holt, J. G., Krieg, N. R., Sneath, P. H. A., Staley, J. T., Williams, S. T. . Bergey's Manual of Determinative Bacteriology., 9th edition. , (1994).
- Fusconi, R., Godinho, M. J. L., Bossolan, N. R. S. Culture and exopolysaccharide production from sugarcane molasses by Gordonia polyisoprenivorans CCT 7137, isolated from contaminated groundwater in Brazil. World Journal of Microbiology and Biotechnology. 24 (7), 937-943 (2007).
- Bujold, A. R., Lani, N. R., Sanz, M. G. Strain-to-strain variation of Rhodococcus equi growth and biofilm formation in vitro. BMC Research Notes. 12 (1), 519 (2019).
- Ceballos, R. M., Stacy, C. L. Quantifying relative virulence: When µmax fails and AUC alone just is not enough. Journal of General Virology. 102 (1), 001515 (2021).
- Siddiquee, S. The basic concept of microbiology. Practical Handbook of the Biology and Molecular Diversity of Trichoderma Species from Tropical Regions. , 1-15 (2017).
- Petrovski, S., Seviour, R. J., Tillett, D. Genome sequence and characterization of the Tsukamurella bacteriophage TPA2. Applied and Environmental Microbiology. 77 (4), 1389-1398 (2011).
- Growth curves: Generating growth curves using colony forming units and optical density measurements. JoVE Science Education Database. Microbiology Available from: https://www.jove.com/v/10511/growth-curvesgenerating-growth-curves-using-colony-forming-units (2023)
- Preparing spread plates protocols. American Society for Microbiology Available from: https://asm.org/ASM/media/Protocol-Images/Preparing-Spread-Plates-Protocols.pdf (2006)
- Mathes, H. N., et al. Complete genome sequences of Chop, DelRio, and GrandSlam, three Gordonia phages isolated from soil in Central Arkansas. Microbiology Resource Announcements. 12 (5), e0002323 (2023).
- Krishnamurthi, V. R., Niyonshuti, I. I., Chen, J., Wang, Y. A new analysis method for evaluating bacterial growth with microplate readers. PLoS One. 16 (1), 0245205 (2021).
- DescTools: Tools for descriptive statistics, R package version 0.99.49. DescTools Available from: https://CRAN.R-project.org/package=DescTools (2023)
- . dplyr: A grammar of data manipulation, R package version 1.1.2 Available from: https://CRAN.R-project.org/package=dplyr (2023)
- . ggplot2: Create elegant data visualisations using the grammar of graphics, R package version 3.4.2 Available from: https://CRAN.R-project.org/package=ggplot2 (2023)
- . readxl: Read excel files, R package version 1.4.2 Available from: https://CRAN.R-project.org/package=readxl (2023)
- Yao, T., Coleman, S., Nguyen, T. V. P., Golding, I., Igoshin, O. A. Bacteriophage self-counting in the presence of viral replication. Proceedings of the National Academy of Sciences of the United States of America. 118 (51), 2104163118 (2021).
- Fang, Q., Feng, Y., McNally, A., Zong, Z. Characterization of phage resistance and phages capable of intestinal decolonization of carbapenem-resistant Klebsiella pneumoniae in mice. Communications Biology. 5, 48 (2022).
- Burrowes, B. H., Molineux, I. J., Fralick, J. A. Directed in vitro evolution of therapeutic bacteriophages: The Appelmans protocol. Viruses. 11 (3), 241 (2019).
- Shapiro, J. W., Williams, E. S. C. P., Turner, P. E. Evolution of parasitism and mutualism between filamentous phage M13 and Escherichia coli. PeerJ. 4, e2060 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten