Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Hochauflösende Respirometrie zur Beurteilung der Mitochondrienfunktion in menschlichen Spermien
In diesem Artikel
Erratum Notice
Zusammenfassung
Die Analyse der Mitochondrienfunktion von Spermien mittels hochauflösender Respirometrie ermöglicht die Messung des Sauerstoffverbrauchs von frei beweglichen Spermien in einem geschlossenen Kammersystem. Die Technik kann zur Messung der Atmung in menschlichen Spermien eingesetzt werden, die Informationen über die mitochondrialen Eigenschaften und die Integrität der Spermien liefert.
Zusammenfassung
Die Samenqualität wird oft durch eine routinemäßige Samenanalyse untersucht, die beschreibend und oft nicht schlüssig ist. Männliche Unfruchtbarkeit ist mit einer veränderten mitochondrialen Aktivität der Spermien verbunden, so dass die Messung der mitochondrialen Funktion der Spermien ein Indikator für die Spermienqualität ist. Die hochauflösende Respirometrie ist eine Methode zur Messung des Sauerstoffverbrauchs von Zellen oder Geweben in einem geschlossenen Kammersystem. Diese Technik kann zur Messung der Atmung in menschlichen Spermien eingesetzt werden und liefert Informationen über die Qualität und Integrität der Spermienmitochondrien. Die hochauflösende Respirometrie ermöglicht es den Zellen, sich frei zu bewegen, was bei Spermien a priori von Vorteil ist. Diese Technik kann mit intakten oder permeabilisierten Spermien angewendet werden und ermöglicht die Untersuchung der intakten Mitochondrienfunktion der Spermien und der Aktivität einzelner Atmungskettenkomplexe. Das hochauflösende Oxygraph-Gerät verwendet Sensoren zur Messung der Sauerstoffkonzentration in Verbindung mit einer empfindlichen Software zur Berechnung des Sauerstoffverbrauchs. Die Daten werden verwendet, um Atmungsindizes auf der Grundlage der Sauerstoffverbrauchsverhältnisse zu berechnen. Folglich sind die Indizes die Anteile von zwei Sauerstoffverbrauchsraten und werden intern auf die Zellzahl oder Proteinmasse normiert. Die Atmungsindizes sind ein Indikator für die mitochondriale Funktion und Dysfunktion der Spermien.
Einleitung
Es wird geschätzt, dass männliche Unfruchtbarkeit 40%-50% aller Fälle von Unfruchtbarkeit bei Paaren ausmacht1. Die konventionelle Samenanalyse spielt eine entscheidende Rolle bei der Bestimmung der männlichen Fruchtbarkeit. Etwa 15 % der unfruchtbaren Männer haben jedoch normale Spermienparameter2. Darüber hinaus liefert die routinemäßige Samenanalyse nur begrenzte Informationen über die Spermienfunktion und spiegelt keine subtilen Spermiendefekte wider3.
Spermienmitochondrien haben eine besondere Struktur, da sie als spiralförmige Hülle um die Geißeln angeordnet sind. Die mitochondriale Hülle enthält eine variable Anzahl von Mitochondrien, die durch intermitochondriale Linker verbunden und durch geordnete Proteinanordnungen auf der äußeren Mitochondrienmembran mit dem Zytoskelett verankert sind 4,5. Diese Struktur macht es besonders schwierig, die Mitochondrien der Spermien zu isolieren. Daher werden in den meisten Studien zur mitochondrialen Funktion von Spermien In-situ-Analysen oder demembranierte Spermien verwendet6.
Die mitochondriale Struktur und Funktion der Spermien wurde konsistent mit männlicher Unfruchtbarkeit in Verbindung gebracht 7,8,9,10,11, was darauf hindeutet, dass die Analyse der Struktur und Funktion dieser Organellen ein guter Kandidat für die Einbeziehung in die Spermienanalyse sein könnte.
Mitochondrien spielen eine wichtige Rolle im zellulären Energiestoffwechsel, insbesondere durch die Verwendung von Sauerstoff zur Herstellung von Adenosintriphosphat (ATP) durch oxidative Phosphorylierung (OXPHOS). Insbesondere bei Spermien ist die Quelle von ATP (Glykolyse vs. OXPHOS) umstritten, und viele der Daten bleiben umstritten und hängen von verschiedenen experimentellen Ansätzen ab 4,12,13. Messungen der Atmung mittels Oximetrie bieten signifikante Einblicke in die mitochondriale Atmungskapazität, die mitochondriale Integrität und den Energiestoffwechsel der Zelle14,15,16. Traditionell wurde diese Technik mit der Clark-Sauerstoffelektrode durchgeführt - einem Instrument, das seit mehr als 50 Jahren zur Messung der mitochondrialen Atmung verwendet wird17,18. Darüber hinaus wurde der mitochondriale Sauerstoffverbrauch der Spermien mit der klassischen Clark-Sauerstoffelektrode 19,20,21 analysiert. Die hochauflösende Respirometrie (HRR) mit Oxygraphen (Oroboros) bietet eine höhere Sensitivität als die Verwendung klassischer Respirometriegeräte22. Die Oxygraphen bestehen aus zwei Kammern mit Injektionsanschlüssen, und jede Kammer verfügt über einen polarographischen Sauerstoffsensor. Mit dieser Technik ist es möglich, Gewebeobjektträger, Zellen und isolierte mitochondriale Suspensionen zu analysieren. Die Probe wird in der Kammer kontinuierlich gerührt, und während des Experiments wird der Sauerstoffverbrauch gemessen und die Sauerstoffraten mit einer speziellen Software berechnet. Die Kammern weisen eine reduzierte Sauerstoffleckage auf, was ein Vorteil gegenüber den herkömmlichen Sauerstoffelektrodenvorrichtungen14,23 ist.
Wie bei anderen Zellen ist auch bei Spermien die Empfindlichkeit der HRR-Geräte höher als bei der herkömmlichen Respirometrie, was bedeutet, dass HRR-Geräte für die Analyse einer begrenzten Anzahl intakter oder permeabilisierter Samenzellen verwendet werden können. Es gibt zwei Hauptstrategien zur Beurteilung der mitochondrialen Funktion von Spermien mittels HRR: (a) Messung des Sauerstoffverbrauchs in intakten Zellen, bei der die Atmungsfunktion in einem Medium, das Substrate wie Glukose enthält, reproduziert wird, oder (b) Messung des Sauerstoffverbrauchs in permeabilisierten Zellen unter Verwendung eines der OXPHOS-Komplexe, wobei spezifische Substrate hinzugefügt werden, um jede Funktion separat zu überwachen.
In der vorliegenden Studie beschreiben wir den Einsatz von HRR zur Bestimmung der mitochondrialen Atmung in menschlichen Samenzellen.
Protokoll
Die Experimente wurden von der Ethikkommission der Facultad de Medicina de la Universidad de la República, Montevideo, Uruguay, genehmigt.
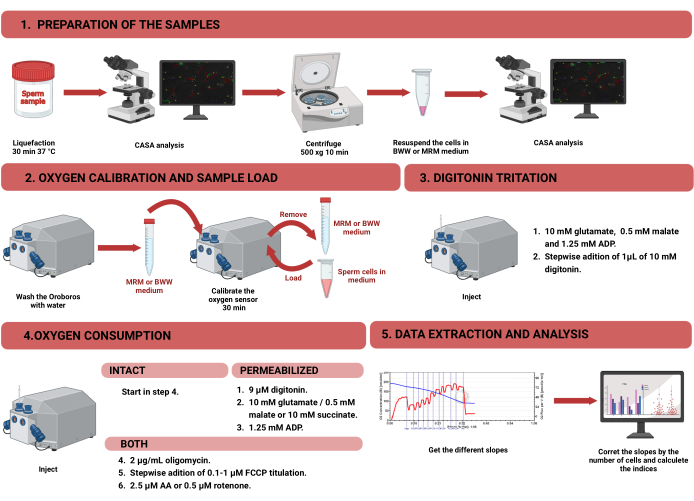
Abbildung 1: Arbeitsablauf für hochauflösende Respirometrie zur Beurteilung der mitochondrialen Funktion in intakten und permeabilisierten menschlichen Spermien. Das Protokoll wurde in vier verschiedene Schritte unterteilt: 1) Vorbereitung der Probe, 2) Sauerstoffkalibrierung im Oroboros-Instrument, 3) Messung des Sauerstoffverbrauchs für intakte und permeabilisierte Zellen und 4) Datenextraktion aus dem Gerät und Analyse. Abkürzungen: CASA = computergestützte Spermienanalyse; BWW = Biggers Whitten Whittingham mittel; MRM = mitochondriales Atmungsmedium; ADP = Adenosindiphosphat; FCCP = Carbonylcyanid -p-Trifluormethoxyphenylhydrazon; AA = Antimycin A. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
HINWEIS: Der Arbeitsablauf zur Messung des Sauerstoffverbrauchs in Spermien mit HRR ist in Abbildung 1 dargestellt. Informationen zu den Materialien, Geräten und Reagenzien, die im Protokoll verwendet werden, sind in der Materialtabelle aufgeführt.
1. Vorbereitung der Probe
- Musterkollektion
- Sammeln Sie frisch ejakuliertes menschliches Sperma durch Masturbation nach einer empfohlenen 3-tägigen Abstinenz in einem sterilen Kunststoffbehälter. Transportieren Sie die Proben sofort ins Labor.
- Inkubieren Sie die Proben für 30-60 Minuten bei Raumtemperatur (RT), um sie vollständig zu verflüssigen24.
- Lagern Sie die Proben nach der Verflüssigung bei 37 °C, bis das Experiment beginnt.
- Spermienauswertung mit computergestützter Spermienanalyse (CASA)
- Mischen Sie die Probe und geben Sie 7 μl in eine vorgewärmte Spermienzählkammer.
- Stellen Sie die Kammer auf den vorgewärmten (37 °C) Tisch eines Direktlichtmikroskops.
- Öffnen Sie die computergestützte Spermienanalyse-Software und geben Sie das Modul Beweglichkeit und Konzentration auf (klicken Sie auf Mot).
- Wählen Sie die Konfiguration aus, die den Bedingungen für menschliche Spermien entspricht.
HINWEIS: Die Konfiguration muss an die Art und Tiefe der Kammer sowie an die Probenart und das System CASA angepasst werden. - Analysieren Sie nach dem Zufallsprinzip 10 verschiedene Felder pro Kammer, indem Sie auf die Schaltfläche Analysieren klicken.
- Klicken Sie auf Ergebnisse , um die Probenkonzentration und -motilität zu erhalten.
- Vorbereitung der Zellen
HINWEIS: Wenn der HRR nicht kalibriert ist, beginnen Sie mit den Schritten 2.1-2.2, bevor Sie die Zellen vorbereiten (Schritt 1.3). Es ist wichtig, den Sauerstoffverbrauch sofort zu messen, wenn die Samenzellen im Medium resuspendiert werden.- Die Proben werden bei 400 x g für 10 min bei RT zentrifugiert.
- Entfernen Sie das Samenplasma und resuspendieren Sie die Spermien in 2 ml Biggers Whitten Whittingham (BWW) für Experimente mit intakten Zellen oder mitochondriales Atmungsmedium (MRM) für Studien mit permeabilisierten Zellen. Die Zusammensetzung der Medien ist in Tabelle 1 dargestellt.
- Wiederholen Sie die in Schritt 1.2 beschriebenen Schritte für Spermienkonzentrationsuntersuchungen.
2. Hochauflösende Respirometrie: OXPHOS-Analyse
HINWEIS: HRR integriert hochempfindliche Oxygraphen (Oxygraph-2 K; Oroboros Instruments GmbH, Innsbruck, Österreich) mit Software (DatLab, Version 4.2; Oroboros Instruments GmbH). Die experimentellen Daten werden als Sauerstoffkonzentration in Abhängigkeit von der Zeit (als pmol von O2/106 Zellen·min−1) und als Echtzeittransformationen dieser Daten angezeigt, so dass der Experimentator die Atmung (Sauerstoffverbrauch, Sauerstofffluss) biologischer und biochemischer Proben verfolgen kann, während das Experiment noch läuft. Die HRR kann verwendet werden, um die Atmung lebender und beweglicher Zellen zu verfolgen, was besonders für Spermien nützlich ist, deren Beweglichkeit mit der Spermienqualität und dem Fruchtbarkeitspotenzial verbunden ist. Das Labor verwendet einen HRR Oroboros Oxygraph2-k, Oroboros Instruments, mit zwei Kammern. Die in diesem Protokoll beschriebenen Schritte müssen für beide 2-ml-Kammern unabhängig voneinander durchgeführt werden.
- Vorbereitung der Ausrüstung
- Schalten Sie den HRR ein und verbinden Sie ihn mit der Respirometrie-Software (DatLab) zur Datenerfassung und -analyse.
- Ersetzen Sie das 70%ige Ethanol in der Oxygraphenkammer durch ddH2O. Rühren Sie es kontinuierlich mit dem magnetischen Rührstab in der Kammer bei 750 U/min um. 10 min stehen lassen und anschließend das doppelt destillierte (dd)H2Oabsaugen.
- Waschen Sie die Kammer dreimal mit ddH2O für jeweils 5 Minuten.
HINWEIS: Dieser Schritt ist notwendig, um das verbleibende Ethanol aus den Kammern zu entfernen. Samenzellen reagieren sehr empfindlich auf Ethanol. Die Aufzeichnung könnte beeinträchtigt werden, wenn dieser Schritt weggelassen wird.
- Kalibrierung der Sauerstoffsensoren
HINWEIS: Das Kalibrierungsverfahren variiert je nach Gerät leicht. Eine Luftkalibrierung des polarographischen Sauerstoffsensors durchführen, wie vom Hersteller25 beschrieben. In diesem Abschnitt wird das Kalibrierungsprotokoll kurz erläutert.- Entfernen Sie dasddH2O und pipettieren Sie 2 ml desselben Mediums, das für die Zellvorbereitung verwendet wurde, in die Kammer. Setzen Sie die Stopfen auf und lassen Sie eine Luftaustauschblase erhalten.
HINWEIS: Es ist wichtig, das Volumen der Kammer zu kennen, um das genaue Volumen des benötigten Mediums zu bestimmen. - Notieren Sie die Sauerstoffkalibrierwerte (klicken Sie auf Layout > 01 Calibration Exp. Gr3-Temp), um die Leistung der Sensormembran zu überwachen, indem Sie das Medium mit dem Rührstab bei 750 U/min für mindestens 30 min bei 37 °C rühren. Verwenden Sie die anderen Einstellungen wie erwähnt: Verstärkung für Sensor: 2; Polarisationsspannung: 800 mV; Datenaufzeichnungsintervall: 2,0 s.
ANMERKUNG: Es wird erwartet, dass eine unkorrigierteO2-Steigung (rote Linie) innerhalb von ±2 pmol∙s−1∙mL−1 mit einem stabilen Signal des polarographischen Sensors erzielt wird. - Ziehen Sie die Maus bei gedrückter linker Maustaste und Umschalttaste, um einen Bereich auszuwählen, in dem die Änderung der Sauerstoffkonzentration (Y1 O2-Konzentration, blaue Linie) stabil ist.
- Öffnen Sie das Fenster O2-Kalibrierung (klicken Sie auf Oxygraph > O2-Kalibrierung). Ändern Sie in der Luftkalibrierung die ausgewählte Markierung in den in Schritt 2.2.3 ausgewählten Bereich. Klicken Sie abschließend auf Kalibrieren und in Zwischenablage kopieren.
- Stoppen Sie die Aufnahme und speichern Sie, indem Sie auf Oxygraph > Ok Control > Save and Disconnect klicken.
HINWEIS: Dieses Dataset muss gespeichert werden, damit es in allen Experimenten des Tages verwendet werden kann. Die Kalibrierung wird nur einmal pro Tag für jedes Medium durchgeführt.
- Entfernen Sie dasddH2O und pipettieren Sie 2 ml desselben Mediums, das für die Zellvorbereitung verwendet wurde, in die Kammer. Setzen Sie die Stopfen auf und lassen Sie eine Luftaustauschblase erhalten.
- Digitonin-Permeabilisierungs-Titration
- Öffnen Sie die Kammer und saugen Sie das Medium im Inneren an.
- In die Kammer werden mindestens 24 x 10 6 und nicht mehr als 70 x 106 Samenzellen in einem Endvolumen von 2 ml MRM geladen.
HINWEIS: Es ist wichtig, die Anzahl der Zellen in der Kammer zu messen, um den Sauerstoffverbrauch am Ende des Experiments anzupassen. Eine geringere Anzahl von Zellen als empfohlen kann nicht gemessen werden. - Schließen Sie die Kammer, indem Sie die Stopfen ganz hineindrücken und saugen Sie die restliche Flüssigkeit oben an. Starten Sie das Experiment mit den gleichen Einstellungen wie bei der Kalibrierung: Rührgeschwindigkeit: 750 U/min; Temperatur: 37 °C; Verstärkung für Sensor: 2; Polarisationsspannung: 800 mV; und Datenaufzeichnungsintervall: 2,0 s.
- Um die Kalibrierung zu laden, doppelklicken Sie auf das Feld Pos Calib in der unteren Ecke. Öffnen Sie die in Schritt 2.2 durchgeführte Kalibrierung (klicken Sie auf Oxygraph > O2-Kalibrierung > Aus Datei kopieren) und klicken Sie auf Kalibrieren und in Zwischenablage kopieren.
HINWEIS: Die POS-Calib-Box wechselt von gelb zu grün. Die Daten werden in Diagrammen mit Sauerstoffdurchfluss pro Volumen korrigiert angezeigt (Layout 05 Fluss pro Volumen unkorrigiert). In Oxygraph > Layout stehen verschiedene Layouts zur Verfügung. - Fügen Sie 5 μl 0,5 M Adenosindiphosphat (ADP), 10 μl 2 M Glutamat und 2,5 μl 0,4 M Malat hinzu (Endkonzentrationen: 1,25 mM, 10 mM und 0,5 mM). Messen Sie den Sauerstoffverbrauch, bis sich das Signal stabilisiert hat.
HINWEIS: Präzisions-Mikrospritzen von Hamilton werden für die Injektion durch die Ladeöffnung im Stopfen verwendet. Verwenden Sie eine Spritze pro Medikament, um eine Kreuzkontamination zu vermeiden. Klicken Sie auf F4 , um sich zu registrieren, und markieren Sie im Sauerstoffregister, wenn eine Behandlung hinzugefügt wird.
HINWEIS: Die Substrate werden in Reinstwasser vorbereitet und 3 Monate lang bei −20 °C gelagert. - Tritatieren Sie durch Zugabe von 1 μl 10 mM Digitonin in aufeinanderfolgenden Schritten, bis der Sauerstoffverbrauch ein maximales Niveau erreicht.
HINWEIS: Eine gründliche Reinigung mit Wasser, 70 % Ethanol und 100 % Ethanol ist unerlässlich, wenn dieselbe Kammer für zwei Experimente am selben Tag verwendet wird.
HINWEIS: Digitonin wird in Reinstwasser hergestellt und 3 Monate lang bei −20 °C gelagert.
- Routinemäßiges Protokoll zur Beurteilung der Atemwege für intakte und permeabilisierte Samenzellen (Komplex I oder Komplex II)
- Öffnen Sie die Kammer und saugen Sie das Medium im Inneren an.
- Mindestens 24 x 10 6 und nicht mehr als 70 x 106 Samenzellen in einem Endvolumen von 2 ml BWW (intakte Zellanalyse) oder MRM (permeabilisierte Zellanalyse) in die Kammer geben.
- Starten Sie das Experiment mit den gleichen Einstellungen wie bei der Kalibrierung (dies ist in Schritt 2.3.3 beschrieben).
- Laden Sie die in Schritt 2.2 durchgeführte Kalibrierung wie in Schritt 2.3.4 beschrieben.
- Zeichnen Sie die Atmung der Zellen mindestens 5 Minuten lang auf, bis ein stabiles Signal erhalten wird. Diese Messung entspricht der basalen Atmung in intakten Zellen.
- Wenn das Experiment mit intakten Zellen durchgeführt wird, fahren Sie mit Schritt 2.4.9 fort. Bei permeabilisierten Zellen werden 4,5 μl 10 mM Digitonin (Endkonzentration: 22,5 μM) injiziert. Permeabilisieren Sie die Zellen für 5 Minuten.
- Fügen Sie die Substrate hinzu: 10 μl 2 M Glutamat und 2,5 μl 0,4 M Malat (Endkonzentrationen: 10 mM bzw. 0,5 mM) für Komplex I oder 20 μL 1 M Succinat (Endkonzentration: 10 mM) für Komplex II. Messen Sie den Sauerstoffverbrauch, bis das Signal ansteigt und sich stabilisiert. Dies ist Zustand 4, was bedeutet, dass der Basalkomplex I oder der Basalkomplex II die Atmung in Abwesenheit von ADP unterstützt.
HINWEIS: Die Substrate werden in Reinstwasser vorbereitet und 3 Monate lang bei −20 °C gelagert. - Injizieren Sie 5 μl 0,5 M ADP (Endkonzentration: 1,25 mM). Messen Sie den Sauerstoffverbrauch, bis das Signal ansteigt und sich stabilisiert. Die Zugabe von ADP erhöht das Signal, das dem maximalen Sauerstoffverbrauch durch Komplex I oder Komplex II entspricht (Zustand 3, in permeabilisierten Zellen).
- Fügen Sie 1 μl 4 mg/ml Oligomycin (Endkonzentration: 2 μg/ml), einen ATP-Synthetase-Inhibitor, hinzu. Messen Sie den Sauerstoffverbrauch, bis das Signal abnimmt und sich stabilisiert.
HINWEIS: Oligomycin wird in Ethanol hergestellt und 3 Monate lang bei −20 °C gelagert. - Titrieren durch Zugabe von 1 μl 0,1 mM zu 1 mM Carbonylcyanid-P-trifluormethoxy-phenylhydrazon (FCCP) in aufeinanderfolgenden Schritten, bis eine maximale entkoppelte Atmungsrate erreicht ist. Messen Sie den Sauerstoffverbrauch, bis das Signal ansteigt und sich stabilisiert.
HINWEIS: FCCP wird in Ethanol hergestellt und 3 Monate lang bei −20 °C gelagert. - Die Endkonzentration von FCCP ist probenabhängig. Hören Sie auf, das Medikament zu injizieren, wenn der Sauerstoffverbrauch zu sinken beginnt.
- Zum Schluss injizieren Sie 1 μl 5 mM Antimycin A (2,5 μM Endkonzentration). Dabei handelt es sich um einen Komplex-III-Inhibitor zur Unterscheidung zwischen dem mitochondrialen und dem Restsauerstoffverbrauch (nicht-mitochondriale Atmung). Für die Analyse von Komplex I wird anstelle von AA 1 μl 1 μl 1 mM Rotenon (0,5 μM Endkonzentration), ein Inhibitor dieses Komplexes, zugegeben. Messen Sie den Sauerstoffverbrauch, bis das Signal abnimmt und sich stabilisiert.
HINWEIS: Die Arzneimittel werden in Ethanol zubereitet und 3 Monate lang bei −20 °C gelagert.
3. Datenextraktion und -analyse
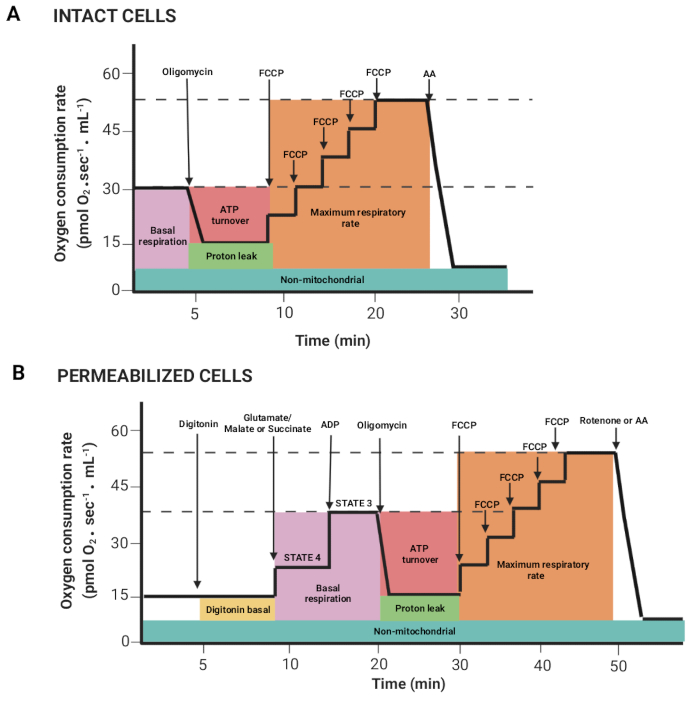
Abbildung 2: Erfassung von respiratorischen Parametern aus einem hochauflösenden Respirometrie-Experiment. (A,B) Schematische Darstellungen von Graphen, die wie in Abbildung 1 beschrieben für intakte bzw. permeabilisierte Zellen erhalten wurden. Diese Parameter wurden bereits beschrieben15. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Ziehen Sie die Maus, indem Sie die linke Maustaste und die Umschalttaste drücken, um Bereiche auszuwählen, in denen der Sauerstofffluss pro Volumen korreliert (Y2 O2 slope uncorr., rote Linie) nach der Injektion eines Substrats oder Inhibitors stabil ist. Figur 2 zeigt die verschiedenen Parameter, die aus dem zuvor beschriebenen Register15 gewonnen werden.
HINWEIS: Die Parameter hängen vom Experiment ab. alle sind wie folgt: basale Atmung in intakten Zellen und Atmung in Gegenwart von Glutamat/Malat oder Succinat (Zustand 4), ADP (Zustand 3), Oligomycin (Protonenleck), FCCP (maximale Atemfrequenz), Rotenon/AA (nicht-mitochondriale Atmung). In permeabilisierten Zellen entspricht die basale Atmung dem Zustand 3. - Klicken Sie auf die Fenster Markierungen > Statistiken , und exportieren Sie die Daten.
- Normalisieren Sie die erhaltenen Daten pro 1 Million Samenzellen. Die Einheiten der Steigungen sind pmolO2·s−1·mL−1·10−6 Zellen.
- Subtrahieren Sie den nicht-mitochondrialen Sauerstoffverbrauch von allen Werten, bevor Sie die Indizes berechnen.
- Berechnen Sie die Indizes mit den verschiedenen Gleichungen, die zuvor15 beschrieben wurden:

Ergebnisse
Bestimmung der optimalen Konzentration von Digitonin in Samenzellen
In diesem Protokoll stellen wir die Verwendung von HRR vor, um Veränderungen von OXPHOS in menschlichen Samenzellen in Echtzeit zu überwachen. Da die Methode zur Analyse von intakten oder Digitonin-permeabilisierten Spermien verwendet werden kann, stellen wir zunächst die Standardisierung der Digitoninkonzentration vor, die für die Permeabilisierung von Spermien erforderlich ist (Abbildung 3).
Diskussion
Die HRR hängt entscheidend von mehreren Schritten ab: (a) der Wartung der Geräte, (b) der genauen Kalibrierung der Sauerstoffsensoren, (c) der Entkopplertitration26 und schließlich (d) der angemessenen Verwendung von Indizes, die die mitochondriale Funktion darstellen. Die Wartung der Geräte ist von entscheidender Bedeutung. Es wird empfohlen, die Membranen des polarographischen Sauerstoffsensors regelmäßig auszutauschen und den instrumentellen Untergrund zu korrigieren. Ein ausgiebiges Wasc...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken der Klinik Fertilab Andrology, insbesondere José María Montes und Andrea Torrents, für den Zugang zu Spendern. Finanzierung: A.C. wird durch Stipendien der Universidad de la República (CSIC_2018, Espacio Interdisciplinario_2021) unterstützt. Zusätzliche Mittel wurden vom Programa de Desarrollo de Ciencias Básicas (PEDECIBA, Uruguay) eingeworben. P.I. und R.S. werden unterstützt von der Universidad de la República (I+D, CSIC 2014; I+D, CSIC 2016, Iniciación a la Investigación, CSIC 2019 und FMV_1_2017_1_136490 ANII- Uruguay). P.I. wird von POS_FMV_2018_1_1007814 und CAP-UDELAR 2020 unterstützt. Die Figuren wurden mit Biorender.com illustriert.
Materialien
| Name | Company | Catalog Number | Comments |
| Acid free- Bovine serum albumine | Sigma Aldrich | A8806 | |
| Adenosine 5'-diphosphate monopotassium salt dihydrate | Sigma Aldrich | A5285 | |
| Animycin A from streptomyces sp. | Sigma Aldrich | A8674 | |
| Calcium chloride | Sigma Aldrich | C4901 | |
| carbonyl cyanide-P- trifluoromethoxy-phenylhydrazone | Sigma Aldrich | C2920 | |
| DatLab sofware version 4,2 | Oroboros Instruments GmbH | N/A | |
| D-glucose | Sigma Aldrich | G7021 | |
| Digitonin | Sigma Aldrich | D141 | |
| EGTA | Sigma Aldrich | E4378 | |
| HEPES | Sigma Aldrich | H3375 | |
| L glutamic acid | Sigma Aldrich | G1251 | |
| L malic acid | Sigma Aldrich | M1000 | |
| Magnesium sulphate | Sigma Aldrich | M7506 | |
| Microliter Syringes | Hamilton | 87900 or 80400 | |
| Microscope camera | Basler | acA780-75gc | |
| Microscope Eclipse E200 with phase contrast 10X Ph+ | Nikon | N/A | |
| Monopotassium phosphate | Sigma Aldrich | P5655 | |
| MOPS | Sigma Aldrich | M1254 | |
| Oligomycin A | Sigma Aldrich | 75351 | |
| Oxygraph-2 K | Oroboros Instruments GmbH | N/A | |
| Potassium chloride | Sigma Aldrich | P3911 | |
| Power O2k-Respirometer | Oroboros Intruments | 10033-01 | |
| Rotenone | Sigma Aldrich | R8875 | |
| Saccharose | Sigma Aldrich | S0389 | |
| Sodium bicarbonate | Sigma Aldrich | S5761 | |
| Sodium lactate | Sigma Aldrich | L7022 | |
| Sodium pyruvate | Sigma Aldrich | P2256 | |
| Sperm class analyzer 6.3.0.59 Evolution-SCA Research | Microptic | N/A | |
| Sperm Counting Chamber DRM-600 | Millennium Sciences CELL-VU | N/A | |
| Succinate disodium salt | Sigma Aldrich | W327700 |
Referenzen
- Agarwal, A., Mulgund, A., Hamada, A., Chyatte, M. R. A unique view on male infertility around the globe. Reproductive Biology and Endocrinology. 13, 37 (2015).
- Guzick, D. S., et al. Sperm morphology, motility, and concentration in fertile and infertile men. The New England Journal of Medicine. 345 (19), 1388-1393 (2001).
- Wang, C., Swerdloff, R. S. Limitations of semen analysis as a test of male fertility and anticipated needs from newer tests. Fertility and Sterility. 102 (6), 1502-1507 (2014).
- Amaral, A. Energy metabolism in mammalian sperm motility. WIREs Mechanisms of Disease. 14 (5), e1569 (2022).
- Leung, M. R., et al. In-cell structures of conserved supramolecular protein arrays at the mitochondria-cytoskeleton interface in mammalian sperm. Proceedings of the National Academy of Sciences of the United States of America. 118 (45), e2110996118 (2021).
- Moraes, C. R., Meyers, S. The sperm mitochondrion: Organelle of many functions. Animal Reproduction Science. 194, 71-80 (2018).
- Cassina, A., et al. Defective human sperm cells are associated with mitochondrial dysfunction and oxidant production. Biology of Reproduction. 93 (5), 119 (2015).
- Marchetti, C., Obert, G., Deffosez, A., Formstecher, P., Marchetti, P. Study of mitochondrial membrane potential, reactive oxygen species, DNA fragmentation and cell viability by flow cytometry in human sperm. Human Reproduction. 17 (5), 1257-1265 (2002).
- Amaral, A., Lourenço, B., Marques, M., Ramalho-Santos, J. Mitochondria functionality and sperm quality. Reproduction. 146 (5), R163-R174 (2013).
- Durairajanayagam, D., Singh, D., Agarwal, A., Henkel, R. Causes and consequences of sperm mitochondrial dysfunction. Andrologia. 53 (1), e13666 (2021).
- Uribe, P., et al. Use of the fluorescent dye tetramethylrhodamine methyl ester perchlorate for mitochondrial membrane potential assessment in human spermatozoa. Andrologia. 49 (9), e12753 (2017).
- Storey, B. T. Mammalian sperm metabolism: Oxygen and sugar, friend and foe. The International Journal of Developmental Biology. 52 (5-6), 427-437 (2008).
- Tourmente, M., Sansegundo, E., Rial, E., Roldan, E. R. S. Capacitation promotes a shift in energy metabolism in murine sperm. Frontiers in Cell and Developmental Biology. 10, 950979 (2022).
- Gnaiger, E., Dykens, J. A., Will, Y. Chapter 12 - Polarographic oxygen sensors, the oxygraph, and high-resolution respirometry to assess mitochondrial function. Drug-Induced Mitochondrial Dysfunction. , 325-352 (2008).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 435 (2), 297-312 (2011).
- Awadhpersad, R., Jackson, C. B. High-resolution respirometry to assess bioenergetics in cells and tissues using chamber- and plate-based respirometers. Journal of Visualized Experiments: JoVE. (176), e63000 (2021).
- Chance, B., Williams, G. R. A simple and rapid assay of oxidative phosphorylation. Nature. 175 (4469), 1120-1121 (1955).
- Li, Z., Graham, B. H. Measurement of mitochondrial oxygen consumption using a Clark electrode. Methods in Molecular Biology. 837, 63-72 (2012).
- Stendardi, A., et al. Evaluation of mitochondrial respiratory efficiency during in vitro capacitation of human spermatozoa. International Journal of Andrology. 34 (3), 247-255 (2011).
- Ferramosca, A., Focarelli, R., Piomboni, P., Coppola, L., Zara, V. Oxygen uptake by mitochondria in demembranated human spermatozoa: A reliable tool for the evaluation of sperm respiratory efficiency. International Journal of Andrology. 31 (3), 337-345 (2008).
- Ferramosca, A., et al. Modulation of human sperm mitochondrial respiration efficiency by plant polyphenols. Antioxidants. 10 (2), 217 (2021).
- Gnaiger, E., Steinlechner-Maran, R., Méndez, G., Eberl, T., Margreiter, R. Control of mitochondrial and cellular respiration by oxygen. Journal of Bioenergetics and Biomembranes. 27 (6), 583-596 (1995).
- . O2k Quality Control 1: Polarographic oxygen sensors and accuracy of calibration Available from: https://www.bioblst.at/images/archive/7/77/20210819114548%21MiPNet06.03_POS-Calibration-SOP.pdf (2020)
- WHO Laboratory Manual for the Examination and Processing of Human Semen. World Health Organization Available from: https://www.who.int/publications/i/item/9789240030787 (2010)
- . O2k-protocols SOP: O2k quality control 1 Available from: https://www.bioblast.at/images/9/9c/MiPNet06.03_POS-Calibration-SOP_DatLab8.pdf (2021)
- Gnaiger, E. . Mitochondrial Pathways and Respiratory Control. , (2012).
- Steinlechner-Maran, R., Eberl, T., Kunc, M., Margreiter, R., Gnaiger, E. Oxygen dependence of respiration in coupled and uncoupled endothelial cells. The American Journal of Physiology. 271, C2053-C2061 (1996).
- Holt, W. V., Van Look, K. J. W. Concepts in sperm heterogeneity, sperm selection and sperm competition as biological foundations for laboratory tests of semen quality. Reproduction. 127 (5), 527-535 (2004).
- Sousa, A. P., et al. Not all sperm are equal: Functional mitochondria characterize a subpopulation of human sperm with better fertilization potential. PloS One. 6 (3), e18112 (2011).
- Moscatelli, N., et al. Single-cell-based evaluation of sperm progressive motility via fluorescent assessment of mitochondria membrane potential. Scientific Reports. 7, 17931 (2017).
- Ferreira, J. J., et al. Increased mitochondrial activity upon CatSper channel activation is required for mouse sperm capacitation. Redox Biology. 48, 102176 (2021).
- Irigoyen, P., et al. Mitochondrial metabolism determines the functional status of human sperm and correlates with semen parameters. Frontiers in Cell and Developmental Biology. 10, 926684 (2022).
Erratum
Formal Correction: Erratum: High-Resolution Respirometry to Assess Mitochondrial Function in Human Spermatozoa
Posted by JoVE Editors on 9/26/2023. Citeable Link.
An erratum was issued for: High-Resolution Respirometry to Assess Mitochondrial Function in Human Spermatozoa. The Protocol and Representative Result sections were updated.
Step 2.4.12 of the Protocol was updated from:
Finally, inject 1 µL of 5 mM antimycin A (2.5 µM final concentration). This is a complex II inhibitor to discriminate between the mitochondrial and residual oxygen consumption (non-mitochondrial respiration). For the analysis of complex I, add 1 µL of 1 mM rotenone (0.5 µM final concentration), an inhibitor of this complex, instead of AA. Measure the oxygen consumption until the signal decreases and stabilizes.
to:
Finally, inject 1 µL of 5 mM antimycin A (2.5 µM final concentration). This is a complex III inhibitor to discriminate between the mitochondrial and residual oxygen consumption (non-mitochondrial respiration). For the analysis of complex I, add 1 µL of 1 mM rotenone (0.5 µM final concentration), an inhibitor of this complex, instead of AA. Measure the oxygen consumption until the signal decreases and stabilizes.
Figure 3 in the Representative Results section was updated from:
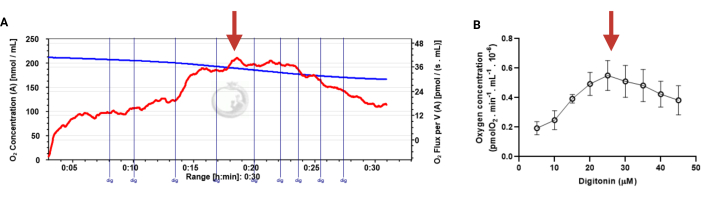
Figure 3: Determination of the optimal concentration of digitonin for the permeabilization of human sperm cells. The respiration rates were measured at 37 °C in MRM medium with glutamate, malate, and adenosine diphosphate. (A) Representative respiratory trace. The blue line is the O2 concentration, and the red line represents the O2 flow per volume correlated. (B) Mitochondria respiration rate means ± standard error, n = 4. The red arrow represents the optimal concentration. Abbreviation: dig = digitonin. Please click here to view a larger version of this figure.
to:
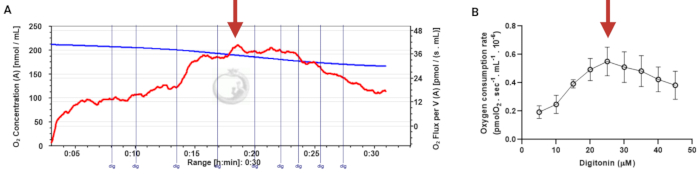
Figure 3: Determination of the optimal concentration of digitonin for the permeabilization of human sperm cells. The respiration rates were measured at 37 °C in MRM medium with glutamate, malate, and adenosine diphosphate. (A) Representative respiratory trace. The blue line is the O2 concentration, and the red line represents the O2 flow per volume correlated. (B) Mitochondria respiration rate means ± standard error, n = 4. The red arrow represents the optimal concentration. Abbreviation: dig = digitonin. Please click here to view a larger version of this figure.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten