Neuronale Fernaktivierung in Verbindung mit automatisierter Blutentnahme zur Induktion und Messung des zirkulierenden luteinisierenden Hormons bei Mäusen
In diesem Artikel
Zusammenfassung
Die Pulsatilität des luteinisierenden Hormons (LH) ist ein Kennzeichen der Fortpflanzungsfunktion. Wir beschreiben ein Protokoll zur Fernaktivierung spezifischer neuronaler Populationen, das mit der seriellen automatisierten Blutentnahme verbunden ist. Diese Technik ermöglicht eine zeitgesteuerte hormonelle Modulation, Multiplexing und die Minimierung von Manipulationseffekten auf den LH-Spiegel bei bewussten, sich frei bewegenden und ungestörten Tieren.
Zusammenfassung
Der zirkulierende Spiegel des luteinisierenden Hormons (LH) ist ein wesentlicher Indikator für die Funktion der Hypothalamus-Hypophysen-Kontrolle der Fortpflanzung. Die Rolle zahlreicher Inputs und neuronaler Populationen bei der Modulation der LH-Freisetzung ist noch unbekannt. Die Messung von Veränderungen des LH-Spiegels bei Mäusen ist oft eine Herausforderung, da sie leicht durch Umweltstress gestört werden können. Aktuelle Techniken zur Messung der LH-Freisetzung und Pulsatilität erfordern ein langfristiges Training für Mäuse, um sich an Manipulationsstress, bestimmte Zurückhaltung, die Anwesenheit des Forschers und die Arbeit an einzelnen Tieren anzupassen, was ihre Nützlichkeit für viele Forschungsfragen verringert.
In diesem Artikel wird eine Technik zur Fernaktivierung spezifischer neuronaler Populationen unter Verwendung der Designer Receptor Exclusive Activated by Designer Drugs (DREADDs)-Technologie in Verbindung mit automatisierter sequentieller Blutentnahme bei bewussten, sich frei bewegenden und ungestörten Mäusen vorgestellt. Wir beschreiben zunächst das stereotaktische Chirurgieprotokoll zur Verabreichung von Adeno-assoziierten Virusvektoren (AAV), die DREADDs exprimieren, an bestimmte neuronale Populationen. Als nächstes beschreiben wir das Protokoll für die Kanülierung der Halsschlagader und der Halsvene und den postoperativen Anschluss an das automatisierte Blutentnahmesystem CULEX. Schließlich beschreiben wir das Protokoll für die intravenöse Injektion von Clozapin-N-oxid zur neuronalen Fernaktivierung und automatisierten Blutentnahme. Diese Technik ermöglicht eine programmierte automatisierte Probenahme alle 5 Minuten oder länger für einen bestimmten Zeitraum, gekoppelt mit einer intravenösen Substanzinjektion zu einem gewünschten Zeitpunkt oder einer gewünschten Dauer. Insgesamt fanden wir, dass diese Technik ein leistungsstarker Ansatz für die Erforschung der neuroendokrinen Kontrolle ist.
Einleitung
Die Hypothalamus-Hypophysen-Gonaden-Achse (HPG) wird zentral durch die pulsierende Freisetzung von Gonadotropin-Releasing-Hormon (GnRH) in das Hypophysenportalsystem reguliert. In der Hypophyse steuert GnRH die pulsierende Freisetzung von Gonadotropinen, luteinisierendem Hormon (LH) und follikelstimulierendem Hormon (FSH) in das Kreislaufsystem. Die pulsierende LH-Freisetzung dient als Kennzeichen für die Funktion der zentralen HPG-Achse 1,2,3,4. Zum Beispiel zeigt es die Auswirkungen genetischer Veränderungen oder Veränderungen hormoneller oder Umweltfaktoren auf den neuronalen Teil der Achse 5,6,7. Bis vor kurzem war die Messung des LH-Pulsmusters auf große Säugetiere8 und Ratten9 beschränkt, da die Probenahme häufig und die großen Blutmengen zur Identifizierung der Pulse erforderlich sind.
Der Nachweis von LH-Impulsen in Mäusen ist wünschenswert, da diese Spezies über breite genetische Modelle verfügt und mit genomischen Technologien leicht manipuliert werden kann, um spezifische Gene und Zellpopulationen weiter zu untersuchen. In den letzten zehn Jahren hat ein großer Fortschritt bei der Analyse der LH-Konzentrationen in Mäusen mit einem Sandwich-LH-Enzym-verknüpften Immunosorbent-Assay (ELISA) den Nachweis von LH in einer winzigen Menge Blut ermöglicht10. Die Entwicklung der häufigen Blutentnahme an der Schwanzspitze hat die notwendige häufige Probenahme zum Nachweis der Frequenz und Amplitude von LH-Impulsen bei Mäusen ermöglicht10,11. Die Blutentnahme an der Schwanzspitze ist jedoch auf die Verwendung bei bei bewusstsein, wachen Tieren beschränkt; Es erfordert eine lange Trainingszeit für Mäuse, um sich an die Handhabung und die Anwesenheit eines bestimmten Prüfarztes während der Probenahme anzupassen. Sein Erfolg ist sehr anfällig für Umweltstressoren und möglicherweise nicht für den Einsatz bei Mäusestämmen mit hohem Angstniveau geeignet. Die intraatriale Kanülierung wurde auch für häufige Blutentnahmen bei frei beweglichen bewussten Mäusen verwendet12. Dieser Aufbau erfordert jedoch immer noch wiederholte manuelle Blutentnahmen und schränkt den Bewegungsraum der Tiere ein, während die Vorhofkanülierung zu dynamischen Veränderungen der Herzfunktion führen kann. Es ist daher wünschenswert, ein Verfahren zur Blutentnahme unter stressfreien Bedingungen bei bewussten, frei beweglichen und ungestörten Mäusen zu etablieren, ohne dass eine vorherige Schulung oder Handhabung oder Anwesenheit durch den Menschen erforderlich ist.
Automatisierte Blut- oder Dialysatproben wurden bereits früher zur Messung verschiedener Hormonspiegel (z. B. Melatonin13,14) und ihrer pulsierenden Sekretion (z. B. Wachstumshormon)15 bei ungezügelten Nagetieren eingesetzt. Wir stellen hier ein Protokoll für die automatisierte Langzeit-häufige Blutentnahme bei bewussten und ungebundenen Tieren vor, gekoppelt mit einer rechtzeitigen Fernaktivierung spezifischer neuronaler Populationen unter Verwendung chemogenetischer Technologien: der Designerrezeptoren, die ausschließlich durch Designerdrogen (DREADDs) aktiviert werden. Wir werden die stereotaktische Verabreichung eines Adeno-assoziierten Virus (AAV)-Vektors und die Fernaktivierung durch eine automatisierte intravenöse (IV) Verabreichung von Clozapin-N-oxid (CNO) beschreiben16,17. Dieses Protokoll ermöglicht den sequentiellen Nachweis von Basalwerten und induzierten Veränderungen der LH-Pulsatilität bei mehreren Tieren gleichzeitig. Sowohl die Blutentnahme als auch die IV-Abgabe der Verbindung werden zeitgesteuert über ein Computerprogramm durchgeführt, wodurch die physische Anwesenheit des Untersuchers oder die Notwendigkeit eines vorherigen Maustrainings entfällt. Diese Methode überwindet die Haupteinschränkungen der manuellen Blutentnahme. Es ermöglicht die Blutentnahme in einem stressfreien Zustand und die gleichzeitige Abgabe von IV-Verbindungen in Verbindung mit der Fernsteuerung der neuronalen Aktivität. Wir zeigen repräsentative Ergebnisse des Einsatzes der automatisierten Blutentnahme allein oder in Kombination mit neuronaler Fernaktivierung und diskutieren ihre Vorteile, Grenzen und zusätzlichen Anwendungen.
Protokoll
Alle Tierverfahren werden in Übereinstimmung mit dem National Research Council Guide for the Care and Use of Laboratory Animals18 sowie den Bundes-, Landes- und lokalen Gesetzen durchgeführt. Für diese Protokolldemonstration wurden erwachsene weibliche Mäuse (3-6 Monate alt) verwendet, darunter vier C57BL/6J-Weibchen und vier Kiss1-Cre; ChR2-eYFP (Kiss1-eYFP) Weibchen. Die Mäuse wurden unter einem 12:12-Hell-Dunkel-Zyklus gehalten, bei 22 °C temperaturgesteuert und ad libitum mit einer phytoöstrogenarmen Diät gefüttert. Die Verfahren und Protokolle wurden vom University of Michigan Institutional Animal Care and Use Committee (IACUC, Animal Protocols: PRO00010420 und PRO00010138) genehmigt.
1. Stereotaktische Abgabe von AAVs an eine bestimmte Zellpopulation
- Vorbereitung auf die Operation
- Sterilisieren Sie alle Werkzeuge. Bereiten Sie mehrere Packungen chirurgischer Instrumente vor, um sicherzustellen, dass jede Packung bei nicht mehr als fünf Tieren verwendet wird. Bereiten Sie sterile Handschuhe vor, mindestens ein Paar für jedes Tier.
- Ziehen Sie Glasmikropipetten für Injektionen mit den folgenden Einstellungen (siehe Materialtabelle) für lange, dünne Mikropipetten, die langsam und gleichmäßig injizieren und nicht leicht verstopfen: Hitze 1: 915, Hitze 2: 630, Zug: 630. Optimieren Sie diese Einstellungen für jeden Abzieher.
- Führen Sie Operationen in einem ausgewiesenen Operationsraum durch. Desinfizieren Sie chirurgische Oberflächen mit 70% Ethanol.
- Verwenden Sie sterile Abdeckungen, um die Sterilität des Operationsfeldes zu erhalten. Tragen Sie einen sauberen Laborkittel oder Einwegkittel und eine Maske.
- Bereiten Sie das Inhalationsanästhesiesystem vor. Offene Sauerstoffzufuhr und Regulierung der Durchflussmenge auf 0,8 l/min.
- Chirurgie
- Legen Sie die Maus in eine Anästhesiebox und öffnen Sie das Isofluran auf 2,5%. Reduzieren Sie den Isofluranfluss nach der ersten Induktion auf 2 %. Halten Sie den Fluss während des gesamten Verfahrens aufrecht. Alternative Anästhesiemethoden finden Sie im Tierprotokoll und in den Richtlinien der örtlichen Ethikkommission.
- Injizieren Sie ein präventives Analgetikum (Carprofen 5 mg/kg s.c.) gemäß den Empfehlungen des Tierverwendungsausschusses und den örtlichen Vorschriften.
- Rasieren Sie den Mauskopf mit einer Haarschneidemaschine.
- Stellen Sie das Tier auf einen stereotaktischen Tisch, platzieren Sie Ohrbügel und stellen Sie sicher, dass der Kopf richtig fixiert und stabil ist. Befestigen Sie den Mund der Maus am Mundstück und achten Sie darauf, die Zunge seitlich außerhalb des Mundes zu platzieren, um ein Ersticken zu vermeiden.
- Stellen Sie sicher, dass das Tier vor Beginn der Operation mit einem Zehenkneifen tief betäubt ist, und überwachen Sie den Atem und die Farbe der Maus während des gesamten Eingriffs.
- Platzieren Sie eine Höhenstütze unter der Maus, um Körper und Kopf in einer horizontalen Position zu halten. Halten Sie das Tier mit einer warmen Unterlage warm, die mit Papier bedeckt ist. Tragen Sie Augensalbe auf beide Augen auf, um ein Austrocknen zu vermeiden.
- Halten Sie den Operationsbereich so sauber wie möglich. Tragen Sie sterile Handschuhe. Desinfizieren Sie den Kopf der Maus vor dem Öffnen der Haut mit Jod und Alkohol. Schneiden Sie mit einem Skalpell die Haut am Kopf entlang der Mittellinie, ungefähr von hinter den Augen bis hinter die Lambda-Naht. Halten Sie den Schädel frei und reinigen Sie ihn mit einem Wattestäbchen, das in steriles 0,9% NaCl eingebettet ist.
- Suchen Sie die rostrale Rhinalvene (RRV) und markieren Sie sie mit einem sterilen Bleistift. Verwenden Sie das Stereoskop für den Rest des Verfahrens.
HINWEIS: Wir erzielen bessere Ergebnisse, wenn wir das RRV als anteroposteriore Referenz verwenden, aber es ist Standard, Bregma als Referenz zu verwenden. - Stellen Sie anhand einer sterilen Nadel als Referenz sicher, dass die Gehirnausrichtung korrekt ist, bevor Sie mit stereotaktischen Messungen fortfahren. Achten Sie auch darauf, dass die Höhen der Schädeloberfläche am RRV und Lambda sowie die seitliche Neigung gleich sind (± 0,02 mm).
HINWEIS: Die seitliche Neigung wird für die Injektion in mehr laterale Gehirnstrukturen relevanter. - Laden Sie eine sterile Glaspipette mit der zu injizierenden Viruslösung. Bringen Sie es zur RRV-Referenz für Referenz 0 anteroposterior (AP). Bewegen Sie sich entlang der sagittalen Naht bis zur AP-Koordinate Ihrer Wahl. Markieren Sie diese Position mit einem sterilen Bleistift, heben Sie die Nadel an und fahren Sie mit der Kraniotomie fort.
- Bohren Sie vorsichtig einen kleinen Kreis um die markierte Position, um einen Bruch des oberen Sagittalsinus zu vermeiden. Positionieren Sie den Bohrer in einer geneigten und nicht in einer senkrechten Position, um den Druck beim Bohren zu reduzieren. Entfernen Sie das Schädelstück mit einer kleinen Pinzette.
- Sobald das Gefäßsystem freigelegt ist, verwenden Sie die Mitte des Sinus sagittalis superior, um es als mediolaterale (ML) Referenz zu verwenden (Punkt 0); Dies ist präziser als die Verwendung der sagittalen Naht. Wechseln Sie zur ML-Position Ihrer Wahl. Senken Sie die Pipette ab, um die Dura-mater als dorsoventrale (DV) Referenz zu berühren (Punkt 0). Brechen Sie die Dura-Mater leicht ab und senken Sie die Pipette in die DV-Position Ihrer Wahl.
- Injizieren Sie die gewünschte Menge AAV (50-200 nL) und lassen Sie die Kanüle 3 Minuten lang an Ort und Stelle, um eine ausreichende Flüssigkeitsverteilung zu ermöglichen. Entfernen Sie die Pipette vorsichtig aus dem Gehirn.
- Lassen Sie die Maus von den Ohrstangen los. Verschließen Sie die Haut mit chirurgischen Clips oder einer Methode Ihrer Wahl. Setzen Sie das Tier zur Erholung in einen separaten beheizten Käfig. Überwachen Sie die Erholung, Reaktivität und Aktivität, nachdem die Maus aktiviert ist. Wenn die Maus vollständig wiederhergestellt ist, bewegen Sie sie zurück in ihren ursprünglichen Käfig.
- Warten Sie mindestens 3-4 Wochen auf die Virusexpression, bevor Sie mit dem zweiten Teil des Verfahrens fortfahren.
2. Kanulation der Halsvene und der Halsschlagader
- Vorbereitung auf die Operation
- Führen Sie Operationen in einem ausgewiesenen Operationsraum durch. Desinfizieren Sie chirurgische Oberflächen mit 70% Ethanol, bevor Sie die Eingriffe einleiten. Bereiten Sie mehrere Packungen chirurgischer Instrumente vor, um sicherzustellen, dass jede Packung bei nicht mehr als fünf Tieren verwendet wird.
- Autoklavieren Sie alle chirurgischen Instrumente. Reinigen Sie die Werkzeuge dann mit sterilem Wasser oder Kochsalzlösung und desinfizieren Sie sie mit einem Heißperlensterilisator für mindestens 15 s (gemäß den Anweisungen des Herstellers) zwischen den Operationen.
- Verwenden Sie sterile Abdeckungen, um die Sterilität des Operationsfeldes zu erhalten. Tragen Sie einen sauberen Laborkittel oder Einwegkittel und eine Maske.
- Bereiten Sie Mikrokatheter für Kanülen in der Halsschlagader und der Halsvene vor. Konstruieren Sie den Arterienkatheter, indem Sie ein kleines Segment eines Mikrorenathanschlauchs (gestreckt von 0,025 Zoll Außendurchmesser [OD] x 0,012 Zoll Innendurchmesser [ID]) mit einem silastischen Schlauch (0,025 Zoll OD x 0,012 Zoll ID) verbinden. Konstruieren Sie den Venenkatheter nur mit silastischen Schläuchen (0,025 Zoll Außendurchmesser x 0,012 Zoll Innendurchmesser). Weichen Sie alle Katheter vor der Operation über Nacht in 70%igem Ethanol ein.
- Schrägen Sie die geschnittenen Spitzen beider Katheter im Winkel von 45° auf die vorgeschätzte Länge basierend auf dem Körpergewicht und der Länge des Tieres ab.
- Chirurgische Eingriffe
- Betäuben Sie die Tiere unter 2 % Isofluran mit einem Tisch-Low-Flow-Isofluran-System, um das Anästhesiestadium und die Anästhesieebene während der Operation präzise zu kontrollieren.
- Injizieren Sie die vorbeugende Dosis eines Analgetikums (Carprofen 5 mg/kg s.c.) und tragen Sie eine Augensalbe auf, um Austrocknung und Hornhautverletzungen zu verhindern.
- Rasieren Sie den Bauch- und Rückenbereich des Halses und reinigen Sie die Haut mit drei Jodpeelings abwechselnd mit 70% Ethanol. Schneiden Sie einen vertikalen Hautschnitt (12 mm) zwischen den Schulterblättern und decken Sie ihn für die spätere Verwendung mit chirurgischer Gaze ab. Legen Sie das Tier in Rückenlage mit dem Kopf zum Chirurgen.
- Verwenden Sie für die meisten der unten beschriebenen Verfahren ein Stereo-Präparierfernrohr.
- Machen Sie einen kleinen vertikalen Schnitt (~10 mm) auf der rechten Seite des Halses, oberhalb des Schlüsselbeins, um die rechte Halsschlagader und die Halsvene freizulegen. Schneiden Sie die Haut mit einer Schere und führen Sie eine stumpfe Dissektion durch, um das Unterhautgewebe mit einer nicht gezahnten Mikrozange mit feinen Spitzen zu trennen, wobei die rechte äußere Halsvene und die rechte Halsschlagader freigelegt werden.
- Binden Sie das distale Ende der Halsvene ab, um den Blutfluss zu stoppen, und schneiden Sie mit einer Mikrozange und einer Schere ein kleines Loch in die kollabierte Vene. Führen Sie den Venenkatheter schräg nach unten und proximal mit einer Mikrozange durch die obere Hohlvene bis zum rechten Vorhof. Die eingesetzte Länge beträgt ~10-12 mm für eine 30 g schlanke Maus. Binden Sie den Katheter zur Fixierung mit 7-0-Seidennähten am Gefäß fest.
HINWEIS: Wenn sich der Katheter an der richtigen Stelle befindet, kann Blut leicht entnommen werden. Andernfalls kann der Katheter in die laterale Brustvene verlegt werden und muss erneut eingeführt werden. - Sezieren Sie vorsichtig das Bindegewebe, um die rechte Halsschlagader freizulegen, die sich in einem dreieckigen Bereich befindet, der vom M. sternohyoideus, dem M. sternomastoideus und dem Musculus digastricus umgeben ist. Verwenden Sie bei Bedarf einen Drahtaufroller, um diese Muskeln zu trennen. Binden Sie die Arterie auf Höhe der Bifurkation der inneren und äußeren Halsschlagadern mit 7-0-Seidennähten zusammen. Platzieren Sie zwei nicht gebundene Nahtschlaufen proximal.
- Stoppen Sie vorübergehend den Blutfluss, indem Sie an einer ersetzten Nahtschlaufe ziehen und mit einer Mikroschere oder einer 27-G-Nadel ein kleines Loch in die Gefäßwand schneiden oder stanzen. Führen Sie den arteriellen Katheter schräg nach unten und proximal bis zu einer geschätzten Länge ein, die den Aortenbogen erreicht, ohne jedoch die Aortenklappe zu berühren. Die eingesetzte Länge beträgt ~9-10 mm für eine 30 g schlanke Maus. Binden Sie den Katheter zur Fixierung mit den beiden vorgefertigten Nähten mit dem Gefäß zusammen.
- Tunneln Sie alle Katheter subkutan und führen Sie sie im Nacken über den vorgeschnittenen Schnitt nach außen und verbinden Sie sie mit den venösen oder arteriellen Anschlüssen eines silikonbeschichteten Schlauchanschlusses aus 25-G-Nadelschlauch: modifizierter MASA19 mit zwei 25-G-Nadelschläuchen und zwei 4,0 cm PE-20-Schläuchen, gesleevt mit 2,0 cm Silastik-Schlauch mit 0,062 Zoll ID, der mit einem kleinen Metalldrahtring befestigt ist. Das Gesamtlumenvolumen jedes Katheters einschließlich des Konnektors beträgt 6-8 μl (Abbildung 1A).
- Schließen Sie den ventralen Schnitt und fixieren Sie den Konnektor subkutan am Verschluss der Rückenhaut mit Nähten. Füllen Sie beide Katheter mit heparinisierter Kochsalzlösung (200 U/ml) und verschließen Sie sie am Ende fest mit chirurgischen Drähten aus Edelstahl.
- Mäuse erholen sich innerhalb von Minuten von der Isofluran-Anästhesie und erholen sich innerhalb von 5 Tagen vollständig von der Operation. Legen Sie die Tiere 24 Stunden nach der Operation in die automatische Blutentnahmekammer und verbinden Sie sie mit dem System, indem Sie den Haltehaken des Systems mit dem Metallring verbinden, der an dem am Nacken implantierten Schlauchanschluss befestigt ist. Schließen Sie den arteriellen und venösen Katheter 24 h vor Beginn der Probenahme an die Injektions- bzw. Probenahmeleitungen an (Abbildung 1B). Die Gesamtlänge der Probenahmeleitung beträgt 55 cm Länge oder 40 μl Lumenvolumen.
HINWEIS: Der Aufbau der Injektions- und Probenahmelinien, die Programmierung der Entnahmemethode und die Käfigbalancemechanismen des automatisierten Blutprobenahmesystems wurden ausführlich beschrieben20,21. Das System hält den Katheter offen, indem es automatisch alle 20 Minuten 10 μl heparinisierte Kochsalzlösung abgibt. - Stellen Sie die Zeit und Häufigkeit der Probenahme vor der Injektion, der Injektion und der Probenahme nach der Injektion über das Computerprogramm des Systems ein. Siehe Schritt 3.1 unten für die aktuellen Einstellungen.
- Das System ermöglicht es dem Tier, sich frei zu bewegen, ohne die Probenahme- und/oder Infusionsleitungen zu verheddern, indem es die Mausbewegung erfasst, während die Gehäusekammer in entgegengesetzte Richtung zur Mausbewegunggedreht wird 21 (Abbildung 1).
- Füllen Sie die Infusions- oder Injektionsleitung wieder mit der Verbindung und schließen Sie sie mindestens 2 Stunden vor Beginn der Infusion oder Injektion wieder an den Venenkatheter an.
HINWEIS: Es können Komplikationen bei der Operation auftreten, und die Tiere müssen zur Genesung und an den Tagen nach der Operation engmaschig überwacht werden. Beziehen Sie sich auf das Tierprotokoll für die korrekte Überwachung, Abbruchanforderungen und Verfahren.
3. Automatisierte Blutentnahme und intravenöse Injektion
- Automatisierte Blutentnahme
- Um diesem Protokoll zu folgen, verwenden Sie ein Probenahmevolumen von 20,0 μl und stellen Sie ein Intervall (d. h. 7,0 min) zwischen jeder Probenahme ein, um eine Probenahmefrequenz von alle 10,0 Minuten pro Probe zu erreichen. Die maximale Rate beträgt kontinuierlich 3,0 min/Probe; das minimal mögliche Probenvolumen beträgt 5,0 μl. Eine gleiche Menge Kochsalzlösung wird automatisch vom System zurückgegeben, um das entnommene Blut zu ersetzen und das Gleichgewicht der Körperflüssigkeit aufrechtzuerhalten.
- Die Gesamtprobenahmezeit wird auf 30 (t = -30 - 0) min vor und 30 (t = 0 - 30) min nach der intravenösen Injektion von CNO (0,5 mg/kg, Abbildung 2) festgelegt.
- Jede entnommene Blutprobe (20,0 μl) wird automatisch in 50 μl Kochsalzlösung (mit Heparin bei 10 U/ml) verdünnt und einzeln in einem Mikroröhrchen aufbewahrt, das vom System in einem gekühlten Probenkarussell aufbewahrt wird.
- Automatisierte intravenöse Injektion
- Trennen Sie die Venenleitung vom Venenkatheter, um CNO (individuell berechnete Volumendosis von ~50-60 μl bei 0,5 mg/kg) mindestens 2 Stunden vor Beginn der Blutentnahme nachzufüllen.
- Ziehen Sie die Lösung (etwas mehr als das berechnete Volumen) manuell mit der Injektionsspritze retrograd aus der Leitung ab, wobei eine kleine Luftblase zwischen der Lösung und der vorhandenen Kochsalzlösung in der Leitung verbleibt.
- Schließen Sie die Injektionsleitung wieder an den Venenkatheter an und stellen Sie die Injektionsrate auf 500 μl/min und die Injektionsstartzeit auf 2 min ein, nachdem die Probenahme t = 0 beendet ist. Die Gesamtinjektionszeit für jedes Tier beträgt 5-6 s.
HINWEIS: Bei Bedarf kann die Verbindung auch durch eine manuelle intraperitoneale Injektion (IP) verabreicht werden, dies erfordert jedoch eine Störung des Tieres während oder vor dem Blutentnahmeprotokoll. Auch diese Alternative zeigen wir in den Ergebnissen.
4. Tierperfusion und Gehirnentnahme (OPTIONAL)
HINWEIS: Dieses Verfahren ist nur zu befolgen, wenn das Gehirn die Gehirnstelle der neuronalen Aktivierung oder der nachgeschalteten Reaktionen analysieren muss.
- Trennen Sie die Maus am Ende des Entnahmeprotokolls vom Blutentnahmesystem. Zwei Stunden nach der intravenösen Injektion wird das Tier mit 10% neutralem gepuffertem Formalin (NBF) perfundiert, wobei die bevorzugte Methode oder wie an anderer Stelle beschrieben angewendetwird 22.
- Sezieren Sie das Gehirn und konservieren Sie es 3 h lang in 20% Saccharose in 10%-NBF, um die Fixierung fortzusetzen.
- Nach 3 Stunden wird das fixierte Gehirn auf 20 % Saccharose in PBS übertragen und bei 4 °C konserviert, bis es zum Schneiden bereit ist.
HINWEIS: Vermeiden Sie eine Überfixierung, da dies die cFOS-Antigene maskiert. In der 20%igen Saccharoselösung sollte das Gehirn auf den Boden des Behälters sinken. - Machen Sie Schnitte mit einem Gefriermikrotom oder Kryostaten und verwenden Sie die bevorzugte Methode, um die neuronale Aktivierung zu untersuchen (z. B. cFOS-Immunhistochemie wird gezeigt).
HINWEIS: Die für die aktuellen Ergebnisse verwendeten Antikörper sind in der Materialtabelle beschrieben.
5. Probenverarbeitung und -analyse
- Entnehmen Sie unmittelbar nach Ende des Experiments Blutproben aus dem automatischen Probenehmer und legen Sie sie auf Eis.
- Schleudern Sie die Proben bei 14.000 × g für 30 s.
- Sammle das Plasma. Bis zur Analyse bei -80 °C lagern.
- Die Blutproben werdenwie oben beschrieben mittels LH-ELISA untersucht.
Repräsentative Ergebnisse
Kisspeptin-exprimierende Neuronen (Kiss1-Gen), die sich im Nucleus arcuatus des Hypothalamus befinden, sind ein starker Stimulator für GnRH und damit für die LH-Freisetzung aus der Hypophyse24,25. In dieser Protokolldemonstration haben wir die Kisspeptin-induzierte LH-Sekretion verwendet, um die Funktionsweise der automatisierten Blutentnahmetechnik zu veranschaulichen. Abbildung 2 zeigt repräsentative LH-Muster bei erwachsenen Kiss1-eYFP-Weibchen, die zuvor eine einseitige stereotaktische Injektion von AAV-hM3Dq-mCherry in den Nucleus arcuatus erhalten hatten (AP: -4,95, ML: -0,35, DV: -5,7). Das ChR2-eYFP wurde als fluoreszierender Reporter für Kiss1-Zellen verwendet. Einen Monat nach der stereotaktischen Operation wurden die Mäuse einer Kanüle der Halsschlagader und der Halsvene unterzogen und 4 Tage nach der Operation an den automatischen Blutprobenehmer angeschlossen. Die Blutentnahmen zur Bestimmung des basalen LH-Spiegels wurden am nächsten Tag mit einer Probenahmefrequenz von 10 Minuten (7 Minuten Intervall zwischen den Proben und 3 Minuten/Probenahme) begonnen, gefolgt von einer automatisierten intravenösen CNO-Injektion und einer fortgesetzten Blutentnahme alle 10 Minuten für 30 Minuten. Die diestrosen LH-Spiegel sind im Allgemeinen niedrig (Abbildung 2A), aber Schwankungen werden normalerweise aufgrund ihrer pulsierenden Freisetzung beobachtet (Abbildung 2B). Nach der CNO-Injektion (und der Aktivierung von Kisspeptin-Neuronen) war der LH-Anstieg stark (innerhalb von 10 Minuten). Der Grad des Anstiegs und die Dauer des Peaks hängen von zahlreichen Faktoren ab, darunter der Ort der Injektion, die Anzahl der aktivierten Neuronen oder die Zielpopulation.
Abbildung 3 zeigt die Injektionsstelle des Gehirns im Nucleus arcuatus der weiblichen Maus, dargestellt in Abbildung 2A. Kiss1-eYFP-Neuronen sind grün markiert, während die mCherry-Immunreaktivität den Ort der AAV-Injektion und -Aktivierung nach CNO zeigt. Aktivierte Neuronen wurden mittels cFOS-Immunreaktivität nachgewiesen, markiert mit DAB. Die meisten mCherry-Neuronen kolokalisierten mit Kiss1-eYFP, und viele zeigten eine cFOS-Immunreaktivität, was zeigt, dass die virale und neuronale Aktivierung spezifisch für die Zielpopulation war.
Ein repräsentatives pulsierendes LH-Freisetzungsmuster in Mäusen mit diesöstrusem Wildtyp (C57BL/6J), gefolgt von der Reaktion auf eine IP-Injektion von Kisspeptin-10, ist in Abbildung 4 dargestellt. Die Maus wurde einer Kanülierung der Halsschlagader unterzogen und 4 Tage nach der Operation an das automatische Blutentnahmesystem angeschlossen. Am nächsten Morgen wurden die Östruszyklen überprüft und die Blutentnahme und Kisspeptin-10-Injektion am26. Tag durchgeführt. Blutproben wurden alle 7 Minuten für 2 Stunden (4-Minuten-Intervall, plus 3 Minuten/Probenahme für 120 Minuten vor der Injektion) entnommen, um die Ausgangswerte und die LH-Pulsatilität zu bestimmen, gefolgt von einer IP-Injektion von Kisspeptin-10 (65 μg/kg) und einer fortgesetzten Blutentnahme alle 7 Minuten für weitere 30 Minuten. Es wurden klare LH-Pulse beobachtet, die für eine Frau in der Diöstrus typisch sind und niedrige basale LH-Spiegel, eine Pulsfrequenz von ~2 Impulsen/h und eine Pulsamplitude von ~1 ng/mLzeigten 27. Als Reaktion auf die Verabreichung von Kisspeptin wurde ein sofortiger und robuster LH-Anstieg festgestellt28. Die LH-Sekretionsmuster und -veränderungen nach der Stimulation stimmen mit anderen Studien überein, in denen die manuelle Blutentnahme verwendetwurde 10,27,29,30. Diese Ergebnisse zeigen, dass die automatisierte Blutentnahmemethode die typische und stimulierte LH-Sekretion unter stressfreien Bedingungen erfasst.
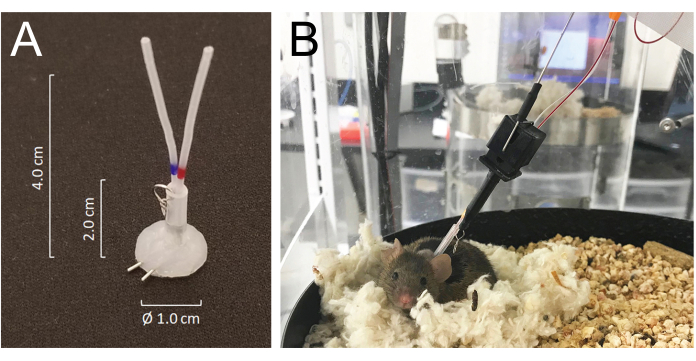
Abbildung 1: Details des Verbindungssystems und der Mausanschlüsse an den Schläuchen des Infusions- und Probenahmesystems. (A) Ein silikonbeschichteter Schlauchverbinder (MASA), der aus zwei 25G-Nadelschläuchen und zwei PE-20-Schläuchen besteht, die in einem silastischen Schlauch ummantelt sind, der mit einem kleinen Metallring befestigt ist. (B) Eine Maus, die mit dem Infusions- und Probenahmeschlauch im Probenahmekäfig verbunden ist und während der Blutentnahme in ihrem Nest ruht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
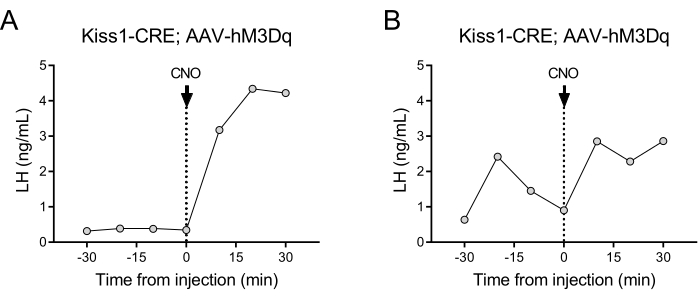
Abbildung 2: Repräsentative Ergebnisse für LH-Impulse in weiblichen Kiss1-Cre-Mäusen, denen AAV-hM3Dq in den Nucleus arcuatus injiziert und mit CNO aus der Ferne aktiviert wurde. Der basale LH-Spiegel wurde eine halbe Stunde lang alle 10 Minuten gemessen. Zum Zeitpunkt 0 nach der Blutentnahme erhielt die Frau eine intravenöse Injektion von Clozapin-N-oxid (0,5 mg/kg) und es wurde weiterhin alle 10 Minuten für eine weitere halbe Stunde Blut aus der Halsschlagader entnommen. (A) Zeigt ein Weibchen mit niedrigen basalen LH-Spiegeln. (B) Zeigt eine Frau mit einer LH-Impuls-Vorinjektion. Abkürzungen: Kiss1 = Kisspeptin; AAV = Adeno-assoziiertes Virus; CNO = Clozapin-N-oxid; LH = luteinisierendes Hormon. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
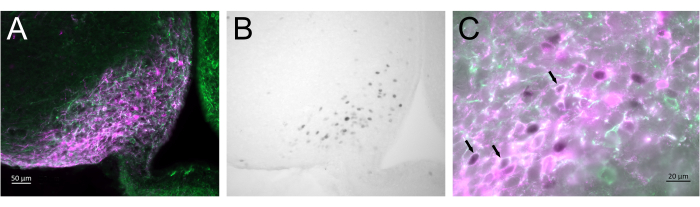
Abbildung 3: Gehirnaktivierung im Nucleus arcuatus des Kiss1-Cre; Chr2-eYFP (Kiss1-eYFP) Weibchen in Abbildung 2A. ChR2-eYFP wurde nur als Reportergen verwendet, um kiss1-Neuronen zu markieren. (A) Fluoreszenzbild mit geringer Vergrößerung, das die Stelle der AAV-Injektion im Nucleus arcuatus zeigt. Grün: eYFP-Immunreaktivität, Magenta: mCherry-Immunreaktivität. (B) Hellfeldbild mit geringer Vergrößerung des Bereichs, der Abbildung 3A entspricht und die cFOS-Immunreaktivität (schwarz) an der Stelle der AAV-Injektion im Nucleus Arcuate zeigt. (C) Fluoreszenz- und Hellfeldbild mit hoher Vergrößerung, das einen genaueren Blick auf die Neuronen in Abbildung 3A, B zeigt. Kiss1-eYFP-Neuronen, die AAV-mCherry koexprimieren und aktiviert wurden, sind solche mit weißem Zytoplasma und schwarzem Kern (Pfeile). Maßstabsleisten = 50 μm (A,B), 20 μm (C). Abkürzungen: Kiss1 = Kisspeptin; AAV = Adeno-assoziiertes Virus; eYFP = verstärktes gelb fluoreszierendes Protein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
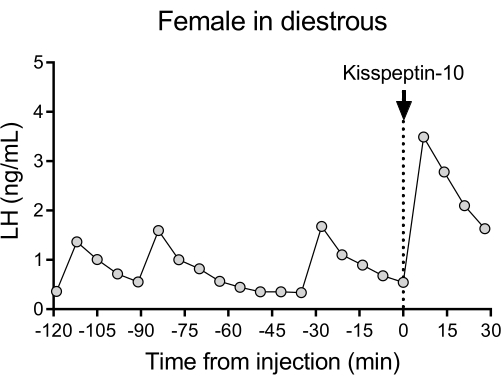
Abbildung 4: Basale LH-Pulsatilität bei einem Weibchen mit dem Wildtyp, gemessen alle 7 Minuten für 2 h. Die Frau erhielt dann eine intraperitoneale Injektion von Kisspeptin-10 (65 μg/kg) zum Zeitpunkt 0, und Blutproben wurden kontinuierlich alle 7 Minuten für eine halbe Stunde entnommen. Abkürzung: LH = luteinisierendes Hormon. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Mit diesem Protokoll konnten wir die basale LH-Pulsatilität und LH-Sekretion nach Stimulation einer neuronalen Population zeigen. Die großen Vorteile des Systems sind die stressfreie Umgebung, in der die Probenahme stattfindet, ohne menschliche Anwesenheit oder Handhabung während der Blutentnahme. Darüber hinaus waren keine vorherigen mühsamen Tiertrainings und Anpassungen an die Anwesenheit oder Handhabung von Menschen während des Experiments erforderlich. Frühere Experimente mit manueller Blutentnahme erforderten viel Zeit und Mühe, um Stressoren zu minimieren 7,31,32. Das Abschneiden des Schwanzes allein ist jedoch ein Stressfaktor33. Die Implementierung einer stressfreien Umgebung und eines Trainingsparadigmas in gemeinsam genutzten Tiereinrichtungen, in denen Unterbrechungen unvorhersehbar sind, kann ebenfalls eine Einschränkung darstellen. In einigen Labors müssen Tiere oft zur Blutentnahme in alternative Verfahrensräume transportiert werden. Diese Einschränkungen können die manuelle Methode für die Erkennung subtiler Veränderungen des LH-Spiegels ungeeignet machen, und daher kann ein Hands-Off-Ansatz in diesen Situationen hilfreich sein. Die automatisierte Probenahme findet in einem ruhigen Raum statt, in dem die Mäuse mehrere Tage im Voraus platziert werden, um sich an die neue Umgebung zu gewöhnen. Unsere bisherigen Erfahrungen mit diesem Protokoll ermöglichten einen präzisen Nachweis von Corticosteron- und pulsierenden Wachstumshormon-Sekretionsmustern bei Mäusen, die während der automatisierten Probenahme keine erhöhten Corticosteronspiegel zeigten15. In den aktuellen Experimenten waren alle Tiere gut an das Probenahmesystem angepasst, das den Nestbau in der Probenahmekammer nach ~24 h und eine helle Haarfarbe zeigte, was auf einen Mangel an Stress und einen insgesamt guten Gesundheitszustand hinweist (Abbildung 1).
Die Hauptschwierigkeit, die zu negativen Ergebnissen führt, ist wahrscheinlich die unangemessene Ausrichtung des AAV auf die erforderliche neuronale Population. Präzision bei den stereotaktischen Injektionen ist unerlässlich und sollte im Voraus geschult werden, um die Koordinaten und Injektionsvolumina zu überprüfen. Das Training kann durchgeführt werden, indem eine kleine Menge von 0,5-1% Evans Blue an die gewünschte Stelle injiziert wird, wenn keine Genesungsoperation durchgeführt wird, und dann ein Stück des frisch präparierten Gehirns mit einer Maushirnmatrix (z. B. Ted Pella) entnommen wird, um die Stelle und Größe der Injektion mit einem Stereoskop zu überprüfen.
Es ist auch wichtig zu berücksichtigen, dass Blut und Plasma, das aus dem automatisierten Blutentnahmesystem entnommen wird, in heparinisierter Kochsalzlösung verdünnt wird (z. B. 20 μl Blut in 50 μl Kochsalzlösung in unseren Ergebnissen)20, und das Verdünnungsverhältnis muss möglicherweise an die Empfindlichkeit der ausgewählten Analysemethode angepasst werden. Wir testeten LH-Spiegel in Vollblut, verdünnt in BSA-PBS (wie empfohlen für ultrasensitiven LH-ELISA)10 oder Kochsalzlösung, und fanden keine Unterschiede in den LH-Werten. Tween kann nicht im Verdünnungsmittel verwendet werden, da dieses in das Blutsystem zirkuliert, um die Proben zu extrahieren, indem die Probenflüssigkeitenersetzt werden 20. Unserer Erfahrung nach ergaben Verdünnungen unter 1:10 gute LH-Ergebnisse, aber leicht unterschätzte LH-Werte im Vergleich zu 1:3,5. Dies deutet darauf hin, dass die Verdünnung bei Bedarf weiter angepasst werden kann, um die entnommene Blutmenge zu reduzieren.
Eine Alternative zur automatisierten Verabreichung von Präparaten ist die manuelle Injektion über den Venenkatheter. In diesem Fall ist der Untersucher kurz im Raum anwesend, um die Injektion zu verabreichen. Es besteht jedoch kein direkter Kontakt zu den Tieren oder ihrer Haltung und Umgebung und im Gegensatz zu intraperitonealen oder subkutanen Injektionen wird der gesamte Vorgang vom Tier oft nicht bemerkt. Die Vorteile einer manuellen Injektion bestehen darin, dass die Verdünnung der Verbindung nicht im Voraus eingerichtet werden muss, was für Verbindungen, die für die Verwendung in größeren Mengen zu teuer sind oder empfindlich auf den Abbau im Laufe der Zeit reagieren, kritisch sein kann. da das Betriebsvolumen kleiner ist als bei der automatisierten Verabreichung, bei der die Infusionsleitung und der Katheter mit mehr Verbundlösung vorgefüllt werden müssen.
Die automatische Blutentnahme bietet eine einzigartige Möglichkeit, LH-Schwankungen während des Schlafs zu untersuchen. Wir haben regelmäßig Tiere beobachtet, die während der Probenahmezeit in ihren Nestern schlafen. Es ist möglich, diese Abtastung mit EEG-Aufzeichnungen zu verknüpfen, um eine detailliertere Analyse der Beziehung zwischen neuronaler Aktivität und LH-Musterzu generieren 34. Wie hier gezeigt, sind die Möglichkeiten für den Einsatz automatisierter Blutproben vielfältig: von der basalen LH-Probenahme über die Prüfung der LH-Antwort auf endogene oder exogene Verbindungen bis hin zur Aktivierung oder Unterdrückung neuronaler Populationen. Die neuronalen Manipulationen können akut mit Chemogenetik oder Optogenetik oder dauerhaft mit transgenen Mausmodellen und apoptotischen oder neuronalen Silencing-Werkzeugen implementiert werden. Die automatisierte Blutentnahme ermöglicht auch die Messung anderer Hormone mit stark pulsierenden sekretorischen Mustern (z. B. Wachstumshormon15). Bei weiblichen Mäusen können, wenn eine bestimmte Phase des Östruszyklus erforderlich ist, Vaginalabstriche Stunden vor Beginn des Protokolls26 sorgfältig entnommen werden, ohne die Infusions- und Probenahmeleitungen zu unterbrechen. Die Tiere können 7-10 Tage lang an das Probenahmesystem angeschlossen werden, wobei das Risiko einer Gerinnung der arteriellen Leitung mit der Zeit zunimmt.
Diese Technik ist jedoch auf den Einsatz bei Tieren in Einzelhaltungen beschränkt und daher möglicherweise nicht für die Untersuchung sozialer Interaktionen geeignet. Es ist auch invasiv und erfordert eine technisch anspruchsvolle Operation, so dass es möglicherweise nicht möglich ist, es bei Jungtieren oder bestimmten Krankheitsmodellen umzusetzen. Da die Kosten für die Anschaffung des Systems für ein einzelnes Forschungslabor zu hoch sein können, wäre es ratsam, es in einem Kernlabor einzurichten, das das erwähnte Versuchsprotokoll als Dienstleistungen anbietet.
Zusammenfassend zeigt dieses Protokoll, wie eine stereotaktische Verabreichung von AAV in Kombination mit einer automatisierten Blutentnahme durchgeführt werden kann. Die präzise räumliche und zeitliche Kontrolle, die mit dieser Technik erreicht wird, zusammen mit ihrer Flexibilität bei der Anwendung auf verschiedene Modelle, Messprotokolle und Hormone, macht sie zu einer leistungsstarken Methode für die Untersuchung der Hormonregulation bei Nagetieren. Am wichtigsten ist, dass die Methode eine stressfreie Umgebung bietet, indem sie die Anwesenheit und Handhabung von Menschen während der Injektion und/oder Probenahme sowie die vorherige Tierschulung eliminiert. Diese Vorteile, zusammen mit der Möglichkeit des Multiplexings, machen diese Methode zu einem einzigartigen Werkzeug zur Untersuchung der neuronalen Kontrolle hormoneller Veränderungen bei bewussten, frei beweglichen und ungestörten Mäusen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Wir danken Dr. Daniel Haisenleder für seine Hilfe bei der Erprobung verschiedener Blutverdünnungsmethoden. Serumhormon-Assays wurden am University of Virginia Center for Research in Reproduction Ligand Assay and Analysis Core durchgeführt, unterstützt durch den Eunice Kennedy Shriver NICHD Grant R24 HD102061. Das Michigan Mouse Metabolic Phenotyping Center-Live wird vom NIH Center Grant U2C DK135066 unterstützt. JF und NQ werden durch DK020572 (MDRC) und DK089503 (MNORC) Zuschüsse unterstützt. CFE und CSM werden durch die NICHD-Zuschüsse R21 HD109485 und R01 HD096324 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| AAV8-hSyn-hM3D(Gq)-mCherry | Addgene | 44361 | Not necessarily this virus but this was the one used for representative results |
| Alcohol | Disinfection | ||
| Anesthesia Induction box | Vetequip | ||
| Anesthesia induction machine | Kent Scientific Equipment | SomnoSuite | |
| Anesthesia masks for mice | Kent Scientific Equipment | SOMNO-0801 | |
| Autoclip applier 9 mm | Clay Adams | 427630 | |
| Autoclip remover 9 mm | Clay Adams | 427637 | |
| Autoclips 9 mm | Clay Adams | 427631 | |
| BASi Culex Controller | Culex | SN: 2151, 2152, 2156, 2158 | 4 stations |
| BASi Honey Comb Fraction Collector | Honey Comb | SN: 2105, 2106, 2107, 2108 | 4 stations |
| BASi Ratrun Rotation Control | RATURN 2 | SN: 5680, 5681, 5682, 5683 | 4 stations |
| C57BL/6J mice | JAX # 000664 | ||
| Carprofen | Zoetis | Rimadyl | Analgesic |
| Clippers | Braun | ||
| Clozapine-N-oxide | ENZO | BLM-NS105-0005 | |
| Cotton tipped applicators | |||
| CULEX Automated In Vivo Sampling System | BASi | DS000627 | with CX-4000S Replacement Tubing Sets |
| Curved forceps serrated | FST | 11151-10 | |
| Drill | Dremel | 61100 | |
| Empis control Module | EMPIS CM | SN: 174 | |
| Empis Programmable Infusion System | EMPIS | SN: 2125 , 2126, 2127, 2128 | With CX-7010S 4 BAS-2 Infusion Sets; 4 stations |
| Envigo 2016 diet | low-phytoestrogen diet | ||
| Eye ointment | Dechra | Puralube Vet Ointment | Petrolatum Ophtalmic oinment |
| Glass pipettes | World Precision Instruments | MIB100-6 | |
| Hemostats | Roboz Surgical | RS-7101 | |
| Iodine | Betadine Surgical scrub | ||
| Isoflurane | VetOne | Fluriso | Anesthetic |
| Isoflurane Vaporizer or SomnoSuite Low-Flow Anesthesia System | Surgivet or Kent Scientific Corp | SS-01 | Anesthesia Machine |
| Kiss1-Cre;ChR2-eYFP (Kiss1-eYFP) mice | JAX # 023436 and #024109 | ||
| Kisspeptin-10 | Phoenix Pharmaceuticals | 048-56 | |
| Micro-renathane tubing | Braintree Scientific | MRE025 | Surgical catheterization |
| Micro-Scissors | Roboz Surgical | RS-5606 | |
| Needle Holder | Roboz Surgical | RS-7842 | |
| Picoliter injector | Warner Instruments | PLI-100A | |
| Pipette puller | Sutter Instruments | P30 | |
| Rodent Warmer X2 | Stoelting | 53850 | |
| Scalpel | FST | 10003-12 | |
| Scissors | Roboz Surgical | RS-6808 | |
| Silicon tubing | Liveo Laboratory Tubing | NO.508-001 | 0.012 in I.D x 0.025 in O.D. |
| Stereotaxic table | RWD | E06208 | |
| Sterile 0.9% saline | Baxter | 2F7124 | |
| Sterile towel drapes | Dynarex | 4410 | |
| Surgical blades | SKLAR | 06-3011 | |
| Surgical stereoscope | Zeiss | f-160 | |
| Tweezers | Roboz Surgical | RS-4960 | |
| Tweezers | Roboz Surgical | RS-4972 | |
| Tweezers | Roboz Surgical | RS-5058 | |
| Antibodies | |||
| Anti-cFos | Millipore | ABE457 | Antigen target: N-terminus cFos; Host organism: Rabbit; Dilution used: 1:5,000; RRID: AB_2631318 |
| Anti-GFP | Aves Labs | GFP-1010 | Antigen target: recombinant GFP null; Host organism: Chicken; Dilution used: 1:10,000; RRID: AB_2307313 |
| Biotin-SP-conjugated AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch Labs | 711-065-152 | Antigen target: Rabbit IgG (H+L); Host organism: Donkey; Dilution used: 1:1,000; RRID: AB_2340593 |
| Donkey anti-Rat IgG, AlexaFluor 594 | Thermo Fisher Scientific | A-21209 | Antigen target: Rat IgG (H+L); Host organism: Donkey; Dilution used: 1:500; RRID: AB_2535795 |
| Goat anti-Chicken IgY, Alexa Fluor 488 | Thermo Fisher Scientific | A-11039 | Antigen target: Chicken, IgY (H+L); Host organism: Goat; Dilution used: 1:500; RRID: AB_2534096 |
| mCherry monoclonal (16D7) | Thermo Fisher Scientific | M11217 | Antigen target: mCherry tag; Host organism: Rat; Dilution used: 1:5,000; RRID: AB_2536611 |
Referenzen
- Kokoris, G. J., Lam, N. Y., Ferin, M., Silverman, A. J., Gibson, M. J. Transplanted gonadotropin-releasing hormone neurons promote pulsatile luteinizing hormone secretion in congenitally hypogonadal (hpg) male mice. Neuroendocrinology. 48 (1), 45-52 (1988).
- Coquelin, A., Desjardins, C. Luteinizing hormone and testosterone in young and old male mice. American Journal of Physiology - Endocrinology and Metabolism. 243 (3), E257-E263 (1982).
- Carmel, P. W., Araki, S., Ferin, M. Pituitary stalk portal blood collection in rhesus monkeys: Evidence for pulsatile release of gonadotropin-releasing hormone (GnRH). Endocrinology. 99 (1), 243-248 (1976).
- Schuiling, G., Gnodde, H. Site of origin of the pulsatile secretion of luteinizing hormone in long-term ovariectomized rats. Journal of Endocrinology. 70 (1), 97-104 (1976).
- Hackwell, E. C. R., Ladyman, S. R., Brown, R. S. E., Grattan, D. R. Mechanisms of lactation-induced infertility in female mice. Endocrinology. 164 (5), 1-12 (2023).
- Bahougne, T., Kretz, M., Angelopoulou, E., Jeandidier, N., Simonneaux, V. Impact of circadian disruption on female mice reproductive function. Endocrinology. 161 (4), (2020).
- Kreisman, M. J., McCosh, R. B., Tian, K., Song, C. I., Breen, K. M. Estradiol Enables Chronic Corticosterone to Inhibit Pulsatile Luteinizing Hormone Secretion and Suppress Kiss1 Neuronal Activation in Female Mice. Neuroendocrinology. 110 (6), 501-516 (2020).
- Moenter, S. M., Evans, N. P. Gonadotropin-releasing hormone GnRH measurements in pituitary portal blood. Journal of Neuroendocrinology. 34 (5), 13065 (2022).
- Maeda, K. I., et al. The LHRH pulse generator: A mediobasal hypothalamic location. Neuroscience and Biobehavioral Reviews. 19 (3), 427-437 (1995).
- Steyn, F. J., et al. Development of a methodology for and assessment of pulsatile luteinizing hormone secretion in juvenile and adult male mice. Endocrinology. 154 (12), 4939-4945 (2013).
- Steyn, F. J., et al. Development of a method for the determination of pulsatile growth hormone secretion in mice. Endocrinology. 152 (8), 3165-3171 (2011).
- Minabe, S., Uenoyama, Y., Tsukamura, H., Maeda, K. Analysis of pulsatile and surge-like luteinizing hormone secretion with frequent blood sampling in female mice. Journal of Reproduction and Development. 57 (5), 660-664 (2011).
- Perreau-Lenz, S., Kalsbeek, A., Pévet, P., Buijs, R. M. Glutamatergic clock output stimulates melatonin synthesis at night. European Journal of Neuroscience. 19 (2), 318-324 (2004).
- Herwig, A., Pévet, P., Bothorel, B., Steinlechner, S., Saboureau, M. Trans-pineal microdialysis in the Djungarian hamster (Phodopus sungorus): A tool to study seasonal changes of circadian clock activities. Journal of Pineal Research. 40 (2), 177-183 (2006).
- Adams, J. M., Otero-Corchon, V., Hammond, G. L., Veldhuis, J. D., Qi, N., Low, M. J. Somatostatin is essential for the sexual dimorphism of GH secretion, corticosteroid-binding globulin production, and corticosterone levels in mice. Endocrinology. 156 (3), 1052-1065 (2015).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63 (1), 27-39 (2009).
- Krashes, M. J., et al. reversible activation of AgRP neurons drives feeding behavior in mice. Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- National Research Council. Guide for the Care and Use of Laboratory Animals. Eighth edition. National Research Council. , (2011).
- Ayala, J. E., et al. Hyperinsulinemic-euglycemic clamps in conscious, unrestrained mice. Journal of Visualized Experiments. (57), e3188 (2011).
- Peters, S., et al. Culex ABS Part I: Introduction to automated blood sampling. Current Separations. 18 (4), 139-145 (2000).
- Bohs, C., Cregor, M., Gunaratna, G., Kissinger, C. Culex Automated blood sampler part II Managing freely-moving animals and monitoring their activity. Current Separations. 18 (4), 147-151 (2000).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Kreisman, M. J., Mccosh, R. B., Breen, K. M. A Modified ultra-sensitive ELISA for measurement of LH in mice. Endocrinology. 163 (9), (2022).
- Pielecka-Fortuna, J., Chu, Z., Moenter, S. M. Kisspeptin acts directly and indirectly to increase gonadotropin-releasing hormone neuron activity and its effects are modulated by estradiol. Endocrinology. 149 (4), 1979-1986 (2008).
- Kumar, D., et al. Specialized subpopulations of kisspeptin neurons communicate with GnRH neurons in female mice. Endocrinology. 156 (1), 32-38 (2015).
- Caligioni, C. S. Assessing reproductive status/stages in mice. Current Protocols in Neuroscience. , 1-8 (2009).
- Czieselsky, K., et al. Pulse and surge profiles of luteinizing hormone secretion in the mouse. Endocrinology. 157 (12), 4794-4802 (2016).
- Wang, L., et al. Genetic dissection of the different roles of hypothalamic kisspeptin neurons in regulating female reproduction. eLife. 8, 43999 (2019).
- McCosh, R. B., Kreisman, M. J., Breen, K. M. Frequent tail-tip blood sampling in mice for the assessment of pulsatile luteinizing hormone secretion. Journal of Visualized Experiments. (137), e57894 (2018).
- Vanacker, C., Defazio, R. A., Sykes, C. M., Moenter, S. M. A role for glial fibrillary acidic protein (Gfap)-expressing cells in the regulation of gonadotropin-releasing hormone (GnRH) but not arcuate kisspeptin neuron output in male mice. eLife. 10, e68205 (2021).
- Dulka, E. A., Defazio, R. A., Moenter, S. M. Chemogenetic suppression of GnRH neurons during pubertal development can alter adult GnRH neuron firing rate and reproductive parameters in female mice. eNeuro. 7 (3), 0223 (2020).
- Talbi, R., et al. Characterization of the Action of Tachykinin Signaling on Pulsatile LH Secretion in Male Mice. Endocrinology. 162 (8), 1-9 (2021).
- Tuli, J., Smith, J., Morton, D. Corticosterone, adrenal and spleen weight in mice after tail bleeding, and its effect on nearby animals. Laboratory Animals. 29 (1), 90-95 (1995).
- Lucien, J. N., Ortega, M. T., Shaw, N. D. Sleep and puberty. Current Opinion in Endocrine and Metabolic Research. 17, 1-7 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten