Generierung eines bovinen primären enteroiden zweidimensionalen Monolayer-Kultursystems für Anwendungen in der translationalen biomedizinischen Forschung
In diesem Artikel
Zusammenfassung
Enteroide entwickeln sich zu einem neuen Modell für die Untersuchung der Gewebephysiologie und Pathophysiologie, der Arzneimittelentwicklung und der regenerativen Medizin. Hier beschreiben wir ein bovines primäres 2D-enteroides Kultursystem, das eine Co-Kultivierung mit relevanten Gewebezelltypen ermöglicht. Dieses Modell bietet einen translationalen Vorteil für die gastrointestinale Forschungsmodellierung.
Zusammenfassung
Organoide Zellkultursysteme können die in Geweben beobachtete Komplexität rekapitulieren, was sie für die Untersuchung von Wirt-Pathogen-Interaktionen, die Bewertung der Wirksamkeit und Toxizität von Medikamenten und das Bioengineering von Geweben nützlich macht. Die Anwendung dieser Modelle aus den beschriebenen Gründen kann jedoch aufgrund der dreidimensionalen (3D) Natur dieser Modelle eingeschränkt sein. Zum Beispiel ist die Verwendung von 3D-enteroiden Kultursystemen zur Untersuchung von Verdauungserkrankungen aufgrund der Unzugänglichkeit des Darmlumens und seiner sekretierten Substanzen eine Herausforderung. In der Tat erfordert die Stimulation von 3D-Organoiden mit Krankheitserregern entweder eine luminale Mikroinjektion, eine mechanische Störung der 3D-Struktur oder die Erzeugung von apikalen Enteroiden. Darüber hinaus können diese Organoide nicht mit Immun- und Stromazellen kokultiviert werden, was eine eingehende mechanistische Analyse der pathophysiologischen Dynamik einschränkt. Um dies zu umgehen, haben wir ein zweidimensionales (2D) enteroidabgeleitetes Monolayer-Kultursystem für bovine Primärzellen optimiert, das eine Co-Kultur mit anderen relevanten Zelltypen ermöglicht. Ileumkrypten, die von gesunden erwachsenen Rindern isoliert wurden, wurden kultiviert, um 3D-Organoide zu erzeugen, die für die zukünftige Verwendung kryokonserviert wurden. Eine 2D-Monoschicht wurde aus wiederbelebten 3D-Enteroiden hergestellt, die durchgelassen und aufgebrochen wurden, um Einzelzellen zu erhalten, die auf mit Basalmembranextrakt beschichteten Transwell-Zellkultureinsätzen ausgesät wurden, wodurch ihre apikale Oberfläche freigelegt wurde. Die intestinale Monolayer-Polarität, die zelluläre Differenzierung und die Barrierefunktion wurden mittels Immunfluoreszenzmikroskopie und Messung des transepithelialen elektrischen Widerstands charakterisiert. Die Stimulation der apikalen Oberfläche der Monoschicht zeigte die erwartete Funktionalität der Monoschicht, die durch die Zytokinsekretion sowohl aus apikalen als auch aus basalen Kompartimenten demonstriert wurde. Das beschriebene 2D-Enteroid-abgeleitete Monolayer-Modell ist vielversprechend für die Untersuchung von Wirt-Pathogen-Interaktionen und der Darmphysiologie, der Arzneimittelentwicklung und der regenerativen Medizin.
Einleitung
Tiermodelle in der Forschung spielen eine entscheidende Rolle bei der Verbesserung unseres Verständnisses der Pathophysiologie von Krankheiten und der Dynamik der Immunantwort des Wirts während einer Infektion und unterstützen die Entwicklung neuartiger präventiver und therapeutischer Strategien 1,2,3,4. Diese Modelle unterstützen die Forschung, Entdeckung und Weiterentwicklung an Tieren und sind der Schlüssel zum Fortschritt der Forschung im Bereich der menschlichen Gesundheit. Seit Jahrzehnten untermauern Nagetiermodelle die Fortschritte in den Immunmechanismen und in der biologischen Grundlagenforschung für menschliche Krankheiten 3,5,6,7. Während Nagetiermodelle für das Screening und die frühe Entwicklungsforschung von entscheidender Bedeutung sind, bieten Großtiermodelle einen relevanteren Vergleich bei der Erforschung menschlicher Krankheiten sowohl in frühen Entdeckungs- als auch in späteren Entwicklungsstudien, einschließlich therapeutischer Wirksamkeits- und Sicherheitstests 1,3,4,5. Nutztiere bieten im Vergleich zu Nagetiermodellen klare Vorteile für eine effizientere Translation für den Menschen bei einigen Krankheiten, darunter Kryptosporidiose, Salmonellose, Tuberkulose, Respiratorisches Synzytial-Virus und Brucellose 1,7,8. In der Tat entwickeln sich diese und andere Krankheiten spontan bei Rindern, die mehrere analoge Krankheitspathogenesen und Immunprozesse wie der Mensch teilen, und als unterzüchtete Population ahmen Rinder die genetische und umweltbedingte Heterogenität nach, die die menschliche Immunantwort beeinflusst 5,8,9,10 . Der Nutzen von Rindermodellen für die Erforschung von Infektionskrankheiten kann maximiert werden, indem zunächst ein ausgeklügeltes Kultursystem eingesetzt und dann schrittweise In-vivo-Studien durchgeführt werden. Der erstmalige Einsatz eines hochkomplexen, aus Rindern gewonnenen Kultursystems kann die Anzahl der Lebendtierstudien erheblich reduzieren und gleichzeitig die Chancen auf eine erfolgreiche translationale und angewandte Forschung verbessern. Kulturmodelle sollten die Krankheitsprozesse auf Organebene rekapitulieren, um eine optimale prädiktive Validität zu erzielen und die native Gewebemikroumgebung räumlich und funktionell beizubehalten.
Die mukosale Immunantwort ist ein facettenreiches System, das aus einer hocheffizienten Barriere besteht, die aus gastrointestinalen Enterozyten und verschiedenen Populationen von Immunzellen besteht, die sich unterhalb der Schleimhautoberfläche befinden11. Dieses hochkomplexe System ist während einer Infektion entscheidend für die Aufrechterhaltung der gastrointestinalen Homöostase und die Initiierung der Immunabwehr gegen enterische Pathogene11. Die Kommunikation zwischen Enterozyten und den Zellen des angeborenen Immunsystems initiiert die Entwicklung schützender Immunantworten gegen pathogene Mikroorganismen. Daher sind Kultursysteme, die in ihrer Komplexität vergleichbar sind, für eine optimale Untersuchung von Wirt-Darmpathogen-Interaktionen notwendig und sehr effektiv für das Verständnis der enterischen Physiologie sowie der Wirkstoffforschung und -entwicklung 12,13. Organoide sind ein robustes Kultursystem, das der Architektur und Funktion des Ursprungsgewebes ähnelt14,15. Die Vielzelligkeit dieser Modelle ermöglicht die Untersuchung der Rolle verschiedener Zellpopulationen und der zellulären Interaktionen, die an der Darmgesundheit und -erkrankung beteiligt sind12,14. Allerdings sind humane Organoidmodelle in der Forschung derzeit durch die Schwierigkeit, eine ausreichende Menge und gleichbleibende Qualität menschlicher Darmepithelzellen zu erhalten, und die begrenzte Zelllebensfähigkeit in Kultur begrenzt. Immortalisierte Zelllinien können verwendet werden, um in diesen Modellen konsistent hohe Ausbeuten an homologen Kulturen zu erzielen; Transformierten Zellen fehlt jedoch von Natur aus die Diversität und funktionelle Komplexität von nicht-transformierten Epithelzellen16,17. Zu den Vorteilen der Verwendung von Kulturen aus Rindergewebe als Modell für die Untersuchung von Magen-Darm-Erkrankungen und -Physiologie gehören die Leichtigkeit, mit der Gewebeproben konsistent von gesunden Spendern gewonnen werden können, eine verbesserte Zelllebensfähigkeit und eine größere zelluläre Vielfalt, die nur mit nicht immortalisiertem Gewebe erreicht werden kann. Vergleichende Gewebetranskriptomik und Charakterisierung von intestinalen Organoiden zeigen Ähnlichkeiten in konservierten orthologen Genen und zellulären Potenzialen zwischen Mensch und Rind18. Daher kann ein aus Rinderorganoiden gewonnenes Kultursystem bei der Untersuchung menschlicher Darmerkrankungen von Vorteil sein, wobei die Ergebnisse leicht auf die Humanmedizin übertragbar sind.
Das hierin beschriebene Protokoll beschreibt eine effektive Plattform zur Bewertung von Wirtsreaktionen auf enterische Krankheitserreger oder Verbindungen und die Darmphysiologie unter Verwendung eines aus Rinderenteroiden gewonnenen 2D-Primärzellkultursystems. Im Gegensatz zu 3D-Organoiden ermöglichen 2D-Kultursysteme, die auf Transwell-Inserts erzeugt werden, eine duale Kultur von Darmzellen mit Immun- oder Stromazellen, was eine Untersuchung der Dynamik auf Gewebeebene ermöglicht. Mit Anwendungen in der biomedizinischen Forschung, der pharmazeutischen Entwicklung und der Wirksamkeitsprüfung kann dieses physiologisch relevante Modell der Gesundheit und dem Fortschritt von Rindern und Menschen gleichermaßen zugute kommen.
Protokoll
Alle Protokolle wurden in Übereinstimmung mit den institutionellen und nationalen Richtlinien und Vorschriften für den Tierschutz durchgeführt.
1. Vorbereitung der Reagenzien
HINWEIS: Die Stamm- und Endkonzentrationen der in dieser Studie verwendeten Reagenzien sind in Tabelle 1 aufgeführt.
- Bereiten Sie den Probenentnahmepuffer vor: Mischen Sie 1 l eiskalte phosphatgepufferte Kochsalzlösung (PBS), die Penicillin (100 U/ml), Streptomycin (100 μg/ml), Gentamicin (25 μg/ml) und Caspofungin (2,5 μg/ml) enthält. Lagern Sie die Stammlösung bei 4 °C.
- Dissoziationsreagenz #1 vorbereiten: Mischen Sie 18,55 ml Probenentnahmepuffer (wie in Schritt 1.1 beschrieben), 1,422 ml Ethylendiamintetraessigsäure (EDTA, 0,422 m/pH 7,4), 20 μl 1 M 1,4-Dithiothreitol (DTT)-Lösung, 4 μl Y-27632-Lösung (5000x/50 mM). Lagern Sie die Lösung bei 4 °C.
- Dissoziationsreagenz #2 vorbereiten: Mischen Sie 18,57 ml Sammelpuffer (wie in Schritt 1.1 beschrieben), 1,422 ml EDTA (0,422 m/pH 7,4), 4 μl Y-27632-Lösung (5000x/50 mM). Lagern Sie die Lösung bei 37 °C.
- Enteroides Wachstumsmedium vorbereiten: Mischen Sie 9,875 ml organoides Wachstumsmedium plus Ergänzung, 100 μl Penicillin (100 U/ml), Streptomycin (100 μg/ml), 5 μl Gentamicin (25 μg/ml) und 20 μl Caspofungin (2,5 μg/ml). Lagern Sie die Lösung bei 4 °C.
- Bereiten Sie enteroide Differenzierungsmedien vor: Mischen Sie 10 ml organoides Differenzierungsmedium plus Ergänzungsmittel, 100 μl Penicillin (100 U/ml), Streptomycin (100 μg/ml), 5 μl Gentamicin (25 μg/ml) und 20 μl Caspofungin (2,5 μg/ml). Lösung bei -20 °C lagern.
- Waschmedium vorbereiten: Mischen Sie 48,45 ml DMEM/F-12 1,1-Medium (mit L-Glutamin, ohne HEPES), 1 ml B-27-Präparat ohne Vitamin A (50-fache Brühe), 500 μl Penicillin (100 U/ml), Streptomycin (100 μg/ml), 25 μl Gentamicin (50 mg/ml-Brühe) und 25 μl Caspofungin (5 mg/ml-Brühe). Lagern Sie die Lösung bei 4 °C.
- Beschichtungspuffer vorbereiten: Mischen Sie 25 ml DMEM: F12-Komplettmedien ohne Inhibitoren und 25 mg Rinderserumalbumin (BSA). Lagern Sie die Lösung bei 4 °C.
2. Isolierung von Darmkrypten aus dem gesamten Gewebe (Abbildung 1)
ANMERKUNG: Rinder-Dünndarmenteroide wurden aus Ileumgewebe erzeugt, das von gesunden erwachsenen Holstein-Ochsen (>2 Jahre) aus einem lokalen Rindfleischverarbeitungsbetrieb gewonnen wurde. Für diese Versuchsreihe wurde ein Spender verwendet.
- Aufbereitung von Darmgewebeproben
- Legen Sie die entnommenen ~10 Zoll (25 cm) Darmgewebeproben in ~400 ml eiskalten Sammelpuffer (PBS+ Antibiotika/Antimykotika) und legen Sie sie für den Transport ins Labor auf Eis.
- Entfernen Sie mit einer chirurgischen Schere (z. B. Mayo-Schere) und einer Pinzette (z. B. Adson-Pinzette) das überschüssige Fett und das Mesenterium aus der Darmgewebeprobe.
- Schneide das Gewebe in zwei gleich große Stücke.
- Öffnen Sie das Gewebe in Längsrichtung mit einer chirurgischen Schere und spülen Sie das Gewebe in sterilem PBS.
- Entfernen Sie vorsichtig die Schleimschicht der Darmprobe mit der Seite eines sterilen Objektträgers aus Glas und spülen Sie das Gewebe mit frischem PBS ab.
HINWEIS: Dieser Schritt hilft, die Zotten zu entfernen und die Reinheit der Kryptenfraktionen in den folgenden Schritten zu erhöhen. - Schneiden Sie das Gewebe für jedes 13 cm (5 Zoll) große Stück in zwei 6,5 cm (2,5 Zoll) und schneiden Sie dann jedes Stück in 4 etwa gleich kleine Stücke, um die Gewebedissoziation zu erleichtern.
- Dissoziation von Darmgewebe
- Bereiten Sie ein Volumen von 20 ml des Gewebedissoziationsreagenzes #1 in einem sterilen konischen 50-ml-Röhrchen vor und legen Sie die kleinen Gewebeproben in das konische Röhrchen, bis die Volumenverschiebung den Meniskus von der 20-ml-Markierung zur 35-ml-Markierung auf dem konischen Röhrchen bewegt.
- Wiederholen Sie den obigen Schritt für die verbleibenden Dünndarmgewebeprobenstücke.
- Versiegeln Sie die konischen Röhrchen mit Parafolie und schütteln Sie das konische Röhrchen 10 Mal von Hand.
HINWEIS: Während des gesamten Protokolls sollte das manuelle Schütteln auf bewusste, aber sanfte Weise erfolgen. - Platzieren Sie die konischen Röhrchen horizontal auf Eis in einem Behälter auf einer orbitalen Schüttelplattform.
- Die konischen Röhrchen auf Eis im Behälter 30 min bei 80 Umdrehungen pro Minute (U/min) schütteln. Schütteln Sie das konische Röhrchen alle 10 Minuten manuell.
- Bereiten Sie ein 20-ml-Volumen des vorgewärmten (37 °C) Gewebedissoziationsreagenzes #2 (wie oben formuliert, jedoch ohne DTT) in einem konischen 50-ml-Röhrchen vor. Geben Sie die Gewebeproben aus den konischen Röhrchen mit dem Dissoziationsreagenz #1 in die konischen Röhrchen mit dem Dissoziationsreagenz #2.
- Versiegeln Sie die konischen Röhrchen mit Parafolie und schütteln Sie die konischen Röhrchen 10 Mal von Hand.
- Die konischen Röhrchen in ein vorgewärmtes (37 °C) Schüttelwasserbad geben, das in einem Winkel von ca. 60 °C geneigt ist, und 10 Minuten lang bei 150 U/min schütteln, wobei Sie nach 5 Minuten und nach der gesamten 10-minütigen Inkubation erneut von Hand geschüttelt werden.
- Isolierung von Kryptenfragmenten
- Etikettieren Sie 10 sterile konische Röhrchen #1 - #10. Geben Sie 20 ml steriles, eiskaltes PBS in jedes beschriftete konische Röhrchen.
- Übertragen Sie die Gewebestücke aus den konischen Röhrchen mit dem Dissoziationsreagenz #2 in ein neues steriles konisches 50-ml-Röhrchen, das eiskaltes PBS #1 enthält.
- Schütteln Sie die konischen Röhrchen 10 Mal von Hand.
- Versiegeln Sie die konischen Röhrchen mit Parafolie und legen Sie sie waagerecht auf Eis. Konische Röhrchen auf einem Orbitalschüttler 10 min bei 80 U/min schütteln. Nach 10 Minuten das konische Röhrchen #1 10 Mal manuell schütteln. Dies wird als Wash #1 bezeichnet.
- Übertragen Sie Gewebeproben vorsichtig mit einer chirurgischen Pinzette in das konische Röhrchen #2.
- Wiederholen Sie die Schritte 2.3.2 - 2.3.4, dies gilt als Waschgang #2.
- Wiederhole die Wäschen bis zum Waschen #10.
- Die Überstände aus jeder Wäsche enthalten die Krypten, die für die Generierung von Enteroiden verwendet werden. Halten Sie die Röhrchen mit den Überständen bei 4 °C, bis alle 10 Wäschen abgeschlossen sind.
- Nachdem die 10. Wäsche abgeschlossen ist und der Gewebeschnitt verworfen wurde, zentrifugieren Sie die Überstände der konischen Röhrchen #6-#10 bei 400 x g für 2 min bei 4 °C, um die isolierten Krypten zu pelletieren.
HINWEIS: Waschungen 6-10 enthalten die saubersten Fraktionen intakter Krypten mit begrenzten Ablagerungen und einzelnen Zellen. Daher wird empfohlen, nur diese Fraktionen für die Enteroiderzeugung zu verwenden und die früheren Waschungen (#2-#5) zu verwerfen) - Verwerfen Sie den Überstand und geben Sie 4 ml frisches, eiskaltes PBS in die Krypten, ohne sie erneut zu suspendieren (dies hilft, die Fragmente bis zur Mikroskopie intakt zu halten).
- Beurteilen Sie die Reinheit der dissoziierten Krypten für jede konische Röhre #6-#10 durch Mikroskopie.
- Geben Sie 50 μl PBS in eine 384-Well-Platte.
- Geben Sie 10 μl Kryptensuspension in das PBS und verwenden Sie ein Objektiv mit 40-facher Vergrößerung, um die Reinheit, Integrität und Anzahl der Krypten zu bestimmen.
HINWEIS: Das Zeichnen eines Kreuzes auf der Unterseite der Platte erleichtert das Zählen.
3. Ex-vivo-Generierung und -Passage von bovinen ilealen Enteroiden (Abbildung 2)
HINWEIS: Die Krypten aus den konischen Röhrchen mit den reinsten, intakten Darmkrypten werden für nachgeschaltete Assays verwendet. Bei allen Schritten, die Krypten und Enteroide betreffen, müssen Pipettenspitzen, Zellschaber und Röhrchen mit dem Beschichtungspuffer vorbeschichtet werden, und Blasen sollten vermieden werden, um den Verlust von Krypten zu verhindern. Sofern nicht anders angegeben, sollte eine Pipettenspitze von 1000 μl verwendet werden, um das Aufbrechen von Kryptenfragmenten zu verhindern.
- Generierung von Enteroiden aus Kryptenfragmenten
- Kombinieren Sie die reinsten Kryptenfraktionen (normalerweise #6-#10) in einem konischen Röhrchen.
- Das konische Röhrchen mit den Krypten wird bei 400 x g 2 min bei 4 °C zentrifugiert.
- Verwerfen Sie den Überstand, indem Sie ihn mit einer Pipette ansaugen, und suspendieren Sie das Gruftpellet wieder in Waschmedien.
- Zentrifugieren Sie wie in Schritt 3.1.2. Dekantieren Sie den Überstand und geben Sie 2 ml Waschmedien in das Kryptenpellet.
- Zählen Sie die Anzahl der Krypten wie in Schritt 2.3.11.1 beschrieben.
- Zentrifugieren Sie wie in Schritt 3.1.2, um die Krypten zu pelletieren, den Überstand zu verwerfen und in einer eiskalten extrazellulären Matrix (BME) mit reduziertem Wachstumsfaktor zu resuspendieren, um eine Konzentration von etwa 400 Krypten/100 μl zu erreichen.
HINWEIS: Es ist wichtig, BME bei 4 °C richtig aufzutauen, da Temperaturschwankungen seine Konsistenz verändern. Ein vorzeitiges Erstarren der BME kann durch einen Kühlblock und vorgekühlte Pipettenspitzen verhindert werden.- Die Verwendung einer anderen Basalmembranmatrix-Formulierung kann eine Verdünnung der BME bei der Herstellung von Kuppeln erfordern. Beachten Sie die Anweisungen des Herstellers für den verwendeten BME.
- Pipetieren Sie auf und ab, um die Krypten im BME gründlich aufzuhängen.
- Stellen Sie Krypten-BME-Kuppeln her, indem Sie 50 μl Krypten-BME-Suspension langsam auf eine 6-Well-Gewebekulturplatte auf einer auf 37 °C eingestellten Wärmeplatte mit bis zu 8 Kuppeln/Well pipettieren.
HINWEIS: Die 6-Well-Platte muss in einem Inkubator über Nacht bei 37 °C vorgewärmt werden, bevor die Kuppeln plattiert werden. - Bewahren Sie die 6-Well-Platte 1 Minute lang auf der Warmhalteplatte auf, bevor Sie die Platte vorsichtig in einen 37 °C und 5 % CO2 -Inkubator stellen.
- Nach 2 Minuten drehen Sie die 6-Well-Platte um, so dass der Deckel nach unten zeigt, und inkubieren Sie weitere 30 Minuten, damit die Kuppeln polymerisieren können.
- Nach 30 Minuten vorsichtig 3 ml enteroides Wachstumsmedium bei Raumtemperatur (RT) mit 10 μM SB202190, 0,5 μM LY2157299 und 10 μM Y-27632 in die Vertiefungen mit Kuppeln geben.
- Inkubieren bei 37 °C, 5 % CO2.
- Entfernen Sie das Medium und ersetzen Sie es alle 2-3 Tage durch frisches enteroides Wachstumsmedium, das mit Inhibitoren ergänzt wird.
- Passage von Enteroiden
- Stellen Sie nach 7-10 Tagen sicher, dass die Krypten 3D-Enteroide mit vielen knospenden Strukturen gebildet haben, wie in Abbildung 2E, und bereit für die Passage sind.
- Entsorgen Sie das Medium aus den Vertiefungen mit den Kuppeln.
- Geben Sie für jeweils 4 Kuppeln pro Vertiefung 1 ml eiskalte nicht-enzymatische Zelldissoziationslösung, ergänzt mit 10 μM Y-27632, in jede Vertiefung, die Kuppeln enthält.
- Lösen Sie die Kuppel mit einem vorbeschichteten Zellschaber vorsichtig von der Gewebekulturplatte.
- Sammeln Sie Enteroide in einem konischen 15-ml-Röhrchen und trituieren Sie sie durch 10-maliges Auf- und Abpipettieren.
- Das konische Röhrchen mit den fragmentierten Enteroiden wird bei RT auf einem Orbitalschüttler bei 80 U/min für 10 min inkubiert.
- Geben Sie 10 ml eiskaltes Waschmedium mit 10 μM Y-27632 zu den Enteroiden.
- Das konische Röhrchen wird bei 300 x g 5 min bei RT zentrifugiert.
- Verwerfen Sie den Überstand und suspendieren Sie das Pellet in 10 ml frischem Waschmedium und geben Sie es in ein neues konisches 15-ml-Röhrchen um.
- Das konische Röhrchen wird bei 300 x g 5 min bei RT zentrifugiert.
- Verwerfen Sie den Überstand und resuspendieren Sie das Pellet in 1 ml enteroidem Wachstumsmedium in einem 1,5 ml Mikrozentrifugenröhrchen.
- Zentrifugieren Sie das Mikrozentrifugenröhrchen bei 300 x g für 5 min bei RT und verwerfen Sie den Überstand.
- Resuspendieren Sie das enteroide Pellet in eiskaltem 100% BME und befolgen Sie die Schritte 3.1.6-3.1.13.
- Repassage von Enteroiden alle 7 Tage. Die Expansionszeiten können aufgrund der Dichte, der Lebensfähigkeit und des Ausbaus variieren. Mehrere knospende Strukturen, die große enteroide Strukturen bilden, deuten darauf hin, dass die Enteroide durchgelassen werden müssen.
- Kryokonservierung von Enteroiden
- Stellen Sie für die Kryokonservierung sicher, dass die Enteroide nicht mehr als fünfmal in Kultur durchgelassen werden.
ANMERKUNG: Dies wurde nicht experimentell getestet und basiert auf der Beobachtung der Autoren, dass spätere Passagen eine reduzierte Lebensfähigkeit aufweisen und zu unterschiedlichen Ergebnissen führen. - Um die Enteroide zu ernten, verwenden Sie den Dissoziationspuffer, wie in den Schritten 3.2.2-3.2.9 beschrieben.
HINWEIS: Dissoziieren Sie die Enteroide mechanisch mit einer 5-ml-Pipette. - Zählen Sie die Anzahl der enteroiden Fragmente, wie in Schritt 2.3.11.1 beschrieben.
- Das konische Röhrchen wird bei 300 x g 5 min bei RT zentrifugiert.
- Verwerfen Sie den Überstand und resuspendieren Sie die enteroiden Fragmente in Kryokonservierungsmedien, die mit 10 μM Y-27632 ergänzt sind, um eine Konzentration von ~2000 enteroiden Fragmenten/ml und aliquot 1 ml in vormarkierten Kryoröhrchen zu erreichen.
- Legen Sie die Kryoröhrchen in einen kontrollierten Gefrierbehälter und lagern Sie sie über Nacht bei -80 °C.
- Überführen Sie die Kryorösflaschen zur Langzeitlagerung in flüssigen Stickstoff in die Dampfphase.
- Stellen Sie für die Kryokonservierung sicher, dass die Enteroide nicht mehr als fünfmal in Kultur durchgelassen werden.
- Reanimation von Darmkryptenfragmenten
- Legen Sie eine 6-Well-Platte über Nacht in den Inkubator.
- Ein 5-ml-Röhrchen mit 5 ml Beschichtungsmedium vorbeschichten.
- Nehmen Sie die Kryoröhrchen aus dem Flüssigstickstofflager.
- Übertragen Sie die Krypten sofort nach dem Auftauen aus dem Kryoröhrchen in das vorbeschichtete 5-ml-Röhrchen. Spülen Sie das Kryoröhrchen mit Waschmedien aus und geben Sie es in das 5-ml-Röhrchen. Vermeiden Sie Blasen.
- Das Volumen mit Waschmedien auf 5 ml bringen und bei 400 x g 5 min bei 4 °C zentrifugieren.
- Während der Zentrifugation wird ein 1,5-ml-Röhrchen mit Beschichtungsmedien vorbeschichtet.
- Nach der Zentrifugation den Überstand abgießen, das Pellet in dem im Röhrchen verbleibenden Medium resuspendieren und in das vorbeschichtete 1,5-ml-Röhrchen überführen. Waschen Sie das 5-ml-Röhrchen mit Waschmedien und geben Sie es in ein 1,5-ml-Röhrchen. Bei 400 x g 5 min bei 4 °C zentrifugieren.
- Erhöhen Sie das Volumen mit enteroiden Wachstumsmedien auf 1,5 ml.
- Wie oben (Schritt 3.4.7) zentrifugieren und vorsichtig absaugen.
- BME ab 4 °C einnehmen und auf Eis/Eisblock legen.
- Resuspendieren Sie das enteroide Pellet in eiskaltem 100% BME und befolgen Sie die Schritte 3.1.6- 3.1.12.
- Wechseln Sie das Medium alle 2-3 Tage.
4. Generierung und Bewertung von 2D-Monolayern aus 3D-Enteroiden
HINWEIS: Wie oben beschrieben, sollten bei allen Schritten, die Krypten und Enteroide betreffen, Pipettenspitzen, Zellschaber und Röhrchen mit dem Beschichtungspuffer vorbeschichtet werden, und Blasen sollten vermieden werden, um den Verlust von Krypten zu verhindern.
- Präparation von Transwell-Inserts für die 2D-Monolagenbildung
- Platzieren Sie die Einsätze in einer 24-Well-Gewebekultur-Adapterplatte und beschichten Sie die apikale Seite von 1-μm-PET-24-Well-Zellkultureinsätzen mit 100 μl 1:15-Verdünnung von BME in enteroiden Wachstumsmedien vor. Beschichten Sie immer eine zusätzliche Einlage, die bei der Durchführung von Barriereintegritätsmessungen als Kontrolle verwendet wird.
- Legen Sie den beschichteten Einsatz in eine 24-Well-Gewebekultur-Adapterplatte im Inkubator.
HINWEIS: Mit den Transwell-Einsätzen muss ein spezieller Adapter oder eine begleitende Gewebekulturplatte verwendet werden. - Die Kultureinsätze werden bei 37 °C und 5 %CO2 für 1 h inkubiert, um eine Polymerisation zu ermöglichen.
HINWEIS: BME-beschichtete Transwells können mit Parafolie versiegelt und bei 4 °C bis zu 1 Woche gelagert werden, wenn sie nicht sofort verwendet werden. - Am Ende der Inkubation wird das 3D-enteroide Kulturmedium abgesaugt.
- Dissoziation von 3D-Enteroiden
- Erzeugen Sie 2D-enteroide Monoschichten aus kryokonservierten enteroiden Fragmenten, die wie oben in Abschnitt 3.1 beschrieben, wiederbelebt, plattiert und kultiviert wurden, um 3D-Enteroide zu bilden. Die aufgetauten Enteroide werden mindestens zweimal durchgelassen, wobei die letzte Passage mindestens 5 Tage lang kultiviert wird, bevor sie verarbeitet werden, um 2D-Monolayer-Kulturen zu erzeugen.
- Ernten Sie die Enteroide, indem Sie eiskaltes Waschmedium, ergänzt mit 10 μM Y-27632, zu den Enteroidkuppeln hinzufügen (verwenden Sie ca. 1 ml Dissoziationspuffer für 4 Kuppeln)
- Lösen Sie die Kuppeln mit einem Zellschaber und sammeln Sie sie in einem konischen 15-ml-Röhrchen.
- 30 Mal mit einer 1-ml-Pipettenspitze trituieren, um enteroide Fragmente zu erzeugen.
- 40 Mal mit einer 200-μl-Pipettenspitze verreiben, um die enteroiden Fragmente weiter aufzubrechen.
- Bringen Sie das Volumen des konischen 15-ml-Röhrchens mit enteroiden Fragmenten mit eiskaltem Waschmedium auf 10 ml.
- Das konische Röhrchen wird bei 300 x g 5 min bei RT zentrifugiert.
- Saugen Sie den Überstand, einschließlich der BME-Schicht, an und achten Sie darauf, das enteroide Pellet nicht zu stören.
HINWEIS: Die BME-Schicht erscheint als trübe gallertartige Schicht direkt über dem Pellet. - Für jeweils 4 Kuppeln wird das Pellet in 1 ml vorgewärmtem TrypLE-Express-Enzym resuspendiert, das mit 10 μM Y-27632 ergänzt wird.
- Das Enteroid-TrypLE-Gemisch wird auf eine 24-Well-Platte gegeben und bei 37 °C und 5 %CO2 für 10 min inkubiert.
- Nach 10 Minuten pipettieren Sie das Enteroid-TrypLE-Gemisch 40 Mal mit einer 1-ml-Pipette, um die Enteroide weiter zu fragmentieren.
- Anschließend werden die Fragmente 40 Mal mit einer 200-μl-Pipette pipetiert, um die Fragmente in einzelne Zellen zu zerlegen.
- Mit einer 3-ml- oder 5-ml-Spritze mit einer sterilen 22-G-Nadel wird die Zellsuspension 4 Mal abgesaugt und abgegeben, um eine Einzelzellsuspension zu erreichen.
- Die Zelldissoziation wird mikroskopisch überwacht, wie in Schritt 2.3.11.1 beschrieben, bis 80 % der Enteroide in einzelne Zellen zerlegt sind.
- Sammeln Sie die Zellsuspension in einem konischen 15-ml-Röhrchen und löschen Sie die enzymatische Reaktion durch Zugabe von 4x Volumen Waschmedium, das mit 10% FBS ergänzt ist.
- Filtrieren Sie die Enteroide durch ein vorbeschichtetes 40-μm-Zellsieb zweimal in ein konisches 50-ml-Röhrchen.
- Die einzelnen Zellen werden pelletiert, indem das konische Röhrchen 5 Minuten lang bei 300 x g zentrifugiert wird.
- 2D-Monolayer-Seeding auf Transwell-Einsätzen.
- Dekantieren Sie den Überstand und resuspendieren Sie das Pellet in einem kleinen Volumen (~600 μl) eines organoiden Wachstumsmediums, das bei RT mit 20 % fötalem Kälberserum (FBS) ergänzt wird.
- Bestimmen Sie die Dichte und Lebensfähigkeit enteroider Zellen mit der Trypanblau-Farbstoffausschlussmethode, dem Hämazytometer oder dem automatisierten Zellzähler. Es wird mit einer durchschnittlichen Rentabilität von 75 % gerechnet.
- Entfernen Sie die überschüssige Beschichtungslösung, die in Schritt 1.3 aufgetragen wurde, vorsichtig aus dem Zellkultureinsatz kurz vor der Aussaat der Zellen.
- Säen Sie die einzelnen Zellen mit 1 x 105 Zellen in einem Volumen von 200 μl pro Einsatz auf die apikale Oberfläche eines vorbeschichteten Zellkultureinsatzes.
- Geben Sie 700 μl des vollständigen Mediums, das mit 20 % FBS angereichert ist, auf die basolaterale Seite des Zellkultureinsatzes.
- Manövrieren Sie die Platte 10 Mal in Form der Zahl 8, damit sich die Zellen gleichmäßig über den Einsatz verteilen können.
- Bewahren Sie den Teller für 10 Minuten auf dem Tellerwärmer in der Biosicherheitswerkbank auf.
- Die Platte wird bei 37 °C und 5 % CO2 inkubiert.
- Ersetzen Sie nach 48 Stunden das Medium auf den apikalen und basalen Kompartimenten durch frisches enteroides Wachstumsmedium, das mit 20% FBS und Inhibitoren ergänzt ist.
- Entfernen Sie am dritten Tag das Medium aus den apikalen und basolateralen Kompartimenten, waschen Sie den Einsatz vorsichtig mit 1x PBS und ersetzen Sie ihn durch enteroide Differenzierungsmedien, die nur mit Inhibitoren ergänzt sind.
- Wechseln Sie die Medien in beiden Fächern alle 2-3 Tage.
- Quantitative Messung der Integrität der Epithelbarriere und der Monolayer-Konfluenz
HINWEIS: Die Barriereintegrität kann mit einem Epithelvoltohmmeter zur Messung des transepithelialen elektrischen Widerstands (TEER) beurteilt werden.- Nehmen Sie die Transwell-Kulturplatte aus dem Inkubator und lassen Sie sie einige Minuten lang in der Biosicherheitswerkbank bei RT äquilibrieren.
- Stellen Sie sicher, dass die STX2-Elektroden vorkonditioniert und das Voltohmmeter gemäß den Anweisungen des Herstellers auf 1000 Ω kalibriert wurden.
- Führen Sie den langen Stab der Sonde in das basolaterale Kompartiment und das kurze Ende in das apikale Kompartiment der Transwell-Epithelzellkultur ein. Achten Sie darauf, den Monolayer nicht zu stören oder den Einsatz zu beschädigen.
- Sobald die Stabilität stabil ist, zeichnen Sie 3 TEER-Messungen pro Transwell-Einsatz auf, einschließlich des Einsatzes ohne Zellen. Ermitteln Sie einen Mittelwert der Maße für jeden Einsatz.
- Berechnen Sie den korrigierten TEER-Wert, indem Sie die durchschnittliche Messung der Blindvertiefung von den Durchschnittsmessungen der Versuchsvertiefungen subtrahieren und dann mit der Oberfläche des Einsatzes multiplizieren, um den Widerstand der Epithelbarriere zu bestimmen (TEER [Ω,cm2] = [Rcell-Schicht - Rblank] × Fläche).
Repräsentative Ergebnisse
Der erste Schritt bei der Erzeugung von 2D-Enteroid-abgeleiteten Monolayern besteht darin, den entnommenen Schnitt des Darmgewebes (Abbildung 1A) für die Gewebedissoziation vorzubereiten. Dazu wird das anhaftende Fett und das Mesenterium aus dem Gewebe entfernt (Abbildung 1B), gefolgt von einem Längsschnitt des Gewebes, um die Lumenoberfläche freizulegen, so dass die Schleimschicht des Darms durch sanftes Abkratzen mit einem Glasobjektträger entfernt werden kann. Der entnommene Darmschnitt wird dann in immer kleinere Gewebeabschnitte geschnitten (Abbildung 1C), um die Dissoziation zu erleichtern. Die Krypten werden dann mit einer Reihe von Waschungen, die aus Chelatpuffern (Abbildung 1D,E) und PBS bestehen, vom darunter liegenden submukösen Gewebe dissoziiert. Die isolierten Darmkrypten (Abbildung 1F) werden dann in Basalmembran-Matrixkuppeln eingebettet (Abbildung 2A) und mehrere Tage lang kultiviert, um 3D-Enteroide zu erzeugen. Aus einem 10-Zoll-Schnitt des bovinen Ileums können etwa 900.000 Krypten isoliert und für die Enteroidbildung verwendet werden. Bereits nach wenigen Stunden in Kultur beginnen sich die plattierten Krypten zu verlängern und entwickeln sich zu Enterosphären (Abbildung 2B). Nach 2 Tagen kann ein gut definiertes Lumen beobachtet werden (Abbildung 2C), wobei Knospenstrukturen bereits am 4. Tag in Kultur festgestellt werden (Abbildung 2D). Am 7. Tag haben sich reife Enteroide entwickelt (Abbildung 2E). Die Immunfluoreszenzfärbung von 7 Tage alten 3D-Enteroiden zeigt das Vorhandensein verschiedener Zelllinien. Die konfokale Mikroskopie von Enteroiden zeigt die Lokalisierung der DAPI-Kernfärbung, des E-Cadherin-Proteins an der Adhärenzverbindung, der Chromogranin-A (Chr-A)-Färbung, die das Vorhandensein von enteroendokrinen Zellen zeigt, des Lysozyms (LYZ), das Paneth-Zellen demonstriert, und des Zytokeratin-18 (CK-18), das Enterozytenzellen repräsentiert (Abbildung 3). Nach 7-10 Tagen in Kultur sollten die Enteroide durchgelassen werden, um eine weitere Ausdehnung zu ermöglichen und eine Überfüllung zu verhindern. Die optimale Zeit bis zur Passage von Enteroiden wurde auf 7-10 Tage nach der anfänglichen Isolierung der Primärkrypte festgelegt und hängt letztendlich von der Gesundheit und Wachstumsrate der Enteroide in Kultur ab. Die optimale Aussaatdichte, um die gewünschte enteroide Morphologie und Lebensfähigkeit zu erreichen, wie in Abbildung 2E dargestellt, beträgt 400 Krypten pro Kuppel. Enteroide können leicht kryokonserviert werden, und die aufgetauten enteroiden Fragmente erholen sich nach zwei Passagen nach dem Auftauen vollständig für experimentelle Zwecke. Bemerkenswert ist, dass vor der Kryokonservierung mindestens zwei Passagen der primären Kryptenkultur empfohlen werden.
Um eine 2D-Enteroid-abgeleitete Monoschicht herzustellen, werden die 3D-Enteroide geerntet und in einer Reihe von Schritten in Gegenwart einer Dissoziationslösung (Abbildung 4A) mechanisch in einzelne Zellen zerrieben. Diese Einzelzellen können dann auf einen Transwell-Einsatz gesät werden, der mit einer Basalmembran-Matrix-Nährmedienlösung vorbeschichtet wurde. Im Durchschnitt können vier Transwells aus vier 3D-enteroiden Kuppeln ausgesät werden. Die Anzahl der verarbeiteten 3D-Enteroide hängt somit von der Anzahl der Transwells ab, die für das Experiment benötigt werden. Die Beschichtung einzelner Zellen mit einer Aussaatdichte von 1 x 105 und deren anfängliche Kultivierung in Gegenwart von 20 % FBS (Abbildung 4B-D) kann in weniger als 1 Woche eine konfluente Monoschicht erzeugen. Die fortschreitende Konfluenz der 2D-Monoschicht in Kultur kann im Laufe der Zeit mit Hilfe der Lichtmikroskopie überwacht werden (Abbildung 4E,F). Messungen des transepithelialen elektrischen Widerstands (TEER) können die Konfluenz bestätigen und die Integrität der Epithelbarriere im Laufe der Zeit und als Reaktion auf experimentelle Stimulation charakterisieren (Abbildung 5A). Im Durchschnitt hat eine etwa 100% konfluente Monolage nach sieben Tagen in Kultur einen entsprechenden TEER-Wert von ~1500 Ω·cm2. Eine longitudinale Bewertung der 2D-enteroiden Monolayer-TEER-Werte zeigt einen stetigen Anstieg der TEER-Werte über sieben Tage und erreicht einen maximalen Durchschnittswert von 1546 Ω·cm2, bevor er mit dem niedrigsten Wert von 11,5 Ω·cm2 am zwölften Tag abnimmt (Abbildung 5B). Die immunfluoreszierende Markierung differenzierter Monoschichten zeigt, dass mit diesem Protokoll intakte, organisierte, polarisierte Darmepithelschichten gebildet werden (Abbildung 6). Die konfokale Mikroskopie der gefärbten 2D-Monoschicht zeigt die Lokalisierung der DAPI-Kernfärbung, der E-Cadherin- und der F-Aktin-Färbung (Abbildung 6A-D). Die Fluoreszenzmikroskopie der 2D-Monoschicht zeigt Kennzeichen differenzierter Darmepithelzellen, wobei die Chromogranin-A (Chr-A)-Färbung das Vorhandensein von enteroendokrinen Zellen, Lysozym (LYZ) Paneth-Zellen und Cytokeratin-18 (CK-18) auf Enterozytenzelllinien hinweisen (Abbildung 6E-L). Die Z-Stack-Modellierung zeigt die erwartete Polarisation der 2D-Monolayer-Kultur mit charakteristischer Ablagerung von F-Aktin, das in den Mikrovilli gefunden wird, die den apikalen Aspekt der differenzierten Enterozyten abdecken, und E-Cadherin, einem Protein, das sich an den Adhärenzverbindungen befindet, die zwischen Epithelzellen verteilt sind (Abbildung 6M).
Die Funktionalität der Monoschicht kann durch apikale Stimulation mit verschiedenen Komponenten, einschließlich Toll-like-Rezeptor (TLR)-Liganden oder Pathogenen, beurteilt werden, gefolgt von der Zytokinquantifizierung von Zellkulturüberständen, die aus den apikalen und basalen Kompartimenten gewonnen wurden. Wenn der apikale Aspekt der Monoschicht am Tag 4 der Kultur für 24 Stunden mit dem TLR 1/2-Agonisten Pam3csk4 stimuliert wird, wird im Vergleich zu den unbehandelten Monolayern eine erhöhte Zytokinproduktion in beiden Kompartimenten beobachtet (Abbildung 7A,B).
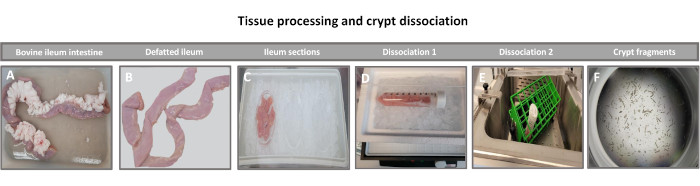
Abbildung 1: Isolierung der Darmkrypte von Rindern von gesunden erwachsenen Rindern. Bilder, die die Gewebeverarbeitung von (A) ganzem ausgewachsenem Rinder-Ileum, (B) entfettetem Ileum, (C) Ileum, das in 6,3 cm (2,5 Zoll) große Stücke in PBS auf Eis geschnitten wurde, (D) ilealen Gewebeschnitten in Dissoziationspuffer #1 bei 4 °C und (E) in Dissoziationspuffer 2 in einem Schüttelwasserbad bei 37 °C und (F) isolierten Ileumkryptenfragmenten veranschaulichen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
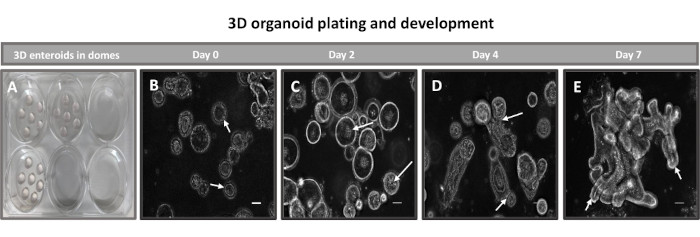
Abbildung 2: Primäre 3D-ileale enteroide Entwicklung von Rindern in der Basalmembranmatrix. Repräsentative Bilder von (A) 3D-Enteroidkuppeln, die in einer 6-Well-Gewebekulturplatte erstellt wurden, und (B-E) 3D-Enteroidentwicklung von den Tagen 0, 2, 4 und 7 in Kultur. Maßstabsleiste = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
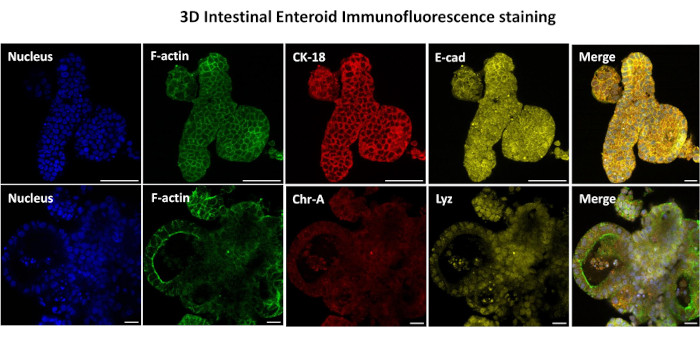
Abbildung 3: Dreidimensionale intestinale Enteroide zeigen die Färbung der Epithelzelllinie. Repräsentative Bilder von 3D-Enteroiden nach 7 Tagen in Kultur zeigen das Vorhandensein von Kernfärbung, F-Aktin, Zytokeratin-18 (CK-18), Chromogranin-A (Chr-A), Ecadherin (E-cad), Lysozym (Lyz) und Überlagerung von Bildern (Merge). Maßstabsleiste 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
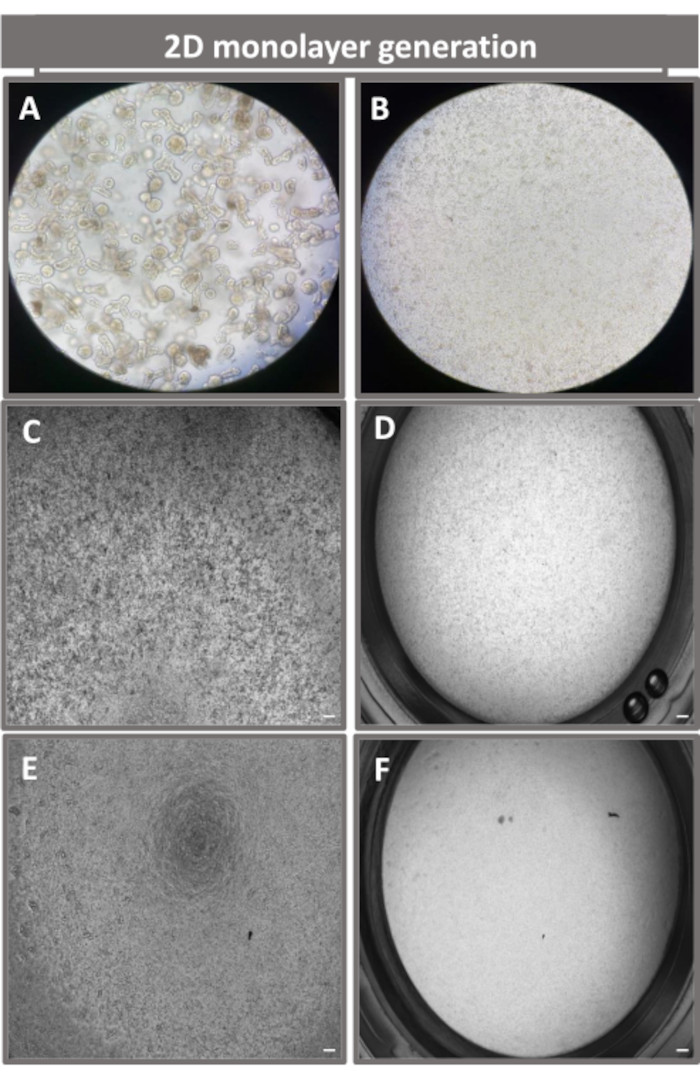
Abbildung 4: Etablierung einer 2D-Enteroid-abgeleiteten Monoschicht aus ilealen Enteroiden. Repräsentative Bilder von (A) 3D-Enteroidfragmenten in Dissoziationslösung zur Vorbereitung für das Monolayer-Seeding, Einzelzellen, die auf einem Transwell-Insert mit einer Seeding-Dichte von 1 x 105 plattiert wurden, die am Tag 0 mit (B) Licht, (C) Phasenkontrast und (D) Hellfeldmikroskopie abgebildet wurden, und Monolayer-Entwicklung auf Transwell-Inserts, die am fünften Tag mit (E) Phasenkontrast und (F) Hellfeldmikroskopie. 40-fache Vergrößerung und Maßstabsleiste = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
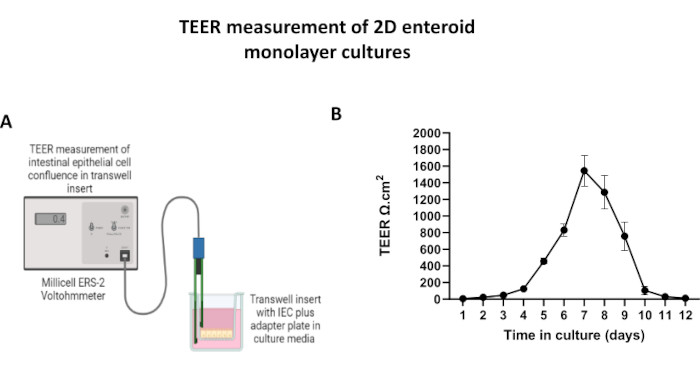
Abbildung 5: Messungen des transepithelialen elektrischen Widerstands (TEER) der 2D-enteroidabgeleiteten Monoschicht auf Transwell-Einsätzen. (A) Schematische Darstellung der TEER-Messungen der 2D-Monoschicht der Darmepithelzellen (IEC) mit den STX2-Essstäbchenelektroden eines Voltohmmeters, (B) Längsschnittüberwachung von 2D-Monolayer-TEER-Messungen über 12 Tage in Zellkultur. Jeder Datenpunkt stellt einen durchschnittlichen TEER-Wert und einen Standardmittelwert (SEM) dar, der aus zwei technischen Replikaten ermittelt wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
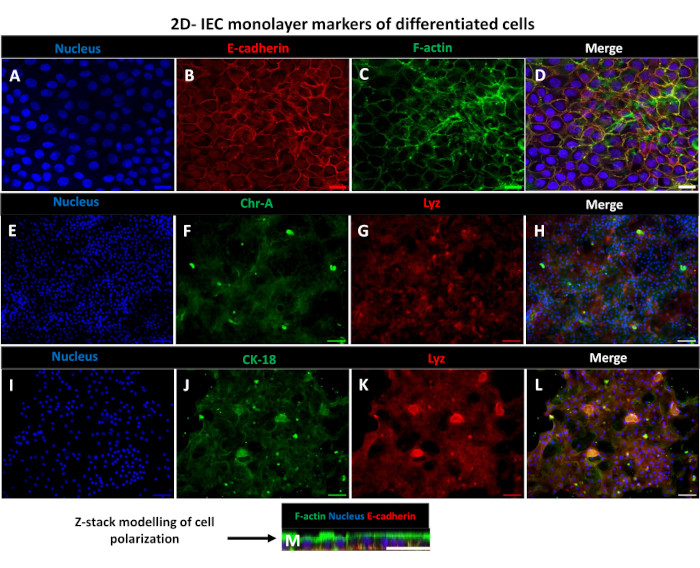
Abbildung 6: Differenzierte 2D-enteroide Monoschichten auf Transwell-Inserts entwickeln sich zu polarisierten Darmepithelschichten. (A-M) Repräsentative Immunfluoreszenzbilder einer 2D-Enteroid-abgeleiteten Monoschicht auf dem Transwell-Insert nach 5 Tagen in Kultur, die den (A) Zellkern (blau), (B) E-Cadherin (Rot), (C) F-Aktin (grün) und (D) Overlay der 3 Bilder (Merge), (E,I) Kernfärbung, (F) Chromogranin-A, (J) Cytokeratin-18, (G,K) Lysozym und (H,L) Merge der Bilder zeigen. (M) Z-Stapel-Modellierung, die die Verteilung der gleichen Epithelzell-Markerproteine des 2D-Monolayer-Blattes zeigt. Die Bilder wurden von 2 biologischen Replikaten erhalten. Maßstabsleiste = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
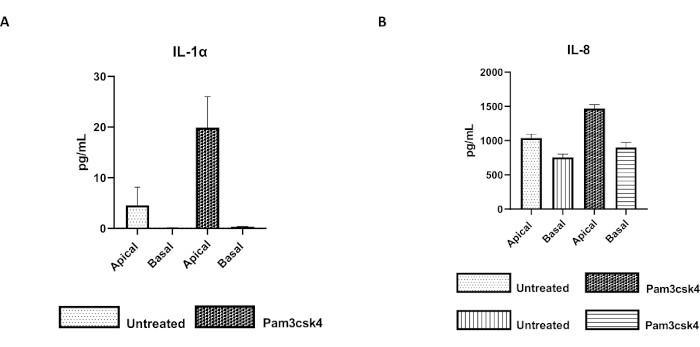
Abbildung 7: Bovine primäre 2D-enteroide Monolayer auf Transwell-Inserts sind funktionell aktiv. Apikale und basale Zellkultur-Zytokinsekretion von (A) IL-1α und (B) IL-8 durch 2D-Monolayer auf Transwell-Inserts nach 5 Tagen in Kultur, die 24 h lang unbehandelt oder mit Pam3csk4 stimuliert wurden. Die Daten sind repräsentativ für die durchschnittlichen Zytokinspiegel und SEM von Monoschichten, die aus gefrorenen Kryptenbeständen eines Tierversuchs und drei unabhängigen Experimenten stammen. Die Zytokine wurden mit dem Bead-basierten Multiplex-Assay (Table of Materials) gemäß den Anweisungen des Herstellers quantifiziert und auf einer kompakten Multiplexeinheit (Table of Materials) und einer Immunoassay-Kurvenanpassungssoftware (Table of Materials) analysiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Stamm- und Endkonzentration der Reagenzien. Bitte klicken Sie hier, um die Tabelle herunterzuladen.
Diskussion
Das hier vorgestellte Protokoll beschreibt ein physiologisch relevantes Modell zur Untersuchung der Darmphysiologie und von Darmerkrankungen. Mehrere Forschungsgruppen haben die Generierung von bovinen enteroiden Kulturen beschrieben, einschließlich der 2D-Monolayer 16,19,20,21,22,23,24. Während die Monolayer-Generierung technisch keine offensichtliche Herausforderung darstellt, sind mehrere winzige Schritte entscheidend für die konsistente Entwicklung erfolgreicher Kulturen. Daher kann die Reproduzierbarkeit von 2D-Monoschichten mit den in der veröffentlichten Literatur kurz beschriebenen Methoden für einen Forschungsanfänger auf dem Gebiet der Organoide eine Herausforderung darstellen. Das hierin beschriebene Protokoll ist von diesen Protokollen und denen, die in anderen Spezies veröffentlicht wurden, adaptiert und bietet eine Schritt-für-Schritt-Anleitung zur Monolagenerzeugung auf Transwell-Einsätzen, die in hohem Maße reproduzierbar ist.
Das hierin beschriebene Protokoll kann leicht modifiziert werden, um den spezifischen Zielen des Versuchsdesigns oder der Verfügbarkeit von Reagenzien gerecht zu werden. In der Tat können nach diesem Protokoll erfolgreiche Kulturen durch Aussaat von Monoschichten bei einer niedrigeren Zelldichte (z. B. 2,5 x 104) oder in Abwesenheit von FBS erreicht werden, wie in anderen Veröffentlichungen24 beschrieben. Die Veränderung dieser Parameter kann jedoch eine erhöhte Kultur erfordern, um eine konfluente Monoschicht zu etablieren. Wenn also andere Faktoren, die für das Studiendesign wichtig sind, einschließlich der Co-Kultur mit Immunzellen, einen bestimmten Zeitverlauf für das Experiment vorgeben, kann die Aussaatdichte nach Bedarf geändert werden. Während andere Basalmembranformulierungen anstelle der in diesem Protokoll verwendeten ersetzt werden können, um 3D-Enteroide und 2D-Monoschichten zu erzeugen, erfordern diese einige Optimierungen, um das optimale Basalmembran-zu-Medien-Verhältnis zu bestimmen.
Die Anwendung von Transwell-Einsätzen in der beschriebenen Methodik hat viele Vorteile gegenüber dem Monoschichtwachstum auf herkömmlichen Kunststoffwaren und 3D-Enteroidkulturen. Im Vergleich zu Standard-Gewebekulturplatten fördert die Verwendung von Transwells für Monolayer-Kulturen die zelluläre Differenzierung und Organisation in einer Weise, die die Ähnlichkeit mit Darmkrypten beibehält14,25. Die Darmepithelbarriere ist von entscheidender Bedeutung, um die Translokation von Toxinen und Mikroorganismen in den Körper zu verhindern und gleichzeitig die Nährstoffaufnahme zu erleichtern. Daher ist es wichtig zu verstehen, wie die Barriereintegrität des Darms bei gesunden Menschen funktioniert und bei Darmerkrankungen oder als Reaktion auf Verbindungen verändert wird. Im Gegensatz zu 3D-enteroiden Kulturen ist eine objektive Beurteilung der Integrität der Darmbarriere möglich, wenn Monoschichten auf Transwells kombiniert und TEER gemessen wird, wie hiergezeigt wird 14,25. Die Erzeugung von 2D-Monolayern auf Transwells ermöglicht auch die duale Kultur mit relevanten Zelltypen wie Immun- oder Stromazellen. Auf diese Weise kann die kritische Kommunikation zwischen Darmzellen und Zellen der Gewebemikroumgebung charakterisiert werden, was mit 3D-Kulturen nicht erreicht werden kann. Die Exposition der apikalen Oberfläche der Monoschicht ermöglicht nicht nur die experimentelle Exposition gegenüber Krankheitserregern und Verbindungen und die Sammlung luminaler Produkte, sondern ermöglicht auch Studien zu anderen Aspekten der Darmphysiologie und -krankheit, einschließlich der Untersuchung der intestinalen Mikrobiota und der molekularen Absorptions- oder Transportphysiologie13. Die unabhängige Kontrolle über die apikalen und basalen Darmoberflächen ist ein deutlicher Vorteil gegenüber 3D-enteroidalen Modellen.
Durch mehrere Versuchsexperimente identifizierten wir wichtige Schritte, die zum Erfolg des Protokolls beitrugen. Während ganze Darmgewebeproben über Nacht gekühlt und am nächsten Tag verarbeitet werden können, müssen die Schritte der Gewebedissoziation und Isolierung von Kryptenfragmenten zeitnah durchgeführt werden, um den Zerfall der isolierten Kryptenfraktionen zu verhindern. Nach Abschluss der PBS-Waschvorgänge kann das Zentrifugieren der Krypten in Waschmedien dazu beitragen, den Zerfall der Krypten zu verhindern, wie in Schritt 2.3.10 beschrieben. Bei der Passage der Enteroide oder bei der Ernte für die Monolagenbildung ist es wichtig, die Enteroide von den BME-Kuppeln zu trennen. Das Waschmedium muss eiskalt sein, um die Auflösung des BME zu unterstützen. Im Gegensatz dazu kann die Verwendung von vorgewärmtem TrypLE und die zweimalige Filterung der Zellsuspension dazu beitragen, die für die Monolayer-Erzeugung erforderlichen Einzelzellen zu bilden. Schließlich kann das manuelle Manövrieren der Platte in Form der Zahl 8 dazu beitragen, die einzelnen Zellen gleichmäßig über den Transwell-Einsatz zu verteilen.
Eine wichtige Einschränkung dieses Protokolls besteht darin, dass die 2D-Monolagen aus enteroiden Stämmen hergestellt wurden, die von einem ausgewachsenen Holstein-Ochsen (>2 Jahre alt) erzeugt wurden. Der reifende Magen-Darm-Trakt bei Kälbern kann geringfügige Änderungen des beschriebenen Protokolls erforderlich machen, um optimale Ergebnisse zu erzielen. Rassespezifische Unterschiede in der Darmphysiologie von Rinderrassen sind in der Literatur beschrieben26. Es ist zwar nicht bekannt, ob sich diese Unterschiede auf die Generierung von Enteroiden und nachfolgenden Monolayern auswirken könnten, aber wir vermuten, dass alle Unterschiede nur zu geringfügigen Änderungen an unserem Protokoll führen würden. Darüber hinaus hat das 2D-Kulturmodell einige inhärente Nachteile. Im Vergleich zu 3D-enteroidalen Modellen können 2D-Kulturen einige Aspekte der Darmgewebearchitektur und der zellulären Vielfalt fehlen und Einschränkungen und Herausforderungen im Zusammenhang mit der Vermehrung von 2D-Kulturen verursachen13. Dennoch zeigen Studien, dass einige Monolagen die erwartete Kryptenorganisation emulieren können27, und einige dieser Einschränkungen könnten sogar durch die Etablierung von 2D-Kulturen mit einer Luft-Flüssigkeits-Grenzfläche überwunden werden. Nichtsdestotrotz sollten die Grenzen dieses Modells umfassend berücksichtigt werden, um festzustellen, ob seine Anwendung für die gestellte experimentelle Frage geeignet ist.
Dieses Protokoll beschreibt ein optimiertes Kultursystem, das den Magen-Darm-Trakt von Rindern unter Verwendung von Enteroiden aus dem bovinen Ileum modelliert, um Monoschichten auf Transwell-Inserts zu bilden. Mit einem breiten Anwendungsspektrum von der Erforschung von Infektionskrankheiten über die Arzneimittelforschung bis hin zur regenerativen Medizin könnte dieses Hochdurchsatz-Kultursystem zu einer beispiellosen Entwicklung präventiver und therapeutischer Strategien führen, die für die Gesundheit von Mensch und Tier von gegenseitigem Nutzen sein könnten.
Offenlegungen
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Wir begrüßen die Nutzung der Cellular and Molecular Core Facility an der Midwestern University.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.2 mL pipette tip | MidSci | PR-200RK-S | |
| 1 µm PET 24-well cell culture inserts | Corning | 353104 | |
| 1000 mL pipette tip | MidSci | PR-1250RK-S | |
| 22 G needle | Becton, Dickinson and Company | 305156 | |
| 24-well culture vessel | Corning | 353504 | |
| 40 μm cell strainer | Corning | 431750 | |
| 50 mL centrifuge tube | Fisher scientific | 14-955-240 | |
| 5-mL pipet tip | Fisher scientific | 30075307 | |
| 5 mL syringe | Becton, Dickinson and Company | 309647 | |
| 5 mL tube | Eppendorf | 30119401 | |
| Anti-Cytokeratin -18 (C-04) | Abcam | AB668-1001 | |
| B-27 supplement without vitamin A | Gibco | 12-587-010 | |
| Belysa software | Luminex | 40-122 | Immunoassay curve fitting software |
| Bovine serum albumin (BSA) | Fisher bioreagents | BP9704-100 | |
| Caspofungin acetate | Selleckchem | S3073 | |
| Cell lifter | Fisher Scientific | 08-100-241 | |
| Chromogranin-A (E-5) | Santa Cruz Biotechnology | SC-271738 | |
| Coverslips | Fisher scientific | 12-540-C | |
| Cryovials | Neptune scientific | 3471.X | |
| Cultrex Ultimatrix RGF BME | R&D Systems | BME001-05 | |
| DAPI | MilliporeSigma | D9542-5MG | |
| Dissecting scissors | VWR | 82027-588 | |
| Dithiothreitol (DTT) solution | Thermo Scientific | FERR0861 | |
| DMEM/ F-12 1.1 medium (with L-glutamine, without HEPES) | Cytiva | SH30271.01 | |
| E-cadherin | Cell Signaling Technology | #3195 | |
| Ethylenediaminetetraacetic acid | Fisher Scientific | BP2482500 | |
| FBS | Corning | MT35070CV | |
| Gentamicin | Gibco | 15710064 | |
| Glass microscope slide | Fisher scientific | 12-550-07 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11001 | |
| Goat anti-mouse Alexa Fluor 647 | Invitrogen | A21235 | |
| Goat anti-rabbit Alexa Fluor 555 | Invitrogen | A21428 | |
| Hemacytometer | Bio-Rad | 1450015 | |
| IntestiCult organoid Differentiation medium (Human) | StemCell Technologies | 100-0214 | |
| IntestiCult organoid growth medium (Human) | StemCell Technologies | 0-6010 | |
| Keyence BZ-X700 | Keyence | BZ-X700 | |
| LY2157299 (Galunisertib) | Selleckchem | S2230 | |
| MAGPIX system | Luminex | Magpix system | Compact multiplexing unit |
| Microscope | Keyence | BZ-X700 | |
| MILLIPLEX Bovine Cytokine/Chemokine Magnetic Bead Panel | MilliporeSigma | BCYT1-33K | Bead-based multiplex assay |
| Mr. Frosty container | Nalgene | 5100-0001 | |
| Non-Enzymatic Cell Dissociation Solution | ATCC | 30-2103 | |
| NutriFreeze D10 Cryopreservation Media | Biological Industries | 05-713-1B | |
| Orbital shaking platform | Thermo Fisher | 88880021 | |
| Pam3Csk4 | invivogen | tlrl-pms | |
| Parafilm sealing film | dot scientific inc. | #HS234526C | |
| Paraformaldehyde 16% solution | Electron Microscopy Sciences | 15710 | |
| Phalloidin-FITC | R&D Systems | 5782/12U | |
| Phosphate buffered saline | Fisher Scientific | BP399-20 | |
| Prolong Glass Antifade | Invitrogen | P36982 | |
| Rabbit anti-human Lyzozyme (EC3.2.1.17) | Agilent technologies | A009902-2 | |
| SB202190 (FHPI) | Selleckchem | S1077 | |
| Shaking water bath | Thermo Fisher | MaxQ 7000 | |
| Sodium Azide | VWR | BDH7465-2 | |
| Streptomycin | Teknova | S6525 | |
| Trypan Blue dye | Gibco | 15250-061 | |
| TrypLE express enzyme | Life technologies | 12604013 | |
| Tween 20 | Fisher Scientific | BP337 | |
| Voltohmmeter | MilliporeSigma | Millicell ERS-2 | |
| Y-27632 | Selleckchem | S1049 |
Referenzen
- Gerdts, V., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Reza Khorramizadeh, M., Saadat, F. Animal models for human disease. Animal Biotechnology. Chapter 8, 153-171 (2020).
- Meyerholz, D. K., Beck, A. P., Singh, B. Innovative use of animal models to advance scientific research. Cell and Tissue Research. 380 (2), 205-206 (2020).
- Hamernik, D. L. Farm animals are important biomedical models. Animal Frontiers. 9 (3), (2019).
- Ribitsch, I., et al. Large animal models in regenerative medicine and tissue engineering: To do or not to do. Frontiers in Bioengineering and Biotechnology. 8, 972 (2020).
- Wagar, L. E., DiFazio, R. M., Davis, M. M. Advanced model systems and tools for basic and translational human immunology. Genome Medicine. 10 (1), 73 (2018).
- Ziegler, A., Gonzalez, L., Blikslager, A. Large animal models: The key to translational discovery in digestive disease research. Cellular and Molecular Gastroenterology and Hepatology. 2 (6), 716-724 (2016).
- Roth, J. A., Tuggle, C. K. Livestock models in translational medicine. ILAR Journal. 56 (1), 1-6 (2015).
- Schultz, R. D., Dunne, H. W., Heist, C. E. Ontogeny of the bovine immune response. Infection and Immunity. 7 (6), 981-991 (1973).
- Potter, A. A., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Ahluwalia, B., Magnusson, M. K., Öhman, L. Mucosal immune system of the gastrointestinal tract: maintaining balance between the good and the bad. Scandinavian Journal of Gastroenterology. 52 (11), 1185-1193 (2017).
- Roodsant, T., et al. A human 2D primary organoid-derived epithelial monolayer model to Study host-pathogen interaction in the small intestine. Frontiers in Cellular and Infection Microbiology. 10, 272 (2020).
- Liu, Y., Chen, Y. G. 2D- and 3D-based intestinal stem cell cultures for personalized medicine. Cells. 7 (12), 225 (2018).
- Duque-Correa, M. A., Maizels, R. M., Grencis, R. K., Berriman, M. Organoids - New models for host-helminth interactions. Trends in Parasitology. 36 (2), 170-181 (2020).
- Kar, S. K., et al. Organoids: a promising new in vitro platform in livestock and veterinary research. Veterinary Research. 52 (1), 43 (2021).
- Hamilton, C. A., et al. Development of in vitro enteroids derived from bovine small intestinal crypts. Veterinary Research. 49 (1), 54 (2018).
- Beaumont, M., et al. Intestinal organoids in farm animals. Veterinary Research. 52 (1), 33 (2021).
- Lee, B. R., et al. Robust three-dimensional (3D) expansion of bovine intestinal organoids: An in vitro model as a potential alternative to an in vivo system. Animals (Basel). 11 (7), 2115 (2021).
- Töpfer, E., et al. Bovine colon organoids: From 3D bioprinting to cryopreserved multi-well screening platforms. Toxicology in Vitro. 61, 104606 (2019).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375 (2), 409-424 (2019).
- Rusu, D., Loret, S., Peulen, O., Mainil, J., Dandrifosse, G. Immunochemical, biomolecular and biochemical characterization of bovine epithelial intestinal primocultures. BMC Cell Biology. 6, 42 (2005).
- Dibb-Fuller, M. P., Best, A., Stagg, D. A., Cooley, W. A., Woodward, M. J. An in-vitro model for studying the interaction of Escherichia coli O157:H7 and other enteropathogens with bovine primary cell cultures. Journal of Medical Microbiology. 50 (9), 759-769 (2001).
- Sutton, K. M., Orr, B., Hope, J., Jensen, S. R., Vervelde, L. Establishment of bovine 3D enteroid-derived 2D monolayers. Veterinary Research. 53 (1), 15 (2022).
- Barrila, J., et al. Modeling host-pathogen interactions in the context of the microenvironment: Three-dimensional cell culture comes of age. Infection and Immunity. 86 (11), e00282-e00318 (2018).
- Carvalho, P. H. V., Pinto, A. C. J., Millen, D. D., Felix, T. L. Effect of cattle breed and basal diet on digestibility, rumen bacterial communities, and eating and rumination activity. Journal of Animal Science. 98 (5), skaa114 (2020).
- Thorne, C. A., et al. Enteroid monolayers reveal an autonomous WNT and BMP circuit controlling intestinal epithelial growth and organization. Developmental Cell. 44 (5), 624-633 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten