Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Grüne Synthese, Charakterisierung, Verkapselung und Messung des Freisetzungspotenzials neuartiger Alkali-Lignin-Mikro-/Submikron-Partikel
In diesem Artikel
Zusammenfassung
Wir beschreiben neuartige, einfache Methoden der Synthese und Charakterisierung von biokompatiblen Lignin-Mikro- und Submikron-Partikeln. Diese Formulierungen bieten einen einfachen Ansatz für die Nutzung des Heteropolymers sowie eine Alternative für das rationale Design multifunktionaler Trägermatrizen mit potenzieller Anwendbarkeit in der Biomedizin, Pharmatechnik und Lebensmittelindustrie.
Zusammenfassung
Die Anwendbarkeit der Biopolymer-Mikro-/Nanotechnologie in der Human-, Veterinär-, Pharma- und Lebensmitteltechnik wächst aufgrund des großen Potenzials von biopolymerbasierten Partikeln als effektive Trägersysteme rasant. Die Verwendung von Lignin als basische Heteropolymer-Biomatrix für das Design innovativer Mikro-/Submikron-Formulierungen ermöglicht die Erzielung einer erhöhten Biokompatibilität und bietet verschiedene aktive funktionelle Gruppen, die Möglichkeiten zur Anpassung der physikalisch-chemischen Eigenschaften und Bioaktivitäten der Formulierungen für verschiedene Anwendungen bieten. Das Ziel der vorliegenden Studie war es, eine einfache und umweltfreundliche Methodik für die Synthese von Ligninpartikeln mit Mikro- und Submikrongröße zu entwickeln; ihre physikalisch-chemischen, spektralen und strukturellen Eigenschaften zu bewerten; und ihre Fähigkeit zur Verkapselung biologisch aktiver Moleküle und ihr Potenzial für die In-vitro-Freisetzung von Bioflavonoiden in simulierten gastrointestinalen Medien zu untersuchen. Die vorgestellten Methoden verwenden billige und umweltfreundliche Lösungsmittel; Einfache, unkomplizierte, schnelle und empfindliche Prozesse, die wenig Ausrüstung, ungiftige Substanzen und einfache Methoden für ihre Charakterisierung, die Bestimmung des Verkapselungsvermögens gegenüber den schwer wasserlöslichen bioaktiven Verbindungen Morin und Quercetin und das In-vitro-Freisetzungspotenzial der Ligninmatrizen erfordern.
Einleitung
Heutzutage hat die Neigung zu Biopolymeren wie Cellulose, Chitosan, Kollagen, Dextran, Gelatine und Lignin als Vorläufer für das Design von Mikro-/Submikron-Trägern mit anpassbarer Größe, physikalisch-chemischen Eigenschaften und Biofunktionalitäten in der biomedizinischen, pharmazeutischen und lebensmitteltechnischen Industrie aufgrund ihrer Anwendbarkeit im Tissue Engineering, 3D-Bioprinting und in vitro zugenommen Krankheitsmodellierungsplattformen, Verpackungsindustrie, Emulsionszubereitung und Nährstoffabgabeunter anderem 1,2,3.
Neuartige Studien beleuchten die Aspekte von ligninbasierten Hydrogelen sowie Mikro- und Nanoformulierungen4 als vorteilhafte Vehikel für Lebensmittelverpackungsmaterialien5, Energiespeicherung6, Kosmetika7, Wärme-/Lichtstabilisatoren, verstärkte Materialien und Wirkstoffträgermatrizen8 für die Abgabe hydrophober Moleküle, Verbesserung von UV-Barrieren9, als Verstärkungsmittel in Nanokompositen und als Alternative zu anorganischen Nanopartikeln aufgrund einiger aktueller Sicherheitsprobleme 10,11,12. Der Grund für diese Tendenz ist die Biokompatibilität, biologische Abbaubarkeit und Nicht-Toxizität des natürlichen Hetero-Biopolymers sowie seine nachgewiesenen Bioaktivitäten in Bezug auf Lignin-antioxidatives Potenzial und Radikalfänger, antiproliferative und antimikrobielle Aktivitäten 13,14,15,16,17.
In der wissenschaftlichen Literatur werden verschiedene Methoden zur Synthese (Selbstorganisation, Anti-Lösungsmittelfällung, Säurefällung und Lösungsmittelverschiebung)18 und zur Charakterisierung von Lignin-basierten mikro-/nanoskaligen Formulierungen berichtet, einschließlich der Anwendung teurer oder schädlicher Lösungsmittel wie Tetrahydrofuran (THF), Dimethylsulfoxid (DMSO), N,N-Dimethylformamid (DMF) und Aceton sowie komplizierter, indirekter und langwieriger Prozesse, bei denen viele Geräte und giftige Substanzen verwendetwerden 12,19,20.
Um die letztgenannten Nachteile zu überwinden, stellen die folgenden Protokolle neuartige Methoden für die Synthese von Lignin-basierten Mikro-/Submikron-Partikeln unter Verwendung billiger und umweltfreundlicher Lösungsmittel vor: Einfache, unkomplizierte, schnelle und empfindliche Prozesse, die wenig Ausrüstung, ungiftige Substanzen und einfache Methoden zu ihrer Charakterisierung und zur Bestimmung der Verkapselungskapazität für schwer wasserlösliche bioaktive Verbindungen und des In-vitro-Freisetzungspotenzials der Ligninmatrizen erfordern. Die vorgestellten Produktionsmethoden im Labormaßstab sind vorteilhaft für die Herstellung von funktionellen Ligninträgern mit einstellbaren Größen, hoher Verkapselungskapazität und nachhaltigem In-vitro-Freisetzungsverhalten unter Verwendung einfacher Charakterisierungsverfahren und umweltfreundlicher Chemikalien, die in verschiedenen Bereichen der biomedizinischen Wissenschaften und Lebensmitteltechnologie Anwendung finden können. Zwei Flavonoide wurden als Zielmoleküle in die Ligninpartikel eingekapselt: Morin in die Mikropartikel und Quercetin in die Submikronpartikel. Der Unterschied in den Strukturen beider Flavonoide ist nur die Position der zweiten -OH-Gruppe im B-aromatischen Ring: Die -OH-Gruppe befindet sich auf der 2'-Position in Morin und auf der 3'-Position in Quercetin, somit sind beide organischen Verbindungen Positionsisomere. Letzteres setzt ein ähnliches Verhalten beider bioaktiver Naturstoffe bei den Prozessen der Verkapselung und/oder Freisetzung voraus.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Synthese von Lignin-Mikropartikeln
- Bereiten Sie eine wässrige Lösung mit 50 mg/ml Alkali-Lignin vor, indem Sie 2,5 g Alkali-Lignin in 50 ml Reinstwasser auf einem Magnetrührer auflösen.
- Bereiten Sie eine 1%ige Tween 80-Lösung vor, indem Sie 1 mL Tween 80 in 100 mL Reinstwasser auflösen.
- Bereiten Sie eine 2 M Lösung von HNO3 vor, indem Sie 6,65 mL 67 % HNO3 (Dichte = 1,413 g/ml) mit Reinstwasser auf ein Endvolumen von 50 mL verdünnen.
- Geben Sie langsam 15 ml der 1%igen Tween 80-Lösung zu 50 ml der 50 mg/ml-Alkali-Lignin-Lösung.
- Rühren Sie das Gemisch auf einem Magnetrührer bei 500 U/min für 10 Minuten, damit sich das Tensid gut verteilt.
- 20 mL 2 M HNO3 tropfenweise mit einer Spritze bei einer Flussrate von ca. 150 μl/s in die Mischung geben.
- Rühren Sie die Mischung 30 Minuten lang weiter, während sich die dunkelbraune Lösung in eine hellbraune Suspension von Mikropartikeln verwandelt.
- Die Suspension in 1,5-2 mL Reagenzgläser überführen und 30 min bei 15.000 × g in einer Ultrazentrifuge bei 10 °C zentrifugieren.
- Sammeln Sie den Überstand für weitere Analysen und spülen Sie die Mikropartikel mit Reinstwasser ab.
- Wiederholen Sie die Spül-/Ultrazentrifugationsvorgänge 3x.
- Tauchen Sie den Behälter mit den Mikropartikeln vor der Ultraschall-Homogenisierung in ein Eisbad.
- Homogenisieren Sie die Mikropartikel 4 min lang mit einer Intensität von 93 % auf einem Ultraschall-Homogenisator.
- Lyophilisieren Sie die Mikropartikel bei einer Temperatur von -64 °C in einem Gefriertrockner und lagern Sie sie in einem Exikator zur weiteren Verwendung.
2. Synthese von Lignin-Submikron-Partikeln
- Bereiten Sie eine wässrige Lösung mit 5 mg/ml Alkali-Lignin vor, indem Sie 125 mg Alkali-Lignin in 25 ml Reinstwasser auf einem Magnetrührer auflösen.
- Geben Sie langsam 1 ml 96% EtOH in die Alkali-Lignin-Lösung.
- Rühren Sie die Mischung auf einem Magnetrührer bei 500 U/min für 3 min.
- Bereiten Sie 50 ml einer 1%igen Zitronensäurelösung vor, indem Sie 0,5 g Zitronensäure in Reinstwasser bis zu einem Endvolumen von 50 ml auflösen.
- Geben Sie 7 ml 1%ige Zitronensäure tropfenweise mit einer Spritze bei einer Durchflussrate von ca. 4 ml/min in die Mischung.
- Rühren Sie die Mischung 10 Minuten lang weiter, bis sich die braune, klare Lösung in eine trübe, hellbraune Suspension aus Submikronpartikeln verwandelt.
- Die Suspension in Reagenzgläser überführen und 30 min bei 15.000 × g in einer Ultrazentrifuge bei 10 °C zentrifugieren.
- Sammeln Sie den Überstand für weitere Analysen und spülen Sie die Mikropartikel mit Reinstwasser ab.
- Wiederholen Sie die Spül-/Ultrazentrifugationsvorgänge 3x.
- Tauchen Sie den Behälter mit den Mikropartikeln vor der Ultraschall-Homogenisierung in ein Eisbad.
- Homogenisieren Sie die Mikropartikel in zwei Zyklen von je 4 min mit einer Intensität von 96 % in einem Ultraschall-Homogenisator mit Ultraschall.
- Kühlen Sie die Behälter nach dem ersten Zyklus 1 Minute lang ab.
- Lyophilisieren Sie die Mikropartikel bei einer Temperatur von -64 °C in einem Gefriertrockner und lagern Sie sie in einem Exikator zur weiteren Verwendung.
3. Synthese von natürlichen, mit Flavonoiden verkapselten Lignin-Mikro-/Submikron-Partikeln
- Wiederholen Sie die Schritte 1.1-1.5 für die Mikropartikel.
- Wiegen Sie 0,08 g Morin, lösen Sie es in 1 ml EtOH auf und fügen Sie diese ethanolische Lösung zu der Mischung hinzu.
- Rühren Sie die Mischung auf einem Magnetrührer bei 500 U/min für 20 min.
- 20 mL 2 N HNO3 tropfenweise mit einer Spritze bei einer Flussrate von ca. 150 μl/s in die Mischung geben.
- Rühren Sie die Mischung 60 Minuten lang weiter.
- Wiederholen Sie die Schritte 1.8-1.13.
- Wiederholen Sie Schritt 2.1 für die Submikron-Partikel.
- Wiegen Sie 0,04 g Quercetin, lösen Sie es in 1 mL EtOH und geben Sie diese ethanolische Lösung in die wässrige Alkali-Lignin-Lösung.
- Rühren Sie die Mischung auf einem Magnetrührer bei 500 U/min für 10 min.
- Wiederholen Sie die Schritte 2.4-2.13.
4. Bestimmung der Verkapselungseffizienz von Lignin-Mikro-/Sumikropartikeln
- Berechnen Sie den Gehalt der zugesetzten bioaktiven Substanz während des Verfahrens zur Synthese beider Arten von Flavonoid-verkapselten Ligninpartikeln.
- Die Resorption des Flavonoids in dem in den Schritten 1.9 und 2.8 erhaltenen Überstand wird spektrophotometrisch bestimmt, nachdem es mit 96 % EtOH verdünnt wurde.
- Berechnen Sie die Konzentration des nicht eingeschlossenen Morins/Quercetins anhand der Kalibrierkurven der Flavonoide.
- Berechnen Sie die Verkapselungseffizienz (EE, %) der Lignin-Mikropartikel gegenüber den natürlichen Flavonoiden mit Hilfe von Gleichung (1):
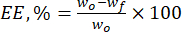 (1)
(1)
Dabei ist wo die Gesamtmenge des zugesetzten bioaktiven Stoffes (mg) und wf die Menge des freien, nicht eingeschlossenen Flavonoids (mg). - Berechnen Sie die Wirkstoffladekapazität (DLC, %) - ein wichtiger Parameter, der die Menge des Arzneimittels in den Partikeln pro Gewichtseinheit des Trägersystems darstellt - mit Gl. (2):
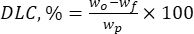 (2)
(2)
Dabei ist wp die Gesamtmenge (Ausbeute) der nach der Lyophilisation (mg) erhaltenen Lignin-Mikro-/Submikron-Partikel.
5. Charakterisierung von Lignin-Mikro- und Submikron-Partikeln
- Bestimmung von Partikelanzahl, -größe und -größenverteilung
- Beurteilen Sie die Partikelgröße und die Partikelgrößenverteilung der Proben mit einem automatischen Zellzähler mit der Option für die Raupenzählung. Mit einer Mikropipette 1 μl der Lignin/Flavonoid-Mikro-/Submikron-Partikelsuspension in Reinstwasser in die Vertiefung des für den Vorgang erforderlichen Zählobjektträgers geben.
- Warten Sie, bis die Anzahl der Partikel in 1 ml der Suspension sowie deren Anzahl und Verteilung nach Größe auf dem Display des automatischen Zellzählers angezeigt werden.
HINWEIS: Das Gerät ermöglicht die Speicherung der Daten auf einem USB-Flash. Die spezielle Software für den automatischen Zellzähler ermöglicht die Weiterverarbeitung der gespeicherten Digital- und Fotodateien.
- Bestimmung des Gehalts an sauren/basischen Oberflächengruppen von Ligninpartikeln durch potentiometrische Titration
- Gewicht 0,04 g unbeladene/mit Flavonoiden verkapselte Ligninpartikel.
- Füllen Sie sie in einen Erlenmeyerkolben, fügen Sie 10 mL 0,1 M HCl hinzu und stellen Sie den Kolben auf ein Magnetrührwerk bei 250 U/min.
- Füllen Sie eine 50 mL Bürette mit einer 0,1 M Standardlösung des Titriermittels NaOH.
- Messen Sie den anfänglichen pH-Wert der Lösung im Erlenmeyerkolben mit einem Tisch-pH-Messgerät, bevor Sie mit der Titration beginnen.
- Starten Sie die Titration und messen Sie den pH-Wert der analysierten Lösung nach jeweils 0,5 ml zugegebenem Teil des Titrationsmittels.
- Speichern Sie die Versuchsdaten in einer Tabelle, die das Volumen des aufgetragenen Titriermittels und den entsprechenden pH-Wert enthält.
- Stoppen Sie die Titration, wenn ein annähernd konstanter Wert des pH-Werts erreicht ist, indem Sie das Volumen der Titriermittellösung erhöhen.
- Plotten Sie die experimentellen Daten in Form von differentiellen Titrationskurven mit null, erster und zweiter Ableitung.
- Bestimmen Sie die Äquivalentpunkte und die entsprechenden äquivalenten Volumina der verwendeten Titranten.
- Berechnen Sie die Gehalte der sauren basischen Gruppen Aaund Abauf der Oberfläche von unbeladenen und flavonoidbeladenen Ligninpartikeln mit Hilfe der Gleichungen (3) und (4):
 , mGEQ/g (3)
, mGEQ/g (3)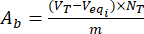 mGEQ/G (4)
mGEQ/G (4)
Dabei ist Veqi das äquivalente Volumen (ml); NT die Normalität des Titriermittels (mgeqv/mL); VT das Volumen des Titriermittels, das für das Bestimmungsverfahren verwendet wird (ml); m das Gewicht der analysierten Probe (g).
- Bestimmung des pH-Punktes der Nullladung (pH PZC) von Lignin-basierten Partikeln mit der Feststoffadditionsmethode.
- Bereiten Sie 60 mL 0,1 M wässrige Lösung von NaCl vor.
- 9 ml der 0,1 M NaCl-Lösung werden in jeden der fünf verstopften Konuskolben gegeben und der pH-Wert auf pHi = 2, 4, 7, 10 und 12 eingestellt (wobei i = 1-5 die Anzahl der entsprechenden Lösung angibt), jeweils durch Zugabe von 0,1 M HCl oder 0,1 M NaOH. Das Gesamtvolumen der Lösung in jedem Kolben wird durch Zugabe von NaCl-Lösung gleicher Stärke auf 10 ml genau eingestellt.
- Geben Sie 40 mg trockene Ligninpartikel (unbeladene, flavonoidbeladene Mikro-/Submikron) in jeden Kolben und verschließen Sie die Kolben fest.
- Befestigen Sie die Kolben aufrecht auf einem Orbitalschüttler und lassen Sie sie 24 Stunden lang zittern.
- Eine Äquilibrierung wird 30 Minuten lang durchgeführt und anschließend der endgültige pH-Wert (pHf) der Überstände in jedem Kolben gemessen.
- PlottenSie die pH-f-Werte gegen die entsprechenden anfänglichen pH-Werte (pHi).
- Der Ladungsnullpunkt (pHPZC) ist definiert als der pH-Wert, bei dem die Kurve ΔpH gegen pHi die Gerade mit den Koordinaten (pHi; pHi) schneidet.
- Bestimmung des Gesamtphenolgehalts (TPC) von Ligninpartikeln
HINWEIS: Der Gesamtphenolgehalt (TPC) der Mikro-/Submikron-Ligninpartikel wird mit einem modifizierten kolorimetrischen Folin-Ciocalteu-Verfahren bestimmt.- Mischen Sie 200 μl einer wässrigen Suspension von Partikeln mit einer Konzentration von 500 μg/ml mit 600 μl Reinstwasser und 200 μl Folin-Ciocalteu-Reagenz (1:1, v/v).
- Nach 5 min 1,0 mL 8 % Na2CO3 und 1,0 mL Milli-Q Wasser zu der Mischung geben und im Dunkeln bei 40 °C für 30 min in einem Wasserbad unter intermittierendem Rühren inkubieren.
- Die Suspension bei 5.300 × g für 2 min zentrifugieren.
- Bereiten Sie einen Rohling vor, der keine Partikel enthält.
- 3,5 mL des Überstands werden in eine 10 mm Quarzküvette überführt und die Extinktion mit einem UV/Vis-Spektralphotometer im sichtbaren Bereich bei 760 nm gegen den Rohling gemessen.
- Erstellen Sie eine Kalibrierkurve der Standard-Gallussäure gemäß den Schritten 5.3.1-5.3.5; Verwenden Sie anstelle von 200 μl der Ligninpartikelsuspension die ethanolische Lösung von Gallussäure mit Anfangskonzentrationen von 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150 und 200 μg/ml.
- Die experimentellen Daten der Mikropartikel sind in mg Gallussäureäquivalente in Milligramm pro Gramm trockener Probe (mg GAE/g) anzugeben.
- Berechnen Sie TPC mit Gleichung (5):
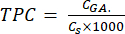 mg GAE/g (5)
mg GAE/g (5)
Dabei ist CGA die Konzentration der Probe, die der Konzentration der Standardgallussäure entspricht, die aus der Kalibrierfläche der Säure (μg GA/ml) ermittelt wurde; Cs ist die Konzentration der Probe, die gleich der Trockenmasse der Probe dividiert durch das Volumen des Lösungsmittels (μg/ml) ist.
6. Bestimmung des In-vitro-Freisetzungsvermögens von Ligninpartikeln
- Bereiten Sie 250 ml simuliertes enzymfreies Magenmedium vor, indem Sie den pH-Wert der PBS-Standardlösung mit 0,1 M HCl auf pH = 1,2 einstellen.
- Bereiten Sie jeweils 250 ml der beiden simulierten Darmflüssigkeitslösungen vor, indem Sie den pH-Wert der PBS-Standardlösung mit 0,1 M NaOH/0,1 M HCl auf pH = 6,8 bzw. 7,4 einstellen.
- Geben Sie 25 mg flavonoidverkapselte Mikro-/Submikron-Partikel zu 50 mL des simulierten enzymfreien Magenmediums in einen Glasbatch-Reaktor, der mit einem mechanischen Rührer geliefert wird, und legen Sie es in ein Thermalwasserbad bei einer konstanten Temperatur von T = 37 ± 0,2 °C.
- Tauchen Sie das Rührwerk bis zu einer Tiefe von 2/3 des Flüssigkeitsvolumens ein, um eine vollständige Durchmischung der festen und flüssigen Phase zu gewährleisten und einen maximalen Stoffaustausch ohne stagnierende Zonen zu gewährleisten.
- Alle 10 Minuten bis zur 90. Minute wird 1 ml Probe aus dem Reaktor entnommen und sofort 1 ml frische, simulierte flüssige Lösung in den Reaktor pipettiert, um eine Veränderung des Gesamtvolumens zu verhindern und die Senkenbedingungen zu gewährleisten.
- Wiederholen Sie das gleiche Verfahren einschließlich der Schritte 6.3-6.6 mit beiden simulierten Darmflüssigkeitslösungen mit einem pH-Wert = 6,8 bzw. 7,4 für 200 Minuten.
- Führen Sie analoge Experimente mit ungeladenen Ligninpartikeln in den drei simulierten Medien durch und verwenden Sie die Proben als Rohlinge für die Nullstellung des Spektralphotometers.
- Die Absorption der Proben wird spektrophotometrisch bestimmt, nachdem die Proben filtriert und mit 96 % EtOH gegen die Blindproben aus Schritt 6.7 verdünnt wurden, und die entsprechende Flavonoidkonzentration wird unter Verwendung der entsprechenden Kalibrierkurven von Morin berechnet, die bei pH = 1,2, 6,8 bzw. 7,4 erhalten wurden.
- Berechnen Sie die kumulative Freisetzung (CR) der Bioflavonoide anhand von Gleichung (6) in μg/ml und den kumulativen Freisetzungsprozentsatz (CRP) anhand von Gleichung (7):
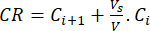 (6)
(6)
Dabei sind Ci und Ci+1 die Konzentrationen von Morin/Quercetin in der i. und (i+1)ten Probe (μg/ml); Vs das Probenvolumen, das dem Batch-Reaktor entnommen wurde (ml); V das Gesamtvolumen des simulierten Mediums (ml).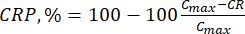 (7)
(7)
Dabei ist Cmax die maximale Konzentration der biologisch aktiven Verbindung im Träger (μg/ml).
7. Statistische Analysen
- Geben Sie die experimentellen Daten als Mittelwert ± Standardabweichungen (SD) von drei unabhängigen Messungen aus.
- Bestimmen Sie die statistische Signifikanz der Versuchsergebnisse, indem Sie den ANOVA-Test als Post-hoc-Test durchführen. Betrachten Sie einen Wert von p < 0,05 als statistisch signifikant.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Es wurde eine Anti-Lösungsmittel-Fällungstechnik zur Herstellung von Alkali-Lignin-Mikro-/Submikron-Partikeln durchgeführt. Eine wässrige Lösung aus verdünnter anorganischer Säure-Salpetersäure/organischer Säure-Zitronensäure wurde in eine wässrige Alkali-Lignin-Lösung dispergiert, die mit einem umweltfreundlichen Tensid/Ethanol angereichert war, was zu einer allmählichen Ausfällung des gelösten Biopolymers führte und nach der Beschallung schließlich eine Suspension aus kompakten Mikro-/Submikron-Partike...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Zu den wichtigsten kritischen Fragen moderner Synthesemethoden für das Design von Wirkstoffträgerformulierungen auf der Basis von Biopolymeren gehört die Verwendung gefährlicher organischer Reagenzien - flüchtiger und brennbarer Lösungsmittel wie Tetrahydrofuran, Aceton, Methanol und sogar DMSO in hohen Konzentrationen -, was ihre Anwendbarkeit in der Biomedizin, pharmazeutischen Industrie und Lebensmitteltechnologie aufgrund der Manifestation möglicher toxischer Wirkungen einschränkt20
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Studie wurde vom Bulgarischen Wissenschaftsfonds unter der Vertragsnummer KΠ-06 H59/3 und vom Wissenschaftlichen Projekt Nr. 07/2023 FVM der Universität Trakia unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| automatic-cell counter | EVE, NanoEnTek | ||
| Citric acid | Sigma | 251275 | ACS reagent, ≥99.5% |
| digital water bath | Memmert | ||
| Eppendorf tubes, 1.5-2 mL | |||
| Ethanol | Sigma | 34852-M | absolute, suitable for HPLC, ≥99.8% |
| Folin–Ciocalteu’s phenol reagent | Sigma | F9252 | |
| freeze dryer | Biobase | ||
| gallic acid | Sigma- | BCBW7577 | monohydrate |
| HCl | Sigma | 258148 | ACS reagent, 37% |
| HNO3 | Sigma | 438073 | ACS reagent, 70% |
| lignin, alkali | Sigma | 370959 | |
| morin | Sigma | PHL82601 | |
| NaCl | Sigma | S9888 | ACS reagent, ≥99.0% |
| Na2CO3 | Sigma | 223530 | powder, ≥99.5%, ACS reagent |
| NaOH | Sigma | 655104 | reagent grade, 97%, powder |
| orbital shaker | IKA | KS 130 basic | |
| pH-meter | Consort | ||
| phosphate-buffered saline (PBS) | Sigma | RNBH7571 | |
| Quercetin hydrate | Sigma | STBG3815V | |
| statistical software for Excel | Microsoft Corporation | XLSTAT Version 2022.4.5. | |
| Tween 80 | Sigma | P8074 | BioXtra, viscous liquid |
| ultracentrifuge | Hermle | Z 326 K | |
| Ultrapure water system | Adrona | INTEGRITY+ | |
| ultrasound homogenizer | Bandelin Sonopuls | HD 2070 | |
| UV/Vis spectrophotometer | Hach-Lange | DR 5000 |
Referenzen
- Yu, X., et al. Lignin nanoparticles with high phenolic content as efficient antioxidant and sun-blocker for food and cosmetics. ACS Sustainable Chem. Eng. 11 (10), 4082-4092 (2023).
- Boarino, A., Klok, H. -A. Opportunities and challenges for lignin valorization in food packaging, antimicrobial, and agricultural applications. Biomacromolecules. 24 (3), 1065-1077 (2023).
- Aadil, K., Barapatre, A., Jha, H. Synthesis and characterization of Acacia lignin-gelatin film for its possible application in food packaging. Bioresour. Bioprocess. 3 (27), 1-11 (2016).
- Sharma, S., et al. Valorization of lignin into nanoparticles and nanogel: characterization and application. Bioresour. Technol. Reports. 18, 101041(2022).
- Zadeh, E. M., O'Keefe, S. F., Kim, Y. -T. Utilization of lignin in biopolymeric packaging films. ACS Omega. 3 (7), 7388-7398 (2018).
- Beaucamp, A., et al. Lignin for energy applications - state of the art, life cycle, technoeconomic analysis and future trends (Critical Review). Green Chem. 24, 8193-8226 (2022).
- Antunes, F., et al. From sugarcane to skin: Lignin as a multifunctional ingredient for cosmetic application. Int J Biol Macromol. 234, 123592(2023).
- Garg, J., et al. Applications of lignin nanoparticles for cancer drug delivery: An update. Materials Letters. 311, 131573(2022).
- Anushikha, K. K. Lignin as a UV blocking, antioxidant, and antimicrobial agent for food packaging applications. Biomass Conv. Bioref. , 1-14 (2023).
- Freitas, F. M. C., et al. synthesis of lignin nano- and micro-particles: Physicochemical characterization, bioactive properties and cytotoxicity assessment. Int J Biol Macromol. 163, 1798-1809 (2020).
- Rismawati, R., Nurdin, I. A., Pradiptha, M. N., Maulidiyah, A., Mubarakati, N. J. Preparation and characterization of lignin nanoparticles from rice straw after biosynthesis using Lactobacillus bulgaricus. Journal of Physics: Conference Series. 9th International Seminar on New Paradigm and Innovation of Natural Sciences and its Application. 1524, 012070(2020).
- Worku, L. A., et al. Synthesis of lignin nanoparticles from Oxytenanthera abyssinica by nanoprecipitation method followed by ultrasonication for the nanocomposite application. Journal of King Saud University - Science. 35 (7), 102793(2023).
- Gala Morena, A., Tzanov, T. z Antibacterial lignin-based nanoparticles and their use in composite materials. Nanoscale Adv. 4, 4447-4469 (2022).
- Ivanova, D., Nikolova, G., Karamalakova, Y., Marutsova, V., Yaneva, Z. Water-soluble alkali lignin as a natural radical scavenger and anticancer alternative. Int J Mol Sci. 24 (16), 12705(2023).
- Ivanova, D., Toneva, M., Simeonov, E., Antov, G., Yaneva, Z. Newly synthesized lignin microparticles as bioinspired oral drug-delivery vehicles: Flavonoid-carrier potential and in vitro radical-scavenging activity. Pharmaceutics. 15 (4), 1067(2023).
- Yaneva, Z., et al. Antimicrobial potential of conjugated lignin/morin/chitosan combinations as a function of system complexity. Antibiotics. 11, 650(2022).
- Handral, H. K., Wyrobnik, T. A., Lam, A. T. -L. Emerging trends in biodegradable microcarriers for therapeutic applications. Polymers. 15 (6), 1487(2023).
- Figueiredo, P., Lintinen, K., Hirvonen, J. T., Kostiainen, M. A., Santos, H. A. Properties and chemical modifications of lignin: Towards lignin-based nanomaterials for biomedical applications. Prog. Mater. Sci. 93, 233-269 (2018).
- Tang, Q., et al. Lignin-based nanoparticles: a review on their preparations and applications. Polymers. 12 (11), Basel. 2471(2020).
- Zhao, W., Simmons, B., Singh, S., Ragauskas, A., Cheng, G. From lignin association to nano-/micro-particle preparation: extracting higher value of lignin. Green Chemistry. 18 (21), 5693-5700 (2016).
- Stewart, H., Golding, M., Matia-Merino, L., Archer, R., Davies, C. Manufacture of lignin microparticles by anti-solvent precipitation: Effect of preparation temperature and presence of sodium dodecyl sulfate. Food Res Int. 66, 93-99 (2014).
- Beisl, S., Friedl, A., Miltner, A. Lignin from micro- to nanosize: Applications. Int. J. Mol. Sci. 18, 2367(2017).
- Mishra, P. K., Ekielski, A. A simple method to synthesize lignin nanoparticles. Colloids Interfaces. 3, 52(2019).
- Qian, Y., Deng, Y., Qiu, X., Li, H., Yang, D. Formation of uniform colloidal spheres from lignin, a renewable resource recovered from pulping spent liquor. Green Chem. 16, 2156-2163 (2014).
- Tardy, B. L., et al. Lignin nano- and microparticles as template for nanostructured materials: formation of hollow metal-phenolic capsules. Green Chem. 20, 1335-1344 (2018).
- Silva, M., et al. Paraquat-loaded alginate/chitosan nanoparticles: preparation, characterization and soil sorption studies. J Haz Mat. 190 (1-3), 366-374 (2011).
- Georgieva, N., Yaneva, Z. Comparative evaluation of natural and acid-modified layered mineral materials as rimifon-carriers using UV/VIS, FTIR, and equilibrium sorption study. Cogent Chem. 1 (1), 1-16 (2015).
- Zhang, P., Chen, D., Li, L., Sun, K. Charge reversal nano-systems for tumor therapy. J Nanobiotechnol. 20, 31(2022).
- Yaneva, Z. L., Georgieva, N. V. Removal of diazo dye from the aqueous phase by biosorption onto ball-milled maize cob (BMMC) biomass of Zea mays. Maced. J. Chem. Chem. Eng. 32 (1), 133-149 (2013).
- Zatorska, M., et al. Drug-loading capacity of polylactide-based micro- and nanoparticles - Experimental and molecular modeling study. Int J Pharmaceutics. 591, 120031(2020).
- Yaneva, Z., Georgieva, N. Chapter 5 - Physicochemical and morphological characterization of pharmaceutical nanocarriers and mathematical modeling of drug encapsulation/release mass transfer processes. Nanoscale Fabrication, Optimization, Scale-Up and Biological Aspects of Pharmaceutical Nanotechnology. Grumezescu, A. M. , William Andrew Publishing. 173-218 (2018).
- Yaneva, Z., Georgieva, N., Staleva, M. Development of d,l-α-tocopherol acetate/zeolite carrier system: equilibrium study. Monatshefte fur Chemie Chemical Monthly. 147 (7), 1167-1175 (2016).
- Yaneva, Z., Georgieva, N. Study on the physical chemistry, equilibrium, and kinetic mechanism of Azure A biosorption by Zea mays biomass. Journal of Dispersion Science and Technology. 35 (2), 193-204 (2014).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten