Ein Mausmodell der Hyperlipidämie-induzierten Herzinsuffizienz mit erhaltener Ejektionsfraktion
In diesem Artikel
Zusammenfassung
Dieses Protokoll stellt einen detaillierten Ansatz zur Replikation eines Mausmodells der Hyperlipidämie-induzierten Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF) vor. Das Design kombiniert die Verabreichung des Adeno-assoziierten Virus 9-kardialen Troponin-T-Low-Density-Lipoprotein-Rezeptors (AAV9-cTnT-LDLR) und Poloxamer-407 (P-407).
Zusammenfassung
Die Pathophysiologie der Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF), die durch Lipotoxizität angetrieben wird, ist unvollständig verstanden. Angesichts des dringenden Bedarfs an Tiermodellen, die kardiometabolische HFpEF genau nachahmen, wurde ein Hyperlipidämie-induziertes Mausmodell durch Reverse Engineering von Phänotypen entwickelt, die bei HFpEF-Patienten beobachtet wurden. Ziel dieses Modells war es, HFpEF zu untersuchen, wobei der Schwerpunkt auf dem Zusammenspiel zwischen Lipotoxizität und metabolischem Syndrom lag. Hyperlipidämie wurde bei Wildtyp-Mäusen (WT) auf einem 129J-Stammhintergrund durch zweiwöchentliche intraperitoneale Injektionen von Poloxamer-407 (P-407), einem Blockcopolymer, das die Lipoproteinlipase blockiert, in Kombination mit einer einzigen intravenösen Injektion des Adeno-assoziierten Virus 9-kardialen Troponin-T-Low-Density-Lipoproteinrezeptors (AAV9-cTnT-LDLR) induziert. Zwischen 4 und 8 Wochen nach der Behandlung wurden umfangreiche Untersuchungen durchgeführt, darunter Echokardiographie, Blutdruckmessung, Ganzkörperplethysmographie, Echokardiographie (EKG)-Telemetrie, Aktivitätsradüberwachung (AWM) sowie biochemische und histologische Analysen. Die LDLR/P-407-Mäuse zeigten nach vier Wochen charakteristische Merkmale, darunter diastolische Dysfunktion, erhaltene Ejektionsfraktion und erhöhte linksventrikuläre Wanddicke. Bemerkenswert ist, dass der Blutdruck und die Nierenfunktion im normalen Bereich blieben. Darüber hinaus zeigten EKG und AWM Herzblockaden bzw. verminderte Aktivität. Die diastolische Funktion verschlechterte sich nach acht Wochen, begleitet von einem signifikanten Rückgang der Atemfrequenzen. Weitere Untersuchungen des Doppelbehandlungsmodells zeigten erhöhte Fibrose-, feuchte/trockene Lungenverhältnisse und Herzgewichts-/Körpergewichtsverhältnisse. Die LDLR/P-407-Mäuse zeigten Xanthelasmen, Aszites und kardiale Ischämie. Interessanterweise traten plötzliche Todesfälle zwischen 6 und 12 Wochen nach der Behandlung auf. Das murine HFpEF-Modell bietet eine wertvolle und vielversprechende experimentelle Ressource zur Aufklärung der Feinheiten des metabolischen Syndroms, das zur diastolischen Dysfunktion im Kontext der Lipotoxizitäts-vermittelten HFpEF beiträgt.
Einleitung
Die Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF) bezeichnet ein kardiometabolisches Syndrom, das mit multiplen Komorbiditäten einhergeht und macht über 50% aller Fälle von Herzinsuffizienzaus 1,2. Darüber hinaus ist die Häufigkeit von HFpEF in den letzten zehn Jahren stetig gestiegen3. Mit begrenzten Behandlungsmöglichkeiten stellt die HFpEF aufgrund ihrer facettenreichen Pathophysiologie den bedeutendsten ungedeckten medizinischen Bedarf bei Herz-Kreislauf-Erkrankungendar 4. Daher besteht ein dringender Bedarf, die zugrunde liegenden Mechanismen und die Pathophysiologie der HFpEF besser zu verstehen, um wirksame Therapien zu entwickeln.
Trotz erheblicher Fortschritte in den letzten Jahren ist die Pathophysiologie der HFpEF, die auf Lipotoxizität zurückzuführen ist, nach wie vor unvollständig verstanden. Es wurde festgestellt, dass Patienten mit HFpEF im Vergleich zu Patienten mit Herzinsuffizienz mit reduzierter Ejektionsfraktion (HFrEF) und gesunden Kontrollen eine bemerkenswerte myokardiale Lipidakkumulation aufweisen5. RNA-Sequenzierungsdaten aus Herzbiopsien zeigten eine Herunterregulierung des Lipoproteinlipase-Gens (LPL) in der HFpEF-Gruppe im Vergleich zu gesunden und HFrEF-Patienten6. Poloxamer-407 (P-407) ist ein Blockcopolymer, das Hyperlipidämie induziert, indem es LPL blockiert und anschließend die Plasmatriglyceride und das LDL-Cholesterin (Low-Density-Lipoprotein)erhöht 7. Frühere Studien zeigten eine hohe LDL-Rezeptor (LDLR)-Expression in den Herzen von HFpEF-Mäusen8.
Aufbauend auf diesen Erkenntnissen und in Anerkennung des dringenden Bedarfs an Tiermodellen, die die kardiometabolische HFpEF genau nachahmen, wurde ein Hyperlipidämie-induziertes Mausmodell entwickelt und vorgestellt. Dieses Modell wurde auf die Erforschung von HFpEF zugeschnitten und konzentrierte sich explizit auf die Beteiligung von Lipotoxizität neben dem metabolischen Syndrom. Induziert durch Hyperlipidämie/LPL-Blockade und erhöhte kardiale LDLR-Expression wurde dieses Modell bei WT-129-Mäusen auf 129J-Hintergrund durch zweiwöchentliche intraperitoneale (i.p.) Injektionen von P-407 in Kombination mit einer einzigen intravenösen (i.v.) Injektion des Adeno-assoziierten Virus 9-kardiales Troponin T-LDLR (AAV9-cTnT-LDLR)9 etabliert.
Zwischen 4 und 8 Wochen nach der Behandlung wurde eine umfangreiche Palette von Untersuchungen durchgeführt, die Echokardiographie, Blutdruckmessungen, Ganzkörperplethysmographie (WBP), kontinuierliche Elektrokardiographie (EKG)-Telemetrie, Aktivitätsradüberwachung (AWM) sowie biochemische und histologische Analysenumfassten 9. Nach vier Wochen zeigten die LDLR/P407- oder "Doppelbehandlungs"-Mäuse deutliche HFpEF-Merkmale, einschließlich diastolischer Dysfunktion, erhaltener Ejektionsfraktion und erhöhter linksventrikulärer Wandstärke9. Darüber hinaus zeigten EKG-Telemetrie und AWM Herzblockaden bzw. verminderte Aktivität. Bemerkenswert ist, dass der Blutdruck und die Nierenfunktion normal blieben9. Nach acht Wochen verschlechterte sich die diastolische Funktion, und WBP-Messungen zeigten reduzierte Atemfrequenzen9.
Eine weitere Untersuchung des Doppelbehandlungsmodells ergab Fibrose, ein erhöhtes Verhältnis von nasser/trockener Lunge und ein Verhältnis von Herzgewicht zu Körpergewicht9. Die Autopsie ergab Aszites, kardiale Ischämie und Xanthelasmen. Interessanterweise wurden plötzliche Todesfälle zwischen 6 und 12 Wochen nach der Behandlung dokumentiert9. Dieses murine Hyperlipidämie-getriebene HFpEF-Modell bietet ein schnelles, wertvolles und vielversprechendes experimentelles Werkzeug, um die Komplexität des metabolischen Syndroms zu entschlüsseln, das zur diastolischen Dysfunktion mit Lipotoxizitäts-vermittelter HFpEF beiträgt.
Protokoll
Das Tierprotokoll wurde vom Institutional Animal Care and Use Committee (IACUC) an der Universität von Miami genehmigt und entspricht den Richtlinien des National Institute of Health (NIH) (IACUC-Protokoll 23-103-AD03). Für die vorliegende Studie wurden Wildtyp-Mäuse (WT) mit 129J-Hintergrund aus einer kommerziellen Quelle erworben (siehe Materialtabelle) und intern gezüchtet. Alle Mäuse waren Wurfgeschwister auf 129J Hintergrund. Die Experimente umfassten sowohl männliche als auch weibliche Mäuse. Die LDLR/P-407 HFpEF-Maus wurde durch Verabreichung einer Einzeldosis AAV9-cTnT-LDLR in der ersten Woche und zweiwöchentlicher p407 über einen Zeitraum von vier Wochen etabliert.
1. AAV9-cTnT-LDLR Zubereitung und Verabreichung
HINWEIS: Das AAV9-cTNT-hLDLR-Plasmid (siehe Materialtabelle) kodiert für das vollständige humane LDLR-Protein (2664bp) (Abbildung 1).
- Vorbereitung des AAV-LDLR-Virusvektors
- Basierend auf der Anzahl der Tiere werden die AAV9-Vorratsfläschchen 20 Minuten lang auf Eis aufgetaut und dann die AAV-Partikel in Dulbeccos phosphatgepufferter Kochsalzlösung (DPBS) verdünnt, um eine Konzentration von 1 x 1012 Vektorgenomen/Maus in 100 μl zu erhalten.
- Geben Sie die Viruslösung in eine 28-30 G-Nadel auf einer 1-ml-Spritze. Achte darauf, dass du keine Luftblasen in die Nadel ziehst.
- Intravenöse (i.v.) Injektionsverfahren für die Schwanzvene
- Schalten Sie den Sauerstoff auf bis zu 0,5 l/min ein und stellen Sie das Isofluran-Anästhesiesystem auf 4%-5% ein. Legen Sie die Maus für ~2 Minuten in die Induktionskammer, bis das Tier nicht mehr ansprechbar ist.
- Setzen Sie das Tier auf einen Mausschwanz-Illuminator (z. B. Braintree Scientific, Inc. (Braintree, MA)) und legen Sie das Tier auf die Seite. Verwenden Sie zur Aufrechterhaltung eine Isofluran-Anästhesie von 2%-3%.
HINWEIS: Die Erwärmung durch das Rückhaltegerät führt zu einer Erweiterung der Schwanzvene der Maus und erleichtert somit die Injektion erheblich. - Identifiziere die seitliche Schwanzvene. Reinigen Sie den Injektionsbereich mit einem Antiseptikum mit einem Mullkissen.
- Halten Sie das Ende des Schwanzes fest, um ihn zu verlängern, und massieren Sie den Mausschwanz mit den Fingern, bis die Vene sichtbar ist. Führen Sie die Nadel in einem niedrigen Winkel (10-15 Grad Winkel) ein und injizieren Sie 100 μl verdünntes AAV in die Schwanzvene (Abbildung 2A).
- Ziehen Sie die Nadel zurück und üben Sie sofort mit einem Finger Druck aus, bis die Blutung aufhört. Setzen Sie die Maus wieder in den ursprünglichen Käfig ein.
2. Vorbereitung und Verabreichung von P-407
- Vorbereitung P-407
- Die Lösung wird hergestellt, indem das Mittel P-407 (siehe Materialtabelle) mit DPBS in einem Abzug auf eine Endkonzentration von 100 mg/ml verdünnt wird. Die Lösung wird über Nacht auf einem Rotator bei 4 °C gekühlt, um das Auflösen des P-40710 zu erleichtern.
- Zweiwöchentliches intraperitoneales (i.p.) Injektionsverfahren
- Wiegen Sie jede Maus am ersten Tag der i.p. Injektionen. Berechnen Sie mit der Formel 1 g/kg die geeignete Dosis für jede Maus anhand des Gewichts und der Vorfüllspritzen.
- Unter einem Abzug halten Sie die Maus manuell mit nach unten geneigtem Kopf und Körper fest, um die inneren Organe kranial neu zu positionieren. Diese Technik vermeidet die Punktion lebenswichtiger Strukturen in der Nähe.
- Identifizieren Sie die linke Peritonealhöhle im unteren Quadranten des Abdomens, lateral der Mittellinie. Reinigen Sie die Stelle mit einem Antiseptikum.
- Führen Sie die Nadel in einem Winkel von 45 Grad oder weniger in die Bauchhöhle ein (Abbildung 2B). Aspirieren Sie die Spritze, um eine ausreichende Insertion zu gewährleisten.
- Wenn bei der Aspiration Blut oder Gewebe vorhanden ist, ziehen Sie die Nadel zurück und wiederholen Sie die Schritte 2.2.2 bis 2.2.4, bis die Spritze klar ist. Entsorgen Sie die Nadel in den entsprechenden Behälter für scharfe Gegenstände und setzen Sie die Maus wieder in den ursprünglichen Käfig ein.
3. Beurteilung der Echokardiographie
- Präparat
- Tragen Sie am Tag vor der Bildgebung oder einige Stunden vor der Bildgebung Enthaarungscreme auf die Brust und den Oberbauch der Maus auf. Entfernen Sie die Creme mit feuchter Gaze nach 2 min.
- Betäuben Sie die Maus mit 2,5%-3,0% Isofluran bei einer Flussrate von 0,8 l/min und halten Sie sie mit 1%-1,5% Isofluran aufrecht. Befestigen Sie dann die Maus in Rückenlage mit den Pfoten auf Elektrodenpads mit leitfähigem Gel auf der entsprechenden Plattform und bedecken Sie Nase und Mund mit einem Nasenkonus, um eine kontinuierliche Anästhesie mit Isofluran zu gewährleisten.
- Parasternale Längsachsenansicht
- Wenn die Maus in Rückenlage positioniert ist, neigen Sie die rechte Seite der Plattform um 45 Grad.
- Richten Sie als Nächstes die Wandlersonde diagonal im Schienensystem aus und schwenken Sie sie im Uhrzeigersinn um 30 bis 40 Grad von der rechten oberen Extremität zum linken Bauch, um Bilder im B-Modus zu erhalten und zu speichern.
- Analysieren Sie die B-Modus-Bilder mit einer Ultraschallanalysesoftware (siehe Materialtabelle), um die Ejektionsfraktion zu erhalten (Abbildung 3A).
- Parasternale Kurzachsenansicht
- Drehen Sie die Wandlersonde im Schienensystem um 90 Grad im Uhrzeigersinn, um Bilder im B- und M-Modus zu erhalten und zu speichern.
- Apikale Ansicht
- Kippen Sie die linke obere Ecke der Plattform nach unten und nach rechts. Richten Sie den Schallkopf auf die rechte Schulter des Tieres aus.
- Visualisieren Sie die Mitralklappe im B-Modus und im Farbdoppler-Modus. Erfassen und Speichern von gepulsten Wellendoppler- (PW) und Gewebedopplerbildern5.
- Analysieren Sie die PW-Doppler- und Gewebe-Doppler-Bilder mit der Ultraschallanalysesoftware, um IVRT, E/E' und E/A zu erhalten (Abbildung 3B-E).
4. Aufzeichnung der Druck-Volumen-Schleife (PV)
- Führen Sie am Ende der Studie hämodynamische Analysen durch, um die systolische und diastolische Funktion des linken Ventrikels (LV) nach dem zuvor beschriebenen Verfahrenzu beurteilen 11,12.
- Beginnen Sie damit, die Maus mit Isofluran (3-5%, Induktionskammer) zu induzieren.
- Wenn die Anästhesiewirkung einsetzt, bringen Sie das Tier auf den Operationstisch und halten Sie die Anästhesie mit Isofluran (1-3%, Gesichtsmaske) aufrecht.
- Machen Sie einen kleinen Schnitt in der Haut über dem Hals, um eine endotracheale Intubation (durch den Mund) zu ermöglichen.
- Beatmung des Tieres mit einer Mischung aus Sauerstoff und Isofluran unter Verwendung eines Nagetierbeatmungsgeräts (z. B. Micro Vent Modell 848, Harvard-Gerät), das auf ein Volumen von ~0,15-0,2 ml und eine Atemfrequenz von 120-170 Atemzügen/min eingestellt ist.
- Überwachen Sie die Körpertemperatur während des gesamten Eingriffs auf einem temperaturgesteuerten Operationstisch bei ~37 °C ± 1 °C.
- Die linke Vena jugularis interna wird mit einer 30-G-Nadel freigelegt und kanüliert, um die Flüssigkeit unterstützend zu verabreichen.
- Schneiden Sie die Haut an der Stelle des Ventralhals medianus und legen Sie die Halsschlagader frei. Nach dem Verschluss des distalen Teils der rechten Halsschlagader ist ein kleiner Schnitt in der Arterie vorzunehmen, um das Einführen eines Mikro-Druckvolumenkatheters (PV) (siehe Materialtabelle) in den linken Ventrikel zu ermöglichen (geschlossener Thoraxzugang).
- Zeichnen Sie PV-Schleifen während des stationären Zustands und des Verschlusses der Vena cava inferior auf.
- Am Ende des Versuchs wird das Tier auf humane Weise (unter tiefer Betäubung) mit einer zugelassenen AVMA-Methode (z. B. Isofluran, gefolgt von einer Gebärmutterhalsluxation) eingeschläfert.
- Analysieren Sie die PV-Daten mit der LabChart-Software (siehe Materialtabelle) und kalibrieren Sie die Volumina mit echokardiographischen Messungen.
Repräsentative Ergebnisse
Nach 4 Wochen kombinierter Einzeldosis i.v. AAV9-cTnT-LDLR und zweiwöchentlicher i.p. P-407-Injektionen ergab die Echokardiographie eine HFpEF, was sich in der erhaltenen Ejektionsfraktion, der verlängerten intraventrikulären Relaxationszeit (IVRT) und E/E' sowie der verminderten E/A zeigt (Abbildung 3A-E). Eine schlimmere diastolische Dysfunktion wurde nach 8 Wochen im Vergleich zu den Daten nach 4 Wochen beobachtet. Die Analyse der Druck-Volumen-Schleife (PV) nach 8-wöchiger Behandlung zeigte eine erhöhte Steigung der enddiastolischen Druck-Volumen-Beziehung, was die echokardiographischen Befunde einer diastolischen Dysfunktion bestätigt (Abbildung 3F). Bemerkenswert ist, dass bei einer signifikanten Anzahl von Mäusen, die mit LDLR/P-407 behandelt wurden, zwischen 6 und 12 Wochen nach der Behandlung mit LDLR/P-407 ein plötzlicher Tod auftrat (Abbildung 3G). Diese Ergebnisse deuten auf eine kardiometabolische HFpEF hin, die die Wirksamkeit dieses Protokolls und des Versuchsdesigns bestätigt. Bei Mäusen, die nach 4 und 8 Wochen mit LDLR/P407 behandelt wurden, wurde Hyperlipidämie festgestellt, was sich in erhöhten Gesamtcholesterinwerten, Triglyceriden, VLDL-Cholesterin (Very Low-Density-Lipoprotein), LDL-Cholesterin (Low-Density-Lipoprotein) und normalen Cholesterinwerten bei High-Density-Lipoproteinen zeigte, was unsere Befunde einer Hyperlipidämie bestätigt (Abbildung 3H).
Abbildung 1: Plasmidkarte für AAV9-cTnT-LDLR. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
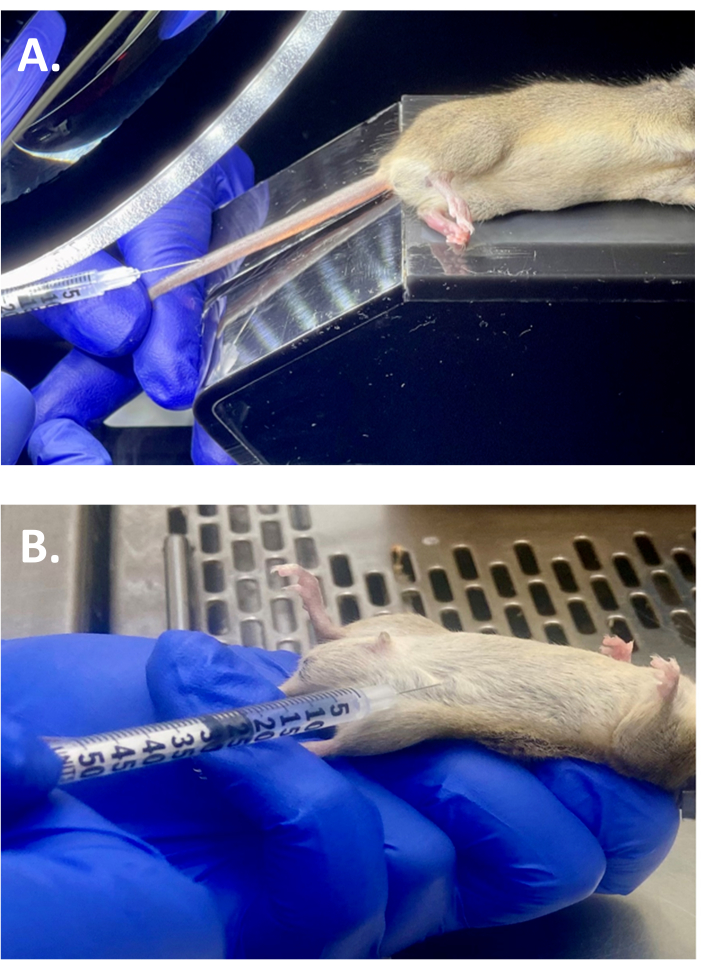
Abbildung 2: Injektionsverfahren. (A) Repräsentatives Bild, das die intravenöse (i.v.) Schwanzveneninjektion von AAV9-cTnT-LDLR bei WT-Mäusen auf dem Hintergrund des 129J-Stammes zeigt. (B) Illustration der intraperitonealen Injektion von P-407 in WT-Maus auf 129J-Stammhintergrund, der zuvor mit einer i.v. Einzeldosis von AAV9-cTnT-LDLR behandelt wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
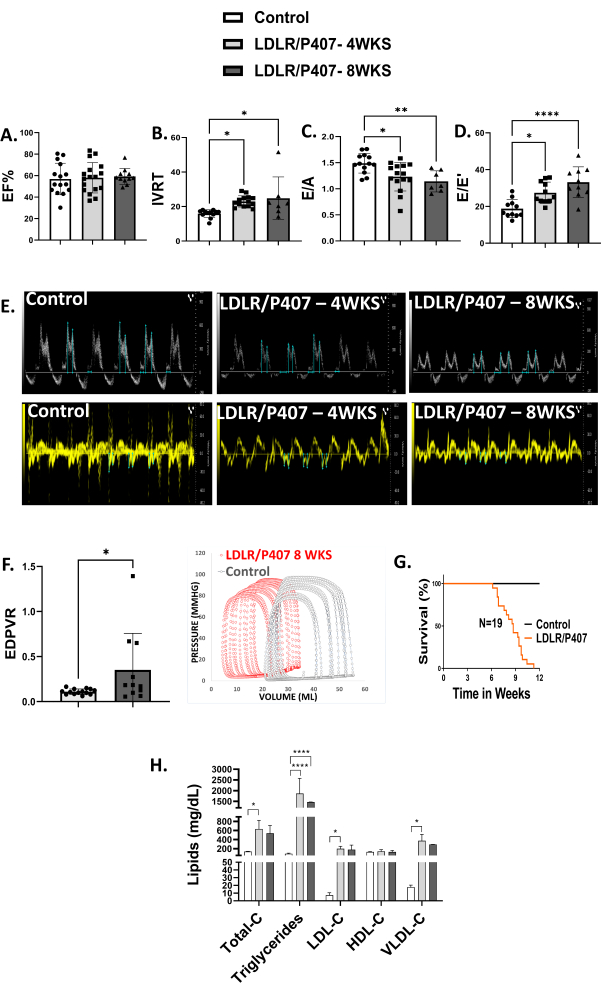
Abbildung 3: Kardiometabolische HFpEF. (A-E) Echokardiographie-Parameter, die eine Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF) nach 4 (n = 17) und 8 Wochen (n = 11) LDLR/P-407-Behandlung im Vergleich zu unbehandelten Mäusen (n = 15) anzeigen. Dies wird durch eine erhaltene Ejektionsfraktion, eine verlängerte isovolumische Relaxationszeit (IVRT), erhöhte E/E' und reduzierte E/A belegt, alles Indikatoren für diastolische Dysfunktion. (F) Die Erfassung und Analyse der Druck-Volumen-Schleife ergab eine erhöhte Steigung der enddiastolischen Druck-Volumen-Beziehung (EDPVR) nach 8-wöchiger Behandlung. (G) Der plötzliche Tod trat zwischen 6 und 12 Wochen nach der Behandlung mit LDLR/P-407 auf. (H) Ein Lipid-Panel bestätigte die Befunde einer Hyperlipidämie bei Mäusen, die nach 4 (n = 4) und 8 Wochen (n = 3) mit LDLR/P407 behandelt wurden, was sich in erhöhten Gesamtcholesterinwerten, Triglyceriden, VLDL-Cholesterin (Very Low-Density-Lipoprotein), LDL-Cholesterin (Low-Density-Lipoprotein) und normalen Cholesterinwerten bei High-Density-Lipoproteinen im Vergleich zu unbehandelten Mäusen (n = 5) zeigte. Die Daten werden als Mittelwert ± SD dargestellt. *P < 0,05, **P < 0,01, ***P < 0,001, ****P < 0,0001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Trotz des stetigen Anstiegs der Prävalenz von HFpEF in den letzten zehn Jahren ist ein konkretes Verständnis der zugrundeliegenden Pathophysiologie nach wie vor schwer fassbar13. Darüber hinaus gibt es bis heute nur eine begrenzte evidenzbasierte Therapie13. Ein besseres Verständnis der Mechanismen, die an der kardiometabolischen HFpEF beteiligt sind, ist notwendig. Zuvor wurde ein hyperlipidämisches Mausmodell eingeführt, das HFpEF weder mit chronischer Nierenerkrankung (CKD) noch mit Bluthochdruck imitiert, der durch kardiale LDLR-OE- und p407-Injektionen induziert wird9.
Die Ergebnisse zeigten, dass die Kombination von kardialer LDLR-OE und Hyperlipidämie nach vier Wochen zu diastolischer Dysfunktion, Herzrhythmusstörungen, linksventrikulärer (LV) Hypertrophie, Belastungsintoleranz, kardialer Lipidakkumulation und Fibrose bei Mäusen führt, wie zuvor veröffentlicht9. Bei diesen Mäusen wurde auch eine Erhöhung der LDL-Cholesterinaufnahme in den Herzen, der Leber und der Skelettmuskulatur sowie eine Verringerung der Triglyceride in Herz und Leber beobachtet9. Der Vorteil dieser Methode liegt in ihrer Schnelligkeit bei der Untersuchung der Signalwege des kardiometabolischen Syndroms, die im Vergleich zu anderen hyperlipidämischen HFpEF-Mausmodellen, wie z. B. der fettreichen Diät (HFD), die bis zu 16 und 20 Wochen benötigen, um14 zu entwickeln, nicht gut verstanden sind. Die Entwicklung dieses Modells dauert vier Wochen und ahmt metabolische Anomalien beim Menschen nach. Daher ist die Reproduzierbarkeit dieses Modells essentiell.
Es ist zwingend erforderlich, die gründliche Vorbereitung und Verabreichung von AAV9-cTnT-LDLR und P-407 sicherzustellen. Die Replizierbarkeit dieses Modells hängt stark von genauen Berechnungen der P-407- und AAV9-cTnT-LDLR-Konzentrationen und -Dosen sowie von Gewichtsmessungen ab. Ebenso wichtig sind Lösungsvorbereitungen und geeignete intravenöse und intraperitoneale Injektionstechniken. Abweichungen in diesen Techniken können zu erheblichen Veränderungen und unerwünschten Ergebnissen führen.
Trotz der Effektivität und Effizienz dieses Modells gibt es mehrere Einschränkungen. Für die Durchführung von intravenösen und intraperitonealen Injektionen ist eine strenge Schulung erforderlich. Darüber hinaus besteht ein potenzielles Morbiditäts- und Mortalitätsrisiko im Zusammenhang mit intravenösen und häufigen intraperitonealen Injektionen. Bei intravenösen Injektionen können Verletzungen des Mausschwanzes auftreten, während bei intraperitonealen Injektionen eine Zäkalpunktion auftreten kann, die zu einer Peritonitis führt15. Diese Verletzungen sind in der Regel auf falsche Techniken zurückzuführen und können zum Verlust von Versuchspersonen und Behandlungen führen. Daher ist vor der Durchführung dieser Verfahren eine umfangreiche Schulung erforderlich. Eine weitere Einschränkung ist die Fokussierung dieses Modells auf den Stamm 129J. Die Begründung für die Wahl des 129J-Stammes stammt aus Vorstudien, die bei diesem Stamm im Vergleich zu den C57BL/6-Mäusen, die wir ursprünglich in unveröffentlichten Untersuchungen untersucht hatten, zu schnelleren diastolischen Dysfunktionen und HFpEF-Ergebnissen führten.
Unabhängig von diesen Einschränkungen wird dieses Modell eine schnellere Untersuchung der zugrunde liegenden Mechanismen der HFpEF und potenziell wirksamer Behandlungsoptionen ermöglichen. Frühere Studien haben zur Entwicklung eines pathophysiologischen Modells für kardiometabolische HFpEF-induzierte HFD und N[w]-Nitro-L-Argininmethylester (L-NAME) über 5-15 Wochen geführt13. Aufgrund des stetigen Anstiegs der Prävalenz von HFpEF besteht jedoch ein dringender Bedarf an weiterem Verständnis der Pathophysiologie der kardiometabolischen HFpEF und der Entwicklung einer wirksamen Therapie. Dieses Mausmodell der kardialen LDLR-OE und p407-induzierten Hyperlipidämie ist eine schnelle und praktikable Methode zur Induktion von kardiometabolischer HFpEF für zukünftige Forschungsvorhaben.
Offenlegungen
JH ist als Miterfinder bei Patenten auf GHRH-Analoga aufgeführt, die der University of Miami und dem Veterans Affairs Department zugewiesen wurden. JH besaß zuvor Anteile an Biscayne Pharmaceuticals, dem Lizenznehmer des in dieser Studie verwendeten geistigen Eigentums. Biscayne Pharmaceuticals hat diese Studie nicht finanziert. JH berichtete, dass er ein Patent für eine auf Herzzellen basierende Therapie besitzt. Er hält Anteile an Vestion Inc. und unterhält eine professionelle Beziehung zu Vestion Inc. als Berater und Mitglied des Board of Directors und des Scientific Advisory Board. JH ist Chief Scientific Officer, Honorarberater und Beiratsmitglied von Longeveron und hält Anteile an Longeveron. JH ist auch Miterfinder von geistigem Eigentum, das an Longeveron lizenziert ist. Longeveron LLC und Vestion Inc. beteiligten sich nicht an der Finanzierung dieser Arbeit. Die Beziehungen von JH werden der University of Miami offengelegt, und es gibt einen Managementplan.
Danksagungen
Wir danken dem Penncore and NHLBI Gene Therapy Resource Program (GTRP) für die Finanzierung der Generierung des Adeno-assoziierten Virus, das in diesem Projekt verwendet wird. Diese Forschung wurde durch Zuschüsse des National Institute of Health (NIH) (1R01HL140468) und des Miami Heart Research Institute an LS finanziert. MW wurde von 2020 bis 2022 mit dem NIH Diversity Supplement Award ausgezeichnet (R01HL140468- 03S1). JH wird finanziert durch 1R01 HL13735, 1R01 HL107110, 5UM1 HL113460, 1R01 HL134558, 5R01 CA136387 (vom NIH), W81XWH-19-PRMRPCTA (vom Verteidigungsministerium) und die Starr, Lipson und Soffer Family Foundations.
Materialien
| Name | Company | Catalog Number | Comments |
| Adeno-associated virus 9-cardiac troponin T-LDLR (AAV9-cTnT-LDLR) | U. Penn Vector Core, funded by the NHLBI Gene Therapy Program (GTRP) | Transgene plasmids and AAVs particles were generated by the U. Penn Vector Core, funded by the NHLBI Gene Therapy Program (GTRP). AAV were provided in Dulbecco’s phosphate-buffered saline (PBS) with 0.001% Pluronic F68. The Core determined AAV titers by digital droplet polymerase chain reaction (ddPCR) and assessed all preparations for capsid protein ratio by SDS-PAGE and for the presence of endotoxin. Constructs include the human (h) transcripts tagged by 3X HA, Penn Vector Core (RRID: SCR_022432). AAV9-cTNT-hLDLR plasmid encodes the full human LDLR protein (2664bp). | |
| Imaging systems with a high frequency transducer probe MS400 | (VisualSonics, Toronto, ON, Canada) | Vevo 2100 or 3100 | |
| Isoflurane | Akorn Animal Health, Inc. | NDC: 59399-106-01 | |
| LabChart software | ADInstruments | Pro version 8.1.5 | |
| Poloxamer 407 | Sigma-Aldrich | 16758 | |
| PV catheter | Millar Instrument | PVR 1035 | |
| Ultrasound analysis software | Vevo Lab | ||
| Wild-type (WT) mice on 129J background | Jackson Laboratory |
Referenzen
- Roger, V. L. Epidemiology of heart failure: A contemporary perspective. Circ Res. 128 (10), 1421-1434 (2021).
- Kosiborod, M. N., et al. Design and baseline characteristics of step-HFpEF program evaluating semaglutide in patients with obesity hfpef phenotype. JACC Heart Fail. 11 (8), 1000-1010 (2023).
- Borlaug, B. A. Evaluation and management of heart failure with preserved ejection fraction. Nat Rev Cardiol. 17 (9), 559-573 (2020).
- Badrov, M. B., Mak, S., Floras, J. S. Cardiovascular autonomic disturbances in heart failure with preserved ejection fraction. Can J Cardiol. 37 (4), 609-620 (2021).
- Wu, C. K., et al. Myocardial adipose deposition and the development of heart failure with preserved ejection fraction. Eur J Heart Fail. 22 (3), 445-454 (2020).
- Hahn, V. S., et al. Myocardial gene expression signatures in human heart failure with preserved ejection fraction. Circulation. 143 (2), 120-134 (2021).
- Korolenko, T. A., et al. Early-stage atherosclerosis in poloxamer 407-induced hyperlipidemic mice: Pathological features and changes in the lipid composition of serum lipoprotein fractions and subfractions. Lipids Health Dis. 15, 16 (2016).
- Patel, M., et al. Osteopontin and ldlr are upregulated in hearts of sudden cardiac death victims with heart failure with preserved ejection fraction and diabetes mellitus. Front Cardiovasc Med. 7, 610282 (2020).
- Williams, M., et al. Mouse model of heart failure with preserved ejection fraction driven by hyperlipidemia and enhanced cardiac low-density lipoprotein receptor expression. J Am Heart Assoc. 11 (17), e027216 (2022).
- Colly, A., Marquette, C., Courtial, E. J. Poloxamer/poly(ethylene glycol) self-healing hydrogel for high-precision freeform reversible embedding of suspended hydrogel. Langmuir. 37 (14), 4154-4162 (2021).
- Kanashiro-Takeuchi, R. M., et al. Efficacy of a growth hormone-releasing hormone agonist in a murine model of cardiometabolic heart failure with preserved ejection fraction. Am J Physiol Heart Circ Physiol. 324 (6), H739-H750 (2023).
- Dulce, R. A., et al. Synthetic growth hormone-releasing hormone agonist ameliorates the myocardial pathophysiology characteristic of heart failure with preserved ejection fraction. Cardiovasc Res. 118 (18), 3586-3601 (2023).
- Borlaug, B. A., et al. Obesity and heart failure with preserved ejection fraction: New insights and pathophysiological targets. Cardiovasc Res. 118 (18), 3434-3450 (2023).
- Noll, N. A., Lal, H., Merryman, W. D. Mouse models of heart failure with preserved or reduced ejection fraction. Am J Pathol. 190 (8), 1596-1608 (2020).
- Guarnieri, M. Considering the risks and safety of intraperitoneal injections. Lab Anim (NY). 45 (4), 131 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten