Method Article
Eine modifizierte Methode zur intrathekalen Katheterisierung bei Ratten
In diesem Artikel
Zusammenfassung
In dieser Arbeit stellen wir eine modifizierte Methode zur intrathekalen Katheterisierung bei Ratten vor, die einen einfachen, bequemen und zuverlässigen Ansatz für die wiederholte intrathekale Verabreichung von Arzneimitteln darstellt.
Zusammenfassung
Die intrathekale Katheterisierung wurde in Tierversuchen häufig angewendet, insbesondere bei neuropathischen Schmerzen. Die traditionellen Methoden haben jedoch immer noch einige Einschränkungen. Obwohl einige Forscher versucht haben, die traditionellen Methoden zu verbessern, müssen die verfügbaren Methoden noch modifiziert werden. In dieser Arbeit stellen wir eine modifizierte Methode zur intrathekalen Katheterisierung bei Ratten vor.
Bei dieser Methode werden ein 20 cm langer Edelstahldraht (0,2 mm Durchmesser), ein 15 cm langer Kunststoffschlauch aus PE10, eine selbstgemachte Verschlusskappe und ein 0,3 cm × 0,5 cm antiallergisches Band verwendet. Unser modifiziertes Verfahren zur intrathekalen Katheterisierung hat mehrere Vorteile. Erstens erhöht das Einbringen eines Edelstahldrahtes in den PE10-Schlauch die Elastizität des Schlauchs, verbessert die Erfolgsrate der intrathekalen Katheterisierung, reduziert den Platzbedarf für die Operation und minimiert die Schädigung des Gewebes um die Lendenwirbelsäule. Zweitens wird die Länge des PE10-Schlauchs vor der Operation bestimmt, und die Verweilzeit des Katheters kann länger als eine Woche betragen. Drittens wird der PE10-Schlauch durch eine 4-fache Figur-8-Naht fixiert, die eine Bewegung und ein Zurückziehen des Schlauchs verhindert, wenn sich das Tier bewegt. Viertens wird eine selbstgemachte Verschlusskappe verwendet, um den PE10-Schlauch abzudichten, was nicht nur das Austreten von Liquor cerebrospinalis verhindert, sondern auch die Notwendigkeit eines wiederholten Schneidens des PE10-Schlauchs reduziert. Schließlich wird das extrakorporale Ende des PE10-Schlauchs mit einem Band zusammengebunden, das ein Zurückziehen des Schlauchs verhindert, wenn sich das Tier bewegt.
Diese Methode kann die Erfolgsrate der Katheterisierung bei Ratten erhöhen, da etwa 80 % der PE10-Schläuche auch 28 Tage nach der Operation an Ort und Stelle blieben. Somit kann dieses modifizierte Verfahren einen einfachen, bequemen und zuverlässigen Ansatz für die wiederholte intrathekale Verabreichung des Arzneimittels darstellen.
Einleitung
Die intrathekale Katheterisierung (auch als Subarachnoidalkatheterisierung bekannt) bei Ratten ist eine Methode, bei der ein Katheter durch den Zwischenwirbelraum in den Subarachnoidalraum eingeführt wird1. Die Medikamente werden durch den Katheter direkt in den Subarachnoidalraum injiziert, was den Forschern hilft, die Auswirkungen von Medikamenten auf das Rückenmark zu untersuchen, ohne die Auswirkungen von Medikamenten zu berücksichtigen, die die Blut-Hirn-Schranke durchdringen 2,3. Darüber hinaus kann nach intrathekaler Katheterisierung Liquor cerebrospinalis entnommen werden, um die Mikroumgebung des Zentralnervensystems zu untersuchen 4,5. Die derzeit verwendete Methode zur intrathekalen Katheterisierung wurde erstmals 1976 von Yaksh und Rudy6 etabliert und wird seitdem in Tierversuchen in den Bereichen Neurowissenschaften, Anästhesie und Analgesie, Rückenmarks-vermittelte kardiovaskuläre Regulation und insbesondere neuropathische Schmerzen in großem Umfang angewendet 2,7. Diese Methode weist jedoch immer noch einige Einschränkungen auf, wie z. B. eine hohe Inzidenz von Rückenmarksschäden, Subarachnoidalblutungen, postoperative sensorische und motorische Dysfunktionen, eine hohe postoperative Mortalität und ein hohes Risiko für neurologische Beeinträchtigungen 4,5,8,9,10 . In einem Versuch, diese Einschränkungen zu überwinden, wurde 1996 von Størkson et al. 11 eine Katheterisierung des Subarachnoidalraums durch lumbale Zwischenräume vorgeschlagen 11, und es wurde über eine höhere postoperative Erfolgsrate berichtet. Bemerkenswert ist, dass die Fixierung des Verweilkatheters bei dieser Methode immer noch eine Herausforderung darstellt, und das Zurückziehen des Katheters ist aufgrund von Tierbewegungen üblich, was die intrathekale Verabreichung des Arzneimittels unpraktisch macht.
Aufgrund der oben genannten Einschränkungen haben einige Forscher 12,13,14,15 versucht, die Werkzeuge für die Punktion, die Methoden der Katheterisierung und die Methoden der Katheterfixierung zu verbessern, aber die verfügbaren Methoden müssen noch geändert werden, da es schwierig ist, den Durchmesser der verwendeten Kügelchen zu quantifizieren, die Notwendigkeit wiederholter Punktionen und die kurze Länge des Katheters. usw.11
In Anlehnung an den lumbalen Zugang zur intrathekalen Katheterisierung1 und die Seldinger-Technik zur Zentralvenenkatheterisierung16 haben wir ein Verfahren zur intrathekalen Katheterisierung bei Ratten entwickelt, das einen Edelstahldraht, eine selbstgemachte Verschlusskappe und ein antiallergisches Band verwendet, um die bestehende Methode zu vereinfachen. Durch diese Methode kann der Katheter leicht in den Subarachnoidalraum eingeführt und stabil auf dem Rücken der Ratte fixiert werden, und die Notwendigkeit wiederholter Punktionen für die wiederholte intrathekale Verabreichung des Arzneimittels wird vermieden.
Hier stellen wir eine modifizierte Methode vor, die die Erfolgsrate der intrathekalen Katheterisierung bei Ratten verbessern kann und einen einfachen, bequemen und zuverlässigen Ansatz für die wiederholte intrathekale Verabreichung von Arzneimitteln darstellt.
Protokoll
Die intrathekale Katheterisierung wurde in strikter Übereinstimmung mit den Empfehlungen in den Richtlinien für die Pflege und Verwendung von Labortieren der National Institutes of Health durchgeführt, und das Protokoll wurde von der Ethikkommission für Versuchstiere, China, genehmigt (Nr. TJBH15523201). In dem Experiment wurden männliche Sprague-Dawley (SD) Ratten verwendet. Es wurde darauf geachtet, die Schmerzen und Beschwerden der Tiere so gering wie möglich zu halten.
1. Material- und Instrumentenvorbereitung
HINWEIS: Die Vorbereitung von Materialien und Instrumenten ist für eine erfolgreiche intrathekale Katheterisierung sehr wichtig.
- Bereiten Sie ein 15 cm langes PE10-Rohr vor (die Länge wird anhand des Abstands zwischen dem Rattenkopf und dem Ende des Schwanzes bestimmt), führen Sie einen 20 cm langen Edelstahldraht (0,2 mm Durchmesser) mit zwei polierten Enden als Stütze in das PE10-Rohr ein und markieren Sie das Rohr 2 cm von einem Ende entfernt, um die Einführtiefe anzuzeigen (wie durch schwarze Kreuze in Abbildung 1A gekennzeichnet, B).
- Schneiden Sie die scharfe Spitze einer 22-G-Nadel ab und versiegeln Sie das distale Ende (Abbildung 1C).
- Schneiden Sie einen Epiduralkatheter (1,0 mm Außendurchmesser) in 1 cm große Fragmente. Führen Sie dann ein Fragment in eine 22-G-Nadel ohne scharfe Spitze ein (Abbildung 1D) und versiegeln Sie das distale Ende des Fragments mit einer erhitzten geraden Pinzette. Diese Vorrichtung wird als Rohrverschlusskappe bezeichnet (Abbildung 1E).
- Bereiten Sie ein 0,3 cm × 0,5 cm langes antiallergisches Band vor, indem Sie ein Seidenband (1,25 cm × 9,1 m) mit einer Schere abschneiden (Abbildung 1F).
2. Vorbereitung auf die Operation
- Bereiten Sie die Instrumente für die intrathekale Katheterisierung vor, indem Sie sie vor der Operation sterilisieren. Die für die Operation verwendeten Instrumente sind eine Zahnzange, eine Schere, ein Sondenapparat, ein Skalpellgriff und #10 Klingen. (Abbildung 2).
- Tauchen Sie das PE10-Rohr und den Führungsdraht zur Sterilisation ca. 2 h lang in 75%iges Ethanol.
3. Chirurgie
- Betäuben Sie die Ratte mit 3% Isofluran bei einer Flussrate von 3 l/min.
- Legen Sie die Ratte auf den Operationstisch und beobachten Sie den Rückzugsreflex beim Einklemmen der Hinterpfote mit einer Pinzette. Das Fehlen einer Bewegung der Hinterpfoten als Reaktion auf die Stimulation bestätigte eine erfolgreiche Anästhesie. Verabreichen Sie eine adäquate Analgesie durch intramuskuläre Injektion von 1 mg/kg Meloxicam vor der intrathekalen Katheterisierung.
- Entferne mit einem Rasierer Haare aus dem Bereich der Lendenwirbelsäule des Rückens und dem Bereich zwischen zwei Ohren.
- Legen Sie ein Zentrifugenröhrchen (3 cm Durchmesser) unter den Bauch der Ratte an der Hüft-Hüft-Verbindung, um die Beugung in der Lendenwirbelsäule zu erhöhen und mehr Platz für die Nadel und den Katheter zu schaffen.
- Sterilisieren Sie die Operationsstellen (den Bereich über der Lendenwirbelsäule und den Bereich zwischen zwei Ohren) mit Povidon-Jod-Lösung und anschließend dreimal mit Ethanollösung. Decken Sie die Ratte mit einem aseptischen Verband ab und legen Sie die Operationsstellen frei. Waschen Sie dann den PE10-Schlauch und den Führungsdraht vor der Operation mit normaler Kochsalzlösung.
HINWEIS: Der Schwanz wurde nicht abgedeckt, so dass während der intrathekalen Katheterisierung eine Schwanzbewegung beobachtet werden konnte. - Bestimmen Sie die Lage des Zwischenwirbelraums zwischen L5 und L6, indem Sie den Dornfortsatz von L6 in der Mitte zwischen dem linken und dem rechten bilateralen Beckenkamm lokalisieren. Fixieren Sie die Haut mit dem linken Daumen und dem linken Zeigefinger des Bedieners und machen Sie dann einen 3-4 cm langen Mittellinienschnitt direkt über dem Dornfortsatz zwischen L4 und S1.
- Trennen Sie das Unterhautgewebe stumpf mit einer Schere. Lokalisieren Sie den Zwischenwirbelraum zwischen L5 und L6 wieder und machen Sie einen kleinen Schnitt (0,3 - 0,5 cm) auf beiden Seiten der dorsalen Fortsätze L5 und L6.
- Klemmen und heben Sie den dorsalen Fortsatz L5 mit einer gezahnten Pinzette an, um den Zwischenwirbelraum zu erweitern. Trennen Sie dann die Muskeln um den Wirbelkörper herum mit einer Schere, bis die Oberseite des L6-Dorsalfortsatzes vollständig freigelegt ist.
HINWEIS: Die Entfernung von Teilen des Wirbelkörpers und der Muskeln sollte vermieden werden, mit dem Ziel, die Schädigung des umgebenden Gewebes zu minimieren. - Wenn der dorsale Fortsatz L5 mit einer gezahnten Pinzette angehoben und der Zwischenwirbelraum mit einer weiteren Pinzette erweitert wird, reinigen Sie den Zwischenwirbelraum L5-6 mit einem Wattebausch, bis der umgekehrte "V"-Bereich vollständig freigelegt ist.
- Punktieren Sie die Wirbelsäule mit einer 23-G-Nadel im umgekehrten "V"-Bereich direkt unter der Spitze des L6-Dorsalfortsatzes.
HINWEIS: Es wird ein Schwanzschlag beobachtet und/oder farblose transparente Flüssigkeit fließt aus dem Subarachnoidalraum, was auf eine erfolgreiche Punktion in den Subarachnoidalraum hinweist. - Führen Sie den PE10-Schlauch mit Edelstahldraht vorsichtig in den Spinalkanal an der Einstichstelle ein, wobei Sie ihn um 30° zum Schwanz hin geneigt haben. Passen Sie den Einführwinkel an, bis das PE10-Rohr erfolgreich und ohne Widerstand eingeführt werden kann (während dieses Vorgangs wurde ein Schwanzschlag beobachtet).
- Wenn der markierte Bereich der PE10-Sonde den hinteren Muskel erreicht, wird die Katheterisierung gestoppt.
- Entfernen Sie langsam den Edelstahldraht vom PE10-Rohr. Es kann ein Schwanzschlag beobachtet werden.
HINWEIS: Es kann ein Schwanzschlag beobachtet werden, und nachdem der Draht entfernt wurde, kann transparente Flüssigkeit (oder hellrote Flüssigkeit) aus dem Schlauch fließen. - Verbinden Sie dann das PE10-Röhrchen mit einer 1-ml-Spritze, durch die 20 μl normale Kochsalzlösung injiziert werden. Nachdem die Spritze entfernt wurde, fließt die Kochsalzlösung kontinuierlich aus dem PE10-Schlauch, was darauf hinweist, dass sie erfolgreich in den Subarachnoidalraum eingeführt wurde.
- Sobald bestätigt wurde, dass der PE10-Schlauch frei ist, vernähen Sie die Muskeln auf einer Seite des Wirbelkörpers mit einer 4-0-Naht und machen Sie einen Knoten. Binden Sie dann die Naht um den PE10-Schlauch und machen Sie einen weiteren Knoten. Schneiden Sie die Naht nicht ab; Nähen Sie die Muskeln auf der anderen Seite; Binden Sie die Naht wieder an den PE10-Schlauch, machen Sie einen dritten Knoten und schneiden Sie die Naht durch.
HINWEIS: Bei diesem Verfahren wird der PE10-Schlauch mit einer 8-Naht fixiert, um die Möglichkeit einer Verschiebung und Retraktion des Schlauchs zu verringern. - Machen Sie einen 0,5 cm langen Schnitt 1 cm unterhalb des Mittelpunkts zwischen den Ohren. Trennen Sie das Unterhautgewebe stumpf mit einer Schere und führen Sie einen Metallschlauch in Richtung Schwanz ein, bis die Spitze im Lendenschnitt sichtbar ist.
- Führen Sie das distale Ende des PE10-Schlauchs in den Sondenschlauch ein, bis der PE10-Schlauch am anderen Ende des Sondenschlauchs austritt. Ziehen Sie dann die Sonde vorsichtig zurück.
- Wenn bestätigt wird, dass der PE10-Schlauch wieder frei ist, vernähen Sie die verbleibenden Muskeln um den Lendenwirbelschnitt mit einer 4-0-Naht, binden Sie die Naht um den PE10-Schlauch und machen Sie einen weiteren Knoten, um den PE10-Schlauch wieder zu fixieren.
- Vernähen Sie die Haut und vermeiden Sie eine Beschädigung des PE10-Schlauchs. Nähen Sie dann die Halshaut mit einer 4-0-Naht, binden Sie die Naht um den PE10-Schlauch und machen Sie einen Knoten, um den PE10-Schlauch zu fixieren.
- Wenn bestätigt wird, dass das PE10-Rohr wieder frei ist, verschließen Sie das extrakorporale Ende des PE10-Rohrs mit einer Verschlusskappe.
- Trocknen Sie das PE10-Röhrchen mit einem Stück Taschentuch ab und binden Sie dann das antiallergische Band mehrmals um das PE10-Röhrchen, um ein Zurückziehen des PE10-Röhrchens bei der Bewegung der Ratte zu verhindern.
4. Experiment zur Lidocain-Validierung
- Bringen Sie die Ratte nach der Operation in ihren Käfig zurück (einen pro Käfig) und überwachen Sie sie während der Genesung von der Narkose genau, bis die Ratte das Bewusstsein erlangt.
- Nachdem die Ratte vollständig wach ist, entfernen Sie die Verschlusskappe und injizieren Sie 20 μl 2% Lidocain in ein PE10-Röhrchen mit einer Geschwindigkeit von 0,02 ml/s über eine Hamilton-Spritze, gefolgt von der Injektion von 10 μl normaler Kochsalzlösung.
- Verschließen Sie das PE10-Rohr mit der Verschlusskappe.
- Lege die Ratte auf einen Tisch und beobachte sie genau. Das Vorliegen einer Lähmung der hinteren Gliedmaßen nach einer intrathekalen Injektion von Lidocain (aus der PE10-Sonde) deutet auf eine erfolgreiche Katheterisierung hin (Abbildung 3). Die Lähmung der Hintergliedmaßen dauert in der Regel etwa 30 Minuten10.
HINWEIS: Lassen Sie die Ratte 5-7 Tage lang sich erholen, bevor Sie die folgenden Versuche durchführen. - Überwachen Sie die Ratte während der Erholungsphase engmaschig, bis die Funktion der Gliedmaßen vollständig wiederhergestellt ist.
Ergebnisse
Für die intrathekale Injektion wurde die extrakorporale Spitze des PE10-Schlauchs abgeschnitten und der PE10-Schlauch mit einer Verschlusskappe zwischen zwei Arzneimittelinjektionen verschlossen. In unserer Pilotstudie lag die Erfolgsrate der intrathekalen Katheterisierung bei etwa 95 % (19 von 20 Ratten); Der Erfolg wurde durch ein Schwanzschnippen und/oder die Freisetzung von farbloser, transparenter Flüssigkeit während des Eingriffs angezeigt. Etwa 85 % der Schläuche blieben 7 Tage nach der Operation an Ort und Stelle, und etwa 80 % blieben 28 Tage nach der Operation an Ort und Stelle. Die Ratten erholten sich kurz nach der Operation, und innerhalb von 7 Tagen nach der Operation wurden keine Komplikationen beobachtet. Die täglichen Bewegungen waren normal, und Verhaltensauffälligkeiten wurden nicht beobachtet. Diese Ergebnisse deuten darauf hin, dass unsere Methode den zuvor berichteten Methoden in Bezug auf die Erfolgsrate und die Verweildauer überlegen ist.
Eine vollständige Lähmung der unteren Extremitäten nach Lidocain-Injektion über Katheter deutet auf eine erfolgreiche intrathekale Katheterisierunghin 15. Die Erfolgsrate der intrathekalen Katheterisierung wird berechnet, indem die Gesamtzahl der Ratten durch die Anzahl der Ratten mit erfolgreicher Katheterisierung dividiert wird. Mit unserer modifizierten Methode lag die Erfolgsrate bei 95 %, was höher war als die Rate, die mit der von Hou et al. berichteten Methode (88 %)15 erreicht wurde. Dies ist in Abbildung 4 dargestellt.
Die intrathekale Sonde wurde 2, 5 und 7 Tage nach der intrathekalen Katheterisierung überwacht und die Rate des erfolgreichen Verweilkatheters wurde als Anzahl der Ratten mit erfolgreichem Verweilkatheter / Gesamtzahl der Ratten × 100% berechnet. 2, 5 und 7 Tage nach der intrathekalen Katheterisierung betrug die Rate des erfolgreichen Verweilkatheters in der Studie von StØrkson et al.11 94 %, 81 % bzw. 65 %. Die Rate des erfolgreichen Verweilkatheters nach 2, 5 und 7 Tagen nach der intrathekalen Katheterisierung betrug mit unserer Technik 95 %, 90 % bzw. 85 % (Abbildung 5).

Abbildung 1. Materialien und Instrumente, die für die intrathekale Katheterisierung verwendet werden. (A) Es wurde ein 15 cm langer PE10-Schlauch vorbereitet, und der Schlauch wurde in einem Abstand von 2 cm von einem Ende markiert, um die Einführtiefe anzuzeigen. (B) Ein 20 cm langer Edelstahldraht mit zwei polierten Enden wurde als Stütze in das PE10-Rohr eingeführt. (C) Die scharfe Spitze der 22G-Nadel wurde mit einer Schere durchtrennt und das distale Ende mit einer Pinzette versiegelt. (D) Ein Epiduralkatheter (1,0 mm Außendurchmesser) wurde in 1 cm große Fragmente geschnitten, die dann in die spitzenfreie 22G-Nadel eingeführt wurden. (E) Das distale Ende des Epiduralkatheters wurde mit einer erhitzten geraden Pinzette verschlossen; Diese Vorrichtung wurde als Rohrverschlusskappe bezeichnet. (F) Mit einer Schere wurde ein 0,3 cm × 0,5 cm langes antiallergisches Band (Seidenband, 1,25 cm × 9,1 m) vorbereitet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Abbildung 2. Vorbereitung von Instrumenten für die intrathekale Katheterisierung. Instrumente (wie Zahnzange, Schere, Sondenapparat, Skalpellgriff und #10 Klingen) wurden ca. 2 h lang mit Ethanol sterilisiert und dann ca. 30 min vor der Operation mit normaler Kochsalzlösung gewaschen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
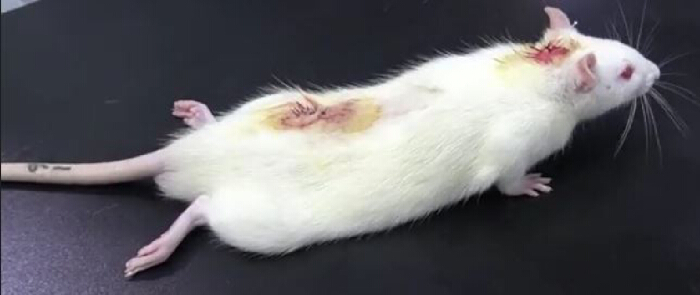
Abbildung 3. Ergebnisse des Lidocain-Validierungsexperiments nach intrathekaler Katheterisierung. Nach intrathekaler Injektion von 20 μl 2 % Lidocain, gefolgt von einer Injektion von 10 μl normaler Kochsalzlösung, war die Ratte vorübergehend gelähmt: Die Lähmung der unteren Gliedmaßen trat innerhalb von 30 s auf und verschwand 30 min später, was auf eine erfolgreiche intrathekale Katheterisierung hinweist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
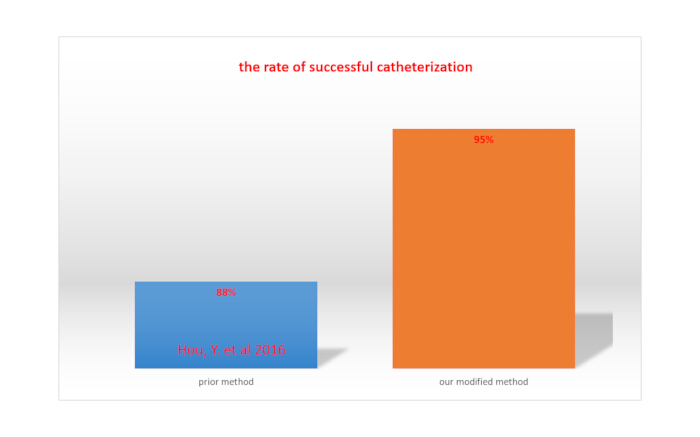
Abbildung 4. Vergleich der Rate der erfolgreichen Katheterisierung zwischen unserer modifizierten Methode und einer zuvor berichteten Methode. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
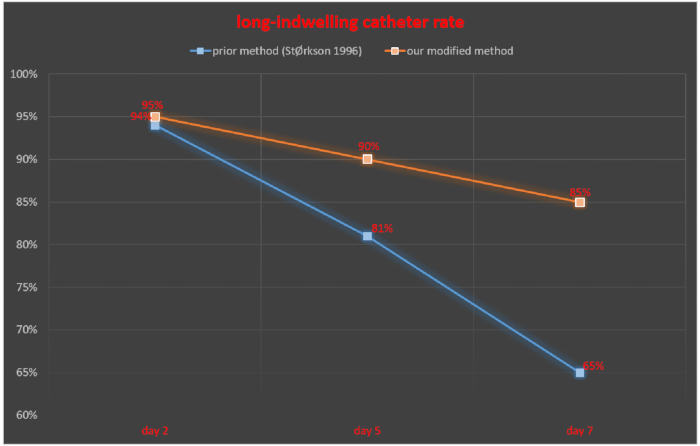
Abbildung 5. Vergleich der Katheterrate mit langer Verweilzeit zwischen unserer modifizierten Methode und einer zuvor beschriebenen Methode. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Modifizierte Methode | Vorherige Methode | Vorteile des modifizierten Verfahrens | Nachteile der vorherigen Methode | |
| Führungsmethode für das Einführen | ein Edelstahldraht | Führungskanüle (20G 0,9× 38 mm) | Erhöht die Elastizität des Rohres, | Der Widerstand ist schwer zu spüren, was die Schwierigkeit der Bedienung erhöht |
| Verbessert die Erfolgsrate der intrathekalen Katheterisierung | Schädigung des Gewebes durch wiederholte Punktion | |||
| Reduziert den Bedarf an Operationsraum | Ein Ende des Rohres wird auf das 1,5-fache der ursprünglichen Länge gedehnt, wodurch der Durchmesser beider Enden unterschiedlich ist | |||
| Minimiert die Schädigung des Gewebes um die Lendenwirbelsäule | Anfälligkeit für Liquorleckagen, da der Durchmesser der 20G-Führungskanüle das 2-fache oder mehr des Durchmessers eines gedehnten PE10-Schlauchs beträgt | |||
| Länge des PE10-Rohres | ca. 15 cm | 14 oder 28 cm | Einfache Bestimmung der Länge des PE10-Schlauchs, unabhängig von der Dauer der Verweildauer des Katheters | Die Verweildauer des Katheters ist bei kürzeren PE10-Schläuchen kürzer; Anfälligkeit für das Herausfallen aus dem Körper bei langen PE10-Rohren |
| Methode der Fixierung | "8" Naht und 4 mal | 1 oder 2 Perlen | Vermeidet die Bewegung und das Zurückziehen des Schlauchs während der Tieraktivitäten | Unterschied im Durchmesser des Rohrs an beiden Enden und Anfälligkeit für die Verschiebung des PE10-Rohrs während der Perlenherstellung |
| Verfahren zur Rohrversiegelung | Selbstgemachte Mütze | Nein | Verhindert das Austreten von Liquor cerebrospinalis | Anforderung des wiederholten Schneidens des PE10-Rohrs |
| Vermeidet das wiederholte Schneiden von PE10-Rohren | ||||
| Verfahren zur Verhinderung des Rückzugs | Antiallergisches Band | 1 oder 2 Perlen | Verhindert das Zurückziehen des Schlauchs während der Tieraktivitäten | Anfälligkeit für Retraktion |
Tabelle 1. Vor- und Nachteile der modifizierten Methode und einer zuvor berichteten Methode.
Diskussion
Es gibt mehrere wichtige Tipps für diese modifizierte Methode, um die Erfolgsrate der intrathekalen Katheterisierung zu maximieren. Zunächst sollte ein 20 cm langer Edelstahldraht mit zwei polierten Enden vorbereitet und als Stütze in das PE10-Rohr eingeführt werden. Zweitens sollte der Bediener den umgekehrten "V"-Bereich vollständig freilegen, nachdem er den L5-6-Zwischenwirbelraum mit einem Wattebausch gereinigt hat, und der Zwischenwirbelraum sollte mit einer weiteren Pinzette erweitert werden, während der L5-Dorsalfortsatz mit einer Zahnzange angehoben wird. Drittens sollte der PE10-Schlauch viermal mit einer Figur-8-Naht fixiert werden. Zum Schluss sollte das extrakorporale Ende des PE10-Schlauches mit einem Band zusammengebunden und mit einer selbstgemachten Kappe verschlossen werden.
Die Erfolgsrate der intrathekalen Katheterisierung und die Schädigung des Gewebes um den Wirbelkörper herum können die Zuverlässigkeit der experimentellen Ergebnisse signifikant beeinflussen15. Daher ist es entscheidend, die Erfolgsquote so weit wie möglich zu verbessern und die Schädigung des umgebenden Gewebes zu reduzieren, um Tiermodelle und relevante Experimente zu etablieren1. Bei diesem modifizierten Verfahren wird ein Edelstahldraht zur Führung in den PE10-Schlauch eingeführt, der die Elastizität des Schlauchs erhöht und die Erfolgsrate der intrathekalen Katheterisierung verbessert. Darüber hinaus wird mit dieser modifizierten Methode der Platzbedarf für die Operation reduziert und die Schädigung des Gewebes um die Lendenwirbelsäule minimiert, da das umliegende Gewebe stumpf getrennt, aber nicht geschnitten wird. Im Vergleich dazu wird bei der zuvor berichteten Methode11 eine 20-G-Führungskanüle verwendet, um den Widerstand während der Punktion zu verringern, und oft ist eine wiederholte Punktion erforderlich, die das Gewebe verletzen kann. Darüber hinaus wird bei der zuvor beschriebenen Methode zur Verringerung des Durchmessers des PE10-Schlauchs dieser in warmes Wasser (60 °C) getaucht und dann an einem Ende auf etwa 150 % der ursprünglichen Länge gedehnt, was möglicherweise die Konsistenz des Schlauchdurchmessers nicht gewährleistet und daher zu einem Austreten von Liquor cerebrospinalis führen kann, da der Durchmesser der 20-G-Führungskanüle ungefähr doppelt so groß oder gleich dem des gedehnten PE10-Schlauchs ist. Darüber hinaus bleibt bei unserer Methode die Lendenwirbelsäulenfunktion weitestgehend erhalten, wodurch der Einfluss einer Operation auf die Ergebnisse nachfolgender Experimente vermieden wird. Diese Ergebnisse stimmen mit denen von Xu et al.überein 2.
Bei der zuvor berichteten Methode11 beträgt die Länge des PE10-Schlauchs etwa 14 cm, wenn der Schlauch an der Stelle um die Einstichstelle befestigt wird, aber die Verweilzeit des Katheters unter diesen Bedingungen oft kürzer als 7 Tage ist (oder der Schlauch wird von der Ratte aus dem Körper entfernt). Die Länge des PE10-Schlauchs beträgt ca. 28 cm, wenn der Schlauch im Nacken befestigt wird, was deutlich länger ist als der bei unserer Methode verwendete PE10-Schlauch (15 cm). Obwohl die Kügelchen nach dem von Størkson et al.11 berichteten Protokoll gebildet wurden, wurden einige Schläuche aus dem Körper entfernt, und nur etwa 65 % der Röhrchen waren 7 Tage nach der Operation noch an Ort und Stelle, was die Ergebnisse der nachfolgenden Experimente erheblich beeinflusste. Bei unserer Methode wird der PE10-Schlauch 4 Mal mit einer Figur-8-Naht fixiert, und das extrakorporale Ende des PE10-Schlauchs wird mit einem Band gebunden, um die Möglichkeit einer Verschiebung und Retraktion zu verringern. Nach unserer Methode blieben etwa 85 % der Schläuche 7 Tage nach der Operation an Ort und Stelle, und etwa 80 % der Schläuche blieben 28 Tage nach der Operation an Ort und Stelle.
Bei der zuvor berichteten Methode11 sollte bei jeder Arzneimittelverabreichung die extrakorporale Spitze des intrathekalen Katheters abgeschnitten werden. Die wiederholte intrathekale Verabreichung von Arzneimitteln kann jedoch die Verweilzeit des Katheters verkürzen, was die intrathekale Verabreichung von Arzneimitteln unpraktisch macht. Daher wird bei unserer Methode eine selbstgemachte Kappe zum Verschließen des PE10-Röhrchens verwendet, das einmal täglich mit Ethanol sterilisiert wird. Dies verhindert nicht nur das Austreten von Liquor cerebrospinalis, sondern reduziert auch die Notwendigkeit eines wiederholten Schneidens des PE10-Schlauchs für die intrathekale Verabreichung von Arzneimitteln, wodurch die effektive Verabreichung der Arzneimittel sichergestellt wird.
Die Vor- und Nachteile der modifizierten Methode und der zuvor berichteten Methode sind in Tabelle 1 zusammengefasst. Erstens, für die modifizierte Methode, erhöht die Verwendung von Edelstahldraht in der PE10-Röhre die Elastizität der Röhre und verbessert die Erfolgsrate der intrathekalen Katheterisierung, der für die Operation benötigte Platz wird reduziert und die Schädigung des Gewebes um die Lendenwirbelsäule wird minimiert. Bei der zuvor beschriebenen Methode wird eine 20G-Führungskanüle eingeführt, bis ein Widerstand zu spüren ist, und oft ist eine wiederholte Punktion erforderlich, die zu einer Schädigung des Gewebes führen kann. Darüber hinaus wird der PE10-Schlauch an einem Ende gedehnt, bis seine Länge etwa 150 % der ursprünglichen Länge erreicht, was zu einem Austritt von Liquor cerebrospinalis führen kann, da der Durchmesser der 20G-Führungskanüle 2-mal größer oder gleich dem des gedehnten PE10-Schlauchs ist. Zweitens wird bei der modifizierten Methode die Länge des PE10-Schlauchs vor der Operation bestimmt, und die Verweilzeit des Katheters kann länger als eine Woche betragen. Bei der zuvor berichteten Methode beträgt die Länge des PE10-Schlauchs etwa 14 cm, wenn er an der Einstichstelle befestigt ist, aber die Verweilzeit des Katheters ist oft kürzer als 7 Tage, da der Schlauch anfällig dafür ist, von der Ratte aus dem Körper gezogen zu werden; Die Länge des PE10-Schlauchs beträgt ca. 28 cm, wenn er im Nacken befestigt wird, was deutlich länger ist als die Länge des Schlauches, der bei unserer Methode verwendet wird. Drittens wird bei der modifizierten Methode der PE10-Schlauch 4 Mal mit einer 8-Naht fixiert, um eine Bewegung und Retraktion des Schlauchs zu verhindern. Zur Abdichtung des PE10-Schlauchs wird eine selbstgemachte Kappe verwendet, die nicht nur das Austreten von Liquor cerebrospinalis verhindert, sondern auch das wiederholte Schneiden des PE10-Schlauchs verhindert. Bei der zuvor beschriebenen Methode ist es schwierig, Perlen mit einem konsistenten Durchmesser zu erhalten, die Verschiebung von PE10-Rohren ist üblich, wenn Perlen gebildet werden, und ein wiederholtes Schneiden von PE10-Rohren ist häufig erforderlich. Schließlich wird bei der modifizierten Methode das extrakorporale Ende des PE10-Rohrs mit einem Band gebunden, das verhindert, dass sich das Rohr während der Bewegung zurückzieht. Bei der vorherigen Methode können die Kügelchen das Zurückziehen des PE10-Rohrs jedoch nicht zuverlässig verhindern, da es schwierig ist, Kügelchen mit einem konsistenten Durchmesser zu erhalten.
Insgesamt hat diese modifizierte Methode zur intrathekalen Katheterisierung folgende Vorteile. Erstens erhöht die Verwendung von Edelstahldraht im PE10-Schlauch die Elastizität des Schlauchs und verbessert die Erfolgsrate der intrathekalen Katheterisierung, der für die Operation benötigte Platz wird reduziert und die Schädigung des Gewebes um die Lendenwirbelsäule wird minimiert, wodurch die Lendenwirbelsäulenfunktion weitestgehend erhalten bleibt und der Einfluss der Operation auf die Ergebnisse nachfolgender Experimente vermieden wird. Zweitens wird der PE10-Schlauch 4 Mal mit einer 8-Figuren-Naht fixiert, die eine Bewegung des Schlauchs und ein Zurückziehen während der Bewegung verhindert. Drittens wird eine selbstgemachte Verschlusskappe zum Abdichten des PE10-Schlauchs verwendet, die nicht nur das Austreten von Liquor cerebrospinalis verhindert, sondern auch das wiederholte Schneiden des PE10-Schlauchs verhindert. Wiederholtes Schneiden des Katheters kann den Katheter verkürzen, was die Verabreichung von Medikamenten unbequem macht. Schließlich wird das extrakorporale Ende des PE10-Schlauchs mit einem antiallergischen Band gebunden, das verhindert, dass sich der Schlauch während der Bewegung zurückzieht.
Es gibt jedoch einige Einschränkungen bei dieser modifizierten intrathekalen Kathetertechnik. Zunächst müssen die Ratten nach der Operation getrennt untergebracht werden (eine pro Käfig), um eine Beschädigung des extrakorporalen Endes des PE10-Röhrchens zu vermeiden. Zweitens ist eine Erholung von 5-7 Tagen nach intrathekaler Injektion von Lidocain erforderlich, bevor nachfolgende Experimente durchgeführt werden.
Zusammenfassend lässt sich sagen, dass dieses modifizierte Verfahren zur intrathekalen Katheterisierung als nützliches Werkzeug für die wiederholte intrathekale Verabreichung von Arzneimitteln dienen kann und eine einfache, bequeme und zuverlässige Möglichkeit darstellt, die Dauer von Experimenten zu verkürzen.
Offenlegungen
Die Autoren dieses Manuskripts erklären, dass es keine Interessenkonflikte gibt.
Danksagungen
Diese Arbeit wurde unterstützt von der National Natural Science Foundation (Nr. 81971042) und den Key Support Specialist Projects der Shanghai Hongkou District Health Commission (Nr. HKZK2020A06).
Materialien
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | Jiangxi Hongda Medical Equipment Co., Ltd | 1 cc | |
| 22 gauge × 1” needles | Jiangxi Hongda Medical Equipment Co., Ltd | 22G | |
| 23 gauge × 1” needles | Jiangxi Hongda Medical Equipment Co., Ltd | 23G | |
| 25 μL Hamilton Syringes | Shanghai Bolige Co.,Ltd | 0.31mm 25 μL | |
| 4-O MERSILK NON-ABSORBABLE SUTURE | ETHICON | SA83G | |
| 50 mL corning centrifuge tubes 3 cm diameter | 430820 | CORNING | |
| Epidural catheter and connector | Henan Tuoren Medical Device Co., Ltd | regular type | |
| Gavage apparatus | Shanghai Bolige Co.,Ltd | 8# | |
| PE-10 Mirco Medical Tubing | BB31695-PE/1 | Scientific Commodities, Inc | |
| Scalpel handle and #10 blades | Jiangsu Songxin Medical Equipment Co., Ltd | 125mm | |
| Scissors | Jiangsu Songxin Medical Equipment Co., Ltd | 100mm | |
| Sprague-Dawley (SD) rats | Shanghai BK/KY Biotechnology Co., Ltd | Male | |
| Stainless steel wire 0.2 mm diameter | Dongguan Jiazhi Metal Products Technology Co., Ltd. | 0.2mm × 1m | |
| Toothed forceps | Jiangsu Songxin Medical Equipment Co., Ltd | 18cm | |
| URGO silk tape | URGO | 1.25cm × 9.1m |
Referenzen
- Kong, G., Huang, Z., Zhu, Q., Wan, Y. Comparison of two modified methods of intrathecal catheterization in rats. Exp Anim. 69 (2), 219-223 (2020).
- Xu, C. S., Sun, P., Lin, C. a new design puncture needle and a device of microcatheter protection for lumbar intrathecal catheterization in rats. Zhongguo Ying Yong Sheng Li Xue Za Zhi. 36 (3), 283-288 (2020).
- Yamamoto, G., et al. Neurosteroid dehydroepiandrosterone sulphate enhances pain transmission in rat spinal cord dorsal horn. Br J Anaesth. 123 (2), e215-e225 (2019).
- Mattioli, T. A., Sutak, M., Milne, B., Jhamandas, K., Cahill, C. M. Intrathecal catheterization influences tolerance to chronic morphine in rats. Anesth Analg. 114 (3), 690-693 (2012).
- Wang, B. C., Hillman, D. E., Li, D., Turndorf, H. Lumbar subarachnoid catheterization in rats. Pharmacol Biochem Behav. 38 (3), 685-688 (1991).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Martin, H., Kocher, L., Chery-Croze, S. Chronic lumbar intrathecal catheterization in the rat with reduced-length spinal compression. Physiol Behav. 33 (1), 159-161 (1984).
- Mazur, C., et al. Development of a simple, rapid, and robust intrathecal catheterization method in the rat. J Neurosci Methods. 280, 36-46 (2017).
- Zhang, S. X., Huang, F., Gates, M., White, J., Holmberg, E. G. Extensive scarring induced by chronic intrathecal tubing augmented cord tissue damage and worsened functional recovery after rat spinal cord injury. J Neurosci Methods. 191 (2), 201-207 (2010).
- Ohara, P. T. Long-term intrathecal catheterization in the rat. J Neurosci Methods. 110 (1-2), 81-89 (2001).
- StØrkson, R. V., KjØrsvik, A., TjØlsen, A., Hole, K. Lumbar catheterization of the spinal subarachnoid space in the rat. J Neurosci Methods. 65 (2), 167-172 (1996).
- Poon, Y. Y., Chang, A. Y., Ko, S. F., Chan, S. H. An improved procedure for catheterization of the thoracic spinal subarachnoid space in the rat. Anesth Analg. 101 (1), table of contents 155-160 (2005).
- Xu, F., Li, T., Zhang, B. An improved method for protecting and fixing the lumbar catheters placed in the spinal subarachnoid space of rats. J Neurosci Methods. 183 (2), 114-118 (2009).
- Igawa, Y., Andersson, K. E., Post, C., Uvelius, B., Mattiasson, A. A rat model for investigation of spinal mechanisms in detrusor instability associated with infravesical outflow obstruction. Urol Res. 21 (4), 239-244 (1993).
- Hou, Y., et al. A modified procedure for lumbar intrathecal catheterization in rats. Neurol Res. 38 (8), 725-732 (2016).
- Farhadi, E., et al. Comparison of open and ultrasound-guided placement of central venous catheter in children weighing less than five kilograms; a randomized clinical trial. Acad Radiol. 30 (7), 1419-1425 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten