Method Article
Laborerhaltung der Unterdipteranen Fliege Bradysia (Sciara) coprophila: Ein neuer/alter aufstrebender Modellorganismus
In diesem Artikel
Zusammenfassung
In dieser Arbeit wird die Laborerhaltung (einschließlich Paarung und Fütterung) der unteren zweiflüglerischen Fliege Bradysia (Sciara) coprophila beschrieben.
Zusammenfassung
Laborbestände der Unterdipterischen Fliege, Bradysia (Sciara) coprophila, werden seit über einem Jahrhundert aufbewahrt. Protokolle für die Laborerhaltung von B. coprophila werden hier vorgestellt. Diese Protokolle werden für die schnell wachsende Zahl von Laboratorien, die B. coprophila untersuchen, nützlich sein, um seine einzigartigen biologischen Eigenschaften zu nutzen, zu denen gehören: (1) eine monopolare Spindel bei der männlichen Meiose I; (2) Nicht-Disjunktion der X-Dyade in der männlichen Meiose II; (3) Chromosomenprägung zur Unterscheidung von mütterlichen und väterlichen Homologen; (4) keimbahnbegrenzte (L) Chromosomen; (5) Chromosomeneliminierung (väterliche Chromosomen bei der männlichen Meiose I; ein bis zwei X-Chromosomen bei frühen Embryonen; L-Chromosomen aus dem Soma in frühen Embryonen); (6) Geschlechtsbestimmung durch die Mutter (es gibt kein Y-Chromosom); und (7) entwicklungsregulierte DNA-Amplifikation an den DNA-Puff-Loci in den Polytenchromosomen der Speicheldrüsen der Larven.
Es ist nun möglich, diese vielen einzigartigen Merkmale der Chromosomenmechanik zu erforschen, indem die jüngsten Fortschritte bei der Sequenzierung und Assemblierung des B. coprophila-Genoms und die Entwicklung von Transformationsmethoden für das Genom-Engineering genutzt werden. Die wachsende wissenschaftliche Gemeinschaft, die B. coprophila für die Forschung verwendet, wird von den hier beschriebenen Protokollen für die Paarung der Fliegen (phänotypische Marker für Mütter, die nur Söhne oder nur Töchter haben werden; Details zur Massenpaarung für biochemische Experimente), die Überprüfung des Schlüpfens des Embryos, die Fütterung von Larven und andere Kommentare zur Aufzucht profitieren.
Einleitung
Ein vollständiges Verständnis der biologischen Prinzipien erfordert das Studium vieler verschiedener Organismen, die den Baum des Lebens umspannen. Obwohl bis zum Ende des 19. Jahrhunderts ein breites Spektrum von Organismen beschrieben wurde, beschränkten sich experimentelle Studien Mitte des 20. Jahrhunderts auf eine Handvoll von weniger als einem Dutzend Modellorganismen. Mit dem Beginn des genomischen Zeitalters und dem Ziel, Genome aller Arten im Baum des Lebens1 zu sequenzieren, sind wir nun in der Lage, die für Laborexperimente verwendeten Organismentypen zu erweitern und die Vorteile ihrer Vielfalt zu nutzen. Eine solche Erweiterung von neu entstehenden Modellorganismen für Experimente setzt voraus, um diese im Labor aufrechterhalten zu können. Hier werden Protokolle für die Aufzucht eines solchen neu entstehenden neuen/alten Modellorganismus beschrieben.
Der Großteil des tierischen Lebens auf der Erde ist auf vier Superstrahlungen von Insekten2 zurückzuführen. Unter den Insekten gibt es etwa 158.000 Arten von Diptera (echte Fliegen)3, davon etwa 3000 Arten in der Familie der Sciaridae (schwarze Trauermücken)4. Die Fruchtfliege Drosophila ist die am gründlichsten untersuchte der Diptera-Fliegen. Die untere zweiflüglerische Fliege (Nematocera), Bradysia (früher Sciara genannt) coprophila, spaltete sich vor 200 Millionen Jahren von Drosophila ab, einer "höheren zweiflüglerischen" Fliege (Brachycera). Daher befindet sich B. coprophila in einer günstigen taxonomischen Position für vergleichende Studien mit D. melanogaster (Abbildung 1). Darüber hinaus weist B. coprophila viele einzigartige biologische Merkmale auf, die für sich genommen eine Untersuchung wert sind 5,6,7. Viele dieser Merkmale verstoßen gegen die Regel der DNA-Konstanz, nach der alle Zellen eines Organismus den gleichen DNA-Gehalt haben. Bei B. coprophila (i) wird das väterliche Genom auf einer monopolaren Spindel in der männlichen Meiose I eliminiert; (ii) es gibt keine Disjunktion der X-Dyade in der männlichen Meiose II; (iii) keimbahnbegrenzte (L) Chromosomen werden aus dem Soma eliminiert; und (iv) je nach Geschlecht des Individuums werden ein oder zwei X-Chromosomen im frühen Embryo eliminiert. Die Chromosomenprägung zur Unterscheidung von mütterlichen und väterlichen Homologen wurde zuerst bei B. coprophila entdeckt und spielt bei vielen dieser Chromosomeneliminierungsereignisse eine Rolle. Neben der Chromosomeneliminierung erfolgt eine weitere Umgehung der DNA-Konstanz durch entwicklungsregulierte, Locus-spezifische DNA-Amplifikation an den DNA-Puff-Loci in den Polyten-Chromosomen der Speicheldrüsen der Larven. Studien zu diesen einzigartigen Merkmalen erfordern eine Laborwartung von B. coprophila; Einzelheiten zu ihrer Haltung werden hier vorgestellt, um solche Studien zu erleichtern.
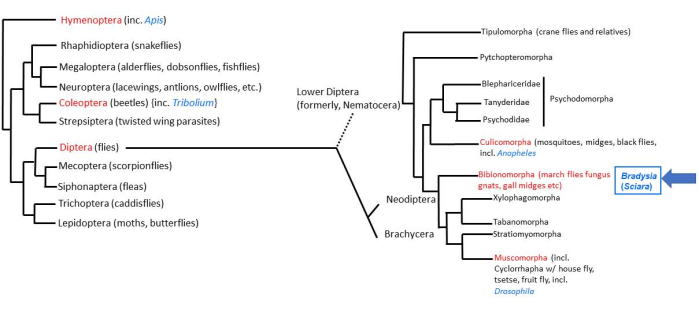
Abbildung 1: Phylogenie von Bradysia (Sciara) coprophila. Beliebte Modellorganismen sind in blauer Schrift und ihre taxonomische Reihenfolge in roter Schrift angegeben. Bradysia und andere Trauermücken sowie Stechmücken sowie Stechmücken sind Fliegen der unteren Zwölftel (früher, Unterordnung Nematocera), während Drosophila-Arten Fliegen mit höheren Trauermücken (Unterordnung: Brachysera) sind. Die Informationen auf der linken Seite der Abbildung stammen von Misof et al.33; die Informationen auf der rechten Seite stammen von Bertone et al.34 und Wiegmann et al.2. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Zuvor hatte die Gattung Sciara die größte Anzahl (700) Arten aller Eukaryoten, was Steffan dazu veranlasste, siein 8 zu unterteilen. Daraufhin schlug Shin vor, die Familie der Sciaridae in die Unterfamilie Sciarinae (mit sechs Gattungen, darunter Sciara, Trichosia und Leptosciarella), die Unterfamilie Megalosphyinae (einschließlich der Gattung Bradysia) und drei weitere Gruppen (einschließlich Pseudolycoriella)9 zu unterteilen. Die Phylogenie der Sciaridae wurde in den letzten Jahren von mehreren Gruppen weiter untersucht 9,10,11. In den letzten Jahrzehnten haben sich die Namen vieler Organismen aus der Familie der Sciaridae geändert12. Obwohl sich der größte Teil der Literatur über mehr als ein Jahrhundert auf den von uns untersuchten Organismus als Sciara coprophila bezieht, lautet sein aktueller taxonomischer Name jetzt Bradysia coprophila (syn. Bradysia tilicola und andere Synonyme)10. Sie kommen weltweit vor und sind allgemein als Trauermücken bekannt, da sie Pilze und andere Pilze fressen. Sie wurden erstmals 1804 von Meigen13 in Europa und später von Johannsen 14,15 in Nordamerika beschrieben. B. coprophila wurde im Cold Spring Harbor Laboratory gesammelt und Laborbestände wurden von Charles Metz in den frühen 1900er Jahren angelegt, als er Doktorand an der Columbia University bei Thomas Hunt Morgan war. Die aktuellen Bestände spiegeln also ein Jahrhundert der Inzucht wider. In ähnlicher Weise wurde die Biologie von B. coprophila durch jahrzehntelange zytogenetische Studien von Helen Crouse (die ihre Doktorarbeit bei Barbara McClintock machte) weiter aufgeklärt.
In den 1930er Jahren konkurrierte Bradysia (Sciara) mit Drosophila melanogaster als Modellsystem für genetische Studien. Trotz seiner vielen einzigartigen biologischen Eigenschaften wurde B. coprophila von D. melanogaster als beliebter Modellorganismus in den Schatten gestellt, da strahleninduzierte phänotypische Mutationen für genetische Studien erforderlich waren und bei letzterem leichter zu erreichen waren, obwohl B. coprophila nur geringfügig resistenter gegen Gammastrahlung ist als D. melanogaster16. In der modernen Ära der Genomik ist dies kein Problem mehr. Da die Genomsequenz 17,18,19 (Urban, Gerbi und Spradling, Daten nicht gezeigt) und die Transformationsmethoden 20,21 (Yamamoto und Gerbi, Daten nicht gezeigt) für B. coprophila kürzlich verfügbar geworden sind, ist die Zeit nun reif, es als neues/altes aufstrebendes Modellsystem zu nutzen, wie es von der wachsenden Gemeinschaft von Wissenschaftlern gesehen wird, die es für ihre Forschung übernommen haben. In diesem Artikel werden die Verfahren für die Wartung im Labor beschrieben.
B. coprophila fehlt ein Y-Chromosom, und das Geschlecht der Nachkommen wird von der Mutter bestimmt. Weibchen, die das X'-Chromosom ("X-prime") mit einer langen parazentrischen Inversion haben, haben nur Töchter, während Weibchen, die homozygot für das Standard-X-Chromosom (nicht invertiert) sind, nur Söhnehaben 5 (Abbildung 2). Für das X'-Chromosom19 sind Sequenzinformationen verfügbar, aber der molekulare Mechanismus muss noch geklärt werden, wie das X'-Chromosom bestimmt, dass die Nachkommen weiblich sein werden. Männchen haben nie das X'-Chromosom, und nach der Befruchtung sind Weibchen X'X (heterozygot für das X') oder XX. Erwachsene X'X-Weibchen können von XX-Weibchen anhand phänotypischer Marker auf dem Flügel unterschieden werden (Abbildung 3). X'X-Weibchen (die nur Töchter haben werden) sind an der dominanten Wavy (W) Flügelmarkierung auf dem X' zu erkennen (wie beim HoLo2-Stamm)22. Alternativ können XX-Weibchen (die nur Söhne haben werden) an der rezessiven zierlichen (p) Flügelmarkierung auf dem X wie beim 91S-Bestand23 erkannt werden. In diesem Fall haben X'Xp-Weibchen durchgehende (nicht zierliche) Flügel und haben nur Töchter. Der Stamm 6980 trägt einen rezessiven Marker auf dem X-Chromosom für geschwollene (sw) Venen24 sowie den dominanten Marker Wavy auf dem X', was zwei Marker für die Selektion für Kreuzungen ermöglicht. Der Grad der Expression von Wavy kann variieren und scheint in überfüllten Fläschchen, in denen die Nahrung begrenzt ist oder wenn die Temperatur zu warm wird, schwächer zu sein. Der Phänotyp des Wellenflügels ist außergewöhnlich stark, wenn die Larven im Kühlraum (4°-8 °C) statt wie üblich bei 21 °C gehalten werden. Obwohl der rezessive Petite-Wing-Marker nicht variabel und sehr leicht zu identifizieren ist, werden 91S-Bestände seltener verwendet, da sie weniger gesund sind als der HoLo2-Bestand. Die Paarungsschemata von B. coprophila werden hier vorgestellt (Abbildung 2) und detailliert für die HoLo2-, 7298- und W14-Stämme (Supplemental File 1), die 91S-Stämme (Supplemental File 1), die 6980-Stämme (Supplemental File 1) und die Translokationsstämme (Supplemental File 1) beschrieben. Die Umlagerungsbestände sind nicht mehr vorhanden; es handelte sich um reziproke Translokationen von Heterochromomeren (H1, H2 und H3) auf dem kurzen Arm des X, der die ribosomalen RNA-Gene 25,26,27 enthält.
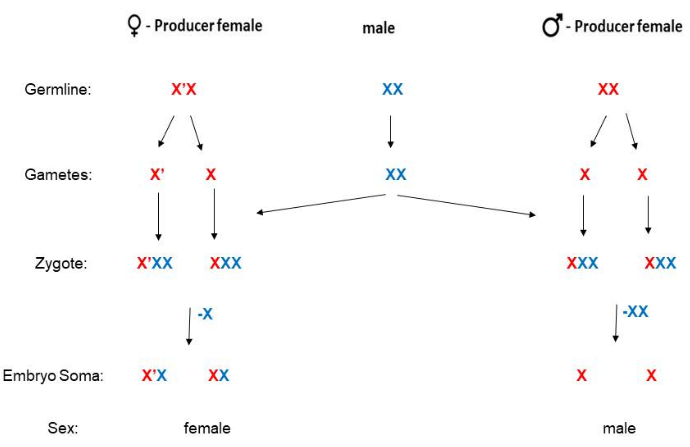
Abbildung 2: Paarungsschema für B. coprophila. Dieser Organismus hat kein Y-Chromosom (das männliche Soma hat ein einzelnes X); Mütter bestimmen das Geschlecht ihres Nachwuchses. XX Mütter haben nur Söhne und X'X Weibchen haben nur Töchter. Das X'-Chromosom hat im Vergleich zum X-Chromosom eine lange parazentrische Inversion. Die väterliche oder mütterliche Abstammungslinie des X- (oder X'-) Chromosoms ist in dieser Abbildung blau bzw. rot gekennzeichnet. Die Spermien sind haploid für die Autosomen, haben aber aufgrund der Nichtdisjunktion in der Meiose II zwei Kopien des X-Chromosoms. Die somatische Abstammungslinie der frühen Embryonen eliminiert eine oder zwei Kopien des väterlichen Abstammungs-X, wenn sie weiblich bzw. männlich sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Flügelphänotypen von B. coprophila. Erwachsene weibliche Fliegen werden mit verschiedenen Flügelphänotypen gezeigt: (A) gerader Flügel (XX), (B) gewellter Flügel (X'WX), (C) extremer Wellenflügel-Phänotyp (X'WX), der nach der Lagerung von Larven im kalten Käfig ein verschrumpeltes Aussehen hat, (D) zierlicher Flügel (XpXp), der verkümmert ist, (E) gerader Flügel mit Wildtyp (XX) und nicht geschwollenen Adern, (F) gerader Flügel mit geschwollenen Adern (XswXsw), bei dem kleine Blasen (schwarze Pfeile) am oberen Rand des Flügels und/oder in der Nähe der Spitze beider Flügel erscheinen, (G) extremes Beispiel für einen geschwollenen Flügel, bei dem eine Blase (weißer Pfeil) auf einem oder beiden Flügeln auftritt. Männchen fehlt das X'-Chromosom und werden daher niemals gewellte Flügel haben, aber sie haben zierliche oder geschwollene Flügel im 91S-Bestand bzw. 6980-Bestand. Maßstabsleiste = 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Das Ziel bei der Bestandspflege ist es, Kreuzungen durchzuführen, bei denen die Hälfte der Kreuzungen von weiblichen Müttern und die Hälfte der Kreuzungen von männlich produzierenden Müttern stammen, um in der nächsten Generation die gleiche Anzahl von weiblichen und männlichen erwachsenen Müttern für nachfolgende Kreuzungen zu haben. Dies erfordert jedoch auch eine Planung, da der Lebenszyklus bei Männchen kürzer ist als bei Weibchen und erwachsene Männchen bis zu einer Woche vor den erwachsenen Weibchen schlüpfen. Die Natur trägt dieser Asynchronität zwischen den Geschlechtern Rechnung, indem sie die männlichen Embryonen 1-2 Tage nach den weiblichen Larven aus einer Kreuzung am selben Tag als Larven schlüpfen lässt. Um jedoch sicherzustellen, dass männliche und weibliche adulte Tiere gleichzeitig für Laborkreuzungen zur Verfügung stehen, kann die Entwicklung der Weibchen etwas beschleunigt werden, indem Fläschchen mit weiblichen Larven bei Raumtemperatur statt bei 21 °C belassen werden oder Fläschchen mit männlichen Larven bei etwas kühleren Temperaturen (z. B. 16 °C) gelagert werden. Ein anderer Weg, der narrensicherer ist, besteht darin, Kreuzungen mit weiblichen Erzeugermüttern am Montag und Kreuzungen mit männlichen Erzeugermüttern am Freitag derselben Woche durchzuführen. Der einfachste Weg, den wir anwenden, besteht darin, Kreuzungen mit weiblichen und männlichen Erzeugermüttern am selben Tag in jeder Woche durchzuführen und an diesem Tag in jeder aufeinanderfolgenden Woche Kreuzungen durchzuführen. Bei diesem Ansatz können adulte Weibchen aus einer Kreuzung in Woche 1 mit erwachsenen Männchen gepaart werden, die aus einer Kreuzung in Woche 2 hervorgegangen sind.
Der Lebenszyklus für weibliche B. coprophila beträgt 5 Wochen, wenn sie bei 21 °C aufgezogen werden (Tabelle 1). Die Länge ihres Lebenszyklus ist bei kühleren Temperaturen oder bei Unterernährung etwas länger. Der Lebenszyklus von männlichen B. coprophila beträgt ~4-4,5 Wochen, da sie sich 0,5-1 Woche vor den Weibchen verpuppen. Das Ende jedes Larvenstadiums ist durch die Ablösung der Kutikula gekennzeichnet, die durch einen Anstieg des Spiegels des Steroidhormons Ecdyson ausgelöst wird. Im Gegensatz zu D. melanogaster, der drei Larvenstadien hat, hat B. coprophila vier Larvenstadien.
| Entwicklungsstadium | Tage nach der Verpaarung (dpm) | Länge der Etappe (Tage) |
| Ei gelegt | 1-2 | |
| Embryo | 1-2 bis 7-8 | ~7 Tage |
| Larve | ||
| Larven in den Stadien 1, 2 und 3 | 7-8 bis 16-19 Uhr | ~10 |
| 4. Larve im Stadium vor dem Augenfleck | 16-19 bis 21-24 | 5 |
| 4. Larvenstadium im Augenfleckstadium | 21-24 bis 25-28 | 4 |
| Puppe | 25-28 bis 30-33 | 5 |
| Erwachsene | lebt 1-2 Tage bei 21 °C, wenn sie verpaart ist, oder lebt 2-3 Wochen bei 16 °C, wenn sie nicht verpaart ist. | |
Tabelle 1: Lebenszyklus von weiblicher B. coprophila bei 21 °C.
B. coprophila kann überall im Bereich von 15 °C bis 25 °C gehalten werden, wobei die Entwicklung bei kühleren Temperaturen langsamer voranschreitet. Dieses Insekt bevorzugt eine feuchte Umgebung (die im Boden von Zimmerpflanzen oder Pilzbeeten zu finden ist), daher bewahren wir einen Becher mit deionisiertem Wasser im Brutkasten auf. B. coprophila kann bei Raumtemperatur in einem Brotkasten aus Metall mit locker sitzendem Deckel und einem Becher Wasser aufbewahrt werden, aber sie gehen bei 37 °C28 in einen Hitzeschock über, was in heißen Klimazonen eine Gefahr darstellt. Michael Ashburner und andere haben mit wenig Erfolg versucht, D. melanogaster in der Kälte zu lagern, um die für die Lagerhaltung benötigte Zeit zu verkürzen. Im Gegensatz dazu besteht ein großer Vorteil von B. coprophila darin, dass Fläschchen mit Larven im mittleren Stadium bis zu 3 Monate auf einem offenen Regal im Kühlraum (4-8 °C) gelagert werden können, wobei nur einmal im Monat gefüttert werden muss. Sie entwickeln sich in der Kälte bis zum Puppenstadium extrem langsam und gehen als fruchtbare Erwachsene aus, wenn die Fläschchen wieder auf 21 °C gebracht werden. Vermutlich ahmt dies ihre Überwinterung in freier Wildbahn nach. Dieser kälteinduzierte Entwicklungsstillstand könnte mit dem nach Gammabestrahlung von B . coprophila-Larven im mittleren Stadium vergleichbarsein 16, aber bei Larven im Spätstadium, die den Punkt überschritten haben, an dem es kein Zurück mehr für ihren normalen Entwicklungsfortschritt gibt, ist kein Entwicklungsstillstand zu beobachten.
Protokoll
Die hier beschriebenen Protokolle repräsentieren ein Jahrhundert Erfahrung aus den Lagerzentren von Bradysia (Sciara), die nacheinander von Charles Metz, Helen Crouse und Susan Gerbi beaufsichtigt wurden, sowie Beiträge von anderen.
1. Kreuzungen paaren
- Verwenden Sie ein erwachsenes Weibchen und zwei erwachsene Männchen pro Glasfläschchen mit einem Durchmesser von 28 mm. Sobald ein 100%iger Erfolg bei der Erkennung von Flügelphänotypen bei Müttern erreicht ist, die nur Töchter oder Söhne haben, verwenden Sie zwei Weibchen und zwei Männchen pro Fläschchen, um die Anzahl der Larven/Fläschchen zu erhöhen. Geben Sie weibliche Exemplare in jedes Fläschchen, bevor Sie die männlichen Ständchen hinzufügen, die schneller aus der Narkose aufwachen als die weiblichen.
HINWEIS: In der folgenden Beschreibung wird davon ausgegangen, dass Sie CO2 haben. Alternativ kann Äther verwendet werden, um die erwachsenen Fliegen zu betäuben. - Wenn Sie Äther verwenden, um die erwachsenen Fliegen zu betäuben, kleben Sie ein Pad mit gefalteten Labortüchern (z. B. Kimwipes) auf die Innenseite eines runden Glasdeckels eines Coplin-Glases und verwenden Sie eine Pipette, um etwas Äther aus der Flasche zu übertragen, um das Laborwischpad zu befeuchten (aber nicht gesättigt und so nass, dass Ätherflüssigkeit davon abfällt und die Gefahr besteht, dass die Fliegen ertrinken). Legen Sie für Schritt 1.6 unten das angefeuchtete Ätherkissen für ~1 min auf das geöffnete Fläschchen, bis sich die Erwachsenen nicht mehr bewegen. Sobald die erwachsenen Tiere auf eine weiße Keramikplatte gebracht wurden (die anstelle des weißen Fliegenkissens verwendet wird), halten Sie das frisch mit Äther angefeuchtete Pad regelmäßig (wenn die Beine der Fliegen zu zucken beginnen) über die Fliegen auf der Platte für ~1 Minute (ohne sie zu berühren).
ACHTUNG: Äther ist brennbar und sollte in einer Dunstabzugshaube und nicht im Kühlschrank gelagert werden. - Ordnen Sie in Reichweite ein Tablett mit Fläschchen mit adulten weiblichen Sorten, ein Tablett mit adulten männlichen Tieren und ein Tablett mit leeren Fläschchen mit 2,2 % (wt/vol) Agar an. Platzieren Sie auf dem Labortisch Plakate mit der Aufschrift "weiblich" oder "männlich" und dem Flügelphänotyp der Mutter, so dass das Fläschchen mit den für die Kreuzung ausgewählten adulten Fläschchen in die richtige Gruppe eingeteilt wird, wobei alle Fläschchen in einer Gruppe nur männliche Nachkommen und alle Fläschchen in der anderen Gruppe nur weibliche Nachkommen enthalten.
HINWEIS: Stellen Sie sicher, dass sich keine Kondenswassertröpfchen in der Durchstechflasche befinden, da die Erwachsenen an den Tröpfchen haften bleiben. Wenn die Fläschchen in einer Plastikbox gelagert wurden, stellen Sie die Fläschchen vor dem Gebrauch mindestens 1 h bei Raumtemperatur auf einen Labortisch, damit das Kondenswasser verdunsten kann. - Schalten Sie das CO2 - Gas und die Lampe für das Präpariermikroskop ein.
HINWEIS: Eine Lichtquelle mit Lichtleiter wird bevorzugt, da sie weniger Wärme abgibt, wodurch die betäubten Fliegen schneller aufwachen. - Klopfen Sie mit Erwachsenen kräftig auf ein Gummipolster auf die Durchstechflasche, so dass die Erwachsenen auf den Boden der Durchstechflasche fallen und den Stopfen entfernen. Setzen Sie die CO2 -Pistolendüse ein und setzen Sie den Stopfen wieder ein.
- Drücken Sie den Düsenauslöser, so dass CO2 für ~1 min in das Fläschchen fließt, um die Erwachsenen zu betäuben.
- Stellen Sie einen Fuß auf das Fußpedal, so dass CO2 auf das weiße Flypad und nicht auf die Pistolendüse fließt. Halten Sie das Fußpedal die ganze Zeit gedrückt, wenn sich die Fliegen auf dem weißen Fliegenpad befinden (oder drücken Sie das Fußpedal zeitweise durch, wenn die Beine der Fliegen zu zucken beginnen).
- Entfernen Sie die Düse und den Stopfen vom Fläschchen und drehen Sie das Fläschchen über ein weißes Fliegenkissen unter einem Präpariermikroskop.
- Klopfen Sie mit dem Boden des umgedrehten Fläschchens gegen das Mikroskop, so dass die Erwachsenen aus dem Fläschchen auf das weiße Fliegenkissen fallen.
- Wählen Sie die dicksten adulten Tiere aus (kürzlich mit weißem Hinterleib umschlossen) und nehmen Sie den Erwachsenen mit einer feinen Pinzette vorsichtig am Mittel- oder Hinterbein hoch. Verletzen Sie nicht die Vorderbeine, die für den Paarungstanz verwendet werden. Verwenden Sie keine erwachsenen Tiere, die sich gerade geschlossen haben und deren Körper vollständig weiß und noch nicht schwarz geworden ist, da ihre Flügel kurz und noch nicht vollständig entwickelt sind, so dass der Flügelphänotyp nicht bewertet werden kann. Erwachsene mit schlankerem Bauch können weiterhin verwendet werden, obwohl sie eine verminderte Fruchtbarkeit haben. Verwenden Sie keine dünnen Erwachsenen, deren Flügel senkrecht vom Körper weg erhoben sind, da sie tot sind.
- Entfernen Sie mit der anderen Hand den Stopfen aus dem Fläschchen mit 2,2 % (Gew./Vol) Agar. Klopfen Sie mit der Hand, die die Pinzette mit dem Erwachsenen hält, kräftig gegen die obere Innenwand des Fläschchens, so dass der Erwachsene auf den Boden des Fläschchens fällt. Setzen Sie den Stopfen wieder in die Durchstechflasche ein.
- Wiederholen Sie die Schritte 1.5-1.11 oben, um jedes Fläschchen mit weiblichen Erwachsenen aufzustellen. Verwende einen Pinsel, um die unbenutzten Fliegen vom weißen Fliegenkissen zurück in ihr Mutterfläschchen zu fegen. Setzen Sie ein Häkchen auf das Etikett der Durchstechflasche, um anzuzeigen, dass sie zum Zusammenstecken verwendet wurde (obwohl sie bei Bedarf erneut verwendet werden kann).
- Für die routinemäßige Bestandspflege stellen Sie 6-8 Durchstechflaschen mit weiblichen Erzeugern und 6-8 Durchstechflaschen mit männlichen Erzeugermüttern auf (Abbildung 4). Richten Sie die Hälfte der Fläschchen mit Müttern (oder Vätern) aus einer Durchstechflasche für Erwachsene und die andere Hälfte der neuen Fläschchen mit einer anderen Durchstechflasche für Erwachsene ein, um genetische Engpässe zu minimieren.
- Gelegentlich führt eine Fehltrennung zu einem außergewöhnlichen Männchen in weiblich produzierenden Fläschchen. Wenn ein Fläschchen mit erwachsenen Weibchen ein außergewöhnliches Männchen enthält, entfernen Sie es und zerquetschen Sie, um dieses Männchen zu töten. Wenn möglich, entsorgen Sie alle weiblichen Tiere aus dieser Durchstechflasche und warten Sie einige Tage, bis sich mehr erwachsene Weibchen schließen und sicher für Kreuzungen verwendet werden können.
HINWEIS: Es ist vorzuziehen, die Weibchen in diesem Fläschchen nicht für Kreuzungen zu verwenden, da sie sich möglicherweise mit dem außergewöhnlichen Männchen gepaart haben und keine fruchtbare Kreuzung hervorbringen.
- Gelegentlich führt eine Fehltrennung zu einem außergewöhnlichen Männchen in weiblich produzierenden Fläschchen. Wenn ein Fläschchen mit erwachsenen Weibchen ein außergewöhnliches Männchen enthält, entfernen Sie es und zerquetschen Sie, um dieses Männchen zu töten. Wenn möglich, entsorgen Sie alle weiblichen Tiere aus dieser Durchstechflasche und warten Sie einige Tage, bis sich mehr erwachsene Weibchen schließen und sicher für Kreuzungen verwendet werden können.
- Nachdem die adulten Weibchen in alle Durchstechflaschen gegeben wurden, wiederholen Sie die Schritte 1.5-1.11, um zwei adulte Männchen (Abbildung 4) zu jeder Durchstechflasche hinzuzufügen, die bereits weibliche Fliegen enthält. Klopfen Sie das Fläschchen mit den Weibchen auf eine Gummiauflage, damit sie nicht entweichen, wenn die beiden Männchen nacheinander hinzugefügt werden.
HINWEIS: Arbeiten Sie schnell und betäuben Sie die erwachsenen Fliegen nicht, da sie sonst getötet werden. - Füge auf jedem Fläschchen ein Etikett hinzu, auf dem der Bestand, die Kreuzung (für weibliche oder männliche Nachkommen), ob die Mutter aus dem adulten Fläschchen #1 oder #2 stammt, und das Datum der Paarung angegeben sind. Geben Sie die oben genannten Informationen ebenfalls in ein Notizbuch ein und geben Sie die Anzahl der für jedes Kreuz eingerichteten Fläschchen an.
HINWEIS: Es ist praktisch, ein Papiertuch hinzuzufügen, um die männlich produzierenden Fläschchen von den weiblich produzierenden Fläschchen in der Schale zu trennen. - Lassen Sie die Fläschchen ~15 Minuten lang ungestört auf der Arbeitsplatte, um sicherzustellen, dass die Erwachsenen aufwachen und herumfliegen. Beobachten Sie, ob sie sich paaren (sehr bald nach dem Aufwachen), bei der das Weibchen und das Männchen von hinten nach hinten ausgerichtet sind (der männliche Clasper greift nach dem spitzen Ovipositor des Weibchens) (Abbildung 4, unten).
HINWEIS: Ein erwachsenes Weibchen akzeptiert ein erwachsenes Männchen nur einmal, also stoßen Sie nach der Paarung nicht an die Fläschchen, da dies das Männchen während der Paarung vom Weibchen trennen könnte und das Weibchen sich nicht erneut paart. - Stellen Sie das Tablett mit den zusammengesteckten Fläschchen in den Inkubator (z. B. 21 °C). Beschriften Sie das Fach mit dem Namen des Materials (z. B. HoLo2) und der Woche des 5-Wochen-Zyklus (Wochen 1, 2, 3, 4 oder 5).
HINWEIS: Bewahren Sie das Tablett mit den frisch verpaarten Fliegen in einem separaten Teil des Inkubators oder einem anderen Inkubator auf, um Sie daran zu erinnern, die Fläschchen nicht zu füttern, bis die Larven geschlüpft sind (siehe unten).
2. Massenverpaarung
HINWEIS: In der Regel hat eine alleinstehende B. coprophila-Mutter 60 Nachkommen in ihrer Brut. Wenn eine größere Anzahl von Nachkommen für Experimente benötigt wird, kann eine Massenverpaarung anstelle der oben beschriebenen Einzelpaarverpaarung durchgeführt werden. Die Massenpaarung kann in den Standard-Glasfläschchen mit einem Durchmesser von 28 cm durchgeführt werden, wenn die Mütter einen Tag später für die induzierte Eiablage und Embryonenentnahme entnommen werden. Wird jedoch eine größere Anzahl von Larven benötigt, erfolgt die Massenpaarung in einem Glas mit größerer Oberfläche, um eine Überfüllung zu vermeiden. Stechen Sie mehrere kleine Löcher in den Deckel des Glases, damit die Larven etwas Luft zum Atmen bekommen.
- Befolgen Sie die Schritte oben in Abschnitt 1, aber verwenden Sie eine Pinzette mit feiner Spitze, um alle weiblichen Mütter (oder alle männlichen Mütter) in eine vordere Ecke des weißen Fliegenkissens zu bewegen. Verwenden Sie 10-15 betäubte fette erwachsene Weibchen und fegen Sie diese Gruppe mit einem Pinsel in das Fläschchen oder Glas mit kleinen Löchern im Deckel.
HINWEIS: Führen Sie die Schritte 2.1 und 2.2 aus. schnell für eine Massenpaarung, um eine Übernarkose zu vermeiden, die fruchtbare Kreuzungen verhindern würde. - Wählen Sie 20-25 betäubte, fette erwachsene Männchen aus und bewegen Sie sie mit einer feinen Pinzette in die vordere Ecke des weißen Fliegenkissens.
- Klopfen Sie das Fläschchen oder das Glas mit den Weibchen kräftig auf ein Gummipolster, damit sie nicht entweichen, wenn der Stöpsel oder Deckel entfernt wird, um die betäubte Gruppe erwachsener Männchen mit einem Pinsel von dem weißen Fliegenkissen einzuholen.
3. Embryonenentnahme nach Massenpaarung
- Einen Tag (24 h) nach der Paarung führen Sie die Schritte 1.5-1.11 durch, um die adulten Fliegen (Mischung aus Weibchen und Männchen) zu betäuben und auf ein weißes Fliegenpad zu übertragen.
HINWEIS: Die Oogenese ist noch nicht abgeschlossen, wenn sich die adulten Fliegen paaren, was die abschließende Meiose auslöst; Die reifen Eizellen werden durch Spermien befruchtet, die in der Spermatheca gespeichert sind, wenn die Eizellen entladen werden 29. Der Abschluss der Oogenese kann 1-2 Tage dauern, weshalb nach der Paarung 1 Tag vergehen darf, bevor die Eiablage eingeleitet wird. - Nehmen Sie ein erwachsenes Weibchen mit einer Pinzette mit feiner Spitze an den Flügeln und legen Sie es auf eine Petrischale mit einem Durchmesser von 100 mm, die 2,2 % (wt/vol) Agar enthält, wobei die Flügel in den Agar eingeführt werden. Wiederholen Sie diesen Schritt nacheinander für jedes erwachsene Weibchen auf dem weißen Fliegenpad. Die erwachsenen Männchen auf das Fliegenpad legen.
- Sobald alle weiblichen Fliegen auf dem Agar aufgespießt sind, leiten Sie die Eiablage ein, indem Sie den Kopf vorsichtig mit einer Pinzette zusammendrücken, bis die weibliche Fliege anfallsähnliche Bewegungen zeigt. Alternativ kannst du auch sanft ihren Brustkorb zusammendrücken. Sie legt dann innerhalb von 30-60 Minuten eine Traube befruchteter Eier. Decken Sie die Petrischale mit dem Deckel ab, der mit einem wasserfeuchten Labortuch angefeuchtet ist, um eine elektrostatische Anziehung der Eier auf den Deckel zu verhindern.
4. Kontrolle des "Schlupfes" der Larven
- Überprüfen Sie, ob die Larven 1 Woche nach der Paarung "geschlüpft" sind. Entfernen Sie den Stopfen aus dem Fläschchen und verwenden Sie ein Präpariermikroskop, um nach Larven zu suchen. Ihr schwarzer Kiefer öffnet und schließt sich immer wieder und sie bewegen sich langsam vorwärts. Wenn es nur wenige Larven gibt, schreiben Sie "wenige" auf das Etikett des Fläschchens, um Sie daran zu erinnern, das Fläschchen weniger zu füttern. Untersuchen Sie jedes Fläschchen in dem Tray mit dem Kreuz und geben Sie die Anzahl der Fläschchen mit Larven in das Notizbuch in eine Spalte neben der Anzahl der Fläschchen ein, die bei dieser Paarung aufgestellt wurden.
HINWEIS: Es entwickeln sich keine tiefgelben Eier. Es ist wahrscheinlich, dass sich weiße Eier entwickeln und 1 Tag bevor die Larven schlüpfen, entwickelt sich am vorderen Ende des Eies schwarzes Pigment (der zukünftige Kiefer). Verwechseln Sie Schimmel nicht mit einem weißen Filament, das an seinem Ende in einer schwarzen Kugel endet, mit Larven - der Schimmel bewegt sich nicht, im Gegensatz zu den Larven, die auf dem Agar nach vorne kriechen. - Geben Sie ein kleines Stück Stroh (nur einmal) in jedes Fläschchen mit den Larven, um die überschüssige Feuchtigkeit zu kontrollieren und den Larven ein Versteck zu bieten.
- Stellen Sie das Tablett in den Inkubator (z. B. 21 °C) mit den Larven aus den Paarungskreuzungen der letzten Wochen und beginnen Sie, die Fläschchen mit neu geschlüpften Larven zu füttern (siehe Abschnitt zur Fütterung unten).
HINWEIS: In der Regel befinden sich die Larven in einer Gruppe in der Nähe ihrer toten Mutter und beginnen, sie zu fressen; Vermutlich überträgt sich dadurch die Hefe aus dem Darm der Mutter in den Darm der Larven. Sie können am Tag des Schlüpfens der Larven oder innerhalb von 2 Tagen danach mit der Fütterung beginnen. ACHTUNG: Wenn die Fütterung verzögert wird, fressen sich die Larven gegenseitig, so dass nur noch eine fette Larve pro Fläschchen übrig bleibt! - Kontrollieren Sie weiterhin Fläschchen, die noch keine Larven enthielten, an 3 Tagen pro Woche. Wenn nach 7-10 Tagen keine Larven geschlüpft sind, entsorgen Sie das Fläschchen oder lagern Sie es zum Waschen des Fläschchens.
5. Zubereitung des Essens
HINWEIS: Alle Lebensmittelzutaten sollten frei von Pestiziden sein!
- Messen Sie mit einem Esslöffel die folgenden Zutaten nach Volumen ab und geben Sie sie in eine Metall- oder Glaspfanne (z. B. eine 8 Zoll x 8 Zoll große Metallbackform): 4 Teile Haferstroh (8 EL), 2 Teile Shitake-Pilzpulver (4 EL), 1 Teil Spinatpulver (2 EL), 1 Teil Brennnesselpulver (2 EL). Mit dem Esslöffel die Zutaten in der Pfanne gut vermischen.
HINWEIS: Alternativ können 2 Teile nur Spinatpulver oder nur Brennnesselpulver anstelle von jeweils 1 Teil verwendet werden. - Decken Sie die Pfanne mit Alufolie ab und autoklavieren Sie sie im Trockengang für 20-30 Minuten. Lassen Sie es über Nacht oder länger auf Zimmertemperatur abkühlen.
- Entfernen Sie die Folie von der Pfanne und brechen Sie die verkrustete sterilisierte Lebensmittelmischung auf, indem Sie mit dem Esslöffel eine pulverförmige Mischung herstellen.
- 1 Teil (2 gehäufte EL) Bierhefe dazugeben und gut unter die autoklavierte Lebensmittelmischung mischen.
HINWEIS: Die Bierhefe wird nicht autoklaviert, da dies die Hefe abtöten würde. - Füllen Sie die Lebensmittelmischung in ein steriles Gefäß mit Deckel.
HINWEIS: Es kann derselbe Typ von 240-ml-Glas verwendet werden, der für die Massenpaarung verwendet wird, und das obige Rezept füllt das Glas. In ähnlicher Weise sollte die gleiche Art von sterilisiertem Deckelglas nur mit Stroh gefüllt werden, das in einer mit Folie bedeckten Pfanne autoklaviert wurde.
6. Füttern
HINWEIS: Passen Sie die Futtermenge entsprechend dem Alter und der Anzahl der Larven an. Geben Sie viel Futter in Gläser mit vielen Larven aus einer Massenpaarung. Geben Sie nur eine leichte Prise Futter auf Petriplatten mit Larven, die einige Tage lang für die Entwicklungsstadien gelagert werden. Die unten beschriebene Fütterungsmethode wurde im Labor von Charles Metz 29 entwickelt und wird von seinem Labor und von Helen Crouse, Susan Gerbi und anderen seit einem Jahrhundert erfolgreich angewendet.
- Waschen Sie sich die Hände und spülen Sie sie gut aus, um Seife zu entfernen.
HINWEIS: Handschuhe werden nicht empfohlen, da sie das Gefühl Ihrer Finger bei der Regulierung der Futtermenge, die jeder Durchstechflasche verabreicht wird, beeinträchtigen. - Lagern Sie ein steriles Gefäß mit Deckel mit gemahlenem Stroh und ein steriles Gefäß mit Futter im Inkubator (z. B. 21 °C), in dem die Larven aufbewahrt werden. Nehmen Sie den Deckel vom Glas ab und gießen Sie etwas Essen in eine saubere Schüssel (z. B. eine Süßigkeitendose), um den Zugriff zu erleichtern. Setzen Sie den Deckel des Glases mit den restlichen Lebensmitteln wieder auf. Bewahren Sie die offene Schüssel mit den Lebensmitteln in einem kleinen Tablett aus Metall oder Glas auf. Dadurch wird verhindert, dass Milben oder andere Insekten über die Wand des Tabletts kriechen, um in die Schüssel mit dem Futter zu gelangen.
- Nimm etwas Nahrung zwischen dem zweiten und dritten Finger (oder zwischen Daumen und zweitem Finger) auf. Nehmen Sie mit der anderen Hand ein Fläschchen aus dem Tablett und entfernen Sie den Stopfen, indem Sie ihn während des Fütterns mit den Fingern festhalten. Untersuchen Sie das Fläschchen auf das Alter und die Anzahl der Larven und geben Sie die entsprechende Menge Futter in das Fläschchen, indem Sie die beiden Finger, die das Futter gegeneinander halten, drehen. Fläschchen mit frisch geschlüpften Larven benötigen nur ein paar Körner Futter. Fläschchen mit älteren Larven sollten eine dünne Schicht Futter haben, die die Oberseite des Agars bedeckt.
- Wenn sich weißer Schimmel im Fläschchen befindet, verwenden Sie 70%iges Ethanol, das auf ein Labortuch gesprüht wurde, um eine lange Metallsonde (z. B. mit einem Holzgriff) zu reinigen, entfernen Sie den Stopfen und führen Sie die saubere Sonde in das Fläschchen ein, um den Schimmel auf der Oberfläche des Agars abzuklopfen. Wenn viel Schimmel vorhanden ist, schwenken Sie die Sonde, um die Form um die Sonde zu wickeln und sie aus dem Fläschchen zu entfernen. Stören Sie nicht die Oberseite des Agars, da dort Larven leben; Geben Sie nur eine kleine Menge Futter hinzu und setzen Sie den Stecker wieder in die Durchstechflasche ein. Wischen Sie die Sonde mit einem mit 70 % Ethanol angefeuchteten Labortuch sauber, bevor Sie die Sonde aufbewahren oder zur Reinigung eines anderen Fläschchens verwenden.
- Sobald alle Fläschchen in einer Schale gefüttert wurden, setzen Sie die Schale wieder in den Inkubator ein und entfernen Sie die nächste Schale für die Fütterung wie in Schritt 6.3.
- Gießen Sie nach Beendigung der Fütterung das restliche Futter aus der Schüssel in das zuvor sterilisierte Glas, verschließen Sie das Glas und bewahren Sie es im Inkubator auf.
7. Sammlung von Larven oder Puppen auf Petriplatten
- Bei einer kleinen Anzahl von Larven verwenden Sie eine Metallsonde oder einen Spatel, der mit 70 % Ethanol abgewischt wurde, um in die oberste Agarschicht in einem Fläschchen zu graben und den anhaftenden Agar mit einigen Larven in eine sterile Petrischale mit einem Durchmesser von 100 mm zu überführen, die zur Hälfte mit 2,2 % (Gew./Vol.) Agar gefüllt ist.
- Bei einer größeren Anzahl von Larven führen Sie einen Spatel entlang der Wand am Boden des Fläschchens ein, um den Agar-Pfropfen aus dem Fläschchen zu lösen, und legen Sie ihn mit der Vorderseite nach oben in eine leere Petrischale. Verwenden Sie ein Präpariermikroskop, um die Larven an der Spitze des Agarpfropfens zu finden, und übertragen Sie sie mit einer feinen Pinzette in eine sterile Petrischale mit einem Durchmesser von 100 mm, die zur Hälfte mit 2,2 % (Gew./Vol.) Agar gefüllt ist.
- Mit einem Präpariermikroskop sortieren Sie die Larven mit einer feinen Pinzette in Gruppen des gleichen Entwicklungsstadiums.
HINWEIS: Aufgrund einer leichten Entwicklungsasynchronität gibt es auf der Petriplatte mehrere verschiedene Cluster von sortierten Larven mit 2,2 % (wt/vol) Agar. - Fügen Sie eine kleine Prise Futter hinzu und stellen Sie die Petrischale mit den Larven in den Inkubator. Nehmen Sie es täglich zur Beobachtung mit dem Präpariermikroskop ab, um das gewünschte Entwicklungsstadium auszuwählen.
HINWEIS: Bei DNA-Puff-Studien durchlaufen frühe Augenfleckenlarven die Stadien 10x5, 12x6, 14x7 und das Randaugen-/Fallkieferstadium mit ~1 Tag in jedem dieser Stadien 30,31. Wählen Sie Puppen, deren Augen zu 1/4 bis 1/2 mit Pigment gefüllt sind, um die Meiose-Stadien I und II in den Puppenhoden zu haben.
8. Kühlraumlagerung von Larven
- Bewahren Sie als Backup etwa vier Fläschchen mit weiblichen Larven und vier Fläschchen mit männlichen Larven aus 2 aufeinanderfolgenden Kreuzungswochen im Kühlraum auf.
- Füttern Sie für die Backup-Lagerung Larven, die sich im frühen 4. Stadium ( Pre-Eyespot-Stadium) befinden, und legen Sie sie in ein offenes Tablett auf einem Regal im Kühlraum. Füttern Sie diese Fläschchen nur einmal im Monat.
- Entfernen Sie die 16 Fläschchen aus den 2 aufeinanderfolgenden Wochen der Kreuzungen aus der Kälte nach 2-3 Monaten (markieren Sie dies als Erinnerung in einem Kalender); Stellen Sie sie in einen Brutkasten (z. B. 21 °C), um sie normal zu füttern, und lassen Sie sie sich zu erwachsenen Tieren entwickeln, die Sie für Kreuzungen verwenden können.
- Wenn die Fläschchen aus dem Kühlraum genommen werden, stellen Sie einen frischen Satz Fläschchen mit Larven im frühen 4. Stadium in den Kühlraum, damit diese Fläschchen immer als Backup für Vorräte zur Verfügung stehen.
HINWEIS: Die Lebensfähigkeit nach der Lagerung in Kühlräumen wurde nicht systematisch für verschiedene Entwicklungsstadien getestet, aber unsere Erfahrung zeigt, dass die Kühllagerung von Larven im frühen 4. Stadium gut funktioniert.
9. Waschen der Fläschchen
- Nachdem die erwachsenen Tiere gestorben sind (~2-3 Wochen nach der Eklosion), nehmen Sie die Fläschchen aus dem Inkubator und stellen Sie sie 1 Stunde lang bei 60-70 °C auf, um alle verbleibenden Organismen abzutöten.
- Entferne die Wattestäpsel und bewahre sie in einer Plastikbox auf.
- Kratzen Sie den Agar-Stopfen mit einem Spatel aus dem Fläschchen in einen Abfalleimer.
- Weichen Sie die Fläschchen über Nacht oder länger in Wasser in einer Schüssel ein.
- Verwenden Sie eine eigens für diesen Zweck aufbewahrte Reagenzglasbürste (niemals für Gefäße mit Chemikalien oder Seife verwendet) und schrubben Sie in der Durchstechflasche unter fließendem Leitungswasser auf und ab. Legen Sie die gereinigte Durchstechflasche mit der offenen Seite nach unten in einen Metallkorb. Füllen Sie den Korb mit gereinigten Fläschchen.
HINWEIS: Verwenden Sie niemals Seife in den Durchstechflaschen, da Seifenreste B. coprophila abtöten könnten. - Setzen Sie einen Drahtgitterdeckel in den Korb und drehen Sie den Korb um, während Sie den Deckel an Ort und Stelle halten, um alle Fläschchen mit entionisiertem Wasser zu füllen. Halten Sie den Deckel fest und drehen Sie den Korb um, um das entionisierte Wasser aus den Fläschchen zu entleeren. Wiederholen Sie die Spülungen mit entionisiertem Wasser 4x.
- Stellen Sie die Körbe mit den gereinigten Fläschchen auf Papiertücher oder eine offene Netzplattform (z. B. Laborwagen), um sie über Nacht oder länger zu trocknen. Bewahren Sie die trockenen Fläschchen in einer Schublade auf.
HINWEIS: Lassen Sie Fläschchen mit toten Erwachsenen nicht zu lange stehen, bevor Sie sie waschen, da dies zu einem Milbenbefall führen kann.
10. Agar gießen
- Füllen Sie einen großen Behälter (Metallkorb oder Metalltablett) mit sauberen Fläschchen und fügen Sie jedem Fläschchen einen Wattestäbchen hinzu. Verwenden Sie die Stopfen, die beim Waschen der Fläschchen aus alten Fläschchen entnommen wurden, wieder und verwenden Sie die Stopfen wiederholt, bis sie sich zersetzen und auseinanderfallen und entsorgt werden sollten. Sterilisieren Sie den Behälter mit den verstopften Fläschchen in einem Trockenzyklus für ~30 Minuten und lassen Sie sie auf Raumtemperatur abkühlen, um sie im Autoklavbehälter aufzubewahren. Halten Sie immer zwei Behälter (einen aktiv genutzten und einen Ersatzbehälter) mit autoklavierten, verstopften Fläschchen bereit.
- Geben Sie 11,0 g Agarpulver in einen 1-Liter-Erlenmeyerkolben und fügen Sie 500 ml destilliertes Wasser hinzu, um eine 2,2%ige (Gew./Vol.) Agarlösung herzustellen, die ausreicht, um ~24 Fläschchen (~21 ml/Fläschchen) zu gießen. Schwenken Sie den Kolben und stellen Sie ihn in die Mikrowelle.
HINWEIS: Verwenden Sie von hier an einen hitzebeständigen Autoklavenhandschuh, um den Kolben zu handhaben. Die gleiche 2,2%ige Agarlösung kann bei Bedarf in Petriplatten (für gepflückte Larven) oder Gläser (für Massenpaarungen) gegossen werden. - 1 Minute in der Mikrowelle erhitzen, den Kolben herausnehmen, um ihn zu schwenken, ihn wieder in die Mikrowelle stellen und erneut 1 Minute in der Mikrowelle erhitzen. Wiederholen Sie dies mehrmals.
- Beobachten Sie die Flasche durch die Glastür des Mikrowellenherds. Wenn die Agarlösung zu schäumen und zu kochen beginnt, betätigen Sie sofort den manuellen Stoppknopf. Schwenken Sie den Kolben zu diesem Zeitpunkt nicht (er könnte überkochen), sondern nehmen Sie ihn vorsichtig vom Ofen auf die Arbeitsfläche und lassen Sie ihn einige Minuten ruhen.
- Entfernen Sie den Stopfen von einem sterilisierten Fläschchen und halten Sie ihn mit einer Hand fest. Gießen Sie mit der anderen Hand ~2,5 cm hohes 2,2% Agar in das sterilisierte Fläschchen. Setzen Sie dann den Stopfen wieder in die Durchstechflasche ein. Wiederholen Sie dies, bis das gesamte Agar gegossen wurde.
HINWEIS: Wenn zu wenig Agar in das Fläschchen gegossen wird, trocknet es während des Gebrauchs schneller aus und schrumpft von den Wänden des Fläschchens ab. Wenn zu viel Agar in das Fläschchen gegossen wird, ist es schwierig, sich auf die oberste Schicht zu konzentrieren, wenn die "Baby-Luke" der Larven mit einem Präpariermikroskop bewertet wird. - Lassen Sie die ausgegossenen Fläschchen 1-2 Tage bei Raumtemperatur auf der Theke stehen, damit der Agar aushärtet und die Feuchtigkeit vollständig verdunstet. Verwenden Sie die Fläschchen zum Anpaaren von Kreuzen oder lagern Sie sie auf der Seite liegend in einer Kunststoffbox mit dicht schließendem Deckel; Lege ein mit Wasser angefeuchtetes Papiertuch auf die Fläschchen, bevor du den Deckel auf die Schachtel legst (dies verhindert, dass der Agar austrocknet und von der Wand des Fläschchens wegschrumpft). Lagern Sie die Box mit gegossenen Fläschchen einige Tage bei Raumtemperatur oder bis zu 2 Wochen im Kühlschrank oder Kühlraum bei 4 °C. Bevor Sie die gelagerten Fläschchen verwenden, nehmen Sie sie aus der Schachtel und lassen Sie sie ein oder zwei Stunden lang bei Raumtemperatur auf der Theke stehen, damit das Kondenswasser aus dem Inneren der Fläschchen verdunsten kann (die erwachsenen Fliegen würden am Kondensat haften bleiben und ertrinken).
11. Herstellung von Stopfen für Fläschchen
- Legen Sie ein sauberes Fläschchen in einen 50-ml-Reagenzglashalter aus Styropor (drücken Sie das Röhrchen hinein, sodass es gerade steht). Schneiden Sie ein Stück Käsetuch (2-4 Schichten dick) aus und legen Sie es auf das Fläschchen.
- Lege Reste von zuvor hergestellten Steckern auf das Käsetuch, um eine dickere Schicht zu erzeugen. Lege Baumwolle auf das Käsetuch und drücke es nach unten in das Fläschchen, wobei du darauf achtest, dass du den oberen Zentimeter des Fläschchens fest ausfüllst.
- Halte die Oberseite der Enden des Käsetuchs zusammen und binde es mit einer Schnur zusammen. Schneiden Sie die überschüssige Schnur und das überschüssige Käsetuch ab (lassen Sie genügend Schwänze der Schnur, um sie festzubinden, und genügend Käsetuch, um den Stecker bequem zu greifen).
HINWEIS: Stecken Sie die Stecker so ein, dass sie fest sitzen. Du solltest sie mit Zeige- und Zeigefinger herausziehen können, während du sie in einer Hand hältst. Wenn Sie das Fläschchen am Stopfen aufheben und es herausfällt, ist es zu locker. Wenn es beim Herausziehen ein lautes Knallgeräusch macht, kann es sein, dass es zu eng ist. Wenn er zu fest ist oder wenn der Pfropfen eine Schicht aus hartem, trockenem Agar aufweist, können die Fliegen ersticken. Wenn der Stopfen etwas zu locker ist oder an den Seiten des Fläschchens herunterrutscht, kann er auf die Arbeitsplatte geklopft werden, um ihn in eine etwas breitere Größe zu drücken.
12. Typischer Wochenplan (für maximale Effizienz Aufgaben in der aufgeführten Reihenfolge ausführen)
- Montag (~30 min)
- Fläschchen mit Larven füttern.
- Gießen Sie Agar in sterile, saubere Fläschchen mit Stopfen.
- Mittwoch (~2 h)
- Fläschchen mit toten Erwachsenen für 1 h in einen Ofen stellen und zum Waschen aufbewahren.
- Prüfen Sie, ob Larven "Baby-Hatch" haben.
- Fläschchen mit Larven füttern.
- Führen Sie wöchentliche Paarungen durch.
- Weitere Aufgaben nach Bedarf: Autoklavieren Sie saubere Fläschchen mit Stopfen, um bei Bedarf einen Reservevorrat zu haben; Stellen Sie neue Lebensmittel her und autoklavieren Sie Stroh nach Bedarf; Autoklavieren Sie Gläser nach Bedarf für Lebensmittel und Stroh.
- Freitag (~30 min)
- Prüfen Sie, ob Larven "Baby-Hatch" haben.
- Fläschchen mit Larven füttern.
Ergebnisse
Die hier beschriebenen Protokolle haben zu nachgewiesenen Erfolgen bei der Aufzucht von B. coprophila geführt. Wenn kürzlich geschlossene fette adulte Tiere für die Paarung ausgewählt werden (Abbildung 4), können über 90% der Kreuzungen fruchtbar sein und Nachkommen hervorbringen. Der Fruchtbarkeitserfolg ist je nach Stamm unterschiedlich (Tabelle 2). Stamm 7298 (X'-Chromosom mit Wellenmarker) war der gesündeste der Stämme, durchlief aber eine Phase des Rückgangs, offenbar aufgrund der Aktivierung mobiler DNA-Elemente, die Genomumlagerungen verursachten32. Der HoLo2-Stamm stellt einen gesunden Stamm dar, der von 7298 abgeleitet ist, bei dem sich die Genomumlagerungen anscheinend stabilisiert haben, und er hat den Elternstamm 7298 in der Stammmitte ersetzt. Der HoLo2-Stamm ist derjenige, der zur Sequenzierung des B . coprophila-Genoms verwendet wurde und von verschiedenen Laborgruppen am häufigsten verwendet wird. Kürzlich wurde die CRISPR-Mutagenese von HoLo2-Fliegen verwendet, um den W14-Stamm mit einem Phänotyp des weißen Auges zu erzeugen, der für die Transformation mit fluoreszierenden Augenmarkern verwendet werden soll (Yamamoto und Gerbi, Daten nicht gezeigt). Der Stamm W14 ist außergewöhnlich robust. Der 6980er Schaft (gewellter Flügel und geschwollene Venenmarkierer) ist etwas weniger robust und der 91S Schaft (petite wing marker) ist noch weniger robust.
Erfolgreiche Kreuzungen führen zu Embryonen (Abbildung 5). Bei den Embryonen werden die geprägten väterlichen X-Chromosomen bei der 7. bis 9. Spaltung eliminiert. Darüber hinaus werden keimbahnbegrenzte L-Chromosomen in Embryonen bei der 5. bis 6. Spaltung aus der somatischen Linie eliminiert. Die Embryonen schlüpfen als Larven, die nicht mit Schimmelpilzen verwechselt werden sollten, die ebenfalls vorhanden sein können (Abbildung 6). Augenflecken (Anlage zu den erwachsenen Augen) treten in der zweiten Hälfte des 4. Larvenstadiums auf (Abbildung 7). Die Größe der Augenflecken stellt einen geeigneten phänotypischen Marker für den Beginn und das Fortschreiten der DNA-Puff-Amplifikation dar, die eines von nur zwei bekannten Beispielen für eine natürlich vorkommende, entwicklungsregulierte ortsspezifische intrachromosomale DNA-Amplifikation (Gen) ist. Anschließend entwickeln sich Puppen, und die Menge an Pigment, die ihre Augen füllt, kann als Entwicklungsmarker für Meiose I und II in der Spermatogenese dienen (Abbildung 8) mit ihrem einzigartigen Chromosomenverhalten in diesen Teilungen.

Abbildung 4: Paarung adulter B. coprophila-Fliegen . Das obere Bild zeigt die drei Arten von adulten Fliegen im HoLo2-Bestand: weibliche produzierende Mütter mit gewellten Flügeln (X'WX erwachsene Weibchen), männlich produzierende Mütter mit geraden Flügeln (XX erwachsene Weibchen) und Männchen mit geraden Flügeln (X0 erwachsene Männchen). Man beachte den spitzen Ovipositor am hinteren Ende der weiblichen Fliegen und den hakenförmigen Klasper am hinteren Ende der männlichen Fliegen. Das untere Bild zeigt ein Männchen und ein Weibchen bei der Paarung, wobei das Männchen den Ovipositor des Weibchens gegriffen hat. Die Spermien werden in der Spermathek des Weibchens gespeichert und befruchten die Eizellen, wenn sie nach außen abgegeben werden. Die Länge der adulten Tiere beträgt 2,0 mm (Männchen), 2,5 mm (Weibchen). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
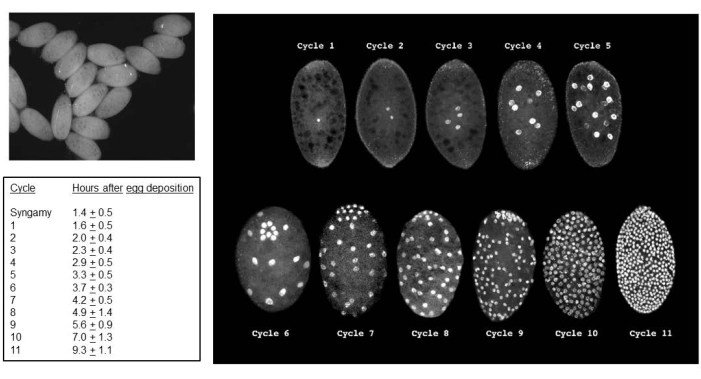
Abbildung 5: B. coprophila-Embryonen. Das obere linke Feld zeigt eine Ansicht von Embryonen mit Standardlicht in einem Präpariermikroskop; Die Zellkerne im synzytialen Zytoplasma erscheinen als schwarze Punkte. Das Panel auf der rechten Seite nutzt die Fluoreszenzmikroskopie, um die mit Propidiumiodid gefärbten Zellkerne von Embryonen sichtbar zu machen. Die Embryonen haben eine durchschnittliche Länge von 200 Mikrometern und eine durchschnittliche Breite von 150 Mikrometern. Die Zellkerne für die Keimzellen gruppieren sich am hinteren Pol des Embryos, wie bei den Zyklen 6 (Embryo nach vorne gekippt) und 7-9, danach sind sie mit somatischen Kernen durchsetzt. Die Eliminierung des L-Chromosoms in der somatischen Linie erfolgt in der Spaltungsabteilung 5 oder 6; Die Eliminierung des X-Chromosoms in der somatischen Linie erfolgt in der 7., 8. oder 9. Spaltung. Die Zellularisierung tritt in der Interphase von Zyklus 11 auf. Die Tabelle links zeigt die durchschnittliche Zeitdauer für jeden Teilungszyklus bei 22 °C. Der Tisch links und die Tafel rechts sind mit Genehmigung von de Saint Phalle und Sullivan35 adaptiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
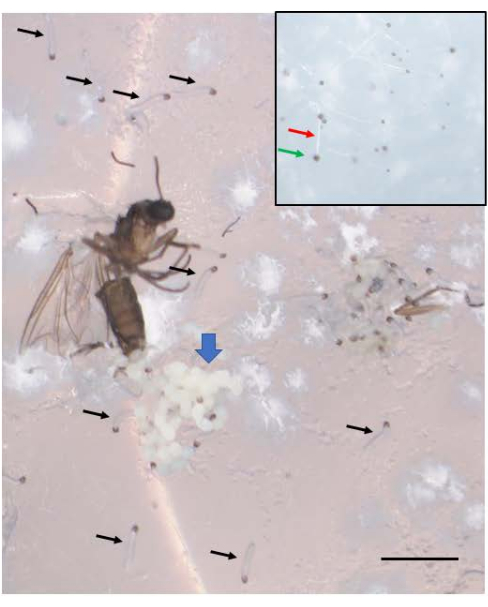
Abbildung 6: B . coprophila-Embryonen schlüpfen als Larven. Eine Gruppe von Embryonen (blauer, dicker Pfeil) ist in der Nähe des Ovipositors des erwachsenen Weibchens zu sehen, das nach der Eiablage gestorben ist. Eine Woche nach der Eiablage werden aus den Embryonen junge Larven, von denen mehrere durch die schwarzen Pfeile gekennzeichnet sind. Die neu geschlüpften Larven haben einen schwarzen Kiefer am vorderen Ende und einen durchscheinenden Körper. Sie bewegen sich auf der Agaroberfläche und sollten nicht mit Schimmel verwechselt werden, der sich nicht bewegt. Der Einschub zeigt etwas Schimmel mit einem weißen Faden (roter Pfeil) und einer schwarzen Spore an der Spitze (grüner Pfeil) und ist etwas kleiner als die neu geschlüpften Larven. Maßstabsleiste = 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
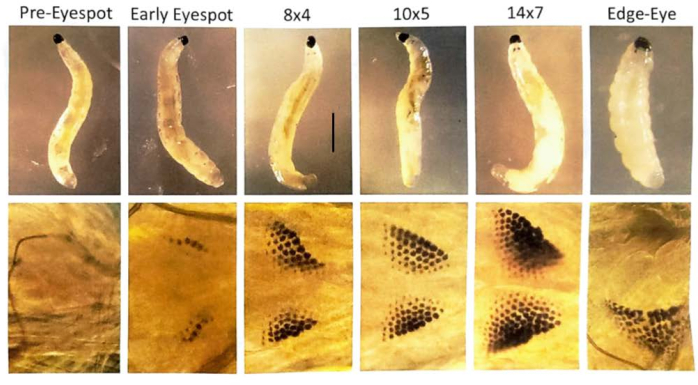
Abbildung 7: Augenfleckenstadien von B. coprophila-Larven . Augenflecken bilden sich am vorderen Rand der Larve, direkt hinter dem Kiefer, und bestehen aus Pigmentkörnern, deren Anzahl zunimmt. Die Augenflecken sind die Anlage zum erwachsenen Auge. Das obere Bild zeigt Larven, die mit einem Präpariermikroskop sichtbar gemacht wurden; Das untere Feld ist eine vergrößerte Ansicht der Augenflecken, bei der ein Phasenkontrastmikroskop verwendet wird, um eine Larve auf einem Objektträger mit einem Tropfen destilliertem Wasser und einem Deckglas, das leicht darauf schwimmt, zu visualisieren. Die Nomenklatur der Augenfleckenstadien entspricht Gabrusewycz-Garcia30 , wobei die Anzahl der Granulate in der längsten Reihe (z. B. 12) und die Anzahl der zusätzlichen Reihen ohne die längste Reihe notiert wird (z. B. 6 für das Augenfleckstadium 12x6). Die Initiierung der ortsspezifischen DNA-Amplifikation in den Polytenchromosomen der Speicheldrüse beginnt im Augenfleckstadium 10x5 und wird bei 14x7 abgeschlossen, wenn es zu einem Ausbruch der Transkription am Locus und einer Expansion der DNA-Puffskommt 31. Im anschließenden Stadium des Randauges/des abgefallenen Kiefers beginnen die Augenfleckenkörnchen zu verschmelzen und bewegen sich seitlich von der Mittellinie weg; Die Länge des Larvenkörpers verkürzt sich. Außerdem kondensieren die DNA-Puffs in diesem Stadium. Bei 21 °C dauert es etwa einen Tag, um jedes Augenfleckstadium zu durchlaufen. Maßstabsleiste = 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
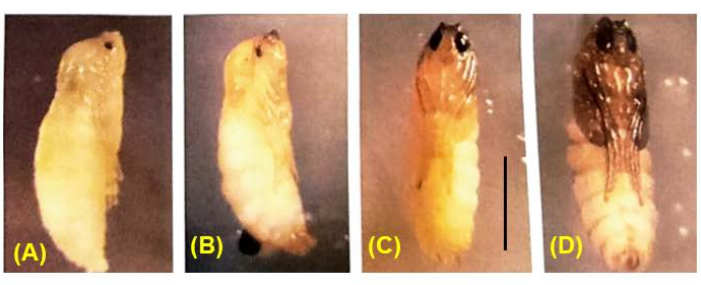
Abbildung 8: Entwicklung von B. coprophila pupae. Während der Verpuppung histolysieren alle Larvengewebe mit Ausnahme des Nervensystems und werden durch adulte Gewebe ersetzt, die durch Zellteilungen der Imaginalscheiben entstehen. Die Körperfarbe wechselt von Weiß über Hellbraun zu Braun zu Schwarz. Das Pigment füllt allmählich das Puppenauge aus; Meiose I und II treten bei männlichen Puppen auf, deren Augen zu 1/4 bis 1/2 mit Pigmentgefüllt sind 36. Maßstabsleiste = 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Name der Aktie | Markierungen | Fertilitätsrate | Kommentare |
| 7298 | Gewellter (W) Flügel | ~75% | |
| HoLo2 | Gewellter (W) Flügel | ~90% | abgeleitet von 7298 |
| W14 | Gewellter (W) Flügel; Weiße Augen | ~95% | abgeleitet von HoLo2 |
| 6980 | Gewellter (W) Flügel; geschwollene (SW) Venen | ~65% | |
| 91ER JAHRE | schwacher gewellter (W) Flügel; Zierliche (P) Flügel | ~50% | der Wavy Marker wurde in einem Kreuz eingeführt, um 91S zu retten |
Tabelle 2: Bestände von Bradysia (Sciara) coprophila. Tabelle 1 von Gerbi6 listet diese und andere Marker auf, die nicht mehr existieren. Fünf Translokationen (T1, T23, T29, T32, T70) am zentromeren Ende des X27 sind in Abbildung 8 von Gerbi6 zusammengefasst, existieren aber nicht mehr.
Ergänzende Datei 1: HoLo2 (und 7298 und W14) Kreuzungen, 91S Kreuz und Rettung, 6980 Kreuz, Translokationskreuze. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die hier vorgestellten Protokolle für die Haltung von B. coprophila werden für Wissenschaftler nützlich sein, die diesen Organismus in ihren Laboratorien für Experimente aufziehen möchten, um seine einzigartigen biologischen Eigenschaften zu erforschen. Die ursprüngliche Beschreibung der Fütterungsmethode mit Hefe und Pilzpulver, die auf eine Agarbasis gestreut wurden, um B. coprophila29 zu erhalten, wurde im Labor in Metz verwendet, um 14 verschiedene Arten von Trauermücken zu züchten5. In der Folge wurde beobachtet, dass die Zugabe von Brennnessel- und/oder Spinatpulver die Vitalität von B. coprophila weiter steigerte (Gabrusewycz-Garcia, persönliche Mitteilung). Diese Methoden haben sich als erfolgreich für die Erhaltung verwandter Arten innerhalb der Familie der Sciaridae erwiesen, einschließlich Bradysia impatiens und Lycoriella ingenua , die sich derzeit in Kultur befinden (Robert Baird, persönliche Mitteilung).
Andere Methoden (wie die unten beschriebenen alternativen Fütterungsmethoden) wurden versucht, um B. coprophila zu züchten, aber die hier beschriebenen Protokolle wurden optimiert, um das günstigste Verhältnis von Larven pro Oberfläche von Agar zu haben, um die fruchtbarsten fettigen adulten Tiere zu erhalten und das Wachstum von Schimmelpilzen zu minimieren. Zur Skalierung kann die Massenpaarung in Glasfläschchen durchgeführt werden, wie in Protokoll 2 oben beschrieben. Alternativ können einige (2-4) erwachsene Weibchen zusammen mit doppelt so vielen erwachsenen Männchen in einen Kolben gegeben werden, wie er zur Aufzucht von Drosophila verwendet wird (Einwegflasche 6 oz. = 177,4 ml Drosophila Polypropylenflasche mit quadratischem Boden). In beiden Fällen muss sich der Forscher sicher sein, dass der Kolben nur alle weiblichen oder alle männlichen Erzeugermütter enthält.
Füttern Sie nur die Larven, da die Puppen und Alttiere nicht fressen. Füttern Sie das Fläschchen nicht, wenn sich die Larven in Puppen verwandelt haben (ein Zeichen dafür ist, wenn die ersten früh schlüpfenden erwachsenen Fliegen erscheinen). Sobald die erwachsenen Tiere sich geschlossen haben, stellen Sie die Fläschchen in einen kühleren Inkubator (z. B. 16 °C), falls verfügbar, da die Erwachsenen so länger leben können. Füttern Sie dreimal pro Woche (z. B. Montag, Mittwoch, Freitag) und erhöhen Sie die Futtermenge pro Fläschchen, wenn die Larven älter werden. Füttern Sie großzügig, und Sie werden mit fetten, fruchtbaren Erwachsenen belohnt. Wenn Sie jedoch zu viel füttern, tritt weißer Schimmel auf, und das ist ein Zeichen dafür, dass Sie die Menge an Futter, die Sie in ein Fläschchen geben, reduzieren sollten. Wenn Sie zu viel füttern, bildet sich außerdem ein dickes Futterpolster auf dem Agar und erschwert es den Erwachsenen, zu schlüpfen (Sie können das Pad mit einer Pinzette entfernen, aber achten Sie darauf, keine Larven mit dem Pad herauszunehmen - es ist am besten, dies überhaupt nicht tun zu müssen). Fläschchen mit wenigen Larven (gekennzeichnet mit "wenigen") benötigen weniger Futter. Wenn Sie zu wenig füttern, klettern die Larven auf der Suche nach Nahrung an den Wänden des Fläschchens. Unterernährte Larven führen zu kleinen adulten Tieren, die weniger fruchtbar sind.
Alternative Fütterungsmethoden
Es wurde eine Vielzahl von Methoden ausprobiert, um die Larven nur einmal während des Larvenstadiums zu füttern, anstatt 3 Mal pro Woche. B. coprophila wächst nicht auf Drosophila-artiger Nahrung. John Urban (persönliche Mitteilung) versuchte, B . coprophila-Nahrung mit dem Agar zu mischen, aber es wuchs zu viel Schimmel. Er fand heraus, dass die Zugabe von zwei Schimmelpilzhemmern (Tegosept und Propionsäure) in Kombination und getrennt von verschiedenen Konzentrationen für B. coprophila in Konzentrationen toxisch war, die Schimmelpilze hemmen. Der Agar sollte einen pH-Wert von 6-7 (neutral) haben , da B. coprophila bei einem sauren pH-Wert krank wird (wie bei Propiansäure). Um eine dreimal wöchentliche Fütterung zu vermeiden, versuchte er, mit einem Spatel oder einer Spritze ohne Nadel eine dicke Hefepaste (Red Star aktive Trockenhefe gemischt mit etwas destilliertem Wasser, um sie zu befeuchten) eine Woche nach der Paarung (d. h. etwa zu dem Zeitpunkt, an dem die Larven zu schlüpfen beginnen) als Klecks auf den Agar in jedem Fläschchen zu geben.
Eine andere Methode, um eine dreimal wöchentliche Fütterung zu vermeiden, besteht darin, jedem Fläschchen eine lebende Pilzkultur hinzuzufügen. Bath und Sponsler37 berichteten, dass eine schräge Agaroberfläche mit Sabouraud-Medium mit einer Pilzkultur der Gattungen Chaetoconidia (best) oder auch Baplosporangia oder Xllescheria gestreift werden sollte. Der Pilz wurde mehrere Tage bis eine Woche vor der Einführung von B. coprophila gezüchtet. Danach war keine Fütterung mehr erforderlich. Eine Variante dieser Methode wurde auch von Ellen Rasch (persönliche Mitteilung) eingesetzt. In unseren Händen waren die Fläschchen mit dieser Methode zu nass und die Larven ertranken, aber es konnte noch einmal versucht werden, die Anzahl der Larven im Verhältnis zu den Fläschchen mit lebenden Pilzen zu optimieren.
Arthur Forer (persönliche Mitteilung) hatte einige Erfolge bei der Aufzucht von B. coprophila auf die gleiche Weise wie die Kranichfliege38. Bei diesem Ansatz wurden die Puppen auf feuchtem Pappmaché aufgezogen. Anschließend wurden die erwachsenen Tiere verpaart und die Eier auf frischem, feuchtem Pappmaché abgelegt. Die daraus resultierenden Larven wurden auf Pappmaché in Petrischalen gehalten und zweimal wöchentlich mit pulverisierten Brennnesselblättern gefüttert. Die Puppen wurden in einen Käfig gesteckt, um den Zyklus zu wiederholen.
Yukiko Yamashita (persönliche Mitteilung) hat erfolglos versucht, B. coprophila auf dem Boden zu züchten, indem sie die Bedingungen nachahmt, unter denen sie in der Natur in Topfpflanzen und Gewächshäusern mit hoher Luftfeuchtigkeit vorkommen. Schimmel kann jedoch zu einem Problem werden, wenn die Luftfeuchtigkeit erhöht wird. Nichtsdestotrotz wurde feuchte Erde mit Erfolg verwendet, um Pseudolycoriella (ehemals Bradysia) hygida Larven in Plastikboxen mit feuchter Erde aufzuziehen; Sie werden mit zersetzten Ilex paraguariensis-Blättern gefüttert, die im späten Larvenleben mit 1,2 % Hefeextrakt, 1,4 % Maisstärke, 0,8 % Hafermehl und 1,2 % Agar12 ergänzt werden. Ebenso kann die feuchte Erde durch feuchtes Torfmoos mit zerkleinerten Kidneybohnen ersetzt werden, um Trauermücken zu züchten 39,40.
Wieder andere Methoden wurden angewandt, um Laborkulturen von Bradysia zu erhalten: (i) autoklavierte Kartoffeln, denen Hefe und getrockneter Blutdünger zugesetzt werden41; ii) Gülle 42,43,44, dem getrocknetes Blut zugesetzt werden kann45; iii) Plastikbehälter mit Wattepads und angefeuchtete Papiertücher mit gemahlenen Sojabohnen46.
Milben
Milben können von Drosophila auf B. coprophila übertragen werden. Um dies zu minimieren, ist es am besten, B. coprophila in einem separaten Brutkasten oder Raum zu halten, nicht in der Nähe von Drosophila-Beständen. Führen Sie außerdem früh am Tag Wartungsarbeiten für B. coprophila durch, bevor Sie mit Drosophila umgehen. Milben können auch von Zimmerpflanzen auf B. coprophila übertragen werden, halten Sie die Pflanzen also nicht im selben Raum wie B. coprophila. Wenn Milben in die Fläschchen eindringen, kann man sie als kleine weiße kugelförmige Organismen sehen, die auf dem Körper von B. coprophila kriechen. Chemische Behandlungen, die Milben in Drosophila zerstören, können bei B. coprophila nicht angewendet werden, da die Chemikalien B. coprophila abtöten (B. coprophila reagiert auch empfindlich auf organische Dämpfe wie Phenol). Die einzige Behandlung, um die Milbenbestände von B. coprophila zu befreien, besteht darin, die Embryonen manuell auf einer Agarplatte zu sammeln, jeden auf das Fehlen von Milben zu untersuchen und sie dann mit einem feinen Pinsel in frische Agarfläschchen zu übertragen. Mit Baumwolle gefüllte Mullstopfen und Flügel aus Zelluloseacetatschaum (wie sie für Drosophila-Polypropylen-Fläschchen verwendet werden) tragen dazu bei, das Eindringen von Milben in die Fläschchen zu verhindern.
Nützlichkeit der Haltungsprotokolle
Die hier beschriebenen Protokolle werden es der wachsenden Gemeinschaft von Wissenschaftlern ermöglichen, B. coprophila als neuen/alten, aufstrebenden Modellorganismus zu züchten, um seine einzigartigen biologischen Eigenschaften zu untersuchen. Neue Laborgruppen werden ermutigt, sich der wachsenden Gemeinschaft anzuschließen, um die einzigartigen biologischen Eigenschaften von Bradysia (Sciara) zu erhalten und zu erforschen.
Offenlegungen
Der Autor hat keine Interessenkonflikte anzugeben.
Danksagungen
Besonderer Dank gilt den früheren B . coprophila-Bestandshaltern (Jacob E. Bliss, Paula Bonazinga, Anne W. Kerrebrock, Ingrid M. Mercer, Heidi S. Smith) und dem Forschungspersonal (insbesondere Robert Baird, Michael S. Foulk, Donna Kubai, John M. Urban, Yutaka Yamamoto) für die Feinabstimmung der Haltungsprotokolle. Erste Anweisungen zur Pflege von B. coprophila wurden von Helen V. Crouse, Natalia Gabrusewycz-Garcia, Reba M. Goodman, Charles W. Metz und Ellen Rasch gegeben. Mit Dank an Yukiko Yamashita und Anne W. Kerrebrock für die Übernahme des Lagerzentrums Bradysia (Sciara). Vielen Dank an die folgenden Personen für ihre hilfreiche Vorbereitung der Abbildungen: Brian Wiegmann (Abbildung 1), John M. Urban (Abbildung 4 oben), Laura Ross (Abbildung 4 unteres Bild), Yutaka Yamamoto (Abbildung 5 linkes Bild), Leo Kadota (Abbildung 7 und Abbildung 8). Vielen Dank an Ava Filiss und das Brown University Multidisciplinary Laboratory für ihre Hilfe beim Fotografieren und Filmen. Vielen Dank an Robert Baird für die Kommentare zu diesem Manuskript. Unsere Forschung und Pflege von B. coprophila wurde von NIH und NSF unterstützt, einschließlich der jüngsten Unterstützung durch NIH GM121455 to S.A.G. Weitere Informationen zu B. coprophila finden Sie auf den Websites des Bradysia (Sciara) Stock Centers (https://sites.brown.edu/sciara/ und https://sciara.wi.mit.edu), die sich derzeit im Aufbau befinden.
Materialien
| Name | Company | Catalog Number | Comments |
| Agar (bacteriological) | U.S. Biological | A0930 | https://www.usbio.net; |
| CO2 FlyStuff Foot Pedal | Genesee Scientific | 59-121 | |
| CO2 FlyStuff Blowgun | Genesee Scientific | 54-104 | |
| CO2 FlyStuff UltimaterFlypad | Genesee Scientific | 59-172 | https://www.geneseesci.com |
| Ether fume hood | Labconco | 3955220 | Sits on top of lab bench |
| Filter replacement cat # 6961300 | |||
| Food: Brewer’s Yeast Powder | Solgar | Obtain from Amazon or health food store | |
| https://www.solgar.com; | |||
| Food: Nettle Powder (pesticide free) | Starwest Botanicals | 209460-51 | |
| Food: Shitake Mushrooms (pesticide free) | Starwest Botanicals | 202127-5 | https://www.starwest-botanicals.com; |
| Food: Spinach Powder ( pesticide free) | Starwest Botanicals | 209583-5 | |
| Food: Straw (pesticide free ) | Starwest Botanicals | 209465-3 | |
| Jar: clear glass, polypropylene lid | Fisher Scientific: | FB02911765 | 73 mm dia, 89 mm ht (240 ml) https://www.fishersci.com; |
| Needle Probe, wooden handle | US Geo Supply Inc | SKU: 4190 | 5.75” long probe, stainless steel needle https://usgeosupply.com; (970)-434-3708 |
| Vials: glass, preferred: | Wilmad LabGlass | ||
| Wilmad-glass custom vials | 28-33 mm inner dia, 33 mm outer dia, 9.5 cm ht Wilmad: https://www.SP-WilmadLabglass.com | ||
| Vials: glass (cheaper and ok) | Fisher Scientific | 03-339-26H | 29 mm outer dia, 9.5 cm h https://www.fishersci.com; |
| Vials: glass (a bit narrow) | Genesee Scientific | 32-201 | 24.5 mm outer dia,9.5 cm h thttps://www.geneseesci.com |
| Vials: polypropylene | Genesee Scientific | 32-114 | 28.5 mm outer dia,9.5 cm ht |
| Vial Plugs | |||
| roll of non-absorbent cotton | Fisher Scientific | 22-456881 | |
| cheesecloth | Fisher Scientific | 22-055053 | https://www.fishersci.com; |
Referenzen
- Lewin, H. A., et al. Earth BioGenome project: Sequencing life for the future of life. Proc Natl Acad Sci USA. 115 (17), 4325-4333 (2018).
- Wiegmann, B. M., et al. Episodic radiations in the fly tree of life. Proc Nat Acad Sci USA. 108 (14), 5690-5695 (2011).
- Yeates, D. K., Wiegmann, B. M. Phylogeny of Diptera. Manual of Afrotropical Diptera.Suricata. 3, 149-161 (2017).
- Vilkamaa, P., Burdíková, N., Ševčík, J. The genus Spinopygina gen. nov. (Diptera, Sciaridae) from Western North America: Preliminary molecular phylogeny and description of seven new species. Insects. 14 (2), 173(2023).
- Metz, C. W. Chromosome behavior, inheritance and sex determination in Sciara. Amer Naturalist. 72 (743), 485-520 (1938).
- Gerbi, S. A. Unusual chromosome movements in Sciarid flies. Results and Problems in Cell Differentiation. Vol 13 Germ Line - Soma Differentiation. Hennig, N. 13, Springer-Verlag. Berlin, Heidelberg. 71-104 (1986).
- Gerbi, S. A. Non-random chromosome segregation and chromosome eliminations in the fly Bradysia (Sciara). 34;Non-Mendelian Inheritance and Meiotic Drive.", Chromosome Research.(special issue). Larracuente, A., Hanlon, S. 30, 273-288 (2022).
- Steffan, W. A. A generic revision of the family Sciaridae (Diptera) of America North of Mexico. University of California Publications in Entomology. 44, 1-77 (1966).
- Shin, S., Jung, S., Menzel, F., Heller, K., Lee, H. Molecular phylogeny of black fungus gnats (Diptera: Sciaroidea: Sciaridae) and the evolution of larval habitats. Molec Phylogenetics Evolution. 66 (3), 833-846 (2013).
- Mohrig, W., Heller, K., Hippa, H., Vilkamaa, P., Menzel, F. Revision of the black fungus gnats (Diptera: Sciaridae) of North America. Studia Dipterologica. 19 (1-2), 141-286 (2013).
- Ševčík, J., et al. Molecular phylogeny of the megadiverse insect infraorder Bibionomorpha sensu lato (Diptera). PeerJ. 4, e2563(2016).
- Menzel, F., et al. Pseudolycoriella hygida (Sauaia and Alves)-An overview of a model organism in genetics, with new aspects in morphology and systematics. Insects. 15 (2), 118(2024).
- Meigen, J. W. Klassifikazion und Beschreibung der europäischen zweiflügligen Insekten (Diptera Linn). 1 (1), Karl Reichard. Braunschweig. (1804).
- Johannsen, O. A. The fungus gnats of North America part I. Maine Agricultural Experimental Station Bulletin. 172, 209-276 (1909).
- Johannsen, O. A. Mycetophilidae of North America. Maine Agricultural Experimental Station Bulletin. 200, 57-146 (1912).
- Urban, J. M., et al. Bradysia (Sciara) coprophila larvae up-regulate DNA repair pathways and down-regulate developmental regulators in response to ionizing radiation. Genetics. (3), (2024).
- Hodson, C. N., Jaron, K. S., Gerbi, S., Ross, L. Gene-rich germline-restricted chromosomes in black-winged fungus gnats evolved through hybridization. PLoS Biology. 20 (2), e3001559(2021).
- Urban, J. M., et al. High contiguity de novo genome assembly and DNA modification analyses for the fungus fly, Sciara coprophila, using single-molecule sequencing. BMC Genomics. 22, 643(2021).
- Baird, R. B., et al. Recent evolution of a maternally acting sex-determining supergene in a fly with single-sex broods. Mol Biol Evol. 40 (7), (2023).
- Yamamoto, Y., Gerbi, S. A. Making ends meet: targeted integration of DNA fragments by genome editing. Chromosoma. 127 (4), 405-420 (2018).
- Yamamoto, Y., Gerbi, S. A. Development of transformation for genome editing of an emerging model organism. Genes. 13 (7), 1108-1124 (2022).
- Metz, C. W., Smith, H. B. Further observation on the nature of the x-prime (X') chromosome in Sciara. Proc Nat Acad Sci USA. 17 (4), 195-198 (1931).
- Crouse, H. V. X-ray induced sex-linked recessive lethals and visibles in Sciara coprophila. Amer Naturalist. 95 (880), 21-26 (1961).
- Metz, C. W., Ullian, S. S. Genetic identification of the sex chromosomes in Sciara (Diptera). Proc Nat Acad Sci USA. 15 (2), 82-85 (1929).
- Crouse, H. V. X heterochromatin subdivision and cytogenetic analysis in Sciara coprophila (Diptera, Sciaridae). I. Centromere localization. Chromosoma. 63, 39-55 (1977).
- Crouse, H. V., Gerbi, S. A., Liang, C. M., Magnus, L., Mercer, I. M. Localization of ribosomal DNA within the proximal X heterochromatin of Sciara coprophila (Diptera, Sciaridae). Chromosoma. 64 (4), 305-318 (1977).
- Crouse, H. V. X heterochromatin subdivision and cytogenetic analysis in Sciara coprophila (Diptera, Sciaridae). II. The controlling element. Chromosoma. 74, 219-239 (1979).
- Mok, E. H., et al. Maintenance of the DNA puff expanded state is independent of active replication and transcription. Chromosoma. 110 (3), 186-196 (2001).
- Smith-Stocking, H. Genetic studies on selective segregation of chromosomes in Sciara coprophila Lintner. Genetics. 21 (4), 421-443 (1936).
- Gabrusewycz-Garcia, N. Cytological and autoradiographic studies in Sciara coprophila salivary gland chromosomes. Chromosoma. 15, 312-344 (1964).
- Wu, N., Liang, C., DiBartolomeis, S. M., Smith, H. S., Gerbi, S. A. Developmental progression of DNA puffs in Sciara coprophila: amplification and transcription. Dev Biol. 160 (1), 73-84 (1993).
- Yamamoto, Y., Gustafson, E. A., Foulk, M. S., Smith, H. S., Gerbi, S. A. Anatomy and evolution of a DNA replication origin. Chromosoma. 130 (2-3), 199-214 (2021).
- Misof, B., et al. Phylogenomics resolves the timing and pattern of insect evolution. Science. 346 (6210), 763-767 (2014).
- Bertone, M. A., Courtney, G. W., Wiegmann, B. M. Phylogenetics and temporal diversification of the earliest true flies (Insecta: Diptera) based on multiple nuclear genes. Syst Entomol. 33, 668-687 (2008).
- de Saint Phalle, B., Sullivan, W. Incomplete sister chromatid separation is the mechanism of programmed chromosome elimination during early Sciara coprophila embryogenesis. Development. 122 (12), 3775-3784 (1996).
- de Saint Phalle, B., Oldenbourg, R., Kubai, D., Salmon, E. D., Gerbi, S. A. Paternal chromosome elimination and X non-disjunction on asymmetric spindles in Sciara male meiosis. BioRxiv. , (2021).
- Bath, J. D., Sponsler, O. L. An alternative method for the culture of Sciara larvae. Science. 109 (2828), 255(1949).
- Forer, A. Crane fly spermatocytes and spermatids: A system for studying cytoskeletal components. Methods Cell Biol. 25, Pt B 227-252 (1982).
- Gillespie, D. R. A simple rearing method for fungus gnats Corynoptera sp. (Diptera: Sciaridae) with notes on life history. J Entomol Soc Br Colum. 83, 45-48 (1986).
- Gardiner, R. B., Jarvis, W. R., Shipp, J. L. Ingestion of Pythium spp. by larvae of the fungus gnat Bradysia impatiens (Diptera: Sciaridae). Ann Appl Biol. 116, 205-212 (1990).
- Hungerford, H. B. Sciara maggots injurious to potted plants. J Econ Entomol. 9 (6), 538-549 (1916).
- Thomas, C. A. A method for rearing mushroom insects and mites. Entomol News. 40, 222-225 (1929).
- Austin, M. D., Pitcher, R. S. A laboratory method for rearing Sciara and phorid flies. Entomol Mon Mag. 72, No. 860 12-15 (1936).
- Butt, F. H. Culture of Sciara. Culture methods for invertebrate animals. Galtsoff, P. S., Lutz, F. E., Welch, P. S., Needham, J. G. , Comstock Publ. Co. Ithaca. 400-401 (1937).
- Hudson, E. K. Regulation of greenhouse sciarid fly populations using Tetradonema plicans (Nematoda: Mermithoidea). J Invert Pathol. 23 (1), 85-91 (1974).
- Wilkinson, J. D., Daughterty, D. M. Comparative development of Bradysia impatiens (Diptera: Sciaridae) under constant and variable temperatures. Ann Entomol Soc Am. 63 (4), 1079-1083 (1970).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten