Bildung humaner Thymus-Organoide in dreidimensionalen Fibrin-Hydrogelen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier beschreiben wir ein Protokoll für die Bildung von humanen iPSC-abgeleiteten Thymus-Organoiden, die in 3D-Fibrin-Hydrogelen gezüchtet werden, um die Reifung der Thymusepithelzellen (TEC) und deren verlängerte Erhaltung sowie die Thymopoese in vitro zu unterstützen.
Zusammenfassung
Die Generierung eines funktionellen und selbsttoleranten T-Zell-Repertoires ist ein komplexer Prozess, der von der Mikroumgebung des Thymus und vor allem von den Eigenschaften seiner extrazellulären Matrix (EZM) abhängt. Thymus-Epithelzellen (TECs) sind entscheidend für die Thymopoese, indem sie sich entwickelnde T-Zellen nähren und auswählen, indem sie selbstreaktive Klone filtern. Es wurde empirisch gezeigt, dass TECs besonders empfindlich auf physikalische und chemische Hinweise reagieren, die von der EZM geliefert werden, und klassische Monolayer-Zellkulturen führen zu einem schnellen Verlust der Funktionalität bis zu ihrem Tod. Aufgrund dieser heiklen Pflege in Kombination mit der relativen Seltenheit und trotz der hohen Einsätze bei der Modellierung der Thymusbiologie in vitro fehlen immer noch Modelle, die in der Lage sind, die TEC-Nische in großem Maßstab und im Laufe der Zeit originalgetreu nachzuahmen. Hier beschreiben wir die Bildung eines multizellulären humanen Thymus-Organoidmodells, in dem das TEC-Kompartiment aus humanen induzierten pluripotenten Stammzellen (iPSC) abgeleitet und mit primären frühen Thymozyten-Vorläuferzellen in einem dreidimensionalen (3D) Fibrin-basierten Hydrogel reaggregiert wird. Dieses Modell entspricht dem aktuellen Bedarf an einem skalierbaren Kultursystem, das die thymusische Mikroumgebung ex vivo reproduziert und die Funktionalität demonstriert, d.h. die Fähigkeit, T-Zellen zu produzieren und das Wachstum von Thymus-Organoiden über mehrere Wochen zu unterstützen. Daher schlagen wir ein praktisches in vitro Modell der Thymusfunktionalität durch iPSC-abgeleitete Organoide vor, das der Forschung in der TEC-Biologie und der T-Zell-Generierung ex vivo zugute kommen würde.
Einleitung
Der Thymus ist ein primäres lymphatisches Organ, das eine wesentliche Rolle bei der Bildung eines kompetenten und toleranten Immunsystems spielt 1,2,3. Frühe thymusische Vorläuferzellen (ETPs) wandern vom Knochenmark in den Thymus, wo sie sich ausdehnen und zu funktionsfähigen T-Zellen differenzieren 1,2,4,5. Diese Prozesse werden durch eine spezialisierte Population, die Thymusepithelzellen (TECs), vermittelt2,6,7. TECs stammen von thymusepithelialen Vorläuferzellen (TEPs)8,9 und umfassen kortikale TECs (cTECs) und medulläre TECs (mTECs), die eine spezifische Rolle bei der Schaffung der spezialisierten 3D-Mikroumgebung spielen, die für die Migration, Expansion und Reifung von T-Zellen benötigt wird. TECs vermitteln die Entwicklung von T-Zellen hauptsächlich durch die Bereitstellung von Wachstums- und Differenzierungsfaktoren 1,10,11 und durch die negative Selektion nicht-funktioneller und nicht-toleranter Thymozyten durch die Präsentation von Selbstantigenen 5,7,12. Die komplexen Wechselwirkungen zwischen sich entwickelnden T-Zellen und TECs spielen auch eine zentrale Rolle bei der Reifung und 3D-Organisation der TEC-Populationen in einem Prozess, der als thymusischer Crosstalk bekannt ist 1,11. Die Wechselwirkungen zwischen den Zellpopulationen des Thymus hängen stark von der spezifischen Mikroumgebung ab, die von der extrazellulären Matrix (EZM) geformt wird. Die Thymus-EZM befindet sich in einem Zustand dynamischer Reziprozität mit Thymuszellpopulationen, beeinflusst die Genregulation und wird im Gegenzug durch die Sekretion von Enzymen oder Matrixproteinen ständig umgeformt13. Die EZM beeinflusst Zellen durch Modifikation der Bioverfügbarkeit von Wachstumsfaktoren und Zytokinen, direkte Signalisierung durch membrangebundene Rezeptoren wie Integrine und durch Formung von Zytoskeletten durch physikalische Kräfte14. Es wurde gezeigt, dass Thymus-ECM-Komponenten wie Kollagene und Laminin eine hohe Affinität zu den Wachstumsfaktoren TGFb und FGFs aufweisen, die für die Aufrechterhaltung der TEC entscheidend sind und um sie durch die Bildung von Komplexen zu fixieren. Die Plastizität, der Elastizitätsmodul und die Dichte der Thymus-EZM spielen ebenfalls eine entscheidende Rolle bei der Instruktion des TEC-Schicksals und der Gestaltung der Kompartimentierung des Thymus, die für seine Funktionalität unerlässlich ist. Diese Hinweise unterstreichen, wie wichtig es ist, die ECM und ihre 3D-Struktur zu berücksichtigen, um den Thymus ex vivo nachzuahmen. Dieser Punkt wird durch die Tatsache unterstützt, dass primäre TECs schnell dedifferenzieren, ihre Funktionalität verlieren und schließlich absterben, wenn sie in klassischen Zellkultur-Setups kultiviert werden 15,16,17.
Es wurden Kulturmodelle entwickelt, um funktionelle TEC-Populationen aus humanen Thymusexplantaten zu erweitern, um die Struktur der EZM und die entscheidenden Hinweise, die sie für die TECs liefert, zu konservieren 18,19,20. Dieses Kultursystem war in der Lage, eine Population von funktionellen TECs in vitro erfolgreich zu erweitern und zu erhalten, konnte aber nicht über 7 bis 8 Tage Kultur aufrechterhalten werden18. Daher ist die Entwicklung eines zugänglichen, praktischen 3D-Kultursystems, das in der Lage ist, die Thymus-Mikroumgebung und ihre Funktionalität in vitro und langfristig zu reproduzieren, ein entscheidendes Anliegen in diesem Bereich. In jüngster Zeit hat die Entwicklung von Hydrogel-basierten 3D-Kultursystemen zur Entstehung mehrerer künstlicher Thymus-Organoidsysteme geführt, die einen großen Fortschritt für die In-vitro-Thymusmodellierung darstellen 15,16,21,22. Wir haben ein humanes thymusisches Organoid (hTO) Co-Kultursystem entwickelt, indem wir humane primäre ETPs mit humanen TEPs, die aus induzierten pluripotenten Stammzellen (iPSC) gewonnen wurden, zu Sphäroiden reaggregiert und auf einem Fibrinhydrogel ausgesiedelt haben.
Die Wahl des Materials und des Hydrogel-Aufbaus in dieser Studie zielte darauf ab, die native Struktur der Thymus-EZM zu reproduzieren und gleichzeitig die Praktikabilität und die Möglichkeit zu erhalten, den Prozess zu skalieren, um eine erschwingliche und reichhaltige Materialquelle für Experimente zu erhalten15. Dieses hTO-System zeigt ein Multilineage-Differenzierungspotenzial und kann eine produktive Thymopoese aus ETPsunterstützen 23. Dieses Organoidsystem stellt ein zuverlässiges Werkzeug für die Untersuchung intrathymer zellulärer Wechselwirkungen und die Modellierung der normalen und pathologischen menschlichen Lymphopoese dar. Durch die Verwendung von iPS-Zellen werden auch Gen-Editing-Funktionen in das Modell eingeführt. Die effektive Differenzierung von iPSC in funktionelles Thymusgewebe war in den letzten 15 Jahren ein langjähriges Ziel dieses Feldes, und bei der Entschlüsselung der Schicksalssignalisierung der TEC-Linie wurden signifikante Fortschritte erzielt 21,24,25,26,27. Um dem Bedarf an einem solchen In-vitro-3D-Thymusmodell gerecht zu werden, beschreibt dieser technische Hinweis die Methoden und technischen Details für die schrittweise Erzeugung von iPSC-abgeleiteten menschlichen Thymus-Organoiden, wobei der Schwerpunkt auf der Bildung von Hydrogel-Gerüsten, der Reaggregation und Aussaat von Zellmikromassen sowie der Organoidkultur und -ernte liegt.
Protokoll
Die hiPSC-Linie hiN.Fm.m.Lon71.019 wurde aus männlichen adulten Fibroblasten erzeugt und mittels mRNA-Transfektion reprogrammiert. Die hiPSC-Linie hiN.Fm.f.Lon80.002 wurde aus weiblichen adulten Fibroblasten erzeugt und mittels mRNA-Transfektion reprogrammiert. Die hiPSC-Linie hiN.Fs.f.MIPS203.003 wurde aus weiblichen adulten Fibroblasten erzeugt und über eine rekombinante Sendai-Virusvektorinfektion reprogrammiert. Alle Zelllinien wurden von der iPSC-Plattform in Nantes bereitgestellt. Die Patienten gaben eine Einverständniserklärung zur Verwendung ihrer Zellen für Forschungszwecke (anonymisierte Sammlung, Lonza, Kat # CC-2511). Primäre ETPs werden durch Dissoziation von postnatalen humanen Thymusproben isoliert, die als anonymisierte entsorgte Abfälle von Patienten gewonnen werden, die sich am selben Tag im Krankenhaus von Nantes (CHU Nantes) einer Kinderherzoperation unterziehen, in Übereinstimmung mit der französischen CODECOH-Verordnung unter Deklaration DC-2017-2987.
1. Gerichtete Differenzierung von iPSCs hin zu einer TEP-Identität
HINWEIS: Seit den ersten von Lai und Jin veröffentlichten Arbeiten, die die Differenzierung von murinen embryonalen Stammzellen (EScs) in Richtung einer thymusepithelialen Identität demonstrieren28, haben mehrere Studien Protokolle entwickelt und optimiert, die die gerichtete Differenzierung von humanen iPS-Zellen zu einer TEP-Identität beschreiben 21,24,25,26,27,29. Diese Studien führten zur Differenzierung von TEPs, die thymusepitheliale Identitätsmarker wie FOXN1 und PAX9exprimieren 24,25,28,30 sowie von Funktionalitätsmarkern wie DLL4 und AIRE26, denen jedoch TEC-Reifungsmarker fehlen24,25. Es wurde gezeigt, dass zwei Ansätze die Reifung der differenzierten TEPs zu einer ausgereiften TEC-Identität unterstützen: die Transplantation in ein In-vivo-Modell wie Mäuse29 und die Reaggregation in 3D-Thymus-Organoidsysteme, die in einem Luft-Flüssigkeits-Grenzflächenaufbau kultiviert wurden21. Beide Systeme haben gezeigt, dass die 3D-Struktur eine entscheidende Rolle bei der Aufrechterhaltung und Unterstützung der Reifung funktioneller TEC-Populationen spielt, die in vivo oder in vitro in der Lage sind, die T-Lymphopoese in vivo oder in vitro zu unterstützen 15,24,25,31.
- Für das in dieser Studie verwendete thymusische Organoidsystem führen Sie die Differenzierung der iPS-Zellen in Richtung einer TEP-Identität nach einem Protokoll durch, das in Provin et al.23 entwickelt und detailliert beschrieben wurde.
2. Isolierung von primären ETPs aus einer pädiatrischen Thymusprobe
HINWEIS: ETPs sind aus dem Knochenmark stammende Vorläuferzellen, aus denen die T-Zell-Linie und dendritische Zellen im Thymus hervorgehen und den folgenden Phänotyp aufweisen: CD3- CD4- CD8- CD14- CD19- CD56- CD45+ CD34+ CD7+32,33.
- Vorbereitung der Verarmungskügelchen
- Übertragen Sie am Vortag die magnetischen Zellisolationskügelchen (Materialtabelle) in ein 15-ml-Röhrchen und waschen Sie sie mit 4 mL Isolationspuffer (PBS + 0,1 % BSA + 2 mM EDTA).
- Legen Sie das Röhrchen in den Magnetständer, entfernen Sie den Überstand und fügen Sie 2 ml Isolationspuffer hinzu.
- Geben Sie Maus-Anti-Human-CD3-, CD4- und CD8-Antikörper zu den Kügelchen und inkubieren Sie sie 45 Minuten lang bei 4 °C unter Rührung. Legen Sie das Röhrchen in den Magnetständer, waschen Sie es mehrmals in Isolationspuffer und suspendieren Sie es wieder in 20 ml Isolationspuffer.
- Dissoziation der Thymusprobe
- Frische Thymusproben in eine mit RPMI1640 gefüllte Petrischale geben (Table of Materials). Schneiden Sie es mit einer sterilen Sezierschere und einer Zange in ca.1 mm 3 große Stücke.
- Spülen Sie das Medium und die Fragmente mit einer 25-ml-Pipette mehrmals (das Medium sollte trüb werden), lassen Sie die Fragmente dann sedimentieren und sammeln Sie die Hälfte des Mediums in einem 50-ml-Röhrchen. Fügen Sie mehr Medium hinzu und wiederholen Sie den Vorgang, bis das Medium klar bleibt.
- Sammeln Sie das Medium in so viele 50-ml-Röhrchen wie nötig und drehen Sie die Röhrchen 5 Minuten lang bei 200 x g .
- Entfernen Sie den Überstand und resuspendieren Sie die Pellets in 10 ml Lyselösung für rote Blutkörperchen (Materialtabelle). 5 Minuten bei Raumtemperatur (RT) inkubieren und 20 ml Waschpuffer (PBS + 0,5 % BSA + 4 mM EDTA + 1 % Penicillin/Streptomycin) hinzufügen.
- Bei 200 x g 5 min schleudern und den Überstand entfernen. Resuspendieren Sie die Pellets in 10 mL Waschpuffer, seihen Sie sie durch einen 70-μm-Maschenfilter und zählen Sie die Zellen.
- ETP-Anreicherung
- Nachdem Sie die Zellen gezählt haben, stellen Sie das Volumen mit dem Waschpuffer auf 10 mL pro Röhrchen ein. Fügen Sie die erforderliche Menge an Zellisolationskügelchen hinzu (pro 200 Millionen Zellen verwenden Sie 500 μl Kügelchen in 20 mL Isolationspuffer) und inkubieren Sie bei 4 °C unter Rühren für 30 Minuten.
- Legen Sie das Röhrchen für 2 Minuten auf das Magnetstativ und sammeln Sie den Überstand vorsichtig in einem sauberen Röhrchen. Entfernen Sie das Röhrchen und reinigen Sie die Kügelchen mit 20 ml Isolationspuffer. Wirbeln Sie das Röhrchen ein, setzen Sie es wieder auf den Magnetständer und sammeln Sie den Überstand. Wiederholen Sie diesen Schritt zweimal.
- Die Überstände bei 200 x g 5 min schleudern. Resuspendieren Sie die Pellets in 2 mL Isolationspuffer und zählen Sie die Zellen.
- ETP-Isolierung
- Stellen Sie die Konzentration auf 200 Millionen Zellen pro ml ein und sammeln Sie ein kleines Volumen als ungefärbte Kontrolle.
- Markieren Sie die Zellen mit Maus-Antikörpern gegen die humane Abstammung (Lin) (CD3, CD4, CD8, CD14, CD19, CD56), CD7 und CD34 (verwenden Sie das gleiche Fluorochrom für alle Lin-Marker). Bei 4 °C 45 min inkubieren.
- Waschen Sie die Zellen in einem gleichen Volumen Waschpuffer. Schleudern Sie die Zellen 5 Minuten lang bei 200 x g , resuspendieren Sie das Pellet in 1 ml und zählen Sie die Zellen.
- Stellen Sie das Volumen auf eine Konzentration von 50 Millionen Zellen pro mL ein und passieren Sie die Zellen durch einen 70 μm Maschenfilter.
- Fügen Sie den Viabilitätsmarker Ihrer Wahl hinzu und sortieren Sie lebende Lin-CD34+ CD7+ Zellen durch Durchflusszytometrie mit einer 70 μm Düse.
3. 3D Thymus-Organoid-Kultur
- TEP-Vorbereitung
- Kontrollieren Sie unmittelbar nach der ETP-Isolierung die Qualität der TEP-Kultur an den Tagen 13-15. Stellen Sie sicher, dass die Zellen die Konfluenz erreichen und eine dichte Monoschicht mit Wölbungen bilden (Abbildung 1).
- Um die differenzierten TEPs zu ernten, waschen Sie die Zellen mit DPBS-/-, entfernen Sie es, fügen Sie 1 mL TrypLE (Table of Materials) pro Vertiefung hinzu und inkubieren Sie bei 37 °C für 5-7 min.
- Fügen Sie 1 ml XVIVO10 (Materialtabelle) pro Vertiefung hinzu, spülen Sie mehrmals, um die Zellen zu lösen, geben Sie es in ein 15-ml-Röhrchen und schleudern Sie es 5 Minuten lang bei 200 x g .
- Entfernen Sie den Überstand, resuspendieren Sie das Pellet in 1 ml XVIVO10 und zählen Sie die Zellen.
HINWEIS: Um die Wirksamkeit der Differenzierung im Voraus zu beurteilen, verwenden Sie eine Kulturvertiefung separat und überprüfen Sie die Expression von FOXN1 und PAX9 durch RT-qPCR und die Differenzierungsausbeute durch Durchflusszytometrie (berechnet als Anteil von EPCAM+ CD205+-Zellen, der über 50 % liegen sollte) (Abbildung 1). In diesem Stadium der Differenzierung sind fast alle EPCAM+-Zellen auch positiv für CD205, was ihre Vorläuferidentität bestätigt11.
- ETP-Vorbereitung
- Unmittelbar nach der ETP-Isolierung das Sammelröhrchen bei 200 x g für 5 min drehen. Resuspendieren Sie das Pellet in 1 ml XVIVO10 und zählen Sie die Zellen.
- Aggregation von Thymus-Organoiden
- Pipettieren Sie die geeigneten Volumina und poolen Sie beide Zellsuspensionen in einer Konzentration von 2.00.000 TEP und 40.000 ETP pro ml, pipettieren Sie zum Homogenisieren einmal vorsichtig auf und ab.
- Fügen Sie die geeigneten Zusätze gemäß Tabelle 1 hinzu und plattieren Sie 100 μl der gemischten Zellsuspension pro Vertiefung in niedrig bindenden U-Bodenplatten mit 96 Vertiefungen. Verwenden Sie eine Mehrkanalpipette für eine höhere Leistung. Eine klassische Ein-Spitzen-Pipette begrenzt jedoch den Verlust von Volumen wertvoller Zellen. Die Platten über Nacht bei 37 °C und 5 % CO2 inkubieren.
- Vorbereitung der Hydrogele
HINWEIS: Der Versuchsaufbau, der für die Hydrogelbildung, die Aussaat von Organoiden und die Verteilung des Kulturmediums verwendet wird, ist in Abbildung 2 dargestellt.- Am nächsten Tag (Tag 1 der Organoidkulturphase) tauen Sie die Aliquots von Thrombin (10 U/ml), Aprotinin (26.000 U/ml) und Fibrinogen (8 mg/ml) auf (Tabelle der Materialien). Thrombin und Aprotinin auf Eis und das Fibrinogen in einem 37 °C warmen Wasserbad auftauen (nicht auf Eis legen, da es ausfällt). Nicht vortexen, sondern die Aliquoten unter die Haube legen und durch schonendes Pipettieren homogenisieren.
- Bereiten Sie so viele hängende Einsätze vor, wie für die Anzahl der produzierten Organoide erforderlich sind, und zwar gemäß den in Tabelle 2 dargestellten Verhältnissen. Setzen Sie die Einsätze mit einer sterilen Zange in die Kulturvertiefungen ein und lassen Sie mindestens eine Spalte oder Reihe in der Kulturplatte leer.
- Bereiten Sie so viele 1,5-ml-Röhrchen vor, wie Gele gegossen werden sollen. Pipettieren Sie in jedem Röhrchen zuerst die erforderlichen Mengen an Fibrinogen und Aprotinin, wie in Tabelle 2 beschrieben.
- Geben Sie in einem zweiten Mal das erforderliche Thrombinvolumen in ein einzelnes Röhrchen, spülen Sie schnell 2 Mal, ohne Blasen zu bilden, um die Reagenzien zu homogenisieren, ziehen Sie dann den gesamten Inhalt des Röhrchens und spülen Sie die Mischung schnell in den hängenden Einsatz. Positionieren Sie die Pipette senkrecht über der Mitte des Einsatzes und spülen Sie die Reagenzmischung vorsichtig aus, ohne Blasen zu erzeugen.
HINWEIS: Bei diesem Schritt ist die Geschwindigkeit der Ausführung entscheidend, da die Reagenzien in wenigen Sekunden polymerisieren und es wichtig ist, sie richtig zu mischen, um die Bildung von Klumpen oder ungleichmäßiger Dichte im Gel zu vermeiden. Gehen Sie nacheinander mit einem anderen 1,5-ml-Röhrchen für jede Vertiefung vor (wenn ein Röhrchen für mehrere Vertiefungen wiederverwendet wird, können verbleibende feste Gelklumpen die Spitze der Pipette verstopfen). Wenn die Polymerisation aufgrund der hohen Aktivität des Thrombin zu schnell erfolgt, verwenden Sie eine 1:2-Verdünnung. Unmittelbar nach dem Gießen müssen die Gele transparent bis leicht durchscheinend sein und auch bei vertikalem Kippen der Platte nach einigen Sekunden noch fließen. - Mindestens 1 h bei 37 °C inkubieren, bis die transparente Lösung erstarrt und undurchsichtig weiß wird und die Gele fest an Ort und Stelle bleiben, wenn die Platte vertikal gekippt wird (Abbildung 2A).
- Organoid-Aussaat
- Überprüfen Sie die Qualität des Aggregationsschritts. Stellen Sie sicher, dass die Mikromassen kugelförmige Zellmassen bilden, mit einem kompakten Kern, der von einem Halo aus ETPs mit geringerer Dichte umgeben ist (Abbildung 3).
- Schneiden Sie die Spitze eines P200-Kegels ab und waschen Sie ihn mit einer Antihaftlösung (Materialtabelle). Um die Zellmassen zu ernten, kippen Sie die Platte in eine nahezu vertikale Position: Die Mikromassen sinken an die untere Wand der Vertiefungen und können leicht zurückgewonnen werden, indem die Pipettenspitze während des Aspirierens schrittweise auf den Boden der Vertiefung gedrückt wird.
- Säen Sie die Masse an der Oberseite der Hydrogele aus, indem Sie sie vorsichtig ablegen, ohne das Gel mit der Pipettenspitze zu berühren, und zwar gemäß den in Tabelle 1 (Abbildung 2B) dargestellten Verhältnissen. Selbst wenn Organoide in diesem Stadium frei schwebend erscheinen, wird das Gel weich, wenn es mit Nährboden aufgequollen wird, und die Organoide schmiegen sich in die obere Schicht ein. Überprüfen Sie unter dem Mikroskop, ob sich kein Organoid mehr in den P96-Vertiefungen befindet.
- Bereiten Sie das erforderliche Volumen des Kulturmediums gemäß Tabelle 1 und Tabelle 2 vor und fügen Sie in jeder Vertiefung langsam ein Viertel des Volumens an der Oberseite der Hydrogele hinzu, ohne sie zu berühren, indem Sie entlang der Einsatzwände und die restlichen drei Viertel am Boden der Vertiefung pipettieren, indem Sie die Pipette zwischen den Armen des hängenden Einsatzes positionieren (Abbildung 2C).
- Geben Sie 1 ml PBS in die leeren Kulturvertiefungen, um die Feuchtigkeit in der Platte aufrechtzuerhalten. Bei 37 °C und 5 % CO2 inkubieren.
- Kultur von Thymus-Organoiden
- Überprüfen Sie an Tag 2, ob die Organoide gut ausgesät sind: Die Hydrogele müssen an Ort und Stelle geblieben sein und die Organoide dürfen sich nicht am Boden des Einsatzes abgesetzt haben.
- Bereiten Sie die erforderliche Menge an Nährmedium gemäß Tabelle 1 und Tabelle 2 vor. Entfernen Sie das Medium, indem Sie die Spitze des Aspirationskegels zwischen die Arme des hängenden Einsatzes richten und darauf achten, das Gel nicht zu berühren. Fügen Sie das neue Medium hinzu, indem Sie die Pipette auf die gleiche Weise positionieren.
- Wechseln Sie das Medium alle 2 Tage und wechseln Sie nach 2 bis 4 Tagen (am 18. Tag nach Beginn der TEP-Differenzierung) zum Medium der zweiten Phase (Tabelle 1).
HINWEIS: Die Organoid-Charge kann auf diese Weise bis zu 6 Wochen in Kultur aufbewahrt werden.
- Organoid-Ernte
- Bereiten Sie ein 15-ml-Röhrchen mit 1 ml TrypLE pro Vertiefung für die Ernte vor.
- Schneiden Sie die Spitze eines P1000-Kegels ab und beschichten Sie ihn mit einer Antihaftlösung. Pipettieren Sie das Gel vorsichtig, indem Sie die Pipettenspitze senkrecht in die Mitte der Einsätze legen (achten Sie darauf, die Membran nicht zu perforieren) und geben Sie es in das TrypLE-Röhrchen. Waschen Sie die Membran des Einsatzes mit TrypLE und geben Sie sie ebenfalls auf die Tube.
- 15 Minuten lang bei 37 °C inkubieren und in Abständen von 5 Minuten sanft vortexen. Stellen Sie sicher, dass die Gele und Organoide dissoziieren.
- Nach 15 min auf einen 70 μm Maschenfilter abseihen und 5 min bei 200 x g schleudern. Resuspendieren Sie das Pellet im Waschpuffer und fahren Sie mit der Analysemethode Ihrer Wahl fort.
Repräsentative Ergebnisse
Der Arbeitsablauf des Protokolls ist in Abbildung 4 zusammengefasst. Für dieses 3D-Organoid-Kulturmodell verwendeten wir ein Thrombin- und Fibrinogen-Hydrogel, das zuvor von unserem Team verwendet worden war, um primäre mTECs der Maus für ein paar Tage aufrechtzuerhalten, dank der physikalischen und mechanischen Hinweise, die es lieferte34. Nach der Polymerisation sollte das Gel eine lockere, schwammartige Netzstruktur aufweisen (Abbildung 5).
Nach der anfänglichen Aussaat- und Anheftungsphase wuchsen und entwickelten sich die Organoide nach und nach sowohl an der Oberfläche als auch in den obersten Schichten des Gels. Abhängig von den Eigenschaften des Gels, den Aussaatbedingungen und der Anzahl der auf dem Gel ausgesäten Organoide bildeten die Organoide kugelförmige bis längliche Strukturen (Abbildung 6) und verschmolzen gelegentlich zu größeren Strukturen. Nach der ersten Kulturwoche wurden innerhalb der Organoide zwei bestimmte Unterebenen der Organisation beobachtet: Zunächst beobachteten wir lange, zelloberflächenprojektionsähnliche Strukturen, die von großen Zellen gebildet wurden, die von den Organoiden bestrahlt wurden und das Hydrogel in alle Richtungen besiedelten (Abbildung 6 und Abbildung 7). Zweitens beobachteten wir clusterartige Strukturen, die von kleineren Zellen gebildet werden, die sich um diese Zellprojektionen herum konzentrieren. Obwohl wir nicht in der Lage waren, beide Zelltypen zu isolieren, um die Hypothese der Studie zu bestätigen, erinnert dieses Phänomen an 3D-Anordnungen, die im thymischen Kortex zu finden sind und durch die Interaktion einzelner cTECs mit einer großen Anzahl viel kleinerer sich entwickelnder T-Zellen gebildet werden, die als thymusische Ammenzellkomplexe bekannt sind11 (Abbildung 8).
Zu mehreren Zeitpunkten während der Organoid-Kulturphase untersuchten wir die zelluläre Zusammensetzung der Thymus-Organoide mittels Durchflusszytometrie und identifizierten mehrere Schlüsselkompartimente: TEC (charakterisiert als EPCAM+ CD45-), Thymozyten (EPCAM-CD45+ CD3+) (Abbildung 9) sowie ein EPCAM-CD45+ CD3-Kompartiment, das aus thymushämatopoetischen Nicht-Thymozyten-Untergruppen besteht. Weitere Details finden sich in Provin et al.23.
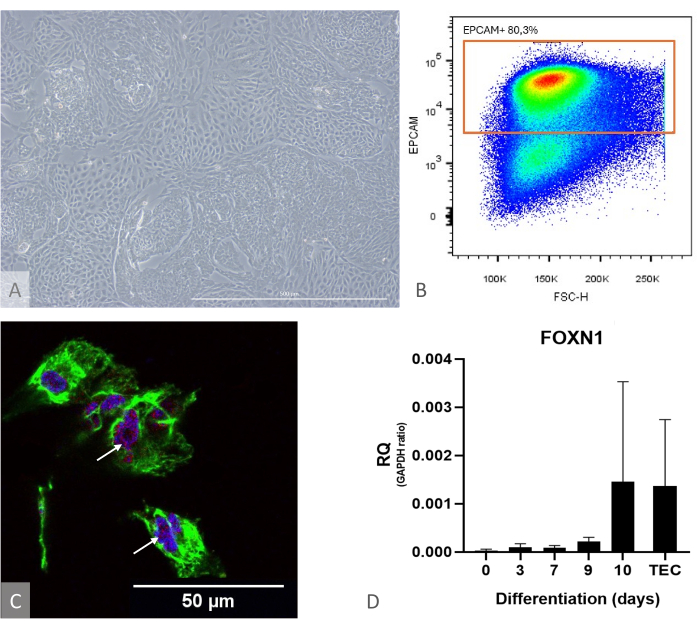
Abbildung 1: Charakterisierung der Differenzierung von iPSC zu TEP. (A) Beispiel für eine Differenzierung von iPSC zu TEP am D13, inverses Phasenkontrastmikroskop, 400x. Maßstabsbalken: 500 μm. (B) Beispiel für ein Dotplot, das Verhältnis von EPCAM+-Zellen zu DAPI-Zellen am Tag 14 der Differenzierung, Bild von FlowJo 10.0.7. (C) Immunfärbung gegen DAPI (blau), PAX9 (rot) und KRT8 (grün), Immunfluoreszenz und konfokale Bildgebung am Tag 16 der Differenzierung von iPSC zu TEP. Weiße Pfeile zeigen auf Beispiele für Anti-PAX9-Färbungen. Skalenbalken: 50 μm (D) Expressionsniveau von FOXN1 (RQ bis GAPDH) während der Differenzierung von iPS zu TEP. TEC: Positivkontrollreferenz, primäre humane TECs, die aus pädiatrischen Thymusproben isoliert wurden. Diagramm von Prism (GraphPad Version 8.0.1). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
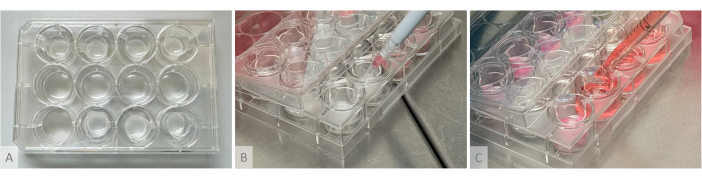
Abbildung 2: Versuchsaufbau für die Hydrogelbildung, die Aussaat von Organoiden und die Verteilung des Kulturmediums. (A) Kulturplatte mit Hydrogelen, die in hängende Einsätze gegossen werden, die in der oberen und unteren Reihe platziert sind. (B) Organoid-Aussaat: Der geschnittene Pipettenkegel, der 1 Organoid enthält, wird über das Hydrogel gelegt, ohne es zu berühren, und das Organoid wird vorsichtig an der Oberfläche des Gels ausgesät. (C) Das Nährmedium wird in die Kulturvertiefung eingebracht, indem die Spitze der Pipette zwischen den Armen des hängenden Einsatzes positioniert wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
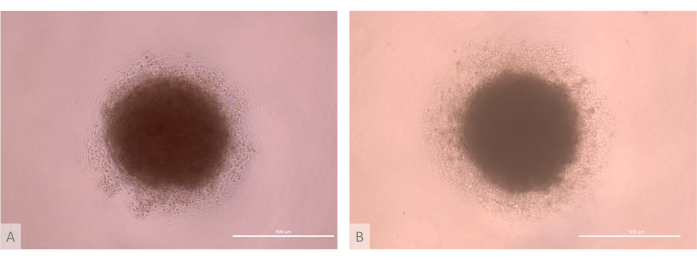
Abbildung 3: D0 der Thymus-Organoidkultur vor der Aussaat (Tage 13-15 des vollständigen Protokolls). (A) Organoid, das mit TECs hergestellt wurde, die von der Lon71.019 iPS-Linie abgeleitet sind. (B) Organoid, hergestellt mit TECs, die von der iPS-Linie MIPS203,003 abgeleitet sind. Inverses Phasenkontrastmikroskop, 1000x. Maßstabsleisten: 500 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
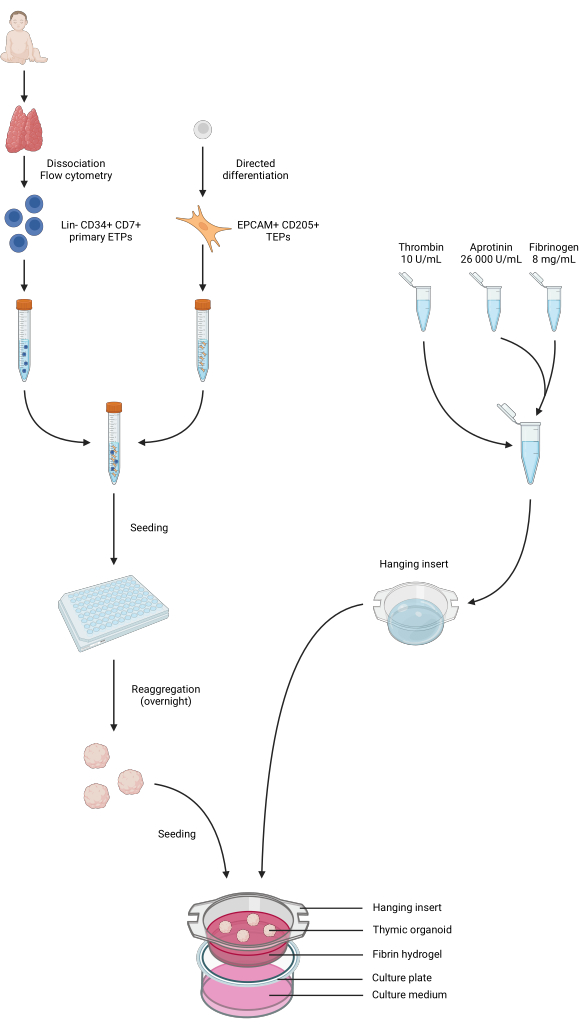
Abbildung 4: Zusammengefasste Darstellung aller Schritte des Protokolls. Pädiatrische Thymusproben wurden entnommen und dissoziiert, und primäre Lin-CD34+ CD7+ ETPs wurden mittels Durchflusszytometrie sortiert. Die Differenzierung der iPS-Zellen erfolgte in Richtung einer TEP-Identität. ETPs und iPS-abgeleitete TEPs wurden gepoolt und in 96-Well-Platten mit geringer Bindung ausgesät und über Nacht zu Thymus-Organoiden aggregiert. Fibrin-Hydrogele wurden aus Aprotinin, Fibrinogen und Thrombin hergestellt und in hängende Einsätze gegossen. Nach der Polymerisation wurden die Organoide auf die Hydrogele ausgesät und das Phase-1-Kulturmedium in die Vertiefungen gegeben. Die Organoide wurden bis zu 6 Wochen in Kultur gehalten. Erstellt in BioRender, Veröffentlichungslizenz AG26EFCZOM. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
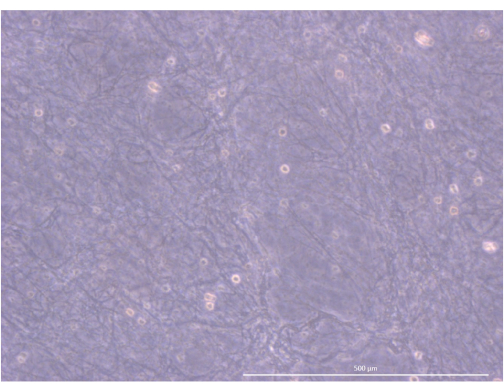
Abbildung 5: Organisation und Struktur des Hydrogels. Inverses Phasenkontrastmikroskop, 1000x. Maßstab: 500 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
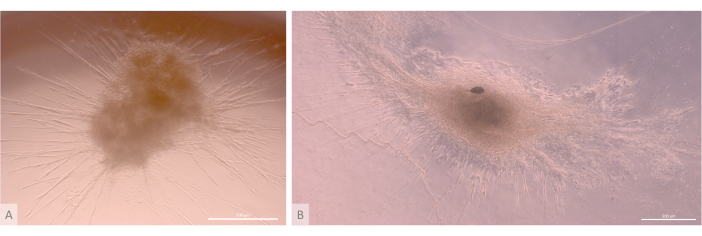
Abbildung 6: Reife Organoide und dreidimensionale Struktur. (A) Thymus-Organoid am Tag 24 der 3D-Kultur, MIPS203,003 iPS-Linie. (B) Kompositbild eines Thymus-Organoids am Tag 32 der 3D-Kultur, Lon71.019 iPS-Linie. Inverses Phasenkontrastmikroskop. Maßstabsleisten: 500 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
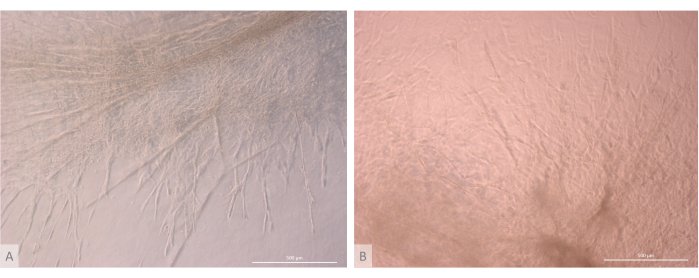
Abbildung 7: Strukturdetail von Thymus-Organoiden. (A) Thymus-Organoid am Tag 32 der 3D-Kultur, L71.019 iPS-Linie. (B) Thymus-Organoid am Tag 27 der 3D-Kultur, L80.002 iPS-Linie. Inverses Phasenkontrastmikroskop, 400x. Maßstabsleisten: 500 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
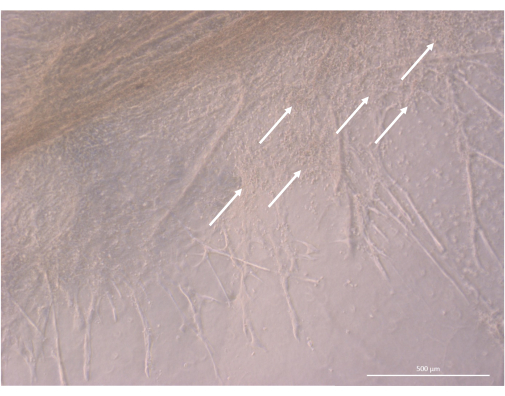
Abbildung 8: Strukturdetail eines Thymus-Organoids am Tag 32 der 3D-Kultur. Weiße Pfeile zeigen auf Cluster kleiner Thymozyten, die sich in unmittelbarer Nähe der TEC-Zellen vermehren. Inverses Phasenkontrastmikroskop, 400x. Maßstab: 500 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
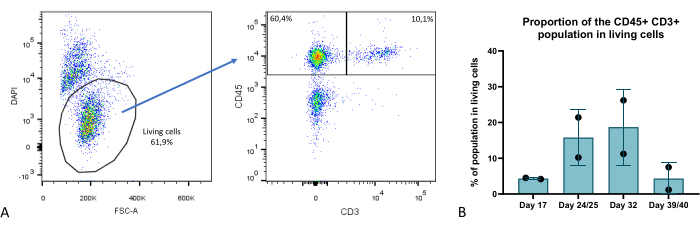
Abbildung 9: Anteil des T-Zell-Kompartiments innerhalb von Thymus-Organoiden. (A) Dotplot-Beispiel, Anteil von CD45+ CD3+ Zellen in lebenden (DAPI-) Zellen in Thymus-Organoiden am Tag 35 der 3D-Kultur, Bild von FlowJo 10.0.7. Die CD45+ CD3-Fraktion besteht aus hämatopoetischen Nicht-Thymozytenzellen. (B) Der Anteil von CD45+ CD3+-Zellen in lebenden Zellen in Thymus-Organoiden an den Tagen 17, 24/25, 32 und 39/40 der 3D-Kultur, n=2 in technischem Duplikat oder Triple-Plikat, Grafik von Prism (GraphPad Version 8.0.1). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Einheit | Phase 1 mittel Tag 14 bis Tag 18 | Phase 2 mittel ab Tag 19 | |
| Basis | XVIVO10 | XVIVO10 | |
| BMP4 | ng/mL | 50 | |
| FGF8 | ng/mL | 10 | |
| FGF10 | ng/mL | 10 | |
| IGF1 | ng/mL | 10 | |
| EGF | ng/mL | 10 | |
| RANG L | ng/mL | 50 | 50 |
| IL7 | ng/mL | 5 | 5 |
| FLT3 L | ng/mL | 5 | 5 |
| SCF | ng/mL | 10 | 10 |
| Glutamax | ng/mL | 1% | 1% |
Tabelle 1: Nahrungsergänzungsmittel und ihre jeweiligen Konzentrationen.
| Aprotinin (μL) | Thrombin (μL) | Fibrinogen (μL) | Phase 1 mittel | Organoide (Einheit) | |
| 24-Well-Platte | 5 | 75 | 75 | 1 | 3 bis 5 |
| 12-Well-Platte | 9.2 | 138.2 | 138.2 | 1.8 | 5 |
| 6-Well-Platte | 16 | 240.8 | 240.8 | 3.2 | 8 bis 9 |
Tabelle 2: Erforderliche Verhältnisse von Komponenten für die Herstellung von Hydrogelen und die Aussaat von Organoiden in 6-, 12- und 24-Well-Platten.
Diskussion
Im Vergleich zur klassischen Monolayer-Kultur in 2D oder noch fortschrittlicheren 3D-Modellen wie RTOC (Reaggregated Thymus Organ Culture) stellt das hier beschriebene Modell deutliche Verbesserungen dar. Aus technischer Sicht bietet dieses Modell eine verbesserte Skalierbarkeit und Reproduzierbarkeit, da TECs von selbsterneuernden iPS-Zellen abgeleitet werden. Es ermöglicht auch die Gen-Editierung im iPS-Stadium, um Knock-in- oder Knock-out-Studien in TECs zu erleichtern. Die Überlebensfähigkeit der in dieser Studie gezeigten Thymus-Organoide ist bemerkenswert und bietet eine signifikante Verbesserung im Vergleich zu 2D- oder RTOC-Kulturen, wobei die T-Zell-Generierung über einen Zeitraum von bis zu 6 Wochen nachgewiesen wurde (Abbildung 9). So führt die Rekonstitution der thymischen 3D-Struktur und der EZM-Eigenschaften zu einer anhaltenden Thymusfunktionalität in unseren Thymus-Organoiden, d.h. der Fähigkeit, T-Zellen aus dem reifsten Thymozytenkompartiment, den jüngsten Thymus-Emigranten, in etwa Woche 4 der 3D-Kultur zu erzeugen, wobei sowohl CD4+- als auch CD8+-T-Zellen erzeugtwurden 23.
Da die Mikroumgebung des Thymus eine intensive Expansions- und Differenzierungsaktivität unterstützt, ist der richtige Gasaustausch ein entscheidender Parameter in jedem in vitro Thymusmodell. In der Tat wurden verbesserte Ergebnisse in Modellen beobachtet, die entweder in einer angereicherten Sauerstoffatmosphäre oder an Luft-Flüssigkeits-Grenzflächen gehalten wurden21,35. Unsere Beobachtungen unterstützen diesen Punkt und unterstreichen die Bedeutung einer korrekten Organoid-Aussaat an der Spitze des Hydrogels direkt unter der Luftgrenzfläche. Defekte in der Polymerisation, die zu viskosen bis flüssigen Hydrogelen führen, führen zum Absinken von Organoiden am Boden der Einsätze und behindern deren Wachstum. Die Kokultur mit Endothelzellen auf dem Chip ist eine vielversprechende Alternative, die diese Barriere durch zusätzliche Vaskularisierung durchbrechen könnte. Die Größe der in dieser Studie hergestellten Thymus-Organoide ist auf etwa 5 mm begrenzt, angeblich aufgrund eines fehlenden Gas- und Nährstoffaustauschs in den Kernbereichen. Die Vaskularisierung würde somit ein Scale-up der Kultur ermöglichen und in Kombination mit der Prozessoptimierung die Herstellung von Organoiden ermöglichen, die Millionen von TECs und T-Zellen enthalten. Die Dichte des Hydrogels ist ebenfalls ein entscheidender Parameter, und seine Reproduzierbarkeit über Chargen hinweg ist eine der Haupteinschränkungen des Protokolls, da die Enzyme empfindlich auf Gefrier- und Auftauzyklen reagieren. Der Hydrogel-Gießschritt ist ein kritischer Schritt im Protokoll; Wir empfehlen, einen Test durchzuführen, indem ein Hydrogel 1 h vor einem geplanten Experiment gegossen wird, um die Reagenzaktivität zu überprüfen. Im Falle einer unzureichenden enzymatischen Aktivität, die zu einer Beeinträchtigung der Polymerisation führt, und angesichts der Kosten der iPSC-abgeleiteten TEPs, raten wir zu keiner anderen Fehlerbehebung, als das Protokoll mit frischen Reagenzien Aliquots neu zu starten. TECs sind wichtige Produzenten von ECM; Angesichts der jüngsten Fortschritte im Verständnis der Rolle von Thymusfibroblasten könnte es jedoch interessant sein, eine Population bestrahlter Fibroblasten in das Organoidmodell aufzunehmen. Diese Population könnte Wachstumsfaktoren und EZM sezernieren, die an der Reproduktion des thymusischen Milieus beteiligt sind, was sich positiv auf die Differenzierung und Erhaltung von TEC- und T-Zellen auswirkt. Eine weitere wichtige Einschränkung dieses Thymus-Organoid-Modells ist das Fehlen einer korrekten kortiko-medullären Segregation. Da gezeigt wurde, dass die kapselförmigen Fibroblasten des Thymus die Bildung der Hirnrinde beeinflussen, könnte ihre Ergänzung des Kulturmodells dazu beitragen, diese Einschränkung zu beheben. Damit stellt dieses Protokoll die Grundlagen für komplexe in vitro Modelle des Thymus vor. Es kombiniert die jüngsten Fortschritte auf dem Gebiet der iPS-Thymusdifferenzierung, der 3D-Hydrogel-basierten Kulturen und der In-vitro-Lymphopoese. Dieses Modell kann weiter verfeinert werden, um die Skalierbarkeit zu verbessern und seine Komplexität zu erhöhen, z. B. durch Hinzufügen von mesenchymalen und vaskulären Kompartimenten. Daraus könnten wertvolle Forschungsplattformen zur Immunität oder Anwendungen in der personalisierten T-Zell-basierten Zelltherapie entstehen.
Offenlegungen
Die Autoren erklären, dass sie keinen Interessenkonflikt haben.
Danksagungen
Wir möchten uns bei den Mitgliedern der iPSC-Kerneinrichtung in Nantes, Frankreich, unter der Leitung von Laurent David bedanken. Diese Arbeit wurde durch das JP-Rare Disease JTC2019-Programm TARID-Projekt (EJPRD19-208) unterstützt, das von der ANR (ANR-19-RAR40011-5) an M.G. finanziert wurde, durch den RFI Bioregate Grant (ThymIPS) von der Region Pays de la Loire an M.G., von der ANR (ANR-22-CE15-0045) an M.G. und das Projekt "SATT Ouest Valorisation" OrgaTreg an M.G. N.P. wurde unterstützt von "la fondation d'entreprise ProGreffe". M.d.A. wurde unterstützt von der "Fondation pour la Recherche Médicale". Wir danken der iPSC-Kerneinrichtung in Nantes, unterstützt von IBiSA und Biogenouest, für die Nutzung ihrer Ressourcen und ihrer technischen Unterstützung. Diese Arbeit wurde teilweise durch das Labex IGO-Programm finanziert, das von der Nationalen Forschungsagentur über die Investition des Zukunftsprogramms ANR-11-LABX-0016-01 unterstützt wurde.
Materialien
| Name | Company | Catalog Number | Comments |
| Aprotinin | Sigma Aldrich | 616370 | |
| BMP4 | Miltenyi | 130-111-165 | |
| CCR7 (CD197) | BD Biosciences | PE | Clone: 3D12; Dilution: 1: 200 |
| CD14 | BD Biosciences | FITC | Clone: M5E2; Dilution: 1: 200 |
| CD19 | BD Biosciences | PE | Clone: HIB19; Dilution: 1: 200 |
| CD205 | BioLegend | FITC | Clone: MG38; Dilution: 1: 200 |
| CD3 | BD Biosciences | PE | Clone: HIT3a; Dilution: 1: 200 |
| CD34 | BD Biosciences | FITC | Clone: 8G12; Dilution: 1: 100 |
| CD4 | BD Biosciences | PE | Clone: RPA-T4; Dilution: 1: 100 |
| CD4 | BD Biosciences | BV711 | Clone: L200; Dilution: 1: 200 |
| CD45 | BD Biosciences | PerCP | Clone: HI30; Dilution: 1: 200 |
| CD56 | BD Biosciences | PE | Clone: B159; Dilution: 1: 200 |
| CD62L | BD Biosciences | BV605 | Clone: DREG-56; Dilution: 1: 200 |
| CD69 | BD Biosciences | BV510 | Clone: FN50; Dilution: 1: 200 |
| CD7 | BD Biosciences | APC | Clone: M-T701; Dilution: 1: 200 |
| CD8 | BD Biosciences | PeCy7 | Clone: RPA-T8; Dilution: 1: 200 |
| CD8 | BD Biosciences | PE | Clone: HIT8a; Dilution: 1: 200 |
| Dynabeads Pan Mouse IgG | Invitrogen | 11041 | |
| EGF | Miltenyi | 130-097-751 | |
| EPCAM (CD326) | BD Biosciences | PE | Clone: HEA-125; Dilution: 1: 200 |
| EPCAM (CD326) | Miltenyi | BV711 | Clone: EBA-1; Dilution: 1: 200 |
| FGF10 | Miltenyi | 130-127-858 | |
| FGF8 | Biotechne R&D | 423-F8 | |
| Fibrinogen | Sigma Aldrich | 341578 | |
| FLT3 L | Peprotech | AF-300-19 | |
| Glutamax | Gibco | 35050-61 | |
| IGF1 | Miltenyi | 130-093-886 | |
| IL7 | Peprotech | AF-200-07 | |
| RANK L | Biotechne R&D | 6449-TEC | |
| Red blood cell lysis solution | Miltenyi | 130-094-183 | |
| RPMI1640 | Gibco | 11875093 | |
| SCF | Peprotech | AF-300-07 | |
| Thrombin | Sigma Aldrich | 605190 | |
| TrypLE | Gibco | 2605010 | |
| XVIVO10 | Lonza | LONBE04-380Q |
Referenzen
- Starr, T. K., Jameson, S. C., Hogquist, K. A. Positive and negative selection of T cells. Annu Rev Immunol. 21, 139-176 (2003).
- Carpenter, A. C., Bosselut, R. Decision checkpoints in the thymus. Nat Immunol. 11 (8), 666-673 (2010).
- Miller, J. F. A. P. The function of the thymus and its impact on modern medicine. Science. 369 (6503), (2020).
- Haddad, R., et al. Dynamics of thymus-colonizing cells during human development. Immunity. 24 (2), 217-230 (2006).
- Cumano, A., et al. New molecular insights into immune cell development. Annu Rev Immunol. 37, 497-519 (2019).
- Bautista, J. L., et al. Single-cell transcriptional profiling of human thymic stroma uncovers novel cellular heterogeneity in the thymic medulla. Nat Commun. 12 (1), 1096 (2021).
- Kadouri, N., Nevo, S., Goldfarb, Y., Abramson, J. Thymic epithelial cell heterogeneity: TEC by TEC. Nat Rev Immunol. 20 (4), 239-253 (2020).
- Alves, N. L., et al. Serial progression of cortical and medullary thymic epithelial microenvironments. Eur J Immunol. 44 (1), 16-22 (2014).
- Baik, S., Jenkinson, E. J., Lane, P. J. L., Anderson, G., Jenkinson, W. E. Generation of both cortical and Aire+ medullary thymic epithelial compartments from CD205+ progenitors. Eur J Immunol. 43 (3), 589-594 (2013).
- Tavian, M., Peault, B. Embryonic development of the human hematopoietic system. Int J Dev Biol. 49 (2-3), 243-250 (2005).
- Abramson, J., Anderson, G. Thymic epithelial cells. Annu Rev Immunol. 35 (1), 85-118 (2017).
- Anderson, M. S., et al. Projection of an immunological self shadow within the thymus by the aire protein. Science. 298 (5597), 1395-1401 (2002).
- Sharma, H., Moroni, L. Recent advancements in regenerative approaches for thymus rejuvenation. Adv Sci. 8 (14), 2100543 (2021).
- Alenghat, F. J., Ingber, D. E. Mechanotransduction: all signals point to cytoskeleton, matrix, and integrins. Sci STKE. 2002 (119), 6 (2002).
- Pinto, S., Schmidt, K., Egle, S., Stark, H. -. J., Boukamp, P., Kyewski, B. An organotypic coculture model supporting proliferation and differentiation of medullary thymic epithelial cells and promiscuous gene expression. J Immunol. 190 (3), 1085-1093 (2013).
- Hun, M., Barsanti, M., Wong, K., Ramshaw, J., Werkmeister, J., Chidgey, A. P. Native thymic extracellular matrix improves in vivo thymic organoid T cell output, and drives in vitro thymic epithelial cell differentiation. Biomaterials. 118, 1-15 (2017).
- Asnaghi, M. A., et al. Thymus extracellular matrix-derived scaffolds support graft-resident thymopoiesis and long-term in vitro culture of adult thymic epithelial cells. Adv Funct Mater. 31 (20), 2010747 (2021).
- Villegas, J. A., et al. Cultured human thymic-derived cells display medullary thymic epithelial cell phenotype and functionality. Front Immunol. 9, 1663 (2018).
- Hauri-Hohl, M., Zuklys, S., Holländer, G. A., Ziegler, S. F. A regulatory role for TGF-β signaling in the establishment and function of the thymic medulla. Nat Immunol. 15 (6), 554-561 (2014).
- Campinoti, S., et al. Reconstitution of a functional human thymus by postnatal stromal progenitor cells and natural whole-organ scaffolds. Nat Commun. 11 (1), 6372 (2020).
- Ramos, S. A., et al. Generation of functional thymic organoids from human pluripotent stem cells. Stem Cell Reports. 18 (4), 829-840 (2023).
- Fan, Y., et al. Bioengineering thymus organoids to restore thymic function and induce donor-specific immune tolerance to allografts. Mol Ther. 23 (7), 1262-1277 (2015).
- Provin, N., et al. Combinatory differentiation of human induced pluripotent stem cells generates thymic epithelium that supports thymic crosstalk and directs dendritic- and CD4/CD8 T-cell full development. bioRxiv. 2023, 572664 (2023).
- Parent, A. V., et al. Generation of functional thymic epithelium from human embryonic stem cells that supports host T cell development. Cell Stem Cell. 13 (2), 219-229 (2013).
- Sun, X., et al. Directed differentiation of human embryonic stem cells into thymic epithelial progenitor-like cells reconstitutes the thymic microenvironment in vivo. Cell Stem Cell. 13 (2), 230-236 (2013).
- Inami, Y., et al. Differentiation of induced pluripotent stem cells to thymic epithelial cells by phenotype. Immunol Cell Biol. 89 (2), 314-321 (2011).
- Gras-Pena, R., et al. Human stem cell-derived thymic epithelial cells enhance human T cell development in a xenogeneic thymus. J Allergy Clin Immunol. 149 (5), 1755-1771 (2022).
- Lai, L., Jin, J. Generation of thymic epithelial cell progenitors by mouse embryonic stem cells. Stem Cells. 27 (12), 3012-3020 (2009).
- Ramos, S. A., et al. Generation of functional human thymic cells from induced pluripotent stem cells. J Allergy Clin Immunol. 149 (2), 767-781 (2022).
- Provin, N., Giraud, M. Differentiation of pluripotent stem cells into thymic epithelial cells and generation of thymic organoids: Applications for therapeutic strategies against APECED. Front Immunol. 13, 930963 (2022).
- Montel-Hagen, A., et al. In vitro recapitulation of murine thymopoiesis from single hematopoietic stem cells. Cell Rep. 33 (4), 108320 (2020).
- Park, J. -. E., et al. A cell atlas of human thymic development defines T cell repertoire formation. Science. 367 (6480), 3224 (2020).
- Flippe, L., et al. Rapid and reproducible differentiation of hematopoietic and T cell progenitors from pluripotent stem cells. Front Cell Dev Biol. 8, 577464 (2020).
- Padonou, F., et al. Aire-dependent transcripts escape Raver2-induced splice-event inclusion in the thymic epithelium. EMBO Rep. 23 (3), e53576 (2022).
- Han, J., Zúñiga-Pflücker, J. C. High-oxygen submersion fetal thymus organ cultures enable FOXN1-dependent and -independent support of T lymphopoiesis. Front Immunol. 12, 652665 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten