Hochauflösende Fluorespirometrie zur Beurteilung dynamischer Veränderungen des mitochondrialen Membranpotentials in menschlichen Immunzellen
In diesem Artikel
Zusammenfassung
Die Methoden zur Untersuchung der mitochondrialen Bioenergetik unter physiologisch relevanten Substratkonzentrationen in Immunzellen sind begrenzt. Wir stellen ein detailliertes Protokoll zur Verfügung, das hochauflösende Fluorespirometrie verwendet, um Veränderungen in der Reaktion des mitochondrialen Membranpotentials auf den Energiebedarf in menschlichen T-Zellen, Monozyten und peripheren mononukleären Zellen zu bewerten.
Zusammenfassung
Periphere mononukleäre Zellen (PBMCs) zeigen robuste Veränderungen der mitochondrialen Atmungskapazität als Reaktion auf Gesundheit und Krankheit. Obwohl diese Veränderungen nicht immer das widerspiegeln, was in anderen Geweben, wie z. B. der Skelettmuskulatur, passiert, sind diese Zellen eine zugängliche und wertvolle Quelle für lebensfähige Mitochondrien von menschlichen Probanden. PBMCs sind systemischen Signalen ausgesetzt, die sich auf ihren bioenergetischen Zustand auswirken. Daher wird die Erweiterung unserer Werkzeuge zur Untersuchung des mitochondrialen Stoffwechsels in dieser Population die Mechanismen im Zusammenhang mit dem Fortschreiten der Krankheit aufklären. Funktionelle Assays von Mitochondrien beschränken sich oft auf die Verwendung von Atemleistungen nach maximalen Substrat-, Inhibitor- und Entkopplerkonzentrationen, um den gesamten Bereich der Atmungskapazität zu bestimmen, der in vivo möglicherweise nicht erreichbar ist. Die Umwandlung von Adenosindiphosphat (ADP) in Adenosintriphosphat (ATP) durch ATP-Synthase führt zu einer Abnahme des mitochondrialen Membranpotentials (mMP) und einer Erhöhung des Sauerstoffverbrauchs. Um eine umfassendere Analyse der mitochondrialen Dynamik zu ermöglichen, wird in diesem Artikel die Verwendung hochauflösender Fluorespirometrie zur Messung der gleichzeitigen Reaktion des Sauerstoffverbrauchs und des mitochondrialen Membranpotentials (mMP) auf physiologisch relevante Konzentrationen von ADP beschrieben. Bei dieser Technik wird Tetramethylrhodaminmethylester (TMRM) verwendet, um die mMP-Polarisation als Reaktion auf ADP-Titrationen nach maximaler Hyperpolarisation mit komplexen I- und II-Substraten zu messen. Diese Technik kann verwendet werden, um zu quantifizieren, wie sich Veränderungen des Gesundheitszustands, wie z. B. Alterung und Stoffwechselerkrankungen, auf die Empfindlichkeit der mitochondrialen Reaktion auf den Energiebedarf in PBMCs, T-Zellen und Monozyten von menschlichen Probanden auswirken.
Einleitung
Die Fähigkeit einer Zelle, in einer Zeit physiologischen Stresses zu funktionieren und zu überleben, hängt weitgehend von ihrer Fähigkeit ab, den energetischen Bedarf zur Wiederherstellung der Homöostase zu decken 1,2. Der Energiebedarf steigt als Reaktion auf eine Vielzahl von Reizen. Zum Beispiel erhöht eine erhöhte Muskelkontraktion während des Trainings die Verwertung von ATP und Glukose durch die Skelettmuskulatur, und ein Anstieg der Proteinsynthese nach einer Infektion erhöht die Verwertung von ATP durch Immunzellen für die Zytokinproduktion und -proliferation 3,4,5,6. Ein Anstieg des Energiebedarfs löst eine Reihe von bioenergetischen Prozessen aus, um das ATP/ADP-Verhältnis wiederherzustellen. Wenn ATP verbraucht wird, steigt der ADP-Spiegel an und stimuliert die F1F0 ATP-Synthase (Komplex V), die eine protonenmotorische Kraft benötigt, um ihre mechanische Rotation und katalytische Umwandlung von ADP in ATP im Mitochondrium7 anzutreiben. Die protonentreibende Kraft ist ein elektrochemischer Gradient, der durch das Pumpen von Protonen während der Übertragung von Elektronen von Substraten auf Sauerstoff durch das Elektronentransportsystem (ETS) innerhalb der inneren Mitochondrienmembran entsteht. Die daraus resultierende Differenz der Protonenkonzentration (Delta-pH) und des elektrischen Potentials (Membranpotential) erzeugt die protonentreibende Kraft, die die ATP-Synthese und den Sauerstoffverbrauch als Reaktion auf den Energiebedarf antreibt, wodurch das ATP/ADP-Verhältnis verringert oder der ADP-Spiegel erhöht wird. Die Affinität der Mitochondrien zu ADP kann durch die Berechnung des Km oder EC50 der ADP-stimulierten Atmung isolierter Mitochondrien oder permeabilisierter Zellen bestimmt werden 8,9. Diese Methode hat gezeigt, dass permeabilisierte Muskelfasern älterer Menschen eine höhere Konzentration an ADP benötigen, um 50% ihrer maximalen oxidativen Phosphorylierungskapazität zu stimulieren als die von jüngeren Probanden9. In ähnlicher Weise benötigt der alternde Skelettmuskel von Mäusen mehr ADP, um die Produktion von mitochondrialen reaktiven Sauerstoffspezies (ROS) zu senken10,11. Darüber hinaus ist die ADP-Sensitivität in permeabilisierten Muskelfasern von Mäusen mit ernährungsbedingter Adipositas im Vergleich zu Kontrollen reduziert und wird in Gegenwart von Insulin und nach Nitratkonsum erhöht12,13. Die Fähigkeit der Mitochondrien, auf den Energiebedarf zu reagieren, variiert also unter verschiedenen physiologischen Bedingungen, was jedoch bisher nicht im Zusammenhang mit Immunzellen erforscht wurde.
Mononukleäre Zellen des peripheren Blutes (PBMCs) werden häufig zur Untersuchung der zellulären Bioenergetik bei menschlichen Probanden verwendet 14,15,16,17,18,19,20. Dies ist hauptsächlich darauf zurückzuführen, dass Zellen in klinischen Studien leicht aus unkoagulierten Blutproben gewonnen werden können, auf die Reaktionsfähigkeit von Zellen auf Stoffwechselstörungen und auf die von verschiedenen Gruppen entwickelten Methoden zur Untersuchung des mitochondrialen Stoffwechsels unter Verwendung von Inhibitoren und Entkopplern zur Bestimmung der maximalen und minimalen Kapazität der mitochondrialen Atmung21,22. Diese Methoden haben zu einer Wertschätzung der Rolle der Bioenergetik beim Altern, bei Stoffwechselerkrankungen und bei der Immunfunktion geführt 14,20,23,24. Die mitochondriale Atmungskapazität ist in der Skelettmuskulatur und bei PBMCs unter Bedingungen der Herzinsuffizienz häufig reduziert18,25. PBMC-Bioenergetik korreliert auch mit kardiometabolischen Risikofaktoren bei gesunden Erwachsenen17 und spricht auf Behandlungen wie Nicotinamid-Ribosidan 18. Zu den PBMCs gehören Neutrophile, Lymphozyten (B-Zellen und T-Zellen), Monozyten, natürliche Killerzellen und dendritische Zellen, die alle zur mitochondrialen Kapazität der PBMC beitragen 26,27,28. Darüber hinaus spielt die zelluläre Bioenergetik eine entscheidende Rolle bei der Aktivierung, Proliferation und Erneuerung von Immunzellen23. Eine Einschränkung dieser Methoden besteht jedoch darin, dass die Zellen unter einem physiologischen Bereich von Substraten nicht funktionieren. Daher sind zusätzliche Methoden erforderlich, um die mitochondriale Funktion in Substratkonzentrationen zu untersuchen, die für das, was Zellen in vivo erleben, relevanter sind.
Das mitochondriale Membranpotential (mMP) ist die Hauptkomponente einer protonengetriebenen Kraft und essentiell für eine Vielzahl von mitochondrialen Prozessen über die ATP-Produktion hinaus, wie z. B. die Regulierung des Atmungsflusses, die Produktion reaktiver Sauerstoffspezies, den Protein- und Ionenimport, die Autophagie und die Apoptose. mMP kann mit elektrochemischen Sonden oder Fluoreszenzfarbstoffen bestimmt werden, die empfindlich auf Änderungen der Membranpolarisation reagieren, wie JC-1, Rhod123, DiOC6, Tetramethylrhodamin (TMRE) oder Methylester (TMRM) und Safranin. Bei den beiden letztgenannten handelt es sich um lipophile kationische Farbstoffe, die erfolgreich in der hochauflösenden Fluorespirometrie von Gewebehomogenaten, isolierten Mitochondrien und permeabilisiertem Gewebe eingesetzt wurden 11,29,30,31,32,33. Bei dieser Technik wird TMRM im Quench-Modus verwendet, bei dem die Zellen einer hohen Konzentration an TMRM ausgesetzt werden, die sich bei Polarisation (hohe mMP und protonomotorische Kraft) in der mitochondrialen Matrix ansammelt, was zu einer Abschreckung der zytosolischen TMRM-Fluoreszenz führt. Wenn Mitochondrien als Reaktion auf ADP oder Entkoppler depolarisieren, wird der Farbstoff aus der Matrix freigesetzt, wodurch das TMRM-Fluoreszenzsignalerhöht wird 34,35. Der Zweck dieser Methode besteht darin, gleichzeitig Veränderungen der mitochondrialen Atmung und der mMP als Reaktion auf ADP-Titrationen in humanen PBMCs, zirkulierenden Monozyten und T-Zellen zu messen, und sie kann auch auf Milz-T-Zellen der Maus angewendet werden.
Protokoll
Die hier vorgestellte Entnahme von Blutproben für die Daten- und Methodenentwicklung wurde vom Internal Review Board der University of Washington genehmigt. Zu den repräsentativen Ergebnissen gehören auch Daten von männlichen C57BL/6J-Mäusen (5-7 Monate alt), die von Jackson Laboratories gekauft wurden. Alle Tierversuche wurden vom Office of Animal Welfare der University of Washington genehmigt. Die Protokollübersicht ist in Abbildung 1 dargestellt. Die Vorbereitung der Reagenzien für dieses Protokoll finden Sie in der Zusatzdatei 1.
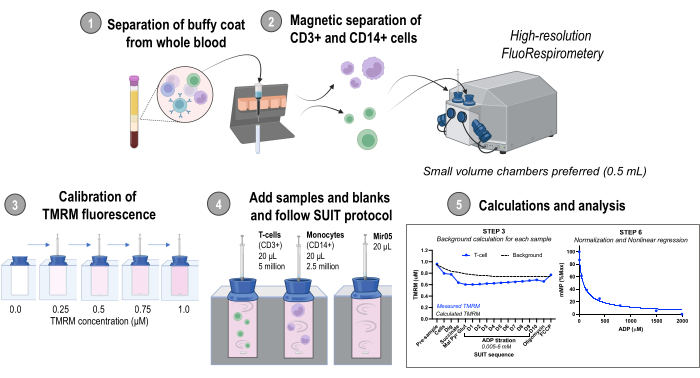
Abbildung 1: Überblick über das Protokoll. Arbeitsablauf mit hochauflösender Fluorespirometrie zur Beurteilung von Veränderungen des mitochondrialen Membranpotentials in isolierten Monozyten (CD14+) und T-Zellen (CD3+) aus frischen menschlichen Blutproben. Abkürzungen: TMRM, Tetramethylrhodaminmethylester; SUIT, Substrat-Entkoppler-Inhibitor-Titrationen; ADP, Adenosindiphosphat; Graben, Digitonin; Mal, Malat; Pyr, Pyruvat; Glut, Glutamat; D1-10, 10 aufeinanderfolgende ADP-Titrationen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
1. Trennung von Buffy Coat und Vollblut
HINWEIS: Die Zellisolierung wurde von Kramer et al.27 modifiziert.
- Lassen Sie den RPMI, den Dichtegradienten und die Zentrifuge auf Raumtemperatur bringen. Sterilisieren Sie die Biosicherheitswerkbank und die Materialien, bevor Sie beginnen.
- Entnehmen Sie venöses Blut in drei 10 mL K2EDTA-Röhrchen. Drehen Sie die Röhren mindestens 3 Mal um.
- Die Röhrchen bei 500 x g 10 min zentrifugieren (22 °C, 9 Beschleunigung [acc], 2 Verzögerung [dec]).
- Entnehmen Sie 1 ml Plasma aus jedem Röhrchen und lagern Sie es für zukünftige Analysen bei -80 °C.
- Übertragen Sie das Plasma und die Hälfte der roten Blutkörperchen aus jedem Röhrchen in ein einzelnes konisches 50-ml-Röhrchen. Fügen Sie RPMI bis zur 40-ml-Marke hinzu. Mindestens 3 Mal invertieren.
- Schichten Sie langsam 10 mL der Plasmalösung in vier konische 15-ml-Röhrchen mit 3 mL des Dichtegradienten.
- Zentrifugieren bei 700 x g für 30 min (22 °C, 5 acc, 2 dec).
- Sammeln Sie das gesamte Plasma und den Buffy Coat mit den peripheren mononukleären Zellen (PBMCs), ohne die roten Blutkörperchen zu stören.
- Bei 500 x g für 10 min (22 °C, 5 acc, 5 dec) zentrifugieren und den Überstand absaugen.
- Waschen Sie das PBMC-Pellet 1x-2x, indem Sie es in 10 mL RPMI resuspendieren und 10 min lang bei 500 x g zentrifugieren (22 °C, 5 acc, 5 dec).
2. Magnetische Trennung von CD14+- und CD3+-Zellen
- Platzieren Sie eine Säule im Magnetfeld eines magnetischen Zellseparators (siehe Materialtabelle). Waschen Sie die Säule mit 3 mL RP-5.
- Resuspendieren Sie das PBMC-Pellet in 80 μl RP-5 und 20 μl Anti-CD14-Mikrokügelchen (siehe Materialtabelle). 15 min bei 4 °C inkubieren.
- Resuspendieren Sie die Zellen mit 1 mL RP-5 und laden Sie die Suspension auf die Säule. Sammeln Sie unmarkierte Zellen, die in ein konisches 15-ml-Röhrchen mit der Bezeichnung "Flow-through 1" fließen. Warten Sie, bis die gesamte Zellsuspension die Säule durchlaufen hat, und fahren Sie dann mit dem Waschen mit 3 mL RP-5 3x fort und sammeln Sie den gesamten Durchfluss.
- Nehmen Sie die Säule vorsichtig aus dem Magnetfeld und setzen Sie sie auf ein neues konisches 15-ml-Röhrchen. Geben Sie 5 mL RP-5 hinzu und verwenden Sie sofort den Kolben, um den Säuleninhalt in ein Sammelröhrchen mit der Bezeichnung "CD14+" zu spülen.
- "Durchfluss 1" bei 500 x g für 10 min (22 °C, 5 acc, 5 dec) zentrifugieren und den Überstand absaugen.
- Wiederholen Sie mit Zellen aus Flow-through 1 die Schritte 2.2-2.5 mit Anti-CD3-Mikrokügelchen (siehe Materialtabelle), um T-Zellen zu isolieren.
- Zentrifugenröhrchen mit T-Zellen (CD3+) und Monozyten (CD14+) bei 300 x g für 5 min. Aspirieren Sie den Überstand und resuspendieren Sie das Pellet in 1 mL RP-5.
- Bestimmen Sie die Zellkonzentration mit einem Hämozytometer oder einem automatischen Zellzähler.
HINWEIS: Zellen können gezählt werden, indem 10 μl einer Zellverdünnung von 1:10 oder 1:20 in ein Hämozytometer gegeben werden. Man kann sich auf zuvor veröffentlichte Protokolle zur Zellzählung mit einem Hämozytometer36 beziehen. - Pipettieren Sie 2,5 Millionen Monozyten oder 5 Millionen T-Zellen in ein neues Zentrifugenröhrchen. 30 s bei 2000 x g zentrifugieren, den Überstand aspirieren und die Zellen in MiR05 resuspendieren, um ein Gesamtvolumen von 20 μl und eine Endkonzentration von 125 Millionen Monozyten oder 250 Millionen T-Zellen pro ml zu erreichen.
HINWEIS: Die endgültige Konzentration wurde so gewählt, dass 2,5 Millionen Monozyten oder 5 Millionen T-Zellen in einem Volumen von 20 μl injiziert werden. Aus der Milz isolierte Maus-T-Zellen wurden ebenfalls mit dieser Methode getestet. Das Verfahren ist in der Zusatzdatei 1 zu finden.
3. Hochauflösende Fluorespirometrie - Sauerstoff- und TMRM-Fluoreszenzkalibrierung
HINWEIS: Diese Methode wurde von früheren Arbeiten an permeabilisierten Fasern von Pharaoh et al.11 adaptiert. Eine hohe, nicht inhibitorische Konzentration von TMRM wird für den Quench-Modus verwendet, bei dem das Verhältnis von mMP und TMRM-Konzentration in der Matrix umgekehrt wird. Eine Abnahme von mMP führt also zur Freisetzung von TMRM-Farbstoff aus der Matrix und zu einer Erhöhung der Fluoreszenz32.
- Installieren Sie 0,5-ml-Kammern im O2K-Respirometer gemäß den Anweisungen des Herstellers (siehe Materialtabelle). Schalten Sie das Gerät ein und verbinden Sie es mit der vom Hersteller bereitgestellten Software für die Datenerfassung.
- Die Temperatur auf 37 °C und die Rührgeschwindigkeit auf 750 U/min einstellen.
- Waschen Sie die Kammern 3x mit destilliertem Wasser. Ersetzen Sie Wasser durch 0,54 mL Mir05, schließen Sie die Stopfen vollständig und entfernen Sie überschüssigen Puffer mit dem integrierten Absaugsystem (ISS). Stopfen anheben, damit sich der Raumsauerstoff mit dem Kammersauerstoff mit Hilfe eines Stopfen-Abstandshalters ausgleichen kann.
- Sobald der Sauerstofffluss stabil ist, führen Sie die Luftsauerstoffkalibrierung (R1) gemäß den Anweisungen des Herstellers durch.
HINWEIS: Es kann >30 Minuten dauern, bis sich der Sauerstofffluss stabilisiert hat. Sauerstoffsensoren erfordern die Bestimmung des Nullpunktsauerstoffs (R0) und des Hintergrundsauerstoffflusses von 50-200 μM aus separaten Experimenten mit Dithionit-Titrationen. Spezifische Methoden finden Sie im Handbuch des Herstellers. - Verschließen Sie die Kammer, indem Sie die Stopfen schließen.
HINWEIS: Im Gegensatz zu Experimenten mit permeabilisierten Fasern ist für PBMCs in den Kammern keine Hyperoxygenierung erforderlich. Durch das Verschließen der Kammer nach der R1-Kalibrierung wird ausreichend Sauerstoff für das Experiment bereitgestellt. Der Sauerstoffgehalt sollte zwischen 50 und 250 μM gehalten werden. Sinkt die Sauerstoffkonzentration unter den Schwellenwert, kann die Kammer teilweise geöffnet werden, so dass sich der Kammersauerstoff mit dem Raumluftsauerstoff ausgleichen kann. - TMRM-Kalibrierung
- Verwenden Sie die grünen LED-Fluo-Sensoren (z.B. 525 nm) mit dem AmR-Filterset (siehe Materialtabelle). Stellen Sie die Fluorometerverstärkung auf 1000 und die Intensität auf 1000 ein. Schalten Sie die Fluo-Sensoren ein und beginnen Sie mit der Aufzeichnung der Baseline.
- Injizieren Sie 2,5 μl 0,05 mM TMRM und lassen Sie das Signal vor der nächsten 2,5 μl Injektion stabilisieren (~2 min), bis insgesamt 4 Injektionen für eine TMRM-Gesamtkonzentration von 1 μM TMRM in der Kammer durchgeführt wurden. Verwenden Sie für alle Injektionen eine Hamilton-Spritze.
- Kalibrieren Sie den Fluo-Sensor, indem Sie für jede Injektion das Fluoreszenzsignal (Spannung) auswählen, das 0, 0,25, 0,5, 0,75 und 1,0 μM TMRM für eine Fünf-Punkt-Kalibrierung darstellt.
4. Protokoll der Substrat-Uncoupler-Inhibitor-Titration (SUIT)
HINWEIS: Führen Sie leere Experimente durch, bei denen 20 μl Mir05 anstelle von 20 μl Zellsuspension in die Kammer injiziert werden, da sich das TMRM-Signal allein als Reaktion auf Injektionen ändert (in repräsentativen Ergebnissen diskutiert). Lassen Sie das Sauerstoffflusssignal vor der nächsten Injektion sowohl für Blind- als auch für Probenexperimente warten, bis sich das Sauerstoffflusssignal stabilisiert hat (ca. 2-3 Minuten). Das folgende Titrationsprotokoll und die erwarteten Beobachtungen sind in Tabelle 1 aufgeführt.
- Sobald der Sauerstofffluss stabil ist, wählen Sie sowohl den Sauerstofffluss als auch das TMRM-Signal aus und beschriften Sie es mit "Vorzelle".
- Injizieren Sie die Zellsuspension, die entweder 5 Millionen T-Zellen oder 2,5 Millionen Monozyten enthält, in ~20 μL und messen Sie sie etwa 10 Minuten lang. Wählen Sie sowohl den Sauerstofffluss als auch das TMRM-Signal aus und beschriften Sie sie als "Zelle".
- Permeabilisieren Sie die Zellen durch Injektion von 2 μl 1 mg/ml Digitonin (Endkonzentration: 4 μg/ml). Warten Sie 20 Minuten. Wählen Sie sowohl den Sauerstofffluss als auch das TMRM-Signal aus und beschriften Sie sie als "Dig".
HINWEIS: Es wird empfohlen, die Digitoninkonzentration in separaten Experimenten zu optimieren. - 2,5 μl 1 M Succinat (Endkonzentration: 5 mM) zugeben. Wählen Sie sowohl den Sauerstofffluss als auch das TMRM-Signal aus und beschriften Sie sie als "SUCC".
- Sobald der Sauerstofffluss stabil ist, fügen Sie 5 μl 100 mM Malat (Endkonzentration: 1,0 mM), 5 μl 1 M Glutamat (Endkonzentration: 10 mM) und 5 μl 500 mM Pyruvat (Endkonzentration: 5 mM) hinzu. Wählen Sie sowohl den Sauerstofffluss als auch das TMRM-Signal aus und beschriften Sie sie als "MPG".
- Sobald der Sauerstofffluss stabil ist, titrieren Sie ADP. Wählen Sie die Raten für jede Titration aus und beschriften Sie sie je nach Anzahl der Titrationen nacheinander mit "D" von 1 bis 10. Verwenden Sie das Titrationsschema in Tabelle 2.
- Sobald der Sauerstofffluss stabil ist, führen Sie eine Reihe von 1-μl-Titrationen mit 0,25 mM Carbonylcyanid-p-(Trifluromethoxy)-phenylhydrazon (FCCP) durch, bis das Fluoreszenzsignal sein Maximum erreicht. Wählen Sie sowohl den Sauerstofffluss als auch das TMRM-Signal aus, das das minimale Membranpotential darstellt, und beschriften Sie es mit "FCCP".
HINWEIS: Eine FCCP-Konzentration von 0,5-1,0 μM ist in der Regel erforderlich, um das mitochondriale Membranpotential zu erschöpfen.
ACHTUNG: FCCP ist giftig. Für die richtige Handhabung ist das Sicherheitsdatenblatt (SDB) zu beachten. - OPTIONAL: Sobald der Sauerstofffluss stabil ist, injizieren Sie 1 μl 0,25 mM Rotenon, um Komplex I zu hemmen und die Atmungskapazität durch Komplex II zu bestimmen.
HINWEIS: Änderungen des Membranpotentials sind nach der Titration mit dem Entkoppler nicht mehr relevant.
ACHTUNG: Rotenon ist giftig. Informationen zur ordnungsgemäßen Handhabung finden Sie im Sicherheitsdatenblatt. - Sobald der Sauerstofffluss stabil ist, injizieren Sie 1 μl 1,25 mM (Endkonzentration: 2,5 μM) Antimycin A, um die mitochondriale Atmung zu hemmen.
ACHTUNG: Antimycin A ist giftig. Informationen zur ordnungsgemäßen Handhabung finden Sie im Sicherheitsdatenblatt.
5. Berechnung des mitochondrialen Membranpotentials und Analyse
- Zeichnen Sie mit Hilfe von Blindversuchen die kalibrierten TMRM-Werte (mikromolare TMRM) vor der Injektion der Blindprobe ("Pre-Sample") und für jede der Injektionen auf. Siehe Abbildung 2.
- Berechnen Sie für jedes blinde Experiment das Hintergrundverhältnis, indem Sie die TMRM-Konzentration "vor der Probenahme" auf 1,0 einstellen. Berechnen Sie die anschließende proportionale Abnahme der TMRM. Berechnen Sie das durchschnittliche Hintergrundverhältnis aus allen leeren Experimenten.
HINWEIS: Die Anzahl der einzubeziehenden Blindexperimente kann von der Genauigkeit des Instruments abhängen. Siehe das Berechnungsbeispiel in Tabelle 3 aus fünf verschiedenen Blindexperimenten, bei denen die Standardabweichung des durchschnittlichen Hintergrundverhältnisses für jede Titration zwischen 0 und 0,016 lag. - Hintergrundberechnung: Berechnen Sie den Hintergrund für jedes Probenexperiment, indem Sie das TMRM vor der Stichprobe des Probenexperiments mit dem durchschnittlichen Hintergrundverhältnis für jede Injektion multiplizieren. Siehe das Berechnungsbeispiel in Tabelle 3.
- Hintergrundkorrektur: Subtrahieren Sie den Hintergrund des Experiments von den gemessenen TMRM-Werten der Probe. Siehe das Berechnungsbeispiel in Tabelle 4.
- FCCP-Korrektur: Subtrahieren Sie den FCCP-hintergrundkorrigierten mMP von jeder Injektion. Siehe das Berechnungsbeispiel in Tabelle 4.
- ADP-Sensitivitätskurve: Normalisieren Sie die ADP-bedingte Abnahme des mMP, indem Sie das höchste und das niedrigste Membranpotential auf 100 % bzw. 0 % festlegen, wobei Sie die mMP-Werte verwenden, die während der ADP-Titration erfasst wurden. Passen Sie die Daten unter Verwendung der bevorzugten statistischen Software in ein nichtlineares Anpassungsregressionsmodell ein, um die halbmaximale Hemmkonzentration (IC50) von ADP auf mMP zu berechnen.
HINWEIS: Die Kurve passt die Antwort [Inhibitor] vs. normalisierte Reaktion - Variable Steigung im Prisma an.
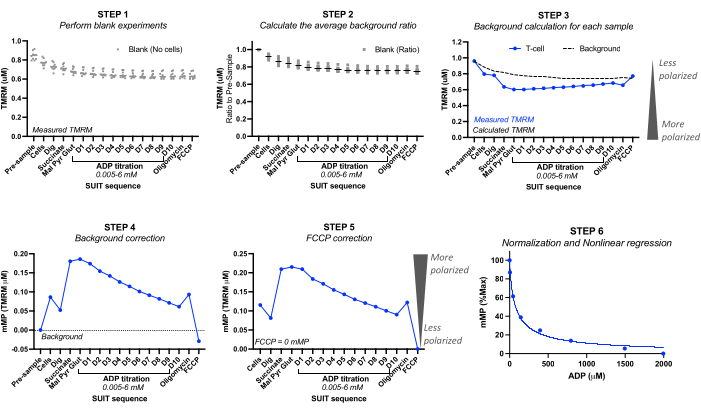
Abbildung 2: Berechnung des mitochondrialen Membranpotentials (mMP) und der ADP-Empfindlichkeit aus der TMRM-Fluoreszenz. Schritte zur Berechnung des mitochondrialen Membranpotentials (mMP) und der ADP-Empfindlichkeit aus Messungen der TMRM-Fluoreszenz durch hochauflösende Fluorespirometrie einer Probe von T-Zellen (n = 1). Schritt 1: Die TMRM-Fluoreszenz wird wie in der biologischen Probe in Blindproben gemessen. Schritt 2: Bestimmen Sie das Verhältnis des TMRM-Signals bei jeder Titration relativ zum Signal vor der Probe für jedes Blindexperiment. Berechnen Sie den Durchschnitt für jede Titration aller Blindproben. Schritt 3: Berechnen Sie den Hintergrund für jedes Probenexperiment, indem Sie die Fluoreszenz vor der Probe mit dem durchschnittlichen Hintergrundverhältnis für jede Titration multiplizieren. Schritt 4: Berechnen Sie die Differenz zwischen Hintergrund- und Proben-TMRM-Fluoreszenz für jede Titration, um Daten als mMP oder mitochondriale TMRM-Aufnahme auszudrücken. Schritt 5: Korrigieren Sie mMP so, dass die vollständige Entkopplung mit FCCP null mMP anzeigt. Schritt 6: Führen Sie eine nichtlineare Regression durch, um Änderungen in mMP mit steigenden ADP-Konzentrationen darzustellen. Die Messungen wurden in 0,5-ml-Kammern durchgeführt, von denen eine 5 Millionen T-Zellen von einem gesunden Freiwilligen enthielt. Gemittelte Daten werden als Mittelwert ± SEM ausgedrückt. Einzelne Datenpunkte eines einzelnen Replikats werden ohne Fehlerbalken ausgedrückt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Repräsentative Ergebnisse
Um die Unterschiede in der optimalen Zellkonzentration für den Assay zu veranschaulichen, wurden 5 Millionen T-Zellen in eine 0,5-ml-Kammer (10 Millionen Zellen/ml) und 1,25 Millionen Zellen in eine andere Kammer (2,5 Millionen Zellen/ml) mit 1 μM TMRM geladen (Abbildung 3A-G). Drei Blindexperimente wurden ebenfalls einbezogen, um den TMRM-Hintergrund zu berechnen. Wir fanden heraus, dass eine höhere Konzentration von T-Zellen zu einer deutlicheren Veränderung der TMRM-Fluoreszenz im Vergleich zum Hintergrund führte (Abbildung 3B,D). Darüber hinaus konnten wir durch eine höhere Zellkonzentration den erwarteten Anstieg des Sauerstoffverbrauchs und die gleichzeitige Erschöpfung des mMP als Reaktion auf die Zugabe von FCCP nachweisen (Abbildung 3E,F). Die Verwendung einer niedrigen Konzentration von Zellen führte zu einer schwachen Änderung der Fluoreszenz, die dem Hintergrund entsprach. Da bei der Berechnung von mMP der Hintergrund vom Signal subtrahiert wird, erlaubt eine niedrige Zellkonzentration keine Bestimmung von Änderungen in mMP als Reaktion auf Substrate und Entkoppler. Zusätzlich zur Verwendung der höheren Zellkonzentrationen in diesem Assay empfehlen wir, die Zellkonzentration für jeden Zelltyp zwischen den Experimenten konstant zu halten.
Um den Einfluss der ATP-Synthase auf die Dissipation von mMP mit ADP-Titrationen zu validieren, führten wir parallele Experimente an PBMCs und T-Zellen durch, bei denen eine Kammer Oligomycin vor der ADP-Titration erhielt (Abbildung 4). Wir fanden keine Dissipation von mMP als Reaktion auf ADP in Zellen, die mit Oligomycin behandelt wurden, was darauf hindeutet, dass die allmähliche Abnahme von mMP mit ADP ein Ergebnis des Protonenflusses durch ATP-Synthase ist (Abbildung 4A-F). Wir verglichen auch die ADP-Sensitivität zwischen T-Zellen und PBMCs desselben Teilnehmers und stellten fest, dass die ADP-Sensitivität in der T-Zell-Fraktion geringer war (höherer EC50) (Abbildung 4G,H).
Wir führten eine Reihe von Blindexperimenten durch, um den Einfluss der Zeit oder des SUIT-Protokolls auf die TMRM-Fluoreszenz zu bestimmen. Wir fanden heraus, dass das TMRM-Signal in Blindexperimenten hauptsächlich durch SUIT-Titrationen beeinflusst wird (Abbildung 5A) und nicht durch das Timing der Titrationen (Abbildung 5B).
Wir verglichen ADP-bedingte Veränderungen der Sauerstoffverbrauchsraten (OCR) und der mMP in T-Zellen und Monozyten von 11 gesunden, in der Gemeinschaft lebenden Freiwilligen (Abbildung 6A-H). Ähnlich wie die Ergebnisse zuvor veröffentlichter Experimente mit extrazellulärem Fluss und enzymatischen Assays zeigten Monozyten eine größere mitochondriale Atmungskapazität als Lymphozyten26,27 (Abbildung 6A,H). Wir konnten jedoch bei keinem der beiden Zelltypen einen typischen Dosis-Wirkungs-Anstieg der OCR mit ADP feststellen (Abbildung 6C,D), im Gegensatz zu dem, was diese Methode bei der Verwendung von hochmetabolischen Geweben wie Mausleber zeigt (Abbildung 7A-H). Auf der anderen Seite ermöglichte uns die Verwendung von TMRM, einen allmählichen Rückgang von mMP mit ADP in humanen Immunzellen (Abbildung 6E-G) und in Milz-T-Zellen von Mäusen (Abbildung 7E-H) zu erkennen. Obwohl wir menschliche und Maus-T-Zellen nicht direkt mit demselben Titrationsprotokoll verglichen haben, fanden wir heraus, dass der IC50 von Maus-T-Zellen um den Faktor 10 niedriger war als der von zirkulierenden T-Zellen von menschlichen Probanden.
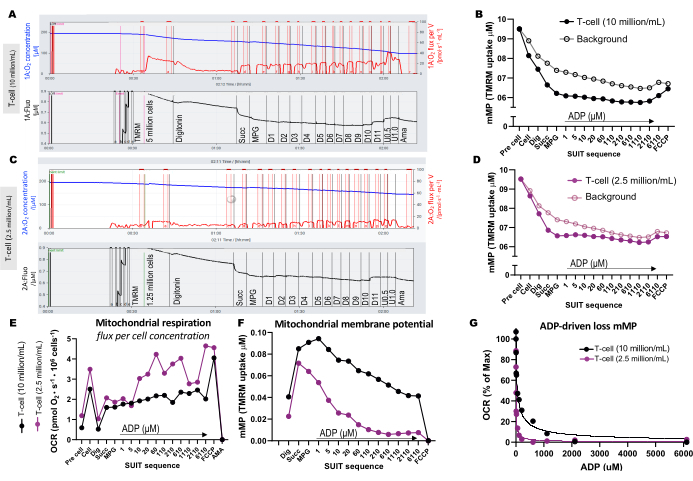
Abbildung 3: Hochauflösende Fluorespirometrie-Experimente. (A-D) Spuren von hochauflösenden Fluorespirometrie-Experimenten mit T-Zell-Konzentrationen von 10 Millionen Zellen/ml und 2,5 Millionen Zellen/ml in 0,5 mL-Kammern. (A) 10 Millionen Zellen/ml in 0,5 ml-Kammern. (C) 2,5 Millionen Zellen/ml in 0,5 ml-Kammern. Der Sauerstofffluss (pmol/s/ml) wird im oberen Bereich (rot) und das kalibrierte TMRM-Signal im unteren Bereich (schwarz) angezeigt. Die Veränderungen der TMRM in der gesamten SUIT für die Probe und ihren berechneten Hintergrund wurden für die Kammern mit (B) 10 Millionen Zellen/ml und (D) 2,5 Millionen Zellen/ml aufgetragen. (E) Für jede Zellkonzentration wurden der Sauerstofffluss (pmol/s/Millionen Zellen) und das (F) mitochondriale Membranpotential berechnet. (G) Die ADP-Sensitivitätskurve wurde aufgetragen und an ein nichtlineares Regressionsmodell angepasst (durchgezogene Linien). Abkürzungen: mMP, mitochondriales Membranpotential; TMRM, Tetramethylrhodaminmethylester; SUIT, Substrat-Entkoppler-Inhibitor-Titrationen; ADP, Adenosindiphosphat; Graben, Digitonin; Mal, Malat; Pyr, Pyruvat; Glut, Glutamat; D1-11, 11 aufeinanderfolgende ADP-Titrationen; U, Entkoppler FCCP von 0,5 und 1,0 μM; AMA, Antimycin A. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
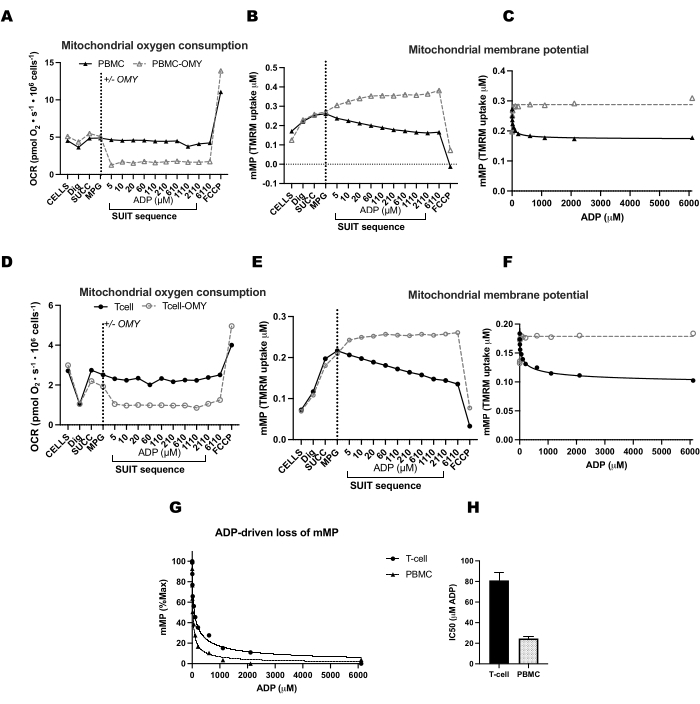
Abbildung 4: ATP-Synthase führt zu einer ADP-getriebenen Abnahme des Membranpotentials in T-Zellen und PBMCs. (A-H) Das hier beschriebene Protokoll wurde an PBMCs und T-Zellen getestet. Zwei O2K-Kammern wurden mit PBMCs injiziert, und zwei Kammern mit einem zusätzlichen O2K wurden mit T-Zellen desselben Teilnehmers injiziert. Nach der Injektion der Substrate Malat, Pyruvat und Glutamat in alle Kammern erhielt eine Kammer mit PBMCs und T-Zellen Oligomycin. Oligomycin verhinderte einen ADP-bedingten Anstieg der Atmung in (A) PBMCs und (D) T-Zellen oder eine Abnahme des mitochondrialen Membranpotentials in (B,C) PBMCs und (E,F) T-Zellen. (G,H) Die ADP-Sensitivität war bei PBMCs im Vergleich zu T-Zellen größer. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
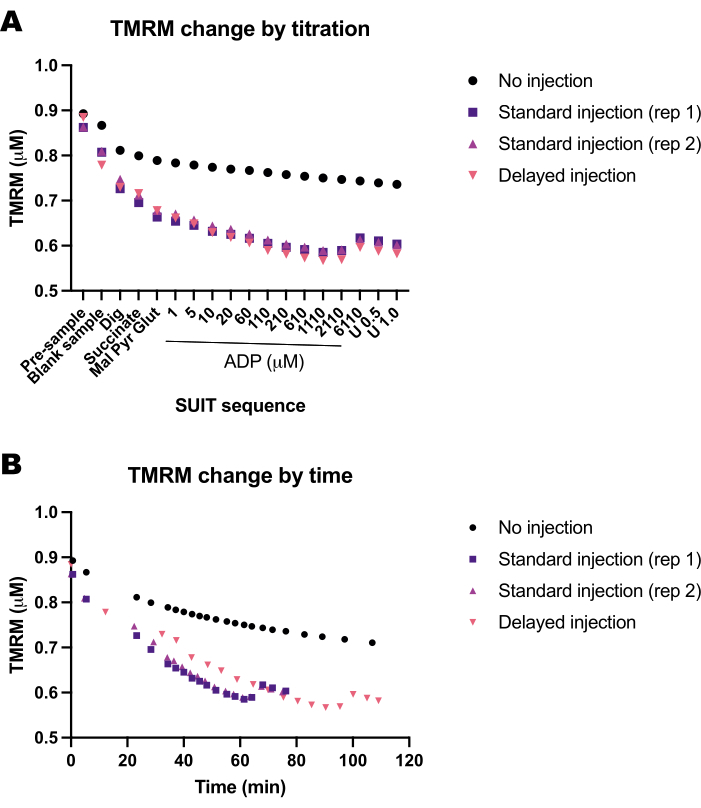
Abbildung 5: Blindexperimente zeigen die Veränderung der TMRM-Fluoreszenz als Reaktion auf Zeit und Titrationen von Substraten, Entkopplern und Inhibitoren (SUIT). (A) Änderung der TMRM-Fluoreszenz als Reaktion auf die Titration. (B) Änderung der TMRM-Fluoreszenz als Reaktion auf die Zeit. Die Experimente wurden in 0,5-ml-Kammern durchgeführt, die mit Mir05 gefüllt waren, das 1 μM TMRM enthielt. Eine Kammer erhielt keine SUIT-Titrationen (keine Injektion); Zwei Kammern in zwei verschiedenen Instrumenten erhielten ein Standard-SUIT-Protokoll (Standardinjektion); Eine Kammer erhielt die gleichen SUIT-Titrationen, jedoch mit einer Verzögerung zwischen den einzelnen Injektionen (verzögerte Injektion). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
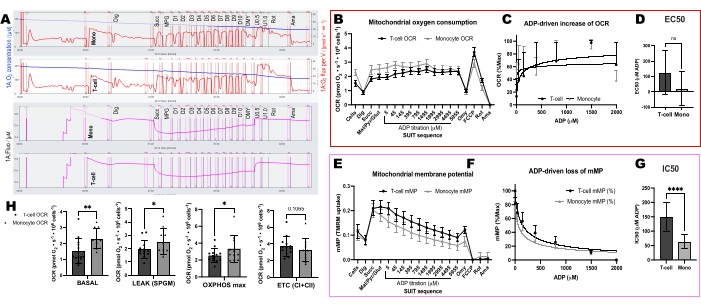
Abbildung 6: Unterschiede in der ADP-Empfindlichkeit zwischen T-Zellen und Monozyten unter Verwendung von OCR und mMP. (A) Spur eines hochauflösenden Fluorespirometrie-Experiments aus der Monozyten- und T-Zell-Probe eines Probanden. (B) Sauerstoffverbrauch in Monozyten (n= 11) und T-Zellen (n= 13) aus dem Blut gesunder Probanden. (C,D) Nichtlineare Regressionsanpassung des aufgetragenen Anstiegs der Atmung mit ADP-Titrationen zur Berechnung eines EC50. (E) Gleichzeitige Messung des mitochondrialen Membranpotentials. (F,G) Nichtlineare Regressionsanpassung des aufgetragenen Abfalls des mitochondrialen Membranpotentials mit ADP-Titrationen zur Berechnung eines IC50. (H) Parameter der Atmungskapazität von Monozyten und T-Zellen. Die Daten werden als Mittelwert ± SEM für Liniendiagramme und als Mittelwert ± SD für Balkendiagramme ausgedrückt. Statistisch signifikante Unterschiede nach t-Tests werden als *p < 0,05 ausgedrückt. **p < 0,01 und ****p < für 0,0001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
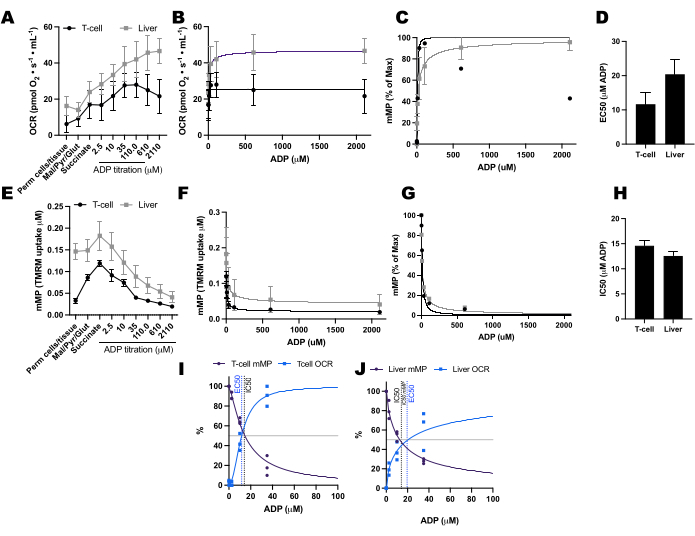
Abbildung 7: Vergleich der ADP-Reaktion in der Atmung und des mitochondrialen Membranpotentials (mMP) in permeabilisierten Milz-T-Zellen und in der Leber der Maus. (A-D) Reaktion auf die Atmung in permeabilisierten Milz-T-Zellen der Maus und in der Leber. (E-H) Ansprechen bei mMP in permeabilisierten Milz-T-Zellen und Leber der Maus. Frische Leber und Milz wurden von drei Mäusen nach einer Gebärmutterhalsluxation präpariert. Milz-Pan-T-Zellen wurden mittels Antikörper-konjugierter magnetischer Bead-Trennung isoliert. Beide Proben wurden dem gleichen SUIT-Protokoll in Gegenwart von 1 μM TMRM unterzogen. (I,J) Vergleich von EC50 berechnet aus dem Anstieg des Sauerstoffverbrauchs (OCR) und IC50 aus der Abnahme des mMP als Reaktion auf ADP. N = 3 pro Gruppe. Die Daten werden als Mittelwert ± SEM ausgedrückt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Beispiel für ein SUIT-Protokoll zur Beurteilung des mitochondrialen Membranpotenzials in frisch isolierten T-Zellen und Monozyten unter Verwendung der 0,5-ml-Kammern. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Empfohlene ADP-Titration für eine 0,5-ml-Kammer. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 3: Berechnung des durchschnittlichen Hintergrundverhältnisses unter Verwendung von fünf unabhängigen Blindexperimenten. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 4: Berechnung des mitochondrialen Membranpotentials (mMP) aus dem Probenexperiment. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Abbildung 1: Wirkung von Mir05 und DMSO auf die mitochondriale Atmung und das Membranpotential. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 1: Reagenzienvorbereitung und Protokoll für die Isolierung von T-Zellen aus der Milz der Maus. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Dieses Protokoll verwendet hochauflösende Fluorespirometrie, um die Empfindlichkeit der mitochondrialen Reaktion auf den Energiebedarf zu messen, indem die Dissipation von mMP als Reaktion auf steigende ADP-Spiegel in PBMCs, Monozyten und T-Zellen gemessen wird. Dies geschieht durch Zugabe von komplexen I- und II-Substraten, um das mitochondriale Membranpotenzial zu maximieren, und durch Titration von ADP, um die ATP-Synthase allmählich zu stimulieren, den Protonengradienten für die ATP-Bildung zu nutzen.
Zu den kritischen Schritten im Protokoll gehören die Einstellung der Verstärkung und Intensität des Fluorophors auf 1000 und die Sicherstellung, dass während der TMRM-Titration ein TMRM-Fluoreszenzsignal erfasst wird. Da die TMRM-Fluoreszenz nach jeder Titration abnimmt (eine Einschränkung dieser Methode), ist es zwingend erforderlich, Hintergrundexperimente mit Blindproben durchzuführen. Wir haben auch festgestellt, dass DMSO eine hemmende Wirkung auf die mitochondriale Atmung und das Membranpotenzial hat, und empfehlen daher, die Arbeitslösung von TMRM in Mir05 zu verdünnen (Ergänzende Abbildung 1).
Einige Modifikationen, die beim Ausprobieren dieses Protokolls verwendet werden können, sind die Anpassung der Zellkonzentrationen und die Verwendung der standardmäßigen 2-ml-Kammer. Die 0,5-ml-Kammer wird jedoch für T-Zellen und Monozyten bevorzugt, da die hohe Konzentration der Zellen für eine optimale Reaktion des Membranpotentials und des Sauerstoffflusses erforderlich ist. Eine niedrigere Konzentration von Zellen kann optimal sein, wenn Zellen mit größerer Atmungskapazität, wie z. B. Makrophagen, getestet werden.
Zu den weiteren Einschränkungen der hier vorgestellten Methode gehört die Anforderung von mindestens 5 Millionen T-Zellen und 2,5 Millionen Monozyten. Wir können oft genügend Zellen aus ~20 ml Blut von gesunden Teilnehmern gewinnen, aber diese Zahlen können je nach Gesundheitszustand, Alter und Geschlecht variieren26. Darüber hinaus müssen die Zellen, wie bei den meisten Methoden zur Beurteilung der mitochondrialen Kapazität, frisch isoliert werden. Diese Methode könnte jedoch in Zukunft an kryokonservierten Zellen ausprobiert werden. Im Vergleich zur Ausbeute aus menschlichem Blut ist die T-Zell-Ausbeute aus der Milz gesunder Mäuse hoch genug, um diesen Test durchzuführen.
Zirkulierende T-Zellen, insbesondere langlebige Gedächtniszellen (T M) und regulatorische (Treg) Zellen, sind auf oxidative Phosphorylierung zur Energiegewinnung angewiesen37. Obwohl ihr Energiebedarf und Sauerstoffverbrauch gering sind (z. B. im Vergleich zu dem von ruhenden Muskeln), ist ihr Überleben für eine wirksame Immunantwort auf Reinfektionen und Krebs unerlässlich 38,39,40. Eine Verringerung der oxidativen Phosphorylierung von T-Zellen führt zu einer Beeinträchtigung der proliferativen Kapazität und fördert die Erschöpfung und Seneszenz der T-Zellen 5,41. Darüber hinaus fördert die mitochondriale Hyperpolarisation eine anhaltende Produktion von Zytokinen (IL-4 und IL-21) durch Effektor-CD4-T-Zellen während der Aktivierung42. Nach einer Infektion kann der Energiebedarf für die Aktivierung und Proliferation von Immunzellen bis zu 25%-30% des Grundumsatzes betragen43. Daher funktionieren Immunzellen in einem breiten und extremen Bereich des Energiebedarfs, und dieses Protokoll kann mitochondriale Reaktionen innerhalb dieses Bereichs testen.
Chronische Entzündungen sind ein häufiges Merkmal von Fettleibigkeit, Diabetes und Alterung. Ein fehlregulierter Spiegel von zirkulierenden Hormonen, Lipiden und Glukose hat systemische Auswirkungen und kann somit beeinflussen, wie Mitochondrien auf eine energetische Herausforderung reagieren. In dieser Arbeit haben wir eine Methode zur Beurteilung der mitochondrialen ADP-Sensitivität in zirkulierenden PBMCs vorgestellt. Weitere Studien sind erforderlich, um festzustellen, wie die ADP-Sensitivität bei Stoffwechselerkrankungen moduliert werden kann und wie sich dies auf den Gesundheitszustand auswirkt.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Wir möchten uns bei den lieben Freiwilligen bedanken, die für dieses Projekt Blut gespendet haben. Wir danken auch Dr. Ellen Schur und ihrem Team für die Bereitstellung zusätzlicher Proben aus ihrer Studie. Wir möchten uns auch bei Andrew Kirsh für die Durchsicht des Manuskripts und die Überarbeitung der Lesbarkeit bedanken. Diese Arbeit wurde durch folgende Förderquellen unterstützt: P01AG001751, R01AG078279, P30AR074990, P30DK035816, P30DK017047, R01DK089036, K01HL154761, T32AG066574.
Materialien
| Name | Company | Catalog Number | Comments |
| Adenosine Diphosphate | Sigma-Aldrich | A5285 | Fluorespirometry |
| Antimycin A | Sigma-Aldrich | A8674 | Fluorespirometry |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A6003 | Mir05 buffer |
| Bovine Serum Albumin | Sigma-Aldrich | A6003 | Cell isolation |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma-Aldrich | C2920 | Fluorespirometry |
| Cell strainers | Fisher Scientific | 22-363-548 | Isolation of T-cells from mouse spleen protocol |
| CD14 Microbeads, human | Miltenyi Biotec | 130-050-201 | Cell isolation |
| CD3 Microbeads, human | Miltenyi Biotec | 130-050-101 | Cell isolation |
| DatLab | Oroboros | Version 8 | |
| Digitonin | Sigma-Aldrich | D141 | Fluorespirometry |
| D-Sucrose | Sigma-Aldrich | 84097 | Mir05 buffer |
| Ethylene glycol-bis(β-aminoethyl ether)-N,N,N′,N′-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | Mir05 buffer |
| Filter Set AmR | Oroboros | 44321-01 | |
| HBSS (10x) | Gibco | 12060-040 | |
| HEPES sodium salt | Sigma-Aldrich | H7523 | Mir05 buffer |
| Histopaque 1077 | Sigma-Aldrich | 10771 | Cell isolation |
| K2EDTA blood collection tubes | BD Vacutainer | 366643 | Cell isolation |
| Lactobionic acid | Sigma-Aldrich | 153516 | Mir05 buffer |
| L-Glutamic acid | Sigma-Aldrich | G1626 | Fluorespirometry |
| L-Malic Acid | Sigma-Aldrich | M1000 | Fluorespirometry |
| LS Columns | Miltenyi Biotec | 130-042-401 | Cell isolation |
| Magnesium Chloride (MgCl2) | Sigma-Aldrich | M9272 | Mir05 buffer |
| Multi-MACS stand and MidiMACS Separator | Miltenyi Biotec | 130-042-301 | Cell isolation |
| O2k-Fluo Smart-Module | Oroboros | 12100-03 | |
| O2k-FluoRespirometer series J | Oroboros | 10201-03 | |
| O2k-sV-Module (0.5 chamber) | Oroboros | 11200-01 | |
| Oligomycin | Sigma-Aldrich | 04876 | Fluorespirometry |
| Pan T Cell Isolation Kit II, mouse | Miltenyi | 130095130 | Isolation of T-cells from mouse spleen protocol |
| Potassium dihydrogen phosphate (KH2PO4) | Sigma-Aldrich | P0662 | Mir05 buffer |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | 221473 | Mir05 buffer |
| Prism | GraphPad | Version 10 | |
| Rotenone | Sigma-Aldrich | R8875 | Fluorespirometry |
| RPMI Buffer | Corning | 17-105-CV | Cell isolation |
| Sodium Pyruvate | Sigma-Aldrich | P2256 | Fluorespirometry |
| Succinate disodium salt | Sigma-Aldrich | S2378 | Fluorespirometry |
| Taurine | Sigma-Aldrich | T0625 | Mir05 buffer |
| Tetramethyrhodamine methyl ester perchlorite | Sigma-Aldrich | T5428 | Fluorespirometry |
Referenzen
- Eisner, V., Picard, M., Hajnóczky, G. Mitochondrial dynamics in adaptive and maladaptive cellular stress responses. Nat Cell Biol. 20 (7), 755-765 (2018).
- Sokolova, I. Bioenergetics in environmental adaptation and stress tolerance of aquatic ectotherms: linking physiology and ecology in a multi-stressor landscape. J Exp Biol. 224, 236802 (2021).
- Buttgereit, F., Brand, M. D. A hierarchy of ATP-consuming processes in mammalian cells). Biochem J. 312, 163-167 (1995).
- Schmid, D., Burmester, G. R., Tripmacher, R., Kuhnke, A., Buttgereit, F. Bioenergetics of human peripheral blood mononuclear cell metabolism in quiescent, activated, and glucocorticoid-treated states. Biosci Rep. 20 (4), 289-302 (2000).
- Vardhana, S. A., et al. Impaired mitochondrial oxidative phosphorylation limits the self-renewal of T cells exposed to persistent antigen. Nat Immunol. 21 (9), 1022-1033 (2020).
- Nelson, S. R., Li, A., Beck-Previs, S., Kennedy, G. G., Warshaw, D. M. Imaging ATP consumption in resting skeletal muscle: One molecule at a time. Biophys J. 119 (6), 1050-1055 (2020).
- Meyrat, A., von Ballmoos, C. ATP synthesis at physiological nucleotide concentrations. Sci Rep. 9 (1), 3070 (2019).
- Gouspillou, G., et al. Accurate determination of the oxidative phosphorylation affinity for ADP in isolated mitochondria. PLoS One. 6 (6), e20709 (2011).
- Holloway, G. P., et al. Age-associated impairments in mitochondrial ADP sensitivity contribute to redox stress in senescent human skeletal muscle. Cell Rep. 22 (11), 2837-2848 (2018).
- Pharaoh, G., Brown, J., Ranjit, R., Ungvari, Z., Van Remmen, H. Reduced adenosine diphosphate sensitivity in skeletal muscle mitochondria increases reactive oxygen species production in mouse models of aging and oxidative stress but not denervation. JCSM Rapid Commun. 4 (1), 75-89 (2021).
- Pharaoh, G., et al. The mitochondrially targeted peptide elamipretide (SS-31) improves ADP sensitivity in aged mitochondria by increasing uptake through the adenine nucleotide translocator (ANT). Geroscience. 45 (6), 3529-3548 (2023).
- Brunetta, H. S., Petrick, H. L., Vachon, B., Nunes, E. A., Holloway, G. P. Insulin rapidly increases skeletal muscle mitochondrial ADP sensitivity in the absence of a high lipid environment. Biochem J. 478 (13), 2539-2553 (2021).
- Brunetta, H. S., et al. Nitrate consumption preserves HFD-induced skeletal muscle mitochondrial ADP sensitivity and lysine acetylation: A potential role for SIRT1. Redox Biol. 52, 102307 (2022).
- Tyrrell, D. J., et al. Blood-cell bioenergetics are associated with physical function and inflammation in overweight/obese older adults. Exp Gerontol. 70, 84-91 (2015).
- Liepinsh, E., et al. Low-intensity exercise stimulates bioenergetics and increases fat oxidation in mitochondria of blood mononuclear cells from sedentary adults. Physiol Rep. 8 (12), e14489 (2020).
- Hedges, C. P., et al. Peripheral blood mononuclear cells do not reflect skeletal muscle mitochondrial function or adaptation to high-intensity interval training in healthy young men. J Appl Physiol. 126 (2), 454-461 (2019).
- DeConne, T. M., Muñoz, E. R., Sanjana, F., Hobson, J. C., Martens, C. R. Cardiometabolic risk factors are associated with immune cell mitochondrial respiration in humans. Am J Physiol Heart Circ Physiol. 319 (2), H481-H487 (2020).
- Zhou, B., et al. Boosting NAD level suppresses inflammatory activation of PBMCs in heart failure. J Clin Invest. 130 (11), 6054-6063 (2020).
- Altintas, M. M., DiBartolo, S., Tadros, L., Samelko, B., Wasse, H. Metabolic changes in peripheral blood mononuclear cells isolated from patients with end stage renal disease. Front Endocrinol (Lausanne). 12, 629239 (2021).
- Pence, B. D., Yarbro, J. R. Aging impairs mitochondrial respiratory capacity in classical monocytes). Exp Gerontol. 108, 112-117 (2018).
- vander Windt, G. J. W., Chang, C. H., Pearce, E. L. Measuring bioenergetics in T Cells using a Seahorse extracellular flux analyzer. Curr Protoc Immunol. 113, 11-14 (2016).
- Chacko, B. K., et al. Methods for defining distinct bioenergetic profiles in platelets, lymphocytes, monocytes, and neutrophils, and the oxidative burst from human blood. Lab Invest. 93 (6), 690-700 (2013).
- Buck, M. D., et al. Mitochondrial dynamics controls T Cell fate through metabolic programming. Cell. 166 (1), 63-76 (2016).
- Quinn, K. M., et al. Metabolic characteristics of CD8. Nat Commun. 11 (1), 2857 (2020).
- Scandalis, L., et al. Skeletal muscle mitochondrial respiration and exercise intolerance in patients with heart failure with preserved ejection fraction. JAMA Cardiol. 8 (6), 575-584 (2023).
- Rausser, S., et al. Mitochondrial phenotypes in purified human immune cell subtypes and cell mixtures. Elife. 10, e70899 (2021).
- Kramer, P. A., et al. Bioenergetics and the oxidative burst: protocols for the isolation and evaluation of human leukocytes and platelets. J Vis Exp. (85), e51301 (2014).
- Kramer, P. A., Ravi, S., Chacko, B., Johnson, M. S., Darley-Usmar, V. M. A review of the mitochondrial and glycolytic metabolism in human platelets and leukocytes: implications for their use as bioenergetic biomarkers. Redox Biol. 2, 206-210 (2014).
- Teodoro, J. S., Machado, I. F., Castela, A. C., Rolo, A. P., Palmeira, C. M. The evaluation of mitochondrial membrane potential using fluorescent dyes or a membrane-permeable cation (TPP+) electrode in isolated mitochondria and intact cells. Methods Mol Biol. 2184, 197-213 (2020).
- Hassan, H., Zakaria, F., Makpol, S., Karim, N. A. A link between mitochondrial dysregulation and idiopathic autism spectrum disorder (ASD): Alterations in mitochondrial respiratory capacity and membrane potential. Curr Issues Mol Biol. 43 (3), 2238-2252 (2021).
- Williams, A. S., et al. Disruption of Acetyl-Lysine turnover in muscle mitochondria promotes insulin resistance and redox stress without overt respiratory dysfunction. Cell Metab. 31 (1), 131-147 (2020).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods Enzymol. 542, 163-181 (2014).
- Chowdhury, S. R., Djordjevic, J., Albensi, B. C., Fernyhough, P. Simultaneous evaluation of substrate-dependent oxygen consumption rates and mitochondrial membrane potential by TMRM and safranin in cortical mitochondria. Biosci Rep. 36 (1), 00286 (2015).
- Vianello, C., et al. High-throughput microscopy analysis of mitochondrial membrane potential in 2D and 3D models. Cells. 12 (7), (2023).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50 (2), 98-115 (2011).
- JoVE, Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE. , (2023).
- Geltink, R. I. K., Kyle, R. L., Pearce, E. L. Unraveling the complex interplay between T cell metabolism and function. Annu Rev Immunol. 36, 461-488 (2018).
- Sukumar, M., et al. Inhibiting glycolytic metabolism enhances CD8+ T cell memory and antitumor function. J Clin Invest. 123 (10), 4479-4488 (2013).
- Gerriets, V. A., et al. Foxp3 and Toll-like receptor signaling balance T. Nat Immunol. 17 (12), 1459-1466 (2016).
- MacIver, N. J., Michalek, R. D., Rathmell, J. C. Metabolic regulation of T lymphocytes. Annu Rev Immunol. 31, 259-283 (2013).
- Desdín-Micó, G., et al. T cells with dysfunctional mitochondria induce multimorbidity and premature senescence. Science. 368 (6497), 1371-1376 (2020).
- Yang, R., et al. Mitochondrial Ca2+ and membrane potential, an alternative pathway for Interleukin 6 to regulate CD4 cell effector function. Elife. 4, 06376 (2015).
- Straub, R. H., Cutolo, M., Buttgereit, F., Pongratz, G. Energy regulation and neuroendocrine-immune control in chronic inflammatory diseases. J Intern Med. 267 (6), 543-560 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten