Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Generierung und Analyse von High-Parameter-Histologiebildern mit Histoflow-Zytometrie
In diesem Artikel
Zusammenfassung
Hier wird ein Verfahren beschrieben, mit dem fünf oder mehr Fluoreszenzparameter mittels Immunfluoreszenzmikroskopie abgebildet werden können. Es wird eine Analysepipeline für die Extraktion einzelner Zellen aus diesen Bildern und die Durchführung von Einzelzellanalysen durch durchflusszytometrie-ähnliche Gating-Strategien skizziert, mit der Zelluntergruppen in Gewebeschnitten identifiziert werden können.
Zusammenfassung
Die Verwendung der Histologie zur Untersuchung der Immunzelldiversität in Gewebeschnitten, wie sie aus dem Zentralnervensystem (ZNS) stammen, ist durch die Anzahl der Fluoreszenzparameter, die gleichzeitig abgebildet werden können, entscheidend begrenzt. Die meisten Untergruppen von Immunzellen wurden mittels Durchflusszytometrie unter Verwendung komplexer Kombinationen von Proteinmarkern definiert, die oft vier oder mehr Parameter zur endgültigen Identifizierung erfordern, was über die Möglichkeiten der meisten herkömmlichen Mikroskope hinausgeht. Da die Durchflusszytometrie Gewebe dissoziiert und räumliche Informationen verliert, besteht ein Bedarf an Techniken, die räumliche Informationen speichern und gleichzeitig die Rollen komplexer Zelltypen hinterfragen können. Diese Probleme werden hier angegangen, indem eine Methode zur Erweiterung der Anzahl der Fluoreszenzparameter entwickelt wird, die abgebildet werden können, indem die Signale von spektral überlappenden Fluorophoren gesammelt und die Signale jedes einzelnen Fluorophors durch spektrale Entmischung getrennt werden. Diese Bilder werden dann mit einer Analysepipeline verarbeitet, um histologische Bilder mit hohen Parametern aufzunehmen und einzelne Zellen aus diesen Bildern zu extrahieren, so dass die einzigartigen Fluoreszenzeigenschaften jeder Zelle auf Einzelzellebene analysiert werden können. Mit Hilfe von Durchflusszytometrie-ähnlichen Gating-Strategien können Zellen dann in Untergruppen profiliert und auf die Histologieschnitte zurückgeführt werden, um nicht nur ihre Häufigkeit zu quantifizieren, sondern auch festzustellen, wie sie mit der Gewebeumgebung interagieren. Insgesamt wird die Einfachheit und das Potenzial der Verwendung der Histoflow-Zytometrie zur Untersuchung komplexer Immunpopulationen in histologischen Abschnitten demonstriert.
Einleitung
Entzündungen, die von Zellen des Immunsystems und Gliazellen ausgelöst werden, können zu chronischen Erkrankungen des ZNS beitragen, bei denen jede Population die Aktivität der anderen fördern kann 1,2,3. Zu verstehen, wie das Immunsystem mit diesen Elementen des ZNS interagiert, um eine ZNS-Entzündung zu fördern, ist derzeit ein wichtiges Thema von Interesse und wurde durch hochparametrische Techniken wie die Einzelzell-RNA-Sequenzierung erheblich erleichtert. Durch Einzelzell-RNA-Sequenzierung haben wir entdeckt, dass bei mehreren ZNS-Erkrankungen eine umfangreiche Kommunik....
Protokoll
Dieses Protokoll gilt nicht für das Schneiden von Geweben für die Histologie; Bitte lesen Sie Jain et al.18 oder19 für Beschreibungen, wie Gewebe für die Histologie geschnitten werden. Dieses Protokoll kann mit allen geschnittenen Geweben auf Objektträgern verwendet werden. In diesem Artikel werden leistenale Lymphknoten verwendet, die von einem immunisierten Tier isoliert wurden, wie zuvor beschrieben18. Das Verfahren und der Zeitplan für dieses Protokoll sind in Abbildung 1 zusammengefasst. Die Einzelheiten zu den Reagenzien und der Ausrüstung, die in dieser Studie ....
Repräsentative Ergebnisse
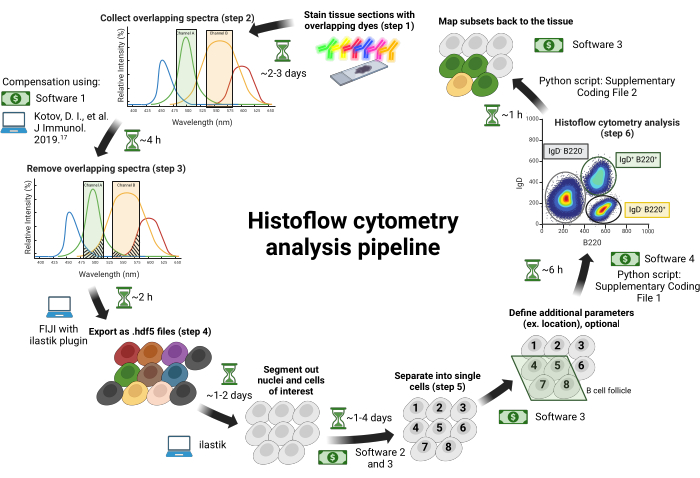
Abbildung 1: Arbeitsablauf der Histoflow-Zytometrie. Die Gewebeschnitte werden mit spektral überlappenden Farbstoffen gefärbt (Schritt 1). Die Bilder werden über einzelne Anregungslaser gesammelt, die mit abstimmbaren Bandpassfiltern gepaart sind, um das spektrale Durchscheinen zwischen den Fluorophoren zu minimieren (Schritt 2). Das spektrale Du.......
Diskussion
Hier wird der Einsatz der Histoflow-Zytometrie beschrieben, eine Technik, die bereits zuvor validiert wurde18. Es wird gezeigt, dass bei der Färbung von Gewebeschnitten mit spektral überlappenden Farbstoffen dieses Durchscheinen über Kanäle mittels spektraler Kompensation entfernt werden kann, was dazu führt, dass eine größere Anzahl von Fluoreszenzparametern eindeutig aufgelöst wird, als dies normalerweise mit herkömmlichen Methoden möglich wäre. Da Histologiebilder mit hohen Parameter.......
Offenlegungen
Die Autoren haben keine finanziellen Interessenkonflikte.
Danksagungen
Wir danken der Hotchkiss Brain Institute Advanced Microscopy Platform für die Bildgebungsinfrastruktur und -expertise. RWJ wurde durch ein Postdoktorandenstipendium des Eyes High-Programms der University of Calgary und durch ein uneingeschränktes Bildungsstipendium der Multiple Sclerosis Society of Canada und Roche Canada unterstützt. VWY erhielt eine Gehaltsunterstützung aus dem Tier-1-Programm des Canada Research Chair. Diese Arbeit wurde durch Betriebsmittel des Canadian Institutes of Health Research Grant 1049959, des Multiple Sclerosis Society of Canada Grant 3236 und des US-Verteidigungsministeriums des Congressionally Directed Multiple Sclerosis Research Progra....
Materialien
| Name | Company | Catalog Number | Comments |
| 100% Ethanol | Sigma | 676829-1L | |
| 4% PFA | Electron Microscopy Sciences | 157-4 | |
| Anaconda | N/A | N/A | https://www.anaconda.com/download |
| Bovine Serum Albumin | Sigma | A4503-50G | |
| Cold fish stain gelatin | Sigma | G7765 | |
| Collating multichannel data from Imaris.ipynb script | N/A | N/A | https://github.com/elliottcalgary/Histoflow-Cytometry-Analysis- |
| Convert FlowJo output to txt file for Cell selection in Imaris.ipynb script | N/A | N/A | https://github.com/elliottcalgary/Histoflow-Cytometry-Analysis- |
| Donkey anti-rat Alexa Fluor 647 | JacksonImmunoResearch | 712-605-153 | 1:300 concentration |
| Donkey anti-rat DyLight 405 | Jackson ImmunoResearch | 712-475-153 | 1:200 concentration |
| Donkey Serum | JacksonImmunoResearch | 017-000-001 | |
| F(ab')2-Goat anti-Mouse IgG PerCP-eFluor 710 | Thermofisher | 46-4010-82 | 1:25 concentration |
| FIJI | N/A | N/A | https://imagej.net/software/fiji/ |
| FlowJo | FlowJo LLC | Software 4 | |
| Fluorescence spectraviewer | https://www.thermofisher.com/order/fluorescence-spectraviewer/#!/ | ||
| Fluoromount-G | Southern Biotech | 0100-01 | |
| Fresh frozen human tonsil sections | amsbio | HF-707 | |
| Glass coverslip | VWR | 48393 106 | |
| Goat anti-human IgA Alexa Fluor 488 | JacksonImmunoResearch | 109-546-011 | 1:400 concentration |
| Goat anti-human IgG Cy3 | JacksonImmunoResearch | 709-166-098 | 1:400 concentration |
| Goat anti-human IgM Dylight 405 | JacksonImmunoResearch | 109-476-129 | 1:300 concentration |
| Goat anti-rabbit A546 | Thermo Fisher Scientific | A-11035 | 1:250 concentration |
| Goat anti-rabbit IgG PE-Alexa Fluor 610 | Thermofisher | A-20981 | 1:250 concentration |
| Horse Serum | Sigma | H1138 | |
| Ilastik | N/A | N/A | https://www.ilastik.org/ |
| Ilastik FIJI plugin | N/A | N/A | https://www.ilastik.org/documentation/fiji_export/plugin |
| Imaris File Converter | Oxford Instruments | Software 2 | |
| Imaris with cell module | Oxford Instruments | Software 3 | |
| kimwipe | Kimtech | 34155 | |
| LasX Life Science software | Leica | Software 1 | |
| Mouse anti-human CD20 | VWR | CA95024-322 | 1:40 concentration |
| Mouse anti-human CD38 APC-R700 | BD Biosciences | 564980 | 1:20 concentration |
| Normal Goat Serum | JacksonImmunoResearch | 005-000-001 | |
| Normal Mouse Serum | JacksonImmunoResearch | 015-000-001 | |
| Normal Rabbit Serum | JacksonImmunoResearch | 011-000-001 | |
| Normal Rat Serum | JacksonImmunoResearch | 012-000-120 | |
| Nuclear Yellow | Abcam | ab138903 | Dissolve in DMSO at a concentration of 2 mg/ml and store at 4°C in the dark |
| PAP pen | Cedarlane | MU22 | |
| PBS | Gibco | 10010-023 | |
| Rabbit anti-human Ki67 | Abcam | ab15580 | 1:500 concentration |
| Rabbit anti-mouse Iba1 | Wako | 019-19741 | 1:500 concentration |
| Rat anti-human Blimp1 | Thermofisher | 14-5963-82 | 1:40 concentration |
| Rat anti-mouse B220 Alexa Fluor 647 | BioLegend | 103226 | 1:250 concentration |
| Rat anti-mouse CD138 | Biolegend | 142502 | 1:200 concentration |
| Rat anti-mouse CD3 PE-eFluor 610 | Thermo Fisher Scientific | 61-0032-82 | 1:40 concentration |
| Rat anti-mouse CD4 Alexa Fluor 488 | BioLegend | 100529 | 1:200 concentration |
| Rat anti-mouse CD45 allophycocyanin-R700 | BD Biosciences | 565478 | 1:50 concentration |
| Rat anti-mouse IgD PerCP-eFluor 710 | Thermo Fisher Scientific | 46-5993-82 | 1:50 concentration |
| SP8 Confocal microscope | Leica | ||
| Triton X-100 | Sigma | X100-500ml | |
| Trueblack | Biotium | 23007 | |
| Tween-20 | Sigma | P7949-500ml | |
| Ultracomp ebeads | Thermofisher | 01-2222-42 |
Referenzen
- Bar-Or, A., Li, R. Cellular immunology of relapsing multiple sclerosis: interactions, checks, and balances. Lancet Neurol. 20 (6), 470-483 (2021).
- Borst, K., Dumas, A. A., Prinz, M. Microglia: Immune and non-immune functio....
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten