Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Hyperpolarisierte 129Xe LungenMRT und Spektroskopie bei mechanisch beatmeten Mäusen
In diesem Artikel
Zusammenfassung
Die hyperpolarisierte Xenon-MRT kann die regionale Lungenmikrostruktur (Luftraumdimensionen) und die Physiologie (Beatmung und Gasaustausch) in der translationalen Forschung und klinischen Versorgung quantifizieren. Obwohl es eine Herausforderung darstellt, kann es in präklinischen Studien vergleichbare pulmonale Erkenntnisse liefern. Dieses Protokoll beschreibt die Infrastruktur und die Verfahren, die für die Durchführung einer routinemäßigen Xenon-Lungen-MRT bei Mäusen erforderlich sind.
Zusammenfassung
Hyperpolarisiertes (HP) Xenon-129 (129Xe) ist ein inhalatives Kontrastmittel für die Magnetresonanztomographie (MRT) mit einzigartigen spektralen und physikalischen Eigenschaften, das zur Quantifizierung der Lungenphysiologie genutzt werden kann, einschließlich Beatmung, eingeschränkter Diffusion (Alveolen-Luftraum-Größe) und Gasaustausch. Beim Menschen wurde es zur Beurteilung der Schwere und des Fortschreitens der Erkrankung bei einer Vielzahl von Lungenerkrankungen eingesetzt und ist in den Vereinigten Staaten und im Vereinigten Königreich für den klinischen Einsatz zugelassen. Über die klinische Anwendung hinaus ist die Fähigkeit der 129Xe-MRT, die pulmonale Pathophysiologie nichtinvasiv zu beurteilen und ortsaufgelöste Informationen zu liefern, für die präklinische Forschung wertvoll. Unter den Tiermodellen sind Mäuse aufgrund der Zugänglichkeit von gentechnisch veränderten Krankheitsmodellen am weitesten verbreitet. Hier ist die 129Xe-MRT vielversprechend als minimalinvasive, strahlenfreie und empfindliche Technik zur longitudinalen Überwachung des Fortschreitens der Lungenerkrankung und des Therapieansprechens (z. B. in der Wirkstoffforschung). Diese Technik kann auf präklinische Anwendungen ausgeweitet werden, indem ein MRT-getriggertes Freiatemgerät oder ein mechanisches Beatmungsgerät zur Gasabgabe eingesetzt wird. Hier beschreiben wir die Schritte und stellen Checklisten zur Verfügung, um eine robuste Datenerfassung und -analyse zu gewährleisten, einschließlich der Erstellung eines thermisch polarisierten Xenon-Gasphantoms für die Qualitätskontrolle, der Optimierung der Polarisation, des Umgangs mit Tieren (Sedierung, Intubation, Beatmung und Versorgung von Mäusen) und Protokolle für Beatmung, eingeschränkte Diffusion und Gasaustauschdaten. Während die präklinische 129Xe-MRT in verschiedenen Tiermodellen (z. B. Ratten, Schweinen, Schafen) angewendet werden kann, konzentriert sich dieses Protokoll auf Mäuse aufgrund der Herausforderungen, die ihre kleine Anatomie mit sich bringt, die durch ihre Erschwinglichkeit und die Verfügbarkeit vieler Krankheitsmodelle ausgeglichen werden.
Einleitung
Während Lungenerkrankungen nach wie vor die Hauptursachen für weltweite Morbidität und Mortalitätsind 1, haben sich die Ergebnisse für Patienten in den letzten zehn Jahren dramatisch verbessert. Diese Verbesserungen sind zum Teil auf zwei Faktoren zurückzuführen. Erstens priorisieren klinische Phase-III-Studien nun Veränderungen der Lungenfunktion als Endpunkte und nicht mehr die Mortalität, was die Arzneimittelstudien beschleunigt 2,3,4,5. Zweitens haben Fortschritte bei verbesserten Tiermodellen Einblicke in Krankheitsmechanismen geliefert und die Therapieentwicklung unterstützt 6,7. Mausmodelle werden oft für die translationale Forschung bevorzugt, da sie physiologische Parallelen zum Menschen, Erschwinglichkeit und eine schnelle Krankheitsentwicklung bieten. Die Gentechnik hat das Spektrum und die Qualität der verfügbaren Modelle erweitert: Die International Mouse Strain Resource umfasst heute über 32.000 Mausstämme8, verglichen mit nur 4.218 Rattenstämmen (Rat Genome Database9). Diese Modelle haben neue Wege für die Untersuchung mechanistischer Treiber und Therapieansprechen für eine Reihe von Lungenerkrankungen eröffnet, darunter chronisch obstruktive Lungenerkrankung (COPD)10, Mukoviszidose (CF)11, Lungenfibrose12,13, pulmonale Hypertonie14,15 und Asthma16.
Leider ist die Lungenforschung an Mäusen durch die verfügbaren Techniken zur Quantifizierung der Krankheitslast begrenzt. Studien stützen sich häufig auf terminale Verfahren, die 1) Informationen über die gesamte Lunge (biochemische Assays) oder lokalisierte Informationen (Histologie) liefern und 2) Querschnittsdesigns und große Stichprobengrößen erfordern. Damit erfassen sie weder räumliche noch zeitliche Krankheitsdynamiken. Im Gegensatz dazu kann die nicht-invasive, dreidimensionale Bildgebung die Struktur, die molekularen Prozesse und die Funktion in der Lunge im Zeitverlauf beurteilen.
Die Lungenstruktur (z. B. Anomalien der Atemwege und interstitielle Fibrose) kann mit Ultrakurz-Echozeit-MRT (UTE) und Mikrocomputertomographie (μCT) mit hoher Auflösung sichtbar gemacht werden. Funktionelle und mechanistische Informationen (z. B. Beatmung, Perfusion, Tumorstoffwechsel und Entzündungsprozesse) können mit exogenen Kontrastmitteln (z. B. Xenon-verstärkte CT und sauerstoffverstärkte UTE) und ionisierenden nuklearmedizinischen Ansätzen (d. h. Positronen-Emissions-Tomographie [PET] und Einzelphotonen-Emissions-Computertomographie [SPECT]) gewonnen werden. Die funktionelle Bildgebung ist jedoch aufgrund des geringen Kontrast-Rausch-Verhältnisses (insbesondere für sauerstoffverstärkte UTE bei den hohen Magnetfeldstärken, die für die präklinische MRT verwendet werden, bei denen T1 verlängert wird) ohne den Einsatz ionisierender Modalitäten mit höheren als normalen Strahlungswerten eine Herausforderung. Während die Bildgebung mit diesen Modalitäten in Tiermodellen mit herkömmlichen Dosen gut vertragen wird, kann die kumulative Bestrahlung die Ergebnisse in Studien zu Immunologie, Entzündungen und Lungenkrebs verfälschen17. Die hyperpolarisierte (HP) Xenon-129 (129Xe) Magnetresonanztomographie (MRT) liefert jedoch minimalinvasive, nicht strahlende und hochempfindliche strukturelle und funktionelle Informationen. Obwohl diese Technik in der präklinischen Forschung zur Charakterisierung von Erkrankungen wie Emphysem18,19, Fibrose20, Lungenkrebs21, COPD22 und strahleninduzierter Lungenschädigung23 zu einem oder mehreren Zeitpunkten eingesetzt wurde, wird sie im präklinischen Umfeld nach wie vor zu wenig genutzt.
Um eine routinemäßige, präklinische 129Xe-MRT zu ermöglichen, sind mehrere Voraussetzungen erforderlich, darunter institutionelle regulatorische Unterstützung, ein Hyperpolarisationsgerät, eine 129Xe-abgestimmte Radiofrequenzspule (RF) und ein multinuklearfähiger Scanner. Obwohl fortgeschrittene Anwendungen 24,25,26,27,28,29,30,31,32,33 eine herstellerspezifische Impulsprogrammierung erfordern, die außerhalb des Geltungsbereichs dieses Protokolls liegt, können grundlegende Anwendungen mit bescheidenen Softwaremodifikationen erreicht werden. Daher konzentrieren wir uns auf die Qualitätskontrolle, die Handhabung von Magnetisierungen, die Datenerfassung und den Umgang mit Tieren – einschließlich der mechanischen Beatmung –, die für die präklinische 129Xe-MRT einzigartig sind (Abbildung 1).
Bisher wurden bei der Bildgebung von Kleintieren 129Xe drei MR-sichere Gaszufuhransätze eingesetzt, die jeweils Vor- und Nachteile haben: frei atmend, kolbengetrieben und Druckabfall. Die freie Atmung ermöglicht eine spontane Inhalation ohne Verletzungsgefahr durch Intubation oder Tracheotomie, verbraucht jedoch deutlich mehr HP-Gas und kann Bewegungsartefakte einführen34,35. Kommerzielle kolbengetriebene Geräte sind selbstkalibrierend und sofort einsatzbereit, können aber unerschwinglich teuer sein36. Der hier verwendete Druckabfall-basierte Ansatz ist in der Literatur gut beschrieben, modular, anpassbar und wird mit Open-Source-Code 37,38,39,40 ausgeführt. Darüber hinaus ist es kostengünstig und kostet in der Regel weniger als 10.000 US-Dollar und einige Wochen dedizierte Entwicklungszeit. Das Druckabfallbeatmungsgerät liefert 129Xe aus einem Dosisbeutel in einem unter Druck stehenden Kanister, während es den Atemwegsdruck einer intubierten Maus überwacht.
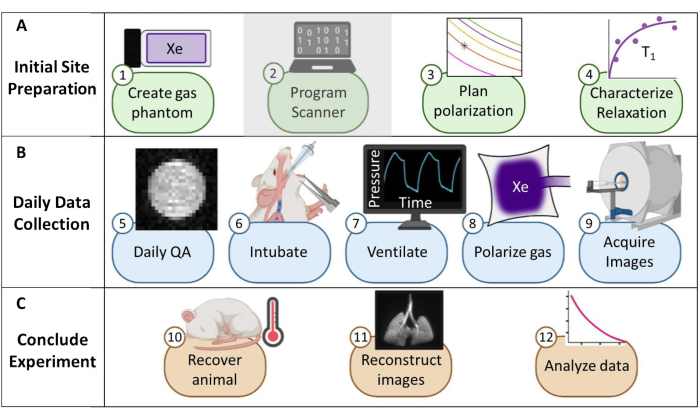
Abbildung 1: Überblick über das Protokoll zur routinemäßigen Erfassung von Xenon-129 (129Xe) Magnetresonanztomographie (MRT) bei Mäusen. (A) Schritte zur Ersteinrichtung. (Hinweis: Die Scannerprogrammierung ist für jeden Anbieter einzigartig und wird in diesem Protokoll nicht beschrieben.) (B) Schritte zur täglichen Qualitätssicherung (QS) und Tierdaten. (C) Schritte für einen erfolgreichen Abschluss des Experiments und die Datenanalyse. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Hier sammeln und analysieren wir die drei gängigen Klassen von 129Xe-MRT-Daten: Beatmung, diffusionsgewichtete Bildgebung (Alveolen-Luftraum-Größe) und Gasaustausch. Beatmungsbilder zeigen die Verteilung des eingeatmeten 129Xe-Gases. Regionen der Lunge mit reduziertem Luftstrom erscheinen in HP-Gasbildern dunkel, und die Pathologie wird durch das Volumen der fehlerhaften Beatmung quantifiziert. Beim Menschen hat der Prozentsatz der Beatmungsdefekte (VDP) eine starke Wiederholbarkeit41,42 und eine hohe Empfindlichkeit gegenüber Lungenobstruktion bei Krankheiten wie COPD 43,44,45 und Asthma46,47 gezeigt.
Die eingeschränkte Diffusion der 129Xe-Atome im Luftraum kann über den scheinbaren Diffusionskoeffizienten (ADC) gemessen werden und dient als Surrogat für die Luftraumgröße. Der ADC wird berechnet, indem ein Basisbild (b0) ohne Diffusionsgewichtung und ein oder mehrere Bilder aufgenommen werden, die in Gegenwart einer bipolaren gradienteninduzierten Diffusionsgewichtung (bN) aufgenommen wurden. Ein erhöhter ADC spiegelt eine Vergrößerung des Luftraums aufgrund von Alterung oder emphysematösem Umbau wider18,48. Darüber hinaus ermöglicht die Verwendung mehrerer b-Wert-Bilder (≥4) die Berechnung detaillierterer morphometrischer Informationen (z. B. mittlerer linearer Schnittpunkt)49,50.
Der Gasaustausch kann charakterisiert werden aufgrund von 1) der Löslichkeit von 129Xe im Kapillarmembrangewebe, im Plasma und in den Erythrozyten (rote Blutkörperchen) und 2) durch die chemische Verschiebung von 129Xe um >200 ppm im Downfield, wenn es in diesen Kompartimenten gelöst wird. Sowohl spektroskopische als auch bildgebende Daten geben Aufschluss über kardiopulmonale Erkrankungen (z. B. pulmonale Hypertonie und Linksherzinsuffizienz 51,52,53). Während viele Spezies (Menschen, Hunde und Ratten) einzigartige spektrale Peaks aufweisen, die von jedem Kompartiment ausgehen, fehlt Mäusen aufgrund von Unterschieden in den Wechselwirkungen zwischen Hämoglobin und Xenon ein einzigartiges Erythrozytensignal. Stattdessen werden in Mäusen alle gelösten Komponenten in einem einzigen Signal zusammengefasst54. Es ist jedoch möglich, eine deutliche Erythrozytenresonanz bei transgenen Mäusen zu beobachten, die menschliches Hämoglobin exprimieren, wie sie in Modellen der Sichelzellkrankheit verwendet werden54. Insgesamt bieten die gelöste 129-Xe-Spektroskopie und -Bildgebung einzigartige Einblicke in die kardiopulmonale Pathophysiologie bei Mäusen 55,56.
Bevor Sie dieses Protokoll versuchen, ist es notwendig, Hintergrundinformationen über den MRT-Scanner, die mechanische Beatmung und die für Mausstudien erforderlichen Maushandhabungstechniken zu verstehen. Vor Beginn von Tierversuchen müssen alle Verfahren vom örtlichen Institutional Animal Care and Use Committee (IACUC)57 genehmigt werden. Da das gesamte magnetische Moment, das in der Lunge der Maus zur Verfügung steht, von Natur aus gering ist (d. h. das Tidalvolumen ~250 μL), muss die Voxelgröße 1000-fach kleiner sein als beim Menschen, um eine anatomisch äquivalente Auflösung zu erreichen. Auch die Atemfrequenz der Maus ist außerordentlich schnell (>100 Atemzüge/Minute). Daher sind die für die Bildgebung beim Menschen üblichen Verfahren mit nur einem Atemanhalten nicht durchführbar. Stattdessen können nur wenige HF-Anregungen in jedem Atemzug angewendet werden, so dass 129Xe-Bilder über Dutzende bis Hunderte von Atemzügen kodiert werden müssen. Eine Impulsprogrammierung kann erforderlich sein, um ein externes Triggern von Aufnahmen zu ermöglichen und Slices, Phasencodierungen und/oder diffusionsgewichtete Bilder ordnungsgemäß zu schleifen, während das Signal-Rausch-Verhältnis (SNR), die Auflösung und die Scandauer ausgeglichen werden. Hier gibt das Beatmungsgerät einmal pro Atemzug einen TTL-Impuls (Transistor-Transistor-Logik) aus, um die Datenerfassung auszulösen (Abbildung 2).
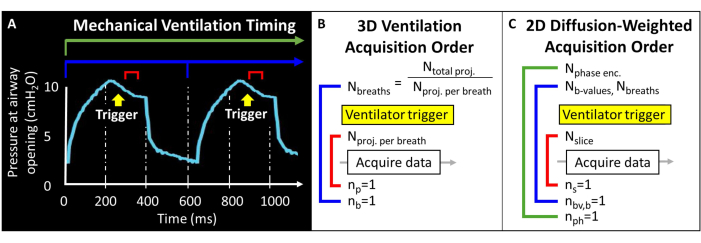
Abbildung 2: Repräsentativer Zeitpunkt für die maschinelle Beatmung und Datenerfassung. (A) Die benutzergesteuerte Beatmung kann die Datenerfassung am Ende der Inspiration, während des Atemanhaltens oder am Ende des Ausatmens auslösen. (B) Für diese radiale 3D-Beatmungssequenz definiert der Benutzer die Gesamtzahl der erfassten Projektionen und die Anzahl der Projektionen pro Atemzug. (C) Für ein schichtselektives, diffusionsgewichtetes 2D-Bild definiert der Benutzer die Reihenfolge der Schichten, b-Wert-Bilder und Phasenkodierungen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Um eine zuverlässige Beatmung und 129Xe-Verabreichung zu ermöglichen, sind robuste Sedierungs- und Intubationsverfahren erforderlich. Für jede Studie müssen die nachgelagerten Wirkungen jedes Anästhetikums berücksichtigt werden - einschließlich Änderungen der Minutenbeatmung, der Herzfrequenz (HF) und des Blutdrucks 58,59,60,61,62,63,64,65,66. Während eine Vielzahl von Beruhigungsmitteln für die präklinische HP-Gas-MRT verwendet wurde, verwenden wir aufgrund seiner Verfügbarkeit, Kosteneffizienz, Zuverlässigkeit und Dauer eine Mischung aus Ketamin, Xylazin und Acepromazin67,68. Nach der Sedierung müssen die Tiere intubiert werden, um eine effektive mechanische Beatmung zu gewährleisten. Die Intubation von Mäusen ist aufgrund der geringen Größe ihrer Anatomie schwierig, daher ist es wichtig, diese Technik gründlich zu trainieren. Wir ermutigen die Prüfärzte, die veröffentlichten Videoprotokollezu überprüfen 69,70. Da die meisten kommerziellen Intubationskanülen Edelstahl enthalten, führen wir eine Technik zur Herstellung metallfreier (d. h. MRT- und HP-Gas-kompatibler), keilförmiger Kanülen ein, die an den Durchmesser der Atemwege angepasst werden können, um eine luftdichte Abdichtung mit der Trachealwand der Maus zu schaffen.
Da 129Xe-Bilder über viele Atemzüge hinweg gesammelt werden, sind die Einstellungen des Beatmungsgeräts von entscheidender Bedeutung. Schützende Beatmungsstrategien müssen sorgfältig abgewogen werden, um Lungenschäden zu verhindern 71,72,73,74. Insbesondere die Verwendung eines niedrigen Tidalvolumens (TV), eines moderaten positiven endexspiratorischen Drucks (PEEP) und alveolärer Rekrutierungsmanöver (RMs) verringert das Risiko einer beatmungsinduzierten Lungenverletzung bei menschlichen Patienten und Tiermodellen 75,76,77,78,79,80,81. Hier empfehlen wir eine einfache Technik, die mit einer mechanischen 129Xe-Beatmung mit Druckabfall kompatibel ist, die schützend ist und ein ausreichendes 129Xe-Bild-SNR bietet. Konkret wenden wir PEEP an, indem wir ein handelsübliches PEEP-Ventil an die Ausatemleitung des Beatmungsgeräts anschließen. Um RMs durchzuführen, muss die Ausatemleitung geschlossen werden, so dass das Tier mehrere Einatmungen ohne Ausatmung erhält, bis ein Zieldruck und eine Zieldauer erreicht sind.
Durchgehend stellen wir allgemeine Beatmungseinstellungen zur Verfügung, aber es wird empfohlen, die Literatur zu überprüfen, um spezifische Studienziele zu erreichen82,83. Neben der Überwachung des inspiratorischen Spitzendrucks während der mechanischen Beatmung ist es wichtig, die Temperatur des Tieres zu überwachen, was mit Standardmethoden zur Überwachung der Maustemperatur erfolgen kann. Die Überwachung der Herzfrequenz über ein Elektrokardiogramm (EKG) ist zwar nicht erforderlich, kann aber von Vorteil sein. Das EKG kann anzeigen, ob ein Tier aus der Sedierung, einer Überdosierung oder einer Belastung erwacht, so dass der Forscher eingreifen kann.
Das von uns beschriebene Protokoll ist darauf ausgelegt, 129Xe-3D-radiale Beatmungsdaten61, diffusionsgewichtete 2D-GRE-Daten76 und dynamische Impulserfassungsspektroskopie-Gasaustauschdaten zu erfassen. Dieses Protokoll zielt darauf ab, die Lücke zwischen der präklinischen Forschung in Kleintiermodellen und dem Potenzial der 129Xe-MRT zu schließen, um unser Verständnis von Lungenerkrankungen zu verbessern.
Protokoll
Alle hier beschriebenen Methoden wurden vom Institutional Animal Care and Use Committee (IACUC) des Cincinnati Children's Hospital Medical Center genehmigt.
1. Erstvorbereitung des Standorts
- Erstellen und testen Sie ein thermisch polarisiertes 129Xe-Gasphantom (Abbildung 3).
- Besorgen Sie sich ein Gefäß aus Borosilikatglas (~60 ml), ein Kolbenventil mit einem O-Ring mit Frontdichtung und einen geschliffenen Schaft aus Borosilikatglas, alle mit einer Nennleistung von bis zu 150 psig. Stellen Sie sicher, dass keine magnetischen Teile vorhanden sind. Befestigen Sie eine Klemmverschraubung am Glasstiel. Festziehen, um eine gasdichte Abdichtung herzustellen.
- Schließen Sie das Gefäß an eine Vakuumpumpe und einen Sauerstoffbehälter an, wie in Abbildung 3A beschrieben. Vakuumbehälter bis weniger als 100 mTorr Absolutdruck.
- Füllen Sie das Gefäß mit Sauerstoff bis zu einem Druck von 1,5 atm, um den 129Xe T1 von > 30 min auf ~2 s zu reduzieren (bei 7 T Magnetfeldstärke; Verwenden Sie für einen 9,4-T-Scanner 1,6 atm Sauerstoff). Gefäß versiegeln.
ANMERKUNG: Bei höheren Feldstärken ist ein etwas höherer Sauerstoffpartialdruck erforderlich, um T1≤ 2 s84 zu erreichen. - Füllen Sie ein gasundurchlässiges Reservoir mit 400 mL isotopenangereichertem Xenon (85% 129Xe).
HINWEIS: Die natürliche Häufigkeit von Xenon (26% 129Xe) kann ebenfalls verwendet werden, aber die Signalmittelung muss erhöht werden, um die ~3-fache Verringerung des SNR abzuschwächen. - Verbinden Sie das Gefäß mit dem Reservoir von 129Xe. Vakuumschlauch bis zu einem Absolutdruck von weniger als 100 mTorr.
- Füllen Sie eine Tischflüssigkeit N2 Dewar mit offenem Mund auf ~90%. Tauchen Sie den Boden des Behälters (~5 cm) in flüssigen Stickstoff, um O2 zu kondensieren und ein Vakuum zu erzeugen (Abbildung 3B). Öffnen Sie im eingetauchten Zustand das Ventil, damit 129Xe aus dem Behälter in den Behälter fließen kann (Abbildung 3C).
- Verschließen Sie das Kolbenventil, indem Sie langsam an der Spindel ziehen, bis das Zuflussloch im Kolben am O-Ring vorbei gezogen wird. Unmittelbar nachdem das Loch den O-Ring passiert hat, ziehen Sie es von Hand fest, um das Gefäß abzudichten. Nehmen Sie das Gefäß von flüssigem Stickstoff und lassen Sie es auftauen.
HINWEIS: Nach dem Auftauen wird das Gefäß auf ~4,5 atm (2 atm O2 + 2,5 atm 129Xe) unter Druck gesetzt. - Schützen Sie die Glaswaren (z. B. Behälter in einen gepolsterten Rohrbehälter aus Polyvinylchlorid (PVC) einsetzen, Abbildung 3D).
HINWEIS: Bei ordnungsgemäßer Wartung kann das Phantom den Druck für ein Jahrzehnt oder länger aufrechterhalten. - Messen Sie den T1 des Phantoms (z. B. mit einer spektroskopischen Inversionswiederherstellungssequenz). Bestätigen Sie T1 < 2 s für 7 T Scanner. Gleissignal und T1 im Zeitverlauf für die Qualitätssicherung (QA).
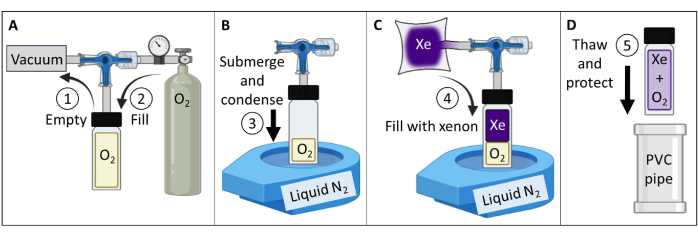
Abbildung 3: Erstellung eines thermisch polarisierten 129Xe-Gasphantoms, das von dem in Schritt 1.1 beschriebenen Protokoll geleitet wird. Die Partialdrücke O2 und 129Xe können verändert werden, um den T1 so anzupassen, dass er das entsprechende 129Xe T1-fache und die Signalstärke bei einer gegebenen Feldstärke84 ergibt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Führen Sie die Qualitätssicherung mit dem thermisch polarisierten Gasphantom durch (Tabelle 1 und Abbildung 4).
- Platzieren Sie die 129Xe-Spule im Isozentrum des Magneten und zentrieren Sie das 129Xe-Gasphantom in der Spule. Stellen Sie in einer einzelnen Impuls-und-Erfassungssequenz ("Einzelimpuls") die Arbeitsfrequenz so ein, dass sie der ungefähren Gasfrequenz von 129Xe im Phantom entspricht (~83,07 MHz bei 7T).
- Zentrieren Sie die Erfassungs- und Anregungsfrequenzen auf die 129Xe Larmor-Frequenz und verwenden Sie diese Frequenz für alle 129Xe-Scans zur Phantomkalibrierung und Qualitätskontrolle. In Tabelle 1 finden Sie experimentelle Parameter für alle QA-Scans. Vergewissern Sie sich, dass das Phantom mit einem Phantomlokalisierer zentriert ist (Abbildung 4A).
- Führen Sie ein Nutationsexperiment durch, um den Flip-Winkel zu kalibrieren: Unter der Annahme, dass das SNR ausreichend ist, verwenden Sie einzelne HF-Impulse mit einem Wiederholungszeitabstand (TR) > 5 x T1. Erhöhen Sie bei jeder Erfassung schrittweise die HF-Leistung, bis das Signal null wird und zu invertieren beginnt. Der hier verwendete Standard lautet: Anzahl der Impulse = 65; TR = 10 s; Impulsdauer = 125 μs; HF-Leistung = 1-13,8 W, in Schritten von 0,2 W
- Fourier-Transformation und Phase des ersten Spektrums (d. h. des Spektrums mit der geringsten HF-Leistung). Wenden Sie für alle Spektren die gleiche Phasenlage an. Plotten Sie die realen Spektren als Funktion der HF-Impulsleistung (Abbildung 4B).
- Die Leistung, die einen Null-Peak (d. h. eine minimale Peakhöhe) erzeugt, entspricht dem 180°-Flip-Winkel. Erreichen Sie einen Schwenkwinkel von 90°, indem Sie die gleiche Leistung bei halber Pulslänge verwenden, die zum Erzeugen des Schwenkwinkels von 180° erforderlich ist. Vorausgesetzt, die Scannersoftware lässt dies zu, stellen Sie diese 90°-Referenzleistung und Impulslänge für die anschließende Flip-Winkel-Skalierung ein.
- Verwenden Sie einen einzelnen Impuls zum Shiming, indem Sie die volle Breite bei halbem Maximum des 129Xe-Spektrums (TR ~ 1 s) minimieren. Zentrieren Sie die Frequenz nach dem Shimming ggf. neu. Zeichnen Sie die Hälfte maximal in voller Breite auf.
- Führen Sie den QA-Scan des 129Xe durch (Tabelle 1 und Abbildung 4C). Zeichnen Sie QA-Daten auf: SNR, mittleres Phantomsignal und Standardabweichung des Rauschens.
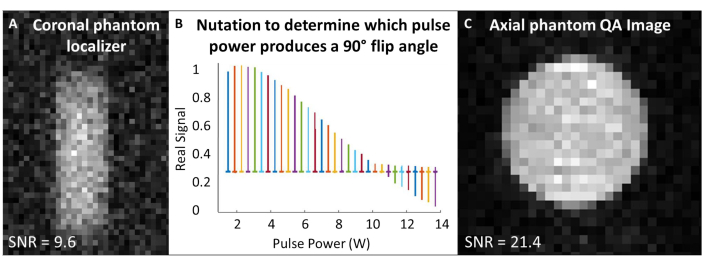
Abbildung 4: Qualitätssicherung vor dem Scan. (A) Ein niedrig aufgelöster 2D-GRE-Koronaphantom-Lokalisierer stellt sicher, dass das Phantom im Magneten zentriert ist. (B) Ein Nutationsexperiment zum Einstellen eines 90°-Pulses zeigt einen Null-Peak beim 180°-Puls. (C) Nach der Lokalisierung und Kalibrierung des Flip-Winkels wird ein 2D-GRE-QA-Bild mit höherer Auflösung aufgenommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Protokoll-Kurzbezeichnung | Beschreibung der Sequenz | TR (ms) | TE (ms) | Durchschnitte / Wiederholungen | Flip-Winkel (°) | Matrixgröße oder NPunkte | Sichtfeld (mm2) | HF BW (kHz) | Dicke der Scheibe / Platte (mm) | Dauer des Scans |
| Einzelner Impuls | Impuls erfassen | 1000 | 1 / 1 | 60 | 2048 | 10 | 1 Sek. | |||
| Phantom-Lokalisierer | 2D GRE | 200 | 3.7 | 20 / 1 | 48 | 60 × 32 | 120 × 48 | 3 | 60 | 2 Minuten |
| Flip-Winkel-Kalibrierung | Impuls erfassen | 7000 | 1 / 65 | 20 | 2048 | 5.12 | 7,5 Minuten | |||
| 129Xe QA | 2D GRE | 5000 | 3.3 | 8 / 1 | 90 | 322 | 322 | 3 | 40 | 21 Minuten |
Tabelle 1: Sequenzparameter für die Qualitätssicherung der Phantomkalibrierung. TR = Wiederholzeit, TE = Echozeit, Npts = Anzahl der Punkte, FOV = Sichtfeld, BW = Bandbreite. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
- Polarisation planen (Abbildung 5A, B).
- Wählen Sie das polarisierte 129Xe-Volumen und die Akkumulationszeit: 400 ml in 15 Minuten sind optimal für dieses Protokoll (Abbildung 5), können aber leicht für andere Anwendungen und Geräte angepasst werden.
- Unter der Annahme eines bekannten Totvolumens innerhalb des Hyperpolarisators (z. B. VTotvolumen = 80 mL) berechnen Sie die Durchflussrate (FXe in SLM) für ein gewünschtes Dosiervolumen V, 129Xe Gasfraktion f und die Akkumulationszeit tacc:
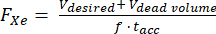 (1)
(1)
HINWEIS: Längere Produktionszeiten führen in der Regel zu einer höheren Polarisation, sind jedoch für die In-vivo-Bildgebung möglicherweise nicht praktikabel. Verwenden Sie ein geeignetes Modell für den Hyperpolarisator 85,86,87,88, um eine Durchflussrate zu bestimmen, die Produktionszeit und Polarisation ausgleicht. Hier wurde das Modell von J. W. Plummer et al.89 (Abbildung 5A) verwendet. Dies gilt für Polarisatoren mit kontinuierlicher Strömung und ist nicht anwendbar für Hyperpolarisatoren mit gestoppter Strömung90. - Polarisieren Sie das Gas nach diesen Parametern, messen Sie die Polarisation mit einem kommerziellen oder selbstgebauten Gerät und vergleichen Sie sie mit der vorhergesagten Polarisation für die Qualitätssicherung.
- Messen Sie den Polarisationsverlust während des Transports. Wenn die Polarisation um einen ausreichend großen Betrag abnimmt (z. B. >10 %), bauen Sie eine magnetische Tragetasche, um die Polarisation während des Transports zu schützen. Siehe Ergänzende Datei 1: Umgang mit Polarisation während des Transports und Ergänzende Abbildung 1.
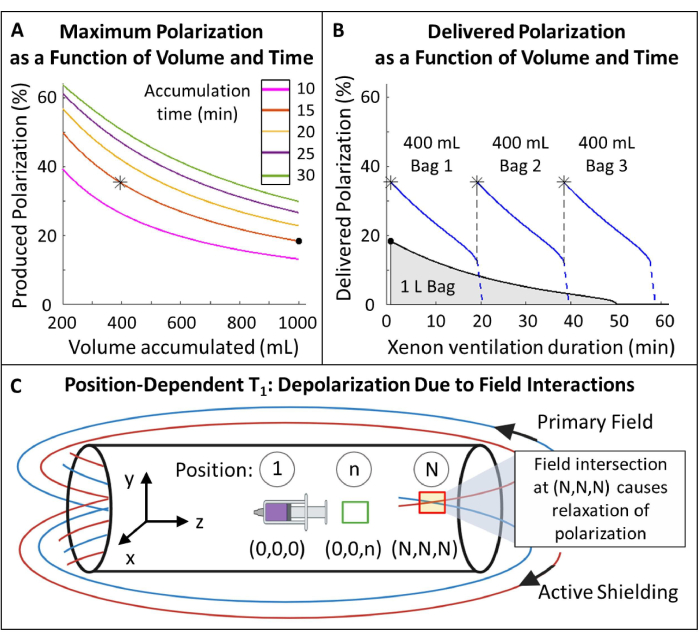
Abbildung 5: Polarisationsmanagement. (A) Polarisation und produziertes Volumen sind eine Funktion der Akkumulationszeit und der Durchflussrate. Ein 400-ml-Beutel mit Gas sorgt für eine hohe anfängliche Polarisation (~35%) über 20 Minuten. Die Verwendung von 1 l Gas mag zwar attraktiv erscheinen, hat aber eine geringere anfängliche Polarisation (~20%). (B) Nach ~15 Minuten Belüftung würde eine 1-Liter-Charge HP 129Xe auf <10 % Polarisation erschöpft sein, während 600 ml Gas116 % übrig blieben. Die Verwendung mehrerer 400-ml-Beutel mit 129Xe sorgt somit für eine höhere durchschnittlich abgegebene Polarisation. C) Stellen, an denen sich das Primärfeld und das aktive Abschirmfeld kreuzen (roter Kasten an Position (N,N,N)), können zu einer schnellen Entspannung des HP 129Xe führen. Die Charakterisierung des Streifenfeldes des Magneten hilft bei der Identifizierung sicherer Zonen, in denen Reservoirs von HP 129Xe ohne schnelle Entspannung platziert werden können (grüner Kasten an Position (0,0,n)). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Datei 1: Umgang mit Polarisation während des Transports. Bitte klicken Sie hier, um diese Datei herunterzuladen.
- Messen Sie den positionsabhängigen T1 von HP 129Xe innerhalb des Streifenfeldes (Abbildung 5C).
- Erstellen Sie Referenzpunkte mit bekannten Abständen und Positionen relativ zum Magnet-Isozentrum entlang der X-, Y- und Z-Dimensionen. Markieren Sie das Isozentrum und beschriften Sie die anderen Positionen n bis N. Die Anzahl der zu untersuchenden Positionen hängt vom verfügbaren Platz ab.
- Hyperpolarisieren Sie ein kleines Volumen von 129Xe (~250 mL) und transportieren Sie es in den MRT-Kontrollraum. Füllen Sie eine große Spritze (50-100 mL) mit 129Xe und platzieren Sie sie am Isozentrum innerhalb des Magneten (Position 1 in Abbildung 5C). Spielen Sie einen ~1° Flip-Winkel-Impuls ab, um das Signal zu messen.
- Lassen Sie die Spritze ~10 Minuten lang in Position und nehmen Sie dann ein weiteres Spektrum auf. Messen Sie das Signal alle 10 Minuten neu, bis das Signal um mindestens 1 T1 abgefallen ist (d. h. das Signal ist auf ~1/3 seines Anfangswerts abgeklungen).
- Starten Sie ein neues T1-Experiment mit einer neuen Spritze 129Xe, indem Sie Schritt 1.4.2 wiederholen.
- Bringen Sie die Spritze in eine neue Position (z. B. Position n in Abbildung 5C) und lassen Sie sie dort 10 Minuten lang. Bringen Sie die Spritze wieder in das Isozentrum zurück, um ein zusätzliches Schwenkwinkelspektrum von ~1° zu erfassen.
- Wiederholen Sie diesen Vorgang: Bewegen Sie die Spritze in Position n, warten Sie 10 Minuten, setzen Sie sie wieder auf das Isozentrum und messen Sie das Signal erneut, bis es mindestens 1 T1 abgeklungen ist.
- Wiederholen Sie die Schritte 1.4.4 - 1.4.6 für die verbleibenden Referenzpositionen, die die X-, Y- und Z-Richtungen abdecken.
- Das Anfangssignal (S0) zerfällt monoexponentiell über n HF-Pulse mit einem θ-Flip-Winkel. Passen Sie das Signal (S) als Funktion der Zeit (t) in das Streifenfeld ein, um T1 in jeder Position zu berechnen:
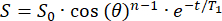 (2)
(2) - Identifizieren Sie eine Position mit ausreichendem T1 (>20 min) für die Platzierung des 129Xe-Reservoirs.
- Erstellen Sie metallfreie Intubationskanülen (Abbildung 6).
- Besorgen Sie sich zwei venöse Verweilkatheter aus Polytetrafluorethylen (PTFE) mit Luer-Konnektoren. Entsorgen Sie die Nadeln in einem Behälter zur Entsorgung scharfer Gegenstände.
HINWEIS: Verwenden Sie für Mäuse >25 g Katheter mit 18 g und 20 g. Verwenden Sie bei kleineren Tieren 20 g und 22 g Katheter. - Schneiden Sie den Luer-Konnektor von den Kathetern ab. Führen Sie den kleineren Katheter in das obere Ende des größeren Katheters ein, um eine sich stärker verjüngende und längere Kanüle zu erhalten. Schneiden Sie die Kompositkanüle auf ~4,6 cm mit abgeschrägtem Ende, ohne die Luer-Basis (Abbildung 6A, B).
- Schneiden Sie das breitere Ende einer 200-μl-Pipettenspitze auf eine Länge von ~2,6 cm ab (Abbildung 6C).
- Beschichten Sie die Innenseite der Pipettenspitze mit allgemeinem Trennschmiermittel. Verwenden Sie eine weitere Pipettenspitze, die in das Gleitmittel eingeführt wird, um es dünn zu verteilen. Füllen Sie die Pipettenspitze mit Acetoxysilikon-Vulkanisationspaste Epoxidharz (Abbildung 6D, E).
- Stecken Sie die Kanüle mit einem 22-G-Draht ein, der aus beiden Enden herausragt. Führen Sie den Kanülenschlauch durch das Silikon in der Pipettenspitze. Verlängern Sie das Röhrchen ~7 mm über das Ende der Pipettenspitze hinaus (Abbildung 6F, G).
- Schieben Sie das Kanülenröhrchen an der breiteren Seite der Pipettenspitze durch einen Luer-Stecker aus Kunststoff und kleben Sie die Teile mit dem Epoxidharz zusammen. Schneiden Sie den Schlauch ab, der über den Luer-Anschluss hinausragt (Abbildung 6H).
- Warten Sie, bis das Epoxidharz getrocknet ist (>24 h), und entfernen Sie dann vorsichtig die Silikon-Intubationskanüle aus der Pipettenspitzenform. Entfernen Sie den Draht von der Kanüle und stellen Sie sicher, dass der Schlauch nicht verschlossen wurde (Abbildung 6I).
- Um einen Griff für eine einfache Intubation herzustellen, verbinden Sie den Schlauch (1/16" oder 1/8") mit einer Luer-Buchse. Wenn Sie für die Intubation bereit sind, verbinden Sie diese weibliche Luer-Konnektorin mit der männlichen Luer-Intubationskanüle. Dieses Stück kann nach der Intubation leicht abgelöst werden (Abbildung 6J).
- Desinfizieren Sie vor jeder Anwendung bei Tieren: Wischen Sie die Außenseite der Kanüle mit 70% Alkohol ab. Wischen Sie den 20-G-Draht mit einem Desinfektionsmittel ab und führen Sie den Draht durch die Kanüle, um das Innere zu desinfizieren und sicherzustellen, dass keine Verstopfungen entstehen.
- Besorgen Sie sich zwei venöse Verweilkatheter aus Polytetrafluorethylen (PTFE) mit Luer-Konnektoren. Entsorgen Sie die Nadeln in einem Behälter zur Entsorgung scharfer Gegenstände.
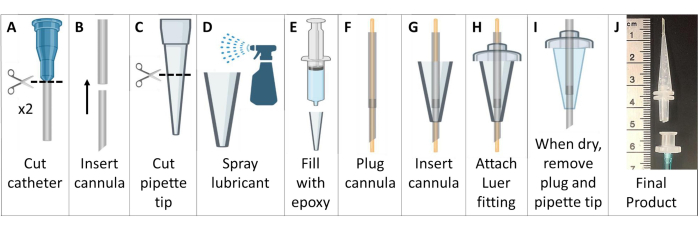
Abbildung 6: Herstellung von MRT- und HP 129Xe-kompatiblen Maus-Intubationskanülen. Diese Kanülen bestehen aus Venenkathetern, Pipettenspitzen und Silikondichtmittel, wie in Schritt 1.5 beschrieben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Tägliche Datenerfassung
HINWEIS: Siehe Ergänzende Datei 2: QS-Checkliste für präklinische Scans.
Ergänzende Datei 2: QS-Checkliste für präklinische Scans. Bitte klicken Sie hier, um diese Datei herunterzuladen.
- Führen Sie die tägliche Qualitätskontrolle des Scanners durch und richten Sie das Beatmungsgerät ein (Abbildung 4).
- Führen Sie bei Phantomen QA-Protokolle auf dem Scanner aus (siehe Tabelle 1 für QA-Scan-Parameter und Schritt 1.2 für tägliche Qualitätskontrollschritte).
- Kalibrieren Sie das Beatmungsgerät nach der Methode von J. Nouls et al.38. Siehe Ergänzende Datei 3: Kalibrierung von Beatmungsgeräten, Ergänzende Abbildung 2 und Ergänzende Abbildung 3.
- Legen Sie die Beatmungsgeräteeinstellungen für die Bildgebung am Ende der Inspiration fest (Tabelle 2). Stellen Sie das Tierbett auf das Scannergestell und das Lebenserhaltungsmodul (d. h. mechanische Beatmungsgeräteteile) auf den Tisch neben dem Scanner.
- Aktivieren Sie die standortspezifische Tierheizung. Stellen Sie eine Heizung auf 35,5 - 40 °C ein, schalten Sie die Umluft ein und platzieren Sie den Luftschlauch in einem Abstand von ~5" von der Stelle, an der der Kopf des Tieres aufliegt, um die Bohrung des Scanners vorzuwärmen.
| Einstellung der Belüftung | Empfehlung für HP 129Xe MRT | Notizen |
| Tidalvolumen (TV) | 8–10 ml/kg ideales Körpergewicht | Mäßiges Fernsehen; Niedriger Fernseher erfordert einen höheren BR, was zu Bewegungsartefakten in Bildern führen kann |
| Positiver endexspiratorischer Druck (PEEP) | 2–6 cmH2Ω | |
| Atemfrequenz (BR) | 80–120 Br/min | |
| Rekrutierungsmanöver (RMs) | ~35 cmH2O für 6 s alle 5 min | |
| Dauer der Beatmung; Position | < 6 h; Supinum | Rückenlage, um die Bewegung des Brustkorbs besser sehen zu können |
| Anteil des eingeatmeten Sauerstoffs (FIO2) | 0.3–0.5 | Verhindern Sie Hypoxie bei anästhesierten Mäusen |
| Inspiratorisches zu exspiratorisches Verhältnis (I:E) | 1:2–1:4 | |
| Inspiratorisch zur Gesamtzyklusdauer | 0.2–0.4 | |
| Minimale Belüftung | ≥0,57 mL·g-1·min-1 | |
| Unsere Ansprüche: | ||
| BR = 80 b/min, Inspirationsdauer = 200 ms, FIO2 = 0,3 | ||
| Bildgebung am Ende der Inspiration: Atemanhalten = 200 ms, Triggerverzögerung = 200 ms nach Beginn der Inspiration | ||
| Bildgebung während des Atemanhaltens: Atemanhalten = 250 ms, Triggerverzögerung = 250 ms nach Beginn der Inspiration | ||
| Bildgebung am Ende der Exspiration: Atemanhalten = 200 ms, Triggerverzögerung = 650 ms nach Beginn der Inspiration | ||
Tabelle 2: Empfohlene Beatmungsgeräteeinstellungen für die 129Xe-Bildgebung. Die Parameter können für spezifische Studienziele und experimentelle Bedingungen fein abgestimmt werden 117,118,119,120,121,122,123,124. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Datei 3: Kalibrierung des Beatmungsgeräts. Bitte klicken Sie hier, um diese Datei herunterzuladen.
- Betäubung und Intubation des Tieres.
- Schalten Sie den Inkubator auf 27,7 °C und/oder das elektrische Heizkissen auf 37,7 °C ein. Messen und notieren Sie die Körpermasse des Tieres. Berechnen Sie die Beruhigungsmitteldosierung basierend auf der Masse. In Tabelle 3 finden Sie ein typisches Dosierungsschema.
- Injizieren Sie das Beruhigungsmittel intraperitoneal. Notieren Sie sich den Zeitpunkt der Injektion und stellen Sie den Timer für die nächste Dosis des Beruhigungsmittels ein.
HINWEIS: Führen Sie die verbleibenden Schritte in Abschnitt 2 (Tägliche Datenerfassung) so schnell wie möglich aus, um die Zeit unter Sedierung und das Risiko einer Überdosierung zu minimieren. - Tragen Sie Augenschmiermittel auf die Augen des Tieres auf und setzen Sie das Tier in einen Käfig auf dem Heizkissen oder in einen Inkubator, um eine Unterkühlung zu vermeiden.
- Bestätigen Sie, dass das Tier vollständig sediert ist, indem Sie 10-15 Minuten nach der Beruhigungsmittelinjektion einen Zehenquetschtest durchführen68. Intubieren Sie nach den in Das et al.69 beschriebenen Verfahren.
HINWEIS: Der Artikel von Das et al.69 wird von einer umfassenden Videodemonstration der Technik begleitet. Die Schritte sind wie folgt: - Hängen Sie das Tier in Rückenlage an den Zähnen auf ein schräges Brett. Verwende einen Nagetier-Zungenspatel, um die Zunge herauszuziehen.
- Um sicherzustellen, dass die Stimmbänder sichtbar sind, geben Sie weißes Licht über ein Glasfaserkabel in der Intubationskanüle oder ein helles Licht, das an der Außenseite des Rachens platziert wird. Führen Sie die Kanüle weniger als 5 mm über die Stimmbänder hinaus ein.
- Stellen Sie sicher, dass sich die Kanüle in der Luftröhre und nicht in der Speiseröhre befindet, indem Sie sie mit einem Schlauch verbinden, in dem sich ein kleiner Wassertropfen befindet. Wenn sich der Wassertropfen im Takt mit den Atemzügen des Tieres bewegt, ist die Positionierung wahrscheinlich korrekt.
| Agent | Dosis | Route | Dauer | Kommentare | |||
| Inhalative Wirkstoffe | |||||||
| Isofluran | Induktion: 4 % – 5 % Wartung: 1%– 3% oder zur Wirkung | Eingeatmet | Während des kontinuierlichen Flusses | • Erfordert die Verwendung eines kalibrierten Verdampfers | |||
| Injizierbare Mittel | |||||||
| Empfohlen: Ketamin + Xylazin + Acepromazin | 90 + 9 + 3 mg/kg | Intraperitoneal | 20–60 Minuten | • Schafft Anfälligkeit für Unterkühlung | |||
| • Bei wiederholter Dosierung wird empfohlen, auf eine Ketamin + Xylazin-Mischung umzusteigen, um eine Überdosierung zu vermeiden | |||||||
| • Verursacht Erschütterungen, wenn es nachlässt. Halten Sie sich bei der Bildgebung strikt an den Dosierungsplan | |||||||
| • Kann Bradykardie verursachen | |||||||
| Ketamin + Xylazin | 90 + 9 mg/kg | Intraperitoneal | 20–40 Minuten | • Siehe oben (Ketamin + Xylazin + Acepromazin) | |||
| Pentobarbital | 50 - 70 mg/kg | Intraperitoneal | 20–60 Minuten | • Senkt die Atemfrequenz und -bewegung | |||
| • Die Kosten können unerschwinglich sein | |||||||
| • Pharmazeutische Qualität ist möglicherweise nicht verfügbar | |||||||
| Haftungsausschluss: Dies sind allgemeine Richtlinien. Konsultieren Sie vor der Implementierung einen Tierarzt, um weitere Informationen zu erhalten. | |||||||
Tabelle 3: Gängige Anästhesieformel für Mäuse. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
- Tiere belüften (Tabelle 2).
- Befestigen Sie das Tier über den Luer-Konnektor an der Intubationskanüle am Beatmungsgerät. Überwachen Sie die Zwerchfellbewegung und den maximalen Inspirationsdruck (~10-12 cm H2O für ein Atemzugvolumen von 10 ml/kg Körpergewicht). Wenn der Druck oder die Atembewegung abnormal ist, passen Sie den Halswinkel und die Tiefe der Kanüle sorgfältig nach Bedarf an.
- Stellen Sie sicher, dass die Intubationskanüle luftdicht ist, indem Sie ein Rekrutierungsmanöver durchführen: Verhindern Sie das Ausatmen (z. B. mit einem Finger die Ausatemöffnung blockieren), so dass das Tier mehrmals einatmet, ohne auszuatmen.
HINWEIS: Wenn der Atemwegsdruck 35 cmH2O Spitzeninspirationsdruck über ~6 s erreicht, ist die Atemwegsdichtung ausreichend dicht. Wenn nicht, lesen Sie die Diskussion zur Problembehandlung. - Lassen Sie die normale Ausatmung wieder aufnehmen. Führen Sie Rekrutierungsmanöver zwischen den Scans und alle ~5 Minuten durch, wenn Sie nicht scannen, um die Lungencompliance aufrechtzuerhalten und Atelektasen zu verhindern. Verbinden Sie das PEEP-Ventil mit der Ausatemleitung. Stellen Sie den PEEP auf 4 cmH2°C ein. Beobachten Sie, wie der inspiratorische Spitzendruck um diesen Betrag ansteigt.
- Planen und initialisieren Sie nach erfolgreicher Intubation die Produktion von HP 129Xe um das Beruhigungsmittel-Redosisschema herum, um zu verhindern, dass das Tier während eines Scans aufwacht. Überwachen Sie die Körpertemperatur während des gesamten Experiments.
- Datenerfassung: Sammeln Sie Lüftungsbilder.
HINWEIS: Die Datenerfassungsschritte 2.4, 2.5 und 2.6 können in beliebiger Reihenfolge ausgeführt werden- Stellen Sie das Beatmungsgerät gemäß Tabelle 2 für die Bildgebung am Ende der Inspiration ein.
- Laden Sie die folgenden Setup-Protokolle: Proton Animal Localizer, Einzelpuls zur Zentrierung auf die Gasfrequenz in der Lunge der Maus und 129Xe Animal Localizer. In Tabelle 4 finden Sie die Scan-Parameter.
- Positionieren Sie das Tier im Isozentrum und bestätigen Sie, dass sich die Brusthöhle in der Mitte des Sichtfeldes mit Protonenlokalisierung befindet. Wenn Sie Einfrequenzspulen verwenden, ersetzen Sie die Protonenspule durch eine 129Xe-abgestimmte HF-Spule.
- Zeichnen Sie eine Polarisation von 129Xe auf und transportieren Sie sie zum MRT-Scanner. Siehe Ergänzende Datei 4: QA-Checkliste für die Xenon-Polarisation.
- Legen Sie einen Beutel mit 129Xe in den Beatmungsbehälter und verschließen Sie ihn. Schließen Sie den Behälter in einer Linie mit dem Ventilator an und lassen Sie den Behälter unter Druck setzen (3 - 6 psig).
- Mechanische Beatmung 129Xe einleiten. Jedes Mal, wenn die 129Xe-Beatmung aktiviert wird, lassen Sie das Tier ~5 Atemzüge durchführen, bevor Sie einen Scan starten, um die funktionelle Restkapazität der Lunge zu überprüfen.
HINWEIS: Wechseln Sie zwischen 129Xe-Scans zum N2/O2-Gemisch, um hyperpolarisiertes Gas zu sparen. - Passen Sie die Arbeitsfrequenz mit einem einzigen Impuls an die In-vivo-Resonanzfrequenz von gasförmigem 129Xe an (~83,07 MHz bei 7 T) an. Kopieren Sie die Frequenz auf alle nachfolgenden Scans der Gasphase 129Xe. Führen Sie eine 129Xe-Lokalisierung durch, um zu bestätigen, dass sich die Lungen im Isozentrum befinden.
- Laden und starten Sie die radiale Lüftungssequenz 129Xe. Überwachen Sie den inspiratorischen Spitzendruck.
HINWEIS: Wenn das 129Xe-Gas ausgeht, bevor das Protokoll abgeschlossen ist, sinkt der Spitzeninspirationsdruck schnell ab. Ein 400-ml-Beutel mit 129Xe kann eine 30-g-Maus ~24 Minuten lang beatmet, wenn er mit 70 % beatmet wird, 129Xe bei 80 Atemzügen pro Minute mit einem Atemzugvolumen von 10 ml/kg idealem Körpergewicht. - Wenn der Scan abgeschlossen ist, wechseln Sie zur Belüftung mit dem N2/O2-Gemisch und entfernen Sie den leeren Beutel mit 129Xe.
- Für die Bildgebung am Ende der Exspiration ändern Sie die Dauer des Atemanhaltens und die Auslöseverzögerung gemäß Tabelle 2 und wiederholen Sie die Schritte 2.4.2 - 2.4.9.
- Exportieren Sie die Rohdaten aus dem Scanner.
| Protokoll-Kurzbezeichnung | Beschreibung der Sequenz | Auslösen | TR (ms) | TE (ms) | Wiederholungen | Flip-Winkel (°) | Matrixgröße oder NPunkte | Sichtfeld (mm2) | HF BW (kHz) | Dicke der Scheibe/Platte (mm) | Dauer des Scans |
| Einzelner Impuls | Impulserfassung (Gasphase) | Wahlfrei | 1000 | 1 | 60 | 2048 | 10 | 1 Sek. | |||
| Tier-Lokalisierer | 2D GRE | Ja | 50 | 1.7 | 1 | 60 | 642 kg | 322 | 3 | 25 | 60 Sek. |
| Radiale Belüftung | 3D Multi-Echo radial | Ja | 20 | Siehe Bildunterschrift | 1 | 30 | 613 kg | 223 | 32.05 | 30 | 16 Minuten |
| Gelöste Phase, Einzelimpuls | Impulserfassung (gelöste Phase) | Nein | 80 | 1 | 90 | 512 | 10.35 | 80 ms | |||
| Dynamische Spezifikation der gelösten Phase. | Impulserfassung (gelöste Phase) | Nein | 50 | 1000 | 90 | 512 | 10.5 | 50 Sek. | |||
| Diffusionsgewichtet | 2D GRE | Ja | 12.2 | 8.1 | 4 | 45 | 642 kg | 322 | 3 | 1.5 | 18 Minuten |
Tabelle 4: In vivo Sequenzparameter. Die zuvor beschriebene 3D-Multiecho-Radialventilationssequenz39 nimmt Bilder mit einer Echozeit von 6 Echozeiten auf. Die Ergebnisse sind für das erste Echobild dargestellt (TE = 1,12 ms, Abbildung 7). Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Datei 4: QA-Checkliste für die Xenon-Polarisation. Bitte klicken Sie hier, um diese Datei herunterzuladen.
- Datenerfassung: Führen Sie eine dynamische Spektroskopie der gelösten Phase durch.
- Stellen Sie das Beatmungsgerät gemäß Tabelle 2 für die Bildgebung während des Atemanhaltens ein. Stellen Sie den BR auf 100 Atemzüge/min ein. Bereiten Sie sich auf einen neuen Beutel mit 129Xe vor, wie in den Schritten 2.4.2 - 2.4.5 beschrieben.
- Mechanische Beatmung 129Xe einleiten. Laden Sie einen einzelnen Impuls und lassen Sie ihn ausführen, um die Arbeitsfrequenz an die gelöste Frequenz anzupassen (~83,084 MHz bei 7 T). Kopieren Sie die Arbeitsfrequenz in die dynamische Spektroskopie der gelösten Phase.
HINWEIS: Dies ist ein einzelner Peak bei Mäusen mit Wildtyp-Hämoglobin54. - Laden und starten Sie die dynamische Spektroskopiesequenz, die sich auf die gelöste Frequenz in der Tierlunge konzentriert. Wenn der Scan abgeschlossen ist, wechseln Sie zur Belüftung mit dem N2/O2-Gemisch und entfernen Sie den leeren Beutel mit 129Xe. Exportieren Sie die Rohdaten aus dem Scanner.
- Datenerfassung: Sammeln Sie diffusionsgewichtete Bilder.
- Stellen Sie das Beatmungsgerät gemäß Tabelle 2 für die Bildgebung während des Atemanhaltens ein. Bereiten Sie sich auf einen neuen Beutel mit 129Xe vor, wie in den Schritten 2.4.2 - 2.4.7 beschrieben.
- Laden Sie die diffusionsgewichtete Sequenz, und führen Sie sie aus. Wenn der Scan abgeschlossen ist, wechseln Sie zur Belüftung mit dem N2/O2-Gemisch und entfernen Sie den leeren Beutel mit 129Xe. Exportieren Sie die Rohdaten aus dem Scanner.
3. Abschluss des Versuchs
- Tier bergen.
- Ziehen Sie die Intubationskanüle gerade aus dem Maul des Tieres. Wenn das Tier nicht sofort spontan zu atmen beginnt, ist eine leichte Herzdruckmassage durchzuführen. Falls verfügbar, verabreichen Sie einen leichten Fluss von medizinischem Sauerstoff in der Nähe des Gesichts des Tieres, um die Genesung der Sedierung zu unterstützen.
- Sobald das Tier gleichmäßig von selbst atmet und das Tier >2 h lang sediert wurde, verabreichen Sie 0,5 - 1 ml normale Kochsalzlösung subkutan, um eine Dehydrierung zu verhindern.
- Setzen Sie das Tier von selbst in einen Käfig zurück. Stellen Sie den Käfig in einen Inkubator oder auf ein Heizkissen.
HINWEIS: Sedierte Tiere sind anfällig für Kannibalismus und können nicht mit Käfiggenossen in einen Käfig gesetzt werden, bis sie sich vollständig erholt haben (d. h. selbstständig herumlaufen). Betäubte Tiere können ihre Körpertemperatur nicht regulieren. Verwenden Sie den Handrücken, um alle paar Minuten die Temperatur des Tieres zu spüren. - Beobachten Sie das Tier genau, bis sein Aufrichtreflex zurückgekehrt ist (d. h. es kann selbstständig von der Rückenlage in die Bauchlage wechseln).
- Nehmen Sie das Tier von der Hitzestütze, sobald es selbstständig laufen kann. Setzen Sie das Tier mit seinen Käfiggenossen in einen Käfig zurück.
HINWEIS: Wenn das Tier keine Käfiggenossen hat, ist es anfälliger für sedierungsinduzierte Hypothermie. Stellen Sie dem Tier zusätzliche Einstreu zur Verfügung und lassen Sie, falls verfügbar, das Tier über Nacht in einem Brutkasten. - Erfassen Sie das Gewicht des Tieres 2 Wochen lang einmal pro Woche, um seine Gesundheit zu überwachen.
HINWEIS: Wenn das Tier durch die Intubation eine Verletzung am Maul oder an der Speiseröhre erlitten hat, kann es aufhören zu fressen. Wenn das Tier >20 % seines ursprünglichen Körpergewichts verliert, konsultieren Sie einen Tierarzt über die Euthanasie.
- Analysieren Sie Lüftungsbilder (Abbildung 7).
- Laden Sie Rohdaten in eine Programmierplattform. Laden Sie das Open-Source-Rekonstruktions-Framework für nicht-kartesische Bilderherunter 91.
- Rekonstruieren Sie Bilder gemäß den Anweisungen des Open-Source-Frameworks. Normalisieren Sie den ersten Punkt auf jeder radialen Projektion39.
- Segmentieren Sie das Lungenparenchym in den Bildern, einschließlich Voxeln mit niedrigem oder keinem 129Xe-Signal. Große Atemwege nicht einschließen. Segmentieren Sie das Hintergrundrauschen im Bild, ohne Lunge, Atemwege und Bildgebungsartefakte.
HINWEIS: Das Bild des Protonenlokalisierers kann bei der Bestimmung der Parenchymgrenzen hilfreich sein. - Berechnen Sie das SNR mit der Formel:
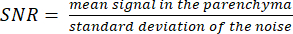 (3)
(3) - Quantifizieren Sie fehlerhafte Beatmung.
HINWEIS: Es wurden verschiedene Methoden vorgeschlagen, um eine gestörte Beatmung in Kleintiermodellen zu quantifizieren. Analysemethoden bleiben ein offenes Forschungsgebiet, aber leicht zu implementierende Ansätze umfassen: (i) Semiquantitative manuelle Segmentierung92, (ii) Histogramm-Ansatz unter Verwendung des Signals aus der Luftröhre zur Normalisierung des parenchymalen Signals47 und (iii) Segmentierung des Gesamtlungenvolumens (TLV) und Definition einer Signalschwelle (z. B. <60 % des gesamten Lungenmittelwerts), um die Lunge in defektes Volumen und beatmetes Lungenvolumen (VV) zu unterteilen. Quantifizieren Sie VDP 93,94 nach:
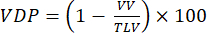 (4)
(4)
- Analysieren Sie die dynamische Spektroskopie der gelösten Phase (Abbildung 8).
- Laden Sie Rohdaten in eine Programmierplattform. Führen Sie eine schnelle Fourier-Transformation durch und phasen Sie die Spektren (gleichzeitiges manuelles Phasenschalten der Spektren nullter Ordnung ist für diese Anwendung ausreichend).
- Berechnen Sie die Standarddaten der Kernspinresonanz (NMR)95,96: SNR, volle Breite halbmaximal, integrierte Fläche, chemische Verschiebung und Phase beider Peaks.
- Teilen Sie aus den Magnitudendaten bei jeder Wiederholung die Signalamplitude des gelösten Spektrums durch die des Gasspektrums, um das Verhältnis von gelöstem zu flüssigem Gas über die Zeit zu ermitteln.
- Analysieren Sie diffusionsgewichtete Bilder (Abbildung 9).
- Laden Sie Rohdaten in eine Programmierplattform. Segmentieren Sie das Lungenparenchym des b0-Bildes wie in Schritt 3.2.3. Berechnen Sie das SNR für jedes b-Wert-Bild.
- Berechnen Sie das Signalwert-Rausch-Verhältnis, SVNR0, indem Sie das Signal in jedem Voxel des b 0-Bildes durch die Standardabweichung des Bildrauschens dividieren. Schließen Sie Voxel mit SVNR0 < 2,5-fachem Bildrauschen97 aus.
HINWEIS: Die SVNR0 ist eine individuelle Voxelmetrik, während das parenchymale SNR eine Ganzlungenmetrik ist. - Berechnen Sie den ADC, indem Sie den Signalausklang über die b-Werte (bi) gemäß Gleichung 598,99 anpassen:
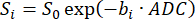 (5)
(5)
Ergebnisse
Lüftungs-Bilder
Wenn die Verfahren zur Vorbereitung und Beatmung der Tiere richtig durchgeführt werden, kann die radiale 3D-Bildgebung die Beatmungsmuster erfolgreich erfassen, wenn die Datenerfassung entweder beim Ein- oder Ausatmen durchgeführt wird (Abbildung 7). Während diese Bilder über viele Atemzüge hinweg gesammelt werden, ähnelt die hier beschriebene Methode der beim Menschen verwendeten Bildgebung...
Diskussion
Die hyperpolarisierte 129Xe-MRT entwickelt sich zu einer ausgeklügelten und leistungsfähigen Technik zur Untersuchung der Mikrostruktur und Funktion der Lunge in Kleintiermodellen. Dieses Protokoll soll als Leitfaden für die Vorbereitung der ersten Stelle dienen und experimentelle Verfahren beschreiben, die zur Quantifizierung von Beatmung, Diffusion und Gasaustausch in der Lunge von Mäusen mit HP 129Xe erforderlich sind. Zu den wichtigsten Voraussetzungen für ...
Offenlegungen
Peter Niedbalski ist Berater bei Polarean Imaging, Plc.
Danksagungen
Die Autoren bedanken sich herzlich bei Jerry Dalke dafür, dass er eine Vorreiterrolle bei der Konstruktion von Beatmungsgeräten gespielt hat. Wir danken Carter McMaster für das Brauen von HP 129Xe Gas. Wir möchten uns auch bei Dr. Matthew Willmering und Dr. Juan Parra-Robles für ihre zum Nachdenken anregenden wissenschaftlichen Diskussionen bedanken. Figuren, die mit BioRender.com erstellt wurden. Diese Arbeit wurde von den National Institutes of Health finanziert (Grant Nos: NHLBI R01HL143011, R01HL151588)
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | fisher scientific | Catalog No.14-955-464 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955464 |
| 10 mL graduated cylinder | Cole-Parmer | UX-34502-69 | https://www.coleparmer.com/i/cole-parmer-essentials-graduated-cylinder-glass-hexagonal-base-10-ml-2-pk/3450269?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7h3do -ssjascARuVviKd7V7kC5ztdIB6 _70DnMr-K3qk9RKeJ7-IrhoCeT 0QAvD_BwE |
| 18 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX1832CA | https://www.shopmedvet.com/product/iv-catheter-18-x-1-25inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 4oTvZkAgWQCda6ocVtQlulVrG 2536FNbu5soMVSFN8xK_g1Uh pXIRoCGwoQAvD_BwE |
| 20 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2051CA | https://www.shopmedvet.com/product/iv-catheter-20-x-2inch?r=GSS17&p=GSS17&utm_source =google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 87ggCkgToD_XF_UgpQBTpmN dgSNfCml6TkDKlW8k27Dq_daR itPuhoCnBQQAvD_BwE |
| 22 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2225CA | https://www.shopmedvet.com/product/iv-catheter-22-x-1inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid =CjwKCAiA0bWvBhBjEiwAtEso W9IM6mpee6m7e-lBfR8dZhSN KYbMUs7qgEU4gYCRTW_rJAs W_lGkthoCm30QAvD_BwE |
| 400 mL tedlar bags | Jensen Inert Products | GST-001S-3507TJC | NA |
| 60 mL syringe | fisher scientific | Catalog No.14-955-461 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955461 |
| 70% alcohol | Cole-Parmer | UX-80024-34 | https://www.coleparmer.com/i/labchem-isopropyl-alcohol-70-v-v-500-ml/8002434?PubID=UX&persist=true&ip= no&gad_source=1&gclid=CjwKC AiA6KWvBhAREiwAFPZM7gGh p8g7MBHBBKadaRCAwfEMgV gna5fhYRsuXIuqoqOiToCC4fem nhoCGMEQAvD_BwE |
| Dewar for liquid nitrogen | Terra Universal | 4LDB | https://www.laboratory-equipment.com/tw-4ldb-liquid-nitrogen-dewar-ic-biomedical.html?srsltid=AfmBOooxwMtOA1Z2TweR P8V5Iy5EvYT3alZuzoiY 3UF3Ib9RgFnDxVTfWP0 |
| Eye lubricant | Refresh | REFRESH P.M. | https://www.refreshbrand.com/Products/refresh-pm |
| Fiber optic light | AmScope | HL250-AY | https://amscope.com/products/hl250-ay?tw_source=google &tw_adid=&tw_campaign= 16705014684&gad_source= 1&gclid=CjwKCAiA6KWvBhA REiwAFPZM7p-DpyvHJaGxR pAD1385hzGf1oPdKHHLFDR Sp8yrtxry11SNJeJnKxoCtAoQ AvD_BwE |
| Gaussmeter | Apex Magnets | GMHT201 | https://www.apexmagnets.com/magnets/accessories/ht-digital-gaussmeter-with-peak-hold-can-display-gauss-or-tesla |
| Glass vessel (phantom) | Ace Glass | 8648-24 | https://aceglass.com/results.php?t=8648-24&t=8648-24 |
| Heating pad | Office Depot | 9206211 | Pure Enrichment PureRelief Express Designer Series Heating Pad 12 x 15 Palm Aqua - Office Depot |
| Hyperpolarizer | Polarean | 9820 | https://polarean.com/xenon-mri-platform/ |
| Intubation board | Hallowell EMC | 000A3467 | https://hallowell.com/product/rodent-tilting-workstand/ |
| Intubation supplies | Parts list published elsewhere | NA | https://app.jove.com/t/50318/a-simple-method-of-mouse-lung-intubation |
| Isotopically enriched xenon cylinder | Linde Isotopes | XE-129(1%)N2(10%)HE CGMP 302SZ | NA |
| Liquid nitrogen | Linde | NI LC160-22 | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_liquid _lc160_22_psi_ni_lc160_22 /ni-lc160-22?cat_id=shop&node=b89 |
| Male slip luer | Cole-Parmer | UX-21943-27 | https://www.coleparmer.com/i/diba-omnifit-t-series-solvent-waste-cap-adapter-polypropylene-male-luer-slip-x-1-16-id-hose-barb-5-pk/2194327 |
| Manometer | Grainger | 3T294 | https://www.grainger.com/product/3T294?gucid=N:N:PS: Paid:GGL:CSM-2295:4P7A1P: 20501231&gad_source=1&gclid =CjwKCAiAi6uvBhADEiwAWiyR dltxrPJmmcm0bFiYLuPrB25HV QFdEfKMBqvgJBNdQUs3DZ7b TLr8CRoCanAQAvD_BwE& gclsrc=aw.ds |
| Minivent ventilator | harvard apparatus | 73-0044 | https://www.harvardapparatus.com/minivent-ventilator-for-mice-single-animal-volume-controlled-ventilators.html |
| Mouse ear puncher | fisher scientific | 13-812-201 | https://www.fishersci.com/shop/products/fisherbrand-animal-ear-tag-punch/13812201 |
| Mouse tongue depressor | Medical Tools | VRI-617 | https://medical-tools.com/shop/rodent-tongue-depressor.html |
| Mouse weight scale | Cole-Parmer | UX-11712-12 | https://www.coleparmer.com/i/adam-equipment-cqt2000-core-portable-balance-2000g-x-1g-220-v/1171212?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7iYnAG5Ilc Z5DZWrdJ6wcLDZSCSfNJHOH m2PQOpyyWe0TjFa75R3tBoCjB sQAvD_BwE |
| MRI scanner | Bruker | 7T Biospec horizontal system | https://www.bruker.com/de/products-and-solutions/preclinical-imaging/mri/biospec.html |
| Multimeter | Home Depot | 1007898529 | https://www.homedepot.com/p/Klein-Tools-600-Volt-Digital-Multi-Meter-Manual-Ranging-MM325/320822947 |
| Natural abundance xenon | Linde Isotopes | UN 2036 | NA |
| Needle | fisher scientific | 305194 | https://www.fishersci.com/shop/products/bd-general-use-precisionglide-hypodermic-needles-20/148266C?keyword=true |
| Needle safe syringe holder | fisher scientific | NC2703873 | https://www.fishersci.com/shop/products/ndlsafe-ii-syr-uncap-deca/NC2703873#?keyword=needlesafe |
| Nitrogen cylinder | Linde | NI M-K | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_nf_k/ni-m-k?cat_id=shop&node=b89 |
| Oxygen cylinder | Linde | OX M-K | https://www.lindedirect.com/store/product-detail/oxygen_o2_oxygen_usp_k/ox-m-k?cat_id=shop&node=b90 |
| Oxygen sensor | Apogee instruments | MO-200 | https://www.apogeeinstruments.com/mo-200-oxygen-sensor-with-handheld-meter/ |
| Oxygen sensor inline flowhead | Apogee instruments | AO-002 | https://www.apogeeinstruments.com/ao-002-oxygen-meter-sensor-flow-through-head/ |
| PEEP valve | Hallowell EMC | 000A6556A | https://hallowell.com/product/adjustable-peep-valve-with-exhaust-port-range-5-20cm-disposable/ |
| Pipette tips | fisher scientific | Catalog No.02-707-108 | Fisherbrand Stack-Rack Space-Saver Tips: 101-1000 L Standard; Blue; Volume: | Fisher Scientific |
| Plunger valve | Ace glass | 8648-20 | https://www.aceglass.com/results.php?t=8648 |
| Preclinical coil | Doty scientific | custom built | https://dotynmr.com/products/bmax-xy-low-e/ |
| Pressure regulators | Cole-Parmer | UX-98202-11 | https://www.coleparmer.com/i/cole-parmer-single-stage-regulator-1500-scfh-capacity-346-cga-fitting/9820211?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7pruR xCAiaj52nA_8Y1nveQZRsD6B f0QO65o2DKFYqRoz0PopSkX QxoCxqcQAvD_BwE |
| Pressure-drop ventilator | Parts list published elsewhere | NA | https://sites.duke.edu/driehuyslab/resources/ |
| PVC pipe for phantom | Home Depot | 193682 | https://www.homedepot.com/p/IPEX-1-2-in-x-10-ft-White-PVC-SCH-40-Potable-Pressure-Water-Pipe-30-05010HD/319692959 |
| SAI animal heating system | SAII | Model 1030 | https://i4sa.com/product/model-1030-monitoring-gating-system/ |
| Saline | Farris Laboratories Inc. | 0409488820-1 | https://www.farrislabs.com/products/bacteriostatic-sodium-chloride-0-9-30ml-bottle?variant=42807174824167¤cy =USD&utm_medium=product_ sync&utm_source=google&utm_ content=sag_organic&utm_ campaign=sag_organic&utm_ campaign=gs-2021-09-24&utm _source=google&utm_medium =smart_campaign&gad_source =1&gclid=CjwKCAiA6KWvBh AREiwAFPZM7oS3-hFDETO_2f6OWOoKyBMb WuDuWqYxdWRYUWEkY M2Py73VfGzVtRoC2FQQAvD_BwE |
| Sharps container | fisher scientific | 22-730-455 | https://www.fishersci.com/shop/products/sharps-container-47/p-7250579#?keyword=needle%20safe |
| Silicone epoxy | Grainger | 3KMY7 | https://www.grainger.com/product/3KMY7?gucid=N:N:PS:Paid:GGL:CSM- 2295:4P7A1P:20501231&gad_ source=1&gclid=CjwKCAiA6KW vBhAREiwAFPZM7voahkm8tda t1Euql1A8DFhC6AZVJ0wXzCE PfE6iUzrIJXV-Hl8o4xoCQLYQA vD_BwE&gclsrc=aw.ds |
| Silicone mold release lubricant | Grainger | 19MW95 | https://www.grainger.com/product/CRC-Mold-Release-Agent-16-oz-19MW95 |
| Spirometer | ADInstruments | FE141 | https://www.adinstruments.com/products/spirometer |
| Spirometer - mouse flowhead | ADInstruments | MLT1L | https://www.adinstruments.com/products/respiratory-flow-heads |
| Tubing - 1/4 OD | Clippard | URH1-0402-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Tubing - 1/8 OD | Clippard | URH1-0804-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Vacuum pump | Cole-Parmer | UX-60062-11 | https://www.coleparmer.com/i/environmental-express-diaphragm-pump-high-volume-120v/6006211?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7uFGwmW pRelHNFgZVvJJV09vDUVyfyG HoKeZTiFNIiVTe-05IpJJPxoCO PoQAvD_BwE |
| Wire - 18 gauge | Digikey | 2328-18H240-ND | https://www.digikey.com/en/products/detail/remington-industries/18H240/15202027?s=N4 IgjCBcoOwBxVAYygMwIYBsDOB TANCAPZQDa4YATPAGwgC6h ADgC5QgDKLATgJYB2AcxAB fQmAAMAFkqIQKSBhwFiZEA GZNATi0SGzNpE48BwsSErqw 6uQqV5CJSOQCsMF%2Bq11 GIVuy58QqLmss4gALbogvy4L AAEAO683LgMIkA |
| Xenon polarization measurement station | Polarean | NA | https://polarean.com/xenon-mri-platform/ |
Referenzen
- World Health Organization. Global health estimates 2020: Deaths by cause, age, sex, by country and by region, 2000-2019. World Health Organization. , (2020).
- Middleton, P. G., et al. Elexacaftor-Tezacaftor-Ivacaftor for cystic fibrosis with a single Phe508del allele. N Engl J Med. 381 (19), 1809-1819 (2019).
- Taylor-Cousar, J. L., et al. Tezacaftor-Ivacaftor in patients with cystic fibrosis homozygous for Phe508del. N Engl J Med. 377 (21), 2013-2023 (2017).
- Richeldi, L., et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2071-2082 (2014).
- King, T. E., et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2083-2092 (2014).
- Yong, K. S. M., Her, Z., Chen, Q. Humanized mice as unique tools for human-specific studies. Arch Immunol Ther Exp (Warsz. 66 (4), 245-266 (2018).
- Li, H., Auwerx, J. Mouse systems genetics as a prelude to precision medicine. Trends Genet. 36 (4), 259-272 (2020).
- Eppig, J. T., Motenko, H., Richardson, J. E., Richards-Smith, B., Smith, C. L. The International Mouse Strain Resource (IMSR): cataloging worldwide mouse and ES cell line resources. Mamm Genome. 26 (9-10), 448-455 (2015).
- Vedi, M., et al. 2022 updates to the rat genome database: A Findable, Accessible, Interoperable, and Reusable (FAIR) resource. Genetics. 224 (1), 042 (2023).
- Ghorani, V., Boskabady, M. H., Khazdair, M. R., Kianmeher, M. Experimental animal models for COPD: a methodological review. Tob Induc Dis. 15, 25 (2017).
- Semaniakou, A., Croll, R. P., Chappe, V. Animal models in the pathophysiology of cystic fibrosis. Front Pharmacol. 9, 1475 (2018).
- Moore, B. B., et al. Animal models of fibrotic lung disease. Am J Respir Cell Mol Biol. 49 (2), 167-179 (2013).
- Jenkins, R. G., et al. An official American thoracic society workshop report: Use of animal models for the preclinical assessment of potential therapies for pulmonary fibrosis. Am J Respir Cell Mol Biol. 56 (5), 667-679 (2017).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Dignam, J. P., Scott, T. E., Kemp-Harper, B. K., Hobbs, A. J. Animal models of pulmonary hypertension: Getting to the heart of the problem. Br J Pharmacol. 179 (5), 811-837 (2022).
- Woodrow, J. S., Sheats, M. K., Cooper, B., Bayless, R. Asthma: The use of animal models and their translational utility. Cells. 12 (7), 1091 (2023).
- Van de Velde, G., et al. Longitudinal in vivo microcomputed tomography of mouse lungs: No evidence for radiotoxicity. Am J Physiol Lung Cell Mol Physiol. 309 (3), L271-L279 (2015).
- Mata, J. F., et al. Evaluation of emphysema severity and progression in a rabbit model: comparison of hyperpolarized 3He and 129Xe diffusion MRI with lung morphometry. J Appl Physiol (1985). 102 (1985), 1273-1280 (2007).
- Boudreau, M., Xu, X., Santyr, G. E. Measurement of 129Xe gas apparent diffusion coefficient anisotropy in an elastase-instilled rat model of emphysema. Magn Reson Med. 69 (1), 211-220 (2013).
- Cleveland, Z. I., et al. 3D MRI of impaired hyperpolarized 129Xe uptake in a rat model of pulmonary fibrosis. NMR Biomed. 27 (12), 1502-1514 (2014).
- Kimura, A., et al. Inflammation during lung cancer progression and ethyl pyruvate treatment observed by pulmonary functional hyperpolarized 129Xe MRI in mice. Contrast Media Mol Imaging. 2021, 9918702 (2021).
- Kimura, A., et al. Treatment response of ethyl pyruvate in a mouse model of chronic obstructive pulmonary disease studied by hyperpolarized 129Xe MRI. Magn Reson Med. 78 (2), 721-729 (2017).
- Ouriadov, A., et al. Early stage radiation-induced lung injury detected using hyperpolarized 129Xe Morphometry: Proof-of-concept demonstration in a rat model. Magn Reson Med. 75 (6), 2421-2431 (2016).
- Willmering, M. M., et al. Improved pulmonary 129Xe ventilation imaging via 3D-spiral UTE MRI. Magn Reson Med. 84 (1), 312-320 (2020).
- Kaushik, S. S., et al. Single-breath clinical imaging of hyperpolarized 129Xe in the airspaces, barrier, and red blood cells using an interleaved 3D radial 1-point Dixon acquisition. Magn Reson Med. 75 (4), 1434-1443 (2016).
- Zanette, B., Munidasa, S., Friedlander, Y., Ratjen, F., Santyr, G. A 3D stack-of-spirals approach for rapid hyperpolarized 129Xe ventilation mapping in pediatric cystic fibrosis lung disease. Magn Reson Med. 89 (3), 1083-1091 (2023).
- Zanette, B., Stirrat, E., Jelveh, S., Hope, A., Santyr, G. Physiological gas exchange mapping of hyperpolarized 129Xe using spiral-IDEAL and MOXE in a model of regional radiation-induced lung injury. Med Phys. 45 (2), 803-816 (2018).
- Collier, G. J., et al. Dissolved 129Xe lung MRI with four-echo 3D radial spectroscopic imaging: Quantification of regional gas transfer in idiopathic pulmonary fibrosis. Magn Reson Med. 85 (5), 2622-2633 (2021).
- Qing, K., et al. Assessment of lung function in asthma and COPD using hyperpolarized 129Xe chemical shift saturation recovery spectroscopy and dissolved-phase MRI. NMR Biomed. 27 (12), 1490-1501 (2014).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Mugler, J. P. Probing lung physiology with xenon polarization transfer contrast (XTC). Magn Reson Med. 44 (3), 349-357 (2000).
- Kern, A. L., et al. Investigating short-time diffusion of hyperpolarized 129Xe in lung air spaces and tissue: A feasibility study in chronic obstructive pulmonary disease patients. Magn Reson Med. 84 (4), 2133-2146 (2020).
- Amzajerdian, F., et al. Simultaneous quantification of hyperpolarized xenon-129 ventilation and gas exchange with multi-breath xenon-polarization transfer contrast (XTC) MRI. Magn Reson Med. 90 (6), 2334-2347 (2023).
- Perron, S., et al. Application of a 2D frequency encoding sectoral approach to hyperpolarized 129Xe MRI at low field. J Magn Reson. 336, 107159 (2022).
- Loza, L. A., et al. Quantification of ventilation and gas uptake in free-breathing mice with hyperpolarized 129Xe MRI. IEEE Trans Med Imaging. 38 (9), 2081-2091 (2019).
- Imai, H., et al. Regional fractional ventilation mapping in spontaneously breathing mice using hyperpolarized 129Xe MRI. NMR Biomed. 28 (1), 24-29 (2015).
- Friedlander, Y., et al. Effect of inhaled oxygen concentration on 129Xe chemical shift of red blood cells in rat lungs. Magn Reson Med. 86 (3), 1187-1193 (2021).
- Virgincar, R. S., et al. A portable ventilator with integrated physiologic monitoring for hyperpolarized 129Xe MRI in rodents. J Magn Reson. 295, 63-71 (2018).
- Nouls, J., Fanarjian, M., Hedlund, L., Driehuys, B. A constant-volume ventilator and gas recapture system for hyperpolarized gas MRI of mouse and rat lungs. Concepts Magn Reson Part B Magn Reson Eng. 39B (2), 78-88 (2011).
- Niedbalski, P. J., et al. Preclinical hyperpolarized 129Xe MRI: ventilation and T2* mapping in mouse lungs at 7 T using multi-echo flyback UTE. NMR Biomed. 33 (7), e4302 (2020).
- Akinyi, T. G. . An Affordable Open-Source Small Animal MR and Hyperpolarized Gas Compatible Ventilator: Feasibility in Preclinical Imaging. , (2017).
- Smith, L. J., et al. The assessment of short and long term changes in lung function in CF using 129Xe MRI. Eur Respir J. 6, 2000441 (2020).
- Svenningsen, S., et al. Reproducibility of hyperpolarized 129Xe MRI ventilation defect percent in severe asthma to evaluate clinical trial feasibility. Acad Radiol. 28 (6), 817-826 (2021).
- Kirby, M., et al. Hyperpolarized 3He and 129Xe MR imaging in healthy volunteers and patients with chronic obstructive pulmonary disease. Radiology. 265 (2), 600-610 (2012).
- Virgincar, R. S., et al. Quantitative analysis of hyperpolarized 129Xe ventilation imaging in healthy volunteers and subjects with chronic obstructive pulmonary disease. NMR Biomed. 26 (4), 424-435 (2013).
- Ebner, L., et al. Multireader determination of clinically significant obstruction using hyperpolarized 129Xe-ventilation MRI. AJR Am J Roentgenol. 212 (4), 758-765 (2019).
- Driehuys, B., et al. 3He MRI in mouse models of asthma. Magn Reson Med. 58 (5), 893-900 (2007).
- Mistry, N. N., Thomas, A., Kaushik, S. S., Johnson, G. A., Driehuys, B. Quantitative analysis of hyperpolarized 3He ventilation changes in mice challenged with methacholine. Magn Reson Med. 63 (3), 658-666 (2010).
- Costa, M., et al. Noninvasive assessment of in vivo mouse lung microstructural changes due to aging and PEEP. Am J Respir Crit Care Med. 207, A4713 (2023).
- Sukstanskii, A. L., Yablonskiy, D. A. Lung morphometry with hyperpolarized 129Xe: theoretical background. Magn Reson Med. 67 (3), 856-866 (2012).
- Chan, H. F., Stewart, N. J., Norquay, G., Collier, G. J., Wild, J. M. 3D diffusion-weighted 129Xe MRI for whole lung morphometry. Magn Reson Med. 79 (6), 2986-2995 (2018).
- Bier, E. A., et al. Noninvasive diagnosis of pulmonary hypertension with hyperpolarised 129Xe magnetic resonance imaging and spectroscopy. ERJ Open Res. 8 (2), 00035 (2022).
- Bier, E. A., et al. A protocol for quantifying cardiogenic oscillations in dynamic 129Xe gas exchange spectroscopy: The effects of idiopathic pulmonary fibrosis. NMR Biomed. 32 (1), e4029 (2019).
- Wang, Z., et al. Diverse cardiopulmonary diseases are associated with distinct xenon magnetic resonance imaging signatures. Eur Respir J. 54 (6), 1900831 (2019).
- Freeman, M. S., Cleveland, Z. I., Qi, Y., Driehuys, B. Enabling hyperpolarized 129Xe MR spectroscopy and imaging of pulmonary gas transfer to the red blood cells in transgenic mice expressing human hemoglobin. Magn Reson Med. 70 (5), 1192-1199 (2013).
- Iguchi, S., et al. Direct imaging of hyperpolarized 129Xe alveolar gas uptake in a mouse model of emphysema. Magn Reson Med. 70 (1), 207-215 (2013).
- Imai, H., et al. Noninvasive detection of pulmonary tissue destruction in a mouse model of emphysema using hyperpolarized 129Xe MRS under spontaneous respiration. Magn Reson Med. 64 (4), 929-938 (2010).
- Silk, S. B., Hampton, L. L., Brown, P. A. What investigators need to know about the use of animals. ILAR J. 54 (3), 324-328 (2014).
- Cereda, M., et al. Mild loss of lung aeration augments stretch in healthy lung regions. J Appl Physiol. 120 (1985), 444-454 (2016).
- Constantinides, C., Murphy, K. Molecular and integrative physiological effects of isoflurane anesthesia: The paradigm of cardiovascular studies in rodents using magnetic resonance imaging. Front Cardiovasc Med. 3, 23 (2016).
- Irwin, M. R., Curay, C. M., Choi, S., Kiyatkin, E. A. Basic physiological effects of ketamine-xylazine mixture as a general anesthetic preparation for rodent surgeries. Brain Res. 1804, 148251 (2023).
- Roth, D. M., Swaney, J. S., Dalton, N. D., Gilpin, E. A., John Ross, J. Impact of anesthesia on cardiac function during echocardiography in mice. Am J Physiol Heart Circ Physiol. 282 (6), H2134-H2140 (2002).
- Massey, C. A., Richerson, G. B. Isoflurane, ketamine-xylazine, and urethane markedly alter breathing even at subtherapeutic doses. J Neurophysiol. 118 (4), 2389-2401 (2017).
- Janssen, B. J. A., et al. Effects of anesthetics on systemic hemodynamics in mice. Am J Physiol Heart Circ Physiol. 287 (4), H1618-H1624 (2004).
- Lenzarini, F., Di Lascio, N., Stea, F., Kusmic, C., Faita, F. Time course of isoflurane-induced vasodilation: A Doppler ultrasound study of the left coronary artery in mice. Ultrasound Med Biol. 42 (4), 999-1009 (2016).
- Mondonedo, J. R., et al. Volatile anesthetics and the treatment of severe bronchospasm: A concept of targeted delivery. Drug Discov Today Dis Models. 15, 43-50 (2015).
- Nolan, J. P. Anaesthesia and Neuromuscular Block. Clinical Pharmacology. , 295-310 (2012).
- Arras, M., Autenried, P., Rettich, A., Spaeni, D., Rülicke, T. Optimization of intraperitoneal injection anesthesia in mice: drugs, dosages, adverse effects, and anesthesia depth. Comp Med. 51 (5), 443-456 (2001).
- Navarro, K. L., et al. Mouse anesthesia: The art and science. ILAR J. 62 (1-2), 238-273 (2021).
- Das, S., MacDonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318 (2013).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. (86), e50269 (2014).
- Slutsky, A. S., Ranieri, V. M. Ventilator-induced lung injury. N Engl J Med. 369 (22), 2126-2136 (2013).
- Matute-Bello, G., et al. An official American thoracic society workshop report: features and measurements of experimental acute lung injury in animals. Am J Respir Cell Mol Biol. 44 (5), 725-738 (2011).
- Kulkarni, H. S., et al. Update on the features and measurements of experimental acute lung injury in animals: An official American thoracic society workshop report. Am J Respir Cell Mol Biol. 66 (2), e1-e14 (2022).
- Tsuchida, S., et al. Atelectasis causes alveolar injury in nonatelectatic lung regions. Am J Respir Crit Care Med. 174 (3), 279-289 (2006).
- Fan, E., et al. An official American thoracic society/European society of intensive care medicine/society of critical care medicine clinical practice guideline: Mechanical ventilation in adult patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 195 (9), 1253-1263 (2017).
- Santos, R. S., Silva, P. L., Pelosi, P., Rocco, P. R. Recruitment maneuvers in acute respiratory distress syndrome: The safe way is the best way. World J Crit Care Med. 4 (4), 278-286 (2015).
- Mekontso Dessap, A., et al. Conflicting physiological and genomic cardiopulmonary effects of recruitment maneuvers in murine acute lung injury. Am J Respir Cell Mol Biol. 46 (4), 541-550 (2012).
- García-Fernández, J., et al. Recruitment manoeuvres in anaesthesia: How many more excuses are there not to use them. Rev Esp Anestesiol Reanim (Engl Ed). 65 (4), 209-217 (2018).
- Allen, G. B., Suratt, B. T., Rinaldi, L., Petty, J. M., Bates, J. H. Choosing the frequency of deep inflation in mice: balancing recruitment against ventilator-induced lung injury. Am J Physiol Lung Cell Mol Physiol. 291 (4), L710-L717 (2006).
- da Silva, A. C. L., et al. Sigh maneuver protects healthy lungs during mechanical ventilation in adult Wistar rats. Exp Biol Med. 245 (15), 1404-1413 (2020).
- Riva, D. R., et al. Recruitment maneuver: RAMP versus CPAP pressure profile in a model of acute lung injury. Respir Physiol Neurobiol. 169 (1), 62-68 (2009).
- Schwarte, L. A., Zuurbier, C. J., Ince, C. Mechanical ventilation of mice. Basic Res Cardiol. 95 (6), 510-520 (2000).
- Joelsson, J. P., Ingthorsson, S., Kricker, J., Gudjonsson, T., Karason, S. Ventilator-induced lung-injury in mouse models: Is there a trap. Lab Anim Res. 37 (1), 30 (2021).
- Jameson, C. J., Jameson, A. K., Hwang, J. K. Nuclear spin relaxation by intermolecular magnetic dipole coupling in the gas phase. 129Xe in oxygen. J Chem Phys. 89 (7), 4074-4081 (1988).
- Kelley, M., Branca, R. T. Theoretical models of spin-exchange optical pumping: Revisited and reconciled. J Appl Phys. 129 (15), 1-16 (2021).
- Norquay, G., Leung, G., Stewart, N. J., Wolber, J., Wild, J. M. 129Xe chemical shift in human blood and pulmonary blood oxygenation measurement in humans using hyperpolarized 129Xe NMR. Magn Reson Med. 77 (4), 1399-1408 (2017).
- Norquay, G., Collier, G. J., Rao, M., Stewart, N. J., Wild, J. M. 129Xe-Rb spin-exchange optical pumping with high photon efficiency. Phys Rev Lett. 121 (15), 153201 (2018).
- Ball, J. E., Wild, J. M., Norquay, G. Investigating Rubidium density and temperature distributions in a high-throughput 129Xe-Rb spin-exchange optical pumping polarizer. Molecules. 28 (1), 11 (2022).
- Plummer, J. W., et al. A semi-empirical model to optimize continuous-flow hyperpolarized 129Xe production under practical cryogenic-accumulation conditions. J Magn Reson. 320, 106845 (2020).
- Nikolaou, P., et al. Near-unity nuclear polarization with an open-source 129Xe hyperpolarizer for NMR and MRI. Proc Natl Acad Sci U S A. 110 (35), 14150-14155 (2013).
- Robertson, S. H., et al. Optimizing 3D noncartesian gridding reconstruction for hyperpolarized 129Xe MRI-focus on preclinical applications. Concepts Magn Reson Part A Bridg Educ Res. 44 (4), 190-202 (2015).
- Thomas, A. C., et al. A robust protocol for regional evaluation of methacholine challenge in mouse models of allergic asthma using hyperpolarized 3He MRI. NMR Biomed. 22 (5), 502-515 (2009).
- Niedbalski, P. J., et al. Protocols for multi-site trials using hyperpolarized 129Xe MRI for imaging of ventilation, alveolar-airspace size, and gas exchange: A position paper from the 129Xe MRI clinical trials consortium. Magn Reson Med. 86 (6), 2966-2986 (2021).
- Woodhouse, N., et al. Combined helium-3/proton magnetic resonance imaging measurement of ventilated lung volumes in smokers compared to never-smokers. J Magn Reson Imaging. 21 (4), 365-369 (2005).
- Brown, R. W., Cheng, Y. C. N., Haacke, E. M., Thompson, M. R., Venkatesan, R. . Magnetic Resonance Imaging: Physical Principles and Sequence Design. , (2014).
- Levitt, M. H. . Spin Dynamics: Basics of Nuclear Magnetic Resonance. , (2013).
- Salerno, M., et al. Emphysema: hyperpolarized helium 3 diffusion MR imaging of the lungs compared with spirometric indexes—initial experience. Radiology. 222 (1), 252-260 (2002).
- Niedbalski, P. J., et al. Validating in vivo hyperpolarized 129Xe diffusion MRI and diffusion morphometry in the mouse lung. Magn Reson Med. 85 (4), 2160-2173 (2021).
- Bdaiwi, A. S., et al. Improving hyperpolarized 129Xe ADC mapping in pediatric and adult lungs with uncertainty propagation. NMR Biomed. 35 (3), e4639 (2022).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Driehuys, B., Mugler, J. P. NMR of hyperpolarized 129Xe in the canine chest: spectral dynamics during a breath-hold. NMR Biomed. 13 (4), 220-228 (2000).
- Driehuys, B., et al. Imaging alveolar-capillary gas transfer using hyperpolarized 129Xe MRI. Proc Natl Acad Sci U S A. 103 (48), 18278-18283 (2006).
- Nakamura, K., et al. 129Xe spectra from the heads of rats with and without ligation of the external carotid and pterygopalatine arteries. Magn Reson Med. 53 (3), 528-534 (2005).
- Kershaw, J., et al. Confirming the existence of five peaks in 129Xe rat head spectra. Magn Reson Med. 57 (4), 791-797 (2007).
- Chen, R. Y., et al. Tissue-blood partition coefficient for xenon: temperature and hematocrit dependence. J Appl Physiol. 49 (2), 178-183 (1980).
- Möller, H. E., et al. Magnetic resonance angiography with hyperpolarized 129Xe dissolved in a lipid emulsion. Magn Reson Med. 41 (5), 1058-1064 (1999).
- Norquay, G., et al. Relaxation and exchange dynamics of hyperpolarized 129Xe in human blood. Magn Reson Med. 74 (2), 303-311 (2015).
- Zhang, L., et al. Absolute thermometry of human brown adipose tissue by magnetic resonance with laser polarized 129Xe. Commun Med. 3 (1), 147 (2023).
- Barshishat-Kupper, M., et al. Protein oxidation in the lungs of C57BL/6J mice following X-irradiation. Proteomes. 3 (3), 249-265 (2015).
- Olsson, L. E., et al. Measurement of MR signal and T2* in lung to characterize a tight skin mouse model of emphysema using single-point imaging. J Magn Reson Imaging. 25 (3), 488-494 (2007).
- Crowle, A. J. Delayed hypersensitivity in mice. J Allergy. 30 (2), 151-164 (1959).
- Guo, J., Cao, X., Cleveland, Z. I., Woods, J. C. Murine pulmonary imaging at 7T: T2* and T1 anisotropic UTE. Magn Reson Med. 79 (4), 2254-2264 (2018).
- Sonobe, T., et al. Imaging of the closed-chest mouse pulmonary circulation using synchrotron radiation microangiography. J Appl Physiol. 111 (1), 75-80 (2011).
- Wang, W., et al. Imaging lung microstructure in mice with hyperpolarized 3He diffusion MRI. Magn Reson Med. 65 (3), 620-626 (2011).
- Ouriadov, A. V., et al. Application of a stretched-exponential model for morphometric analysis of accelerated diffusion-weighted 129Xe MRI of the rat lung. Magn Reson Mater Phy. 34 (1), 73-84 (2021).
- O'Halloran, R. L., Holmes, J. H., Altes, T. A., Salerno, M., Fain, S. B. The effects of SNR on ADC measurements in diffusion-weighted hyperpolarized He-3 MRI. J Magn Reson. 185 (1), 42-49 (2007).
- Moller, H. E., Cleveland, Z. I., Driehuys, B. Relaxation of hyperpolarized 129Xe in a deflating polymer bag. J Magn Reson. 212 (1), 109-115 (2011).
- Reiss, L. K., Kowallik, A., Uhlig, S. Recurrent recruitment manoeuvres improve lung mechanics and minimize lung injury during mechanical ventilation of healthy mice. PLoS One. 6 (9), e24527 (2011).
- Cagle, L. A., et al. Effects of positive end-expiratory pressure and recruitment maneuvers in a ventilator-induced injury mouse model. PLoS One. 12 (11), e0187419 (2017).
- Cannizzaro, V., et al. Lung volume recruitment maneuvers and respiratory system mechanics in mechanically ventilated mice. Respir Physiol Neurobiol. 169 (3), 243-251 (2009).
- Hohlbaum, K., et al. Impact of repeated anesthesia with ketamine and xylazine on the well-being of C57BL/6JRj mice. PLoS One. 13 (9), e0203559 (2018).
- Blevins, C. E., Celeste, N. A., Marx, J. O. Effects of oxygen supplementation on injectable and inhalant anesthesia in C57BL/6 mice. J Am Assoc Lab Anim Sci. 60 (3), 289-297 (2021).
- Cannizzaro, V., et al. Impact of supplemental oxygen in mechanically ventilated adult and infant mice. Respir Physiol Neurobiol. 165 (1), 61-66 (2009).
- Sembroski, E., Sanghavi, D. K., Bhardwaj, A. Inverse Ratio Ventilation. StatPearls Publishing. , (2023).
- Boros, S. J. Variations in inspiratory:expiratory ratio and airway pressure wave form during mechanical ventilation: the significance of mean airway pressure. J Pediatr. 94 (1), 114-117 (1979).
- Zheng, W., Cleveland, Z. I., Moller, H. E., Driehuys, B. Gradient-induced longitudinal relaxation of hyperpolarized noble gases in the fringe fields of superconducting magnets used for magnetic resonance. J Magn Reson. 208 (2), 284-290 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten