Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Synthese von mit Schwarzkümmelöl beladenen, auf Alginat basierenden, pH-empfindlichen Kügelchen mittels Elektrospraying-Technik
In diesem Artikel
Zusammenfassung
Es wird eine Technik vorgestellt, die eine hohe elektrische Spannung und eine gezielte, mit Wirkstoffen beladene Emulsion verwendet, um pH-empfindliche, gleichmäßige Mikrokügelchen herzustellen.
Zusammenfassung
Schwarzkümmelöl (BSO), das aus den Samen der Nigella sativa-Pflanze gewonnen wird, hat Aufmerksamkeit für seine potenziellen krebshemmenden Eigenschaften erregt, insbesondere im Zusammenhang mit Darmkrebs. Sein Wirkstoff Thymochinon kann helfen, das Wachstum von Krebszellen zu hemmen und die Apoptose in Darmkrebszellen zu induzieren. Darüber hinaus könnte die entzündungshemmende und antioxidative Wirkung von Schwarzkümmelöl zu einer gesünderen Darmumgebung beitragen und möglicherweise das Krebsrisiko verringern. Daher wurden in dieser Studie pH-empfindliche Alginatkügelchen synthetisiert, um BSO in kontrollierter Freisetzung in den Dickdarm zu bringen, ohne das Arzneimittel bei pH 1,2 (Magen) freizusetzen, wodurch ein gut definiertes Freisetzungsmuster bei pH 6,8 bereitgestellt wurde. Der Einsatz der Elektrospray-Technologie verbessert die Prozessleistung, indem es einfacher wird, kleine, homogene Kügelchen mit einer höheren Quell- und Diffusionsrate im Magen-Darm-Medium zu formulieren.
Die formulierten Kügelchen wurden durch einen Ex-vivo-Test der mukoadhäsiven Festigkeit, der Beads Größe, des Sphärizitätsfaktors (SF), der Verkapselungseffizienz (EE), des Rasterelektronenmikroskops (REM), des in vitro Quellverhaltens (SB) und der in vitro Wirkstofffreisetzung in sauren und Puffermedien charakterisiert. Alle diese hergestellten Kügelchen wiesen in diesem Test bescheidene Größen von 0,58 ± 0,01 mm und eine Kugelform von 0,03 ± 0,00 mm auf. Die Formulierung zeigte in vitro vielversprechende schwimmende und freisetzende Eigenschaften. Mit einem sehr geringen kumulativen Prozentsatz an Kügelchen war der Öl-EE von 90,13 % ± 0,93 % hoch, und die Freisetzungsstudie zeigte mehr als 90 % bei pH 6,8 mit guter Schwimmnatur im Magen. Zusätzlich waren die Kügelchen gleichmäßig über den Darm verteilt. Der in diesem Protokoll verwendete Elektrospray-Ansatz kann reproduzierbar sein und führt zu konsistenten Ergebnissen. Daher kann dieses Protokoll für die Großproduktion zu Kommerzialisierungszwecken verwendet werden.
Einleitung
Schwarzkümmel, und insbesondere BSO, wird aufgrund seiner gut etablierten medizinischen Eigenschaften seit Jahrhunderten zur Heilung einer Vielzahl von Krankheiten verwendet. Thymochinon ist vielleicht einer der wichtigsten sekundären Pflanzenstoffe, die in BSO1 enthalten sind. In den letzten Jahren haben Forscher den potenziellen therapeutischen Nutzen von Thymochinon in vivo und in vitro untersucht und empirische Beweise für die Verwendung von BSO erbracht. Antihypertensive, antibakterielle, antihistaminische, antimykotische, analgetische, antidiabetische, lipidsenkende und entzündungshemmende Eigenschaften wurden in diesen Studien für BSO nachgewiesen, die zur Behandlung von Symptomen wie Ekzemen, Bluthochdruck, Asthma, Husten, Kopfschmerzen, Influenza, Fieber, Krebs, Schwindel und Aktivität eingesetzt werdenkönnen 2,3.
Das Aufbringen von relativ dünnen Beschichtungen auf kleine Tröpfchen von Flüssigkeiten und Dispersionen oder Partikel aus festem Material wird als Mikroverkapselung bezeichnet. Wenn es um Öl geht, ist mikroverkapseltes Öl in der Regel sehr wertvoll, da einige Formen von Ölen, wie BSO, als nahrhafte Lebensmittel gelten und medizinische Vorteile bieten4. Die direkte Zugabe von Ölen zur Matrix des Lebensmittels kann jedoch zu einer Verflüchtigung führen, die dazu führen kann, dass Aktivitäten infolge der Einwirkung von Sauerstoff und UV-Licht schnell verschwinden5. Darüber hinaus führt die mangelnde Kontrolle über die Freisetzungsrate der Öle zu einer sofortigen und vorübergehenden Wirkung. Die Herstellung einer polymeren Beschichtung um das ätherische Öl durch Mikroverkapselung oder Mikrosphärifikation ist eine Methode, um diese Nachteile zu überwinden6.
Mikrokapseln, auch Mikrosphären genannt, schirmen die Öle vor schädlichen Umwelteinflüssenab 7. Dieses Verfahren wird häufig eingesetzt, um die Wirksamkeit von Arzneimitteln zu erhöhen, den Wirkstoffinhalt zu erhalten, Tabletten mit verzögerter Freisetzung zu ermöglichen, die Geschmacksmaskierung zu verbessern, den Geschmacksverlust während der Produkthaltbarkeit zu reduzieren, das Mundgefühl zu verlängern und unverträgliche Inhaltsstoffe in einer einzigen Dosierung zu trennen8. Die Mikroverkapselung hilft auch bei der Aufrechterhaltung der metabolischen Absorption, der Kontrolle der Ölfreisetzungsrate und der Aufrechterhaltung der geeigneten Konzentrationen, um das beabsichtigte Ergebnis an einer bestimmten Stelle zu erzielen9.
Die elektrohydrodynamische Verkapselung ist eine unkomplizierte und anpassungsfähige Methode. Der Wirkstoff befindet sich im inneren Kern einer Mikrokapsel, die aus einer äußeren Hülle besteht. In dieser Hinsicht verfügt es über eine ziemlich starke Matrix, um zu gewährleisten, dass die aktive Komponente effektiver verbreitet werden kann, anstatt über einen klar definierten Zellkern. Vor der Sphircyclation müssen der Wirkstoff und die Polymerlösung kombiniert werden, um die Mikrosphären9 herzustellen. Da Öl jedoch flüchtig ist, kann die Mikroverkapselung äußerst schwierig sein und erfordert eine sorgfältige Temperaturkontrolle.
Es gibt verschiedene Methoden, um Öle zu verkapseln. So müssen beispielsweise bestimmte Öle bei niedrigen Temperaturen verkapselt werden, um den Abbau oder die Verflüchtigung ihrer bioaktiven Bestandteile zu verhindern. Um Strukturen im Mikro- und Nanomaßstab zu erzeugen, wurde die elektrohydrodynamische Zerstäubung (EHDA) von Forschern ausgiebig untersucht10. In diesem Sinne sind die Verarbeitungsbedingungen, zu denen die Durchflussrate, die angelegte Spannung und die Düsengröße sowie die Sammelabstandseigenschaften der polymeren Lösung gehören, die beiden Hauptfaktoren, die berücksichtigt werden müssen, um die gewünschte Partikelgröße oder Morphologie herzustellen11,12.
In dieser Untersuchung wurden Alginate - eine Art natürlich vorkommender Polysaccharide, die für die orale Einnahme geeignet sind - verwendet, um das BSO einzukapseln. Braunalgen enthalten Alginat, ein anionisches Polymer, das in der Natur vorkommt. Es besteht aus zwei monomeren Strukturen: α-L-guluronsäure (G) und 1-4βD-Mannuronsäure (M)13. Sein Polymer ist ungiftig14, hat ein hohes Maß an Biokompatibilität, ist kostengünstig und baut effektivab 15. Es wird daher häufig in den Bereichen Biotechnologie und Ingenieurwesen eingesetzt.
Alginate sind das Material der Wahl für die Verkapselung durch ionische Gelierung, da sie eine vernetzte Struktur zwischen den G-Gruppen verschiedener Alginatketten erzeugen können, indem sie ionische Verbindungen mit zweiwertigen Kationen wie Sr2+, Ca2+ oder Zn2+ Ionen bilden. Der Gelierungsprozess kann durch das Egg-Box-Modell, das das zweiwertige Kation auf zwei Carboxylgruppen auf den nebeneinander liegenden Alginatmolekülen begrenzt, adäquat charakterisiert werden. Es wurde vermutet, dass die Hydrogeleigenschaften von Natriumalginatkügelchen die Freisetzung von Makromolekülen und kleinen Molekülen regulieren können. Die Natriumalginatkügelchen können aufgrund ihrer mukoadhäsiven Eigenschaften über einen längeren Zeitraum an der Darmschleimhaut haften. Darüber hinaus bietet Alginat einen Schutzschild, der Öle vor äußeren Elementen, wie sauren Medien16, schützen kann und Öle in die Verabreichungskanäle des Magen-Darm-Trakts17 überträgt. Seitdem wird es in der Forschung eingesetzt, um die ortsspezifische Verabreichung von Medikamenten an Schleimhautgewebe zu unterstützen18,19.
Der elektrohydrodynamische Ansatz wurde in dieser Studie verwendet, um die Machbarkeit des Emulgierens kommerzieller Öle zur Herstellung von Kapselnzu untersuchen 20. Hier wurde der elektrohydrodynamische Ansatz zur Erzeugung und Analyse von Alginat-BSO-beladenen Mikrosphären20 verwendet. In dieser Studie wurden eine Reihe anderer Faktoren untersucht, darunter die SF, ex-vivo, die mukoadhäsiven Eigenschaften der Mikrosphären, EE%, das physikalische Erscheinungsbild, die Größenverteilung und das Zetapotenzial; Die abgeschwächte Totalreflexions-Fourier-Transformations-Infrarotspektroskopie (ATR-FTIR) wurde verwendet, um die chemische Verträglichkeitzu testen 20.
Protokoll
1. Herstellung der Alginat-BSO-Emulsion
- Dispergieren Sie 10 % w/v BSO in 1 % w/v Natriumalginatlösung, die 1, 3 und 5 % w/v Lecithin enthält, in einem 50-ml-Becherglas.
- Erhalten Sie eine Nanoemulsion mit einem Ultraschall-Homogenisator. Stellen Sie die Leistungsstufe auf 20 % ein. Lassen Sie den Homogenisator 55 s lang laufen, indem Sie auf die Startschaltfläche klicken, um den Vorgang abzuschließen.
2. Charakterisierung der Alginat-BSO-Emulsion
- Analyse des Zetapotenzials und der Partikelgrößenverteilung
- Nehmen Sie 0,1 mL der frisch zubereiteten Emulsion in ein 25 mL Becherglas und verdünnen Sie sie mit 9,9 mL destilliertem Wasser.
- Nehmen Sie 2,5 mL dieser verdünnten Lösung in eine 3 mL Quarzküvette und stellen Sie die Küvette in eine Messkammer.
- Öffnen Sie die Abdeckung und setzen Sie die Küvette in das Gerät ein, wobei Sie darauf achten, dass die Küvette in Bezug auf den Weg des Lichtstrahls korrekt ausgerichtet ist. Klicken Sie auf das Messsymbol.
- Die Küvette herausnehmen. Entnehmen Sie die Probe oder entsorgen Sie sie ordnungsgemäß.
- Speichern Sie die Daten als PDF-Datei in einem persönlichen Ordner zur weiteren Verwendung.
- Bestimmung der Emulsionsstabilität (ES)
- Nehmen Sie 5 ml frisch zubereitete Emulsion in 10-ml-Zentrifugenröhrchen. Die Emulsionen (n = 3) werden 5 min lang bei 894 × g zentrifugiert.
- Bestimmen Sie mit Hilfe von Gleichung (1) den ES basierend auf der Position der Phasentrennungsgrenzfläche.
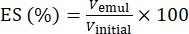 (1)
(1)
Dabei ist Vemul das Volumen der nach der Zentrifugation verbleibenden Emulsion und Vinitial das Volumen der Anfangsemulsion.
- Vorbereitung der Raupe
- BSO Alginat-Kügelchen
- Bereiten Sie BSO-Alginatkügelchen mit der Elektrospray-Technik EHDA vor. Verwenden Sie eine BSO-Emulsion (w/v), die aus 10 % BSO, 1 % Natriumalginat und 3 % Lecithinlösung besteht.
- Verwenden Sie eine Spritzenpumpe, um die Durchflussrate zu regulieren, füllen Sie die Emulsion in eine 10-ml-Kunststoffspritze und drücken Sie sie durch eine 22-G-Nadel. Befestigen Sie die Nadelspitze an der positiven Elektrode eines Hochspannungsnetzteils.
- Als Auffangbehälter ist ein geschliffenes Becherglas mit 50 mL 1 Gew.-% Calciumchlorid (Gelierbad) zu verwenden. Wechseln Sie die Tropfdurchflussrate zwischen 1 mL/min und 3 mL/min bei Spannungen von 3, 5 und 7 kV, während Sie einen Abstand von 10 cm über der Oberfläche der Calciumchloridlösung einhalten.
- Um eine vollständige Gelierung zu bestätigen, lassen Sie die Kügelchen 30 Minuten lang im Gelierbad, während Sie sie bewegen. Verwenden Sie einen Edelstahlfilter, um die Kügelchen aus dem Gelierbad zu nehmen, und waschen Sie die gerafften Kügelchen mit hochreinem destilliertem Wasser.
- Lassen Sie die Kügelchen 16 h bei Raumtemperatur auf einem Labortisch trocknen. Verwenden Sie Gleichung (2), um die prozentuale Ausbeute der Perlen zu berechnen.
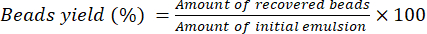 (2)
(2)
- BSO-freie Alginatkügelchen
- Bereiten Sie eine 1%ige w/v-Lösung von Natriumalginat vor. Geben Sie Lecithin in Konzentrationen von 1 %, 3 % und 5 % w/v zur Lösung. Mischen Sie die Lösung gründlich, bis sich das Lecithin vollständig aufgelöst hat.
- Verwenden Sie die Lösung aus Schritt 2.3.2.1, um BSO-freie Alginatkügelchen herzustellen, wie in den Schritten 2.3.1.2-2.3.1.5 beschrieben. Berechnen Sie die Ausbeute mit Gleichung (2).
- BSO Alginat-Kügelchen
3. Charakterisierung der Raupe
- Bestimmung von Größe und Form
- Um die Größe und Form der Kügelchen zu bestimmen, verwenden Sie einen Bildanalysator. Machen Sie Fotos mit einer Digitalkamera von den nassen und getrockneten Kügelchen.
- Messen Sie dann den Perlendurchmesser mit der vorinstallierten Skalenleiste des Instruments. Berechnen Sie anhand der Durchmesserwerte den SF aus den erhaltenen Durchmesserwerten mit Hilfe von Gleichung (3):
SF =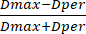 (3)
(3)
Dabei steht Dmax für den größten Durchmesser, der durch die Mitte einer Raupe verläuft (in mm), während Dper sich auf den Durchmesser bezieht, der senkrecht zu Dmax verläuft und durch die Mitte der Raupe verläuft (in mm).
HINWEIS: Ein SF von Null bezeichnet eine idealerweise sphärische Raupe, wobei steigende SF-Werte eine größere Abweichung von einer sphärischen Form bedeuten. Darüber hinaus gelten Perlen als kugelförmig, wenn ihre SF 0,05 oder weniger beträgt.
4. Bestimmung des EE%
- Desintegration der Kügelchen in phosphatgepufferter Kochsalzlösung (PBS), um sie wieder in die Emulsion zu bringen. Messen Sie die Absorption der resultierenden Emulsion bei 600 nm mit einem UV-Vis-Spektralphotometer.
- Verwenden Sie den Absorptionswert, um die Trübung der Emulsion darzustellen. Erstellen Sie eine Standardkurve mit einer bekannten Menge an BSO in der Emulsion.
- Berechnen Sie den EE% mit Hilfe von Gleichung (4):
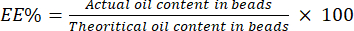 (4)
(4)
5. Rasterelektronenmikroskopie (REM)
HINWEIS: Verwenden Sie REM, um die Mikrostruktur und Oberflächenmorphologie der BSO-Alginatkügelchen zu beobachten.
- Um das Innere der getrockneten Perlen zu inspizieren, schneide ein paar davon ab. Die abgeschnittenen Perlen auf Aluminiumstummel aufkleben und mit Carbon-Klebebändern einkleben.
- Sputtern Sie die Kügelchen mit einem Kohlenstoff-Sputtermodul in einem Vakuumverdampfer in einer Argonatmosphäre. Tragen Sie eine Dicke von 100 Å und 50 Å für die Carbonbeschichtung auf.
- Erfassen Sie Bilder der beschichteten Kügelchen im Hochvakuum mit einem Spannungsbeschleuniger zwischen 10 kV und 15 kV.
6. Bestimmen Sie die Wechselwirkung zwischen Arzneimitteln und sonstigen Bestandteilen mit ATR-FTIR
- Stellen Sie die Wellenzahlen des Instruments zwischen 4.000 cm-1 und 400 cm-1 ein, indem Sie Umgebungsluft als Hintergrund und eine Auflösung von 1 cm-1 verwenden. Siehe Ergänzende Akte 1.
- Zeichnen Sie Spektren von BSO, Natriumalginat, Lecithin, Calciumchlorid, BSO-freien Kügelchen, Alginat-BSO-Kügelchen und physikalischen Gemischen aus Wirkstoff und Hilfsstoffen (Natriumalginat, Lecithin, Calciumchlorid und BSO) separat auf.
- Legen Sie die Probe (5-10 mg) auf den Probenahmebereich. Einstellen von 20 Scans, Auflösung 4, Messkraft 80, Druckarm mit flacher Spitze. Stellen Sie sicher, dass die Option "Auto Increment " auf die Option "Leer" eingestellt bleibt, damit das Spektrum automatisch im gewünschten Ordner gespeichert wird.
- Um die Stichprobenmessung zu starten, klicken Sie auf die Schaltfläche [Probe]. Da es keine Wartezeit gibt, stellen Sie nach der Auswahl von [Probe] sicher, dass die Probe bereit ist und die Druckklemme reduziert ist. Analysieren Sie alle Proben einzeln. Analysieren Sie alle aufgezeichneten Spektren einzeln mit der Spektroskopie-Software.
7. Dynamische Differenzkalorimetrie (DSC)
HINWEIS: Die thermischen Eigenschaften und die Verträglichkeit der BSO-beladenen Kügelchen wurden mit DSC (Supplemental File 1) untersucht.
- Versiegeln Sie Perlen mit einem Gewicht von ~3,20 mg in einer normalen Aluminiumpfanne. Erhitzen Sie die Proben bei einer Geschwindigkeit von 10 °C/min, während sie in einem Temperaturbereich von 50-350 °C unter einem Stickstoffstrom mit einer Geschwindigkeit von 20 l/min analysiert werden.
8. Quelleigenschaften von Perlen
- Bereiten Sie 100 mg getrocknete Alginat-BSO-Kügelchen vor.
- Bereiten Sie simulierte Darmflüssigkeit (SIF) und simulierte Magenflüssigkeit (SGF) in einem sauberen, trockenen Mischgefäß geeigneter Größe - 6 l, 10 l oder 25 l - vor. Geben Sie gereinigtes Wasser auf ca. 33 % des erforderlichen Volumens - 2 l, 3 l oder 8 l - und geben Sie den Inhalt der Flasche mit dem Konzentrat in das Gefäß. Spülen Sie die Flasche mit gereinigtem Wasser aus und geben Sie die Spülungen und das gereinigte Wasser in das Mischgefäß, um das erforderliche Volumen zu erhalten. Gründlich mischen. Messen Sie den pH-Wert und fahren Sie fort, wenn er innerhalb der Spezifikation liegt. Passen Sie den pH-Wert bei Bedarf an.
- Tauchen Sie die Kügelchen in 50 ml Medien, die simulierte Darmflüssigkeit (SIF) und simulierte Magenflüssigkeit (SGF) enthalten. Die Bedingungen werden 2 Stunden lang bei 37 ± 0,5 °C gehalten.
- Entfernen Sie die aufgeblasenen Perlen und filtern Sie sie in vordefinierten Intervallen von 0, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110 und 120 Minuten oder mehr durch ein Metallgitter. Verwenden Sie ein Papiertuch, um überschüssige Flüssigkeit von den geschwollenen Kügelchen zu entfernen.
- Messen Sie das Gewicht der abgewischten Kügelchen mit einer elektronischen Analysenwaage. Bestimmen Sie den prozentualen Anteil des Quellindex (%SI) anhand von Gleichung (5):
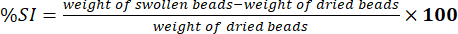 (5)
(5)
Ergebnisse
Aufbereitung von BSO-beladenen Alginat-Mikrokügelchen
Abbildung 1 zeigt den Versuchsaufbau zur Herstellung von BSO-beladenen Alginat-Mikrokügelchen. Die Menge des eingesetzten Lecithins hatte einen erheblichen Einfluss auf die Stabilität der BSO-Emulsion. Emulsionen, die mit allen drei Lecithin-Konzentrationen hergestellt wurden, waren vergleichsweise stabil. Die Zentrifugationsmethode (894 × g, 5 min) wurde in diesem Versuc...
Diskussion
Mit Hilfe des EHDA-Verfahrens wurden BSO-beladene Alginat-Mikrokügelchen als pH-empfindlicher Träger hergestellt. Das Netzwerk der Kügelchen zeigte ein pH-abhängiges Quell- und Wirkstofffreisetzungsverhalten aufgrund des hohen Vorhandenseins von Carbonsäuregruppen. Es zeigte sich, dass die starke intermolekulare Wasserstoffbindung zwischen den Polymerketten der Grund für den verminderten Quellcharakter von BSO-beladenen Kügelchen bei pH 1,2 ist. BSO-beladene Kügelchen können von...
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Studie wurde unterstützt von der Princess Nourah bint Abdulrahman University Researchers Supporting Project Nummer (PNURSP2024R30), Princess Nourah bint Abdulrahman University, Riad, Saudi-Arabien. Diese Forschung wurde von der Researchers Supporting Project Nummer (RSPD2024R811) der King Saud University, Riad, Saudi-Arabien, finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 10 mL Centrifuge Tubes | Globe Scientific | 22-171-624 | |
| 22 G needle | Sigma-Aldrich (St.Louis, Missouri, USA). | CAD4172 | |
| 3 mL quartz-cuvette | Sigma-Aldrich (St.Louis, Missouri, USA). | Z276669 | |
| 50 mL beaker | |||
| Aluminum stubs | |||
| An electronic analytical balance | |||
| ATR-FTIR | Bruker Malaysia Sdn Bhd, Kawasan Perindustrian Temasya, 40150 Shah Alam, Selangor, Malaysia. | ||
| Black seed oil | IKOP Pharmaceutical Ltd. (IKOP, Faculty of Pharmacy, IIUM, 25200 Kuantan, Pahang, Malaysia | B182111 | Active ingredient |
| Calcium chloride dehydrate, CaCl2 · 2H2O | Sigma-Aldrich (St.Louis, Missouri, USA). | 21074 | Gelling agent |
| Carbon adhesive tapes | |||
| Centrifuge | |||
| Differential scanning calorimetry | |||
| Digital camera | |||
| Grounded beaker | |||
| High guluronic acid content Sodium alginate (mw. 97,000) with medium viscosity (40 – 100 mPa s) | Sigma-Aldrich (St.Louis, Missouri, USA). | W201502 | Polymer |
| High voltage power supply | |||
| Isopropyl alcohol | Sigma-Aldrich (St.Louis, Missouri, USA). | W292912 | ATR-FTIR cleaning purpose |
| Lecithin | Sigma-Aldrich (St.Louis, Missouri, USA). | P7568 | Surfactant |
| Microscope | |||
| Paper towel | |||
| Scanning electron microscopy | |||
| Simulated gastric fluid | Sigma-Aldrich (St.Louis, Missouri, USA). | 1651 | Release media and swelling media |
| Simulated intestinal fluid | Sigma-Aldrich (St.Louis, Missouri, USA). | 84082-64-4 | Release media and swelling media |
| Spectroscopy software | |||
| Stainless-steel filter | |||
| Syringe pump | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Ultrapure distilled water | Supplied by institutional lab | ||
| Ultrasonic homogenizer | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| UV-vis spectrophotometer. | |||
| Vacuum evaporator | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Voltage accelerator | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Zetasizer Nano-ZS | (Malvern Zetasizer Nano series Nano-S and Nano-Z, Malvern Instruments Ltd., Worcestershire, UK) |
Referenzen
- Benavides, S., Cortés, P., Parada, J., Franco, W. Development of alginate microspheres containing thyme essential oil using ionic gelation. Food Chem. 204 (8), 77-83 (2016).
- Agbaria, R., Gabarin, A., Dahan, A., Ben-Shabat, S. Anticancer activity of Nigella sativa (black seed) and its relationship with the thermal processing and quinone composition of the seed. Drug Des Devel Ther. 9 (1), 3119 (2015).
- Wang, D., Qiao, J., Zhao, X., Chen, T., Guan, D. Thymoquinone inhibits IL-1β-induced inflammation in human osteoarthritis chondrocytes by suppressing NF-κB and MAPKs signaling pathway. Inflammation. 38 (7), 2235-2241 (2015).
- Beyki, M., et al. Encapsulation of Mentha piperita essential oils in chitosan-cinnamic acid nanogel with enhanced antimicrobial activity against Aspergillus flavus. Ind Crop Prod. 54 (3), 310-319 (2014).
- Hosseini, S. M., et al. Incorporation of essential oil in alginate microparticles by multiple emulsion/ionic gelation process. Inter J Biol Macromol. 62 (11), 582-588 (2013).
- Banerjee, S., et al. Influence of process variables on essential oil microcapsule properties by carbohydrate polymer-protein blends. Carbohydr Polym. 93 (2), 691-697 (2013).
- Sebe, I., Szabó, E., Zelkó, R. Advances in drug delivery via electrospun and electrosprayed formulations. In Emerging Drug Delivery and Biomedical Engineering Technologies. , 71-104 (2023).
- Akram, N., et al. Fabrication and characterization of PVA-WPI based nanofiber mats for improved viability of Lactobacillus rhamnosus GG. Foods. 12 (21), 3904 (2023).
- Azad, A. K., Sinan, M. A. A., John, F. K., Bappaditya, C., Hriday, B. Electro-hydrodynamic assisted synthesis of lecithin-stabilized peppermint oil-loaded alginate microbeads for intestinal drug delivery. Int J Biol Macromol. 185 (8), 861-875 (2021).
- Chan, E. S. Preparation of Ca-alginate beads containing high oil content: Influence of process variables on encapsulation efficiency and bead properties. Carbohydr Polym. 84 (4), 1267-1275 (2011).
- Xie, J., Jiang, J., Davoodi, P., Srinivasan, M. P., Wang, C. H. Electrohydrodynamic atomization: A two-decade effort to produce and process micro-/nanoparticulate materials. Chem Eng Sci. 125 (3), 32-57 (2015).
- Zamani, M., Prabhakaran, M. P., Ramakrishna, S. Advances in drug delivery via electrospun and electrosprayed nanomaterials. Int J Nanomed. 8 (8), 2997 (2013).
- Husain, O., Lau, W., Edirisinghe, M., Parhizkar, M. Investigating the particle to fibre transition threshold during electrohydrodynamic atomization of a polymer solution. Mater Sci Eng. C. 65 (8), 240-250 (2016).
- Wan, L. Q. Calcium concentration effects on the mechanical and biochemical properties of chondrocyte-alginate constructs. Cell Mol Bioeng. 1 (3), 93-102 (2008).
- Baimark, Y., Srisuwan, Y. Preparation of alginate microspheres by water-in-oil emulsion method for drug delivery: Effect of Ca2+ post-cross-linking. Adv Powder Technol. 25 (5), 1541-1546 (2014).
- Paques, J. P., Sagis, L. M. C., van Rijn, C. J. M., van der Linden, E. Nanospheres of alginate prepared through w/o emulsification and internal gelation with nanoparticles of CaCO3. Food Hydrocoll. 40 (10), 182-188 (2014).
- Suksamran, T. Biodegradable alginate microparticles developed by electrohydrodynamic spraying techniques for oral delivery of protein. J Microencapsul. 26 (7), 563-570 (2009).
- Wang, H., et al. Characterization, release, and antioxidant activity of curcumin-loaded sodium alginate/ZnO hydrogel beads. Int J Biol Macromol. 121 (1), 1118-1125 (2019).
- Bera, H., Boddupalli, S., Nayak, A. K. Mucoadhesive-floating zinc-pectinate-sterculia gum interpenetrating polymer network beads encapsulating ziprasidone HCl. Carbohydr Polym. 131 (10), 108-118 (2015).
- Azad, A. K., et al. Encapsulation of black seed oil in alginate beads as a pH-sensitive carrier for intestine-targeted drug delivery: In vitro, in vivo and ex vivo study. Pharmaceutics. 12 (3), 219 (2020).
- Azad, A. K., et al. A dataset of microstructure features of electro-hydrodynamic assisted 5-fluorouracil-grafted alginate microbeads and physicochemical properties for effective colon targeted carriers drug delivery. Data in Brief. 53 (4), 110202 (2024).
- Danaei, M., et al. Impact of particle size and polydispersity index on the clinical applications of lipidic nanocarrier systems. Pharmaceutics. 10 (2), 57 (2018).
- Piornos, J. A., Burgos-Díaz, C., Morales, E., Rubilar, M., Acevedo, F. Highly efficient encapsulation of linseed oil into alginate/lupin protein beads: Optimization of the emulsion formulation. Food Hydrocoll. 63 (2), 139-148 (2017).
- Morales, E. Alginate/Shellac beads developed by external gelation as a highly efficient model system for oil encapsulation with intestinal delivery. Food Hydrocoll. 70 (9), 321-328 (2017).
- Nikoo, A. M., Kadkhodaee, R., Ghorani, B., Razzaq, H., Tucker, N. Electrospray-assisted encapsulation of caffeine in alginate microhydrogels. Int J Biol Macromol. 116 (9), 208-216 (2018).
- Shao, L., et al. Effect of cold-spray parameters on surface roughness, thickness and adhesion of copper-based composite coating on aluminum alloy 6061 T6 substrate. Processes. 11 (3), 959 (2023).
- Li, W., et al. Effects of spraying parameters and heat treatment temperature on microstructure and properties of single-pass and single-layer cold-sprayed Cu coatings on Al alloy substrate. Surf Coat Technol. 30 (490), 131184 (2024).
- . . US Pharmacopoeia National Formulary, USP 23/NF 18. , (2000).
- Chen, Y. -. C., Ho, H. -. O., Liu, D. -. Z., Siow, W. -. S., Sheu, M. -. T. Swelling/floating capability and drug release characterizations of gastroretentive drug delivery system based on a combination of hydroxyethyl cellulose and sodium carboxymethyl cellulose. PLoS One. 10 (1), e0116914 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten