Method Article
Ein Mausmodell für vaskuläre kognitive Beeinträchtigung und Demenz basierend auf einer nadelgesteuerten asymmetrischen bilateralen Stenose der Arteria carotis communis
In diesem Artikel
Zusammenfassung
Die Nadelmethode der asymmetrischen bilateralen Stenose der Arteria carotis communis wird vorgeschlagen, um ein Mausmodell für vaskuläre kognitive Beeinträchtigungen und Demenz zu schaffen. Es führt zu längerfristigen Ergebnissen im Vergleich zu bisher etablierten Modellen und ist mit der Live-MRT kompatibel. Die visuelle Darstellung, die das Verfahren demonstriert, bietet eine Anleitung zur Beherrschung der Operation.
Zusammenfassung
Vaskuläre kognitive Beeinträchtigung und Demenz (VCID) resultieren aus einer vaskulären Hirnverletzung. Angesichts der hohen Inzidenz von VCID, die mit zunehmendem Alter der Bevölkerung voraussichtlich weiter steigen wird, ist es von entscheidender Bedeutung, ein robustes Tiermodell für die Krankheit zu etablieren. In dieser Arbeit wird eine neuartige Methode zur Erstellung eines Mausmodells für VCID vorgestellt, das auf einer asymmetrischen bilateralen Stenose der Arteria carotis communis basiert, die die durch Carotis-Atherosklerose verursachte chronische zerebrale Hypoperfusion beim Menschen nachahmt.
Kurz gesagt, die Arteria carotis communis (CCAs) werden mit Hilfe von 7-0-Seidennähten an Nadeln unterschiedlicher Stärke (32 G für die rechte CCA und 34 G für die linke CCA) ligiert, gefolgt von einer sofortigen Nadelentfernung. Die verbleibenden Nahtringe verursachen eine anhaltende Durchblutungsminderung und langfristige kognitive Beeinträchtigungen, die mit Verletzungen der weißen Substanz, Mikroinfarkten und reaktiver Gliose einhergehen, wodurch die Pathogenese von VCID genau nachgeahmt wird. Wichtig ist, dass sich in diesem Nadelmodell die klinischen Repräsentationen mit der Zeit nicht umkehren, was zu einer zuverlässigen langfristigen kognitiven Beeinträchtigung führt. Darüber hinaus betrug die Überlebensrate 24 Wochen nach der Operation 81,6%, was im Vergleich zu den anderen etablierten Modellen von VCID mit einem ähnlichen Grad der Blutflussreduktion höher ist.
Weitere Vorteile sind die geringen Materialkosten und die Kompatibilität mit der MRT zur Überwachung von Hirnverletzungen bei lebenden Tieren, da kein Metall implantiert wird. Die größte Herausforderung bei der Anwendung des Nadelmodells von VCID ist die Notwendigkeit, fortgeschrittene chirurgische Fähigkeiten zu entwickeln, da CCAs von Mäusen einen Durchmesser von weniger als 0,6 mm haben und sehr zerbrechlich sind. Eine qualitativ hochwertige visuelle Darstellung der Operation wird den Forschern daher helfen, diese Technik zu beherrschen und unser Verständnis von VCID zu verbessern, was möglicherweise zur Entwicklung neuartiger therapeutischer Modalitäten führt, um den verheerenden kognitiven Verfall im Zusammenhang mit VCID zu verringern.
Einleitung
Vaskuläre kognitive Beeinträchtigung und Demenz (VCID) ist die zweithäufigste Ursache für kognitiven Verfall. Trotz der unbestreitbaren Fortschritte, die beim Verständnis der VCID-Pathogenese und ihrer Risikofaktoren erzielt wurden, bleibt der Mechanismus, wie neurovaskuläre Dysfunktion zum Rückgang der kognitiven Fähigkeiten beiträgt, vage. Eine Reihe von Nagetiermodellen unterschiedlicher Komplexität wurden etabliert, um eine zerebrale Ischämie zu induzieren, um die klinischen Repräsentationen von humanem VCID1 nachzuahmen. Einige dieser Modelle basieren auf der Erzeugung einer vorübergehenden zerebralen Hypoperfusion; Die meisten von ihnen werden jedoch durch Induktion einer chronischen zerebralen Hypoperfusion erzeugt, dem Hauptmechanismus, der bei menschlichen Patienten zu VCID führt2.
Chronische zerebrale Hypoperfusion kann entweder durch einen bilateralen Karotis-Verschluss (BCAO), der schwere, aber oft tödliche Folgen hat, oder durch eine bilaterale Carotis-Stenose (BCAS) eingeleitet werden. BCAS wird in der Regel mit einer von zwei Methoden durchgeführt: indem identische Mikrospulen um beide CCAs gelegt werden, was zu einer symmetrischen Stenoseführt 3; oder durch Implantation eines Ameroid-Constrictors und einer Mikrospirale um die linken bzw. rechten CCAs, was zu einem allmählichen Verschluss und einer Verringerung des Blutflusses von ~50 % an den linken und rechten CCAs führt,entsprechend 4. Die Nachteile beider Methoden sind eine hohe Sterblichkeitsrate, wenn die Stenose zu stark ausgeprägt ist oder wenn der CCA verschlossen ist, und die Unverträglichkeit mit MRT-Scans bei lebenden Tieren aufgrund des Vorhandenseins von Metall im Körper. Es wurden auch einige genetische Mausmodelle etabliert 1,5,6,7,8. Weitere Optionen sind die zerebrale autosomal-dominante Arteriopathie mit subkortikalen Infarkten und Leukenzephalopathie-Mausmodellen 9,10. Nichtsdestotrotz ahmt keines der vorgeschlagenen Modelle das gesamte Spektrum der ischämischen Schädigung nach, die bei menschlichen Patienten auftritt, und daher wird die Suche nach aktualisierten VCID-Modellen fortgesetzt.
In dieser Arbeit wird eine neuartige chirurgische Methode zur Induktion einer asymmetrischen bilateralen Stenose der Arteria carotis communis (ABCS) bei Mäusen vorgestellt, bei der die CCA-Stenose mit Hilfe von Seidennähten durchgeführt und durch das Ligamieren von CCAs an Nadeln mit unterschiedlichen Durchmessern kontrolliert wird, gefolgt von einer sofortigen Nadelentfernung11. Infolgedessen werden Nahtringe mit präzisen Durchmessern dauerhaft auf den CCAs belassen, um eine chronische Stenose zu gewährleisten. Der Vorteil der Verwendung von ABCS gegenüber einer symmetrischen Methode besteht darin, dass eine moderate Hypoperfusion auf der rechten Seite ein besseres Überleben gewährleistet, während eine ausgeprägtere Hypoperfusion auf der linken Seite langfristige neurologische und pathologische Repräsentationen gewährleistet. Dieses Nadelmodell hat mehrere Vorteile gegenüber den traditionellen BCAS-Modellen11 , wie z. B. persistente Ergebnisse, geringere Mortalität, extrem niedrige Kosten, Flexibilität und die Möglichkeit, spezielle analytische Ansätze zu verwenden.
Um diese Vorteile zu verdeutlichen, verursachen drei Ligaturen ein Fragment der CCA-Stenose anstelle einer Fokalpunktstenose, was bei ~90% der Mäuse zu einer anhaltenden Minderdurchblutung, einer Verletzung der weißen Substanz und einem kognitiven Verfall führt. Die Mortalität der Nadelmäuse lag bei ~17% und damit unter der von Hattori's Ameroidrestriktor/Microcoil Modell4, das nach unseren Erfahrungen eine Mortalität von ~30% über 16 Wochen aufweist. Jedes BCAS-Modell kostet aufgrund der teuren Mikrospulen oder Ameroidrestriktoren in der Regel etwa 100 US-Dollar, während das Nadelmodell nur etwa 1 US-Dollar pro Maus kostet. Darüber hinaus könnte die Stärke der Nadeln je nach den forschungsspezifischen Anforderungen an die Blutflussbeschränkung auf beiden Seiten modifiziert werden. In der in der vorliegenden Arbeit vorgestellten Variation ahmt das Nadelmodell die Pathophysiologie der schweren Carotisstenose nach, die durch eine einseitige permanente Stenose ohne Okklusion verursacht wird, die in der Klinik die häufigste Darstellung der Erkrankung darstellt11. Darüber hinaus bestehen Ameroidrestriktoren und Mikrospulen, die in traditionellen BCAS-Modellen verwendet werden, aus Metall, was bei einer In-vivo-MRT erhebliche Artefakte verursachen kann, obwohl das Metall nicht im Gehirn, sondern in der Brust implantiert wird. Es könnte schwierig sein, vorherzusagen, wie genau sich das Vorhandensein von Metall auf die Bildgebung auswirken würde.
Im Allgemeinen handelt es sich bei der In-vivo-MRT , die nach der Implantation einer Mikrospirale durchgeführt wird, in der Regel um eine einfache anatomische Bildgebung, die nicht für die quantitative Analyse multipler Beleidigungen geeignet ist, was für die VCID-Forschung sehr wünschenswert ist. Im Gegensatz dazu verwendet das hier vorgestellte Nadelmodell nur Seidennähte und ist voll kompatibel mit jeder Art von in vivo MRT. Dies ist aus zwei Gründen von Bedeutung: (1) Die MRT ist extrem empfindlich gegenüber kleinen Hirnläsionen, Mikroblutungen oder oberflächlicher Siderose12 und wird daher den anderen Analysemethoden, wie z. B. dem CT-Scan, vorgezogen. (2) Die In-vivo-MRT sollte der Ex-vivo-MRT vorgezogen werden, da die VCID-Forschung zweifellos von der Verfolgung der Dynamik des Fortschreitens/der Heilung der Läsion profitieren kann. insbesondere als Reaktion auf die vorgeschlagenen neuartigen Behandlungen. Darüber hinaus kann eine funktionelle (fMRT) im Nadelmodell durchgeführt werden, um wichtige Einblicke in die Integrität der neurovaskulären Kopplung als Reaktion auf eine zerebrale Hypoperfusion zu erhalten. Die Möglichkeit, die In-vivo-MRT zu verwenden, eröffnet somit einen Weg für eine eingehende Analyse der komplizierten Korrelation zwischen der Größe und dem Ort der Läsionen und der kognitiven Funktion sowie der neurovaskulären Kopplung, insbesondere in pharmakodynamischen Studien.
Protokoll
Alle Tierprotokolle wurden vom Institutional Animal Care and Use Committee an der University of Pittsburgh genehmigt und in Übereinstimmung mit dem National Institutes of Health Guide for the Care and Use of Laboratory Animals durchgeführt. Bei allen Überlebensoperationen müssen sterile Techniken beibehalten werden. In den vorgestellten Experimenten wurden zwölf Wochen alte männliche C57BL/6J-Mäuse mit einem Körpergewicht von 25-30 g verwendet.
1. Vorbereitung der Materialien und des Arbeitsraums
- Bereiten Sie die Nadelfragmente vor (~4 mm lang; 32 G für den rechten CCA und 34 G für den linken CCA). Stumpfen Sie das scharfe Ende der Nadeln leicht ab, indem Sie vorsichtig gegen eine harte Oberfläche klopfen und trennen Sie die Nadeln vorsichtig mit einem Nadelhalter von den Kunststoffstücken. Vorgeschnittene 7-0 Seidennähte in 1-2 cm lange Stücke.
- Sterilisieren Sie chirurgische Instrumente, Nadelfragmente und Nähte durch Autoklavieren oder eine andere geeignete Methode.
2. Durchführung der Operation
- Wiegen Sie die Maus und leiten Sie eine Anästhesie ein, indem Sie die Maus für 2-3 Minuten in eine Kammer legen, die mit 3 % Isofluran in einer Mischung aus 25 % O2 und 72 % N2O beatmet ist.
- Legen Sie die Maus (mit der Bauchseite nach oben) auf ein Heizkissen, das mit einem sterilen OP-Tuch bedeckt ist, um eine konstante Körpertemperatur (37 °C) zu halten, und befestigen Sie eine Gesichtsmaske zur Beatmung mit 1 % Isofluran in einer Mischung aus 25 % O2 und 74 % N2O. Befestigen Sie die Gliedmaßen der Maus mit Klebeband.
- Rasieren Sie das Fell am Hals mit einem Elektrorasierer. Reinigen Sie das feine Haar mit Klebeband oder einem Tastaturstaubsauger.
- Desinfizieren Sie die Operationsstelle mit Betadin-Lösung (10% Jod). Entjodieren Sie die Haut mit 70% Ethanol. Wiederholen Sie die Infektion 3x. Stellen Sie sicher, dass das Anästhesieniveau angemessen ist, indem Sie nicht auf ein festes Einklemmen der Zehen reagieren (Pedalreflex).
- Drapieren Sie den Operationsbereich. Machen Sie dann einen vertikalen Mittellinienschnitt entlang der Luftröhre und trennen Sie die beidseitigen Schilddrüsen mit einer Mikrozange. Ziehen Sie die Haut und das Gewebe mit sterilen kleinen Hautretraktoren ab.
- Verwenden Sie unter dem Mikroskop eine abgewinkelte Pinzette, um einen der CCAs vorsichtig freizulegen und stumpf vom Vagusnerv und der Hülle abzustumpfen. Verwenden Sie steriles Wasser oder phosphatgepufferte Kochsalzlösung (PBS), um die Inzisionsstelle zu befeuchten, wenn die CCA dazu neigt, an der Pinzette zu kleben. Legen Sie eine kleine Plastikspritze unter den Nacken, um die Haltung bei Bedarf zu unterstützen.
HINWEIS: Achten Sie besonders darauf, dass der CCA nicht reißt. - Fädeln Sie drei vorgestanzte Seidennahtfragmente (Größe 7-0) mit einer abgewinkelten Pinzette (1 mm Abstand) unter den CCA.
- Ziehen Sie einen sehr lockeren Doppelknoten um den CCA auf einem der Nahtfragmente.
HINWEIS: Das Befeuchten der Operationsstelle und der Nähte mit sterilem Wasser oder PBS kann beim Knüpfen eines Knotens hilfreich sein. - Platzieren Sie ein Nadelfragment (32 G für den rechten CCA und 34 G für den linken CCA) parallel zum CCA in den losen Knoten (Abbildung 1A). Ziehen Sie den Primärknoten vorsichtig um die Nadel und den CCA fest, bis kein Blutfluss mehr zu beobachten ist, und befestigen Sie ihn mit einem Sekundärknoten. Ziehen Sie sofort die Nadel heraus, um den teilweisen Blutfluss wiederherzustellen, und schneiden Sie die Enden der Naht ab.
HINWEIS: Der Chirurg muss beim Trimmen der Nahtenden sehr vorsichtig sein, nachdem die Knoten fertiggestellt sind. Wenn du zu nah am Knoten schneidest, kann sich der Knoten lösen. Darüber hinaus ist es wichtig, die CCA nach dem Entfernen der Nadel zu beobachten, um sicherzustellen, dass der Blutfluss stromabwärts des Knotens noch möglich ist. Wenn der CCA nach der Nadelentfernung sehr blass aussieht, bedeutet dies, dass der CCA überkomprimiert ist. - Wiederholen Sie die Schritte 2.8-2.9 für den 2. und3. Nahtfaden auf demselben CCA, etwa 1 mm voneinander entfernt (Abbildung 1B).
- Wiederholen Sie die Schritte 2.6-2.10 mit dem entgegengesetzten CCA unter Verwendung eines 32 G Nadelfragments.
- Prüfen Sie sorgfältig, ob beide CCAs effizient ligiert sind: Vergewissern Sie sich, dass alle drei Nahtbänder fest verknotet sind, aber nicht so fest, dass der Blutfluss vollständig blockiert wird (stellen Sie sicher, dass die CCAs stromabwärts der Knoten nicht blass sind). Vergewissern Sie sich, dass die drei Nahtbänder an jedem CCA etwa 1 mm voneinander entfernt sind.
- Verschließen Sie die Haut mit sterilen monofilen Nähten.
- Unmittelbar nach der Operation injizieren Sie 100-150 μl Ketoprofen (1 mg/ml Stamm; 5 mg/kg Körpergewicht) intraperitoneal, um die postoperativen Schmerzen zu lindern. Wiederholen Sie diese Injektion 24 h und 48 h nach der Operation.
- Legen Sie die Maus zur kontinuierlichen Überwachung 2 Stunden lang auf eine homöotherme Decke bei 37 °C, bevor Sie das Tier in die Tiereinrichtung zurückbringen.
HINWEIS: Für das Scheinverfahren sollten die Schritte 2.7-2.12 weggelassen werden.
3. Validierung des Modells
HINWEIS: Die Hirnverletzung wurde mit einer In-vivo-MRT analysiert und mit Luxol Fast Blue (LFB) Färbe- und Verhaltenstests weiter verifiziert.
- Bildgebung der zerebralen Blutperfusion.
- Betäuben Sie die Maus mit 1-1,5% Isofluran. Sterilisieren Sie die Operationsstelle mit Betadin-Lösung (10% Jod). Dann entjodieren Sie die Haut mit 70% Ethanol.
- Befestigen Sie den Schädel des Tieres in einem stereotaktischen Rahmen. Machen Sie einen saggitalen Schnitt in der Mittellinie in der Kopfhaut vom Stirn- bis zum Hinterhauptbein, um den Schädel freizulegen und die Schädeloberfläche mit steriler Kochsalzlösung zu reinigen.
- Platzieren Sie eine Kamera mit geladenem gekoppeltem Gerät 10 cm über dem Schädel mit einem zweidimensionalen Laser-Speckle-System. Setzen Sie einen Sondenhalter über die Kraniektomiestelle und befestigen Sie ihn fest.
- Nehmen Sie 5 Minuten vor der Operation und unmittelbar nach dem Lösen der Nadel oder 7, 14, 21, 28, 35 und 42 Tage nach der Operation Blutperfusionsbilder auf.
- Verschließen Sie die Haut mit sterilen monofilen Nähten. Injizieren Sie 100-150 μl Ketoprofen (1 mg/ml Stamm; 5 mg/kg Körpergewicht) intraperitoneal, um die postoperativen Schmerzen zu lindern. Wiederholen Sie diese Injektion 24 h und 48 h.
- Im lebenden Organismus MRI
- Betäuben Sie die Mäuse mit 1-1,5 % Isofluran, wobei die Atmung kontinuierlich überwacht und die Temperatur während der Bildaufnahme mit warmer Luft auf 37 °C gehalten wird.
- Führen Sie eine In-vivo-MRT mit einem 9,4-T-Scanner, einer 86-mm-Tx-Spule und einem 4-Kanal-Maus-Gehirn-Empfänger-Array durch, auf dem die zugehörige Software ausgeführt wird. Erfassen Sie nach Positionierungs- und Pilotscans T2-gewichtete Bilder (T2WI) mit einer RARE-Sequenz (Rapid Acquisition with Relaxation Enhancement) mit den folgenden Parametern: Echozeit/Wiederholzeit (TE/TR) = 40/4.000 ms, Mittelwerte = 8.256 × 256-Matrix, 16 Schichten mit einer Schichtdicke von 0,5 mm, einem RAR-Faktor = 4 und einem Sichtfeld (FOV) von 20 x 20 mm.
- Erfassen Sie DTI-Daten (Diffusion Tensor Imaging) mithilfe einer EPI)-DTI-Bildgebungssequenz (Echo Planar Imaging) unter Verwendung derselben Geometrie und gleichen Parameter wie bei der T2WI mit den folgenden Ausnahmen: TR/TE = 2.300/22 ms, Erfassungsmatrix = 128 x 128, 2 Segmente, 5 A0-Bilder und 30 nichtkolineare Diffusionsbilder, Δ/δ = 10/3 ms und ein b-Wert = 1.000 s/mm2.
- Analysieren Sie DTI-Daten mit der DSI Studio-Software (http://dsistudio.labsolver.org/) und suchen Sie nach Unterschieden in den skalaren Diffusionsparametern (fraktionale Anisotropie (FA), mittlere Diffusivität (MD), axiale Diffusivität (AD) und radiale Diffusivität (RD)). Zeichnen Sie Regionen von Interesse (ROIs) für das Corpus callosum (CC), die externe Kapsel (EC), die innere Kapsel (IC), die Fimbria, die vordere Kommissur (AC), das Cingulum (Cing), den Hippocampus (Hippo), den Kortex (C) und das Striatum (Str) aus beiden Hemisphären.
- Luxol Fast Blue (LFB) Färbung
- Bereiten Sie Gehirnschnitte vor: Fixieren Sie das Gehirn 24 h lang mit 4 % PFA und tauchen Sie das Gehirn dann in 30 % Saccharose, bis das Gehirn absinkt. Betten Sie das Gehirn in eine OCT-Verbindung auf Trockeneis ein. Schneiden Sie eine 20 μm dicke koronale Hirnscheibe auf ein gleitendes Mikrotom. Lagern Sie die Gehirnschnitte in Aufbewahrungslösung (30 % Glycerin/30 % Ethylenglykol in PBS).
- Tauchen Sie die Gehirnschnitte in LFB (0,1%ige Alkohollösung), halten Sie sie über Nacht bei 56 °C und waschen Sie sie mit destilliertem Wasser.
- Inkubieren Sie Gehirnschnitte in 0,05 % Lithiumcarbonat und dehydrieren Sie durch abgestufte Alkohole.
- Die Abschnitte 5 min lang mit 0,5 % Kresylviolett einfärben, differenziert mit 70 % Ethanol.
- Montieren Sie die verfärbten Hirnabschnitte mit Einbettmedium.
- Bewertung der kognitiven Funktion mit einem modifizierten Morris-Wasserlabyrinth-Test
- Füllen Sie einen runden Tank mit Wasser (25 °C, Tiefe 33 cm) und tauchen Sie eine quadratische ~10 x 10 cmgroße 2 Plexiglasplattform 1,2 cm unter dem Wasserspiegel, 31 cm vom Nord-, Ost-, Süd- oder Westrand des Beckens entfernt.
HINWEIS: Diese Plattform sollte während der gesamten Testdauer am selben Ort bleiben. - Schalten Sie eine an der Decke montierte Videokamera ein. Platzieren Sie eine Maus in den Tank (lassen Sie sie nicht auf Wasserhöhe los), mit dem Gesicht zur Wand und beginnen Sie entweder mit Nordosten, Südosten, Südwesten oder Nordwesten. Lassen Sie die Maus maximal 90 s lang schwimmen, um eine untergetauchte Plattform zu finden.
- Lassen Sie die Maus 30 s lang auf der untergetauchten Plattform verbleiben, wenn die Plattform gefunden wird. Wenn die Plattform nicht gefunden wird, platzieren Sie die Maus dort für 30 s.
- Lassen Sie die Maus 5 min ruhen und wiederholen Sie den Schwimmversuch (Schritte 3.4.2 - 3.4.3) 2x.
- Trocknen Sie die Maus mit einem Tuch ab und setzen Sie sie wieder in ihren Käfig unter einer Glühbirne ein.
- Wiederholen Sie jeden Tag drei Schwimmversuche für 5 aufeinanderfolgende Tage.
- Berechnen Sie anhand von Videomaterial die Latenz bis zur Flucht (wie lange dauert es, die Plattform in jedem Versuch zu finden).
- Entfernen Sie am letzten Testtag die Plattform, und notieren Sie die Zeit, die die Maus in dem Quadranten verbringt, in dem sich die Plattform zuvor befand.
- Füllen Sie einen runden Tank mit Wasser (25 °C, Tiefe 33 cm) und tauchen Sie eine quadratische ~10 x 10 cmgroße 2 Plexiglasplattform 1,2 cm unter dem Wasserspiegel, 31 cm vom Nord-, Ost-, Süd- oder Westrand des Beckens entfernt.
Ergebnisse
Langfristige asymmetrische zerebrale Hypoperfusion
Der CCA-Blutfluss wurde vor und unmittelbar nach dem Lösen der Nadel aus der letzten (dritten) Ligatur gemessen, wie zuvor beschrieben11. Der Blutfluss war um ~70% in der linken CCA und ~50% in der rechten CCA reduziert. Die zerebrale Blutperfusion wurde dynamisch mit Hilfe von zweidimensionalen Laser-Speckles überwacht. Die Operation führte zu einer zerebralen Minderdurchblutung in beiden Hemisphären, wobei die linke Hemisphäre stärker betroffen war (Abbildung 2). Die zerebrale Hypoperfusion wird mindestens 24 Wochen nach der Operation aufrechterhalten11.
Geringere Sterblichkeit
Die Überlebensrate für männliche Mäuse über 6 Wochen betrug 81,6 % (Abbildung 3); Mäuse waren in der ersten Woche nach der Operation anfälliger für den Tod.
In vivo MRT-Nachweis von Hirnverletzungen
T2-gewichtete Bilder zeigten hypo- oder hyperintense Regionen im Hippocampus (Hippo), in der äußeren Kapsel (EC), in der inneren Kapsel (IC), im Corpus callosum (CC) und im Striatum (Str) bei Mäusen, die einer ABCS-Operation unterzogen wurden, was auf eine Hirnverletzung hinweist (Abbildung 4A). Strukturelle Schäden wurden in den direktional kodierten Farbkarten (DEC) des DTI von ABCS-Mäusen im Vergleich zum Schein beobachtet (Abbildung 4B).
Quantitative Analysen zeigten, dass ABCS-Mäuse im Vergleich zu Scheinmäusen (P < 0,05 gegenüber Scheinmäusen) eine signifikant geringere fraktionelle Anisotropie (FA) bei linkem Hippo, IC, anteriorer Kommissur (AC), Cingulum (Cg) und Fimbria (Fi) aufwiesen, was auf eine Beeinträchtigung der Mikrostruktur der weißen Substanz in der linken Hemisphäre hinweist (Bild oben links, Abbildung 4C). FA im rechten Cg und Fi bei ABCS-Mäusen waren ebenfalls reduziert (P < 0,05 gegenüber Schein). Die FA im linken IC und Fi war bei ABCS-Mäusen signifikant niedriger als die des rechten IC (P < 0,05, links versus rechts).
In ähnlicher Weise wurde eine signifikant niedrigere axiale Diffusivität (AD) in den linken EC, IC, Str und Fi bei ABCS-Mäusen im Vergleich zu Scheinmäusen gezeigt, was auf eine axonale Schädigung hindeutet (oberes rechtes Bild, Abbildung 4C (P < 0,05 versus Schein)). Nur der linke Str zeigte eine Verringerung der mittleren Diffusivität (MD) bei ABCS-Mäusen im Vergleich zu Scheinmäusen (unteres linkes Bild, Abbildung 4C). Ein Unterschied in der radialen Diffusivität (RD) wurde bei linken CC, Str und Fi in ABCS-Mäusen beobachtet (unteres rechtes Bild, Abbildung 4C), was auf eine Entzündung und erhöhte Zellularität in diesen Regionen hindeutet13.
Asymmetrische Hirnverletzung in den beiden Hemisphären und Schädigung in den Regionen der weißen Substanz in der linken Hemisphäre
Hirnverletzungen wurden zusätzlich mit LFB-Färbung unter Verwendung des zuvor beschriebenen Verfahrens analysiert14 (Abbildung 5). Bilder mit geringerer Vergrößerung zeigten eine hellere Blaufärbung in EC und Str, was auf eine Demyelinisierung in diesen Regionen hindeutet. Hochauflösende Bilder zeigten, dass Scheinmäuse gut organisierte und myelinisierte Axone mit linearen Oligodendrozyten in EC aufwiesen; Die Axone verschwanden jedoch und bei ABCS-Mäusen wurden allgegenwärtige, blau gefärbte Zellen in EC beobachtet. Scheinmäuse zeigten tiefblau gefärbte und gut organisierte Faserbündelstrukturen in Str. Die Faserbündel färbten sich jedoch heller und kleiner, und ihre Integrität war beeinträchtigt; einige Faserbündel wurden in ABCS-Mäusen vakuolisiert. Die Faserbündel wurden verzerrt und die Matrix zwischen den Bündeln war in AC bei ABCS-Mäusen signifikant verdickt. Zusammenfassend lässt sich sagen, dass die ABCS-Operation axonale Demyelinisierung und Schädigung verursacht; Schäden an der weißen Substanz treten hauptsächlich in der linken Hemisphäre auf.
Lern- und Gedächtnisstörungen
Die Nadel-ABCS-Operation führte zu einer erheblichen Lernbehinderung, was sich in einer längeren Zeit zeigte, um eine untergetauchte Plattform zu finden (Latenz zum Entkommen) während eines Morris-Wasserlabyrinth-Tests (Abbildung 6). Diese Behinderung bestand mindestens 24 Wochen nach der Operation an. Der Arbeitsspeicher war ebenfalls erheblich beeinträchtigt, was sich in einer verringerten Zeit im Zielquadranten zeigt, nachdem die Plattform entfernt wurde.
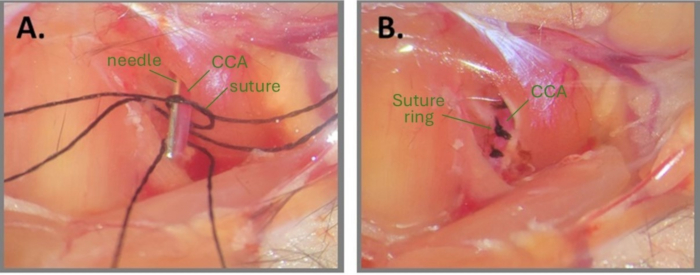
Abbildung 1: Schritte der Nadelchirurgie zur Erstellung eines ABCS. (A) Das linke CCA wird freigelegt und drei Seidennähte werden unter das CCA eingefädelt. Auf eines der Nahtfragmente wird ein loser Knoten gezogen und die Nadel parallel zum CCA positioniert. (B) Drei Nahtringe sind in einem Abstand von ca. 1 mm positioniert. Abkürzungen: ABCS = asymmetrische bilaterale Stenose der Arteria carotis communis; CCA = Arteria carotis communis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Persistierende asymmetrische zerebrale Hypoperfusion im Nadel-ABCS-Modell. Dynamische Überwachung des Blutflusses des Gehirns nach der Operation. Eine persistierende zerebrale Hypoperfusion kann in beiden Hemisphären beobachtet werden, wobei sie auf der linken Seite stärker ausgeprägt ist. Schwarze Sternchen weisen auf Hypoperfusionsregionen hin. Abkürzung: ABCS = asymmetrische bilaterale Stenose der Arteria carotis communis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Überlebensrate nach Nadel-ABCS-Operation. Die Operation führte zu einer Überlebensrate von 81,6 % über 6 Wochen; Der Tod trat hauptsächlich in der ersten postoperativen Woche auf. Abkürzung: ABCS = asymmetrische bilaterale Stenose der Arteria carotis communis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
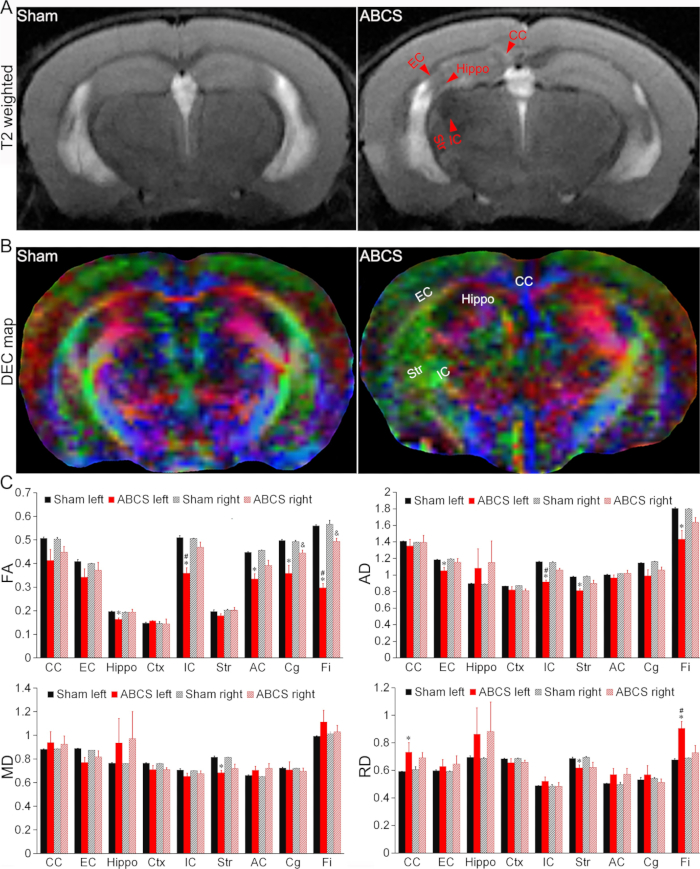
Abbildung 4: In vivo MRT-Detektion von Hirnverletzungen im Nadel-ABCS-Modell. (A) Repräsentative T2-gewichtete Bilder von Schein- und ABCS-Mäusen. Rote Pfeilspitzen zeigen hypo- oder hyperintense Regionen an. (B) Repräsentative DEC-Karte der in vivo DTI 2 Wochen nach der Nadel-ABCS-Operation. Die Farben zeigen die Richtungsabhängigkeit der Hauptdiffusionsachse an (rot = links/rechts, grün = dorsal/ventral und blau = rostral/kaudal). (C) Quantitative Analyse an Schein- und ABCS-Mäusen (Einweg-ANOVA). * steht für p < 0,05 ABCS gegenüber Schein (linke Hemisphäre). # steht für p < 0,05 links versus rechts. & steht für p < 0,05 ABCS gegenüber Schein (rechte Hemisphäre). Die Daten werden als Mittelwert ± SEM dargestellt; n = 4 für Schein, n = 4 für ABCS-Mäuse. Abkürzungen: ABCS = asymmetrische bilaterale Stenose der Arteria carotis communis; Nilpferd = Hippocampus; EC = externe Kapsel; IC = interne Kapsel; CC = Corpus Callosum; Str = Striatum; DEC = richtungscodierte Farbe; DTI = Diffusions-Tensor-Bildgebung; FA = fraktionierte Anisotropie; MD = mittlere Diffusivität; AD = axiale Diffusivität; RD = radiale Diffusivität. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
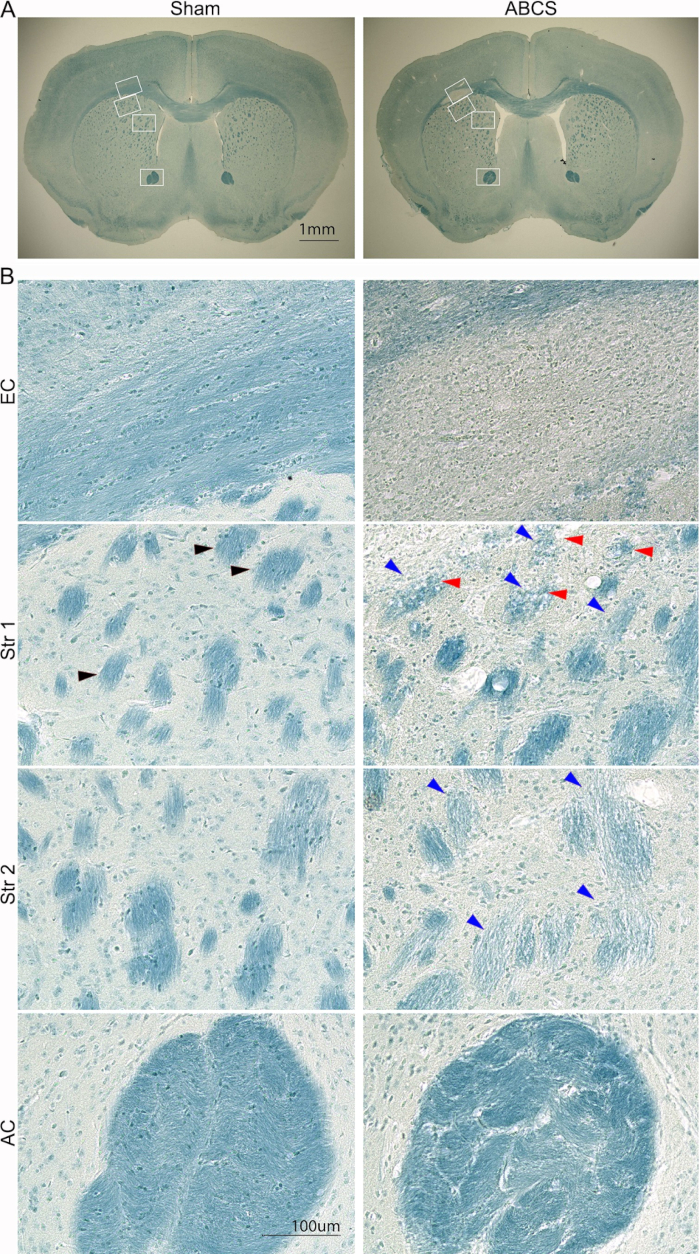
Abbildung 5: Repräsentative LFB-Färbung von Hirnschnitten 6 Wochen nach der Nadel-ABCS-Operation. (A) Low-Power-Bilder der LFB-Färbung von Schein- und ABCS-Mäusen. Weiße Kästchen kennzeichnen die Position, die den Bildern mit höherer Auflösung in B entspricht. (B) Hochauflösende Bilder (200x) von EC (obere Platte) und Str-Positionen 1 und 2 (mittlere Platte) und AC (untere Platte). Die schwarze Pfeilspitze zeigt ein normales Faserbündel. Blaue Pfeilspitzen zeigen auf ein beschädigtes Faserbündel. Rote Pfeilspitzen kennzeichnen vakuolisierte Fasern. Maßstabsleisten = 1 mm (A), 100 μm (B). Abkürzungen: ABCS = asymmetrische bilaterale Stenose der Arteria carotis communis; LFB = Luxol schnell blau; EC = externe Kapsel; Str = Striatum; AC = anteriore Kommissur. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
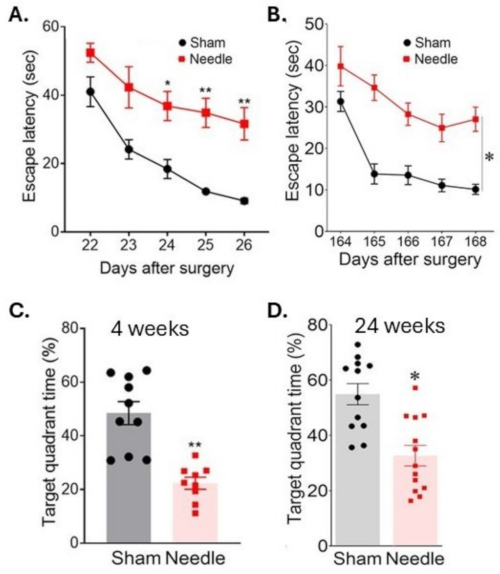
Abbildung 6: Räumliches Lernen und Gedächtnisbewertung im Wasserlabyrinth-Test. Das räumliche Lernen wurde (A) 3 Wochen und (B) 24 Wochen nach der Operation bewertet, indem die Zeit bis zur Ortung der Plattform an aufeinanderfolgenden Tagen gemessen wurde. Das Gedächtnis wurde (C) 4 Wochen und (D) 24 Wochen nach der Operation beurteilt, indem die Zeit gemessen wurde, die nach der Entfernung der Plattform im Zielquadranten verbracht wurde. Die Operation führte zu einer langfristigen Störung der kognitiven Funktionen. Die Daten wurden als Mittelwert ± SEM, *p < 0,05 Nadel versus Schein ausgedrückt; **p < 0,01 gegenüber Schein; Zwei-Wege-ANOVA und Neuman-Keuls post hoc. n = 10 für Schein, n = 10 für Nadelgruppen. Diese Abbildung wurde von Weng et al.11 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Es wurden mehrere Methoden der VCID-Induktion mittels asymmetrischer CCA-Stenose beschrieben, die alle eine wichtige und kritische chirurgische Schrittisolierung des CCA vom Vagusnerv und die Hülle und Freilegung des CCA gemeinsam haben, um ihn für Stenosen zugänglich zu machen. Während wir eine qualitativ hochwertige visuelle Anleitung zur chirurgischen Exposition von CCAs vor der Ligatur bieten, möchten wir die Forscher auch darauf hinweisen, sich zusätzliche Videos zur CCA-Isolierung anzusehen, die im Rahmen anderer Maus- und Rattenoperationen online verfügbar sind 15,16,17,18. Es sollte besonders darauf geachtet werden, dass das CCA nicht komprimiert oder gerissen wird, da es die Hauptarterie ist, die das Gehirn mit sauerstoffreichem Blut versorgt.
Ein weiterer kritischer Schritt der Operation, der gemeistert werden muss, ist das Ziehen eines losen Knotens und das weitere Festziehen um den CCA mit der Nadel, gefolgt von der Nadelentfernung. Wir empfehlen dringend, diesen Schritt nur mit der Nadel allein zu üben, bevor Sie versuchen, ihn in einer narkotisierten Maus durchzuführen. Dies ermöglicht es, filigrane Zangenbewegungen zu beherrschen und Manipulationen mit den Nähten zu perfektionieren, ohne das Risiko, die Maus zu verletzen. Der Knoten muss gut gesichert sein, ohne beim Entfernen der Nadel auseinander zu fallen, fest genug, um die Nadel zu halten, aber locker genug, um die Nadel mit einer Pinzette von der verknoteten Naht wegschieben zu können.
Wichtig ist, dass wir festgestellt haben, dass eine einzige Ligatur jedes CCA nicht ausreicht, um den Blutfluss zuverlässig zu verringern und eine langfristige zerebrale Hypoperfusion aufrechtzuerhalten11. Eine mögliche Erklärung könnte sein, dass eine einzelne Ligatur eine Punktstenose verursacht, die wahrscheinlich einen lokalen Druckanstieg verursacht, der zu einer erhöhten Geschwindigkeit des Blutflusses führt, um die Verringerung des Blutflusses zu kompensieren. Wir empfehlen, drei Ligaturen im Abstand von ~1 mm voneinander durchzuführen, um ein Stenosefragment zu erzeugen. Ein weiterer Vorteil der Verwendung von drei Ligaturen besteht darin, dass die Knoten als Gärmechanismus dienen, falls sich einer der Knoten bei der zusätzlichen Nadelentfernung löst. Tatsächlich erhöht ein Stenosefragment, das durch drei separate Ligaturen desselben CCA verursacht wird, die Modellkonsistenz, was bei etwa 90 % der Mäuse zu einer anhaltenden zerebralen Hypoperfusion führt. Darüber hinaus ahmt die Fragmentstenose die durch Atherosklerose verursachte CCA-Stenose bei menschlichen Patienten im Vergleich zur Fokalpunktstenose genauer nach, wodurch die klinische Relevanz des Nadelmodells erhöht wird.
Wir empfehlen dringend, die Nadel nach Abschluss der ersten Ligatur sofort zu entfernen, um sicherzustellen, dass der CCA-Blutfluss teilweise wiederhergestellt ist, und erst dann nacheinander mit der zweiten und dritten Ligatur fortzufahren. Es wird nicht empfohlen, alle drei Ligaturen mit der Nadel in allen drei Knoten zu beenden, da dies die Zeit bis zur vollständigen Obstruktion des Blutflusses erheblich verlängern würde. In der Regel empfehlen wir nicht mehr als 1 Minute vollständigen CCA-Verschluss, bevor die Nadel entfernt wird. Diese Empfehlung basiert auf dem Bericht, dass Mäuse nach 3 Sitzungen mit 60 s Okklusion beider CCAs keine Anzeichen einer funktionellen Beeinträchtigung zeigten19. In unserem Modell arbeitet der Chirurg jeweils an einem CCA, was verzeihender ist als die gleichzeitige Okklusion beider CCAs, aber wir empfehlen trotzdem, diesem Zeitplan zu folgen, um Artefakte auszuschließen, die durch eine anhaltende Okklusion und nicht durch eine chronische Hypoperfusion auf beiden Seiten verursacht werden.
Während dieses Nadelmodell die Anpassung der Durchmesser der verknoteten Nähte durch die Verwendung von Nadeln mit unterschiedlichen Durchmessern (basierend auf dem Körpergewicht oder den spezifischen Anforderungen der Blutflusseinschränkung) ermöglicht, hatten Mäuse nach unserer Erfahrung höhere Überlebensraten, wenn die Hypoperfusion in der rechten Hemisphäre eher moderat als schwerwiegend war. Auf der anderen Seite führte eine anhaltende schwere Hypoperfusion in der linken Hemisphäre zu langfristigen pathologischen und neurologischen Ergebnissen. Daher empfehlen wir, eine asymmetrische Ligatur durchzuführen, indem eine dickere Nadel zur Ligatur der rechten CCA (was zu einer mäßigen Minderdurchblutung in der rechten Hemisphäre führt) und eine dünnere Nadel zur Ligatur der linken CCA (was zu einer schweren Minderdurchblutung in der linken Hemisphäre führt) verwendet wird.
Schließlich sollten sich die Forscher darüber im Klaren sein, dass verschiedene Mausstämme unterschiedliche Ergebnisse bei der ischämischen oder traumatischen Insult hervorrufen können, hauptsächlich aufgrund von Unterschieden in der zerebralen Gefäßanatomie20,21. Da viele Studien heutzutage die Erzeugung neuartiger transgener Mäuse erfordern, muss der Hintergrundstamm sorgfältig abgewogen werden, wenn in irgendeiner Phase des Versuchsdesigns eine BCAO-Operation erforderlich ist. Zum Beispiel sind sowohl C57BL/6- als auch SV129-Stämme eine gängige Hintergrundwahl für die Erzeugung transgener Tiere für die Schlaganfallforschung21. Es ist jedoch gut dokumentiert, dass C57BL/6-Mäuse im Vergleich zu den anderen getesteten Stämmen, einschließlich SV129-Mäusen, viel empfindlicher auf Ischämie reagieren 20,21. Tatsächlich gibt es Hinweise darauf, dass die Wirkung des murinen Stammes sogar noch wichtiger sein kann als die Wirkung der Technik, die zur Induktion von VCID21 verwendet wird. Daher ist es von entscheidender Bedeutung, die Hintergründe der Maus in allen Experimenten, bei denen es zu ischämischen Hirnverletzungen bei Nagetieren kommt, konsistent zu halten. Wichtig ist, dass die Forscher die Effizienz des Operationsergebnisses bei lebenden Tieren anhand neurologischer Scoring-Systeme22 mit einem Score von 0,5 als Einschlusskriterium bewerten können. Hirnverletzungen können mit Hilfe der Iba1-Immunfärbung weiter bestätigt werden, die auch nach geringfügigen fokalen Schädigungen sehr empfindlich auf Hirnschäden reagiert.
Zusammenfassend ist es wichtig, sich vor Augen zu führen, dass VCI ein komplexer Begriff ist, der viele klinische Darstellungen und Ursachen unter einem Dach vereint. Daher sollten sich Forschende immer vor Augen halten, welches Modell anhand der VCI-Aspekte, die sie untersuchen möchten, ausgewählt werden soll. Es kann nie ein allgemeingültiges Modell für alle VCI-Erscheinungsformen geben. CCA-Stenosemodelle schränken den Blutfluss aus den großen Arterien stark ein und ahmen so Patienten mit arteriosklerotischer Stenose nach. Die neuartige Nadelmethode zur Erzeugung asymmetrischer BCAS in C57BL/6J-Mäusen ist eine zuverlässige Methode zur Nachahmung von VCID, die mehrere Vorteile gegenüber den zuvor berichteten Methoden bietet (insbesondere hohe Flexibilität, niedrige Mortalität, Langzeitergebnisse, minimale Kosten und Live-MRT-Überwachung). Aufgrund seiner Vorteile gegenüber den anderen Modellen kann es verwendet werden, um unser Wissen über die VCID-Progression weiter zu vertiefen und als Grundlage für das Screening potenzieller Therapeutika zur Heilung oder Verlangsamung des Fortschreitens von VCID zu dienen. Ähnlich wie bei anderen berichteten Methoden von BCAS erfordert das Nadelmodell fortgeschrittene chirurgische Fähigkeiten, die mit der Zeit gemeistert werden können, wobei diese visuelle Demonstration als Leitfaden dient.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Dieses Projekt wurde durch die National Institutes of Health/NINDS Grants RF1NS117509 (G. Cao) und VA Merit Review Grants BX003923 and BX006454 (G. Cao) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD | 309659 | IP injection of ketoprofen |
| 2.5 mm blunt retractor tips | Kent Scientific Corporation | SURGI-5016-2 | 2 needed |
| Andis Ion T-Blade Pet Trimmer | Andis | BTF3 | To shave fur |
| Betadine Solution | Avrio Health L.P. | NDC 67618-150-17 | |
| Braided silk suture, 5-0 | Teleflex Medical | 106-S | For suturing skin |
| Braided silk suture, 7-0 | Teleflex Medical | 103-S | For ligating CCAs |
| Camera | Med Associates, Inc | VID-CAM-MONO-7 | For model validation |
| cover glass | Fisherbrand | 12-541-012 | For model validation |
| cresyl violet | Thermo Scientific | C581-25 | For model validation |
| Dispensing Tip, Needle, Flex, 34 Gauge, 1/4" OAL | Jensen Global | JG34-0.25HPX | For the left CCA |
| DSIStudio | https://dsi-studio.labsolver.org; for DTI data analysis | ||
| Dumont Tweezers; Pattern #1 | Roboz Surgical Instrument Co | RS-4960 | 2 needed |
| Dumont Tweezers; Pattern #5, 45 Degree Angle | Roboz Surgical Instrument Co | RS-5058 | 2 needed |
| Ethanol | Fisher Scientific | 64-17-5 | Dilute to 70% |
| ethylene glycol | Thermo Scientific | E178-4 | For model validation |
| Eye Needle, Size #4; 3/8 Circle, Cutting Edge, 11 mm Chord Length | Roboz Surgical Instrument Co | RS-7981-4 | For suturing skin |
| E-Z Anesthesia Classic System | E-Z systems | EZ-7000 | |
| glycerol | Thermo Scientific | AAA16205AP | For model validation |
| Homeothermic Monitoring System | Harvard Bioscience | K 022258 | |
| Imaging system EVOS FL Auto | Life Technologies | AMAFD2000 | For model validation |
| Isoflurane | Covetrus | 11695-6777-2 | |
| Ketoprofen | Zoetis | 5487 | |
| Leica M320 F12 clinic and surgery microscope | Leica | M320 F12 | |
| Lidocaine and Prilocaine Cream, USP 2.5%/2.5% | Padagis | NDC 0574-2042-30 | Generic to EMLA cream |
| lithium carbonate | Thermo Scientific | L119-500 | For model validation |
| Luxol fast blue | Thermo Scientific | AC212170250 | For model validation |
| microscope slides | Fisherbrand | 12-550-403 | For model validation |
| Microtome | Leica | SM2010R | For model validation |
| Morris Water Maze with the hidden platform | Maze Engineers | https://maze.conductscience.com/portfolio/morris-water-maze/ | |
| M-Prove Portable Balance | Sartorius | AY711 | Scales for weiging the mouse |
| MRI with ParaVision 6.0.1 | Bruker | AV3HD 9.4T | For model validation |
| Multi gas flow meter | Aalborg Instruments | GMR2-010334 | for low flow rate gas blending (N2O and O2) |
| Nano Ultra Fine Pen Needles - 32G 4mm | BD | 58320883 | For the right CCA |
| O.C.T. | Thermo Scientific | 23-730-571 | For model validation |
| Paraformaldehyde, 4% | Thermo Scientific | J61899.AK | For model validation |
| PBS | Thermo Scientific | BP399500 | For model validation |
| PeriCam PSI System with Aperiflux probe holder | Perimed Inc | PeriCam PSI HR | For model validation |
| permount | Thermo Scientific | SP15-100 | For model validation |
| Round Handle Forceps; Micro Suturing With Tying Platform; Curved | Roboz Surgical Instrument Co | RS-5264 | To help with cutting and suturing the skin |
| Small Animal Heat Lamp, 75 Watt | Morganville Scientific | HL0100 | For model validation |
| Small cotton-tipped applicators | Fisher Scientific | 23-400-118 | |
| Spring Scissors - 8mm Cutting Edge | Fine Science tools | 15024-10 | |
| Student Halsey Needle Holder | Fine Science tools | 91201-13 | 3 needed: 2 for holding skin retractors and 1 for suturing the skin |
| Sucrose | Thermo Scientific | A15583.36 | For model validation |
| Universal Camera Ceiling Mount | Med Associates, Inc | ENV-598 | For model validation |
| water bath | VWR | 89032-226 | For model validation |
Referenzen
- Tuo, Q. Z., Zou, J. J., Lei, P. Rodent models of vascular cognitive impairment. J Mol Neurosci. 71 (5), 1-12 (2021).
- Zhou, Z., et al. Deeper cerebral hypoperfusion leads to spatial cognitive impairment in mice. Stroke Vasc Neurol. 7 (6), 527-533 (2022).
- Shibata, M., Ohtani, R., Ihara, M., Tomimoto, H. White matter lesions and glial activation in a novel mouse model of chronic cerebral hypoperfusion. Stroke. 35 (11), 2598-2603 (2004).
- Hattori, Y., et al. A novel mouse model of subcortical infarcts with dementia. J Neurosci. 35 (9), 3915-3928 (2015).
- Janson, J., et al. Increased risk of type 2 diabetes in Alzheimer disease. Diabetes. 53 (2), 474-481 (2004).
- Herzig, M. C., et al. Abeta is targeted to the vasculature in a mouse model of hereditary cerebral hemorrhage with amyloidosis. Nat Neurosci. 7 (9), 954-960 (2004).
- Miao, J., et al. Cerebral microvascular amyloid beta protein deposition induces vascular degeneration and neuroinflammation in transgenic mice expressing human vasculotropic mutant amyloid beta precursor protein. Am J Pathol. 167 (2), 505-515 (2005).
- Moechars, D., et al. Early phenotypic changes in transgenic mice that overexpress different mutants of amyloid precursor protein in brain. J Biol Chem. 274 (10), 6483-6492 (1999).
- Wallays, G., et al. Notch3 Arg170Cys knock-in mice display pathologic and clinical features of the neurovascular disorder cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy. Arterioscler Thromb Vasc Biol. 31 (12), 2881-2888 (2011).
- Cognat, E., Cleophax, S., Domenga-Denier, V., Joutel, A. Early white matter changes in CADASIL: evidence of segmental intramyelinic oedema in a pre-clinical mouse model. Acta Neuropathol Commun. 2, 49(2014).
- Weng, Z., et al. A novel needle mouse model of vascular cognitive impairment and dementia. J Neurosci. 43 (44), 7351-7360 (2023).
- Biesbroek, J. M., Biessels, G. J. Diagnosing vascular cognitive impairment: Current challenges and future perspectives. Int J Stroke. 18 (1), 36-43 (2023).
- Winklewski, P. J., et al. Understanding the physiopathology behind axial and radial diffusivity changes-what do we know. Front Neurol. 9, 92(2018).
- Jing, Z., et al. Neuronal NAMPT is released after cerebral ischemia and protects against white matter injury. J Cereb Blood Flow Metab. 34 (10), 1613-1621 (2014).
- Yang, S. T., et al. Adult mouse venous hypertension model: common carotid artery to external jugular vein anastomosis. J Vis Exp. (95), e50472(2015).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387(2013).
- Lee, D., et al. A murine model of ischemic retinal injury induced by transient bilateral common carotid artery occlusion. J Vis Exp. (165), (2020).
- Schleimer, K., et al. Training a sophisticated microsurgical technique: interposition of external jugular vein graft in the common carotid artery in rats. J Vis Exp. (69), e4124(2012).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387(2013).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Wellons, J. C., et al. A comparison of strain-related susceptibility in two murine recovery models of global cerebral ischemia. Brain Res. 868 (1), 14-21 (2000).
- Cao, G., et al. In Vivo delivery of a Bcl-xL fusion protein containing the TAT protein transduction domain protects against ischemic brain injury and neuronal apoptosis. J Neurosci. 22 (13), 5423-5431 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten