Method Article
Identifizierung von EcoHIV-infizierten Zellen in Mikroglia-manipulierten transgenen Mäusen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt, wie die Kombination einer EcoHIV-Infektion mit Tmem119-EGFP-Mäusen ein wertvolles biologisches System für die Untersuchung von Mikrogliaveränderungen und viralen Reservoirs in Nagetiermodellen für HIV-assoziierte neurokognitive Störungen darstellt.
Zusammenfassung
Die kombinierte antiretrovirale Therapie (cART) hat die Lebensqualität von Menschen mit HIV (PLWH) dramatisch verbessert. Über 4 Millionen PLWH sind jedoch über fünfzig Jahre alt und leiden an begleitenden HIV-assoziierten neurokognitiven Störungen (HAND). Um zu verstehen, wie sich HIV auf das zentrale Nervensystem auswirkt, ist ein zuverlässiges und praktikables Modell von HIV erforderlich. Zuvor wurde ein neuartiges biologisches System mit chimärer HIV (EcoHIV)-Impfung in einem Rattenmodell entwickelt, um neurokognitive Beeinträchtigungen und synaptische Dysfunktionen zu untersuchen. Dennoch bleibt eine große Herausforderung bei der Aufklärung der neuroanatomischen Verteilung von EcoHIV, insbesondere seiner unterschiedlichen Expression in verschiedenen Zelltypen im Gehirn. In der aktuellen Studie wurde EcoHIV mit mScarlet-Fluoreszenzmarkierung modifiziert und retroorbital in Tmem119-EGFP-Knock-in-Mäuse injiziert (die ein verstärktes grünes Fluoreszenzprotein hauptsächlich in Mikroglia exprimieren), um festzustellen, ob Mikroglia der Hauptzelltyp sind, der für die Virusexpression und die Reservoire von HIV im Gehirn verantwortlich ist. Die aktuellen Daten zeigen, dass: (1) in vitro EcoHIV-mScarlet-Fluoreszenzsignale überwiegend in Mikroglia-ähnlichen Zellen unter primären Nagetier-Gehirnzellen lokalisiert waren; (2) In vivo induzierte die Injektion von EcoHIV-mScarlet in Tmem119-EGFP-Mäuse eine signifikante HIV-Expression im Gehirn von Mäusen. Die Kolokalisation von mScarlet- und EGFP-Signalen deutet darauf hin, dass Mikroglia der Hauptzelltyp sind, der HIV im Gehirn beherbergt. Insgesamt bietet EcoHIV bei Nagetieren ein wertvolles biologisches System zur Untersuchung von Mikroglia-Veränderungen, viralen Reservoirs im Gehirn und den neurologischen Mechanismen von HIV-assoziierten neurokognitiven Störungen.
Einleitung
Trotz der tiefgreifenden Vorteile, die sich aus der antiretroviralen Therapie ergeben, leiden Menschen mit HIV (PLWH) immer noch unter neurokognitiven Störungen. Um die neuronalen Mechanismen der HIV-assoziierten neurokognitiven Störung (HAND) besser zu verstehen, besteht ein dringender Bedarf an HIV-Modellen, um die spezifische Beteiligung des Zelltyps an NeuroHIV weiter aufzuklären.
Die transgene HIV-1-Ratte, die konstitutiv HIV-1-Virusproteinen ausgesetzt ist, ist ein beliebtes Nagetiermodell, das zur Untersuchung von neurokognitiven Störungen 1,2,3,4 und neuroanatomischen Veränderungen 5,6,7 im Zusammenhang mit HAND verwendet wird. Die funktionelle Deletion der gag- und pol-Domänen verhindert die virale Replikation, wodurch die HIV-1-transgene Ratte nicht infektiös ist 8,9. Kürzlich wurde ein chimäres HIV (EcoHIV)-Infektionsmodell bei Mäusen zunächst von Potash et al.10 berichtet und später auf Ratten ausgeweitet, was für weitere Studien zu HAND- und Substanzgebrauchsstörungen von Vorteil sein könnte11. In diesem neuartigen biologischen System wurde eine systemische HIV-1-Infektion zusammen mit vielen klinischen Merkmalen von HIV-1 beim Menschen beobachtet, einschließlich der Beteiligung von Lymphozyten und Makrophagen, antiviralen Immunreaktionen, Neuroinvasivität und Gehirnentzündungen.
Mikroglia spielen als spezialisierte hirnresidente Makrophagen eine entscheidende Rolle bei der Aufrechterhaltung der Gehirnfunktion und Homöostase. Zur Unterscheidung von Mikroglia von eng verwandten Zelltypen (z.B. Blutmonozyten, perivaskuläre Makrophagen, meningeale Makrophagen) wurde in der aktuellen Studie die Tmem119-EGFP-Knock-in-Mauslinie verwendet. Frühere Studien haben berichtet, dass das Transmembranprotein 119 (Tmem119) ein ausschließlich Mikroglia-spezifisches Expressionsmuster in Nagetier- und menschlichem Hirngewebe aufweist 12,13,14,15. Das EGFP-Signal in Tmem119-EGFP-Knock-in-Mäusen wurde im gesamten Gehirn beobachtet und spezifisch auf Mikrogliazellen lokalisiert.
In der vorliegenden Studie wurden Tmem119-EGFP-Knock-in-Mäuse mit dem EcoHIV-mScarlet-Virus geimpft und Zellen identifiziert, die positiv für EcoHIV im Zentralnervensystem sind. Hier stellen wir ein Protokoll für die EcoHIV-mScarlet-Inokulation in Tmem119-EGFP-Knock-in-Mäusen vor, das ein zuverlässiges Modell für die therapeutische Behandlung von Mikroglia-Veränderungen bei HIV bietet.
Protokoll
Das Animal Care and Use Committee an der University of South Carolina genehmigte alle Tierprotokolle (Federal Assurance Number: D16-00028). Alle Versuche hielten sich strikt an die Richtlinien, die von den National Institutes of Health im Leitfaden für die Pflege und Verwendung von Labortieren festgelegt wurden. Tmem119-EGFP-Knock-in-Mäuse (30 Tage alt, männlich, 23-26 g Körpergewicht) wurden aus einer kommerziellen Quelle gewonnen und in AAALAC-akkreditierten Einrichtungen untergebracht. Alle Tiere wurden in einem 12/12 h Hell-Dunkel-Zyklus mit freiem Zugang zu Futter und Wasser untergebracht. Die Einzelheiten zu den Tieren, Reagenzien und Geräten, die in dieser Studie verwendet wurden, sind in der Materialtabelle aufgeführt.
1. EcoHIV-mScarlet-Verpackung in 293FT-Zellen
- Die 293-FT-Zellen werden in einem mit Gelatine vorbeschichteten 75-cm-2-Kolben inkubiert. Halten Sie das Wachstum der Zellen bei der Transfektion auf 30 % konfluent.
- Führen Sie die Transfektion der Plasmid-DNA (15 μg) von EcoHIV-mScarlet (Ergänzende Datei 1) mit Lipofectamine 3000 (22,5 μl) gemäß den Anweisungen des Herstellers durch (siehe Materialtabelle).
- Kultivieren Sie die Zellen in DMEM-Medium mit 10% FBS-Serum für 3 Tage bei 37 °C.
- Sammeln Sie das bedingte Medium mit der Virussuspension. Bei 500 × g 10 min bei 4 °C zentrifugieren. Übertragen Sie den Überstand mit einer 10-ml-Pipette auf ein steriles 50-ml-Röhrchen.
- Geben Sie eine bestimmte Menge Lenti-x Konzentrator (Verhältnis 1:3) in die Virusmischung (z. B. 8 mL Konzentrator mit 24 mL Virusmischung). Drehen Sie das Rohr vorsichtig fünfmal um.
- Halten Sie das Virus-Lenti-Konzentratorgemisch 2 Tage lang bei 4 °C. Zentrifugieren bei 1.500 × g, 45 min, 4 °C. Entfernen Sie den Überstand vorsichtig so weit wie möglich mit einer Pipette.
- Das Pellet wird mit vorgekühlten 200 μl 100 mM PBS wieder suspendiert. Lagern Sie das Virus bei -80 °C.
HINWEIS: Die Details der EcoHIV-mScarlet-Verpackung in 293FT-Zellen wurden in unserer vorherigen Studiebeschrieben 16. Verwirbeln Sie die Viruslösung nicht und führen Sie keine Luftblasen in die Viruslösung ein.
2. EcoHIV-mScharlach-Infektion in primären Gehirnzellen von Ratten
- Führen Sie die Isolierung der primären Gehirnzellen von Rattenföten (18 Tage) gemäß dem zuvor veröffentlichten Berichtdurch 16.
- Übertragen Sie dissoziierte Zellen auf Poly-L-Lysin-vorbeschichtete 12-Well-Platten mit Glaseinsätzen, die 1 ml DMEM/F12-Medium plus 10 % FBS enthalten. Ersetzen Sie das Medium am nächsten Tag durch das Neurobasalmedium durch das B27-Supplement.
- Kultivieren Sie primäre fetale Gehirnzellen 3 Wochen lang in einem 5% CO2 -Inkubator.
- Geben Sie EcoHIV-mScarlet (60 μL, 1,26 × 106 TU/ml) in das Kulturmedium. Inkubieren Sie die kultivierten Gehirnzellen 6 Tage lang mit EcoHIV-mScarlet.
- Fixieren Sie die Zellen mit 4% PFA und führen Sie eine Immunfärbung an infizierten Gehirnzellen mit spezifischen Primärantikörpern (CD11b/c, Iba1) durch.
- Erfassen Sie Bilder mit einem 40×-Objektiv unter einem konfokalen Mikroskopiesystem.
3. EcoHIV-mScarlet-Virus-Infektion in primären Gliazellen adulter Mäuse
- Betäuben Sie adulte Mäuse 5 Minuten lang mit 5% Sevofluran (gemäß den institutionell anerkannten Protokollen). Sterilisieren Sie die Haut des Kopfes mit 70% EtOH.
- Nachdem Sie sich vergewissert haben, dass die Maus nicht mehr auf schädliche Reize reagiert, verwenden Sie eine sterilisierte, geschärfte Schere, um die Enthauptung durchzuführen. Übertragen Sie den Kopf in eine neue Petrischale, die mit 5 mL HBSS gefüllt ist.
- Öffnen Sie die Kopfhaut und übertragen Sie das Hirngewebe in eine andere Petrischale, die 5 ml sterilisiertes HBSS enthält. Entferne die Hirnhäute und übertrage den frontalen Kortex in 2 mL HBSS.
- 20 μl 0,25 % Trypsin-EDTA in die Mischung geben. 15 Minuten bei Raumtemperatur inkubieren; Schwenken Sie die Tube alle paar Minuten vorsichtig.
- Dissoziierte Zellen werden in einen mit Poly-L-Lysin vorbeschichteten 75-cm-2-Kolben mit 10 ml DMEM/F12-Medium und 10 % FBS überführt.
- Kultivieren Sie Zellen bei 37 °C, 5 % CO2 -Inkubator, bis zu 90 % Konfluenz. Verdauen Sie Gehirnzellen mit 2 ml 0,25% Trypsin-EDTA.
- Subkultur von Gehirnzellen in 35-mm-Glasbodenschalen mit 5 ml DMEM/F12-Wachstumsmedium bis zu einer Konfluenz von 80 %.
- EcoHIV-mScarlet (8 μl, 1,26 × 106 TU/mL) in das Kulturmedium geben. Inkubieren Sie Maus-Gliazellen für 2 Tage.
- Überprüfen Sie die roten (mScarlet) Fluoreszenzsignale täglich unter einem Fluoreszenzmikroskop.
4. Retroorbitale Injektion des EcoHIV-mScarlet-Virus in Tmem119-EGFP-Mäuse
- Verwenden Sie 3 % Sevofluran, um die Tmem119-EGFP-Mäuse (sowohl männliche als auch weibliche Mäuse im Alter von 30 Tagen) zu anästhesieren, bis sie nicht mehr auf schädliche Reize reagieren.
- Sichern Sie die Mäuse in einer seitlichen Position mit dem Injektionsauge nach oben und atmen Sie durch den Nasenkonus, der mit einem Anästhesiesystem verbunden ist. Verwenden Sie eine geeignete Nasenkonusgröße, um eine kontinuierliche Anästhesie zu gewährleisten.
- Tauen Sie das EcoHIV-mScarlet auf Eis auf. Füllen Sie die Viruslösung in eine intraokulare Injektorspritze mit einer stumpfen 33-G-Nadel.
- Platzieren Sie die Maus in der rechten Seitenlage und halten Sie den Kopf nach links. Identifizieren Sie die Lage des medialen Canthus als Injektionsstelle.
- Nach dem Prostosieren des Auges führen Sie langsam und vorsichtig eine Nadel (45-Grad-Winkel) in den medialen Canthus des Auges ein. Führen Sie die Nadel vorsichtig nach vorne in die Gefäße hinter dem Augapfel (Sinus retroorbitalis) ein.
- Injizieren Sie vorsichtig 6,5 μl EcoHIV-mScarlet (1,26 × 106 TU/ml, bilaterale Augeninokulation) in die retroorbitale Sinus. Entfernen Sie vorsichtig die Nadel aus dem retroorbitalen Sinus und üben Sie sanft Druck auf die Augenlider aus, um eine Blutstillung zu gewährleisten.
- Tragen Sie Gleitgel auf das Auge auf, um zu verhindern, dass die Hornhaut austrocknet oder sich verletzt.
- Lassen Sie die Mäuse in einer Aufwachkammer mit einem Heizkissen ruhen, bis sie aufgewacht sind.
HINWEIS: Die Nadelfase sollte nicht zu tief positioniert werden, damit die Arterien nicht reißen oder die Knochen gebrochen werden. Die Infusionszeit des Virus hängt von mehreren Faktoren ab (z. B. Injektionsvolumen, Titer, Tiergröße). Für die EcoHIV-Virusinfusion wurde eine Woche nach retroorbitalen Injektionen eine signifikante Expression beobachtet 11,16,17.
5. Visualisierung von Hirngewebeschnitten
- Betäuben Sie Mäuse tief mit 5% Sevofluran. Fahren Sie mit Schritt 5.2 fort, wenn die Mäuse keine Reaktion auf schädliche Reize zeigen und Reflexe fehlen.
- Halten Sie die Mäuse in Rückenlage in einem chemischen Abzug.
- Öffnen Sie die Haut entlang der thorakalen Mittellinie. Trennen Sie das Zwerchfell und öffnen Sie den Brustkorb mit einer Schere.
- Führen Sie eine 22 G1 1/2 Nadel in die linke Herzkammer ein. Öffnen Sie das rechte Atrium mit einer Schere.
- 50 mL vorgekühltes PBS mit 100 mM perfundieren. 100 mL vorgekühlten 4%igen Paraformaldehyd-Puffer16 perfusieren.
- Entfernen Sie das gesamte Mäusegehirn16.
- Über Nacht mit 4% Paraformaldehyd fixieren.
- Befestigen Sie das Hirngewebe mit Gewebekleber auf der Metallplattform des Vibratome. Schneiden Sie Koronaprofile mit einer Dicke von 50 μm mit Klingen aus Kohlenstoffstahl.
- Legen Sie die Gehirnscheiben mit einem Pinsel auf Objektträger. Geben Sie sofort 0,1 ml des Antifading-Eindeckmediums in jeden Abschnitt.
- Legen Sie ein Deckglas von 22 mm x 50 mm über die Gehirnabschnitte. Trocknen Sie die Superfrost-Dias 1 Tag lang im Dunkeln.
- Konfigurieren Sie das konfokale Mikroskopsystem auf eine Vergrößerung von 60× (A/1,4, Öl) und stellen Sie ein Z-Ebenenintervall von 0,15 μm ein, mit einer Lochblendengröße von 30 μm und einem rückprojizierten Lochblendenradius von 167 nm.
- Verwenden Sie die Wellenlängen 488 nm und 594 nm, um Mehrkanalbilder von Gehirnregionen von Interesse aufzunehmen.
Ergebnisse
Ein Fragment von mScarlet (1858 bp), das Enzymstellen von "Cla1" am 3'-Ende und "Not1" am 5'-Ende enthielt, wurde in den pNL4-3-EcoHIV-lentiviralen Vektor eingefügt (Abbildung 1). Um die Expression von EcoHIV-mScarlet zu validieren, wurden primäre Hirnzellen, die aus der Hirnrinde von Rattenembryonen isoliert wurden, 6 Tage lang in vitro mit EcoHIV-mScarlet (60 μL, 1,26 × 106 TU/ml) behandelt. Die Daten in Abbildung 2 zeigten, dass rot fluoreszierende Signale von mScarlet hauptsächlich in glialen Zelltypen lokalisiert waren, basierend auf der unterschiedlichen Zellmorphologie. Darüber hinaus zeigte die Markierung von CD11b/c und Iba1 (Zellmarker für Mikroglia), dass mScarlet-Signale mit CD11b/c + und/oder Iba1 + Zellen kolokalisiert waren. Die Daten deuteten darauf hin, dass Mikroglia in vitro der Hauptzelltyp der EcoHIV-mScarlet-Verteilung waren. Es gab keine signifikante neuronale Infektion in den kultivierten Zellen (Ergänzende Abbildung 1).
Als nächstes wurde die Infektion von EcoHIV-mScarlet an adulten primären gemischten Gliazellen der Maus getestet. Zu diesem Zweck wurden zunächst gemischte Gliazellen von adulten Mäusen isoliert und gereinigt (2 Monate) und 2 Tage lang mit EcoHIV-mScarlet (8 μL, 1,26 × 106 TU/ml) infiziert. Die Bilder in Abbildung 3 zeigten, dass EcoHIV-mScarlet erfolgreich die Gliazellen adulter Mäuse infizierte.
Um das Verteilungsmuster von EcoHIV-mScarlet im Gehirn von Mäusen weiter zu untersuchen, insbesondere zur Identifizierung des infizierten Zelltyps, wurde EcoHIV-mScarlet retroorbital in eine Tmem119-EGFP-Knock-in-Mauslinie injiziert, in der Mikroglia spezifisch mit EGFP-Signalen markiert wurden, ohne dass andere Makrophagentypen von Konfliktenauftraten 5. Die Ergebnisse in Abbildung 4 (auch in der ergänzenden Abbildung 2) zeigen, dass mScarlet-rote Fluoreszenzsignale in EGFP-positiven Zellen beobachtet wurden, was darauf hindeutet, dass Mikroglia der Hauptzelltyp der EcoHIV-Expression in Mäusegehirnen ist.
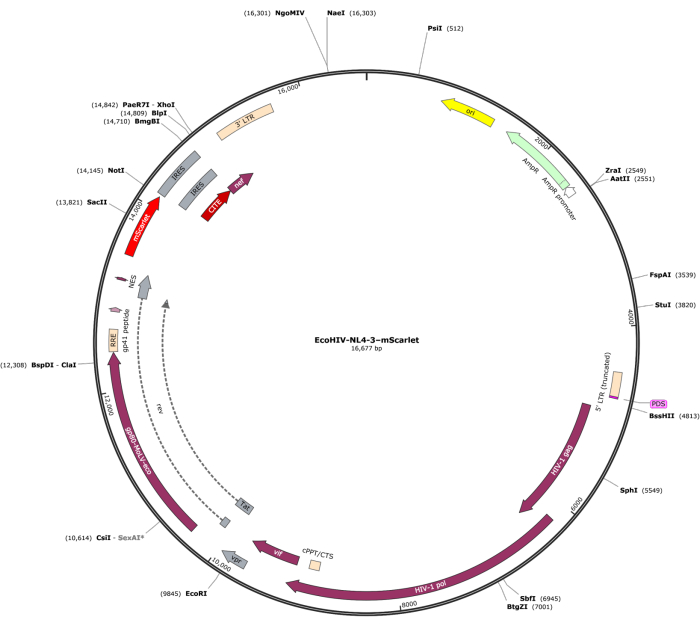
Abbildung 1: Die Vektorkarte von EcoHIV-NL-4-3-mScarlet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
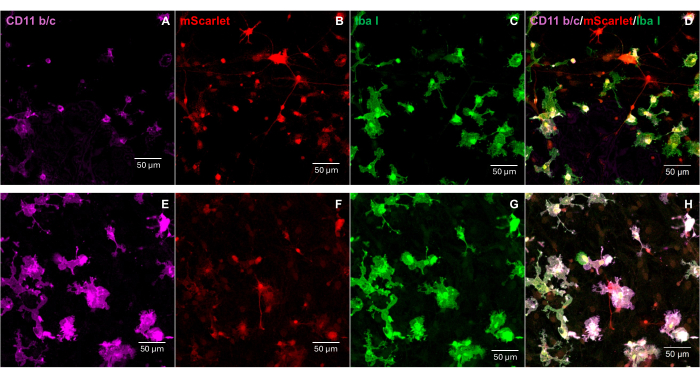
Abbildung 2: Die EcoHIV-mScarlet-Infektion in primären Gehirnzellen von Ratten. (A,E) Repräsentative Bilder der CD11b/c-Färbung an primären Gehirnzellen. Die Gehirnzellen wurden aus E18-Rattenembryonen isoliert und 6 Tage lang mit dem EcoHIV-mScarlet-Virus infiziert. (B,F) Repräsentative Bilder von mScarlet-Fluoreszenzsignalen von in vitro Gehirnzellen. (C,G) Repräsentative Bilder der Iba1-Färbung an primären Gehirnzellen. (D,H) Zusammengeführte Bilder der dreifachen Markierung von CD11b/c, mScarlet und Iba1. Maßstabsstäbe: 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
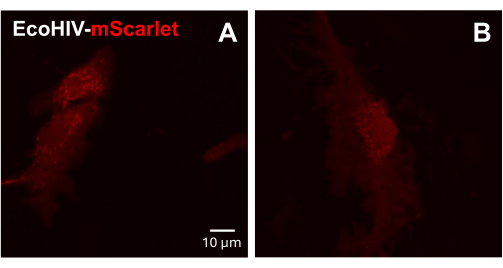
Abbildung 3: EcoHIV-mScarlet-Infektion in primären gemischten Gliazellen der Maus. (A,B) Repräsentative konfokale Bilder der mScarlet-Verteilung in vitro. Die primären gemischten Gliazellen wurden von adulten C57BL6-Mäusen (2 Monate alt) isoliert und vor der Virusinfektion 2 Wochen lang kultiviert. Das EcoHIV-mScarlet wurde für zwei Tage in das Kulturmedium gegeben und die Bilder unter dem 60×-Objektiv des konfokalen Mikroskops aufgenommen. Maßstab: 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
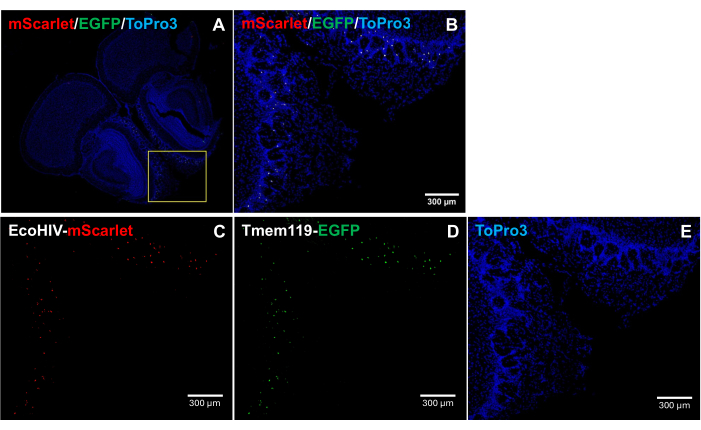
Abbildung 4: EcoHIV-mScarlet-Verteilung in der Knock-in-Mauslinie von Tmem119-EGFP . (A,B) Zusammengeführte Bilder von mScarlet/EGFP/ToPro3-Signalen in Gehirnschnitten. Der gelbe Rahmen zeigt den Zielbereich von (B) an. Maßstabsbalken: 300 μm. (C) Repräsentatives Bild der mScarlet-Verteilung in der äußeren plexiformen Schicht der olfaktorischen Region der Knock-in-Mauslinie Tmem119-EGFP . (D) Repräsentatives Bild der EGFP-Verteilung. Die Fluoreszenzsignale wurden in Mikrogliazellen in der Tmem119-EGFP-Knock-in-Mauslinie lokalisiert. (E) Repräsentatives Bild der TO-PRO-3-Kernfärbung. Maßstabsbalken: 300 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: MAP2- und MOG-Färbung von primären Gehirnzellen der Ratte, die mit dem EcoHIV-mScarlet-Virus infiziert sind. Maßstabsbalken: 50 μm. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Konfokale Bilder der EcoHIV-mScarlet-Infektion in der Knock-in-Mauslinie von Tmem119-EGFP . Maßstabsstäbe: 75 μm. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 1: DNA-Sequenz des EcoHIV-mScarlet-Plasmids. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
In der vorliegenden Studie wurde festgestellt, dass (1) das neuartige EcoHIV-mScarlet primäre Gehirnzellen von Ratten erfolgreich in vitro infizierte; (2) Die dreifache Markierung von mScarlet, CD11b/c und Iba1 identifizierte Mikroglia als den vorherrschenden Zelltyp für diese EcoHIV-Expression in Rattengehirnzellen in vitro; (3) Primäre Maus-Gehirnzellen von Erwachsenen in vitro belegen die EcoHIV-mScarlet-Infektion; (4) Die EcoHIV-mScarlet-Verteilung in der Knock-in-Mauslinie von Tmem119-EGFP zeigte ein Mikroglia-spezifisches Verteilungsmuster der EcoHIV-Infektion.
Neue Studien deuteten darauf hin, dass verschiedene Arten von Gehirnzellen, die im Zentralnervensystem identifiziert wurden (Neuronen, Astrozyten, Mikroglia, Oligodendrozyten usw.), während HIV und HIV-assoziierten neurokognitiven Störungen funktionelle und transkriptomische Veränderungen aufweisen18,19. Zum Beispiel tragen Astrozyten 30 % bis 70 % des Gehirns bei und führen eine Überwachung durch, um die Homöostase des Gehirns aufrechtzuerhalten20. Astrozyten modulieren auch die Immunfunktion und regulieren die Sekretion von Multizytokinen und Chemokinen, insbesondere in der Situation der Gehirnentzündung und Neurodegeneration bei HIV21,22. Die HIV-Infektion von Mikroglia führt nicht nur zu einer kontinuierlichen Freisetzung von viralen Proteinen und proinflammatorischen Zytokinen und Chemokinen, sondern liefert auch vorherrschende Quellen für HIV-Virusreservoire 23,24,25,26. Darüber hinaus tragen aktivierte Mikroglia zu einer kritischen immunologischen Funktion im ZNS bei; Eine verlängerte Aktivierung kann jedoch auch die Neurodegeneration in der HIV-Progression verschlimmern10,27. Oligodendrozyten spielen ebenfalls eine wichtige Funktion, einschließlich der Freisetzung mehrerer Neurotrophine (wie Nervenwachstumsfaktor, vom Gehirn abgeleiteter neurotropher Faktor usw.)28. Eine frühere Studie ergab, dass die Anzahl der Oligodendrozyten im Gehirn von AIDS-Patienten signifikant abnahm, was auf eine direkte Schädigung der Oligodendrozyten durch HIV-Virusproteine hindeuten könnte29. Daher sollte ein spezifischer Typ von zellmanipuliertem Infektionsmodell von HIV grundlegende Mittel zur Identifizierung der unterschiedlichen Funktionen verschiedener Gehirnzellen nach einer Infektion bieten. In der aktuellen Studie wurde ein biologisches System entwickelt, das Merkmale von HIV-1 durch chimäre HIV-Impfung (EcoHIV) nachahmt. Diese HIV-Impfung wurde auch mit der Knock-in-Mauslinie Tmem119-EGFP kombiniert, um ein Mikroglia-manipuliertes Nagetiermodell von HIV zu generieren und zu validieren.
Allerdings müssen die Grenzen der vorliegenden Studie anerkannt werden. Es gab einige Iba1/CD11b/c-negative Zellen, die in vitro mScarlet-Fluoreszenzsignale zeigten. Andere Arten von Gehirnzellen, wie z. B. Makrophagen oder Perizyten, können an einer EcoHIV-Infektion beteiligt sein, oder alternativ kann die Zellkulturumgebung abweichende Infektionsmuster im Vergleich zur In-vivo-Impfung fördern. Zukünftige Ganztierstudien sollten die Funktion von mScarlet+-Mikroglia im Prozess der EcoHIV-Infektion weiter klären und die regionale Verteilung von mScarlet+EcoHIV-Mikroglia im Gehirn weiter definieren. Darüber hinaus können auch neurokognitive Veränderungen, die als Folge von Mikrogliainfektionen auftreten, in diesem Nagetiermodell behandelt werden. Insgesamt bietet die EcoHIV-mScarlet-Inokulation von Tmem119-EGFP-Knock-in-Mäusen ein neuartiges Modell und eine Forschungsstrategie zur Untersuchung der mikroglialgesteuerten Mechanismen von HIV-assoziierten neurokognitiven Störungen.
Offenlegungen
Keiner der Autoren hat Interessenkonflikte zu deklarieren.
Danksagungen
Diese Arbeit wurde durch NIH-Zuschüsse DA059310, DA058586, AG082539 und GM109091 finanziert. Wir danken für die großzügige Spende des EcoHIV-NL4-3-EGFP von Dr. Potash von der Icahn School of Medicine am Mount Sinai.
Materialien
| Name | Company | Catalog Number | Comments |
| 293FT cells | ThermoFisher Scientific | R70007 | |
| 33 G, Small Hub RN Needle, (Point Style: 3, Needle Length: 19.25 mm) | Hamilton | 7803-05 | |
| Antibiotic-Antimycotic solution | Cellgro | 30004CI | 100x |
| C57BL/6-Tmem119em2Gfng/J | The Jackson Laboratory | Strain #:031823 | |
| Corning BioCoat Gelatin 75cm² Rectangular Canted Neck Cell Culture Flask with Vented Cap | Life Technologies | 354488 | |
| Corning DMEM with L-Glutamine, 4.5 g/L Glucose and Sodium Pyruvate | Life Technologies | 10013CV | |
| Cover glass | VWR | 637-137 | |
| Dumont #5 Forceps | World Precision Instruments | 14095 | |
| Dumont #7 Forceps | World Precision Instruments | 14097 | |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | 12362 | |
| Eppendorf Snap-Cap Microcentrifuge Biopur Safe-Lock Tubes | Life Technologies | 22600028 | |
| Feather Double Edge Carbon Steel Blades | Ted Pella, inc. | 121-9 | |
| Fisher BioReagents Microbiology Media: LB Broth, Miller | Fisher Scientific | BP1426-500 | |
| Human recombinant anti-CD11b antibody | Miltenyi Biotec | 130-120-214 | 1:50 dilution |
| Intraocular Injector Syringe (6.5 µL), Removable Needle | Hamilton | 6609071-01 | |
| Invitrogen Lipofectamine 3000 Transfection Reagent | Life Technologies | L3000015 | |
| Invitrogen One Shot TOP10 Electrocomp E. coli | Fisher Scientific | C404052 | |
| Iris Forceps | World Precision Instruments | 15914 | |
| Iris Scissors | World Precision Instruments | 500216 | |
| Lentivirus-Associated p24 ELISA Kit | Cell Biolabs, inc. | VPK-107-5 | |
| Lenti-X Concentrator | Takara | PT4421-2 | |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 11058021 | |
| Paraformaldehyde | Sigma-Aldrich | 158127-500G | |
| Paraformaldehyde | Sigma | P6148 | |
| PELCO easiSlicer Vibratory Tissue Slicer | Ted Pella, inc. | 11000 | |
| PELCO Pro CA44 Tissue Adhesive | Ted Pella, inc. | 10033 | |
| PELCO Pro Specimen Retrievers | Ted Pella, inc. | 101-33 | |
| ProLong Gold | Fisher Scientific | P36930 | |
| Rabbit monoclonal anti-Iba1 antibody | Abcam | ab178847 | 1:500 dilution |
| RN Compression Fitting 1 mm | Hamilton | 55750-01 | |
| Sevoflurane | Merritt Veterinary Supply | 347075 | |
| Sprague Dawley pregnant rat | Inotiv | ||
| SuperFrost Plus Slides | Fisher Scientific | 12-550-154% | |
| To-Pro-3 | ThermoFisher Scientific | T3605 | Nucleus staining kit |
| Trypsin-EDTA (0.25%), phenol red | ThermoFisher Scientific | 25200-056 | |
| Vannas Scissors | World Precision Instruments | 500086 |
Referenzen
- Vigorito, M., Lashomb, A. L., Chang, S. L. Spatial learning and memory in HIV-1 transgenic rats. J Neuroimmune Pharmacol. 2, 319-328 (2007).
- Moran, L. M., Booze, R. M., Mactutus, C. F. Time and time again: Temporal processing demands implicate perceptual and gating deficits in the HIV-1 transgenic rat. J. Neuroimmune Pharmacol. 8 (4), 988-997 (2013).
- Repunte-Canonigo,, et al. Gene expression changes consistent with neuroAIDS and impaired working memory in HIV-1 transgenic rats. Mol Neurodegener. 9, 26(2014).
- Reid, W., et al. An HIV-1 transgenic rat that develops HIV-related pathology and immunologic dysfunction. Proc Natl Acad Sci USA. 98 (16), 9271-9276 (2001).
- McLaurin, K. A., Li, H., Booze, R. M., Mactutus, C. F. Disruption of timing: NeuroHIV progression in the post-cART era. Sci Rep. 9, 827(2019).
- Roscoe, R. F., Mactutus, C. F., Booze, R. M. HIV-1 transgenic female rat: Synaptodendritic alterations of medium spiny neurons in the nucleus accumbens. J Neuroimmune Pharmacol. 9 (5), 642-653 (2014).
- Denton, A. R., et al. Selective monoaminergic and histaminergic circuit dysregulation following long-term HIV-1 protein exposure. J NeuroVirol. 25 (4), 540-550 (2019).
- Peng, J., et al. The HIV-1 transgenic rat as a model for HIV-1 infected individuals on HAART. J Neuroimmunol. 218 (1-2), 94-101 (2010).
- Abbondanzo, S. J., Chang, S. L. HIV-1 transgenic rats display alterations in immunophenotype and cellular responses associated with aging. PLoS ONE. 9, e105256(2014).
- Potash, M. J., et al. A mouse model for study of systemic HIV-1 infection, antiviral immune responses, and neuroinvasiveness. Proc Natl Acad Sci USA. 102 (10), 3760-3765 (2005).
- Li, H., McLaurin, K. A., Illenberger, J. M., Mactutus, C. F., Booze, R. M. Microglial HIV-1 expression: Role in HIV-1 associated neurocognitive disorders. Viruses. 13 (5), 924(2021).
- Kaiser, T., Feng, G. Tmem119-EGFP and Tmem119-CreERT2 transgenic mice for labeling and manipulating microglia. eNeuro. 6 (4), (2019).
- Bennett, M. L., et al. New tools for studying microglia in the mouse and human CNS. Proc Natl Acad Sci. USA. 113 (12), E1738-E1746 (2016).
- Satoh, J., et al. TMEM119 marks a subset of microglia in the human brain. Neuropathology. 36 (1), 39-49 (2016).
- Li, H., Aksenova, M., Bertrand, S. J., Mactutus, C. F., Booze, R. M. Quantification of filamentous actin (F-actin) puncta in rat cortical neurons. J Vis Exp. (108), e53697(2016).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. A rat model of EcoHIV brain infection. J Vis Exp. (167), e62137(2021).
- Alfar, H. R., et al. Protocol for optimizing production and quality control of infective EcoHIV virions. STAR Protoc. 4 (3), 102368(2023).
- Malatesta, P., Hartfuss, E., Götz, M. Isolation of radial glial cells by fluorescent-activated cell sorting reveals a neuronal lineage. Development. 127 (24), 5253-5263 (2000).
- Parpura, V., et al. Glutamate-mediated astrocyte-neuron signaling. Nature. 369 (6483), 744-747 (1994).
- Wahl, A., Al-Harthi, L. HIV infection of non-classical cells in the brain. Retrovirology. 20 (1), 1(2023).
- Pandey, H. S., Seth, P. Friends turn foe-astrocytes contribute to neuronal damage in NeuroAIDS. J. Mol. Neurosci. 69 (2), 286-297 (2019).
- Minagar, A., et al. The role of macrophage/microglia and astrocytes in the pathogenesis of three neurologic disorders: HIV-associated dementia, Alzheimer's disease, and multiple sclerosis. J Neurol Sci. 202 (1-2), 13-23 (2002).
- Borrajo, A., Spuch, C., Penedo, M. A., Olivares, J. M., Agís-Balboa, R. C. Important role of microglia in HIV-1 associated neurocognitive disorders and the molecular pathways implicated in its pathogenesis. Ann Med. 53 (1), 43-69 (2021).
- González-Scarano, F., Martín-García, J. The neuropathogenesis of AIDS. Nat Rev Immunol. 5 (1), 69-81 (2005).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. Microglia proliferation underlies synaptic dysfunction in the prefrontal cortex: Implications for the pathogenesis of HIV-1-associated neurocognitive and affective alterations. J. Neurovirol. 29 (4), 460-471 (2023).
- Kim, B. H., et al. EcoHIV infection of primary murine brain cell cultures to model HIV replication and neuropathogenesis. Viruses. 16 (5), 693(2024).
- Réu, P., et al. The lifespan and turnover of microglia in the human brain. Cell Rep. 20 (4), 779-784 (2017).
- Jones, J. D. Potential of glial cell modulators in the management of substance use disorders. CNS Drugs. 34 (7), 697-722 (2020).
- Kaalund, S. S., Johansen, A., Fabricius, K., Pakkenberg, B. Untreated patients dying with aids have loss of neocortical neurons and glial cells. Front Neurosci. 13, 1398(2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten