Galleria mellonella als antimikrobielles Screening-Modell
In diesem Artikel
Zusammenfassung
In dieser Studie wird ein standardisierter Rahmen zur Optimierung von G. mellonella-Infektionsmodellen für die präklinische antimikrobielle Bewertung vorgestellt. Die Anwendung eines G. mellonella-Modells als Teil einer präklinischen antimikrobiellen Entwicklungspipeline könnte die Anzahl unwirksamer Wirkstoffe, die in klinische Studien übergehen, verringern.
Zusammenfassung
Um das weltweit zunehmende Problem der Antibiotikaresistenz zu bekämpfen, ist die beschleunigte Entwicklung neuartiger Antibiotika unerlässlich. Die derzeitige präklinische Entwicklung antimikrobieller Wirkstoffe führt zu einer beträchtlichen Anzahl von Leitstrukturen, die sich entweder vor oder während klinischer Studien als ungeeignet erweisen. Um die Effizienz der präklinischen Entwicklung zu steigern, müssen relevante, standardisierte, zugängliche und kostengünstige Modelle entwickelt werden. Larven von Galleria mellonella (Große Wachsmotte) werden häufig als Infektionsmodell verwendet, um die mikrobielle Virulenz zu bewerten, Toxizitätstests für Arzneimittel durchzuführen und als vorläufiges Mittel zur Bewertung der In-vivo-Wirksamkeit neuartiger antimikrobieller Verbindungen zu dienen. Diese Infektionsmodelle haben eine größere biologische Relevanz als viele In-vitro-Screens mit vergleichbarem Durchsatz und verringern die Abhängigkeit von Säugetiermodellen, wenn sie als Vorscreening für antimikrobielle Tests verwendet werden. Dieses Protokoll beschreibt eine standardisierte Methodik zur Optimierung von G. mellonella-Infektionsmodellen , die auf Bakterienspezies und antimikrobielle Therapeutika der Wahl angewendet werden kann. Am Beispiel des WHO-prioritären Erregers Pseudomonas aeruginosa skizzieren wir Schritte, die unternommen werden können, um ein reproduzierbares Modell für Infektions- und Therapietests zu entwickeln. Dazu gehören Empfehlungen zum Versuchsaufbau, zur Probenvorbereitung sowie zu Infektions- und Behandlungsprotokollen. Die Integration dieses Modells in die präklinische Entwicklung antimikrobieller Wirkstoffe würde die Abhängigkeit von Säugetiermodellen verringern, die Anzahl unwirksamer Wirkstoffe in klinischen Studien verringern und letztendlich die Effizienz der präklinischen Entwicklung antimikrobieller Wirkstoffe erhöhen.
Einleitung
Larven der Galleria mellonella (der Großen Wachsmotte) werden in den Biowissenschaften in großem Umfang als Infektionsmodelle für mikrobielle Spezies und für Toxizitätstests neuartiger Wirkstoffe verwendet 1,2. Sie haben das Potenzial für einen erheblichen Nutzen in einer präklinischen antimikrobiellen Testpipeline, da sie einen hohen Durchsatz aufweisen, integrale In-vivo-Eigenschaften menschlicher Infektionen replizieren und die Abhängigkeit von Säugetiermodellen verringern, im Einklang mit den Prinzipien der Reduktion, Verfeinerung und Ersetzung, die für die ethische Verwendung von Säugetierarten in der Forschung gelten.
Die Entwicklung neuer Antibiotika erfordert vor der klinischen Validierung umfangreiche präklinische Tests in vitro und in vivo-Modellen 3. Nur wenige neuartige Wirkstoffe mit vielversprechenden präklinischen Datenpaketen werden jemals in die Klinik gebracht, und ein Grund für diese hohe Fluktuationsrate ist das Versagen der präklinischen Screenings, die Komplexität des Infektionsumfelds zu erfassen4. Diese Probleme tragen nicht nur zu einer geringen Translationsrate von antimikrobiellen Wirkstoffen in die Klinik bei, sondern auch zu einem verstärkten Einsatz von Versuchstieren im präklinischen Spätstadium. Um die präklinische Bewertung neuartiger antimikrobieller Wirkstoffe zu verbessern und den Einsatz von teuren, zeitaufwändigen, komplexen und ethisch problematischen Maus-In-vivo-Modellen zu reduzieren, sind bessere Instrumente für das Wirkstoffscreening in der Frühphase erforderlich, die die Anzahl der vielversprechenden Wirkstoffe reduzieren, die in Wirbeltiersystemen getestet werden.
G. mellonella hat einen kurzen Lebenszyklus von 8 Wochen, der sich aus vier Lebensstadien zusammensetzt: Ei, Larven, Puppen und adulte Tiere, von denen die Larvenform in diesem Protokoll verwendet wird1. G. mellonella sind während eines Versuchs leicht zu pflegen, ohne dass spezielle Geräte oder eine spezielle Tierforschungseinrichtung erforderlich sind. Es ist nicht erforderlich, eine ethische Genehmigung für ihre Verwendung einzuholen, und Forscher können den Organismus intern züchten, um die experimentelle Qualität zu verbessern 2,5,6,7. Das Immunsystem von G. mellonella ähnelt stark dem des angeborenen Immunsystems von Säugetieren, mit der Fähigkeit, auf "Selbst"- und "Nicht-Selbst"-Reize zu reagieren8. Hämozyten sind für die pathogen-assoziierte molekulare Mustererkennung und die anschließende Phagozytose verantwortlich und spielen dabei eine funktionell analoge Rolle zu der von Neutrophilen beim Menschen9. G. mellonella kodiert für drei Arten von Toll-like-Rezeptoren, die durch Sequenzhomologie zum Menschen identifiziert wurden, und produziert komplementähnliche Proteine, die nach der Aktivierung und Polymerisation von Phenoloxidase zu Melanin10 fremdes Material erkennen und lokalisierte Melanisierungskomplexe bilden. Dies kann als visuelles Auslesen der Gesundheit der Larven während Infektionsexperimenten dienen, da die Kutikula durch Melanisierung verdunkelt wird. Es ist jedoch zu beachten, dass sich die Melanisierungsachse bei Insekten, an der Phenoloxidase beteiligt ist, wesentlich von der Tyrosinase-Melanin-Achse bei Säugetieren unterscheidet11,12. Darüber hinaus produziert G. mellonella 18 induzierbare antimikrobielle Peptide, darunter Lysozym- und Defensin-Homologen13. Diese Ähnlichkeit, sowie die unkomplizierten Verfahren zur Pflege der Larven und der hohe Durchsatz des Modells, haben G. mellonella zu einem weit verbreiteten Organismus bei der Bewertung neuartiger Medikamente gemacht. In der präklinischen Antibiotikaentwicklung hat G. mellonella im Vergleich zu In-vitro-Modellen einen höheren Nutzen, da sie Wirt-Erreger-Arzneimittel-Wechselwirkungen in einer komplexen Umgebung mit aktiver Immunität genauer modellieren können.
Derzeit gibt es in Europa keinen standardisierten Lieferanten für G. mellonella in Forschungsqualität. Stattdessen müssen die Forscher G. mellonella-Larven in Ködergeschäften kaufen oder ihre eigene Kolonie pflegen. Obwohl Methoden zur Erhaltung einer hauseigenen G. mellonella-Kolonie beschrieben wurden und die experimentelle Konsistenz erhöhen können 5,6,7, ist diese Option wahrscheinlich nur für diejenigen attraktiv, die die Larven häufig verwenden. Daher konzentriert sich dieses Protokoll auf den Versuchsaufbau nach dem Kauf von Larven von einem Lebendköderlieferanten. Diese Methode ist zwar leichter zugänglich, erhöht aber die experimentelle Komplexität und kann aufgrund von Inkonsistenzen in der Gesundheit der Larven zu dem Zeitpunkt, an dem sie von Lieferanten erhalten werden, zu zusätzlicher Variabilität in die Assays führen. Damit Wissenschaft, Industrie und Aufsichtsbehörden G. mellonella-Tests als Teil einer präklinischen antimikrobiellen Entwicklungspipeline akzeptieren und übernehmen können, ist ein standardisiertes System zur Optimierung und Bewertung der antimikrobiellen Wirksamkeit erforderlich.
Diese Studie optimiert das experimentelle Design eines G. mellonella-Infektionsmodells für die Antibiotikaentwicklung. Während G. mellonella-Infektionsmodelle beschrieben wurden14,15, dokumentiert die vorliegende Methodik zusätzliche Schritte zur Milderung der zusätzlichen Komplexität, die durch die Inkonsistenz der Versorgung verursacht wird, und bietet einen Rahmen für die Bewertung neuartiger antimikrobieller Wirkstoffe. Als Testfall wurde G. mellonella mit dem WHO-Prioritätserreger Pseudomonas aeruginosa infiziert und die Behandlung mit einem Aminoglykosid-Wirkstoff (Tobramycin) optimiert. Dieser Rahmen, der in Abbildung 1 dargestellt ist, bildet die Grundlage für zukünftige präklinische antimikrobielle Screening-Studien mit neuartigen Wirkstoffen.
Protokoll
In dieser Studie wurden Larven von Galleria mellonella (Große Wachsmotte) als Modell für Antibiotika-Empfindlichkeitstests und akute Toxizitätsstudien ausgewählt. Für die experimentelle Verwendung von Galleria mellonella ist keine ethische Genehmigung erforderlich. Die Einzelheiten zu den verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Versuchsplanung
- Bestimmen Sie die geeigneten Gruppengrößen der Galleria mellonella-Larven basierend auf der proportionalen Veränderung des Larvenüberlebens, die die Studie erfassen soll. Tabelle 1 zeigt die Gruppengrößen, die erforderlich sind, um spezifische prozentuale Veränderungen des Überlebens unter Verwendung eines Infektionsmodells des Pseudomonas aeruginosa-Stammes PAO1 zu erkennen.
HINWEIS: Bei Verwendung eines neuartigen Erregers ist zunächst die Variabilität des proportionalen Überlebens infizierter, aber unbehandelter Larven zwischen den Assays zu bestimmen, da dies die Bestimmung der Probengröße beeinflusst.- Es gibt zwei Gruppen von PBS-Kontrollen: eine, die vor dem Rest der Infektionen injiziert wird, um sicherzustellen, dass die Spritze scharf und gebrauchstauglich ist, und eine andere, die während oder nach bakteriellen Infektionen injiziert wird, um eine ordnungsgemäße Sterilisation zwischen den Infektionsgruppen zu gewährleisten. Wenn Sie mit einem neuen Erreger optimieren, sollten Sie eine wärmebehandelte Kontrolle einbauen, um sicherzustellen, dass der Tod nicht das Ergebnis einer Immunantwort auf Fremdpartikel ist.
HINWEIS: Insulinspritzen können für Injektionen verwendet werden, um das Risiko von Abstumpfung und Kontamination zu verringern. In Experimenten können jedoch routinemäßig Hunderte von G. mellonella verwendet werden, was den Einsatz von Insulinspritzen kostspielig und verschwenderisch macht. - Für Studien zur Optimierung der antibakteriellen Behandlung sind zwei zusätzliche Kontrollen einzubeziehen: eine Gruppe, die mit Bakterien infiziert und dann mit einer Vehikel-Scheinbehandlung injiziert wurde, und eine Gruppe, die zweimal mit dem Vehikel injiziert wurde, einmal zum Zeitpunkt der Infektion für die anderen Erkrankungen und einmal zum Zeitpunkt der Behandlung.
HINWEIS: Ersteres ist eine unbehandelte Kontrolle, während letzteres auf Traumata abzielt, die durch die Injektionen verursacht wurden. Ein solches Trauma ist wahrscheinlicher, wenn stumpfe Nadeln verwendet werden.
- Es gibt zwei Gruppen von PBS-Kontrollen: eine, die vor dem Rest der Infektionen injiziert wird, um sicherzustellen, dass die Spritze scharf und gebrauchstauglich ist, und eine andere, die während oder nach bakteriellen Infektionen injiziert wird, um eine ordnungsgemäße Sterilisation zwischen den Infektionsgruppen zu gewährleisten. Wenn Sie mit einem neuen Erreger optimieren, sollten Sie eine wärmebehandelte Kontrolle einbauen, um sicherzustellen, dass der Tod nicht das Ergebnis einer Immunantwort auf Fremdpartikel ist.
- Bestellen Sie G. mellonella bei einem Lebendköderlieferanten oder halten Sie eine Kolonie von G. mellonella wie zuvor beschrieben 5,6,7. Bestellen Sie bei dem in der Materialtabelle aufgeführten Lieferanten das 1,8-fache der geplanten Anzahl an Larven, da ca. 33 % aufgrund der Größe ausgeschlossen werden und weitere 10 % nach der Sterilisation der Nagelhaut absterben können.
- Bestimmen Sie die Gewichtsvariabilität von G. mellonella vor der experimentellen Verwendung und stellen Sie sicher, dass der Gewichtsbereich eine Standardabweichung des Mittelwerts nicht überschreitet.
HINWEIS: Bei Lieferanten, die nicht in der Materialtabelle aufgeführt sind, veranlassen Sie, dass der Lieferant neue Lagerbestände bereitstellt.
- Bestimmen Sie die Gewichtsvariabilität von G. mellonella vor der experimentellen Verwendung und stellen Sie sicher, dass der Gewichtsbereich eine Standardabweichung des Mittelwerts nicht überschreitet.
- Lagern Sie G. mellonella nach Erhalt bei Raumtemperatur, um die Wahrscheinlichkeit einer Cocoonbildung zu begrenzen, die nach der Inkubation bei 37 °C auftritt.
HINWEIS: Nicht alle Larven von kommerziellen Anbietern bilden Kokons, die bisher als Indikator für die Gesundheit der Larven verwendet wurden16. - Verwenden Sie die Larven innerhalb von 1 Woche nach Erhalt, in diesem Fall müssen sie nicht gefüttert werden.
HINWEIS: Obwohl das Lebensstadium der Larven zwischen den Chargen variiert, werden die meisten Larven während des letzten Stadiums vor der Verpuppung abgegeben. In diesem Stadium nimmt die Fütterung im Vergleich zu früheren Stadien auf natürliche Weise ab17.
2. Sterilisation und Selektion von G. mellonella-Larven
- Wiegen Sie Galleria mellonella-Larven und entsorgen Sie alle, die außerhalb des Bereichs von 224 mg ± 49,2 mg liegen, was dem Durchschnittsgewicht der Larven plus oder minus einer Standardabweichung entspricht. Dies führt zum Ausschluss von etwa 33 % der Larven.
HINWEIS: Gewichtsunterschiede können je nach Anbieter unterschiedlich sein. Für Lieferanten, die nicht in diesem Protokoll aufgeführt sind, berechnen Sie einen angemessenen Gewichtsbereich. - Führen Sie die folgenden Schritte unter aseptischen Bedingungen durch.
- Sprühen Sie 70% Ethanol in eine Petrischale, so dass genügend Ethanol den Boden der Schale bedeckt.
- Sterilisieren Sie die Oberfläche von G. mellonella in Chargen von 10-20 Larven.
- Geben Sie jede Charge einzeln in die Schale und besprühen Sie die Larven zweimal mit 70% Ethanol.
- Verwenden Sie eine Pinzette, um die Larven zu rollen, um eine vollständige Abdeckung zu gewährleisten.
- Entfernen Sie die Larven aus dem Ethanol und legen Sie sie in eine sterile Petrischale. Lassen Sie die Schale unbedeckt, damit die Larven trocknen können.
ACHTUNG: Wenn G. mellonella länger als 15 s im Ethanol verbleibt, führt dies zu einer hohen Mortalität.
- Sobald etwa 90 % der Larven nach 2 Stunden wieder aktiv sind, werden die wiedergefundenen Larven in Gruppen von einer Größe aufgeteilt, die einen ausreichenden Nachweis von Überlebensveränderungen gemäß den in Tabelle 1 aufgeführten Leistungsberechnungen ermöglicht.
- Verwenden Sie G. mellonella innerhalb von 6 Stunden nach der Sterilisation.
3. Optimierung der bakteriellen Inokulumdichte
- Bereiten Sie vor der Infektion einen bakteriellen Infektionsbestand einer bekannten KBE/ml vor. Die Methoden zur Erzeugung von Vorräten variieren je nach Organismus. Hier wurde Pseudomonas aeruginosa in Nährbrühe bis zur mittleren logarithmischen Phase gezüchtet, aliquotiert und bei einer Dichte von 6 x 107 KBE/ml eingefroren.
- Der Infektionsfond wird durch Zentrifugieren bei 10.000 x g bei Raumtemperatur für 5 min pelletiert und in PBS resuspendiert. Verdünnen Sie den Bakterienstamm seriell um das Zehnfache, um einen Bereich von Inokulumdosen von 101 bis 7 KBE pro Larve zu erzeugen, wobei zu berücksichtigen ist, dass jeder Larve 10 μl Inokulum injiziert wird.
HINWEIS: Der spezifische Inokulum-Dosisbereich unterscheidet sich je nach bakterieller Virulenz, aber der hier vorgeschlagene Bereich sollte für die meisten pathogenen Spezies geeignet sein. Die Bestimmung der In-vitro-Wachstumsrate kann bei der Auswahl eines geeigneten Dosisbereichs hilfreich sein, da die stammspezifische Wachstumsrate in Flüssigkulturen mit der Larvensterblichkeit korreliert. - Bevor Sie mit Infektionen beginnen, zählen Sie das Inokulum mit einer seriellen Verdünnung nach Miles und Misra auf, um die Inokulumdichte18 genau zu bestimmen.
- Bereiten Sie drei 1-ml-Mikrofugenröhrchen vor, die entweder steriles dH2O, 70 % Ethanol oder steriles PBS enthalten. Diese werden kontinuierlich zur Sterilisation der Spritze verwendet, mit der die Larven injiziert werden.
- Untersuchen Sie eine sterile 100-μl-Hamilton-Spritze und stellen Sie sicher, dass die Nadelspitze scharf ist und keinen Haken gebildet hat, der die Infektionsstelle erheblich traumatisieren kann.
ACHTUNG: Eine Hamilton-Spritzennadelspitze beginnt sich nach etwa 300 Infektionen zu verziehen. Wenn sich die Nadelspitze verzogen hat, muss sie ausgetauscht werden. - Waschen Sie die Spritze vor Infektionen nacheinander mit dH2O, Ethanol und PBS, wobei Sie das maximale Fassungsvermögen der Spritze ermitteln und verwerfen.
- Das resuspendierte Infektionsinokulum wird vortext und maximal 100 μl in die Hamilton-Spritze aufgezogen, was ausreicht, um 10 μl pro Larve zu injizieren.
- Injizieren Sie jeder Larve 10 μl Inokulum in den hinteren rechten Vorraum. Stellen Sie sicher, dass die Nadel ca. 2 mm in den Körper eindringt.
HINWEIS: Es können verschiedene Infektionsmethoden verwendet werden. Dazu gehören das Halten der Larve über eine Pipettenspitze, um die Prolegs freizulegen, das statische Sichern der Spritze und das Positionieren des G. mellonella mit der Hand oder das Freihändige Injizieren. - Sterilisieren Sie die Spritze zwischen den einzelnen Infektionen wie in Schritt 2.5 beschrieben, um eine Kontamination durch Hautreste zu verhindern.
- Die infizierten Larven werden bei einer für das mikrobielles Wachstum ausreichenden Temperatur zwischen 20 °C und 42 °C inkubiert, was ein geeigneter Bereich für das Überleben von G. mellonella ist 5.
- Überwachen Sie das Überleben von G. mellonella in regelmäßigen Abständen ab dem Zeitpunkt, zu dem die Mortalität in der Regel zum ersten Mal beobachtet wird, um den Zeitpunkt des Todes genau zu messen. Dies muss in einer ersten Maske beurteilt werden. Entfernen Sie alle toten Larven und notieren Sie deren Todeszeitpunkt.
- Wählen Sie die optimale Infektionsdosis für eine therapeutische Teststudie auf der Grundlage der Dosis, die eine Mortalität von 50 % nach 18 Stunden und über 80 % nach 72 Stunden ergibt. Dies ermöglicht die Entwicklung eines schnellen eintägigen Screenings bei gleichzeitiger Gewährleistung einer ausreichenden Virulenz und eines angemessenen therapeutischen Fensters.
4. Toxizitätsprüfung neuartiger antimikrobieller Wirkstoffe an nicht infizierten Larven
- Bewertung der Toxizität neuartiger antimikrobieller Wirkstoffe und ausgewählter Vehikel in Galleria mellonella vor ihrer Verwendung mit experimentell infizierten Larven. Bereiten Sie eine breite Palette von Dosen vor, die über den erwarteten therapeutischen Bereich des antimikrobiellen Wirkstoffs hinausgehen, und orientieren Sie sich dabei an In-vitro-Toxizitätsdaten (z. B. Zelllinien), falls verfügbar.
- Beachten Sie, dass den Larven 10 μl des Therapeutikums injiziert werden. Bereiten Sie reine Vehikel-Kontrollen in Konzentrationen vor, die denen entsprechen, in denen das Therapeutikum verabreicht wird.
- Injizieren Sie gesunde, sterile G. mellonella in geeigneten Gruppengrößen mit den unterschiedlichen antimikrobiellen und PBS-Vehikelkonzentrationen, wie in den Schritten 3.2 bis 3.10 beschrieben. In der vorliegenden Studie war das verwendete antimikrobielle Mittel Tobramycin.
HINWEIS: Für Mittel, die DMSO als Lösungsmittel benötigen, injizieren Sie mit einer 26s-Nadel anstelle der Standardnadel mit 22 Gauge, da ein Trauma durch größere Nadeln die Mortalität bei der Verwendung von DMSO erhöht. - Definieren Sie eine sichere Dosis als eine Dosis, die keinen signifikanten Unterschied in der Mortalität im Vergleich zu Larven hervorruft, die nur mit PBS injiziert wurden.
5. Optimierung der Behandlung von bakteriellen G. mellonella-Infektionen mit einem antimikrobiellen Wirkstoff
- Bereiten Sie eine Reihe von Dosen des antimikrobiellen Mittels vor, wobei zu berücksichtigen ist, dass infizierte Larven mit einer Dosis von 10 μl behandelt werden. Verwenden Sie eine Reihe von Dosen mit minimaler Toxizität, wie in Schritt 4 bewertet.
- Befolgen Sie die Schritte 1 und 2 dieses Protokolls, um Galleria mellonella in geeigneten Gruppen mit der zuvor optimierten Infektionsdosis vorzubereiten und zu infizieren.
- 2 Stunden nach der Infektion sind die Larven mit dem vorbereiteten antimikrobiellen Mittel oder der Vehikelkontrolllösung zu behandeln. Befolgen Sie die Schritte 3.2-3.8 und injizieren Sie in das entgegengesetzte Bein des während der Infektion injizierten. Sterilisieren Sie die Nadel zwischen den Gruppen.
HINWEIS: Für diese Optimierung wurde eine Behandlung nach 2 h gewählt, um aussagekräftige Dosis-Wirkungs-Daten zu erhalten, aus denen eine anschließende Optimierung des Behandlungszeitpunkts bestimmt wurde19. - Überwachen Sie das Überleben von G. mellonella in Abständen von 30 Minuten oder häufiger ab dem Zeitpunkt, zu dem die Mortalität normalerweise zum ersten Mal beobachtet wird. Entfernen Sie alle toten Larven und notieren Sie deren Todeszeitpunkt.
- Berechnen Sie die Veränderung der Überlebensanteile zwischen den Behandlungsgruppen. Verwenden Sie die Kaplan-Meier-Überlebensanalyse, um festzustellen, ob die Behandlung zu einer signifikant veränderten Larvensterblichkeit führt. Fügen Sie eine geeignete Post-hoc-Korrektur für paarweise Multiplizität in Multigruppenanalysen hinzu.
6. Optimierung des Behandlungszeitpunkts für infizierte G. mellonella
- Befolgen Sie die Schritte 1 und 2, um Galleria mellonella in geeigneten Gruppen mit der zuvor optimierten Infektionsdosis zuzubereiten.
- Bereiten Sie das antimikrobielle Mittel in der zuvor in Schritt 4 optimierten Dosis vor.
- Behandeln Sie die infizierten Larven entweder 2 h, 4 h, 6 h, 9 h oder 12 h nach der Infektion, indem Sie die Schritte 3.2-3.8 befolgen, um zu vergleichen, wie sich der Zeitpunkt der Behandlung auf die Mortalität auswirkt.
- Überwachen Sie das Überleben von G. mellonella in Abständen von 30 Minuten oder häufiger ab dem Zeitpunkt, zu dem die Mortalität normalerweise zum ersten Mal beobachtet wird. Entfernen Sie alle toten Larven und notieren Sie deren Todeszeitpunkt. Der optimale Zeitpunkt ist derjenige, der das beobachtete Überleben nach der anfänglichen Optimierung der Behandlungsdosis aufrechterhält.
HINWEIS: Wenn Sie die antimikrobielle Wirksamkeit bei G. mellonella testen, optimieren Sie sowohl die Behandlungsdosis als auch den Zeitpunkt getrennt und verwenden Sie Ersteres, um die Behandlungsdosis bei Letzterem zu bestimmen.
Repräsentative Ergebnisse
Bewertung der Chargenvariation des Gewichts von G. mellonella
Eine potenzielle Quelle für unerwünschte Variationen in Infektionsexperimenten sind Größenunterschiede zwischen einzelnen Versuchseinheiten (d. h. Larven) und zwischen den Chargen. Die Auswirkungen dieser Variation können entweder durch Anpassung der Behandlungs- oder Infektionsdosis auf der Grundlage des Gewichts oder durch Auswahl nur derjenigen Larven innerhalb eines definierten Gewichtsbereichs für die Verwendung in Experimenten gemildert werden. Die letztere Anpassung ist pragmatischer und unterliegt keinen menschlichen Fehlern, die bei der Dosisvorbereitung auftreten können. Ein weiterer Vorteil des Wiegens der Larven besteht darin, dass es die Umrechnung der Behandlungsdosen von den den Larven verabreichten Dosen in ihre mg/kg Äquivalente beim Menschen ermöglicht. Um die Variation innerhalb und zwischen den Chargen zu quantifizieren, wurden drei Chargen mit 50 Larven, die zu unterschiedlichen Zeitpunkten bestellt wurden, gewogen. Das Durchschnittsgewicht in jeder Gruppe betrug 225,5 mg, 230,54 mg und 215,86 mg, mit Standardabweichungen von 49,1 mg, 53,7 mg bzw. 44,3 mg (Abbildung 2A). Zwischen den Chargen gab es keinen signifikanten Gewichtsunterschied. Über die Chargen hinweg reichte das Gewicht von 107,5 mg bis 341,0 mg, mit einem Mittelwert von 224,0 mg ± 49,2 mg.
Um reproduzierbare Ergebnisse zu erhalten, wurden die Larven vor dem Versuch gewogen und ausgewählt, wenn ihr Gewicht 224 mg ± 49,2 mg betrug, wodurch der Gewichtsbereich von 233,5 mg bis 98,4 mg reduziert und 33 % der Larven entfernt wurden. Dies steht im Einklang mit früheren Arbeiten, die eine signifikante Variation des Überlebens von mit MRSA infizierten Larven mit Gewichtsklassen von mehr als 100 mg feststellten14,20. Wir verglichen auch das Gewicht von G. mellonella zum Zeitpunkt der Entbindung mit dem eine Woche nach der Entbindung, da jede signifikante Gewichtsveränderung die Versuchsergebnisse beeinflussen könnte, wenn die Larven nicht unmittelbar nach der Ankunft verwendet werden. Das mittlere Gewicht von G. mellonella betrug 230,54 mg ± 53,7 mg. Eine Woche nach der Entbindung betrug das Durchschnittsgewicht 221,8 mg ± 45,7 mg Standardabweichung (Abbildung 2B). Es gab keinen signifikanten Unterschied zwischen dem Gewicht bei der Ankunft und dem Gewicht nach einer Woche, woraus wir schließen, dass die Larven jederzeit innerhalb der ersten Woche nach der Entbindung zu Versuchszwecken verwendet werden können. Es ist wichtig zu beachten, dass diese Ergebnisse nur für G. mellonella repräsentativ sind, die von einem Lieferanten gekauft wurden, und das Gewicht kann zwischen den Lieferanten oder bei der Bestellung der Larven zu unterschiedlichen Zeiten erheblich variieren.
Optimierung der Inokulumdichte von P. aeruginosa PAO1
Die Virulenz von fünf P. aeruginosa-Isolaten mit vier Inokulumdichten wurde untersucht, darunter drei häufig verwendete Laborstämme, PAO1, PA14 und PAK, sowie zwei klinische Isolate aus chronischen Atemwegsinfektionen, LESB58 und IST27-M. Diese wurden als Teil eines von Mahenthiralingam et al. entwickelten CF-relevanten Stammpanels verwendet.21 und sind repräsentativ für die globale Phylogenie der Art. Vorläufige Wachstumsdaten in der Nährstoffbrühe zeigten eine geringere Wachstumsrate für die Isolate aus chronischen Infektionen (Abbildung 3). Unter Berücksichtigung dessen wurde G. mellonella in Gruppen von 10 Larven mit Dosen von 101, 102, 103 oder 104 KBE/Larve in 10μl PBS für PAO1, PA14 und PAK und Dosen von 102, 103, 104 oder 105 KBE/Larve für LESB58 und IST27-M infiziert. Zwei Gruppen von 10 Larven erhielten ebenfalls nur PBS, eine Gruppe vor und eine Gruppe nach den Infektionen. PBS-Injektionen vor Infektionen kontrollieren auf kontaminiertes PBS oder Kontamination von Nadeln mit mikrobiellen Spezies aus der Galleria-Nagelhaut, während PBS-Injektionen nach der Infektionskontrolle auf eine Kontamination von Nadeln mit Bakterien durchgeführt werden, die im Infektionsprozess verwendet werden. Optimale Dosen für PAO1, PA14 und PAK betrugen 10 KBE/Larve, da höhere Dichten zu > 50%igen Tod nach 18 Stunden führten (Abbildung 4). 10 KBE war die niedrigste Dosis, die zuverlässig und reproduzierbar auf eine Infektion vorbereitet werden konnte. Höhere Dosen von LESB58 und IST27-M waren erforderlich, um die gewünschte Überlebenskinetik zu erreichen, was das langsamere Wachstum und die geringere Tragfähigkeit dieser Isolate unter In-vitro-Bedingungen widerspiegelt (Abbildung 4). Die optimale Dosis für beide betrug 104 KBE/Larven. LESB58 und IST27-M sind klinische Isolate von Personen mit chronischen Infektionen, und LESB58 hat zuvor in Nagetiermodellen eine geringere Virulenz gezeigt als PAO122.
Toxizitätstests von Tobramycin und Colistin bei Galleria mellonella
Bevor die Wirksamkeit neuartiger antimikrobieller Verbindungen bewertet wird, muss ihre Toxizität durch Injektion eines breiten Spektrums klinisch relevanter Dosen bewertet werden. Dies ermöglicht es, Verbindungen mit hoher Toxizität frühzeitig in der präklinischen Pipeline aus der Prüfung zu entfernen. Tobramycin und Colistin wurden gegen nicht infizierte G. mellonella-Larven untersucht, da sie üblicherweise zur Behandlung von P. aeruginosa-Infektionen bei Patienten mit Mukoviszidose (pwCF) verabreicht werden23. Die klinische Anwendung von Tobramycin reicht von 3 mg/kg täglich für schwer kranke Personen ohne Mukoviszidose bis zu 11 mg/kg alle 24 h für Patienten mit Mukoviszidose24,25. Diese Werte wurden als Richtwert für die Dosierung in Galleria mellonella verwendet, wobei 1 mg/kg, 2,5 mg/kg, 5 mg/kg, 10 mg/kg, 25 mg/kg, 50 mg/kg, 100 mg/kg, 250 mg/kg Tobramycin für die Toxizitätsprüfung ausgewählt wurde. Bei keiner Konzentration wurde ein Todesfall beobachtet. Unter Berücksichtigung der fehlenden Toxizität von Tobramycin in hohen Konzentrationen wurde die Colistin-Toxizität bewertet, da sie zuvor bei 29,8 % der Behandlung mit pwCF mit Nephro- oder Neurotoxizität in Verbindung gebracht wurde, mit einer Aufsättigungsdosis von 2,9 (±1,5) mg/kg und der täglichen Gesamtdosis von 4,1 (±1,1) mg/kg26. Dies machte es zu einem wertvollen Kandidaten für Toxizitätstests, obwohl die organspezifischen Wirkungen beim Menschen darauf hindeuteten, dass die Toxizität möglicherweise nicht auf G. mellonella übertragen werden kann. Bei der Verabreichung von Dosen von 1 mg/kg, 2,5 mg/kg, 5 mg/kg, 10 mg/kg, 25 mg/kg, 50 mg/kg, 100 mg/kg und 250 mg/kg Colistin wurde über einen Zeitraum von 72 Stunden kein Absterben der Larven beobachtet. Daher wurde Colistin schließlich in seiner höchsten Löslichkeit in H2O bei 2000 mg/kg verabreicht. Der Tod aller Larven wurde innerhalb von 12 Stunden beobachtet, was bestätigt, dass die Arzneimitteltoxizität bei G. mellonella beurteilt werden kann, dass jedoch bei dem Versuch, die Toxizität für den Menschen vorherzusagen, Vorsicht geboten ist.
Optimierung der Behandlungsdosis von Tobramycin gegen P. aeruginosa PAO1-Infektionen
Eine Reihe klinisch relevanter Tobramycin-Dosen wurde P. aeruginosa-infizierten Larven verabreicht, um die Behandlungsdosis zu optimieren. Bei neuartigen antimikrobiellen Mitteln kann die Dosierung zunächst auf der Grundlage des klinischen Einsatzes ähnlicher vorhandener Antibiotika oder auf präklinischen Daten für das neuartige Mittel, wie z. B. minimale Hemmkonzentrationen der Brühe, ausgewählt werden. Um die Wirksamkeit von Tobramycin gegen P. aeruginosa PAO1 zu beurteilen, wurden G. mellonella-Larven wie zuvor optimiert mit 10 KBE P. aeruginosa PAO1 infiziert und 2 h nach der Infektion mit 1 mg/kg, 2,5 mg/kg oder 5 mg/kg Tobramycin injiziert. Diese Dosen wurden auf der Grundlage früherer Arbeiten von G. mellonella mit Tobramycin ausgewählt und entsprechen den aktuellen klinischen Dosen von Tobramycin bei Personen ohne Mukoviszidose 24,27,28.
Die Schwelle für den anfänglichen Erfolg war eine 50%ige Erhöhung des Überlebens von G. mellonella im Vergleich zu den unbehandelten Kontrollen. Die Behandlung mit PAO1 mit 1 mg/kg Tobramycin hatte nur einen geringen Einfluss auf die Mortalität von G. mellonella , wobei 90 % der Todesfälle 28 Stunden nach der Infektion zu verzeichnen waren (Abbildung 5). Die Behandlung mit 2,5 mg/kg Tobramycin verzögerte die Mortalität, führte jedoch zu einer Gesamtmortalität von 80 % mit 5 mg/kg Tobramycin, was zu einem optimalen Überleben von 90 % führte. Die wirksame Dosis für PA14 betrug 5 mg/kg, für PAK jedoch 2,5 mg/kg. Die wirksame Dosis für IST27-M war mit 10 mg/kg höher, während keine getestete Tobramycin-Konzentration ausreichte, um die Larven vor einer LESB58-Infektion zu retten. Dieser Trend korrelierte mit den Werten der minimalen Hemmkonzentration (MIC) für Tobramycin in kationenadjustierter Müller-Hinton-Brühe, bei der 1 μg/ml ausreichte, um 90 % des Wachstums in allen Stämmen mit Ausnahme von LESB58 zu hemmen, das eine MHK von 8 μg/ml aufwies. Daher können erste MHK-Tests verwendet werden, um die relative Resistenz zwischen den Stämmen anzuzeigen, obwohl sie nicht zur Bestimmung von Dosisbereichen bei G. mellonella verwendet werden sollten, die separat optimiert werden sollten.
Optimierung des Zeitpunkts der Tobramycin-Behandlung gegen eine P. aeruginosa PAO1-Infektion
Die klinische Anwendung von Antibiotika erfolgt in der Regel nicht innerhalb von Stunden nach der Infektion, sondern Tage oder Wochen danach. Die Erprobung neuartiger antimikrobieller Wirkstoffe auf diese Weise ist bei G. mellonella nicht möglich, da innerhalb von 24 Stunden nach der Infektion mit P. aeruginosa PAO1 eine hohe Mortalität beobachtet wird. Um die Relevanz des Infektionsmodells zu erhöhen, sollten neuartige antimikrobielle Mittel so spät wie möglich während der Infektion verabreicht werden. Um die Behandlungszeiten zu optimieren, wurden 5 mg/kg Tobramycin an PAO1-infizierte G. mellonella-Larven 2 h, 4 h, 6 h, 9 h und 12 h nach der Infektion verabreicht. Als experimenteller Erfolg wurde definiert, dass die Antibiotikabehandlung im Vergleich zur Infektion mit PAO1 eine Überlebenssteigerung von >50% bewirkte. Die Behandlung nach 9 Uhr und 12 Uhr verzögerte die Mortalität, obwohl sie die Infektion nicht heilen konnte (Abbildung 6). Die Behandlung nach 2 Stunden, 4 Stunden und 6 Stunden führte zu einer Überlebensrate von über 50%.
Optimierung der Gruppengröße von G. mellonella
Die Größe der experimentellen Gruppe wurde auf der Grundlage der Variation des Überlebens von G. mellonella nach einer Infektion mit 10 KBE / Larven von P. aeruginosa PAO1 berechnet. Die Gruppengröße kann je nach erwarteter prozentualer Veränderung zwischen der unbehandelten Kontroll- und der Behandlungsgruppe in einer Studie variieren (Tabelle 1). Die Berechnungen folgten denen, die von Charan et al.29 beschrieben werden. Die verwendete Gleichung wird im Folgenden beschrieben.
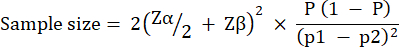
Wo:
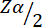 = 1,96 bei Typ 1 Fehler von 5 %.
= 1,96 bei Typ 1 Fehler von 5 %.
Zβ = 0,842 ist der Wert, der 80 % statistische Aussagekraft liefert.
p1 = Der Anteil der Ereignisse in der Testgruppe, berechnet als p2 + die erwartete prozentuale Änderung
p2 = Der Anteil der Ereignisse in der Kontrollgruppe (unbehandelte Infektion), berechnet auf der Grundlage der Überlebensvariabilität von P. aeruginosa PAO1 bei 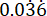 .
.
P = Gepoolte Prävalenz, definiert als (p1 + p2)/2.
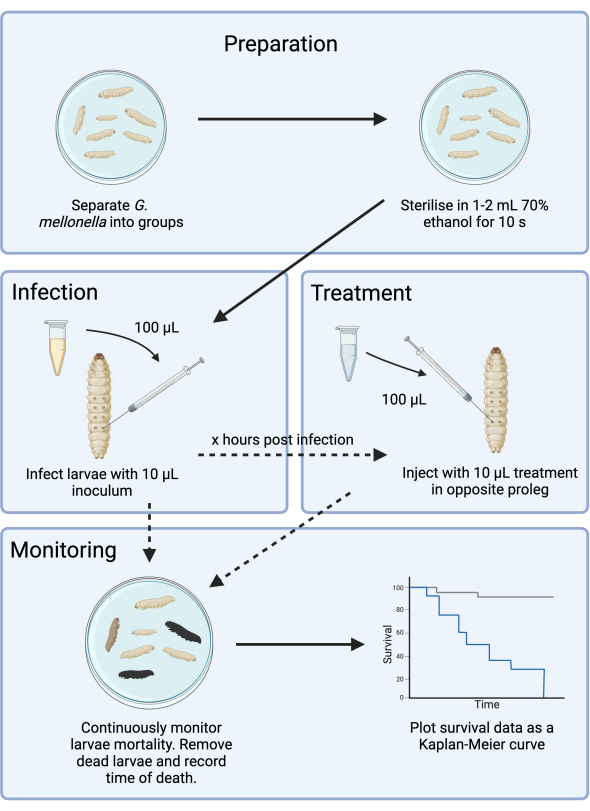
Abbildung 1: Schematische Darstellung einer G . mellonella-Infektionsstudie . Das allgemeine Protokoll umfasst die Vorbereitung von G. mellonella-Larven vor der Infektion, die Infektion mit einem 10-μl-Inokulum, die optionale Behandlung einige Stunden nach der Infektion und eine kontinuierliche Überwachung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
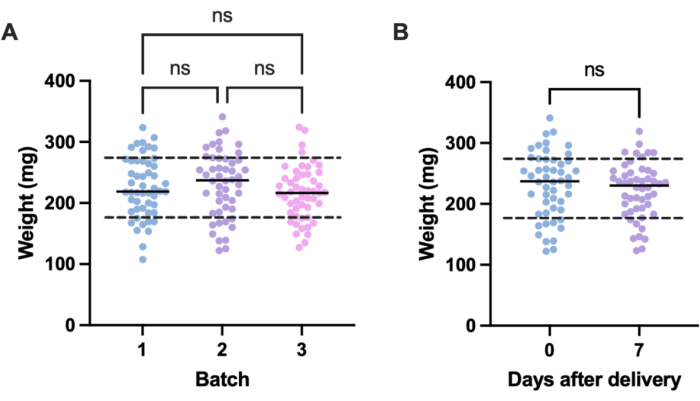
Abbildung 2: Chargen- und zeitabhängige Variation des Gewichts der Galleria mellonella-Larven . (A) Gewicht von drei Chargen von 50 Galleria mellonella-Larven , die unmittelbar nach der Lieferung gewogen wurden. Jede Charge wurde zu unterschiedlichen Zeiten bestellt. Es gab keinen signifikanten Unterschied im Gewicht zwischen den Chargen, berechnet durch eine einfache ANOVA (P > 0,05). (B) Gewicht von 50 Larven, die bei Erhalt gewogen wurden, verglichen mit der gleichen Charge, die eine Woche später gewogen wurde. Es gab keinen signifikanten Gewichtsunterschied, der durch den t-Test eines Studenten (P > 0,05) berechnet wurde. ns: Nicht signifikant. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
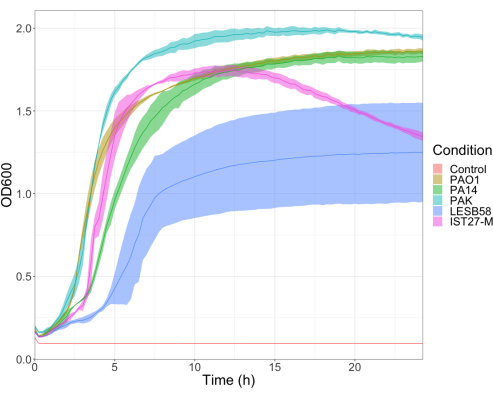
Abbildung 3: Wachstumskurven der P. aeruginosa-Stämme PAO1, PA14, PAK, LESB58 und IST27-M. Jeder Stamm wurde in LB von einem anfänglichen OD600 von 0,08-0,13 gezüchtet, und OD600 wurde anschließend alle 15 Minuten während eines 24-stündigen statischen Wachstums bei 37 °C gemessen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
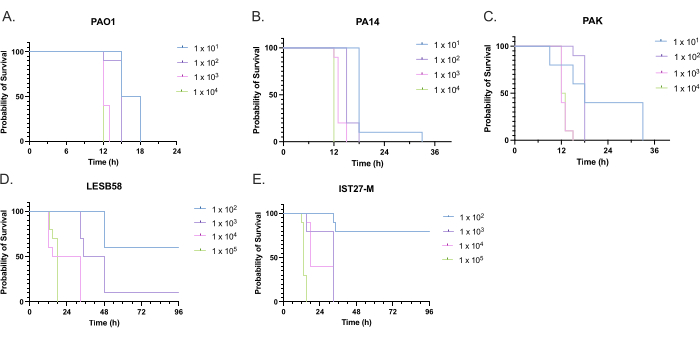
Abbildung 4: Optimierung der Inokulumdichte von Pseudomonas aeruginosa-Stämmen für die Infektion von Galleria mellonella-Larven . Überleben von Galleria mellonella-Larven nach Injektion mit unterschiedlichen Dichten von koloniebildenden Einheiten (KBE) pro Larve. Die getesteten Inokulumdichten betrugen 10, 10², 10³ oder 104 KBE pro Larve für (A) PAO1, (B) PA14 oder (C) PAK und 10², 10³, 104 oder 105 KBE pro Larve für (D) LESB58 und (E) IST27-M. Pro Gruppe wurden zehn Larven verwendet, denen jeweils 10 μl Inokulum in das rechte hintere Vorderbein injiziert wurden. Das Überleben wurde ab 16 Stunden nach der Infektion alle 30 Minuten überwacht und der Todeszeitpunkt aufgezeichnet. Alle Stämme zeigten eine dosisabhängige Virulenz, die durch den Log-Rank-Test (Mantel-Cox) auf Signifikanz bestimmt wurde. P < 0,05 für alle Dosisvergleiche innerhalb des Stammes mit Ausnahme von PAK 101 vs. PAK 102, PAK 103 vs. PAK 104, LESB58 104 vs. LESB58 105 und IST27-M 103 vs. IST27-M 104, die nicht signifikant waren. Diese Abbildung ist repräsentativ für drei biologische Replikate. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
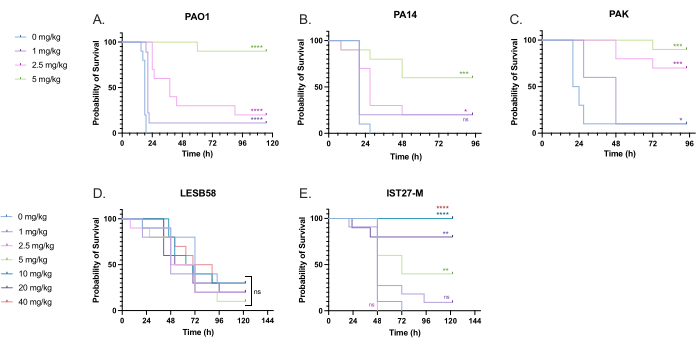
Abbildung 5: Überleben von Galleria mellonella-Larven nach Injektion mit P. aeruginosa-Panel-Stämmen und Behandlung mit Tobramycinsulfat 2 h nach der Infektion. 10 G. mellonella-Larven pro Versuchsgruppe wurden entweder mit 10 KBE (A) PAO1, (B) PA14 oder (C) PAK oder 103 KBE von (D) LESB58 oder (E) IST27-M pro Larve in 10 μl PBS infiziert. Die Infektionen wurden am hinteren linken Vorbein verabreicht. 2 Stunden nach der Infektion wurden PAO1, PA14 und PAK mit 10 μl PBS als Kontrollgruppe ohne Behandlung, 1 mg/kg, 2,5 mg/kg oder 5 mg/kg Tobramycin injiziert, wobei LESB58 und IST27-M entweder mit 10 μl PBS, 1 mg/kg, 2,5 mg/kg, 5 mg/kg, 10 mg/kg, 20 mg/kg oder 40 mg/kg Tobramycin behandelt wurden. wie in der Abbildung gezeigt. Tobramycin wurde in destilliertem Wasser verdünnt und in das hintere rechte Bein verabreicht. Das Überleben wurde kontinuierlich überwacht und der Todeszeitpunkt aufgezeichnet. Logarithmus-Rang-Test (Mantel-Cox) auf Signifikanz vs. PBS-Regler für jeden Stamm. ns: Nicht signifikant, *P < 0,05, **P < 0,005, ***P < 0,0005 ****P < 0,0001. Diese Abbildung ist repräsentativ für drei biologische Replikate. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
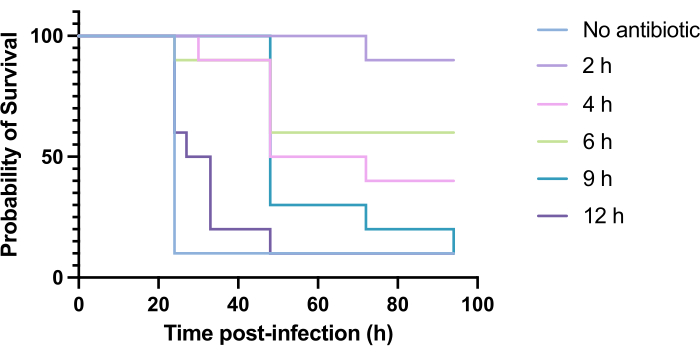
Abbildung 6: Überleben von Galleria mellonella-Larven nach Infektion mit Pseudomonas aeruginosa PAO1 und anschließender Behandlung mit Tobramycin zu verschiedenen Zeitpunkten nach der Infektion. 10 G. mellonella-Larven pro Versuchsgruppe wurden mit 10 KBE PAO1 in 10 μl PBS infiziert, die in das hintere rechte Bein injiziert wurden. Die Larven wurden anschließend 2 h, 4 h, 6 h, 9 h oder 12 h nach der Infektion mit 5 mg/kg Tobramycinsulfat in 10 μl destilliertem Wasser in den hinteren linken Vorraum injiziert. Das Überleben wurde kontinuierlich überwacht und der Todeszeitpunkt aufgezeichnet. Logarithmus-Rang-Test (Mantel-Cox) auf Signifikanz vs. unbehandelte Kontrolle. P < 0,0005, ****P < 0,0001. Diese Abbildung ist repräsentativ für drei biologische Replikate. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Erwartete Veränderung des Überlebens (%) | Gruppengröße |
| 30 | 26 |
| 40 | 18 |
| 50 | 13 |
| 60 | 10 |
| 70 | 8 |
| 80 | 6 |
| 90 | 5 |
| 100 | 4 |
Tabelle 1: Gruppengröße für G . mellonella-Überlebensexperimente , in denen G . mellonella-Larven mit 10 KBE/Larven mit P. aeruginosa PAO1 infiziert und anschließend ein Wirkstoff verabreicht wurde.
Diskussion
Die Belastung durch Antibiotikaresistenzen (AMR) nimmt kontinuierlich zu. Im Jahr 2019 waren weltweit schätzungsweise 4,95 Millionen Todesfälle mit AMRverbunden 30. Bis 2050 wird die durch AMR verursachte Sterblichkeit schätzungsweise 10 Millionenerreichen 31. Um diesem Risiko zu begegnen, müssen neuartige antimikrobielle Wirkstoffe effizient und kostengünstig entwickelt und getestet werden, was die Verwendung präklinischer Modelle erfordert, die die Wirksamkeit antimikrobieller Wirkstoffe genau vorhersagen. Die hohe Fluktuationsrate, die bei der Translation in klinische Studien beobachtet wird, ist ein wesentlicher limitierender Faktor. Eine Studie beschrieb 13 Antibiotikakandidaten, die in klinischen Studien versagten, wobei 11 nicht in die Phase II übergingen32.
Die vorliegende Studie bietet einen Rahmen für die Optimierung präklinischer antimikrobieller Screening-Studien von G. mellonella und eine Methode zur Bewertung der antimikrobiellen Wirksamkeit. G. mellonella-Larven haben einen erheblichen Nutzen bei der Bewertung der Arzneimitteltoxizität, der MHK-Bestimmung und der Virulenzprüfung und tragen gleichzeitig zur Reduzierung von Säugetieren bei, die in der präklinischen Entwicklung verwendet werden. Galleria mellonella-Larven haben einen relativ hohen Durchsatz, sind biologisch relevant und lassen sich gut in komplexere Säugetiermodelle übertragen. Während Wildtyp-Labormäuse zwischen 8 und 30 Pfund pro Maus kosten und ~7 Pfund wöchentlich gewartet werden, kostet G. mellonella ~2 Pfund für 50 Larven. Das Testen von 10 Verbindungen in einem G. mellonella-Modell würde daher ~60 £ kosten, verglichen mit mehr als 4000 £ für die gleiche Studie an Mäusen. Darüber hinaus haben frühere Studien die Toxizität und Wirksamkeit neuartiger Verbindungen verglichen und eine Korrelation zwischen akuter Toxizität bei G. mellonella und Mäusen festgestellt 8,19,33. Daher wird die Implementierung eines G. mellonella-Screenings empfohlen, um Verbindungen zu priorisieren, die in Mausmodellen weiter getestet werden sollen.
Trotz des klaren Nutzens des Modells gibt es einige Überlegungen, um eine erfolgreiche Anwendung zu gewährleisten. Der Mangel an sterilen Larven für die Forschung erschwert ihre Vorbereitung für den experimentellen Einsatz, da eine Ethanolsterilisation erforderlich ist oder die Forscher ihre eigene G. mellonella-Kolonie halten müssen, was das Kontaminationsrisiko verringern und die Versuchsqualität insgesamt verbessernwürde 5,6. Eine unsachgemäße Sterilisation kann zu einer erheblichen Sterblichkeit führen, und es ist eine Herausforderung, den Organismus vollständig zu sterilisieren, da eine längere Ethanol-Einwirkzeit zum Tod führt. Zu den alternativen Sterilisationsmethoden gehört der Abstrich des Vorderbeins jeder Larve mit 70 % Ethanol vor der Infektion, was die Sterblichkeit während der Sterilisation verringern würde, aber eine arbeitsintensivere Methode ist. Andere Antiseptika könnten ebenfalls verwendet werden, obwohl in dieser Studie keine Alternativen bewertet wurden, da die Ethanolsterilisation nach Optimierung zu einem Todesfall von <10 % führte. Darüber hinaus ist oft unklar, ob die Lieferanten ihre G. mellonella mit Antibiotika behandeln, da die Lieferanten ihre Larven möglicherweise von anderen Lieferanten beziehen, anstatt selbst Bienenvölker zu halten.
Die Biologie von G. mellonella unterscheidet sich erheblich von der von Säugetieren, was ihren Nutzen einschränkt. Ihrem Immunsystem fehlt jegliche adaptive Immunität, obwohl wichtige lösliche und zelluläre Aspekte der angeborenen Immunität vorhanden sind. Hämozyten sind eine wichtige angeborene Immunabwehr von G. mellonella und weisen phagozytenähnliche Eigenschaften auf. Es wurden verschiedene Untergruppen dieser Zellen beschrieben, darunter unter anderem Granulozyten und Plasmatozyten34. G. mellonella kann auch relevante Infektionsherde, wie z. B. die von Atemwegs- oder Blaseninfektionen, nicht rekapitulieren. In einer präklinischen Pipeline würde G. mellonella jedoch als Vorscreening für Mausmodelle dienen, um sicherzustellen, dass nur die vielversprechendsten Wirkstoffe in das komplexe Säugetiersystem gelangen, das den menschlichen Infektionsumgebungen ähnlicher ist. Schließlich würde das Modell von einer weiteren genomischen Charakterisierung von G. mellonella profitieren, um seine Eignung für die Beurteilung von Veränderungen klinisch relevanter Biomarker zu bestimmen. Dies erfordert insbesondere ein besseres Verständnis der Immunität von G. mellonella.
Insgesamt ist das Galleria mellonella-Infektionsmodell ein wertvolles Werkzeug für die präklinische Bewertung neuartiger antimikrobieller Wirkstoffe vor ihrer Bewertung in Säugetiermodellen. Während ihre Verwendung durch mangelnde Angebotsstandardisierung erschwert wird, ist ihre Anwendung ein hoher Durchsatz, einfach und kann in der gesamten antimikrobiellen Entwicklungslandschaft breit angewendet werden. Die Integration dieses Modells in eine standardisierte präklinische Pipeline könnte in Zukunft die Entwicklung neuer antimikrobieller Wirkstoffe beschleunigen, um den Anteil der Kandidaten zu erhöhen, die von der präklinischen Bewertung in die klinische Prüfung übergehen.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
TB, AK, JF und DN erhielten Fördermittel für das Strategische Forschungszentrum (SRC) "Ein evidenzbasierter präklinischer Rahmen für die Entwicklung antimikrobieller Therapeutika bei Mukoviszidose" (PIPE-CF; Projekt-Nr. SRC 022) des UK Cystic Fibrosis Trust und der US Cystic Fibrosis Foundation. LD und JF bestätigen die Finanzierung durch Kidney Research North West (Projekt Nr. 49/19).
Materialien
| Name | Company | Catalog Number | Comments |
| 22s gauge, Small Hub RN Needle, 2 in, point style 2 | Hamilton | 7758-03 | Replacement for the Hamilton syringe. |
| Bacterial infection stocks | Bacterial stocks of a known density (CFU/mL) frozen during mid-exponential phase of growth. | ||
| Ethanol | Fisher Scientific | 10610813 | Other manufacturers may be used. |
| G. mellonella larvae | Livefoods | 5.06045E+12 | For this supplier, orders are marked as “New stock for lab use”. As of April 2024, new stock is delivered to the supplier on Mondays. Orders should be placed then, for delivery on Wednesdays. |
| Microliter syringe | Hamilton | 80630 | The 80630 syringe has a 100 µL capacity. Other volumes exist, such as the 80430, 80530 or 80730. |
| Petri dish | Fisher Scientific | 12674785 | Other manufacturers may be used. |
Referenzen
- Menard, G., Rouillon, A., Cattoir, V., Donnio, P. Y. Galleria mellonella as a suitable model of bacterial infection: Past, present and future. Front Cell Infect Microbiol. 11, 782733 (2021).
- Piatek, M., Sheehan, G., Kavanagh, K. Galleria mellonella: The versatile host for drug discovery, in vivo toxicity testing and characterizing host-pathogen interactions. Antibiotics. 10 (12), 1545 (2021).
- Miethke, M., et al. Towards the sustainable discovery and development of new antibiotics. Nat Rev Chem. 5 (10), 726-749 (2021).
- Seyhan, A. A. Lost in translation: The valley of death across preclinical and clinical divide - identification of problems and overcoming obstacles. Transl Med Commun. 4 (1), (2019).
- Firacative, C., et al. Rearing and maintenance of Galleria mellonella and its application to study fungal virulence. J Fungus. 6 (3), 130 (2020).
- Pereira, M. F., Rossi, C. C. Overview of rearing and testing conditions and a guide for optimizing Galleria mellonella breeding and use in the laboratory for scientific purposes. APMIS. 128 (12), 607-620 (2020).
- Jorjão, A. L., et al. From moths to caterpillars: Ideal conditions for Galleria mellonella rearing for in vivo microbiological studies. Virulence. 9 (1), 383-389 (2018).
- Tsai, C. J. -. Y., Loh, J. M. S., Proft, T. Galleria mellonella infection models for the study of bacterial diseases and for antimicrobial drug testing. Virulence. 7 (3), 214-229 (2016).
- Gallorini, M., et al. Immunophenotyping of hemocytes from infected Galleria mellonella larvae as an innovative tool for immune profiling, infection studies and drug screening. Sci Rep. 14, 759 (2024).
- Smith, F. Q., Casadevall, A. Fungal immunity and pathogenesis in mammals versus the invertebrate model organism Galleria mellonella. Pathog Dis. 79 (3), ftab013 (2021).
- Sugumaran, M. Comparative biochemistry of eumelanogenesis and the protective roles of phenoloxidase and melanin in insects. Pigment Cell Res. 15 (1), 2-9 (2002).
- Sheehan, G., Garvey, A., Croke, M., Kavanagh, K. Innate humoral immune defences in mammals and insects: The same, with differences. Virulence. 9, 1625-1639 (2018).
- Wright, C. L., Kavanagh, O. Galleria mellonella as a novel in vivo model to screen natural product-derived modulators of innate immunity. Appl Sci. 12 (13), 6587 (2022).
- Newton, S. M., et al. Use of the invertebrate Galleria mellonella as an infection model to study the Mycobacterium tuberculosis complex. J Vis Exp. (148), e59703 (2019).
- Frankel, G., Collins, J. W., Schroeder, G. N., Harding, C. R. Use of Galleria mellonella as a model organism to study Legionella pneumophila infection. J Vis Exp. (81), e50964 (2013).
- Romera, D., et al. The Galleria mellonella infection model as a system to investigate the virulence of Candida auris strains. Pathog Dis. 78 (9), ftaa067 (2020).
- Kwadha, C. A., Ong'amo, G. O., Ndegwa, P. N., Raina, S. K., Fombong, A. T. The biology and control of the greater wax moth, Galleria mellonella. Insects. 8 (2), 61 (2017).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. J Hyg. 38, 732-749 (1938).
- Ignasiak, K., Maxwell, A. Galleria mellonella (greater wax moth) larvae as a model for antibiotic susceptibility testing and acute toxicity trials. BMC Res Notes. 10 (1), 428 (2017).
- Hesketh-Best, P. J., Mouritzen, M. V., Shandley-Edwards, K., Billington, R. A., Upton, M. Galleria mellonella larvae exhibit a weight-dependent lethal median dose when infected with methicillin-resistant Staphylococcus aureus. Pathog Dis. 79 (2), ftab003 (2021).
- Mahenthiralingam, E., Weiser, R., Floto, R. A., Davies, J. C., Fothergill, J. L. Selection of relevant bacterial strains for novel therapeutic testing: a Guidance document for priority cystic fibrosis lung pathogens. Curr Clin MicrobiolRep. 9 (4), 33-45 (2022).
- Carter, M. E. K., et al. A subtype of a Pseudomonas aeruginosa cystic fibrosis epidemic strain exhibits enhanced virulence in a murine model of acute respiratory infection. J Infect Dis. 202 (6), 935-942 (2010).
- Herrmann, G., et al. Colistin-tobramycin combinations are superior to monotherapy concerning the killing of biofilm Pseudomonas aeruginosa. J Infect Dis. 202 (10), 1585-1592 (2010).
- Hennig, S., Standing, J. F., Staatz, C. E., Thomson, A. H. Population pharmacokinetics of tobramycin in patients with and without cystic fibrosis. Clin Pharmacokinet. 52 (4), 289-301 (2013).
- Reyhanoglu, G., Reddivari, A. K. R. . Tobramycin. , (2023).
- Crass, R. L., Rutter, W. C., Burgess, D. R., Martin, C. A., Burgess, D. S. Nephrotoxicity in patients with or without cystic fibrosis treated with polymyxin b compared to colistin. Antimicrob Agents Chemother. 61 (4), e02329-e02416 (2017).
- Deacon, J., et al. Antimicrobial efficacy of tobramycin polymeric nanoparticles for Pseudomonas aeruginosa infections in cystic fibrosis: Formulation, characterization and functionalization with dornase alfa (DNase). J Control Release. 198, 55-61 (2015).
- Tamma, P. D., et al. Infectious Diseases Society of America 2022 guidance on the treatment of extended-spectrum β-lactamase producing enterobacterales (ESBL-E), carbapenem-resistant enterobacterales (CRE), and Pseudomonas aeruginosa with difficult-to-treat resistance (DTR-P. aeruginosa). Clin Infect Dis. 75 (2), 187-212 (2022).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies. J PharmacolPharmacother. 4 (4), 303-306 (2022).
- Murray, C. J. L., et al. Global burden of bacterial antimicrobial resistance in 2019: A systematic analysis. Lancet. 399 (10325), 629-655 (2022).
- de Kraker, M. E. A., Stewardson, A. J., Harbarth, S. Will 10 million people die a year due to antimicrobial resistance by 2050. PLoS Med. 13 (11), e1002184 (2016).
- Prasad, N. K., Seiple, I. B., Cirz, R. T., Rosenberg, O. S. Leaks in the pipeline: A failure analysis of gram-negative antibiotic development from 2010 to 2020. Antimicrob Agents Chemother. 66 (5), e0005422 (2022).
- Wang, S., et al. A novel Galleria mellonella experimental model for zoonotic pathogen Brucella. Virulence. 14 (1), 2268496 (2023).
- Senior, N. J., Titball, R. W. Isolation and primary culture of Galleria mellonella hemocytes for infection studies. F1000Res. 9, 1932 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten