Case Report
Einzelinzision plus laparoskopische proximale Gastrektomie mit einem Port und Doppelkanal-Anastomose zur Behandlung von Magenkrebs
In diesem Artikel
Zusammenfassung
Die laparoskopische proximale Gastrektomie mit Einzelinzision und einem Port und Doppelkanal-Anastomose wurde ursprünglich für die radikale Resektion des proximalen Magenkarzinoms eingesetzt. Diese Studie demonstrierte die Machbarkeit des Verfahrens und legte den Grundstein für weitere Forschungen.
Zusammenfassung
Die laparoskopische proximale Gastrektomie mit Einzelinzision und Ein-Port-Einkanal-Anastomose (SILT-DT) ist ein minimal-invasiver chirurgischer Ansatz zur Behandlung von proximalem Magenkrebs. Diese Technik umfasst eine umfassende laparoskopische Resektion des proximalen Magens, eine Lymphknotendissektion und eine Doppeltrakt-Anastomose. Durch die Integration der laparoskopischen Chirurgie mit einem einzigen Port und einem zusätzlichen Operationsloch reduziert SILT-DT die Verfahrensschwierigkeiten und erleichtert gleichzeitig die Platzierung eines abdominalen Drainageschlauchs. Im Vergleich zur herkömmlichen laparoskopischen Gastrektomie mit fünf Ports benötigt die SILT-DT weniger Ports und führt zu kürzeren Schnittlängen, was zu weniger postoperativen Schmerzen und einer schnelleren Genesung beiträgt. Um den Erfolg des Eingriffs zu gewährleisten, wurde eine gründliche präoperative Evaluierung durchgeführt, bei der Faktoren wie Tumorgröße, Stadium, Lokalisation und BMI des Patienten sorgfältig berücksichtigt wurden. Diese umfassende Beurteilung ermöglichte eine optimale Patientenauswahl und Operationsplanung. Die postoperative Nachsorge zeigte keine signifikanten Komplikationen, was die Sicherheit und Wirksamkeit von SILT-DT unterstreicht. Diese innovative Technik bietet eine vielversprechende minimal-invasive Alternative zur Behandlung von proximalem Magenkrebs bei gleichzeitiger Beibehaltung hervorragender klinischer Ergebnisse.
Einleitung
Laparoskopische Techniken haben sich in jüngster Zeit zu einer der Hauptrichtungen für die chirurgische Behandlung von Magenkrebs entwickelt 1,2. Die routinemäßige laparoskopische Operation bei Magenkrebs wird meist mit der 5-Loch-Methode durchgeführt. Mit Fortschritten bei den Operationstechniken und kontinuierlichen Verbesserungen bei medizinischen Geräten hat sich die laparoskopische Magenkrebschirurgie mit reduzierten Anschlüssen allmählich entwickelt, um chirurgische Traumata weiter zu reduzieren, Störungen der Bauchhöhle zu minimieren und die postoperative Genesung zu beschleunigen 3,4,5,6.
Omori7 berichtete erstmals 2011 über eine laparoskopische distale Magenkrebsoperation mit einem Port. Die reine laparoskopische radikale Gastrektomie mit einem Port bei Magenkrebs ist schwieriger als die herkömmliche laparoskopische Gastrektomie mit fünf Ports. Um dies zu beheben, wird dem laparoskopischen Verfahren mit einem einzigen Anschluss ein zusätzliches Operationsloch hinzugefügt, das die Schwierigkeit der Operation verringert und die Platzierung eines abdominalen Drainageschlauchs erleichtert 8,9. Die laparoskopische Chirurgie mit nur einem Schnitt plus einem Port (SILS+1), eine minimalinvasive Technik für Patienten mit Magenkrebs, hat in den letzten Jahren aufgrund der reduzierten Anzahl von Ports und der kürzeren Schnittlängen an Popularität gewonnen.
Derzeit ist die laparoskopische oder SILS+1-Magenkrebsoperation mit einem Port bei der distalen Gastrektomie relativ häufig, während ihre Anwendung bei der totalen Gastrektomie selten ist. Darüber hinaus wurde über die Verwendung einer totalen laparoskopischen Anastomose bei Doppeltrakt-Magenkrebs nicht berichtet.
Darauf aufbauend versuchten wir zunächst eine laparoskopische totale laparoskopische proximale Gastrektomie mit Doppeltrakt-Anastomose (SILT-DT). Der transumbilikale Port wurde als Hauptoperationsport verwendet, und der linke obere Bauchdrainageport diente als zusätzlicher Operationsport. Diese Technik wurde zur Durchführung einer proximalen Gastrektomie, einer D2-Lymphknotendissektion und einer Doppeltrakt-Anastomose zur Rekonstruktion des Verdauungstrakts eingesetzt.
FALL-PRÄSENTATION:
Der Patient, ein 63-jähriger Mann, wurde ins Krankenhaus eingeliefert, nachdem bei einer Magenspiegelung ein Tumor am ösophagogastrischen Übergang entdeckt worden war (Abbildung 1). Die Biopsieergebnisse des Gastroskops deuteten auf ein mäßig differenziertes Adenokarzinom hin (Abbildung 2). Präoperative CT-Scans des Brustkorbs und des Abdomens zeigten keine Hinweise auf Fernmetastasen (Abbildung 3). Der Patient war zuvor gesund und hatte keine Vorgeschichte von Bauchoperationen.
Patientenauswahl
Patienten waren teilnahmeberechtigt, wenn sie ein histologisch bestätigtes Siewert-Adenokarzinom Typ II oder III des gastroösophagealen Übergangs hatten, wobei das präoperative abdominale CT keine vergrößerten Lymphknoten um den Magen oder Fernmetastasen zeigte. Der maximale Durchmesser des Tumors sollte weniger als 3 cm betragen, und der Abstand zwischen dem unteren Pol des Tumors und dem Magenwinkel musste 5 cm überschreiten. Zu den Ausschlusskriterien gehörten Patienten, die sich zuvor einer Bauchoperation unterzogen hatten, Patienten mit einem präoperativen Tumordurchmesser von mehr als 3 cm und/oder die eine multiviszerale Resektion benötigten, Patienten, die sich multidisziplinären Teamgesprächen (MDT) bezüglich neoadjuvanter Radiochemotherapie unterzogen hatten oder die eine neoadjuvante Radiochemotherapie erhalten hatten, sowie Patienten mit einer Unverträglichkeit gegenüber laparoskopischen Operationen.
Protokoll
Der Betrieb folgte den Standardverfahren und erhielt die ethische Genehmigung. Diese Studie wurde von der Ethikkommission des Zentralkrankenhauses von Xiangyang genehmigt, das der Universität für Kunst und Wissenschaft Hubei angegliedert ist. Die schriftliche Einverständniserklärung des Patienten wurde eingeholt. Die Forschungsinhalte und -methoden hielten sich an die Normen und Anforderungen der Medizinethik. Die in der Studie verwendeten Reagenzien und Geräte sind in der Materialtabelle aufgeführt.
1. Präoperative Schritte
- Der Patient wurde angewiesen, einen Tag vor der Operation orales Natriumphosphatsalz zur Darmvorbereitung einzunehmen. Der Patient nüchterte 8 Stunden lang und durfte bis zu 2 Stunden vor der Operation Wasser zu sich nehmen. Vor dem Betreten des Operationssaals wurde eine obere Magensonde eingeführt.
- Der Patient wurde in Rückenlage mit gespaltenen Beinen positioniert, der Kopf angehoben und leicht nach rechts geneigt.
- Es wurde eine endotracheale Intubation durchgeführt und eine Vollnarkose nach institutionell anerkannten Protokollen durchgeführt.
2. Chirurgischer Eingriff
- Um den Nabel herum wurde ein Querschnitt von 3,0 bis 3,5 cm angelegt, um den SILS-Port einzuführen, der mit vier eingebauten Trokaren ausgestattet ist (Abbildung 4A). Ein zusätzlicher 12-mm-Trokar wurde in den linken oberen Quadranten eingeführt, der als Operationsöffnung für chirurgische Instrumente diente, einschließlich der Ultraschallschere, des endoskopischen Linearstaplers und des postoperativen Drainageschlauchs.
- Ein Ultraschallmesser wurde verwendet, um das fette lymphatische Gewebe der Gruppen 1, 2, 3, 4, 7, 8a, 9 und 11p zu präparieren (Abbildung 5A,B). Eine untere Länge des Ösophagussegments von etwa 5-7 cm wurde sichergestellt (Abbildung 5C), und die Freiheit der stärkeren Krümmung und der geringeren Krümmung des Magens wurde beibehalten.
HINWEIS: Das SILT-DT-Verfahren ist in Abbildung 5 dargestellt. Die Magen- und Lymphknotendissektion wurde in Übereinstimmung mit den Leitlinien für die laparoskopische Chirurgie bei Magenkrebs (Ausgabe 2023)10 durchgeführt. Es wurden eine D2-Lymphadenektomie und eine proximale Gastrektomie durchgeführt. - Die Anastomose des Ösophagus-Jejunums (EJ) wurde angelegt. Die UG-Anastomosenstelle wurde am Jejunum identifiziert, 20 cm distal des Treitz-Bandes und in der Nähe des unteren Ösophagus. Die EZ-Anastomose wurde durch den 12-mm-Port im linken oberen Quadranten mit einem endoskopischen 60-mm-Linearstapler durchgeführt (Abbildung 5D).
HINWEIS: Das schematische Diagramm, das die Rekonstruktion des Verdauungstraktes veranschaulicht, ist in Abbildung 4B dargestellt. - Ein endoskopischer Linearstapler von 60 mm wurde verwendet, um Proben der Speiseröhre zu resezieren und die Anastomosenöffnung zwischen Jejunum und Speiseröhre zu verschließen (Abbildung 5E).
- Es wurde die gastrojejunale (GJ) Anastomose angelegt, wobei die Stelle auf dem Jejunum 8-15 cm distal der UG-Anastomose und an der hinteren Wand der großen Krümmung des verbleibenden Magens markiert ist (Abbildung 5F).
- Die jejunojejunale Anastomose wurde etabliert. Die jejunojejunale Anastomose wurde durch den 3,5 cm langen Schnitt am Nabel mit einem endoskopischen 60-mm-Linearstapler durchgeführt, wobei 5 cm distal zur GJ-Anastomosenstelle markiert wurde (Abbildung 5G).
- Die einzelnen Anastomosen wurden verschlossen und verstärkt. Sowohl die gemeinsamen Öffnungen der GJ-Anastomose als auch der jejunojejunalen Anastomose wurden mit einem 3-0 Micro Joe-Faden verschlossen. Der mesangiale Hiatus wurde mit einer durchgehenden Naht verschlossen.
- Ein Drainageschlauch wurde hinter die UG-Anastomose gelegt und aus dem linken Oberbauch ausgetreten (Abbildung 5H).
3. Postoperatives Management
- Nach der Operation wurde eine Wassernüchternheit durchgeführt und die Magensonde mit einem Verweilbeutel entleert.
- Die Magensonde wurde nach 48 Stunden Beobachtung entfernt, wobei sichergestellt wurde, dass keine blutige Drainageflüssigkeit vorhanden war.
- Eine Flüssigkeitsinfusion wurde verabreicht, um das Wasser-, Elektrolyt- und Säure-Basen-Gleichgewicht aufrechtzuerhalten, zusammen mit der Säuresuppression. Die Dauer der prophylaktischen Antibiotika war auf maximal 48 h begrenzt.
- Die Frühmobilisierung wurde innerhalb von 6-24 Stunden nach der Operation aktiv gefördert. Während der Genesung wurde eine flüssige Diät für 2-3 Tage eingeleitet.
- Die Anastomosenleckage wurde beurteilt und die Entwicklung des Restmagens wurde durch eine Röntgenaufnahme des oberen Gastrointestinaltrakts an Tag 7 beurteilt.
- Der Drainageschlauch in der Bauchhöhle wurde innerhalb von 5 bis 7 Tagen nach der Entlassung aus dem Krankenhaus entfernt.
Ergebnisse
Die Operation wurde innerhalb von 150 Minuten abgeschlossen, mit minimalen intraoperativen Blutungen von 5 ml. Es gab keine kurzfristigen Komplikationen, und die postoperative Genesung des Patienten verlief erfolgreich. Insgesamt wurden 24 Lymphknoten entnommen, und es wurden keine Lymphknotenmetastasen gefunden. Die Operationszeit betrug 150 min und der geschätzte Blutverlust 5 ml. Der Patient blieb 2 Tage im Bett. Die Zeit bis zum ersten Flatus betrug 70 Stunden, und der Patient begann nach 3 Tagen mit dem Verzehr von flüssigen Lebensmitteln und Getränken. Die Magensonde wurde am 4. Tag entfernt und die Drainagesonde wurde innerhalb von 7 Tagen entfernt. Das Kontrastmittel verblieb 30-50 min im Restmagen ohne Rückfluss in die Speiseröhre (Abbildung 6). Das kosmetische Ergebnis der postoperativen Bauchschnitte war zufriedenstellend (Abbildung 4C). Der Schmerz wurde anhand einer 11-stufigen numerischen Bewertungsskala (NRS) bewertet, wobei 0 kein Schmerz und 10 der schlimmste vorstellbare Schmerz ist11. Detaillierte Daten für den Patienten sind in Tabelle 1 dargestellt.
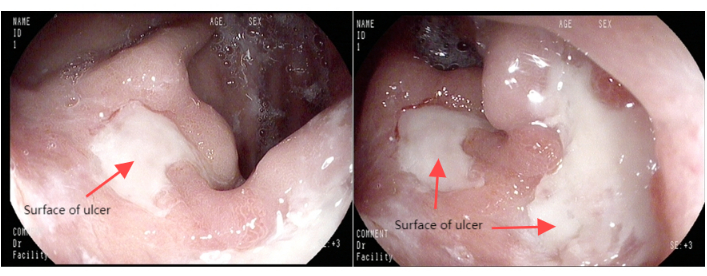
Abbildung 1: Gastroskopische Aufnahmen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
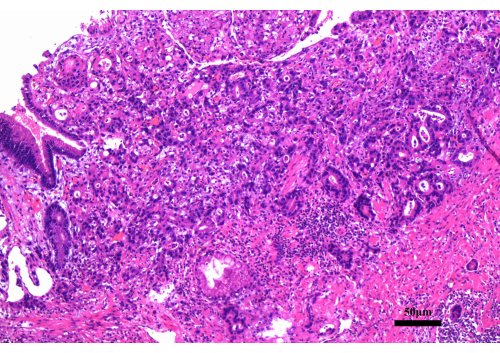
Abbildung 2: Die Befunde der gastroskopischen Biopsie. Die gastroskopische Biopsie ergab ein mäßig differenziertes Adenokarzinom. Maßstab: 50 μm; Vergrößerung: 200x. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
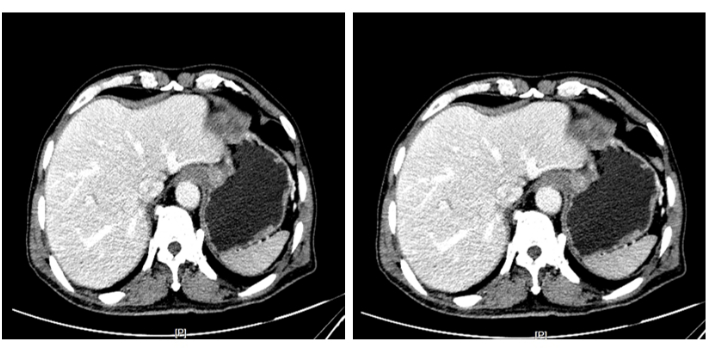
Abbildung 3: Abdominale verstärkte CT-Scans. Eine heterogene Verbesserung wurde in der Kardia beobachtet, die als neoplastische Läsion angesehen wurde, und der Tumor drang nicht in die Muskelschicht ein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
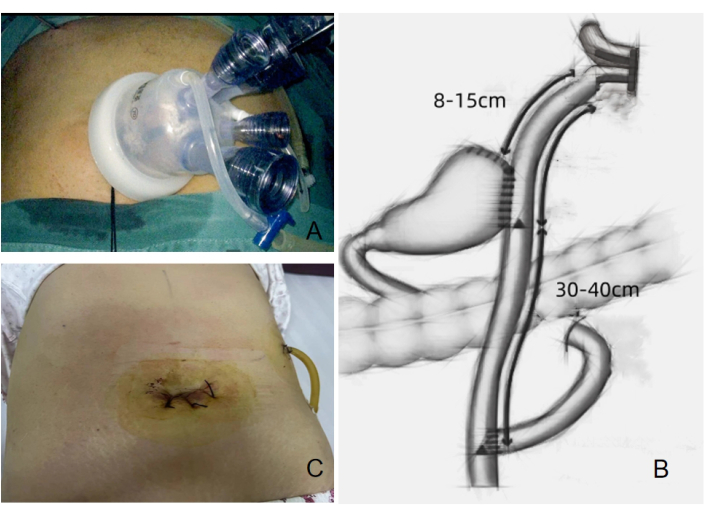
Abbildung 4: Chirurgischer Aufbau und postoperativer Wundzustand. (A) Vier eingebaute Trokare, die bei dem Verfahren verwendet werden. (B) Doppeltrakt-Anastomose, die während der Operation durchgeführt wird. (C) Postoperativer Wundzustand, der nach dem Eingriff dargestellt wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
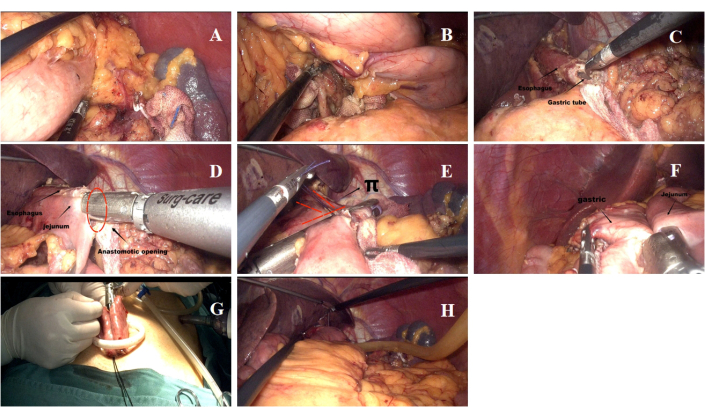
Abbildung 5: Details zum chirurgischen Eingriff. (A,B) Der Prozess der Reinigung der Lymphknoten während der Operation. (C) Durchtrennung des Ösophagus und Öffnung des unteren Ösophagusendes. (D) Side-to-Side-Ösophagojejunostomie, die im Rahmen der Anastomose durchgeführt wird. (E) Verschluss der gemeinsamen Öffnung an der Ösophagojejunalanastomosenstelle. (F) Rest-Gastrojejunostomie abgeschlossen. (G) Seitliche enterointestinale Anastomose, die durch den Nabelschnitt durchgeführt wird. (H) Lage des Abflussrohrs. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
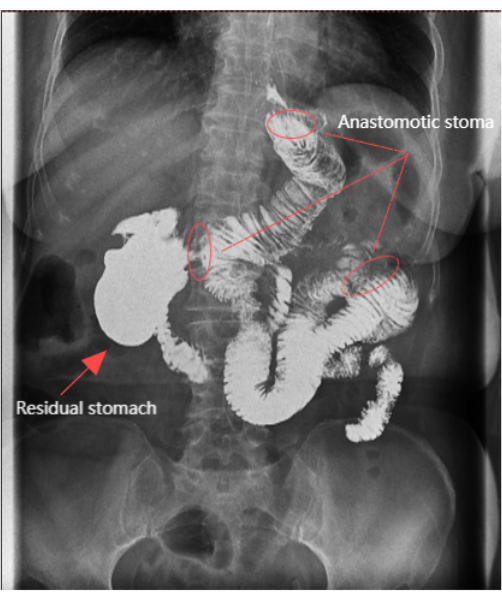
Abbildung 6: Röntgenaufnahme des oberen Gastrointestinaltrakts. Die Röntgenaufnahme des oberen Gastrointestinaltrakts zeigte, dass die Anastomose offen war und der verbleibende Magen deutlich sichtbar war. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Artikel | Ergebnis |
| Geschlecht | Männlich |
| Jahr | 63 |
| BMI (kg/m2) | 23.5 |
| Grad der Anästhesie | III |
| Präoperatives TNM-Staging | cT1N0M0 |
| Betriebszeit (min) | 150 |
| Schnittlänge (cm) | 2.8 |
| Intraoperatives Blutungsvolumen (ml) | 5 |
| Pathologie | mäßig differenziertes Adenokarzinom |
| Der Abstand des proximalen Randes (cm) | 3.4 |
| Der Abstand des distalen Randes (cm) | 5.5 |
| Tumorgröße (cm) | 1.5*2*1.2 |
| Die Anzahl der entnommenen Lymphknoten | 24 |
| TNM-Inszenierung | pT2N0M0 |
| Die Dauer der Entfernung der Magensonde nach der Operation (d) | 4 |
| Die Dauer bis zur ersten Mahlzeit | 3 |
| Die Dauer der Bettaktivität | 2 |
| Die Dauer bis zum Flatus (h) | 70 |
| Die Zeit für den Stuhlgang (d) | 6 |
| Die Dauer des Drainageschlauchs (d) | 7 |
| Schmerzscore am ersten Tag nach der Operation | 2 |
| Postoperativer Krankenhausaufenthalt (Tag) | 8 |
| Komplikationen | Nichts |
Tabelle 1: Perioperative Daten des Patienten. Einzelheiten zu den perioperativen Daten des Patienten, einschließlich der wichtigsten Messungen und Ergebnisse.
Diskussion
Die laparoskopische radikale Gastrektomie mit einem Port und einem reduzierten Port hat sich zu innovativen Ansätzen in der Behandlung von Magenkrebs entwickelt und gewinnt stetig an Akzeptanz. Diese Techniken erhalten aufgrund ihrer Vorteile, darunter verbesserte kosmetische Ergebnisse, reduzierte postoperative Schmerzen, ein geringeres Risiko von Wundinfektionen und schnellere Genesungszeiten, zunehmende Aufmerksamkeit.
Die Ergebnisse von 12 Studien mit 343 Fällen zeigten, dass die laparoskopische Chirurgie mit einem Port und reduziertem Port bei der Behandlung von distalem Magenkrebs wirksam war, was die Mehrheit der Fälle ausmachte:3, 4, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21. Allerdings konzentrierten sich nur vier Studien auf die totale Magenresektion 22,23,24,25. Diese Ergebnisse deuten darauf hin, dass die klinische Erforschung und Anwendung der Magenkrebschirurgie mit einem Port, insbesondere der totalen Gastrektomie, aufgrund der hohen chirurgischen Schwierigkeit, der erforderlichen umfangreichen Dissektion und Lymphknotenentfernung und der komplexen Technik der endoskopischen Rekonstruktion des Verdauungstrakts begrenzt ist.
Wir haben die erste laparoskopische proximale Gastrektomie mit Doppeltrakt-Anastomose mit einer einzigen Inzision plus einem Port zur Behandlung von proximalem Magenkrebs erfolgreich durchgeführt. Im Vergleich zu herkömmlichen Operationsmethoden ist die Operation mit einem Schnitt plus einem Port minimalinvasiver. Im Vergleich zur Single-Port-Technik erhöht die Hinzufügung des linken Oberbauchports den Komfort während der Operation und ermöglicht die rationelle Platzierung eines Drainageschlauchs durch einen Schnitt im linken Oberbauch.
Lee et al.26 berichteten 2016 über den ersten Fall einer laparoskopischen proximalen Gastrektomie mit Einzelport-Rekonstruktion durch einen Doppeltrakt bei Magenkrebs im Frühstadium. Im Vergleich zur SILS beinhaltet die Operation mit einem Schnitt plus einem Port einen zusätzlichen linken Oberbauchport, wodurch eine dreieckige Struktur entsteht, die sich aus der Nabelregion, dem linken Oberbauch und dem Operationsgebiet zusammensetzt. Dieser innovative Ansatz beseitigt effektiv die Einschränkungen der reinen Einzelschnittchirurgie, wie z. B. unzureichende Antitraktion und lineare Visualisierung. Darüber hinaus erhöht es die Flexibilität des rechten Instruments des Chirurgen, was zu einer deutlichen Verbesserung der operativen Effizienz und einer geringeren Komplexität bei jeder Anastomose unter Totallaparoskopie führt.
Darüber hinaus können verschiedene Strategien die betriebliche Effizienz steigern und die Verfahrensdauer verkürzen. Der Chirurg kann erwägen, seine Positionierung während der Lymphknotendissektion und der Rekonstruktion des Verdauungstrakts zu ändern, z. B. sich auf der linken Seite des Patienten oder zwischen den Beinen des Patienten zu positionieren, um die Freilegung des Operationsbereichs zu optimieren. Bei Eingriffen wie Ösophagojejunostomie und Gastrojejunostomie wird empfohlen, dass ein Assistent oder der Chefchirurg eine stabile Position beibehält, während ein anderer das Docking durchführt, wodurch die Effizienz der Anastomose verbessert und das Risiko eines Gewebeausrisses minimiert wird. Darüber hinaus wird der Einsatz integrierter laparoskopischer Instrumente empfohlen, um Interferenzen zwischen optischen Fasern und anderen Instrumenten zu minimieren.
Zusammenfassend lässt sich sagen, dass die laparoskopische proximale Gastrektomie mit Einzelinzision und Ein-Port-Anastomose zur Behandlung von proximalem Magenkrebs durchführbar ist. In diesem Fall erlebte der Patient eine erfolgreiche Genesung. Die Operation ist minimalinvasiv und die Genesung ist schneller. Zu den Einschränkungen dieses Protokolls gehört jedoch die Notwendigkeit von Magenkrebs im Frühstadium oder gutartigen Magentumoren, bei denen der BMI des Patienten nicht übermäßig hoch ist. Die Anwendung dieses Protokolls wird für Patienten mit lokal fortgeschrittener Erkrankung oder hohem BMI aufgrund des potenziellen Risikos positiver Tumorränder und erhöhter chirurgischer Komplexität nicht empfohlen. Dieses Protokoll befindet sich noch in der Phase der technischen Erkundung, ohne etablierte Leitlinien und unzureichende klinische Daten, um seine langfristige Wirksamkeit vollständig zu validieren. Die Entwicklung dieses Protokolls erfordert die ethische Genehmigung durch medizinische Einrichtungen und die strikte Einhaltung chirurgischer Indikationen. Weitere klinische Forschung und Erforschung sind notwendig, um die klinische Anwendbarkeit der SILT-DT-Technik zu bestimmen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte oder finanziellen Verbindungen offenzulegen.
Danksagungen
Diese Arbeit wurde durch Zuschüsse aus dem wissenschaftlichen Forschungsprojekt der Gesundheitskommission der Provinz Hubei und dem Xiangyang Key Project of Science and Technology in the medical and health field (2021YL15) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 3D laparoscope | KARL STORZ SE & Co. KG | 26605BA | |
| Absorbability surgical sutures | Johnson & Johnson | TLBJXZ | |
| Absorbable ligature clip | Hangzhou KANGJI Medical Instrument co., LTD | KJ-JZJ02ML | |
| Disposable puncture device | Hangzhou KANGJI Medical Instrument co., LTD | Type IV sets F | |
| Disposable step type endoscopic cutting stapler and nail bin | Nanjing Maidixin Medical Device Co.,Ltd | MLCR-Mb,MLCNC-60b-purple, MLCNC-45b-white | |
| laparoscopic instruments | Hangzhou KANGJI Medical Instrument co., LTD | ||
| Ultrasound knife | INNOLCON, Medical Science and Technology (suzhou) co., LTD |
Referenzen
- Bray, F., et al. Global cancer statistics 2018: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 68 (6), 394-424 (2018).
- Chevallay, M., et al. Cancer of the gastroesophageal junction: A diagnosis, classification, and management review. Ann N Y Acad Sci. 1434 (1), 132-138 (2018).
- Omori, T., et al. A randomized controlled trial of single-port versus multi-port laparoscopic distal gastrectomy for gastric cancer. Surg Endosc. 35 (8), 4485-4493 (2021).
- Kang, S. H., et al. Postoperative pain and quality of life after single-incision distal gastrectomy versus multiport laparoscopic distal gastrectomy for early gastric cancer - a randomized controlled trial. Surg Endosc. 37 (3), 2095-2103 (2023).
- Teng, W., et al. Short-term outcomes of reduced-port laparoscopic surgery versus conventional laparoscopic surgery for total gastrectomy: A single-institute experience. BMC Surg. 23 (1), 75 (2023).
- Podda, M., Saba, A., Porru, F., Pisanu, A. Systematic review with meta-analysis of studies comparing single-incision laparoscopic colectomy and multiport laparoscopic colectomy. Surg Endosc. 30 (11), 4697-4720 (2016).
- Omori, T., et al. Transumbilical single-incision laparoscopic distal gastrectomy for early gastric cancer. Surg Endosc. 25 (7), 2400-2404 (2011).
- Teng, W., et al. Comparison of short-term outcomes between single-incision plus one-port laparoscopic surgery and conventional laparoscopic surgery for distal gastric cancer: A randomized controlled trial. Transl Cancer Res. 11 (2), 358-366 (2022).
- Du, G. S., et al. Single-incision plus one-port laparoscopic gastrectomy versus conventional multi-port laparoscopy-assisted gastrectomy for gastric cancer: A retrospective study. Surg Endosc. 36 (5), 3298-3307 (2022).
- Chinese Society of Laparoscopic and Endoscopic Surgery, C. S. S., Chinese Medical Association, Association, R. a. L. S. C. O. C. R. H., Endoscopic and Robotic Surgical Society, C. a.-C. A., Endoscopy and Minimally Invasive Technology Society, C. a. O. M. E. Guideline for laparoscopic gastrectomy for gastric cancer (2023 edition). Chinese J Digest Surg. 22 (4), 425-436 (2023).
- Hjermstad, M. J., et al. Studies comparing numerical rating scales, verbal rating scales, and visual analogue scales for assessment of pain intensity in adults: A systematic literature review. J Pain Symptom Manage. 41 (6), 1073-1093 (2011).
- Park, D. J., Lee, J. H., Ahn, S. H., Eng, A. K., Kim, H. H. Single-port laparoscopic distal gastrectomy with d1+β lymph node dissection for gastric cancers: Report of 2 cases. Surg Laparosc Endosc Percutan Tech. 22 (4), e214-e216 (2012).
- Ahn, S. H., Jung, D. H., Son, S. Y., Park, D. J., Kim, H. H. Pure single-incision laparoscopic d2 lymphadenectomy for gastric cancer: A novel approach to 11p lymph node dissection (midpancreas mobilization). Ann Surg Treat Res. 87 (5), 279-283 (2014).
- Ahn, S. H., Son, S. Y., Jung, D. H., Park, D. J., Kim, H. H. Pure single-port laparoscopic distal gastrectomy for early gastric cancer: Comparative study with multi-port laparoscopic distal gastrectomy. J Am Coll Surg. 219 (5), 933-943 (2014).
- Kim, S. M., et al. Techniques of the single-port totally laparoscopic distal gastrectomy. Ann Surg Oncol. 22 (Suppl 3), S341 (2015).
- Jeong, O., Park, Y. K., Ryu, S. Y. Early experience of duet laparoscopic distal gastrectomy (duet-ldg) using three abdominal ports for gastric carcinoma: Surgical technique and comparison with conventional laparoscopic distal gastrectomy. Surg Endosc. 30 (8), 3559-3566 (2016).
- Kim, S. M., et al. Comparison of single-port and reduced-port totally laparoscopic distal gastrectomy for patients with early gastric cancer. Surg Endosc. 30 (9), 3950-3957 (2016).
- Lee, B., et al. Learning curve of pure single-port laparoscopic distal gastrectomy for gastric cancer. J Gastric Cancer. 18 (2), 182-188 (2018).
- Omori, T., et al. The safety and feasibility of single-port laparoscopic gastrectomy for advanced gastric cancer. J Gastrointest Surg. 23 (7), 1329-1339 (2019).
- Kang, S. H., et al. Long-term outcomes of single-incision distal gastrectomy compared with conventional laparoscopic distal gastrectomy: A propensity score-matched analysis. J Am Coll Surg. 234 (3), 340-351 (2022).
- Lee, S., et al. Intracorporeal modified delta-shaped gastroduodenostomy during 2-port distal gastrectomy: Technical aspects and short-term outcomes. Ann Surg Treat Res. 105 (3), 172-177 (2023).
- Ahn, S. H., Park, D. J., Son, S. Y., Lee, C. M., Kim, H. H. Single-incision laparoscopic total gastrectomy with d1+beta lymph node dissection for proximal early gastric cancer. Gastric Cancer. 17 (2), 392-396 (2014).
- Ertem, M., Ozveri, E., Gok, H., Ozben, V. Single incision laparoscopic total gastrectomy and d2 lymph node dissection for gastric cancer using a four-access single port: The first experience. Case Rep Surg. 2013, 504549 (2013).
- Lee, I. Y., Lee, D., Lee, C. M. Case report: Single-port laparoscopic total gastrectomy for gastric cancer in patient with situs inversus totalis. Front Oncol. 13, 1094053 (2023).
- Luo, Y., et al. A novel single-port robot for total gastrectomy to treat gastric cancer: A case report (with video). Asian J Endosc Surg. 17 (2), e13292 (2024).
- Lee, C. M., et al. Single-port laparoscopic proximal gastrectomy with double tract reconstruction for early gastric cancer: Report of a case. J Gastric Cancer. 16 (3), 200-206 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten